魔芋葡甘聚糖(konjac glucomannan,KGM)是由魔芋产生的中性多糖,其分子链是由主链D-甘露糖与D-葡萄糖通过β-1,4糖苷键链接而成,甘露糖与葡萄糖分子摩尔比为1.6∶1[1-3]。KGM独特的分子结构赋予了KGM优良的持水性、成膜性、凝胶性、增稠性、乳化性,从而被广泛应用于食品工业[2]。利用KGM良好的凝胶性能制备凝胶类食品,如制成魔芋豆腐、魔芋蛋糕、魔芋粉丝、果冻、果酱、软糖等,可以赋予凝胶类食品很好的黏弹性、咀嚼性等[4];利用KGM良好的黏性与增稠性,可以用来提高面团结构的稳定性,也可以作为增稠剂,常被用于饮料、酸奶、罐头、粥、果汁、啤酒、冰淇淋等食品中,以此提高产品稳定性、口感和外观质量、延长保质期、改善质地等[3,5]。
粗制魔芋葡甘聚糖一般呈浅色,有鱼腥味,以及存在黏度低、透明度差等缺点,不能满足高质量魔芋食品以及各种食品添加剂的需求[6]。企业与学者探究了许多的KGM提纯方法,主要包括乙醇沉淀法、酸水解法、生物酶法、Pb(Ac)2法等,但是并不是所有的提纯方法都适用于实际生产。如酸水解法因酸的作用降低了KGM的分子质量、黏性、成膜性能等;生物酶法产品缺乏选择性,无法定向酶解;Pb(Ac)2法会引入有毒的Pb2+,造成污染,并且KGM的提取率低[7-8]。上述3种方法提取工艺复杂,问题较多,不适用于实际食品工业生产。乙醇沉淀法是目前规模化生产使用得最多的方法,主要有高浓度乙醇沉淀法[9]、超声波-微波联合辅助乙醇沉淀法[8]等方法;但也存在着操作较为复杂、乙醇浓度高、容易造成浪费等问题;也有通过控制温度达到共沸点的乙醇沉淀法来纯化得到高质量的KGM[6],但是共沸点温度过高、时间过长,导致生产成本过高。因此探究一种低成本、低耗能的乙醇沉淀法对KGM的纯化意义重大。
粗制魔芋葡甘聚糖分子上有淀粉、灰分等杂质,较低浓度乙醇沉淀法有利于KGM分子表面上杂质溶解清除。目前,对于低浓度乙醇纯化魔芋葡甘聚糖的研究较少,关于低浓度乙醇对KGM性能和结构的研究鲜有报道,特别是洗脱时间和洗脱次数对KGM性能和结构的研究尚未见报道。基于此,本文研究不同乙醇浓度、不同洗脱时间和不同洗脱次数对KGM黏度和凝胶强度的宏观特性的影响,并通过傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)、X射线衍射(X-ray diffraction,XRD)、扫描电子显微镜(scanning electron microscope,SEM)、粒径分析等对纯化后KGM结构进行表征,探究低浓度乙醇对KGM的理化特性和结构影响,解析低浓度乙醇纯化KGM的机理,为实际生产生活的需要提供数据支撑和理论指导。
1 材料与方法
1.1 材料与试剂
特级普通魔芋粉,重庆鑫来农产品开发有限公司;无水碳酸钠(分析纯),成都市科龙化工试剂厂;无水乙醇(分析纯),重庆川东化工有限公司。
1.2 仪器与设备
LE104E分析天平,梅特勒-托利多仪器(上海)有限公司;台式常温离心机,基因有限公司;NDJ-5S 数字式黏度计,上海舜宇恒平科学仪器有限公司;DHG-9140A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;JJ-1B恒速电动搅拌器,金坛区西城新瑞仪器厂;HZ-ZK8型数显恒温水浴锅,巩义市予华仪器有限责任公司;TA.XT Plus质构仪,英国Stable Micro System公司;Mastersizer 3000激光粒度仪,英国马尔文公司;Spectrun100傅里叶变换红外光谱仪,美国Perkin Elmer公司;Phenom Pro扫描电子显微镜,荷兰Phenom World公司;X'Pert3 Powder X射线衍射仪,荷兰帕纳特有限公司。
1.3 实验方法
1.3.1 纯化工艺
特级普通魔芋粉和乙醇的料液比为1∶4(g∶mL),在200 r/min的转速下洗脱,随后配平之后放入离心机中,以5 000 r/min的速度离心10 min;离心之后去除上层清液,将其按照料液比1∶4(g∶mL),在50%(体积分数)乙醇中洗涤5 min,接着进行离心;最后将离心后的魔芋粉放进50 ℃的烘箱中干燥6 h,干燥后研磨过60目筛制得样品[7]。
1.3.2 不同工艺处理对魔芋粉纯化的作用
a)称取粗制魔芋葡甘聚糖后,分别用体积分数为27%、30%、33%、36%、39%、42%的乙醇洗脱魔芋粉1次,洗脱时间为30 min,其他操作同1.3.1节。
b)称取粗制魔芋葡甘聚糖后,用33%(体积分数)的乙醇分别洗脱魔芋粉10、20、30、40、50、60 min,洗脱次数为1次,其他操作同1.3.1节。
c)称取粗制魔芋葡甘聚糖后,用33%(体积分数)的乙醇洗脱魔芋粉30 min,分别洗脱魔芋粉1、2、3次,其他操作同1.3.1节。
1.4 指标测定
1.4.1 黏度测定
参照CHEN等[10]方法,稍加改进。配制质量分数0.5%的KGM溶液,为了让KGM充分溶胀,设定转速为500 r/min,在25 ℃搅拌2 h。搅拌后立即使用黏度计的4号转子,在12 r/min下测定黏度,所有样品的黏度测量重复进行3次。
1.4.2 凝胶制备及凝胶强度测定
凝胶制备:参照SU等[11]方法,稍加改进。将1.8 g KGM加入含有碳酸钠溶液(Na2CO3/KGM的质量分数之比为8%)的烧杯中,KGM在搅拌下膨胀,搅拌10 min后,在25 ℃下静置2 h之后,放置在90 ℃水浴锅中加热1 h形成凝胶,冷却至室温备用。
测定方法:凝胶样品切成15 mm厚的薄片,质构分析为TPA模式,探头采用P/0.5,测前速率为2 mm/s,测试速率为1 mm/s,测后速率为l mm/s,形变量为80%,触发力为5 g,触发时间为5 s[12]。
1.4.3 FT-IR测定
将干燥的样品进行扫描,扫描范围为4 000~600 cm-1,光谱分辨率为4 cm-1,连续扫描64次自动平均,测试前需要扣除背景[12]。
1.4.4 XRD测定
将适量不同的KGM放入载玻片上压片后放入X射线衍射仪测试。管压40 kV,电流40 mA,扫描范围4~40°,速率2 °/min[13]。
1.4.5 颗粒粒径测定
采用Mastersizer3000型激光粒度分析仪测定KGM的粒径分布,以无水乙醇为分散系,折射率为1.52,折光度范围:8%~20%[14]。
1.4.6 SEM测定
使用扫描电子显微镜对各样品的微观结构进行观察,将样品固定在铜台上,在真空度1.0×10-3 Pa,溅射电压1.2 kV条件下镀金5 min,镀金后的样品送入电镜观察,选择有代表性的区域进行拍摄,拍摄倍数为1 000×[15]。
1.5 数据统计与分析
采用Excel处理数据,每组试验最少重复3次,结果以“平均值±标准差”来表示,采用SPSS 26.0软件对试验数据进行统计分析,不同字母表示样品间存在显著性(P<0.05),采用Origin 2018软件作图。
2 结果与分析
2.1 乙醇浓度对KGM纯化的影响
乙醇浓度对KGM的凝胶强度和黏度影响如图1所示。KGM在未发生溶解的情况下(乙醇体积分数为27%),随着乙醇浓度的增加,凝胶强度和黏度同时呈现先上升再下降的趋势。当用浓度为33%(体积分数)的乙醇洗脱KGM时,洗脱后KGM的凝胶强度(347 g)和黏度(7 000 mPa·s)最高,且显著高于未纯化的KGM(凝胶强度279 g,P<0.05;黏度5 817 mPa·s,P<0.05)。这是因为魔芋葡甘聚糖是高分子多糖类物质,易在水中溶解而不溶于乙醇;适宜的乙醇浓度可促进KGM膨胀和淀粉等杂质的溶出[8-9]。乙醇体积分数为27%~33%时KGM的黏度和凝胶强度升高,可能是因为KGM吸水膨胀,淀粉等一些亲水性杂质溶解于水中而导致[9];而乙醇体积分数为33%~42%时KGM的黏度和凝胶强度又下降,或是由于KGM在此浓度下分子呈卷缩的状态,杂质未洗出导致[8]。
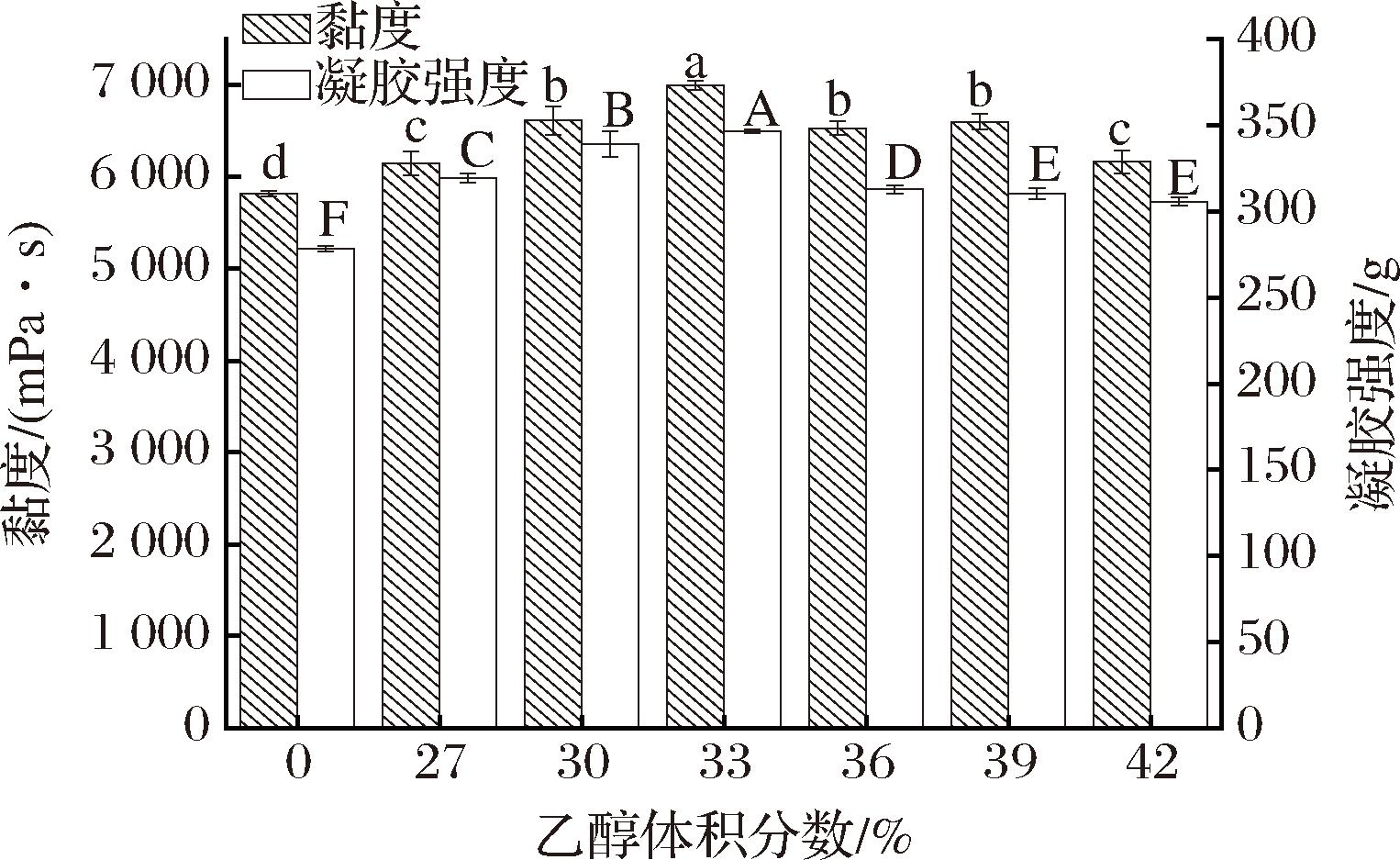
图1 乙醇浓度对KGM凝胶强度和黏度的影响
Fig.1 Effects of different ethanol concentrations on gel strength and viscosity of KGM
注:同种柱形图上方的不同字母表示组间差异显著(P<0.05)(下同)。
2.2 洗脱时间对KGM纯化的影响
洗脱时间对KGM的凝胶强度和黏度影响如图2所示。随着洗脱时间的延长,纯化后的KGM凝胶强度和黏度同时呈现先上升再下降的趋势。当洗脱时间为30 min时,洗脱后的KGM凝胶强度(347 g)和黏度(7 000 mPa·s)最高,且显著高于未纯化KGM的凝胶强度(279 g,P<0.05)和黏度(5 817 mPa·s,P<0.05)。洗脱时间在0~30 min内,KGM的黏度和凝胶强度逐渐增大,这可能是因为随着洗脱时间的延长,KGM吸水膨胀,表面杂质逐渐洗出致其性能改善[8];而洗脱时间在30~60 min内,KGM的黏度和凝胶强度减小,或是由于洗脱时间的延长,KGM部分降解导致[9]。
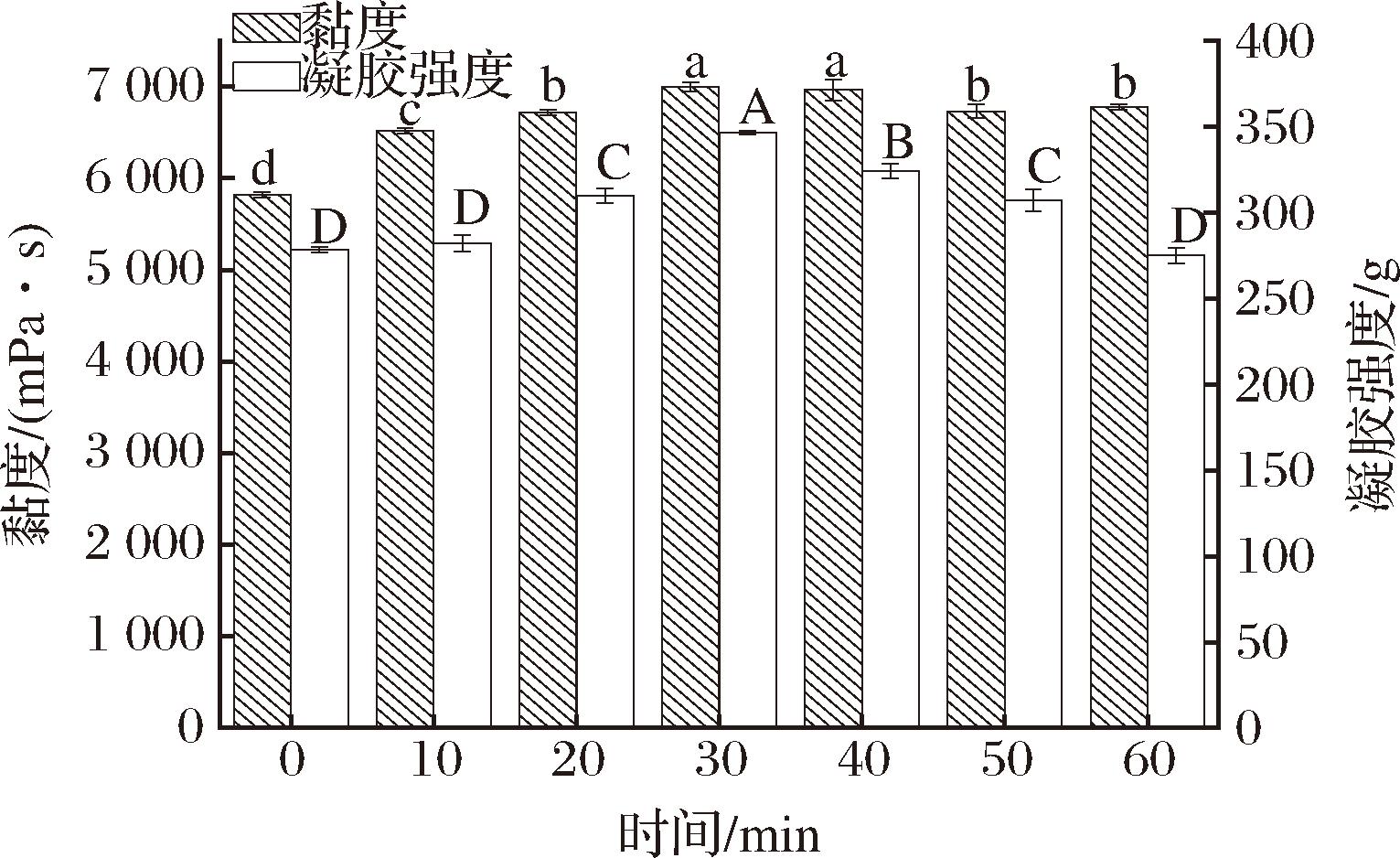
图2 洗脱时间对KGM凝胶强度和黏度的影响
Fig.2 Effect of different elution time on gel strength and viscosity of KGM
2.3 洗脱次数对KGM纯化的影响
洗脱次数对KGM的凝胶强度和黏度影响如图3所示。KGM随着洗脱次数的增加,凝胶强度和黏度都呈现一直上升的趋势,这是因为KGM凝胶强度和黏度皆与KGM含量呈正相关,KGM越洗越纯,杂质越来越少[16-17]。当洗脱KGM的次数为2时,凝胶强度为358.147 g,黏度是7 833 mPa·s;当洗脱KGM的次数为3时,凝胶强度为365.613 g,黏度是8 167 mPa·s。在洗脱次数超过2后,凝胶强度和黏度的增幅减小,考虑到成本和纯化效果等多方面,洗脱2次的效果适合实际生产需要,与汪佳文等[18]实验结果一致。
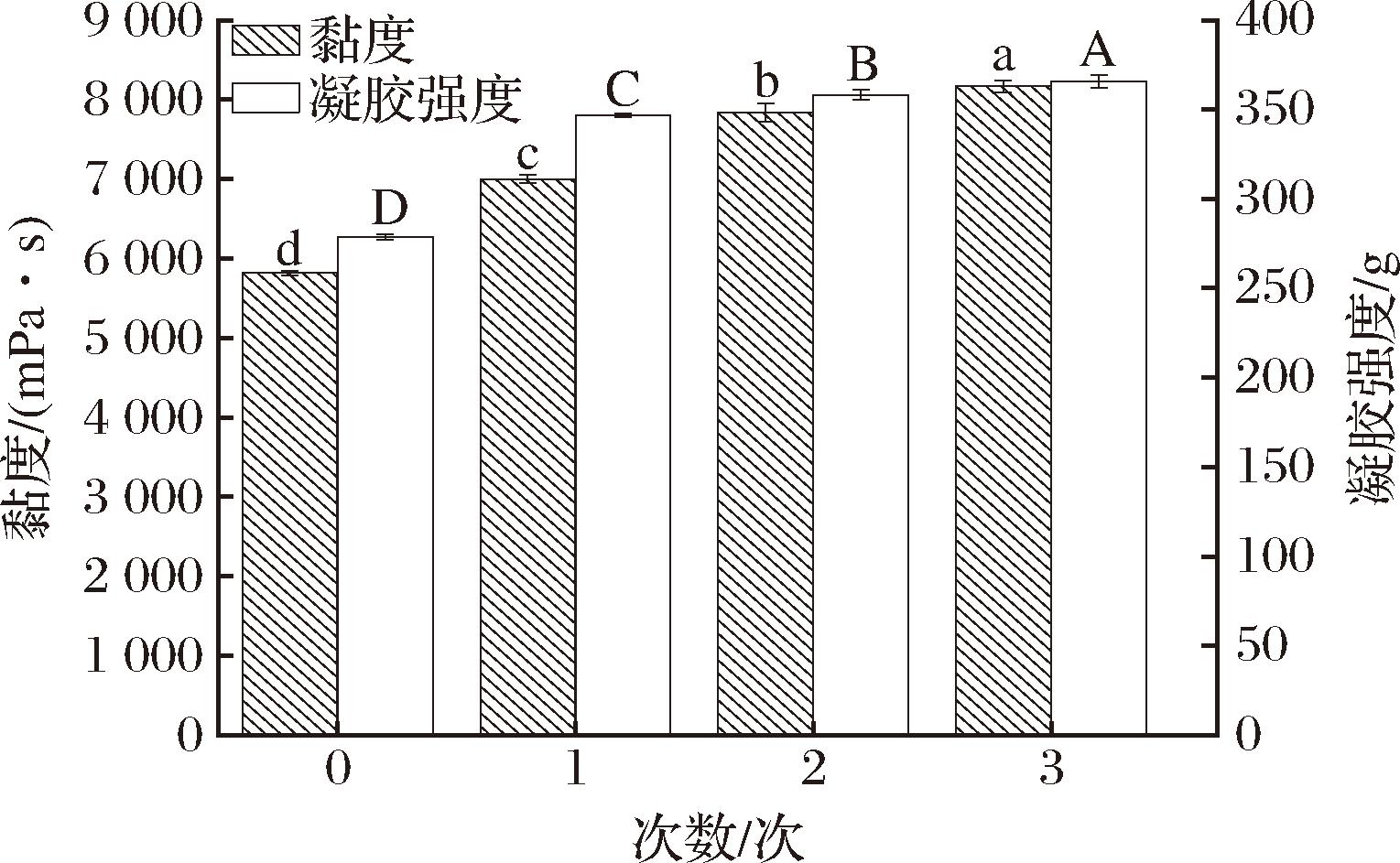
图3 洗脱次数对KGM凝胶强度和黏度的影响
Fig.3 Effect of different elution times on gel strength and viscosity of KGM
2.4 FT-IR结果分析
不同纯化处理的KGM 傅里叶变换红外光谱如图4所示,纯化后KGM的特征峰没有产生新的基团或键,其特征基团与其他文献结果一致[19],特别是—OH的伸缩振动峰均位于3 321 cm-1附近;且此振动吸收峰带较对照组变窄,表明去除杂质后KGM链更加有序[20]。氢键作用力是KGM凝胶过程中的主要作用力,可促进KGM凝胶的形成[21],同时也会使KGM更具有亲水性,利于吸水和增稠,使KGM黏度增强[16,22]。
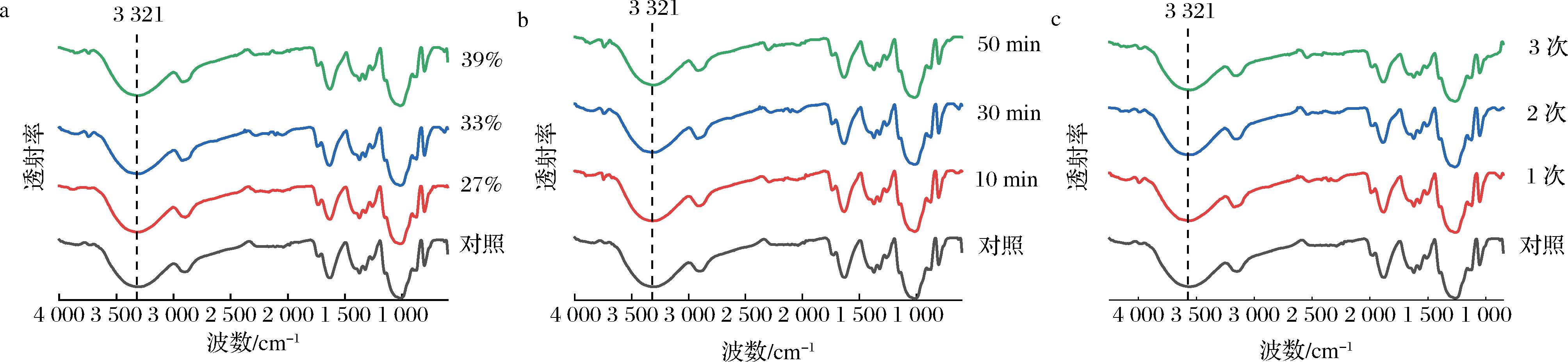
a-乙醇浓度不同;b-洗脱时间不同;c-洗脱次数不同
图4 不同纯化处理的KGM傅里叶变换红外光谱图
Fig.4 Fourier transform infrared spectra of KGM with different purification treatments
注:图中百分数均为乙醇的体积分数(下同)。
根据对照组和纯化后的KGM红外图可知,对照和体积分数为27%、33%、39%乙醇洗脱的KGM在3 321 cm-1附近的吸收波长分别为3 319、3 318、3 307、3 311 cm-1;对照和10、30、50 min乙醇洗脱的KGM在3 321 cm-1附近的吸收波长分别为3 319、3 320、3 307、3 320 cm-1;对照和洗脱1次、2次、3次的KGM在3 321 cm-1附近的吸收波长分别为3 319、3 307、3 300、3 305 cm-1。上述结果表明不同浓度、不同时间和不同次数的乙醇处理,对KGM的—OH振动有显著影响。一般来说峰值波数越低,其氢键作用力越强[23];乙醇体积分数33%、30 min且处理2次的峰值波长相比其他处理而言波数降低得最多,因而氢键作用最强,其凝胶强度与黏度最好,这与前述不同纯化处理对KGM的凝胶强度和黏度影响的研究结果一致。
2.5 XRD分析
不同纯化处理KGM的X-射线衍射图谱如图5所示,当2θ处于5~30°时,KGM均呈现出较为明显的弥散峰,且未出现明显的结晶峰,但在20°左右均有一个较大的无定形态非结晶峰。在改变乙醇浓度的情况下,2θ≈20°衍射峰高度几乎没有变化;在乙醇体积分数为27%~33%时,随着浓度的增加,KGM衍射峰强度随之加强;而当乙醇体积分数从33%升至39%时,其衍射峰强度又随之减弱。上述KGM分子链的衍射峰先提高再下降的变化,进一步说明33%(体积分数)的乙醇浓度可促进KGM分子内聚收缩,增强KGM分子之间氢键相互作用,进而诱导局部形成有序的短程结构[24]。同理,30 min的洗脱时间可促进KGM分子发生聚集而致使局部有序结构增加。在改变洗脱次数的情况下,2θ≈20°的衍射峰高度发生了较为明显的改变,随着洗脱次数的增强,弥散峰强度增强,相对结晶度增强,氢键作用力增强,局部有序结构增加,与前述红外结果一致。
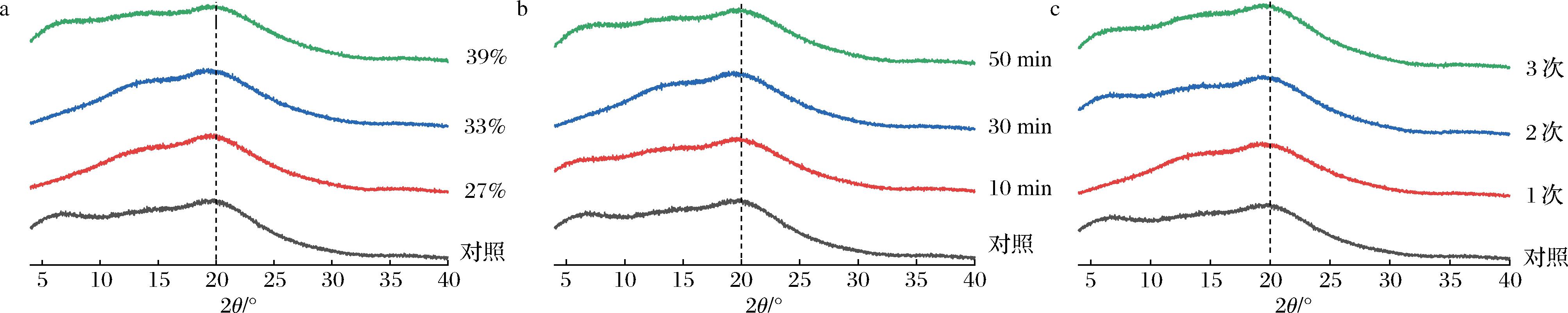
a-乙醇浓度不同;b-洗脱时间不同;c-洗脱次数不同
图5 不同纯化处理的KGM X-射线衍射图谱
Fig.5 X-ray diffraction of KGM with different purification treatments
2.6 粒径分析
对照组和不同纯化处理后的KGM粒径如图6所示,KGM粒径主要分布在70~700 μm,且存在较大粒径的颗粒。经过乙醇处理后的KGM粒径分布与对照组差异不大,这与酶降解魔芋葡甘聚糖的研究结论一致[25]。乙醇体积分数从27%升至39%时,粒径参数Dx(10)、Dx(50)、Dx(90)、D[4,3]呈现出先降低再增加趋势,乙醇浓度对KGM的粒径影响显著。由表1可以看出,33%(体积分数)乙醇使KGM适度的膨胀,杂质溶出,粒径变小;而在乙醇浓度较低时,KGM膨胀过大,粒径偏大;乙醇浓度较高时,KGM膨胀较小,但水溶性杂质溶解较少或者KGM分子呈现较卷缩态,杂质未洗出,粒径仍较大,与前文研究结果一致。洗脱时间为30 min时,KGM充分洗出杂质,粒径减小;洗脱时间短时,因杂质未完全洗出,KGM略吸水后分子粒径较大;洗脱时间长时,虽KGM表面部分略降解,但分子粒径仍稍有增大,可能是随着时间的延长,KGM与水分子充分接触,KGM膨胀的体积增加较多导致的[14]。洗脱次数对KGM粒径的影响也较大,洗脱次数增加,KGM粒径增加,这可能是因为洗脱次数增加,KGM分子表面杂质充分洗脱,KGM分子略膨胀,粒径增加,这与前文凝胶强度和黏度结果一致。总之,在低浓度乙醇中KGM分子会发生适度微膨胀,使其表面杂质暴露洗落出来,进而改变粒径大小。
表1 不同纯化处理的KGM粒径参数 单位:μm
Table 1 Particle size parameters of KGM with different purification treatments
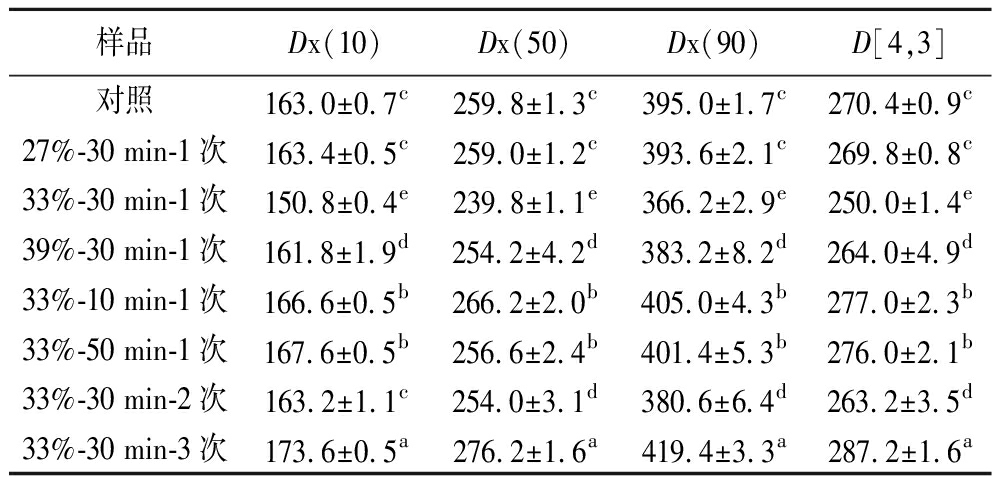
样品Dx(10)Dx(50)Dx(90)D[4,3]对照163.0±0.7c259.8±1.3c395.0±1.7c270.4±0.9c27%-30 min-1次163.4±0.5c259.0±1.2c393.6±2.1c269.8±0.8c33%-30 min-1次150.8±0.4e239.8±1.1e366.2±2.9e250.0±1.4e39%-30 min-1次161.8±1.9d254.2±4.2d383.2±8.2d264.0±4.9d33%-10 min-1次166.6±0.5b266.2±2.0b405.0±4.3b277.0±2.3b33%-50 min-1次167.6±0.5b256.6±2.4b401.4±5.3b276.0±2.1b33%-30 min-2次163.2±1.1c254.0±3.1d380.6±6.4d263.2±3.5d33%-30 min-3次173.6±0.5a276.2±1.6a419.4±3.3a287.2±1.6a
a-乙醇浓度不同;b-洗脱时间不同;c-洗脱次数不同
图6 不同纯化处理的KGM 粒径分布图
Fig.6 Particle size distribution diagram of KGM with different purification treatments
2.7 SEM分析
由图7可以看出,对照组KGM颗粒表面杂质颗粒较大、较明显、呈圆形、没有明显的褶皱,与王瑶等[9]KGM优化制备研究结果一致。杂质如灰分、蛋白质、淀粉等,留在表面或嵌入粗制KGM颗粒内,通过不同浓度的乙醇洗脱,可将粗制KGM的表面和内部的微细杂质去除,使纯化后KGM颗粒的表面和内部形成了较高的粗糙度和规则褶皱结构[6]。乙醇体积分数为27%~33%时,随着乙醇浓度的升高,纯化KGM的效果越明显,表面杂质越少,形成的褶皱越多且规则,这可能是因为较低乙醇体积分数能促使KGM部分膨胀并有效浸出其表层附着的小分子杂质,形成局部塌陷[24];而当乙醇体积分数从33%升至39%时,形成的褶皱呈不规则形状,且存在的淀粉杂质较多;因此乙醇体积分数为33%时,KGM显微效果最佳。经过一定时间低浓度乙醇洗脱后,KGM的表面和内部的杂质去除,粗糙度和规则褶皱结构增加,KGM理化特性增强;综合比较洗脱时间为30 min时,KGM显微效果较好。同理,随着洗脱次数的增加,KGM颗粒表面的层状和规则褶皱越来越多,形状多异,含有的淀粉等杂质越来越少,KGM的凝胶强度和黏度得以提高;综合分析洗脱2次显微效果优。

a-对照;b-27%乙醇;c-33%乙醇;d-39%乙醇;e-对照; f-10 min;g-30 min;h-50 min;i-对照;j-1次;k-2次;l-3次
图7 不同纯化处理的KGM微观结构(×1 000)
Fig.7 Microstructure of KGM with different purification treatments(×1 000)
3 结论
使用低浓度乙醇对粗制魔芋葡甘聚糖进行纯化,可有效改善粗制魔芋葡甘聚糖的理化特性,如KGM的凝胶强度、表观黏度等均得到显著改善。由红外光谱、X-射线衍射、扫描电镜等结构分析可知,低浓度乙醇处理对KGM的重复结构单元和功能基团并不会造成影响,主要是通过增强氢键作用力、增加衍射峰强度、去除表面的杂质等来改变KGM的凝胶强度和黏度。使用低浓度乙醇纯化KGM能获得溶剂用量小、成本低的生产方式;且通过不同的低浓度乙醇纯化工艺,可制得不同性能的KGM,从而应用于不同生产。如凝胶性能良好的KGM适合于生产魔芋豆腐等凝胶性能良好的产品,高黏度的KGM适合于生产冰淇淋等黏性和增稠性良好的产品。后续还可以通过拉曼光谱、低场核磁共振等先进手段进一步研究低浓度乙醇纯化KGM的结构变化,从而能够更加深入地解析低浓度乙醇纯化魔芋葡甘聚糖的机制,扩大其在新型魔芋食品开发的应用范围。
[1] DEVARAJ R D, REDDY C K, XU B J.Health-promoting effects of konjac glucomannan and its practical applications:A critical review[J].International Journal of Biological Macromolecules, 2019, 126:273-281.
[2] ZHANG W L, RHIM J W.Recent progress in konjac glucomannan-based active food packaging films and property enhancement strategies[J].Food Hydrocolloids, 2022, 128:107572.
[3] GUO J Y, LIU F, GAN C F, et al.Effects of konjac glucomannan with different viscosities on the rheological and microstructural properties of dough and the performance of steamed bread[J].Food Chemistry, 2022, 368:130853.
[4] ZHANG Y, ZHAO Y, YANG W F, et al.Structural complexity of konjac glucomannan and its derivatives governs the diversity and outputs of gut microbiota[J].Carbohydrate Polymers, 2022, 292:119639.
[5] 李浪, 张泽俊, 彭潇, 等.魔芋中多糖提取分离纯化及应用研究进展[J].山东化工, 2020, 49(20):50-51;53.
LI L, ZHANG Z J, PENG X, et al.Extraction purification and application of polysaccharides from konjac[J].Shandong Chemical Industry, 2020, 49(20):50-51;53.
[6] XU W, WANG Y T, JIN W P, et al.A one-step procedure for elevating the quality of konjac flour:Azeotropy-assisted acidic ethanol[J].Food Hydrocolloids, 2014, 35:653-660.
[7] 吴远艳. 魔芋葡甘露聚糖的提纯以及化学改性研究进展[J].陕西农业科学, 2017, 63(4):63-67.
WU Y Y.Research progress on purification and chemical modification of konjac glucomannan[J].Shaanxi Journal of Agricultural Sciences, 2017, 63(4):63-67.
[8] 聂娅娜. 魔芋葡甘聚糖的纯化及在米饭中的应用研究[D].长春:吉林大学, 2016.
NIE Y N.Study on the purification of konjac glucomannan and its application in rice[D].Changchun:Jilin University, 2016.
[9] 王瑶, 宁杰, 宋庆贺, 等.响应面法优化魔芋葡甘露聚糖制备工艺及其理化性质分析[J].食品研究与开发, 2020, 41(18):154-161.
WANG Y, NING J, SONG Q H, et al.Optimization of preparation of konjac glucomannan from amorphophallus konjac by response surface methodology and its physicochemical properties[J].Food Research and Development, 2020, 41(18):154-161.
[10] CHEN Z J, WANG S S, SHANG L C, et al.An efficient and simple approach for the controlled preparation of partially degraded konjac glucomannan[J].Food Hydrocolloids, 2020, 108:106017.
[11] SU Y J, ZHANG M Z, CHANG C H, et al.The effect of citric-acid treatment on the physicochemical and gel properties of konjac glucomannan from Amorphophallus bulbifer[J].International Journal of Biological Macromolecules, 2022, 216:95-104.
[12] 范盛玉, 严竟, 朱坤, 等.辣椒红色素对魔芋葡甘聚糖-大豆分离蛋白复合凝胶性质的影响[J].食品与发酵工业, 2023, 49(8):216-222.
FAN S Y, YAN J, ZHU K, et al.Effects of capsanthin on properties of konjac glucomannan-soybean protein isolate composite gel[J].Food and Fermentation Industries, 2023, 49(8):216-222.
[13] WANG M, LI Y C, MENG F B, et al.Effect of honeysuckle leaf extract on the physicochemical properties of carboxymethyl konjac glucomannan/konjac glucomannan/gelatin composite edible film[J].Food Chemistry:X, 2023, 18:100675.
[14] TANG H B, WANG L, LI Y P, et al.Effect of acidolysis and oxidation on structure and properties of konjac glucomannan[J].International Journal of Biological Macromolecules, 2019, 130:378-387.
[15] 刘海利, 范盛玉, 张盛林, 等.不同干燥条件对白魔芋精粉性质的影响及其结构表征[J].食品与发酵工业, 2024, 50(7): 212-219.
LIU H L, FAN S Y, ZHANG S L, et al.Effect of different drying conditions on the properties of white konjac flour and its structural characterization[J].Food and Fermentation Industries, 2024, 50(7): 212-219.
[16] LIU L, ZHANG Y T, DAO L P, et al.Efficient and accurate multi-scale simulation for viscosity mechanism of konjac glucomannan colloids[J].International Journal of Biological Macromolecules, 2023, 236:123992.
[17] LIU Z J, REN X, CHENG Y Q, et al.Gelation mechanism of alkali induced heat-set konjac glucomannan gel[J].Trends in Food Science &Technology, 2021, 116:244-254.
[18] 汪佳文, 冯程.魔芋中KGM的提取及抑菌活性分析[J].广州化工, 2021, 49(14):67-69.
WANG J W, FENG C.Study on extraction conditions and determination of antibacterial activity of KGM[J].Guangzhou Chemical Industry, 2021, 49(14):67-69.
[19] ZHANG K G, GE F, TANG F K, et al.A structure-property study for konjac glucomannan and guar galactomannan:Selective carboxylation and scale inhibition[J].Carbohydrate Polymers, 2023, 299:120220.
[20] KURT A, KAHYAOGLU T.Rheological properties and structural characterization of salep improved by ethanol treatment[J].Carbohydrate Polymers, 2015, 133:654-661.
[21] ZHOU Y, JIANG R S, PERKINS W S, et al.Morphology evolution and gelation mechanism of alkali induced konjac glucomannan hydrogel[J].Food Chemistry, 2018, 269:80-88.
[22] ZHENG Q Y, LIU Z J, LIANG X M, et al.Insights into network rearrangement of konjac glucomannan gel induced by post-gelation soaking[J].Food Hydrocolloids, 2023, 145:109044.
[23] LI Z Y, ZHANG L, MAO C L, et al.Preparation and characterization of konjac glucomannan and gum arabic composite gel[J].International Journal of Biological Macromolecules, 2021, 183:2121-2130.
[24] 陈士勇, 汪超, 靳贞亮, 等.乙醇阻溶体积分数对魔芋葡甘聚糖结构及性能影响[J].食品科学, 2011, 32(3):73-75.
CHEN S Y, WANG C, JIN Z L, et al.Influence of alcohol treatment at various concentrations on the structure and properties of konjac glucomannan[J].Food Science, 2011, 32(3):73-75.
[25] 唐晓东. β-甘露聚糖酶降解对魔芋葡甘聚糖结构、黏度性质的影响[J].粮食加工, 2022, 47(4):59-62;67.
TANG X D.Effects of β-mannanase degradation on structure and viscosity properties of konjac glucomannan[J].Grain Processing, 2022, 47(4):59-62;67.