桑葚又名桑果、桑子、桑枣等,是桑科桑属植物桑树的果实。桑葚中含有丰富的花色苷、非花色苷酚类化合物等活性物质以及有机酸、维生素、矿物质、氨基酸等营养成分,具有抗氧化、促进造血细胞生长、降血糖、降血脂、提高免疫力等功效[1]。桑葚以其丰富的营养成分、保健功效和药用价值成为开发功能性食品的首选,也是被国家卫生部批准的第一批“药食同源”农产品[2]。
由于桑葚鲜果果皮极薄,容易腐烂变质,在桑葚采收季节,经常有大量桑葚果实滞销腐烂,造成极大经济损失,因此对新鲜桑葚进行深加工开发副产品,是减少桑农损失的有效途径[3]。在桑葚的众多加工产品中,桑葚果酒具有极高的附加值,它不仅可以有效保留桑葚浆果中的营养成分,还可以通过酵母代谢产生新的功能活性成分,增强其保健功能[4-5]。研究表明,桑葚果酒具有较高的抗氧化活性、抗菌性以及抗癌性[6]。目前对于桑葚果酒的研究更多集中在酿造工艺方面,而对于其活性成分的研究还比较匮乏。
本文采用高效液相色谱串联电喷雾二级质谱(high performance liquid chromatography-electron spray ionization-mass spectrometry/mass spectrometry,HPLC-ESI-MS/MS)法鉴定了桑葚浆果、桑葚干酒和桑葚利口酒中的花色苷及非花色苷类化合物,并比较了桑葚浆果、桑葚干酒和桑葚利口酒中酚类化合物的种类、含量和抗氧化活性的差异,为桑葚的深加工提供理论依据。
1 材料和方法
1.1 材料与试剂
材料:桑葚采摘至云南蒙自,采回后立即用液氮速冻,于-80 ℃冰箱中保存。桑葚干酒,桑葚利口酒均来自云南红河马桑饮品有限公司。
试剂:冰醋酸、甲醇、甲酸、乙腈(色谱纯),美国Fisher公司;DPPH、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、原儿茶酸(protocatechuic acid)、二氢槲皮素(taxifolin)、芦丁(rutin)、槲皮素(quercetin),美国Sigma公司;花青素-3-葡萄糖苷(cyanidin-3-O-glucoside)、花青素-3-云香糖苷(cyanindin-3-rutinoside)标准品,Extrasynthese公司。
1.2 仪器与设备
Agilent 1200液质联用仪,美国安捷伦公司;HZS-H水浴振荡器,哈尔滨东联公司;GL-20G-Ⅱ离心机,上海安亭公司;DBS-100自动馏分收集器,上海沪西;KQ 2200B超声波清洗机,昆山市超声仪器公司。
1.3 花色苷与非花色的多酚的提取
桑葚果实:称取一定质量的桑葚加入100%乙醇(料液比1∶5,g∶mL),破碎均质,超声提取10 min,30 ℃条件下振动提取2 h,然后9 000×g离心10 min,收集上清液,重复提取3次后,合并上清液。然后向沉淀中加入50%乙醇(料液比1∶5,g∶mL),重复上述提取步骤3次,合并上清液后,加入100%乙醇,使其乙醇含量达到80%,静置过夜,然后9 000×g离心10 min,收集上清液并与100%乙醇提取液合并。在30 ℃条件下旋转蒸发至干燥,剩余物质用去离子水定容,即为桑葚酚类物质粗提取液。向酚类物质粗提取液中等体积加入石油醚萃取3次除去脂溶性杂质后,加入等体积的乙酸乙酯,重复萃取3次,合并有机相(非花色苷多酚),在30 ℃条件下旋转蒸发至干燥,甲醇定容,避光保存于-20 ℃以备液相分析检测;同时收集水相用于测定花色苷。测定前用0.45 μm滤膜过滤。
桑葚酒:桑葚酒中的花色苷采取直接进样法。桑葚酒中非花色苷多酚的提取参考孙佳莹等[7]的研究方法,并稍作修改。向5 mL的桑葚酒样中加入5 mL的水和4 mL的乙酸乙酯,重复萃取3次,合并有机相后,在30 ℃条件下旋转蒸发至干燥,甲醇定容至0.5 mL,避光保存于-20 ℃以备液相分析检测非花色苷多酚。测定前用0.45 μm滤膜过滤。
1.4 花色苷和非花色苷多酚的HPLC-ESI-MS/MS分析
非花色苷多酚LC分析条件:ZORBAX SB-C18(250 mm×4.6 mm,5 μm)色谱柱,流动相A[V(乙酸)∶V(水)=1∶99],流动相B[V(乙酸)∶V(甲醇)=1∶99]。梯度洗脱程序:0~10 min:10%~25% B;10~25 min:25%~40% B;25~45 min:40%~65% B;45~55 min:65%~95% B;55~58 min:95%~10% B;58~61 min:10% B,流速:1.0 mL/min,进样量:10 μL,检测波长:280 nm,柱温:25 ℃。
花色苷LC分析条件:Kromasil C18色谱柱,流动相A [V(甲酸)∶V(水)=1∶19],流动相B [V(甲酸)∶V(乙腈)=1∶19]。梯度洗脱程序:0~1 min:5% B;1~10 min:5%~15% B;10~22 min:15%~24% B;22~28 min:24%~31% B;28~33 min:31%~5% B,流速:1 mL/min,进样量:20 μL,检测波长:525 nm,柱温:25 ℃。
电喷雾电离质谱的分析条件:非花色苷多酚分析采用负离子模式,扫描范围:50~1 000 m/z,雾化压力:30 psi,流速:10 L/min,温度:325 ℃,二级质谱诱导碰撞能量:1.0 V。花色苷分析采用正离子模式,扫描范围:100~1 500 m/z,雾化压力:30 psi,流速:12 L/min,温度:300 ℃,二级质谱诱导碰撞能量:1.0 V。
1.5 花色苷和非花色苷多酚的HPLC定量分析方法
非花色苷多酚的含量通过HPLC进行测定,测定条件如下:ZORBAX SB-C18(250 mm×4.6 mm,5 μm)色谱柱,梯度洗脱程序:0~10 min:10%~20% B;10~20 min:20%~25% B;20~40 min:25%~41% B;40~55 min:41%~56% B;55~57 min:56%~95% B;57~59 min:5%~10% B,59~61 min:10% B,流速:1.0 mL/min,进样量:10 μL,检测波长:280 nm,柱温:25 ℃。采用外标法对非花色苷多酚进行定量分析,非花色苷多酚的含量以绿原酸当量表示。
花色苷的含量的测定程序同1.4节花色苷LC分析条件。采用外标法对花色苷进行定量分析,花色苷的含量以花青素-3-葡萄糖苷当量表示。
1.6 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定是基于文献[8]的方法,并略有改动,在3 mL的0.1 mmol/L的DPPH的乙醇溶液中加入0.2 mL样品溶液,室温下放置30 min,测定517 nm波长吸光值。桑葚酒测定前需要在35 ℃条件下进行旋转蒸发除掉乙醇,并用去离子水补充到原刻度。抗氧化活性计算方法如公式(1)所示:
(1)
式中:SA为清除率,%;A0为试剂空白吸光值;A1为加入待测样反应吸光值;A2为样品本底吸光值。
1.7 数据处理
采用SPSS12.0统计分析软件(IBM,美国)进行单因素的方差分析,通过Ducan’s multiple comparison 检验进行差异显著性分析,显著性水平为P<0.05。
2 结果与分析
2.1 桑葚果实、桑葚干酒和桑葚利口酒中酚类物质鉴定
2.1.1 花色苷的鉴定
在桑葚浆果、桑葚干酒和桑葚利口酒中共鉴定出4种花色苷,4种花色苷的峰编号、保留时间、分子质量、二级质谱碎片信息、最大吸收波长和化合物名称见表1。通过将峰1和峰2的保留时间、分子质量、MS/MS质谱碎片信息与标准品进行比对,确定峰1和峰2依次为花青素-3-葡萄糖苷和花青素-3-芸香糖苷。
表1 桑葚果实、桑葚干酒和桑葚利口酒中的花色苷在正离子模式下的LC-ESI-MS/MS 信息
Table 1 LC-ESI-MS/MS information of anthocyanins in mulberry fruit, dry wine, and liqueur under positive-ion mode

编号tR/min分子离子(m/z)碎片离子(m/z)λmax /nm化合物分布峰19.0449287516花青素-3-葡萄糖苷桑葚果实、桑葚干酒、桑葚利口酒峰29.7595449, 287518花青素-3-芸香糖苷桑葚果实、桑葚干酒、桑葚利口酒峰310.15173555024-丙酮酸-花青素-3-葡萄糖苷桑葚利口酒峰411.5579433, 271506花葵素-3-芸香糖苷桑葚干酒
峰3的分子离子[M+H]+为m/z 517,在二级质谱断裂时丢失一个m/z 162(葡萄糖),产生碎片[M-H-162 amu]+ m/z 355,m/z 355比花青素-3-葡萄糖苷的二级质谱碎片m/z 287大68 Da,而68 Da正是丙酮酸的分子质量,其与花青素在4位成环后骨架稳定,在二级质谱中不产生断裂,据此推测,峰3可能是4-丙酮酸-花青素-3-葡萄糖苷[9]。在葡萄酒中,来自葡萄果皮的花色苷可能会在酒精发酵和陈酿阶段与酵母代谢产物,如丙酮酸、乙醛和黄烷-3-醇等非花色苷多酚发生4位加合成环反应,形成新的花色苷[10],例如葡萄中的二甲花翠素-3-葡萄糖苷会在酒精发酵后转变成4-丙酮酸-二甲花翠素-3-葡萄糖苷。由此推测,桑葚酒中的4-丙酮酸-花青素-3-葡萄糖苷,可能是由桑葚浆果中的花青素-3-葡萄糖苷转化而来[9]。
峰4在一级质谱出现分子离子m/z 579,在MS/MS中,丢失1个鼠李糖(146 amu)或丢失一个鼠李糖后再丢失1个葡萄糖(162 amu)碎片,产生碎片离子m/z 433 和m/z 271,m/z 271是花葵素的质量数[11],推测峰4可能是花葵素-3-芸香糖苷。另外,峰4的紫外可见吸收光谱λmax为502 nm,并在440 nm有明显的肩峰(图1-b),是典型的花葵素型花色苷的光谱特征[12],进一步证明了峰4是花葵素-3-芸香糖苷的推论。
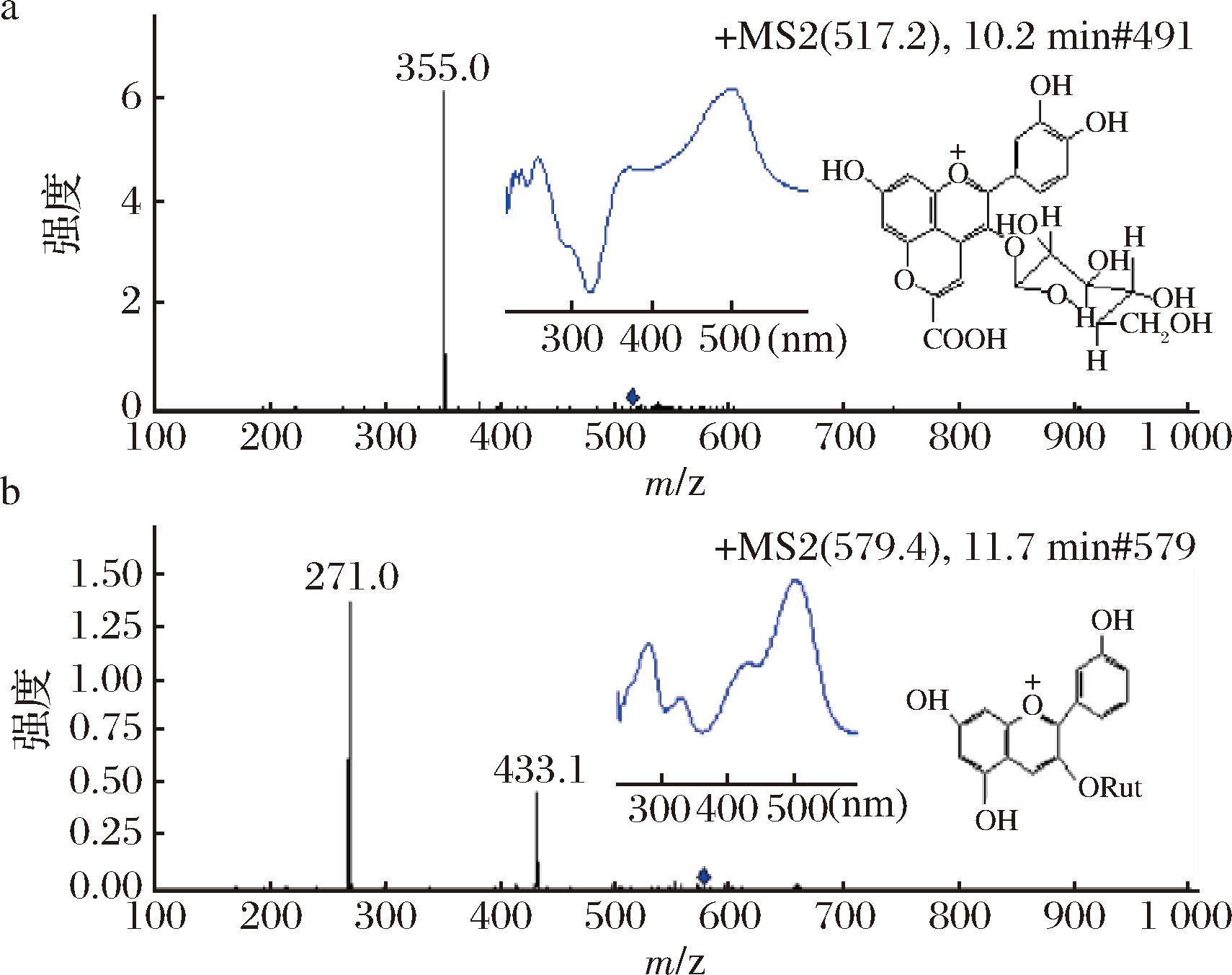
a-峰3;b-峰4
图1 峰3和峰4的LC-ESI-Vis-MS/MS及结构信息
Fig.1 The LC-ESI-MS/MS and structure information of peak 3 and peak 4
2.1.2 非花色苷多酚的鉴定
在桑葚果实、桑葚干酒和桑葚利口酒中分离出14中非花色苷多酚。通过将14种峰的保留时间、分子质量、MS/MS质谱碎片和最大吸收波长与标准品进行逐一比对,鉴定出5种化合物,依次为原儿茶酸、绿原酸、二氢槲皮素、芦丁和槲皮素(表2和表3)。
表2 桑葚果实中8种非花色苷多酚在负离子模式下的HPLC-ESI-MS/MS信息
Table 2 HPLC-ESI-MS/MS information of eight non-anthocyanin phenolics in mulberry fruits under negative-ion mode

编号tR/minλmax/nm分子离子(m/z)碎片离子(m/z)化合物峰19.7260, 294153109原儿茶酸峰316353191242, 326, 297 sh绿原酸峰417.2353.4173, 179, 191242, 326, 297 sh4-咖啡奎尼酸峰525.9290, 335 sh303285, 125, 177二氢槲皮素峰729.9515.5353, 191, 179242, 328, 300 sh3,5-二咖啡奎尼酸峰832256, 356609.5301, 179, 255, 343芦丁峰936.6447285266, 348, 296 sh山萘酚-六碳糖苷峰1142.4256, 372301151, 179, 273, 107槲皮素
注:sh 表示UV-Vis光谱中的肩峰(下同)。
表3 桑葚干酒和桑葚利口酒中4种非花色苷多酚在负离子模式下的HPLC-ESI-MS/MS信息
Table 3 HPLC-ESI-MS/MS information of four non-anthocyanin phenolics in mulberry dry wine and liqueur under negative-ion mode

编号tR/minλmax/nm分子离子(m/z)碎片离子(m/z)化合物峰19.7260, 294153109原儿茶酸峰631.4288, 335 sh303285, 125, 177二氢槲皮素峰842.5256, 354609.5301, 179, 255, 343芦丁峰1454.0256, 370301151, 179, 273, 107槲皮素
如图2-a和图2-b所示,峰4和峰7具有相同的紫外可见吸收光谱,都具备含有咖啡酸基团的典型光谱特征[13]。峰4在MS/MS断裂时,产生了3个碎片m/z 173、m/z 191和m/z 179,其中m/z 179和m/z 191 碎片是咖啡奎尼酸基团断裂的特征碎片,而碎片m/z 173可以由4-咖啡奎尼酸在MS/MS断裂过程中产生的,由此推测峰4为4-咖啡奎尼酸。另外,峰7的分子离子[M-H]ˉ为m/z 515.5,主要碎片离子为m/z 353、m/z 191和m/z 179,其分子离子和二级质谱断裂特征与二咖啡奎尼酸及其同分异构体相同。由于二咖啡奎尼酸的同分异构体中,3,5-二咖啡奎尼酸的二级质谱断裂方式简单,碎片较少,且不会出现碎片m/z 335,据此推测峰6为3,5-二咖啡奎尼酸[14]。
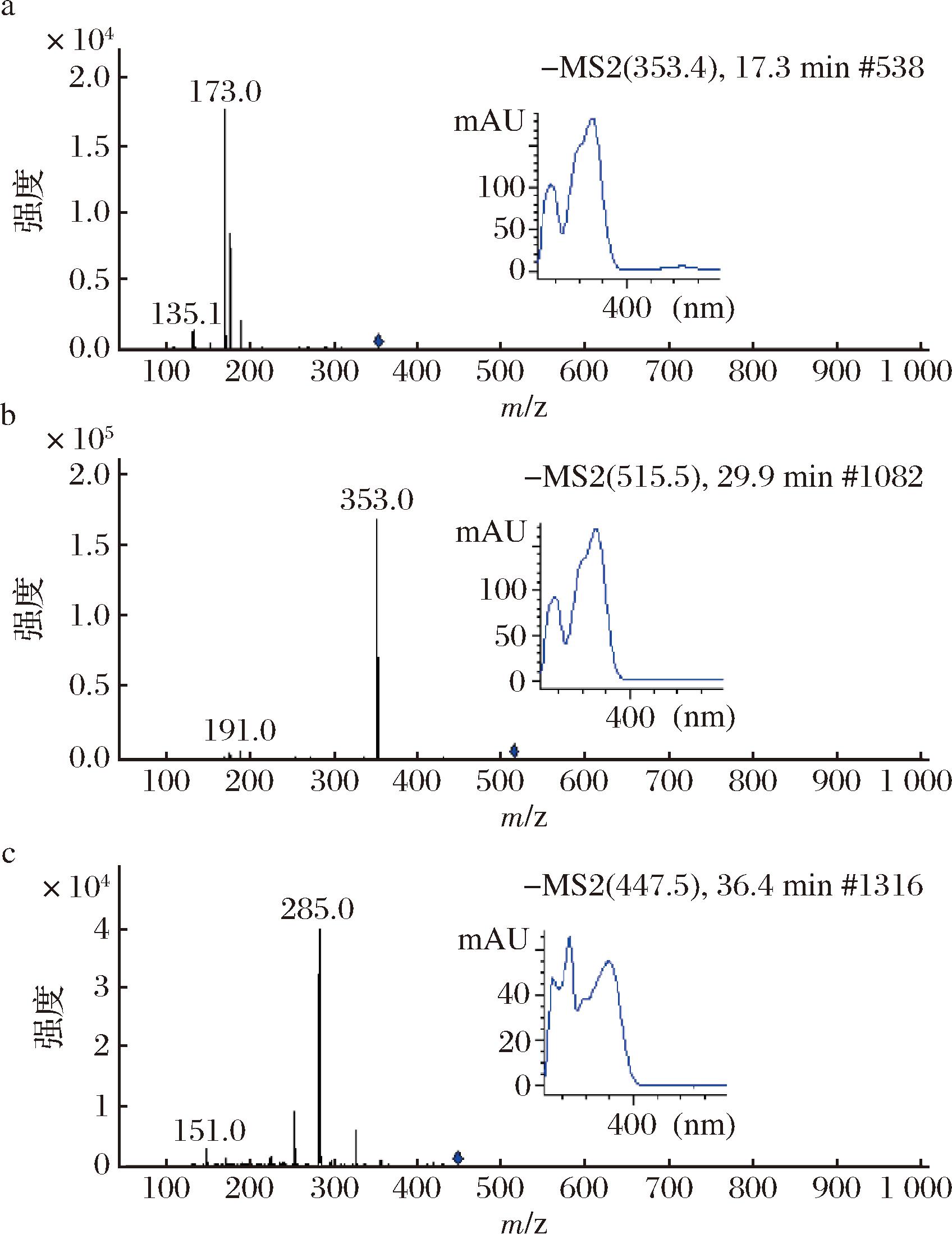
a-峰4;b-峰7;c-峰9
图2 峰4、峰7和峰9的LC-ESI-Vis-MS/MS及结构信息
Fig.2 The LC-ESI-MS/MS and structure information of peak 4, peak 7, and peak 9
峰9具备山奈酚的典型光谱特征(图2-c),其分子离子[M-H]ˉ为m/z 447,碎片离子为m/z 285,m/z 285正是由分子离子丢失一个六碳糖(162 amu)所形成的,这表明糖苷配基的分子质量为286 amu,恰好与山萘酚的分子质量相同,因此,峰9可能是山萘酚-六碳糖苷。研究表明,黄酮醇苷相比于其配基,它的糖苷的带Ⅰ和带Ⅱ都有不同程度的蓝移[15]。峰9的吸收光谱的带Ⅰ峰值为348 nm,相较于山萘酚的吸收光谱带Ⅰ短移16 nm,进一步证明峰9是山萘酚-六碳糖苷。
2.2 桑葚果实、桑葚干酒和桑葚利口酒中酚类物质的含量分析
2.2.1 花色苷的含量分析
桑葚果实、桑葚干酒和桑葚利口酒中花色苷的含量如表4所示。花青素-3-葡萄糖苷和花青素-3-芸香糖苷是桑葚果实、桑葚干酒和桑葚利口酒中主要的花色苷。和桑葚果实(3 316.60 μg/g)相比,桑葚干酒(65.38 μg/mL)和利口酒(31.40 μg/mL)中花色苷的含量显著下降。研究表明,花青素主要存在于浆果皮下细胞的液泡中,浸渍发酵过程中花青素向果酒中的转移会受到液泡膜和细胞膜2种主要的传质阻力影响,从而降低了花青素等酚类化合物的提取率[16]。与此同时,存在于浆果和酵母细胞壁中的β-葡萄糖苷酶可以催化花色苷β-糖苷键的断裂,导致花色苷的降解[17-18]。此外,酵母细胞壁对花色苷的吸附作用也会导致花色苷含量的损失[19]。另外,相较于花青素-3-芸香糖苷,桑葚酒(干酒和利口酒)中花青素-3-葡萄糖苷含量的下降更为显著,这可能与酒精发酵过程中酵母优先利用葡萄糖而不是芸香糖有关[20]。
表4 桑葚果实、桑葚干酒和桑葚利口酒中花色苷的含量
Table 4 Content of anthocyanin in mulberry fruits, dry wine, and liqueur

化合物桑葚果实中含量/(μg/g)桑葚干酒中含量/(μg/mL)桑葚利口酒中含量/(μg/mL)花青素-3-葡萄糖苷 2 157.68±120.28a13.18±0.57b3.22±0.96b花青素-3-芸香糖苷 1 158.93±81.46a51.08±1.50b27.08±1.29b4-丙酮酸-花青素-3-葡萄糖苷ndnd1.10±0.12花葵素-3-芸香糖苷nd1.12±0.35nd总量3 316.62±200.3a65.38±2.74b31.40±2.30b
注:相同行中不同字母表示差异显著 (n=3, Duncan, P<0.05)(下同)。
2.2.2 非花色苷多酚的含量分析
如表5所示,桑葚果实中含有8种非花色苷多酚:原儿茶酸、绿原酸、4-咖啡奎尼酸、3,5-二咖啡奎尼酸、二氢槲皮素、山萘酚-六碳糖苷和槲皮素。与桑葚果实不同,桑葚干酒和桑葚利口酒中没有检测到绿原酸、4-咖啡奎尼酸、3,5-二咖啡奎尼酸和山萘酚-六碳糖苷。研究表明,在桑葚酒的酿造过程中,对桑葚浆果的机械破碎可能会增加酚类化合物(如羟基肉桂酸)被多酚氧化酶氧化的风险[21]。与此同时,来源于浆果和酵母的水解酶还会促进以糖苷形式存在的酚类化合物的水解,导致其含量的降低[22]。和桑葚果实相比,桑葚干酒和桑葚利口酒中芦丁含量显著下降,而槲皮素含量显著升高,这可能是由于在桑葚酒的酿造过程中,芦丁被水解酶水解,转化形成了槲皮素[23]。
表5 桑葚果实、桑葚干酒和桑葚利口酒中非花色苷多酚的含量
Table 5 Content of non-anthocyanidin phenolics in mulberry fruits, dry wine, and liqueur
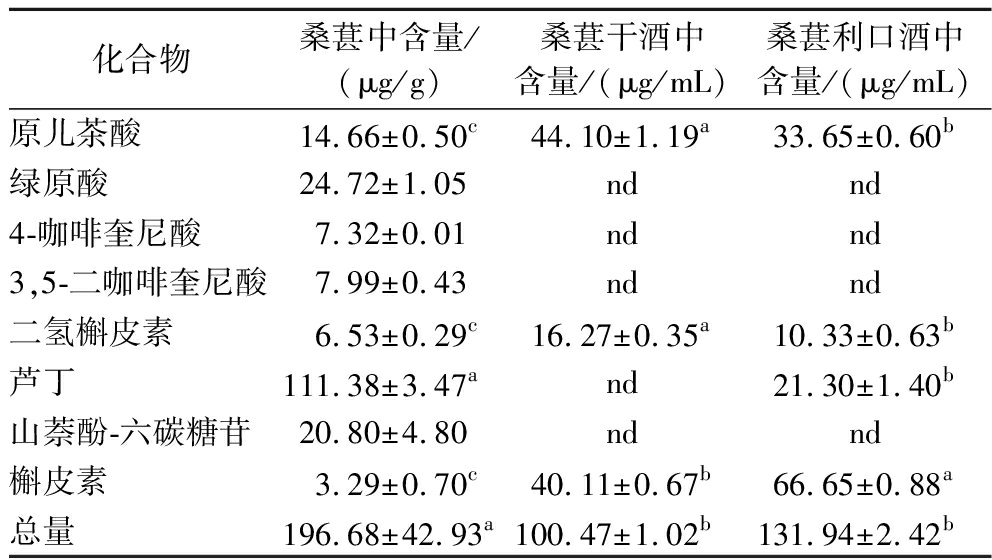
化合物桑葚中含量/(μg/g)桑葚干酒中含量/(μg/mL)桑葚利口酒中含量/(μg/mL)原儿茶酸14.66±0.50c44.10±1.19a33.65±0.60b绿原酸24.72±1.05ndnd4-咖啡奎尼酸7.32±0.01ndnd3,5-二咖啡奎尼酸7.99±0.43 ndnd二氢槲皮素6.53±0.29c16.27±0.35a10.33±0.63b芦丁111.38±3.47and21.30±1.40b山萘酚-六碳糖苷20.80±4.80 ndnd槲皮素3.29±0.70c40.11±0.67b66.65±0.88a总量196.68±42.93a100.47±1.02b131.94±2.42b
由表5可知,桑葚干酒和桑葚利口酒中原儿茶酸和二氢槲皮素的含量显著高于桑葚果实。在酒精发酵过程中,由酵母代谢产生的单宁酶、葡萄糖苷酶和纤维素酶等代谢产物可以通过分解植物细胞壁促进酚类化合物的释放,进而增加酚类化合物的含量[24]。ZOU等[25]研究了柿子在酒精发酵过程中酚类化合物的变化,发现没食子酸的含量在酒精发酵过程中增加了14.4%。
2.3 桑葚果实、桑葚干酒和桑葚利口酒DPPH自由基清除能力比较
由图3可知,桑葚果实DPPH自由基清除能力介于桑葚利口酒和桑葚干酒之间,其中桑葚利口酒DPPH自由基清除能力最高为65.69%。研究表明,抗氧化能力的差异取决于酚类化合物的含量、结构组成以及酚类化合物之间的协同作用[26]。众所周知,红葡萄酒中富含的酚类化合物是导致红葡萄酒相较于白葡萄酒和桃红葡萄酒抗氧化活性更高的原因[27]。有研究通过测定葡萄酒中酚类物质的组成和抗氧化活性发现,槲皮素等黄酮醇类化合物对DPPH自由基清除能力贡献较大。与此同时,不同结构的黄酮类化合物也会表现出抗氧化能力的差异,其中具有3′,4′-邻二羟基、C3—OH、C2![]() C3和C-4羰基结构的黄酮类化合物自由基清除能力最强[28]。此外,DPPH自由基清除能力也会受到美拉德反应的影响[29]。LERTITTIKUL等[30]通过研究猪血浆蛋白-糖模型中美拉德反应产物(Maillard reaction products,MRP)的抗氧化活性发现,DPPH自由基清除能力与MRP的含量呈正相关,桑葚利口酒中较高的糖含量可能会促进美拉德反应,从而提高DPPH自由基清除能力。
C3和C-4羰基结构的黄酮类化合物自由基清除能力最强[28]。此外,DPPH自由基清除能力也会受到美拉德反应的影响[29]。LERTITTIKUL等[30]通过研究猪血浆蛋白-糖模型中美拉德反应产物(Maillard reaction products,MRP)的抗氧化活性发现,DPPH自由基清除能力与MRP的含量呈正相关,桑葚利口酒中较高的糖含量可能会促进美拉德反应,从而提高DPPH自由基清除能力。
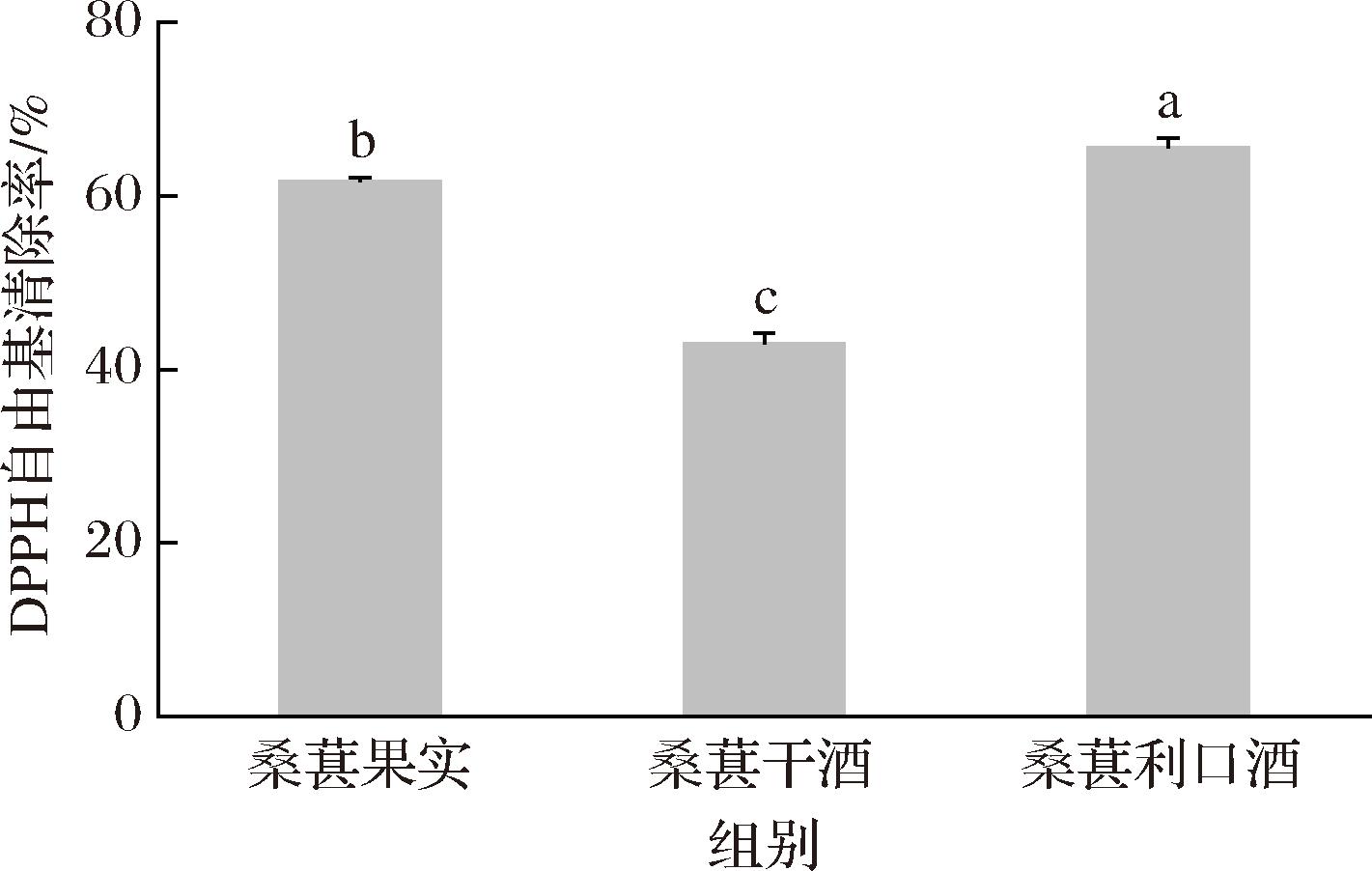
图3 桑葚果实、桑葚干酒和桑葚利口酒清除DPPH自由基能力
Fig.3 The DPPH scavenging activities of mulberry fruits, dry wine, and liqueur
3 结论
桑葚果实和桑葚果酒(干酒、利口酒)在酚类化合物的种类、含量和抗氧化能力方面存在显著差异。
花色苷方面:在桑葚浆果中鉴定出花青素-3-葡萄糖苷和花青素-3-芸香糖苷2种花色苷,而在桑葚干酒和利口酒中不仅鉴定出花青素-3-葡萄糖苷和花青素-3-芸香糖苷,还分别鉴定出花葵素-3-芸香糖苷和4-丙酮酸-花青素-3-葡萄糖苷。桑葚果实中花色苷的含量显著高于桑葚干酒和利口酒。非花色苷多酚方面:在桑葚果实中共鉴定出8种非花色苷多酚,而在桑葚干酒和桑葚利口酒中仅鉴定出其中的4种。桑葚果实中非花色苷多酚的含量显著高于桑葚干酒和利口酒。抗氧化能力方面:DPPH自由基清除能力强弱为桑葚利口酒>桑葚果实>桑葚干酒。
[1] 王娜, 范作卿, 朱琳, 等. 桑椹的化学成分及应用研究进展[J]. 现代农业科技, 2017(9):261-263; 266.
WANG N, FAN Z Q, ZHU L, et al. Research progress on chemical constituents and application of mulberry[J]. Modern Agricultural Science and Technology, 2017(9):261-263; 266.
[2] 尹爱国, 曾霞, 程水明, 等.白桑椹柠檬果酒发酵工艺研究[J].食品研究与开发, 2020, 41(8):153-159.
YIN A G, ZENG X, CHENG S M, et al.Optimization of brewing technology for white mulberry-lemon wine[J].Food Research and Development, 2020, 41(8):153-159.
[3] 彭凯雄, 郑钰涵, 陈晓明.桑葚活性成分及其现代食品开发研究进展[J].淮阴工学院学报, 2021, 30(5):9-14.
PENG K X, ZHENG Y H, CHEN X M.Research progress of mulberry active ingredients and their usage in modern food development[J].Journal of Huaiyin Institute of Technology, 2021, 30(5):9-14.
[4] 杨新, 卢红梅, 杨双全, 等.桑葚及桑葚果酒的研究进展[J].食品与发酵工业, 2019, 45(4):257-262.
YANG X, LU H M, YANG S Q, et al.Research progress on mulberry and mulberry wine[J].Food and Fermentation Industries, 2019, 45(4):257-262.
[5] 顾逸菲, 李江, 赵福权, 等.发酵型枳椇子黄酒抗氧化能力及活性成分的分析[J].食品工业科技,2022, 43(7):368-375.
GU Y F, LI J, ZHAO F Q, et al.Analysis of antioxidant capacity and active components of Huangjiu fermented with Hovenia dulcis thunb[J].Science and Technology of Food Industry, 2022, 43(7):368-375.
[6] 刘阿文. 桑葚果酒发酵工艺条件及生理活性研究[D].延吉:延边大学, 2019.
LIU A W.Study on the fermentation technology and physiological activity of mulberry wine[D].Yanji:Yanbian University, 2019.
[7] 孙佳莹, 刘娟, 王宏, 等.HPLC法对贺兰山东麓干红葡萄酒中酚类物质的测定与分析[J].中外葡萄与葡萄酒, 2017 (2):30-34;38.
SUN J Y, LIU J, WANG H, et al.Determination and analysis of phenols in dry red wine from the eastern foot of Helan mountain by HPLC[J].Sino-Overseas Grapevine &Wine, 2017 (2):30-34;38.
[8] 范昊安, 沙如意, 方晟, 等.苹果梨酵素发酵过程中的褐变与抗氧化活性[J].食品科学, 2020, 41(14):116-123.
FAN H A, SHA R Y, FANG S, et al.Browning and antioxidant activity of apple-pear jiaosu during fermentation[J].Food Science, 2020, 41(14):116-123.
[9] 孙建平. 葡萄与葡萄酒中酚类物质LC-UV-MS/MS谱库构建及应用[D]. 北京: 中国农业大学, 2006.
SUN J P. Construction and application of LC-UV-MS/MS library of phenols in grapes and wine[D].Beijing: China Agricultural University, 2006.
[10] 张波, 韩舜愈, 马腾臻, 等.红葡萄酒中花色苷衍生物结构研究进展[J].食品科学, 2018, 39(5):284-295.
ZHANG B, HAN S Y, MA T Z, et al.Progress in understanding structures of anthocyanins derivatives in red wines[J].Food Science, 2018, 39(5):284-295.
[11] TARDUGNO R, POZZEBON M, BEGGIO M, et al.Polyphenolic profile of Cichorium intybus L.endemic varieties from the Veneto region of Italy[J].Food Chemistry, 2018, 266:175-182.
[12] SAHA S, SINGH J, PAUL A, et al.Anthocyanin profiling using UV-vis spectroscopy and liquid chromatography mass spectrometry[J].Journal of AOAC International, 2020, 103(1):23-39.
[13] S NCHEZ-RABANEDA F, J
NCHEZ-RABANEDA F, J UREGUI O, CASALS I, et al.Liquid chromatographic/electrospray ionization tandem mass spectrometric study of the phenolic composition of cocoa (Theobroma cacao)[J].Journal of Mass Spectrometry.2003, 38(1):35-42.
UREGUI O, CASALS I, et al.Liquid chromatographic/electrospray ionization tandem mass spectrometric study of the phenolic composition of cocoa (Theobroma cacao)[J].Journal of Mass Spectrometry.2003, 38(1):35-42.
[14] CLIFFORD M N, KNIGHT S, KUHNERT N.Discriminating between the six isomers of dicaffeoylquinic acid by LC-MSn[J].Journal of Agricultural and Food Chemistry,2005, 53(10):3821-3832.
[15] SUN J P, LIANG F, BIN Y, et al.Screening non-colored phenolics in red wines using liquid chromatography/ultraviolet and mass spectrometry/mass spectrometry libraries[J].Molecules,2007, 12(3):679-693.
[16] JUNQUA R, CARULLO D, FERRARI G, et al.Ohmic heating for polyphenol extraction from grape berries:An innovative prefermentary process[J].OENO One, 2021, 55(3):39-51.
[17] BONCIANI T, DE VERO L, GIANNUZZI E, et al.Qualitative and quantitative screening of the β-glucosidase activity in Saccharomyces cerevisiae and Saccharomyces uvarum strains isolated from refrigerated must[J].Letters in Applied Microbiology, 2018, 67(1):72-78.
[18] 杨文君. 酿酒酵母固定化及其对桑葚果酒发酵过程中花色苷的影响研究[D].淮安:淮阴工学院, 2021.
YANG W J.Study on the immobilization of Saccharomyces cerevisiae and its effect on anthocyanins during fermentation of mulberry wine[D].Huaian:Huaiyin Institute of Technology, 2021.
[19] 苗丽平, 赵新节, 韩爱芹, 等.红葡萄酒中花色苷的影响因素[J].酿酒科技, 2016 (2):40-46.
MIAO L P, ZHAO X J, HAN A Q, et al.The main influencing factors of anthocyanins in red wine[J].Liquor-Making Science &Technology, 2016(2):40-46.
[20] 许子刚, 刘深勇.糖分对葡萄酒发酵的影响[J].食品安全导刊, 2017(30):133.
XU Z Q, LIU S Y.Effect of sugar on wine fermentation[J].China Food Safety Magazine, 2017(30):133.
[21] 李青青, 何国庆, 张艳芳.红葡萄酒酿造过程中多酚氧化酶的变化[J].科技通报, 2007, 23(5):698-701.
LI Q Q, HE G Q, ZHANG Y F.Change of polyphenoloxidase during red wine making[J].Bulletin of Science and Technology, 2007, 23(5):698-701.
[22] ZHANG P Z, MA W, MENG Y Q, et al.Wine phenolic profile altered by yeast:Mechanisms and influences[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(4):3579-3619.
[23] MINNAAR P, NYOBO L, JOLLY N, et al.Anthocyanins and polyphenols in Cabernet Franc wines produced with Saccharomyces cerevisiae and Torulaspora delbrueckii yeast strains:Spectrophotometric analysis and effect on selected sensory attributes[J].Food Chemistry, 2018, 268:287-291.
[24] HUR S J, LEE S Y, KIM Y C, et al.Effect of fermentation on the antioxidant activity in plant-based foods[J].Food Chemistry, 2014, 160:346-356.
[25] ZOU B, WU J J, YU Y S, et al.Evolution of the antioxidant capacity and phenolic contents of persimmon during fermentation[J].Food Science and Biotechnology, 2017, 26(3):563-571.
[26] SAKURAI S, KAWAKAMI Y, KUROKI M, et al.Structure-antioxidant activity (oxygen radical absorbance capacity) relationships of phenolic compounds[J].Structural Chemistry, 2022, 33(4): 1055-1062.
[27] LI H, WANG X Y, LI Y, et al.Polyphenolic compounds and antioxidant properties of selected China wines[J].Food Chemistry, 2009, 112(2):454-460.
[28] 任红, 郑少杰, 张小利, 等.基于不同抗氧化机制的黄酮类化合物构效关系研究进展[J].食品工业科技, 2016, 37(2):384-388. REN H, ZHENG S J, ZHANG X L, et al.Research progress on the structure-activity relationship of flavonoid compounds based on different antioxidant mechanism[J].Science and Technology of Food Industry, 2016, 37(2):384-388.
[29] TSAI P J, DELVA L, YU T Y, et al.Effect of sucrose on the anthocyanin and antioxidant capacity of mulberry extract during high temperature heating[J].Food Research International, 2005, 38(8-9):1059-1065.
[30] LERTITTIKUL W, BENJAKUL S, TANAKA M.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry, 2007, 100(2):669-677.