β-胡萝卜素(β-carotene)是一种萜类化合物,分子式为C40H56,化学结构如图1所示,属于脂溶性天然色素,是维生素A的前体[1]。β-胡萝卜素在生物医药、食品和化妆品等行业有着广泛的应用,在多个国家和地区批准使用,目前市场需求量较大[2],并且需求量以年增长率10%~15%快速增长[3]。获取β-胡萝卜素有3种方法,分别是植物提取法、化学合成法和生物合成法。其中,植物提取法得率低、成本高、植物生长周期长且受季节和地域限制。化学合成法具有操作复杂、产率低、有害残留多和污染环境等缺点。生物合成法因其高安全性、高稳定性和高产量等优点引起广泛关注。
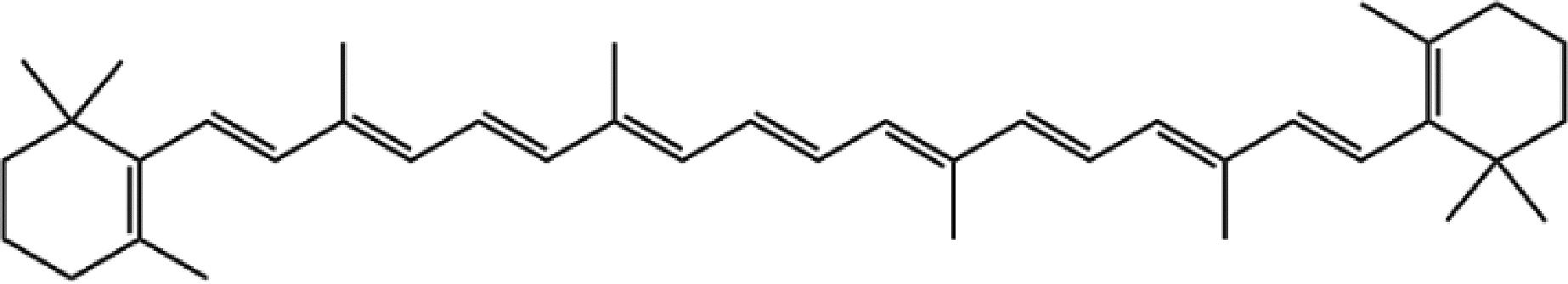
图1 β-胡萝卜素的化学结构
Fig.1 Chemical structure of β-carotene
酿酒酵母是生物学研究重要的模式微生物,成为合成很多天然化合物重要的宿主菌,它具有高安全性和耐酸性等优势,并且目前酿酒酵母有比较齐全的基因操作手段。近年来,通过对酿酒酵母的改造,完成了很多物质的高效合成,实现了科研成果的转化,创造了较高的商业价值。例如,利用酿酒酵母作为底盘细胞高效合成柠檬烯、咖啡酸和玉米黄质等。
酿酒酵母基于MVA途径合成β-胡萝卜素。乙酰辅酶A经MVA途径生成异戊二烯基焦磷酸(isopentenyl diphosphate,IPP)和二甲基丙烯焦磷酸(dimethylallylpyrophosphate,DMAPP),经法尼基二磷酸合酶(fanesyl pyrophosphate synthase,ERG20)催化生成法尼基二磷酸(farnesyldiphosphate,FPP),再经CrtE酶催化生成香叶基香叶基二磷酸酯(geranylgeranyldiphosphate,GGPP),最后经CarRA和CarB酶催化合成β-胡萝卜素[4-6]。酿酒酵母胞质乙酰辅酶A主要来源于丙酮酸脱氢酶支路,丙酮酸脱羧酶(pyruvate decarboxylase,PDC)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALD)和乙酰辅酶A合成酶(acyl coenzyme A synthetase,ACS)[7-9]参与这一过程。在酿酒酵母中,乙酰辅酶A分布在不同的细胞器中,酿酒酵母中有柠檬酸-草酰乙酸穿梭系统[10-11],可以在胞质和线粒体之间转运乙酰基,胞质ATP-柠檬酸裂解酶是这一途径的关键酶,通过强化胞内亚细胞间乙酰基转移可增加胞质乙酰基含量。同时过表达酿酒酵母自身泛酸激酶能够提高胞质辅酶A基团的合成,进而提高胞质乙酰辅酶A含量[12],乙酰辅酶A合成及柠檬酸-草酰乙酸穿梭系统如图2所示。氨基酸会影响菌体的生长及次级代谢产物的积累等,有些研究还会探究不同氨基酸对酿酒酵母代谢的影响[13]。
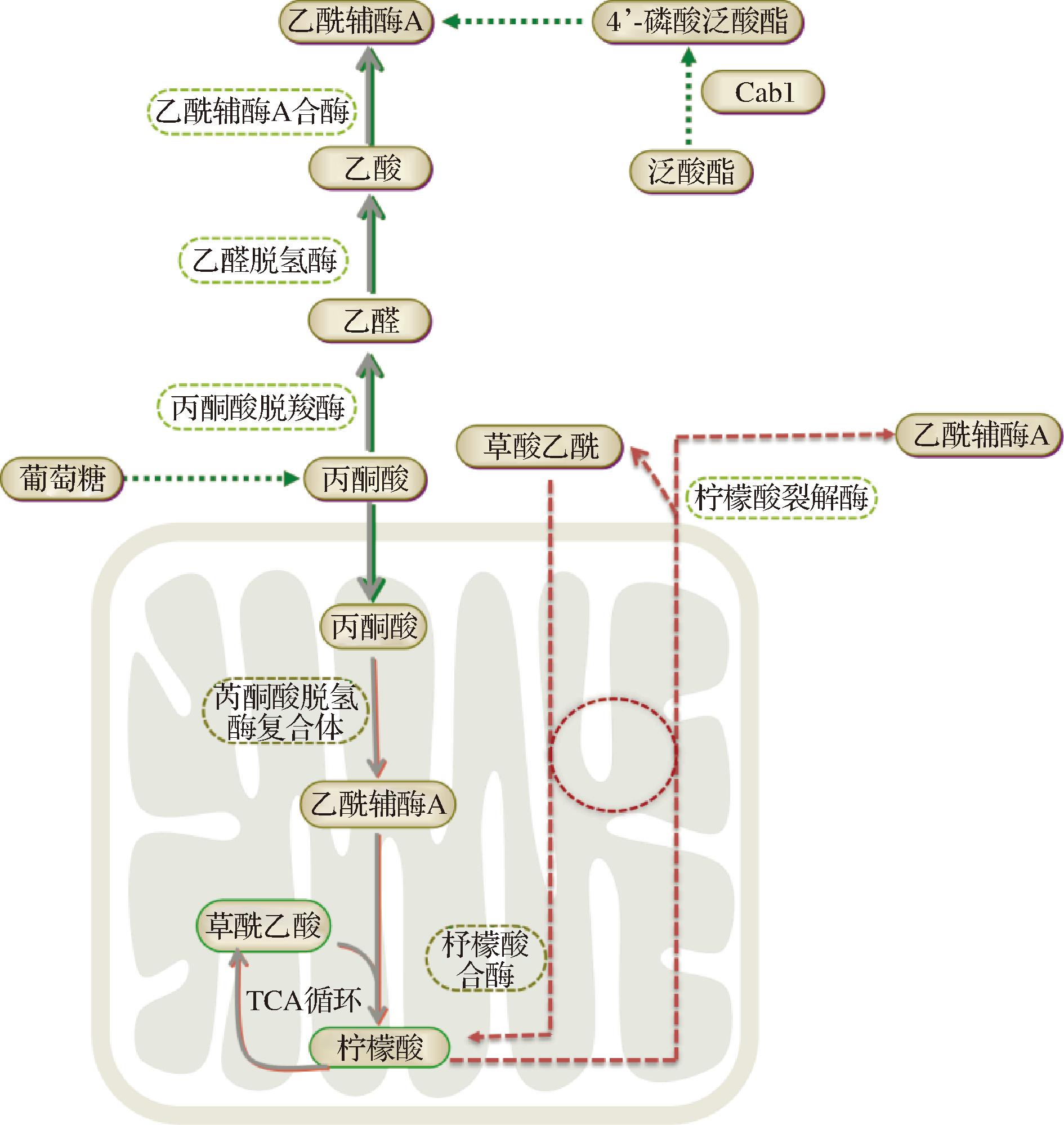
图2 酿酒酵母乙酰辅酶A合成及柠檬酸-草酰 乙酸穿梭系统
Fig.2 Synthesis of acetyl-coenzyme A and the citrate-oxaloacetate shuttle system in Saccharomyces cerevisiae
本研究室前期工作是以一株经过脂质体改造的酿酒酵母YPH499为底盘细胞[14],导入来源于三孢布拉霉(Blakeslea trispora)的β-胡萝卜素合成酶基因表达盒,同时过表达与碳代谢和脂质体合成有关的HXK1、DPP1、IPP1和FDH1基因得到菌株ZS20[15],选用酵母粉再加倍的DYPD培养基进行发酵罐发酵,β-胡萝卜素产量为526.3 mg/L。本课题通过研究柠檬酸-草酰乙酸穿梭系统的调控以及辅酶A基团的回补与调控的方式来增加胞质乙酰辅酶A含量,进而提高β-胡萝卜素产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本研究所用菌株详细信息如表1所示。
表1 本研究所用菌株
Table 1 Strains used in this study
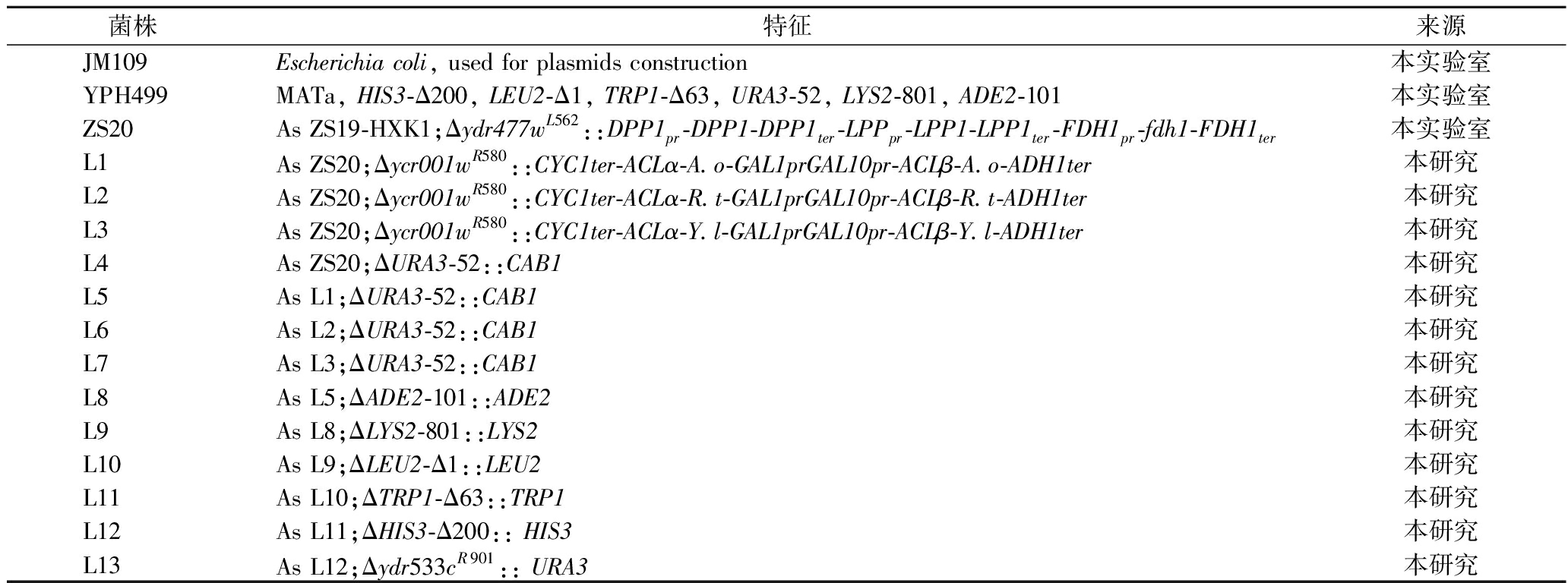
菌株特征来源JM109Escherichia coli, used for plasmids construction本实验室YPH499MATa, HIS3-Δ200, LEU2-Δ1, TRP1-Δ63, URA3-52, LYS2-801, ADE2-101本实验室ZS20 As ZS19-HXK1;Δydr477wL562::DPP1pr-DPP1-DPP1ter-LPPpr-LPP1-LPP1ter-FDH1pr-fdh1-FDH1ter本实验室L1As ZS20;Δycr001wR580::CYC1ter-ACLα-A.o-GAL1prGAL10pr-ACLβ-A.o-ADH1ter本研究L2As ZS20;Δycr001wR580::CYC1ter-ACLα-R.t-GAL1prGAL10pr-ACLβ-R.t-ADH1ter本研究L3As ZS20;Δycr001wR580::CYC1ter-ACLα-Y.l-GAL1prGAL10pr-ACLβ-Y.l-ADH1ter本研究L4As ZS20;ΔURA3-52::CAB1本研究L5As L1;ΔURA3-52::CAB1本研究L6As L2;ΔURA3-52::CAB1本研究L7As L3;ΔURA3-52::CAB1本研究L8As L5;ΔADE2-101::ADE2本研究L9As L8;ΔLYS2-801::LYS2本研究L10As L9;ΔLEU2-Δ1::LEU2本研究L11As L10;ΔTRP1-Δ63::TRP1本研究L12As L11;ΔHIS3-Δ200:: HIS3本研究L13As L12;Δydr533cR901:: URA3本研究
1.1.2 质粒
本研究所用质粒详细信息如表2所示。
表2 本研究所用质粒
Table 2 Plasmids used in this study

质粒特征来源Vector 19T(simple)ampicillin sulfate本实验室Ts-Cab1URA3pr-Cab1- URA3ter,possessing yel021whomologous arm本研究ycr001w(gRNA)single knockout plasmid carrying the PAM sequence of the gene ycr001w本研究Ts-ACL(A.oryzae)CYC1ter-ACLα-A.o-GAL1prGAL10pr-ACLβ-A.o-ADH1ter,possessing ycr001w homologous arm本研究Ts-ACL(R.toruloides)CYC1ter-ACLα-R.t-GAL1prGAL10pr-ACLβ-R.t-ADH1ter,possessing ycr001w homologous arm本研究Ts-ACL(Y.lipolytica)CYC1ter-ACLα-Y.l-GAL1prGAL10pr-ACLβ-Y.l-ADH1ter,possessing ycr001w homologous arm本研究URA3-52(gRNA)single knockout plasmid carrying the PAM sequence of the gene URA3-52本研究ADE2-101(gRNA)single knockout plasmid carrying the PAM sequence of the gene ADE2-101本研究LEU2-Δ1(gRNA)single knockout plasmid carrying the PAM sequence of the gene LEU2-Δ1本研究
续表2

质粒特征来源LYS2-801(gRNA)single knockout plasmid carrying the PAM sequence of the gene LYS2-801本研究TRP1-Δ63(gRNA)single knockout plasmid carrying the PAM sequence of the gene TRP1-Δ63本研究HIS3-Δ200 (gRNA)single knockout plasmid carrying the PAM sequence of the gene HIS3-Δ200本研究URA3 (gRNA)single knockout plasmid carrying the PAM sequence 本研究
1.1.3 引物
本研究所用引物信息如表3所示,实验所用引物均由天霖生物科技有限公司合成。
表3 本研究所用引物
Table 3 Primers used in this study

引物名序列(5′-3′)GAL1,10-F(A.oryzae)AGCGGCGCGGTGCTGCTCATTTTCAAAAATTCTTACTTTTTTTTTGGATGGACGAL1,10-R(A.oryzae)AGAATGCTTTTCGCGCTCATGTTTTTTCTCCTTGACGTTAAAGTATAGAGGAL1,10-F(R.toruloides)TTGCTGCCCGGCACATACATTTTCAAAAATTCTTACTTTTTTTTTGGATGGACGAL1,10-R(R.toruloides)GTGCGGGTCGCGCTAAACATGTTTTTTCTCCTTGACGTTAAAGTATAGAGGAL1,10-F(Y.lipolytica)TGAATGCTTTTCGCGCTCATTTTCAAAAATTCTTACTTTTTTTTTGGATGGACGAL1,10-R(Y.lipolytica)ATGTTTTCGTTCGCGCTCATGTTTTTTCTCCTTGACGTTAAAGTATAGAGACLα(A.oryzae)-FgtgacataactaattacatgAATGTTCACTTCCACGCGACLα(A.oryzae)-RAAAAGTAAGAATTTTTGAAAATGAGCAGCACCGCGACLα(R.toruloides)-FgtgacataactaattacatgCAGCAGGCCCGCCACLα(R.toruloides)-RAAAAGTAAGAATTTTTGAAAATGTATGTGCCGGGCAGACLα(Y.lipolytica)-FgtgacataactaattacatgCACGCCCAGCGGGACLα(Y.lipolytica)-RAAAAGTAAGAATTTTTGAAAATGAGCGCGAAAAGCATTCACLβ(A.oryzae)-FTAACGTCAAGGAGAAAAAACATGAGCGCGAAAAGCATTCACLβ(A.oryzae)-RcaaacctctggcgaagaattCGCGCTAAATTCTTTCACATCACLβ(R.toruloides)-FTAACGTCAAGGAGAAAAAACATGTTTAGCGCGACCCACLβ(R.toruloides)-RcaaacctctggcgaagaattTTTCACCAGTTTCAGAATCGCACLβ(Y.lipolytica)-FTAACGTCAAGGAGAAAAAACATGAGCGCGAACGAAAACACLβ(Y.lipolytica)-RcaaacctctggcgaagaattGCTGCGGGTTTTCGCL-FCGCGGATCCGCGAGGATGTGATTTATCAATATCTGCATTAAGTAATGAACTTTGCCCaaagccttcgagcgtccR-RCCGGAATTCCGGATCCTGAACAGCGATTGACTTTCTCCCATTTTTTATAGTTTTCTAgctattacgccagctgaattgCYC1(A.oryzae) -RGCCGCGTGGAAGTGAACATTcatgtaattagttatgtcacgcttacCYC1(R.toruloides) -RCGGAAGCGGCGGGCCTGCTGcatgtaattagttatgtcacgcttacCYC1(Y.lipolytica) -RCGAGCACCCCGCTGGGCGTGcatgtaattagttatgtcacgcttacADH1(A.oryzae)-FCGATGTGAAAGAATTTAGCGCGaattcttcgccagaggtttgADH1(R.toruloides)-FCGATTCTGAAACTGGTGAAAaattcttcgccagaggtttgADH1(Y.lipolytica)-FGCAAAGCGAAAACCCGCAGCaattcttcgccagaggtttggRNA(ACL)-FGTGGGAATATCCTCAGTAGAgttttagagctagaaatagcaagttaaaataaggRNA(ACL)-RTCTACTGAGGATATTCCCACgatcatttatctttcactgcggagJP(ACL)-FCCAAACATGAAAGTGCTCCJP(ACL-A.oryzae)-RGCCGCAACAACCCGJP(ACL-R.toruloides)-RGCCGCGAAATGCTGTTTJP(ACL-Y.lipolytica)-RGAGCGCGGGCTTTGJP(gRNA-ACL)-FgataatgtatgattatgctttcactcatatttatacagJP(gRNA-ACL)-R caagttgataacggactagccCAB1-FGCAGGAAACGAAGATAAATCATGCCGCGAATTACTCAAGCAB1-RTTTACTTATAATACAGTTTTCTACGTACTTGTTTTCTTAGTAGATGAATGURA3-up-arm-FGCGAGGCATATTTATGGTGAAGURA3-up-arm-RTCTTGAGTAATTCGCGGCATGATTTATCTTCGTTTCCTGCAGGURA3-down-arm-FCTAAGAAAACAAGTACGTAGAAAACTGTATTATAAGTAAATGCATGTATACTAAACTCURA3-down-arm-RCTTTACAGTCCTGTCTTATTGTTCTTGJP(CAB1)-RGCCAGAGTGCCTCCTATATCgRNA(CAB1)-FGCAGACATTACGAATGCACAgttttagagctagaaatagcaagttaaaataaggRNA(CAB1)-RTGTGCATTCGTAATGTCTGCgatcatttatctttcactgcggagCAS9-FctgctacctgcaggagatcCAS9-RgattaccaaacaggccgttcADE2-up-arm-FCTCTTGTTGCATGGCTACGADE2-up-arm-RCCTTGCTTCTTGTTACTGGATATGLYS2-up-arm-FCGCGTGTGACTCAATGTCLYS2-up-arm-RGAAGCTGCCATTAGCAGACLEU2-up-arm-FGTGAGAGCGCCGGAACLEU2-up-arm-RCCTTATCACGTTGAGCCATTAGTATCTRP1-up-arm-FCCAGATGGCAGTAGTGGAAGTRP1-up-arm-RGCCTGTGAACATTCTCTTCAACACT1(qpcr)-FACTCTCCCATAACCTCCTATATTGACTGATACT1(qpcr)-RCCGGCTTTACACATACCAGAACC
续表3

引物名序列(5′-3′)ACLqpcr(A.oryzae)-FGCCGCCTTTCTGCAGCGACLqpcr(A.oryzae)-RGCAACAGCGGCGCGACLqpcr(R.toruloides)-FGCGCAATCACGCTCTGCGACLqpcr(R.toruloides)-RGCTTTACCGGCAAACAAGCGATTCACLqpcr(Y.lipolytica)-FGCTCGCTTCGGTGCTCGACLqpcr(Y.lipolytica)-RGCGGCGGCCCGAACCAB1qpcr-FCTTGCTATTGATATAGGAGGCACTCTGGCCAB1qpcr-RGCCACCACCAGTGGCAATTATATGAGURA3-FGAAGAATAAGCCCATAAAAAAATCACGTTCATCATCTCATGGATCTURA3-RGAAAGAACGATCCTCGGCCCAAGCCTTGTCCCAA
1.1.4 试剂与培养基
Fast DigestedTM快速限制性内切酶;T4 DNA连接酶(大连Takara公司);2×Rapid Taq Master Mix、2×Phanta® Flash Master Mix(Dye Plus)、ClonExpress® Multis One Step Cloning Kit(C113)、HiScript® Ⅲ All-in-one RT SuperMix Perfect for qPCR、HiScript® Ⅲ All-in-one RT SuperMix Perfect for qPCR、FastPure® Gel DNA Extraction Mini Kit(DC301)和FastPure® Plasmid Mini Kit(DC201)(南京诺唯赞生物科技有限公司);Hieff UNICON® Universal Blue qPCR SYBR Green Master Mix(羿圣生物科技上海有限公司);RNA提取试剂盒;乙酰辅酶A ELISA试剂盒;氨苄青霉素;硫酸诺尔斯菌素;潮霉素;β-胡萝卜素标准品(HPLC≥90%,CAS#502-65-8) (上海源叶生物科技有限公司)。LB培养基:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L。YPD培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L。DYPD培养基:酵母粉20 g/L,蛋白胨40 g/L,葡萄糖20 g/L。4YPD培养基:酵母粉40 g/L,蛋白胨80 g/L,葡萄糖20 g/L。YNB培养基:酵母氮源基础培养基7 g/L,葡萄糖20 g/L,氨基酸补足液(赖氨酸100 μg/mL,亮氨酸100 μg/mL,色氨酸80 μg/mL,组氨酸30 μg/mL,尿嘧啶30 μg/mL)等。
1.2 实验方法
1.2.1 发酵实验
摇瓶发酵:将-70 ℃冰箱保藏的甘油菌在YPD平板上划线活化2~3 d后,挑取单菌落到装有15 mL酵母培养基的50 mL摇瓶中,在摇床中以30 ℃、220 r/min培养30 h,然后转接到装有50 mL酵母培养基的250 mL摇瓶中,接种量为3%,然后在摇床中培养发酵,培养条件是:30 ℃、220 r/min。
发酵罐发酵:将-70 ℃冰箱保藏的甘油菌在YPD平板上活化2~3 d后,挑取单菌落到装有75 mL酵母培养基的250 mL摇瓶中,在摇床中以30 ℃、220 r/min培养24 h作为种子液,然后转接到5 L发酵罐发酵。发酵罐装液2.5 L,接种量为3%,温度为30 ℃,搅拌转速为500 r/min,通气量为2 L/min。大约发酵15 h时溶氧降到最低,开始指数流加葡萄糖(浓度为500 g/L),流加方程为μ=0.02 h-1,F1(0)=0.003 L/h。
1.2.2 细胞干重和β-胡萝卜素产量测定
细胞干重测定:取1 mL发酵液到提前烘干并称重的EP管中,12 000 r/min 离心2 min,弃上清液,然后用ddH2O洗涤2次,弃去上清后放到70 ℃烘箱烘干至恒重,然后称量计算细胞干重。
β-胡萝卜素产量测定:用β-胡萝卜素复溶剂配制不同浓度梯度β-胡萝卜素溶液,β-胡萝卜素复溶剂作为空白对照,用酶标仪测定其在450 nm处的吸光值并制作标准曲线。取100 μL发酵液12 000 r/min离心2 min后弃上清,然后用ddH2O洗涤2次,加入适量三氯甲烷和与菌体等体积的直径为0.5 mm的玻璃珠,振荡破碎5 min,立即冰浴1 min,重复多次,然后使用冷冻离心机在4 ℃下12 000 r/min离心5 min,将含有β-胡萝卜素的萃取液转移到10 mL EP管里,重复上述操作直到萃取液无色。萃取液用氮吹仪吹干,加入2 mL β-胡萝卜素复溶剂,12 000 r/min离心1 min后,吸取上清液测定其在450 nm处的吸光值,根据β-胡萝卜素标准曲线计算得到β-胡萝卜素产量。
1.2.3 实时荧光定量PCR
摇瓶发酵30 h,取适当发酵液,使用Simply P总RNA提取试剂盒(北京博迈斯科技发展有限公司)提取总RNA,然后核酸电泳验证条带数并使用核酸定量仪测定RNA浓度。使用HiScript® Ⅲ All-in-one RT SuperMix Perfect for qPCR(南京诺唯赞生物科技有限公司)将RNA逆转录成cDNA,cDNA适当稀释5~10倍,然后使用Hieff UNICON®Universal Blue qPCR SYBR Green Master Mix(羿圣生物科技上海有限公司),选择ACT1作为内参基因进行qPCR,按照2-ΔΔCt的计算方法,从而分析目的基因的相对表达量[16]。计算方法如式(1)所示:
相对表达量=2[(A-B)-(C-D)]
(1)
式中:A为待测组目标基因平均Ct值,B为待测组内参基因平均Ct值,C为对照组目标基因平均Ct值,D为对照组内参基因平均Ct值。
2 结果与分析
2.1 柠檬酸-草酰乙酸穿梭系统的改造
乙酰辅酶A在酿酒酵母细胞器之间不能自由扩散,线粒体里的乙酰辅酶A无法自由扩散到细胞质中。酿酒酵母通过柠檬酸-草酰乙酸穿梭系统可以在线粒体和细胞质之间转运乙酰基。在线粒体中,乙酰辅酶A由丙酮酸脱氢酶复合体催化形成,然后乙酰辅酶A和草酰乙酸经柠檬酸合成酶催化生成柠檬酸,柠檬酸转运到胞质中[17]。本研究通过引入外源ATP-柠檬酸裂解酶基因,在细胞质中柠檬酸重新生成乙酰辅酶A和草酰乙酸。ATP-柠檬酸裂解酶可以来源于米曲霉(Aspergillus oryzae)、圆红冬孢酵母(Rhodosporidium toruloides)和解脂耶氏酵母(Yarrowia lipolytica),在NCBI上检索不同来源的ATP-柠檬酸裂解酶基因序列,经密码子优化后,在苏州金唯智生物科技有限公司合成,并选取GAL1prGAL10pr启动子,终止子CYC1和终止子ADH1,利用重叠延伸PCR构建以下不同来源的ATP-柠檬酸裂解酶基因表达盒,如图3-a所示。
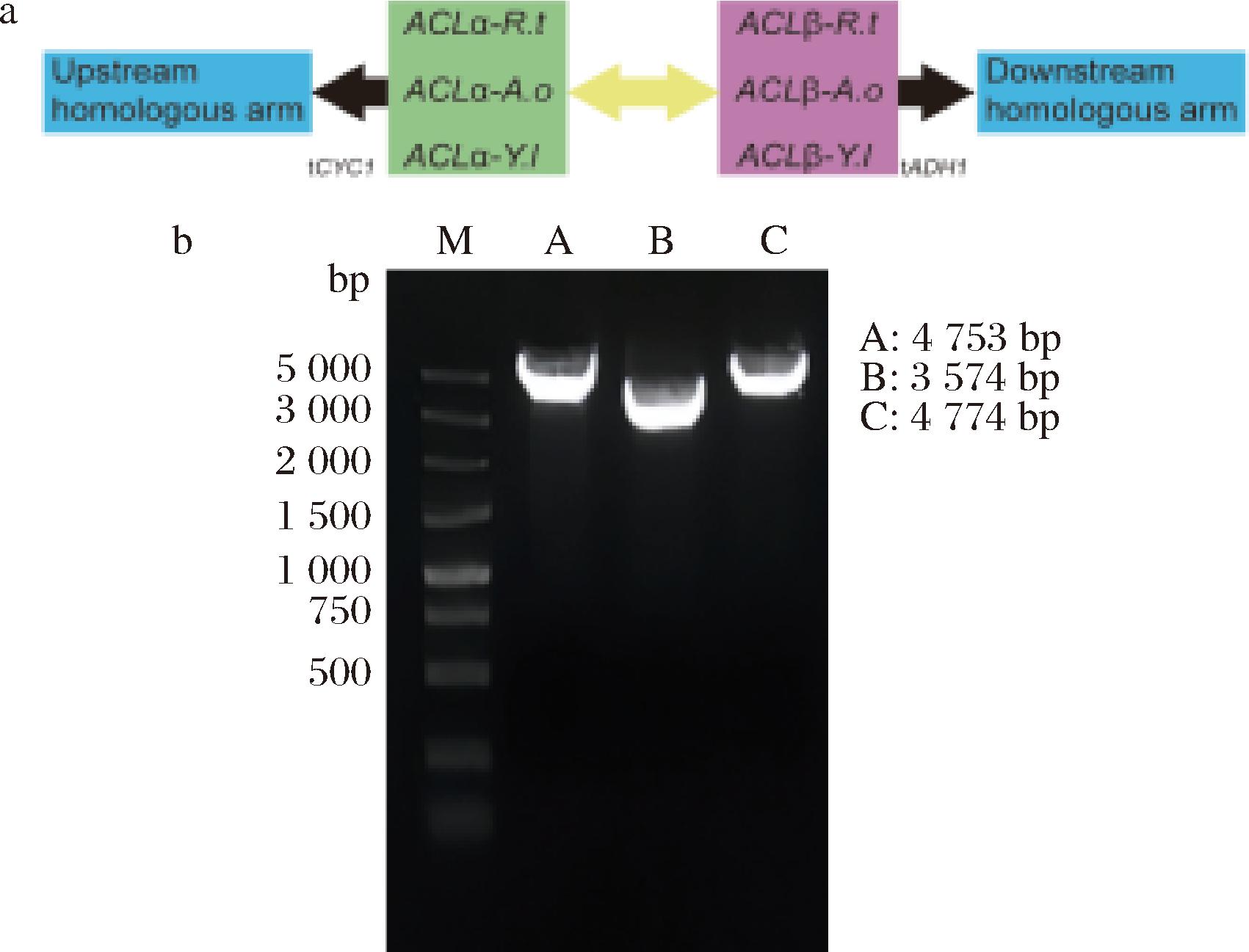
a-ATP-柠檬酸裂解酶基因表达盒;b-目的片段PCR验证结果; M-DL5000 DNA Maker (A:Aspergillus oryza; B:Rhodosporidium toruloides; C:Yarrowia lipolytica)
图3 ATP-柠檬酸裂解酶基因表达盒的构建及验证
Fig.3 Construction and verification of ATP-citrate lyase gene expression box
不同来源的ATP-柠檬酸裂解酶基因表达盒经TA克隆后分别和Vector 19T(simple) 连接构建以下质粒:Ts-ACL(A.oryzae)、Ts-ACL(R.toruloides)和Ts-ACL(Y.lipolytica)。重组质粒目的片段PCR验证结果如图3-b所示,并且测序正确。将不同来源的ATP-柠檬酸裂解酶基因表达盒利用醋酸锂转化法转化本实验室工程菌ZS20,分别得到菌株L1、L2和L3,转化平板如图4-a所示。

a-ATP-柠檬酸裂解酶基因转化平板;b-不同菌株的发酵液
图4 ATP-柠檬酸裂解酶基因的转化及摇瓶发酵
Fig.4 Transformation of ATP-citrate lyase gene and flask fermentation
在转化平板上分别挑取菌落PCR验证正确且颜色较深的单菌落到装有15 mL DYPD培养基的50 mL摇瓶中,30 ℃、220 r/min振荡培养30 h得到种子液,然后以3%接种量转接到装有50 mL DYPD的250 mL摇瓶中,30 ℃、220 r/min发酵96 h,每12 h取1次样。不同菌株摇瓶发酵发酵液颜色对比如图4-b所示,取样测定β-胡萝卜素产量和细胞干重,结果如图5所示。
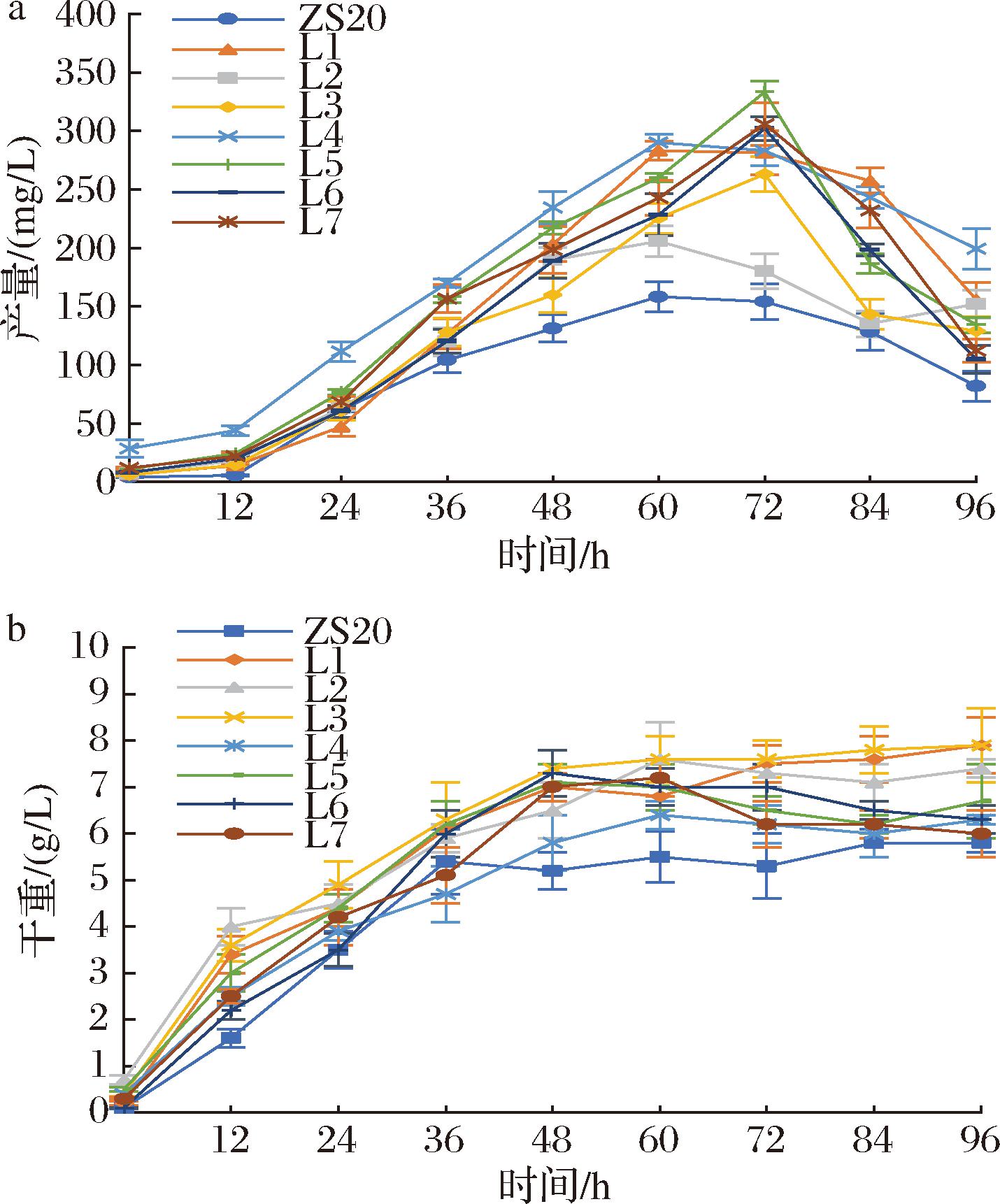
a-β-胡萝卜素产量;b-细胞干重
图5 不同菌株利用DYPD培养基的摇瓶发酵结果
Fig.5 Flask fermentation results of different strains using DYPD medium

a-CAB1基因转化平板;b-不同菌株的发酵液
图6 CAB1基因的转化及摇瓶发酵
Fig.6 Transformation of CAB1 gene and flask fermentation
菌株ZS20转化不同来源的ATP-柠檬酸裂解酶基因后摇瓶发酵,β-胡萝卜素产量和细胞干重均有所提升,其中转化米曲霉来源的ATP-柠檬酸裂解酶基因的菌株L1产量最高。菌株SZ20摇瓶发酵60 h β-胡萝卜素产量为158.4 mg/L,最高细胞干重为5.8 g/L,而菌株L1摇瓶发酵60 h达到最高产量283.2 mg/L,相比出发菌株提高约78.8%,最高细胞干重为7.9 g/L, 相比出发菌株提高约36.2%。
2.2 CAB1基因的过表达
增加胞质乙酰辅酶A的供给不仅可以从乙酰基方面探究,也可以考虑强化辅酶A基团的回补。泛酸激酶是辅酶A合成途径的重要限速酶,在酿酒酵母中,泛酸激酶由CAB1基因编码。以酿酒酵母S288C的基因组为模板,PCR扩增CAB1基因,利用重叠延伸PCR反应构建CAB1基因过表达盒。CAB1基因过表达盒经TA克隆后与Vector 19T(simple)连接构建质粒:Ts-Cab1,重组质粒目的片段PCR验证正确。将构建好的CAB1基因利用醋酸锂转化法分别转化菌株ZS20和L1,得到菌株L4和L5,转化平板如图6-a所示。
在转化平板上分别挑取单菌落到装有15 mL DYPD培养基的50 mL摇瓶中,在30 ℃、220 r/min摇床中振荡培养30 h至对数生长中期得到种子液,然后以3%接种量转接到装有50 mL DYPD的250 mL摇瓶中,30 ℃、220 r/min 摇瓶发酵96 h,每12 h取一次样。培养72 h发酵液颜色如图6-b所示。
菌株ZS20和L1分别转化CAB1基因后摇瓶发酵,β-胡萝卜素产量均有所提升,同时我们也在菌株L2和L3基础上转化了CAB1基因得到菌株L6和L7,进行了同样的摇瓶发酵实验,结果如图5所示。菌株L4摇瓶发酵60 h,产量为290.1 mg/L;菌株L5摇瓶发酵72 h,达到最高产量333.3 mg/L,菌株L6和菌株L7的β-胡萝卜素产量也有了提高。
菌株L5摇瓶发酵30 h时收集少量菌体提取mRNA,逆转录后使用荧光定量PCR仪反应系统CFX96对ATP-柠檬酸裂解酶基因和CAB1基因做荧光定量PCR验证,其中以酿酒酵母ACT1基因作为内参基因,以菌株ZS20作为对照组,按照2-ΔΔCt的计算方法,测得菌株L5的CAB1基因的平均Ct值为29.565,菌株L5的ACT1基因的平均Ct值为29.833,菌株ZS20的CAB1基因的平均Ct值为28.630,菌株ZS20的ACT1基因的平均Ct值为28.285。计算得到菌株L5相对菌株ZS20的CAB1基因的表达上调1.5倍。同样的方法得到菌株L5相对菌株ZS20的ATP-柠檬酸裂解酶基因的表达上调343.2倍,结果如表4所示。菌株L5相对出发菌株ZS20,ATP-柠檬酸裂解酶基因显著表达,CAB1基因的表达水平提高。
表4 qPCR验证转录结果
Table 4 qPCR verify transcription results

基因相对表达量调控ACL343.2±15.3上调CAB11.5±0.1上调
2.3 胞质乙酰辅酶A的测定
本研究对菌株ZS20改造前后胞质乙酰辅酶A含量的变化进行分析。将发酵样品反复冻融并使用玻璃珠振荡破碎细胞,用PBS溶液提取细胞中的乙酰辅酶A,然后使用乙酰辅酶A ELISA试剂盒(上海生工生物工程有限公司)进行检测,结果如表5所示。
表5 胞质乙酰辅酶A浓度 单位:ng/mL
Table 5 Cytoplasmic acetyl-CoA concentration
时间/hZS20L1L2L3L4L5L6L7247.4±0.311.9±0.822.2±1.64.1±0.38.5±0.55.8±0.316.0±0.96.0±0.1368.5±0.343.7±0.919.7±1.516.9±1.29.1±0.39.3±0.629.1±3.115.2±2.04818.6±0.337.5±1.856.4±2.145.7±2.125.3±1.217.3±1.023.8±1.018.8±1.1608.3±0.546.4±1.262.3±4.920.9±1,921.0±2.365.0±2.130.3±2.044.7±3.1726.0±0.420.2±1.435.7±1.146.1±2.129.3±2.025.6±1.220.6±2.045.2±3.08417.8±0.129.9±1.542.3±4.514.7±1.030.7±1.125.3±1.211.2±2.124.5±1.99613.7±0.930.2±1.117.4±0.925.0±1.019.2±0.541.9±2.215.0±0.344.2±3.1
较出发菌株ZS20,只转化ATP-柠檬酸裂解酶基因的菌株L1、L2和L3,只转化了CAB1基因的菌株L4以及同时转化了ATP-柠檬酸裂解酶基因和CAB1基因的菌株L5、L6和L7,其胞质乙酰辅酶A的含量均有所提高。乙酰辅酶A作为甲羟戊酸途径的前体化合物,其在胞质积累是提高包括β-胡萝卜素在内的萜类化合物生产必须考虑的关键因素之一,在酿酒酵母中大量合成萜类化合物首先必须保证乙酰辅酶A的供应。
2.4 氨基酸缺陷型菌株的回补
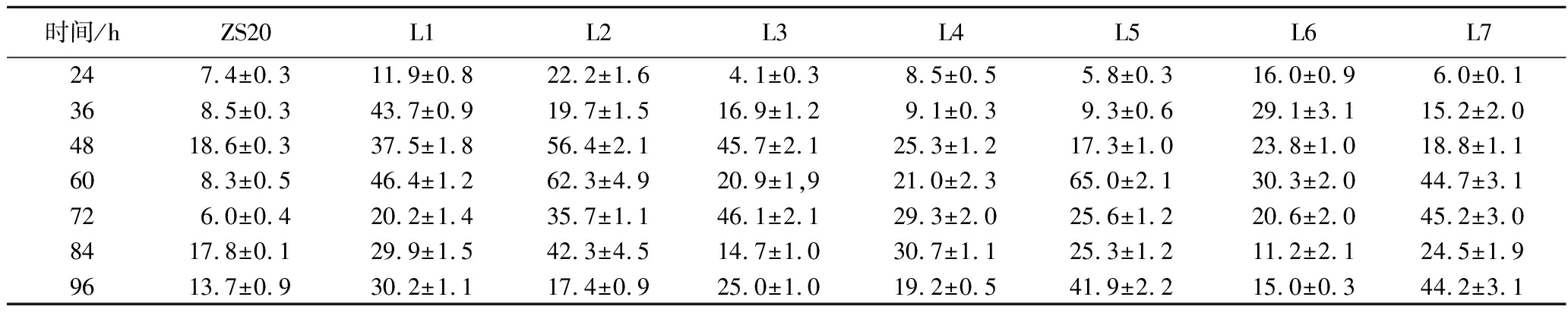
实验室出发菌株是一株多种氨基酸营养缺陷型菌株,其中编码腺嘌呤、赖氨酸、亮氨酸、色氨酸、组氨酸和尿嘧啶的基因均被破坏,使用YPD培养基不能很好满足其生长代谢需求。本研究室前期通过优化选用DYPD和4YPD培养基用于该菌株的培养发酵,细胞生长代谢和产物合成情况有所改善[18-19]。基于这一点,本研究在菌株L5基础上进行了腺嘌呤、赖氨酸、亮氨酸、组氨酸、色氨酸和尿嘧啶编辑基因的修复。以酿酒酵母S288C基因组为模板,PCR扩增ADE2、LYS2、LEU2、TRP1、HIS3和URA3基因,并构建sg质粒,利用醋酸锂转化法,转化完成后涂布YNB平板进行筛选,分别得到菌株L8、L9、L10、L11、L12和L13。利用YPD培养基进行发酵,β-胡萝卜素产量和细胞干重如图7所示。菌株L5利用YPD培养基发酵72 h β-胡萝卜素产量为121.5 mg/L,菌株L11对腺嘌呤、赖氨酸、亮氨酸和色氨酸编辑基因进行了修复,采用YPD培养基摇瓶发酵60 h β-胡萝卜素产量就达到378.1 mg/L,是菌株L5的3.1倍。菌株L12和菌株L13较菌株L11产量略有降低,可能因为YPD中的组氨酸和尿嘧啶含量已经足够菌株生长并合成产物,课题组将会进一步研究。
a-β-胡萝卜素产量;b-细胞干重
图7 不同菌株利用YPD培养基的摇瓶发酵结果
Fig.7 Flask fermentation results of different strains using YPD medium
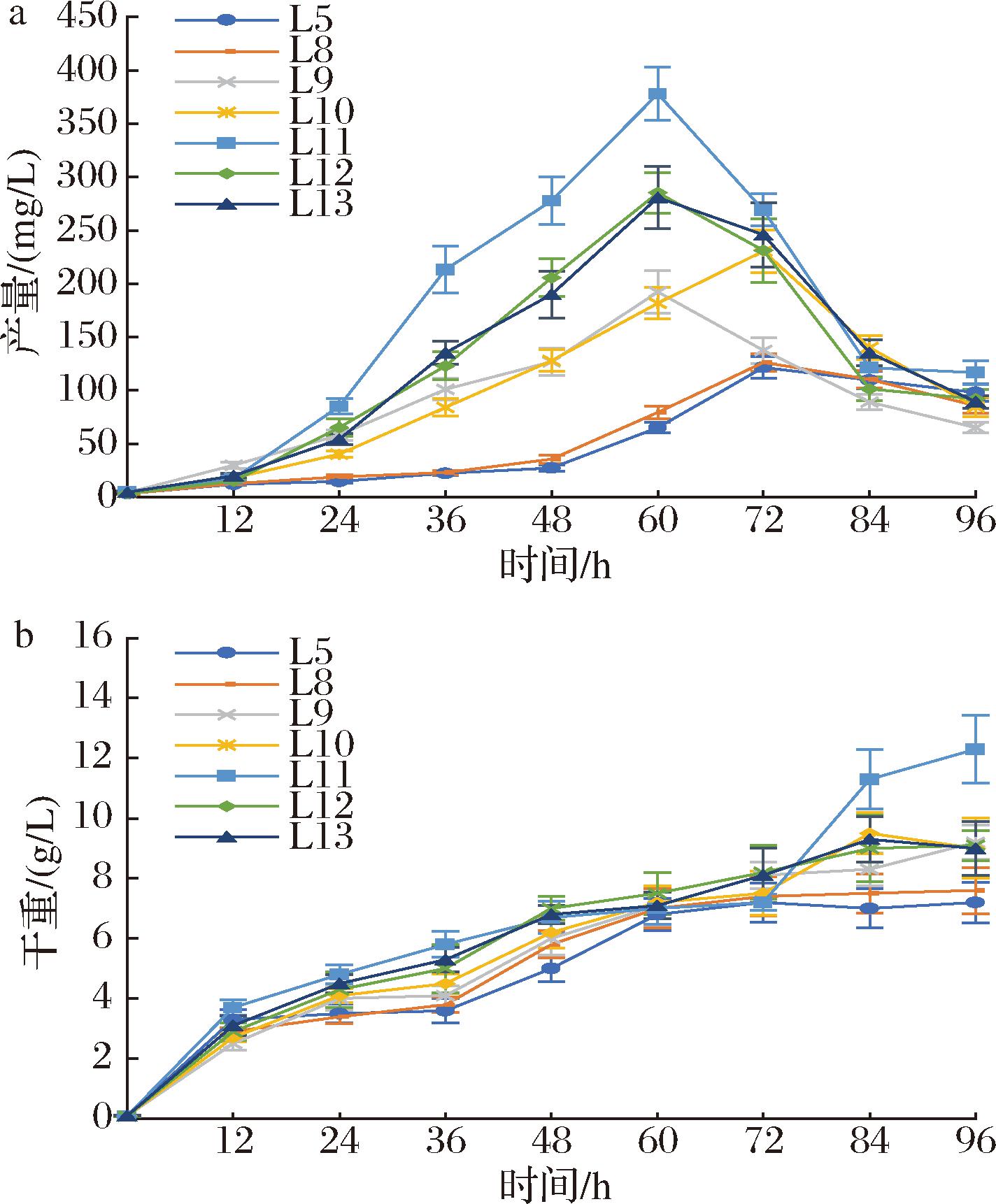
菌株L11分别选择YPD、DYPD和4YPD培养基进行摇瓶发酵,发酵条件是:30 ℃、220 r/min,β-胡萝卜素产量和细胞干重如图8所示。其中,YPD培养基发酵,β-胡萝卜素在60 h达到最高产量378.1 mg/L,DYPD培养基发酵,β-胡萝卜素在60 h达到最高产量390.2 mg/L,4YPD培养基发酵,β-胡萝卜素在60 h达到最高产量405.8 mg/L。
a-β-胡萝卜素产量;b-细胞干重
图8 菌株L11利用不同培养基的摇瓶发酵结果
Fig.8 Flask fermentation results of strain L11 using different media
2.5 发酵罐发酵培养
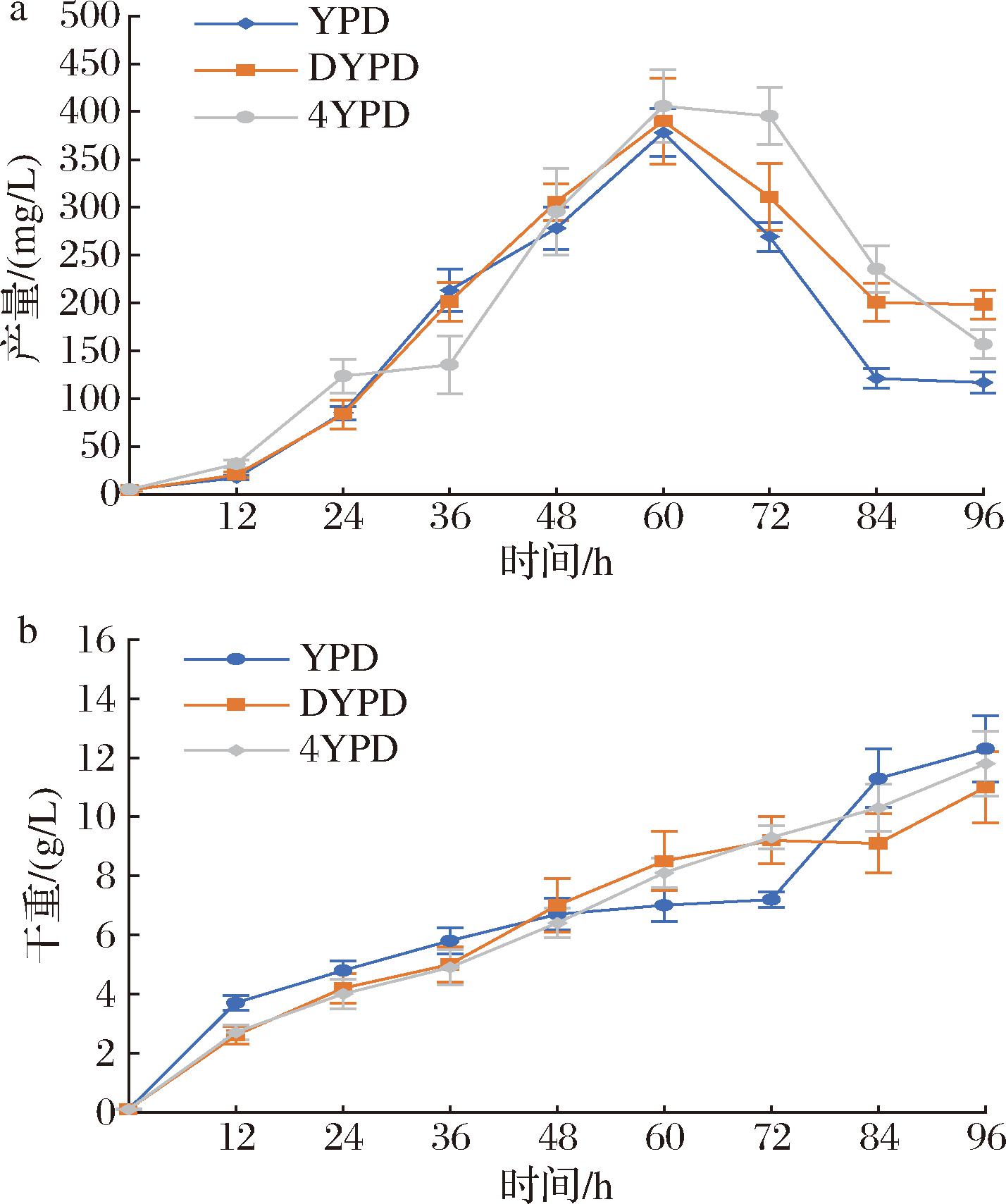
重组菌L11使用5 L发酵罐发酵培养,控制发酵温度为30 ℃,搅拌转速为500 r/min,通气量控制在2 L/min,发酵到15 h时,发酵液溶氧降到最低,开始指数流加葡萄糖进行补料,流加方程为:μ=0.02 h-1,F1(0)=0.003 L/h。为探究培养基对酿酒酵母细胞发酵的影响,分别选用3种不同培养基进行发酵培养,β-胡萝卜素产量和细胞干重如图9所示。
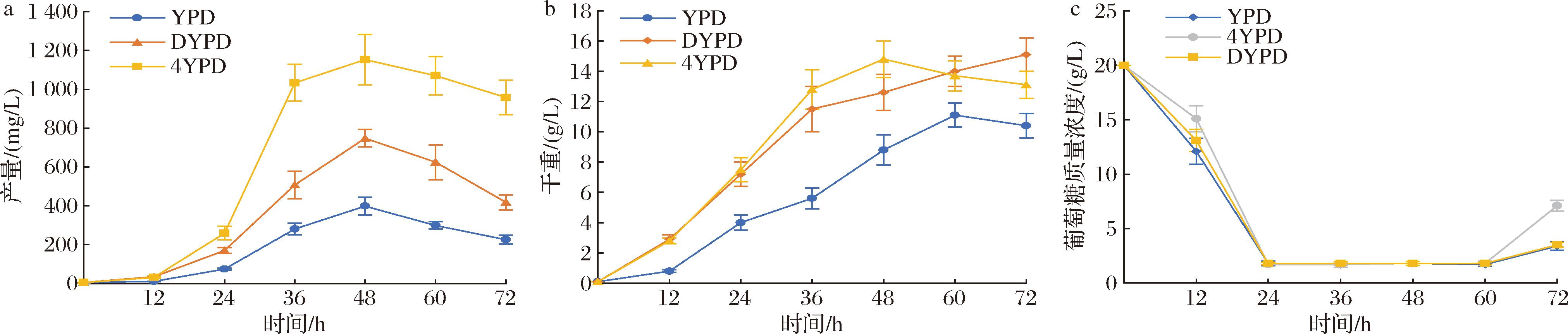
a-β-胡萝卜素产量;b-细胞干重;c-发酵液中葡萄糖浓度
图9 菌株L11利用不同培养基的发酵罐发酵结果
Fig.9 Fermenter fermentation results of strain L11 using different media
菌株L11选用不同培养基进行发酵罐发酵培养,实验室前期实验测得菌株ZS20利用酵母粉再加倍的DYPD培养基发酵,β-胡萝卜素最高产量为526.3 mg/L。而菌株L11利用YPD培养基发酵,β-胡萝卜素最高产量为398.3 mg/L;DYPD培养基发酵,β-胡萝卜素最高产量为747.8 mg/L;4YPD培养基发酵,β-胡萝卜素最高产量为1 152.7 mg/L,单位细胞产量为77.9 mg/g DCW,最高细胞干重达到14.8 g/L,产量较菌株ZS20提高了1.19倍。
发酵液初始葡萄糖质量浓度为20 g/L,按照μ=0.02 h-1,F1(0)=0.003 L/h指数流加500 g/L的葡萄糖溶液,对发酵液中的葡萄糖含量进行测定,结果如图9-c所示。高浓度葡萄糖抑制GAL启动子发挥作用,按照这种方式流加葡萄糖,在产物快速积累阶段,能够使葡萄糖浓度控制在维持细胞高速生长且不抑制GAL启动子发挥作用的水平。
3 结果与讨论
本研究以酿酒酵母为底盘细胞,导入不同来源的ATP-柠檬酸裂解酶基因以及过表达自身泛酸激酶基因,从而增加胞质乙酰辅酶A的含量,并进一步探究胞质乙酰辅酶A含量与细胞生长和产物合成之间的关系。LIAN等[20]表达了来源于解脂耶氏酵母的柠檬酸裂解酶基因,从而使产物正丁醇产量提高2倍。LIU等[21]过表达酿酒酵母自身泛酸激酶基因,使柚皮素产量提高2倍;同时提高乙酰基和辅酶A的供给,柚皮素产量较出发菌株提高24.4倍。朱文凯等[22]利用粘红酵母发酵生产β-胡萝卜素产量达到788.88 μg/L。王思懿等[23]筛选具有八氢番茄红素合成酶与番茄红素环化酶的双功能酶基因、香叶基焦磷酸合成酶基因和八氢番茄红素脱氢酶基因得到一株高产β-胡萝卜素的酿酒酵母菌株,摇瓶发酵产量达到14.53 mg/g DCW。本研究通过代谢改造以及发酵优化,β-胡萝卜素最高产量达到1 152.7 mg/L,较出发菌株提高1.19倍,单位细胞产量为77.9 mg/g DCW。
通过本研究进一步论证了乙酰辅酶A在细胞生长代谢过程中的重要作用,之后的研究会进一步改造菌株,加强胞质乙酰辅酶A的供给,可以尝试在酿酒酵母中进行肉碱穿梭系统的重构与调控,以肉碱作为载体分子转运乙酰基,进一步增加胞质乙酰辅酶A含量。同时,可继续优化发酵培养基、补料方式以及发酵条件等来提高重组菌株β-胡萝卜素的产量。
[1] 任建敏. 类胡萝卜素结构及在动植物中的功能与生理活性[J].重庆工商大学学报(自然科学版), 2021, 38(2):102-107.
REN J M.Carotenoid structure, function and physiological activity in plants and animals[J].Journal of Chongqing Technology and Business University (Natural Science Edition), 2021, 38(2):102-107.
[2] DESOBRY S A, NETTO F M, LABUZA T P.Preservation of β-carotene from carrots[J].Critical Reviews in Food Science and Nutrition, 1998, 38(5):381-396.
[3] 丁长河, 张梦涵.一株β-胡萝卜素生产菌的鉴定及其发酵工艺优化[J].中国酿造, 2019, 38(7):116-121.
DING C H, ZHANG M H.Identification and fermentation process optimization of a β-carotene producing strain[J].China Brewing, 2019, 38(7):116-121.
[4] BRÖKER J N, MÜLLER B, VAN DEENEN N, et al.Upregulating the mevalonate pathway and repressing sterol synthesis in Saccharomyces cerevisiae enhances the production of triterpenes[J].Applied Microbiology and Biotechnology, 2018, 102(16):6923-6934.
[5] LANGE N, STEINBÜCHEL A.β-Carotene production by Saccharomyces cerevisiae with regard to plasmid stability and culture media[J].Applied Microbiology and Biotechnology, 2011, 91(6):1611-1622. Ye S M, Wang S N, Ma J P, et al.Study of identifying synthetic β-carotene and natural β-carotene by fermentation[J].Food Additives in China, 2020, 31(01):76-84.
[6] ZHANG Y Y, WANG J, CAO X S, et al.High-level production of linalool by engineered Saccharomyces cerevisiae harboring dual mevalonate pathways in mitochondria and cytoplasm[J].Enzyme and Microbial Technology, 2020, 134:109462.
[7] KOCHARIN K, CHEN Y, SIEWERS V, et al.Engineering of acetyl-CoA metabolism for the improved production of polyhydroxybutyrate in Saccharomyces cerevisiae[J].AMB Express, 2012, 2(1):52.
[8] WANG D P, WANG L, HOU L, et al.Metabolic engineering of Saccharomyces cerevisiae for accumulating pyruvic acid[J].Annals of Microbiology, 2015, 65(4):2323-2331.
[9] ZHONG W, YANG M H, HAO X M, et al.Improvement of d-lactic acid productivity by introducing Escherichia coli acetyl-CoA synthesis pathway in engineered Saccharomyces cerevisiae[J].Journal of Chemical Technology and Biotechnology, 2021, 96(9):2509-2519.
[10] KIM D H, KIM I J, YUN E J, et al.Metabolic engineering of Saccharomyces cerevisiae by using the CRISPR-Cas9 system for enhanced fatty acid production[J].Process Biochemistry, 2018, 73:23-28.
[11] RODRIGUEZ S, DENBY C M, VAN VU T, et al.ATP citrate lyase mediated cytosolic acetyl-CoA biosynthesis increases mevalonate production in Saccharomyces cerevisiae[J].Microbial Cell Factories, 2016, 15(1):48.
[12] HONG K Q, FU X M, DONG S S, et al.Modulating acetate ester and higher alcohol production in Saccharomyces cerevisiae through the cofactor engineering[J].Journal of Industrial Microbiology &Biotechnology, 2019, 46(7):1003-1011.
[13] 成婷, 邢爽, 刘治国, 等.关键氨基酸对酿酒酵母高级醇代谢的影响[J].食品与发酵工业.DOI:10.13995/j.cnki.11-1802/ts.037418.
CHENG T, XING S, LIU Z G, et al.Effects of key amino acids on metabolism of higher alcohols in Saccharomyces cerevisiae[J].Food and Fermentation Industries. DOI:10.13995/j.cnki.11-1802/ts.037418.
[14] 李方迪, 李由然, 张梁, 等.代谢改造酿酒酵母生产番茄红素[J].食品与发酵工业, 2022, 48(23):25-33.
LI F D, LI Y R, ZHANG L, et al.Metabolic engineering of Saccharomyces cerevisiae for lycopene production[J].Food and Fermentation Industry, 2022, 48(23):25-33.
[15] 周颂, 李由然, 张梁, 等.代谢工程改造酿酒酵母合成β-胡萝卜素[J].食品与发酵工业, 2024, 50(3):1-8.
ZHOU S, LI Y R, ZHANG L, et al.Synthesis of β-carotene from Saccharomyces cerevisiae by metabolic engineering[J].Food and Fermentation Industry, 2024, 50(3):1-8.
[16] 刘翔, 李由然, 张梁, 等.地衣芽孢杆菌中木糖操纵子受葡萄糖胁迫的转录调控特性[J].应用与环境生物学报, 2019, 25(3):695-701.
LIU X, LI Y R, ZHANG L, et al.The transcriptional regulation characteristics of xylose-inducible promoter in Bacillus licheniformis[J].Chinese Journal of Applied and Environmental Biology, 2019, 25(3):695-701.
[17] 王招悬, 刘营航, 刘萌萌, 等.酵母中乙酰辅酶A的代谢工程研究进展[J].生物加工过程, 2023, 21(6):599-607.
WANG Z X, LIU Y H, LIU M M, et al.Advance in metabolic engineering of acetyl-CoA in yeast[J].Chinese Journal of Bioprocess Engineering, 2023, 21(6):599-607.
[18] 李方迪. 代谢改造酿酒酵母生产番茄红素[D].无锡:江南大学, 2022.
LI F D.Metabolic engineering of Saccharomyces cerevisiae for lycopene production[D].Wuxi:Jiangnan University, 2022.
[19] 周颂. 代谢工程改造酿酒酵母合成β-胡萝卜素[D].无锡:江南大学, 2023.
ZHOU S.Synthesis of β-carotene from Saccharomyces cerevisiae by metabolic engineering[D].Wuxi:Jiangnan University, 2023.
[20] LIAN J Z, SI T, NAIR N U, et al.Design and construction of acetyl-CoA overproducing Saccharomyces cerevisiae strains[J].Metabolic Engineering, 2014, 24:139-149.
[21] LIU W S, ZHANG B, JIANG R R.Improving acetyl-CoA biosynthesis in Saccharomyces cerevisiae via the overexpression of pantothenate kinase and PDH bypass[J].Biotechnology for Biofuels, 2017, 10(1):41.
[22] 朱闻凯, 李安军, 何宏魁, 等.粘红酵母产β-胡萝卜素的发酵条件优化及包埋工艺研究[J].中央民族大学学报(自然科学版), 2023, 32(04):52-59.
ZHU W K, LI A J, HE H K, et al.Optimization of fermentation conditions for β-carotene yield by using Rhodotorula mucilaginosa and embedding process of β-carotene[J].Journal of Minzu University of China (Natural Sciences Edition), 2023, 32(4):52-59.
[23] 王思懿, 张悦, 王燕燕, 等.酿酒酵母中高效积累β-胡萝卜素的代谢途径构建[J].微生物学杂志, 2023, 43(4):10-17.
WANG S Y, ZHANG Y, WANG Y Y, et al.Metabolic pathway construction of β-carotene accumulation in Saccharomyces cerevisiae[J].Chinese Journal of Microbiology, 2023, 43(4):10-17.