荔枝(Litch chinensis Soon.)是我国南方特色经济水果,富含氨基酸、多糖、维生素、多酚类等营养物质,口味甘甜,可补脾益肝、止咳养心,具有较高的保健功效和市场价值[1]。我国是全球荔枝原产地与第一主产国,种植历史悠久,种植面积和年产量均位于全世界第一位[2]。荔枝生长喜高温高湿环境,主产区分布在广东、广西、海南等地[3]。高纬度的湿热环境使荔枝易受多种病虫危害,导致荔枝品质、产量和经济效益受到严重影响。截至目前,荔枝生产中防治病虫害的主要手段仍为化学农药[4]。但是农药的大量使用对荔枝果品造成了残留污染,不仅影响荔枝产品质量安全,也加剧环境风险。为控制农产品中过量农药残留以保障食用者的安全,世界各国和组织制定了农产品中农药最大残留限量值。然而,荔枝属于用药短缺特色小宗作物,仅有少部分农药在荔枝上登记使用,荔枝上登记农药有效成分仅56种(涵盖杀虫剂、杀菌剂、除草剂和植物生长调节剂)[5],但荔枝上虫害种类有80余种、病害20余种,远远不能满足实际生产需要,导致荔枝生产中部分农药的使用参数只能参照其他作物[6],这增加了荔枝果品中农药残留情况的复杂性。为保证荔枝产业发展及食品安全,建立可靠的、高灵敏度的、可用于荔枝多种农药残留同时检测的分析方法具有重要意义。
荔枝生产中常用农药主要有吡虫啉等新烟碱类、苯醚甲环唑等三唑类、嘧菌酯等甲氧基丙烯酸酯类以及三唑磷等有机磷类化合物等。目前新烟碱类农药的主要检测方法有高效液相色谱法(HPLC)和液相色谱-串联质谱法(LC-MS/MS),水果中的提取和净化处理方法主要包括溶剂萃取、QuEChERS 净化、固相萃取净化(solid phase extraction, SPE)、分散固相萃取净化(dispersive solid phase extraction, dSPE)法等[7-9];三唑类农药与甲氧基丙烯酸酯类农药的主要检测方法有气相色谱-串联质谱法(GC-MS)和高效液相色谱-串联质谱法(HPLC-MS/MS),前处理方法主要有固相萃取小柱净化、QuEChERS方法等[10-13];有机磷农药的主要检测方法有GC-MS和LC-MS/MS,样品的前处理方法主要有磁性固相萃取净化法等[14-17]。GC和HPLC-MS/MS均具有快速、灵敏度高、应用范围广、特异性好等优点,运用GC-MS和LC-MS/MS 建立分析方法已成为农药残留研究的热点。QuEChERS法具有萃取过程简单、耗时少、有机溶剂用量少、回收率高等优点,可选择不同的吸附剂种类来净化不同的干扰杂质,其在水果和蔬菜基质中的净化效果十分突出,是目前广泛应用的前处理方法[18-19]。使用QuEChERS结合GC-MS或HPLC-MS/MS已成为最通用的检测技术模式,目前已成功分离检测数百种农药[20]。KUANG等[20]、李海等[21]采用了QuEChERS结合超高效液相色谱-串联质谱(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS /MS)和GC技术对不同产区采集的荔枝样品进行农药的残留检测,均不同程度检测出了有机磷类、拟除虫菊酯类、咪唑类等农药残留。UPLC-MS/MS可对单一母离子或子离子进行筛选,选择性较高,能区分同一碎片子离子的不同母离子归属,适宜多组分的同系物测定,在优化方法的过程中只需要挑选响应较高的母离子即可,对色谱分离要求较低。高效液相色谱-四极杆-飞行时间质谱(high-performance liquid chromatography-tandem quadrupole-time of flight-mass spectrometry, HPLC-Q-TOF/MS)技术将四极杆和飞行管2种不同的质量分析器串联到一起,属于高分辨类质谱,因为能检测到精确质量,定性能力比UPLC-MS/MS等四极杆类质谱更强,并且HPLC-Q-TOF/MS具有快速的扫描能力,一般可以一次进样检测几百个化合物,实现高通量检测。
随着产业发展和生活水平提高,消费者对农产品质量安全的要求也日益提升。目前食品安全问题受到消费者的广泛关注,各国及组织将农产品上的农药最大残留限量标准值逐步降低,因此建立高效和灵敏的检测方法同时测定农产品中多种农药含量的方法显得尤为紧迫[18],但目前有关荔枝上农药多残留分析方法的报道较少。鉴于此,本文应用优化的QuEChERS前处理方法,结合HPLC-Q-TOF/MS技术,建立新烟碱类、三唑类、甲氧基丙酸酯类、有机磷类农药等29种农药在荔枝基质中多残留分析方法,以期为保证荔枝果品质量安全、农药残留标准制定及荔枝安全监管提供技术支撑。
1 材料与方法
1.1 材料与试剂
29种农药标准品的纯度均在98%以上,生产厂家主要为Dr.Ehrenstorfer GmbH和Chem Service公司;乙腈(色谱纯),美国Sigma Aldrich公司;氯化钠、无水硫酸镁、柠檬酸钠、柠檬酸二钠(分析纯),广州化学试剂厂;N-丙基乙二胺吸附剂(primary secondary amine,PSA)、石墨化碳黑吸附剂(graphitized carbon black,GCB),上海安谱实验科技股份有限公司;实验用水为二次蒸馏水。
1.2 仪器与设备
AB5600+四极杆-飞行时间质谱仪,美国SCIEX公司;LC-30AD液相色谱系统、SHANGPING FA2004分析天平、SHIMADZU TXB622L电子天平,日本岛津公司;GTR22-1离心机,北京时代北利离心机有限公司;XW-80A涡旋仪,上海精科有限公司;ULTRA-TURRAXT 25匀浆机,德国IKA公司。
1.3 标准溶液配制
标准储备液:分别准确称取适量29种农药标准品,用乙腈配制成1 000 mg/L的标准储备液,于4 ℃避光保存,待用。
混合标准溶液:分别准确吸取1 mL 29种农药标准品的标准储备液于10 mL容量瓶中,用乙腈溶液定容至10 mL,配制100 mg/L混合标准溶液。
1.4 基质匹配标准溶液配制
通过乙腈溶解制备29种农药标准储备液,稀释荔枝全果的空白提取液,从而制备出不同质量浓度的基质匹配标准液(0.20、0.10、0.020、0.010、0.002、0.001 mg/L),参考1.6节所示仪器条件实施测定。得到29种农药溶剂和基质匹配标准溶液的线性回归方程。
基质效应计算如公式(1)所示:
基质效应![]()
(1)
1.5 样品前处理
准确称取荔枝全果或果肉样品10.0 g(精确至0.01 g),分别置于50 mL离心管中,加入10 mL乙腈、4 g无水MgSO4、1 g NaCl、1 g柠檬酸钠、0.5 g柠檬酸二钠,剧烈振荡,涡旋1 min,然后以5 000 r/min离心2 min。取4 mL乙腈层溶液,置于加有0.6 g无水MgSO4、0.10 g PSA和0.3 g GCB的离心管中,剧烈振荡后,涡旋10 s,再以10 000 r/min离心2 min。取上清液,过0.22 μm有机滤膜,待仪器测定。
1.6 仪器条件
1.6.1 色谱条件
Waters BEH-C18色谱分离柱(100 cm×4.6 mm,2.5 μm);流动相A为0.1%甲酸-水溶液(含5 mmol/L甲酸铵),流动相B为乙腈,流速0.5 mL/min;色谱柱柱温:40 ℃;样品进样量:10 μL。
正离子模式洗脱方式:梯度洗脱;洗脱程序:0~1 min:80% A;1~7 min:80%~5% A;7~11 min:5% A;11~12 min:5%~80% A;12~15 min:80% A。
负离子模式洗脱方式:等度洗脱(VA∶VB=40∶60)。
1.6.2 质谱条件
采用电喷雾电离源ESI进行测定和大气压化学电离源进行校正,扫描方式:正/负离子模式;一级(TOF)扫描质量范围:50~1 500 Da;二级(Product ion)扫描准确质量范围:50~1500 Da;正/负离子模式校正液流速:0.5 mL/min;测定过程中设置每5个样品自动校正1次,保持目标物精准质量数在稳定范围内;气帘气(N2):30psi;雾化气(N2):50psi;加热辅助气(N2):50psi;离子源温度为:负离子模式450 ℃,正离子模式550 ℃;锥孔电压:负离子模式-4 500 V,正离子模式5 500 V;去簇电压:负离子模式-90 V,正离子模式90 V;碰撞能量:负离子模式(-45±25) eV,正离子模式(45±25) eV;监测模式:TOF-IDA-MS。
1.7 数据分析方法
所有质谱数据在AB sciex公司的Analyst TF 1.6 软件采集,数据在 Peak View 2.0, Master View 2.0 和Multi Quant 3.0等软件上进行定性和定量数据处理分析。根据TOF-MS和IDA-MS高分辨质谱获得化合物的精确分子质量,分析29种农药。
2 结果与分析
2.1 定性定量分析依据
采用HPLC-Q-TOF/MS方法检测29种农药(上样质量浓度为0.01 mg/L),以农药的母离子精确质量数、母离子同位素丰度比、二级碎片离子的精确质量数和丰度比以及色谱保留时间作为定性和定量分析依据,29种农药的母离子精确质量及测量精度见表1。在一级质谱的模式下,采用保留时间和分子离子的精确质量数对29种农药进行初步定性分析;实际测得的29种农药的分子离子质量数与理论质量数的误差为-8.8~1 mg/L(表1),标准品的提取离子流色谱图见图1。

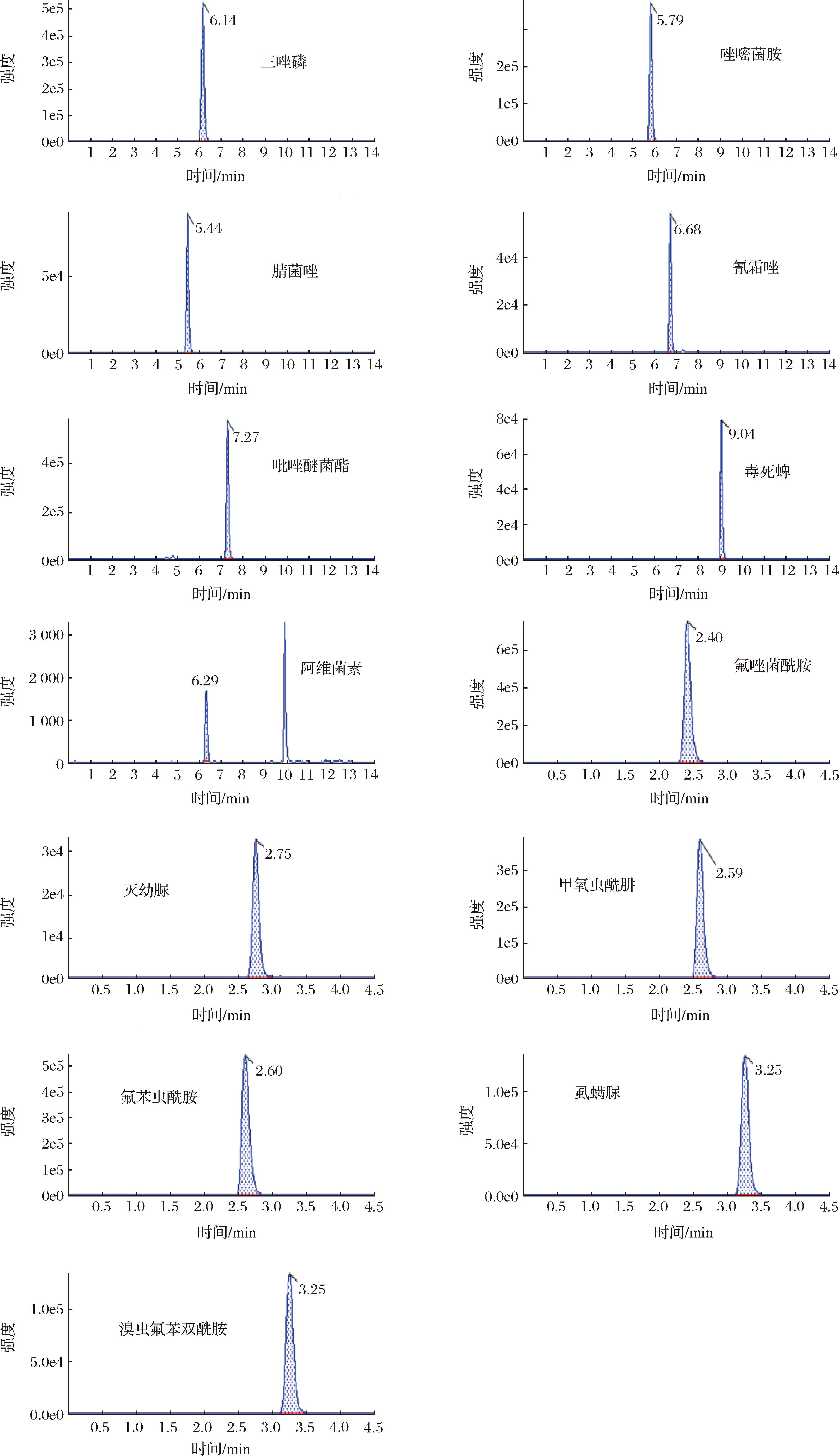
图1 29种农药标准品的提取离子流色谱图
Fig.1 Extraction ion chromatograms of 29 pesticide standards
表1 29种农药定性定量分析质谱数据
Table 1 Mass spectrometric parameters for qualitative and quantitative analysis of 29 pesticides
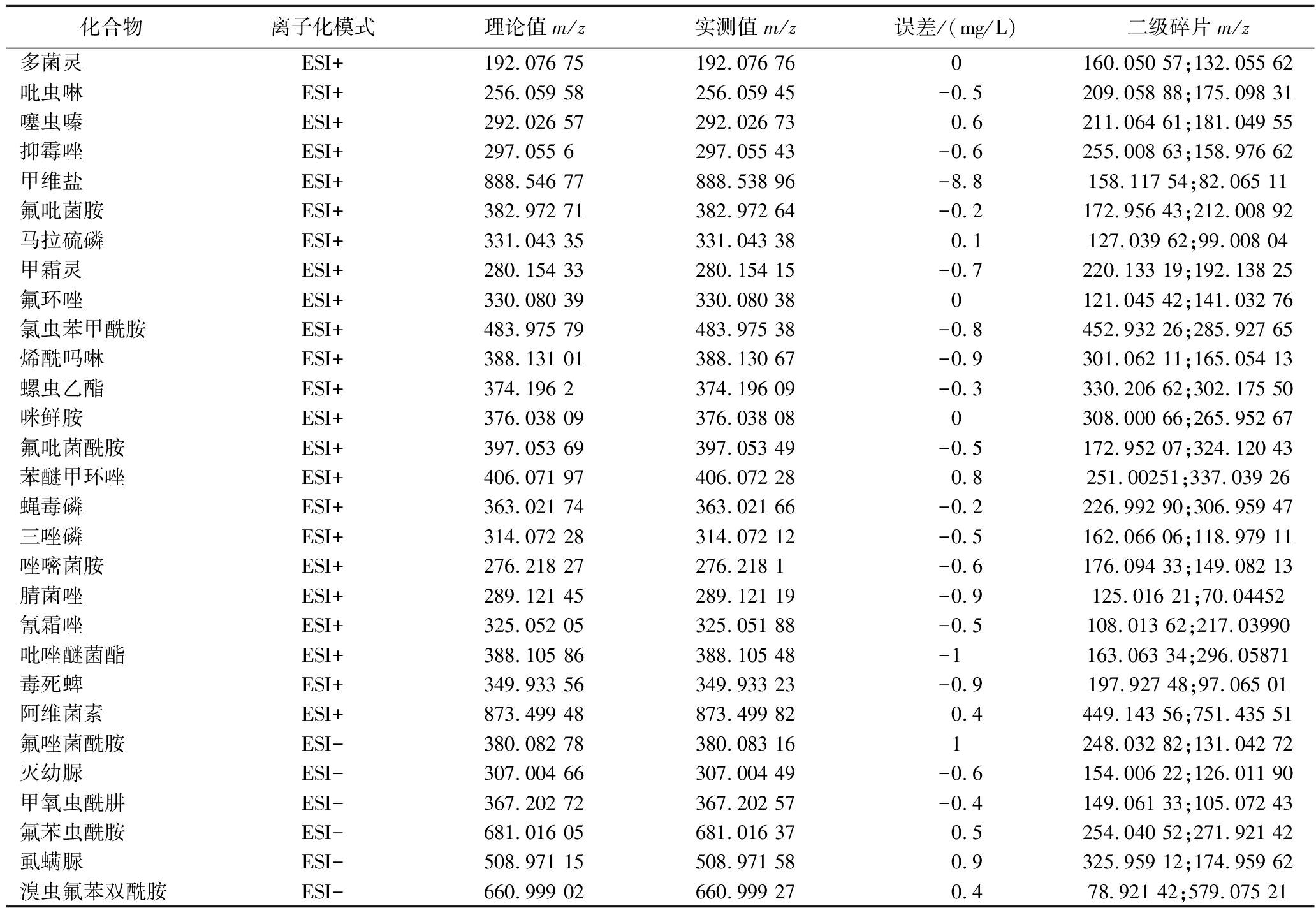
化合物离子化模式理论值m/z实测值m/z误差/(mg/L)二级碎片m/z多菌灵ESI+192.076 75192.076 760160.050 57;132.055 62吡虫啉ESI+256.059 58256.059 45-0.5209.058 88;175.098 31噻虫嗪ESI+292.026 57292.026 730.6211.064 61;181.049 55抑霉唑ESI+297.055 6297.055 43-0.6255.008 63;158.976 62甲维盐ESI+888.546 77888.538 96-8.8158.117 54;82.065 11氟吡菌胺ESI+382.972 71382.972 64-0.2172.956 43;212.008 92马拉硫磷ESI+331.043 35331.043 380.1127.039 62;99.008 04甲霜灵ESI+280.154 33280.154 15-0.7220.133 19;192.138 25氟环唑ESI+330.080 39330.080 380121.045 42;141.032 76氯虫苯甲酰胺ESI+483.975 79483.975 38-0.8452.932 26;285.927 65烯酰吗啉ESI+388.131 01388.130 67-0.9301.062 11;165.054 13螺虫乙酯ESI+374.196 2374.196 09-0.3330.206 62;302.175 50咪鲜胺ESI+376.038 09376.038 080308.000 66;265.952 67氟吡菌酰胺ESI+397.053 69397.053 49-0.5172.952 07;324.120 43苯醚甲环唑ESI+406.071 97406.072 280.8251.00251;337.039 26蝇毒磷ESI+363.021 74363.021 66-0.2226.992 90;306.959 47三唑磷ESI+314.072 28314.072 12-0.5162.066 06;118.979 11唑嘧菌胺ESI+276.218 27276.218 1-0.6176.094 33;149.082 13腈菌唑ESI+289.121 45289.121 19-0.9125.016 21;70.04452氰霜唑ESI+325.052 05325.051 88-0.5108.013 62;217.03990吡唑醚菌酯ESI+388.105 86388.105 48-1163.063 34;296.05871毒死蜱ESI+349.933 56349.933 23-0.9197.927 48;97.065 01阿维菌素ESI+873.499 48873.499 820.4449.143 56;751.435 51氟唑菌酰胺ESI-380.082 78380.083 161248.032 82;131.042 72灭幼脲ESI-307.004 66307.004 49-0.6154.006 22;126.011 90甲氧虫酰肼ESI-367.202 72367.202 57-0.4149.061 33;105.072 43氟苯虫酰胺ESI-681.016 05681.016 370.5254.040 52;271.921 42虱螨脲ESI-508.971 15508.971 580.9325.959 12;174.959 62溴虫氟苯双酰胺ESI-660.999 02660.999 270.478.921 42;579.075 21
2.2 提取条件优化
对比了5种不同提取溶剂对29种目标农药的提取效率影响,结果表明(图2),当选用乙腈作为提取溶剂时,29种农药的回收率均为70%~120%,符合农药残留检测分析要求。
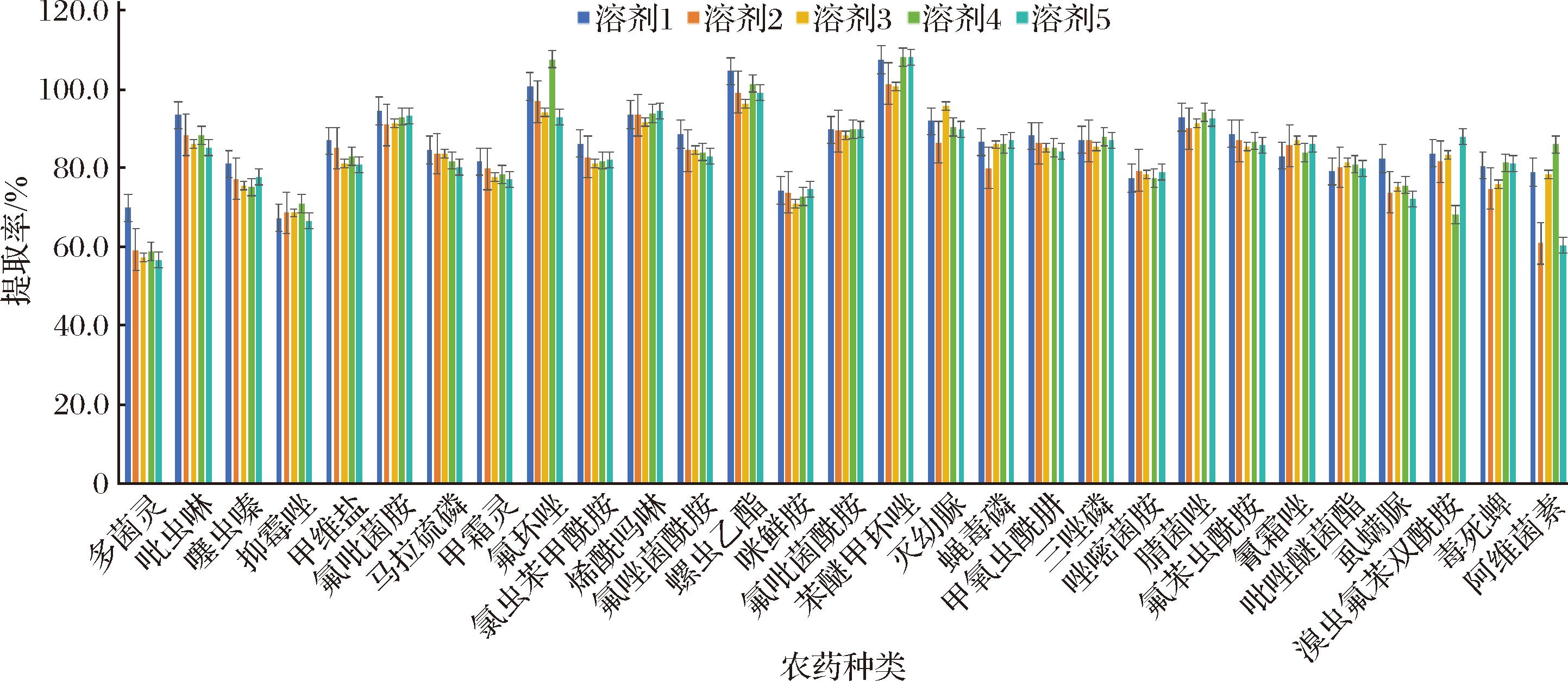
图2 五种不同提取溶剂对29种农药提取效率的影响
Fig.2 Effect of five different extraction solvents on the extraction efficiency of 29 pesticides
当选用乙腈作为提取溶剂后,考察了萃取盐包的选择和用量对29种农药回收率的影响。无水MgSO4具有吸收样品水分的作用,可显著提高农药萃取回收率,NaCl、柠檬酸钠和柠檬酸二钠均具有盐析作用,对农药萃取回收率的提高具有促进作用。当选择4 g无水MgSO4、1 g NaCl、1 g 柠檬酸钠、0.5 g柠檬酸二钠作为萃取盐包时,29种农药的回收率满足要求,具体见图3。

图3 三种不同萃取盐包对29种农药回收率影响
Fig.3 Effect of three extraction salt package on the extraction efficiency of 29 pesticides
注:溶剂1为乙腈;溶剂2 为0.1%甲酸-乙腈;溶剂3为0.1%乙酸-乙腈;溶剂4为0.5%甲酸-乙腈;溶剂5为0.5%乙酸-乙腈。
注:萃取盐包1为4 g无水MgSO4、1 g NaCl、1 g柠檬酸钠、0.5 g柠檬酸二钠;萃取盐包2为4 g无水MgSO4和1 g NaCl; 萃取盐包3为6 g无水MgSO4和1 g NaCl。
2.3 净化剂选择优化
荔枝全果中含有大量糖类、酚类、色素等干扰物质,因此需要对提取液进行净化,最大程度去除干扰杂质的影响。
考察了9种净化剂组合对29种农药的净化效果和回收率影响。结果表明,当净化剂为600 mg 无水MgSO4和0.1 g PSA时,29种农药回收率可满足分析要求,但净化后的颜色仍较深,因此,考虑加入GCB吸附色素,并考察了不同含量的GCB对色素的吸附和29种农药回收率的影响,图4显示,当净化剂中加入GCB后,净化后提取溶液的颜色明显发生改变,GCB有效吸附了荔枝提取溶液中的色素,避免了对色谱仪器的污染,同时GCB的加入也会影响氯虫苯甲酰胺、烯酰吗啉、螺虫乙酯、咪鲜胺、唑嘧菌胺、氟苯虫酰胺和吡唑醚菌酯等7种农药的回收率。因此,综合考虑回收率和吸附色素情况,本研究最终优选的净化剂组合为600 mg 无水MgSO4、0.1 g PSA和0.03 g GCB。

图4 九种净化剂组合对29种农药的净化效果影响
Fig.4 Effect of combination of nine purification agents on the purification of 29 pesticides
注:1为600 mg 无水MgSO4;2为600 mg 无水MgSO4和0.1 g PSA;3为600 mg 无水MgSO4和0.2 g PSA;4为600 mg无水MgSO4和0.3 g PSA; 5为600 mg无水MgSO4和0.4 g PSA;6为600 mg 无水MgSO4、0.1 g PSA、0.01 g GCB;7为600 mg无水MgSO4、0.1 g PSA、0.02 g GCB; 8为600 mg 无水MgSO4、0.1 g PSA、0.03 g GCB;9为600 mg 无水MgSO4、0.1 g PSA、0.04 g GCB。
2.4 基质效应分析
基质效应是影响液质联用分析中定量结果准确性的重要因素。由表2可知,毒死蜱的基质效应为-24.1%,其他28种农药基质效应值为-20%~20%,因此,采用基质匹配标溶液对样品进行定量分析,可确保检测结果可靠性。
表2 29种线性方程和基质效应
Table 2 Linear equation and matrix effects of 29 pesticides

基质线性方程相关系数r基质效应/%LOD/(μg/kg)LOQ/(μg/kg)多菌灵+溶剂y=0.052 6x-0.069 20.996 5-12.50.52多菌灵+基质y=0.046x-0.061 90.936 2吡虫啉+溶剂y=0.039 1x-0.052 40.993 2-15.90.52吡虫啉+基质y=0.045 3x-0.059 90.940 3噻虫嗪+溶剂y=0.044 7x-0.058 90.998 72.690.251噻虫啉+基质y=0.045 9x-0.061 60.939 8抑霉唑+溶剂y=0.052 2x-0.068 40.993 7-11.10.251抑霉唑+基质y=0.046 4x-0.063 10.934 2甲维盐+溶剂y=0.047 5x-0.062 40.999 3-4.63310甲维盐+基质y=0.045 3x-0.059 90.938 3氟吡菌胺+溶剂y=0.046 2x-0.060 20.998 4-1.940.10.3氟吡菌胺+基质y=0.045 3x-0.060.938 4马拉硫磷+溶剂y=0.048 2x-0.063 30.995 3-6.840.20.5马拉硫磷+基质y=0.044 9x-0.058 80.940 4甲霜灵+溶剂y=0.047 5x-0.062 50.999 6-4.420.10.3甲霜灵+基质y=0.045 4x-0.060 10.937 3氟环唑+溶剂y=0.044 6x-0.060.993 83.820.10.3氟环唑+基质y=0.046 3x-0.062 90.938 7氯虫苯甲酰胺+溶剂y=0.045 3x-0.059 10.995 41.110.20.5氯虫苯甲酰胺+基质y=0.045 8x-0.061 30.932 6烯酰吗啉+溶剂y=0.042 4x-0.056 40.996 18.490.10.3烯酰吗啉+基质y=0.046x-0.061 90.936 6氟唑菌酰胺+溶剂y=0.044 4x-0.0590.998 63.160.10.3氟唑菌酰胺+基质y=0.045 8x-0.061 40.941 4螺虫乙酯+溶剂y=0.041 2x-0.055 70.996 012.40.10.3螺虫乙酯+基质y=0.046 3x-0.062 90.936 5咪鲜胺+溶剂y=0.048 3x-0.063 90.997 2-5.790.20.5咪鲜胺+基质y=0.045 5x-0.060 50.933 2氟吡菌酰胺+溶剂y=0.045 5x-0.057 90.994 1-0.440.10.3氟吡菌酰胺+基质y=0.045 3x-0.059 80.938 5苯醚甲环唑+溶剂y=0.035 6x-0.0480.992 90.850.10.3苯醚甲环唑+基质y=0.035 9x-0.031 70.932 4灭幼脲+溶剂y=0.045 9x-0.062 40.992 71.0913灭幼脲+基质y=0.046 4x-0.063 30.938 6蝇毒磷+溶剂y=0.045 2x-0.060 50.991 71.110.52蝇毒磷+基质y=0.045 7x-0.061 10.939 3甲氧虫酰肼+溶剂y=0.045 8x-0.060 10.996 9-0.870.31甲氧虫酰肼+基质y=0.045 4x-0.060 30.937 3
续表2

基质线性方程相关系数r基质效应/%LOD/(μg/kg)LOQ/(μg/kg)三唑磷+溶剂y=0.045 3x-0.059 30.999 00.670.10.3三唑磷+基质y=0.045 6x-0.059 30.937 8唑嘧菌胺+溶剂y=0.047 1x-0.061 10.993 6-3.390.10.3唑嘧菌胺+基质y=0.045 5x-0.060 40.937 8腈菌唑+溶剂y=0.044 9x-0.060 40.992 82.450.52腈菌唑+基质y=0.046x-0.061 90.935 3氟苯虫酰胺+溶剂y=0.044 4x-0.056 10.990 42.480.10.3氟苯虫酰胺+基质y=0.045 5x-0.060 30.943 2氰霜唑+溶剂y=0.043 5x-0.058 60.995 87.3613氰霜唑+基质y=0.046 7x-0.064 20.938 1吡唑醚菌酯+溶剂y=0.052 3x-0.062 10.998 2-19.70.20.5吡唑醚菌酯基质y=0.042x-0.050.938 9虱螨脲+溶剂y=0.073x-0.080 40.990 5-410.31虱螨脲基质y=0.043 1x-0.053 40.942 2溴虫氟苯双酰胺+溶剂y=0.044 9x-0.062 20.991 26.460.52溴虫氟苯双酰胺基质y=0.047 8x-0.066 80.928 1毒死蜱+溶剂y=0.060 9x-0.0820.994 1-24.113毒死蜱-基质y=0.046 2x-0.062 60.936 8阿维菌素+溶剂y=0.059 5x-0.0950.997 7-19.7310阿维菌素-基质y=0.047 8x-0.067 30.939 0
注:LOD:检出限(limit of detection);LOQ:定量限(limit of quantitation)。
2.5 方法回收率、精密度与定量限
荔枝全果基质分别进行0.01、0.10、0.5 mg/kg 3个添加水平的回收率试验,共设置5次重复,结果如表3所示。回收率均值为70.2%~102.4%,相对标准偏差(relative standard deviation,RSD)为2.4%~6.2%,符合残留分析要求。分别按3倍信噪比(S/N=3)和10倍信噪比(S/N=10)计算LOD和LOQ,29种农药的LOD为0.1~3 μg/kg,LOQ为0.3~10 μg/kg。
表3 29种农药在荔枝中的添加回收率及相对标准偏差(n=5)
Table 3 Average recovery, relative standard deviation of 29 pesticides in litchi (n=5)

添加水平/(mg/kg)多菌灵吡虫啉噻虫嗪抑霉唑甲维盐平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%0.0170.24.380.25.687.86.279.64.977.45.50.176.02.891.54.992.15.888.84.482.15.10.571.83.498.74.194.34.897.83.889.84.6添加水平/(mg/kg)氟吡菌胺马拉硫磷甲霜灵氟环唑氯虫苯甲酰胺平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%0.0176.25.585.75.987.95.188.13.982.95.10.185.74.889.95.198.64.398.74.688.74.70.599.85.293.23.6102.14.8101.85.191.62.4添加水平/(mg/kg)烯酰吗啉氟唑菌酰胺螺虫乙酯咪鲜胺氟吡菌酰胺平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%0.0180.65.582.74.686.75.580.15.680.65.60.192.14.989.55.992.14.189.64.189.750.599.84.298.14.1100.44.882.14.985.64.1添加水平/(mg/kg)苯醚甲环唑灭幼脲蝇毒磷甲氧虫酰肼三唑磷平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%0.0190.15.982.76.079.74.182.95.580.95.90.195.74.689.95.185.65.898.74.194.16.10.5102.44.098.45.982.93.090.14.992.34.2添加水平/(mg/kg)唑嘧菌胺腈菌唑氟苯虫酰胺氰霜唑吡唑醚菌酯平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%0.0189.75.185.64.182.75.382.94.288.65.90.186.14.887.94.589.45.087.65.195.14.80.590.25.792.53.981.64.185.14.697.74.3添加水平/(mg/kg)虱螨脲溴虫氟苯双酰胺毒死蜱阿维菌素平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%平均回收率/%RSD/%0.0188.15.180.14.482.75.278.75.90.194.64.986.44.989.9582.15.20.594.24.285.93.692.14.380.94.8
2.6 实际样品检测
采用本方法对市场中随机购买的20份荔枝样品进行检测,结果见表4。29种农药中有11种被检出,检出率较高的农药为虱螨脲、吡唑醚菌酯、氯虫苯甲酰胺、烯酰吗啉、苯醚甲环唑和多菌灵。目前,我国已经制定了毒死蜱、吡唑醚菌酯、氯虫苯甲酰胺、氰霜唑、咪鲜胺、烯酰吗啉、苯醚甲环唑和多菌灵在荔枝上的最大残留限量分别为1、0.1、1、0.02、2、5、0.5、0.5 mg/kg[22],市售荔枝样品的检测结果暂未超过最大残留限量。
表4 29种农药在市售荔枝样品中的检测结果 单位:mg/kg
Table 4 Residues of 29 pesticides in commercially lychee samples

样品编号毒死蜱虱螨脲吡唑醚菌酯氯虫苯甲酰胺氰霜唑咪鲜胺烯酰吗啉氟吡菌胺苯醚甲环唑吡虫啉多菌灵样品10.07样品20.090.150.040.19样品30.2样品40.020.020.460.090.280.080.08样品50.040.050.160.060.310.11样品60.060.040.220.04样品70.020.820.05样品80.030.090.1样品90.080.010.05样品100.020.050.21样品110.060.590.19样品120.020.060.24样品130.050.17样品140.010.010.090.220.37样品150.050.050.050.350.010.080.16样品160.020.010.070.440.810.140.01样品170.070.120.220.22样品180.10.030.090.21样品190.050.110.220.070.22样品200.280.070.240.010.190.05
注:空白处表示未检出。
3 结论与讨论
本研究系统优化了荔枝中29种农药的前处理提取和净化方法,建立了荔枝全果种29种农药的检测分析方法。该方法具有良好的准确度和精密度,可满足农药残留检测分析要求,且用基质匹配标准溶液定量可消除荔枝全果中杂质的影响。
[1] IBRAHIM S R M, MOHAMED G A. Litchi chinensis: Medicinal uses, phytochemistry, and pharmacology[J]. Journal of Ethnopharmacology, 2015, 174:492-513.
[2] 庄丽娟, 邱泽慧. 2019年中国荔枝产业发展特征与政策建议[J]. 中国南方果树, 2021, 50(4):184-188.
ZHUANG L J, QIU Z H. Development characteristics and policy suggestions of litchi industry in China in 2019[J]. South China Fruits, 2021, 50(4):184-188.
[3] 陈厚彬, 苏钻贤, 杨胜男. 2023年全国荔枝生产调查与形势分析[J]. 中国热带农业, 2023(3):13-22.
CHEN H B, SU Z X, YANG S N. Investigation and analysis of the litchi production in China in 2023[J]. China Tropical Agriculture, 2023(3):13-22.
[4] 陈厚彬, 欧良喜, 李建国, 等. 新中国果树科学研究70年: 荔枝[J]. 果树学报, 2019, 36(10):1399-1413.
CHEN H B, OU L X, LI J G, et al. Fruit scientific research in New China in the past 70 years: Litchi[J]. Journal of Fruit Science, 2019, 36(10):1399-1413.
[5] 罗成, 周如, 杨春亮, 等. 国内外荔枝农药残留限量标准对比分析[J]. 中国南方果树, 2023, 52(3):236-241.
LUO C, ZHOU R, YANG C L, et al. Comparative analysis of the domestic and abroad standards of pesticide residue limit for Litchi[J]. South China Fruits, 2023, 52(3):236-241.
[6] 顾燕萍, 张树飞, 张惠云, 等. 我国荔枝龙眼中农药最大残留限量标准现状分析与建议[J]. 现代食品科技, 2024, 40(3):333-341.
GU Y P, ZHANG S F, ZHANG H Y, et al. Current standard staus analysis and suggestion for the maximum residue limits of pesticides in Chinese litchi and Longan[J]. Modern Food Science and Technology, 2024, 40(3):333-341.
[7] WANG Y D, FU Y W, WANG Y Y, et al. A comprehensive review on the pretreatment and detection methods of neonicotinoid insecticides in food and environmental samples[J]. Food Chemistry: X, 2022, 15:100375.
[8] CALZA P, GUARINO B, DAL BELLO F, et al. Integrated approach for the analysis of neonicotinoids in fruits and food matrices[J]. Food Chemistry, 2022, 372:131153.
[9] 平华, 赵天宇, 马智宏, 等. 分散固相萃取-超高效液相色谱-串联质谱法同时测定土壤中新烟碱类农药及其代谢物的残留量[J]. 理化检验-化学分册, 2023, 59(11):1276-1283.
PING H, ZHAO T Y, MA Z H, et al. Simultaneous determination of residues of neonicotinoid pesticides and their metabolites in soil by ultra-high performance liquid chromatography-tandem mass spectrometry with disperse solid phase extraction[J]. Physical Testing and Chemical Analysis (Part B (Chemical Analysis)), 2023, 59(11):1276-1283.
[10] 刘文, 车安怡, 王晋琦, 等. 固相萃取-电喷雾-离子迁移谱检测饮用水中三唑类农药残留[J]. 分析试验室, 2023, 1-7.
LIU W, CHE A Y, WANG J Q, et al. Determination of triazole pesticide residues in drinking water by solid phase extraction-electrospray ionization-ion mobility spectrometry [J]. Chinese Journal of Analysis Laboratory, 2023, 1-7.
[11] ZHENG Q, QIN D Q, YANG L P, et al. Dissipation and distribution of difenoconazole in bananas and a risk assessment of dietary intake[J]. Environmental Science and Pollution Research International, 2020, 27(13):15365-15374.
[12] KOWALSKA G, PANKIEWICZ U, KOWALSKI R. Estimation of pesticide residues in selected products of plant origin from Poland with the use of the HPLC-MS/MS technique[J]. Agriculture, 2020, 10(6):192.
[13] CAO J L, LIU X G, WU X H, et al. Uptake and distribution of difenoconazole in rice plants under different culture patterns[J]. Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2022, 39(6):1100-1108.
[14] ZHANG Q, CAO R, TANG T, et al. The integrated exposure assessment and potential risks of five organophosphorus pesticides in vegetables in Zhejiang, China (2018-2020)[J]. Environmental Science and Pollution Research, 2023, 30(11):28916-28924.
[15] PA GA P, SOUSA S, VERA J, et al. Multi-residue analysis of fifty pesticides in river waters and in wastewaters[J]. Environmental Science and Pollution Research International, 2021, 28(47):66787-66803.
GA P, SOUSA S, VERA J, et al. Multi-residue analysis of fifty pesticides in river waters and in wastewaters[J]. Environmental Science and Pollution Research International, 2021, 28(47):66787-66803.
[16] SIRAJ J, EJETA F. Analysis of pesticide residues in fruits and vegetables using gas chromatography-mass spectrometry: A case from West Omo and Bench-Sheko Zone, Southwest Ethiopia[J]. International Journal of Environmental Analytical Chemistry, 2024, 104(3):531-551.
[17] 吕佳宁, 许燕, 丁葵英, 等. 金属有机框架化合物ZIF-8基于QuEChERS-GC-MS/MS测定禽蛋中21种有机磷农药[J]. 中国食品添加剂, 2024, 35(1):8-15.
LYU J N, XU Y, DING K Y, et al. Determination of 21 organophosphorus pesticides in poultry eggs by metal organic framework compound ZIF-8 based on QuEChERS-GC-MS/MS[J]. China Food Additives, 2024, 35(1):8-15.
[18] NARENDERAN S T, MEYYANATHAN S N, BABU B. Review of pesticide residue analysis in fruits and vegetables. Pre-treatment, extraction and detection techniques[J]. Food Research International, 2020, 133:109141.
[19] DE O SILVA R, DE MENEZES M G G, DE CASTRO R C, et al. Efficiency of ESI and APCI ionization sources in LC-MS/MS systems for analysis of 22 pesticide residues in food matrix[J]. Food Chemistry, 2019, 297:124934.
[20] KUANG L X, WANG Z Q, CHENG Y, et al. Residue levels and risk assessment of pesticides in litchi and Longan of China[J]. Journal of Food Composition and Analysis, 2023, 115:104921.
[21] 李海, 邓金兰, 李伟华. 茂名地区荔枝农药残留膳食摄入风险评估[J]. 食品工业, 2023, 44(6):337-340.
LI H, DENG J L, LI W H. Risk assessment of dietary intake of pesticide residues in litchi from Maoming area[J]. The Food Industry, 2023, 44(6):337-340.
[22] 国家卫生健康委员会, 农业农村部, 国家市场监督管理总局. GB 2763—2021食品安全国家标准 食品中农药最大残留限量[S]. 北京: 中国标准出版社, 2021. National Health Commission of the People′s Republic of China, Ministry of Agriculture and Rural Affairs of the People′s Republic of China, State Administration for Market Regulation. GB 2763—2021 National food safety standard Maximum residue limits for pesticides in food[S]. Beijing: Standards Press of China, 2021.