近年来,毒品成分的非法添加在各类食品中均有发现,有商贩向火锅中添加含有罂粟碱、吗啡等多种毒品成分的罂粟壳以吸引回头客[1],也有商家向运动营养食品中添加可卡因等毒品成分以增强产品抗疲劳效果[2],甚至有不法商贩向减肥保健食品中添加芬氟拉明等新型毒品以提升减肥效果[3]。一些专门从事毒品犯罪的人员也将目标转向食品领域,这类人员在夜店、KTV等各类娱乐场所中活动,将毒品暗中添加到娱乐场所常见的饮品和食品中诱骗客人尝试。奶茶作为在青少年群体中较为畅销的饮品,多被毒品犯罪人员选作添加对象,常见的添加成分有甲基苯丙胺(methamphetamine,MET)、氯胺酮(ketamine,KET)和可卡因(cocaine,COC)等[4-5],添加后无论从外观、香味、口味以及服用方式都与未被添加的奶茶没有明显区别,具有极强的迷惑性。消费者误食这类含有毒品成分的食品极易对人体神经系统造成损害,甚至可能出现内分泌失调等症状,最终成瘾,给社会造成巨大的安全风险。
目前毒品成分检测的方法有高效液相色谱法[6]、液相色谱与质谱联用法[7]、超高效液相色谱-质谱联用法[8]、气相色谱-质谱联用法[9]和电化学发光法[10]等。这些方法大部分基于生物样本,如血液[11]、尿液[12-13]、毛发[14-15]等,少量研究环境样本,如水样[16-17]等。而关于食品样本检测的报道仍然较少,且这些方法仍然存在检测设备昂贵、检测速度慢等局限,无法满足现场即时检测的实际需求。胶体金免疫层析技术具有操作简单、灵敏特异、快速便携等优点[18],已逐渐应用到毒品的现场快速检测中,但仍面临多目标同时检测的现实挑战[19-21]。因此,亟需建立一种能够现场快速检测食品中多种毒品成分的新型检测方法。
本研究以奶茶为样品,建立了一种快速灵敏的三重胶体金免疫层析方法,实现了对奶茶中甲基苯丙胺、可卡因和氯胺酮3种毒品的联合检测,为保障消费者的食品安全、打击食品中的违法添加提供技术支持,对维护社会稳定具有重要意义。
1 材料与方法
1.1 材料与试剂
MET、KET、COC、大麻二酚(cannabidiol,CBD)、苯巴比妥(phenobarbitalum,PHB)、地西泮(diazepamum,DZP)、甲氧麻黄酮(mephedrone,MEPH)、咖啡因(caffeine,CAF)、牛磺酸(taurine,TAU)、伪麻黄碱(pseudoephedrine,PE)、大麻四氢酚(tetrahydrocannabinol,THC)、五氯酚钠(sodium pentachlorophenol,NaPCP)、卡西酮(cathinone,CTN)、甲卡西酮(methcathinone,MC)、四氢大麻酚酸(tetrahydrocannabinolic acid,THCA)、美沙酮(methadonu,MTD)、甲氧那明(methoxyphenamine,MP)、苯丙胺醇(phenylpropanolamine,PPA),浙江迪恩生物科技股份有限公司;硝酸纤维素膜(nitrocellulose membrane,NC)、样品垫、结合垫、背衬卡、吸水纸,浙江迪恩生物科技股份有限公司;甲基苯丙胺-牛血清白蛋白(methamphetamine-bovine serum albumin,MET-BSA)、氯胺酮-牛血清白蛋白(ketamine-bovine serum albumin,KET-BSA)、可卡因-牛血清白蛋白(cocaine-bovine serum albumin,COC-BSA)、甲基苯丙胺单克隆抗体(methamphetamine-monoclonal antibody,MET-mAb)、氯胺酮单克隆抗体(ketamine-monoclonal antibody,KET-mAb)、可卡因单克隆抗体(cocaine-monoclonal antibody,COC-mAb)、山羊抗小鼠IgG(goat Anti-Mouse IgG,GAM-IgG)、牛血清白蛋白(bovine serum albumin,BSA),杭州快格科技有限公司;四氯金酸(HAuCl4)、柠檬酸三钠(C6H5Na3O7),Sigma-Aldrich公司;磷酸二氢钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)、碳酸钾(K2CO3)和其他化学品,国药集团化学试剂有限公司。
1.2 仪器与设备
XYZ-3000喷金点膜仪、CM-2000切割机,美国BioDot公司;干燥箱,上海博远实业有限公司;胶体金读数仪,苏州赫尔曼精密仪器公司;低温高速离心机,美国Thermo Fisher Scientific公司;涡旋混合仪,杭州齐威有限公司;Milli-Q超纯水系统,德国默克公司;EXPEC 5210液相色谱-三重四极杆质谱联用仪,杭州谱育科技发展有限公司。
1.3 实验方法
1.3.1 胶体金探针的制备
本研究采用柠檬酸钠还原法制备胶体金纳米粒子(colloidal gold nanoparticles,CGNPs)[22]。将100 mL 0.1 g/L HAuCl4溶液搅拌煮沸,加入3 mL 10 g/L C6H5Na3O7溶液,搅拌1 min待反应溶液变成酒红色后,再煮沸5 min,冷却至室温,4 ℃保存备用。根据实验室前期胶体金检测探针制备方法[23],取1 mL胶体金溶液至1.5 mL EP管中,用10 g/L K2CO3调节溶液pH值至8.2,常温静置10 min。加入10 μg/mL的单克隆抗体,混匀后静置10 min。向上述溶液中加入10 μL 10 g/L BSA溶液,封闭10 min后,8 000 r/min离心10 min,弃上清液。沉淀物用含有10 g/L BSA的0.01 mol/L PBS复溶至1 mL,4 ℃避光保存备用。
1.3.2 试纸条制备
免疫层析试纸条由5部分组成(图1),包括吸水纸、聚氯乙烯背衬板(PVC底板)、结合垫、样品垫和硝化纤维素(NC)膜。
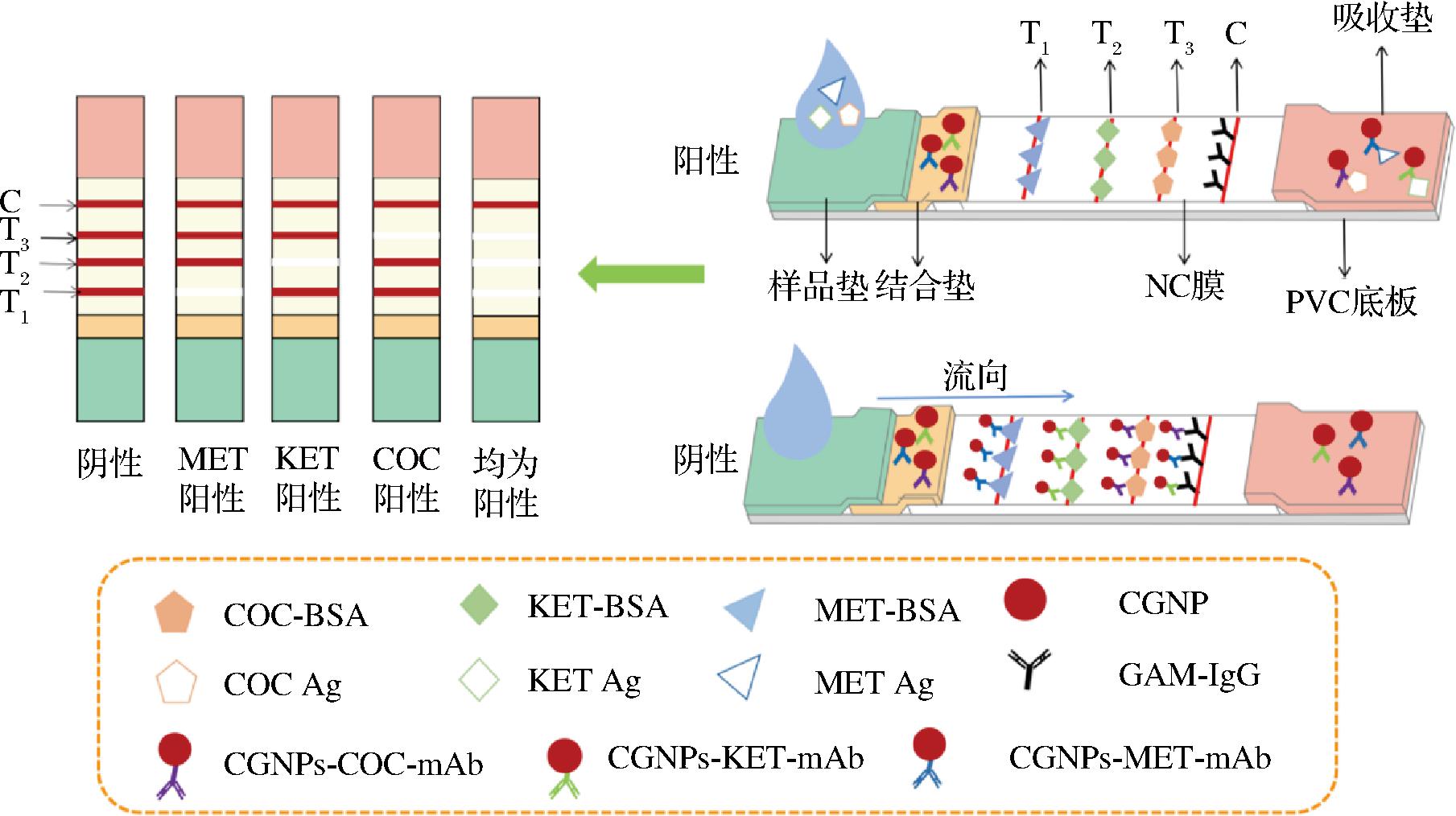
图1 三重试纸条检测原理
Fig.1 Detection principle of triple test strip
a)样品垫和结合垫前处理:样品垫和结合垫均由相同规格的玻璃纤维组成。将结合垫切割成 30 cm长、0.8 cm宽的条带,用5 mL PBS浸润处理,放置在37 ℃的烘箱中干燥24 h,室温保存于密封袋中。样品垫切成30 cm长、2 cm宽的条带,使用相同方法处理并贮存。
b)喷金:使用XYZ 3000喷金点膜仪将胶体金-单克隆抗体偶联物(CGNPs-MET-mAb、CGNPs-KET-mAb和CGNPs-COC-mAb混合物)以1.5 μL/cm的喷量,喷洒到结合垫上,烘干备用。
c)划膜:将MET-BSA、KET-BSA、COC-BSA和山羊抗小鼠IgG(1.0 mg/mL)分别喷洒在NC膜的测试线T1、T2、T3和对照线(C线)位置处,37 ℃的烘箱中干燥2 h。
样品垫、结合垫、NC膜和吸水纸由下到上依次叠放在底板上,裁剪成3 mm宽的测试条,室温保存。
1.3.3 检测原理
基于抗原抗体竞争反应的免疫层析试纸条,如图1所示。以MET为例,将40 μL待测样本滴加在样品垫上,其中含有的MET与NC膜上的固定抗原(MET-BSA)竞争结合CGNPs-MET-mAb。当检测阴性样本时,结合垫的CGNPs-MET-mAb会随着毛细管作用流经T线,与T1线上的MET-BSA进行结合;当检测阳性样本时,MET将会与结合垫上的CGNPs-MET-mAb结合,过量的CGNPs-MET-mAb仍会与T线上的MET-BSA结合,导致T1上偶联物减少,显色亮度下降。如果MET过量,CGNPs-MET-mAb将不会与T线上的MET-BSA结合,从而观察不到T1显色。KET和COC的检测原理与MET类似。待测样品中的目标分析物浓度与相对显色强度(T/C值)成反比,目标分析物浓度越高,T/C值越低,目标分析物浓度越低,T/C值越高。
1.3.4 胶体金免疫层析检测体系优化
1.3.4.1 最佳工作浓度优化
采用正交实验对人工抗原和胶体金偶联物的质量浓度进行优化。将3种胶体金偶联物(CGNPs-mAbs)按不同的质量浓度(2.5、5、10、15、20 ng/mL)以1.5 μL/cm的喷量喷洒在结合垫上,将MET-BSA、KET-BSA和COC-BSA以0.5、1、1.5、2、2.5 mg/mL质量浓度喷洒在NC膜上,检测阴性样本,通过胶体金读数仪记录T值和C值。
1.3.4.2 最佳反应时间优化
使用0.01 mol/L PBS(pH 8.0)作为阴性对照,将40 μL PBS缓冲液滴加在试纸条上,借助胶体金读数仪每1 min记录一次T/C值,在第20 min完成最后1次读数,重复测试3次后分析数据,选择最佳免疫反应时间。
1.3.5 灵敏度和特异性评估
1.3.5.1 灵敏度实验
用PBS缓冲液稀释MET、KET和COC标准品,配制成系列混合溶液,混合溶液中MET的质量浓度分别为0、1、5、10、20、30、40、50、60、80、100 ng/mL,KET和COC的浓度与MET保持一致。使用三重CG-LFIC(lateral flow immuroch romatography)检测上述混合溶液,借助读数仪分别读取T1、T2、T3和C线的显色强度,计算抑制率,建立以标准品混合溶液浓度的对数值为横坐标,抑制率为纵坐标的标准曲线。计算如公式(1)所示:
(1)
式中:H,抑制率,%;B,阳性样本的T/C值;B0,阴性样本的T/C值。
1.3.5.2 特异性评估
特异性通常指免疫检测中抗原专一结合对应抗体的能力。使用CBD、PHB、DZP、MEPH、CAF、TAU、PE、THC、NaPCP、CTN、MC、THCA、MTD、MP、PPA等15种药物评价三重CG-LFIC的特异性。每种药物均稀释至100 ng/mL,滴加后记录显色强度并计算T/C值。
1.3.6 加标回收实验
从浙江省的10家不同娱乐场所中随机抽取售卖的奶茶,经LC-MS/MS验证后在阴性奶茶样本中分别以单独、两两混合和三者混合的方式添加MET、KET和COC标准品。每种标准品的添加质量浓度分别为2.00、4.00、20.00 ng/mL,使用制备的三重CG-LFIC进行检测,计算平均回收率和相对标准偏差。LC-MS/MS色谱条件为:COSMOSIL(2.1ID×100 mm,2.6 μm)色谱柱,以0.1%甲酸-乙腈溶液(A)、0.1%乙酸-水溶液(B)为流动相,梯度洗脱,流速1.0 mL/min,柱温30 ℃,进样量5 μL,质谱条件为:电喷雾正离子模式,喷雾电压4 000 V,离子源温度500 ℃,气帘气(CUR)207 kPa;雾化气(GS1)345 kPa;辅助气(GS2)379 kPa。
1.3.7 三重CG-LFIC与LC-MS/MS方法对比研究
向阴性奶茶样本中混合添加MET、KET和COC标准品,每种标准品的添加质量浓度分别为2.00、4.00、20.00 ng/mL,使用三重CG-LFIC和LC-MS/MS方法同时进行检测,比较2种方法的检测结果。
2 结果与分析
2.1 胶体金探针的制备
透射电子显微镜下观察到的CGNPs状态如图2-a所示,在视野中可以明显观察到未与抗体偶联的CGNPs四周边界模糊,而与抗体偶联后的CGNPs外圈有白色膜状物质(图2-b~图2-d)。CGNPs与抗体偶联前后的形态变化明显,可以表明CGNPs与抗体成功偶联。

a-未与抗体偶联的胶体金纳米粒子;b-MET抗体偶联后的胶体 金纳米粒子;c-KET抗体偶联后的胶体金纳米粒子; d-COC抗体偶联后的胶体金纳米粒子
图2 胶体金探针透射电子显微镜鉴定图
Fig.2 Colloidal gold probe transmission electron microscopy identification chart
2.2 胶体金免疫层析检测体系优化
2.2.1 最佳工作质量浓度优化
为了获得良好的显色效果,对3种探针的质量浓度和固定抗原的浓度进行了优化。检测结果显示(图3-a),使用2.0 mg/mL的MET-BSA和5 ng/mL的CGNPs-MET-mAb时,相对显色强度比值(T/C)最大。对于KET而言(图3-b),2.0 mg/mL的KET-BSA和10 ng/mL的CGNPs-KET-mAb显色效果最佳。同样,2.0 mg/mL的COC-BSA和10 ng/mL的CGNPs-COC-mAb是检测COC的最佳用量(图3-c)。
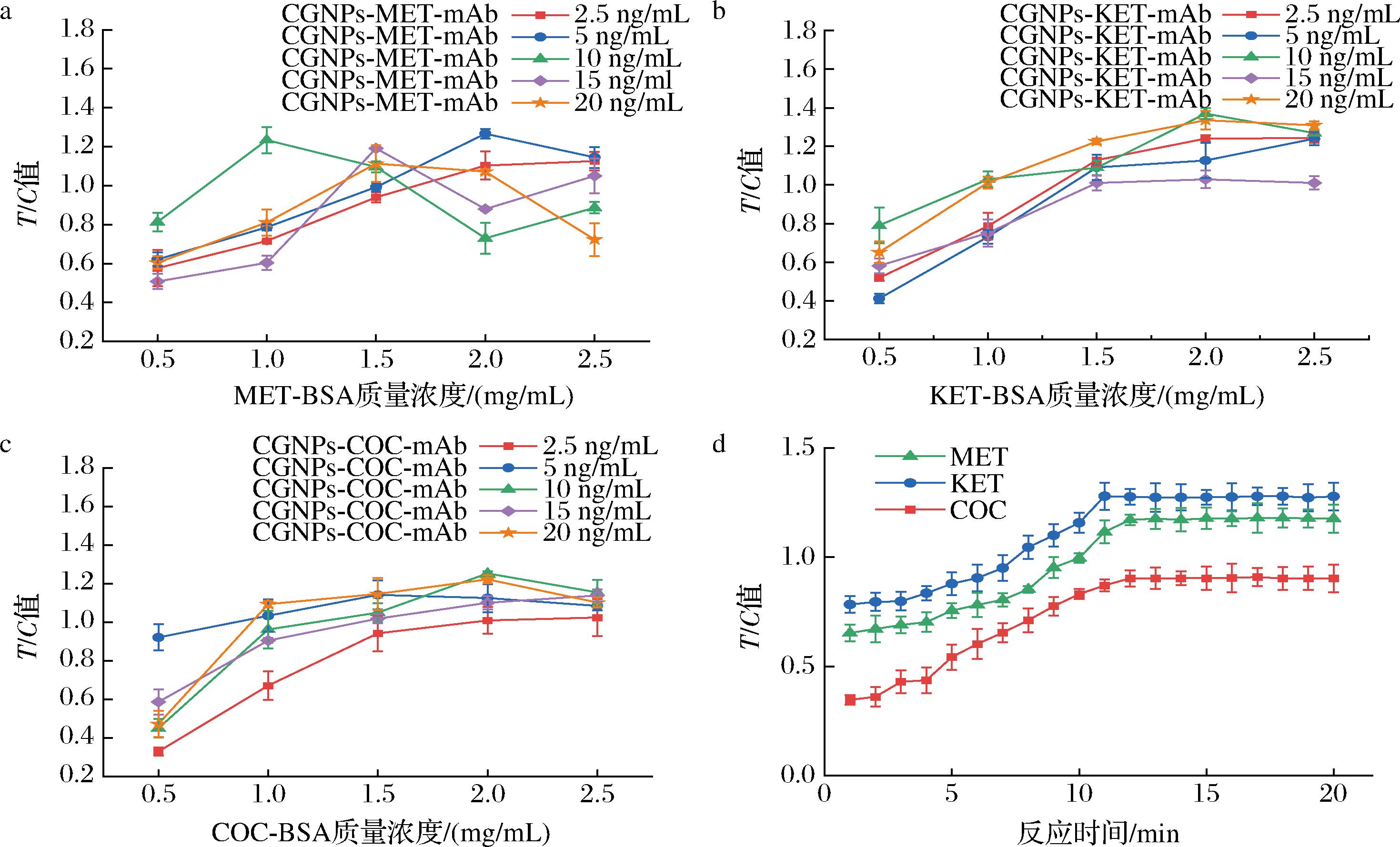
a-MET最佳工作质量浓度优化;b-KET最佳工作质量浓度优化;c-COC最佳工作质量浓度优化;d-反应时间优化
图3 三重CG-LFIC优化实验结果
Fig.3 Triple CG-LFIC optimization results
2.2.2 最佳反应时间优化
免疫反应时间对单抗探针和抗原的结合效果具有一定的影响,随着免疫反应时间的延长,检测线的显色强度逐渐提高。
结果如图3-d所示,反应12 min后,T/C值随时间延长无明显变化。在保证显色效果的前提下,免疫反应时间设定为12 min,可以满足现场快速检测的需求。
2.3 灵敏度和特异性评估
2.3.1 灵敏度实验
从图4-a中可以看出,随着混合标准品溶液质量浓度的增加,3条T线的显色强度逐渐降低,直到消失。将抑制率为10%的标准品浓度(IC10)定义为最低检测限(limit of detection,LOD),IC10~IC90定义为线性范围。结果显示(图4-b),抑制率与标准品混合溶液浓度的对数值之间存在良好的线性关系(R2>0.99),MET、KET和COC线性范围(IC10~IC90)分别为1.60~97.66、1.59~98.06、1.39~77.98 ng/mL。
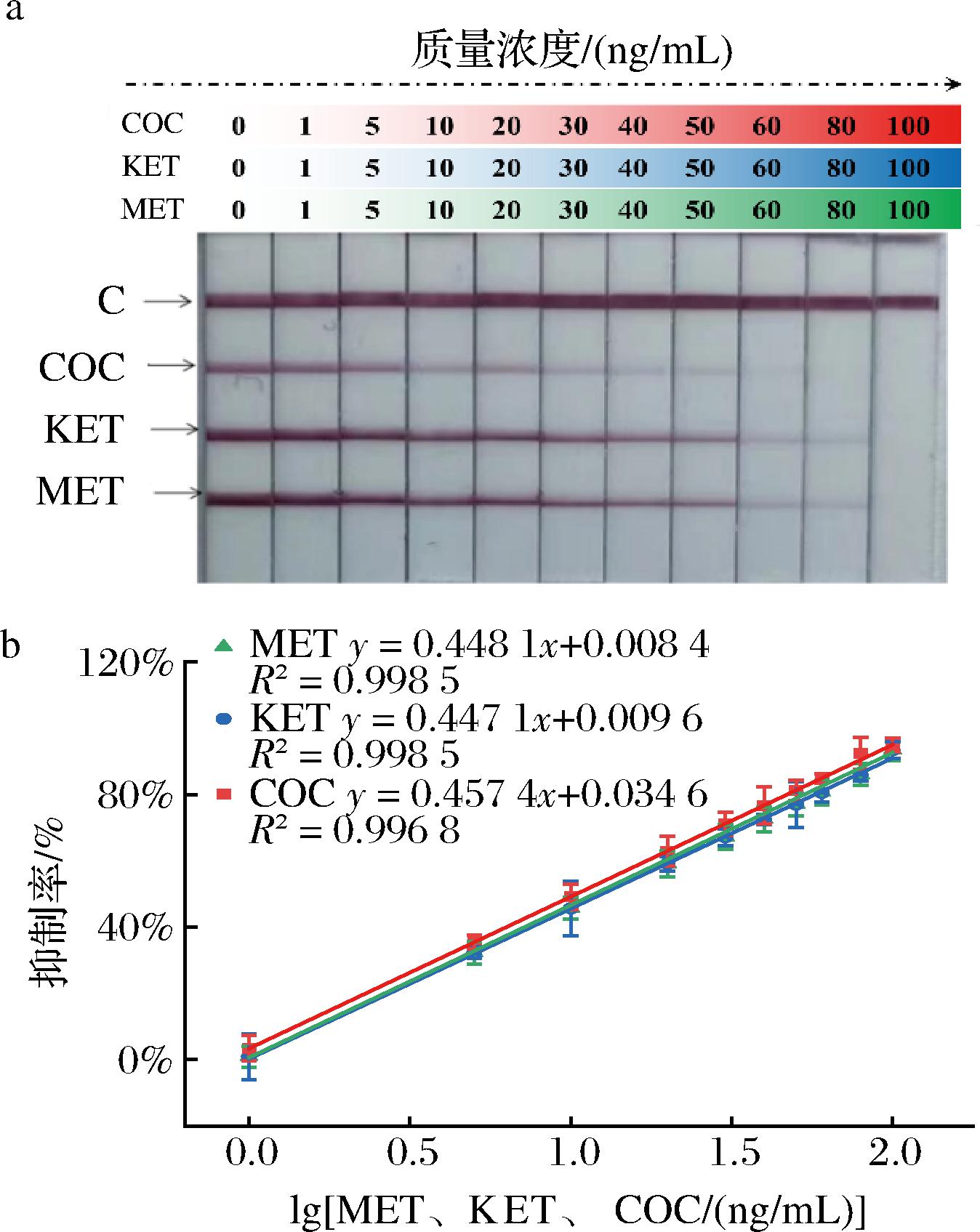
a-灵敏度分析实物图;b-灵敏度标准曲线
图4 三重CG-LFIC灵敏度分析
Fig.4 Triple CG-LFIC sensitivity analysis
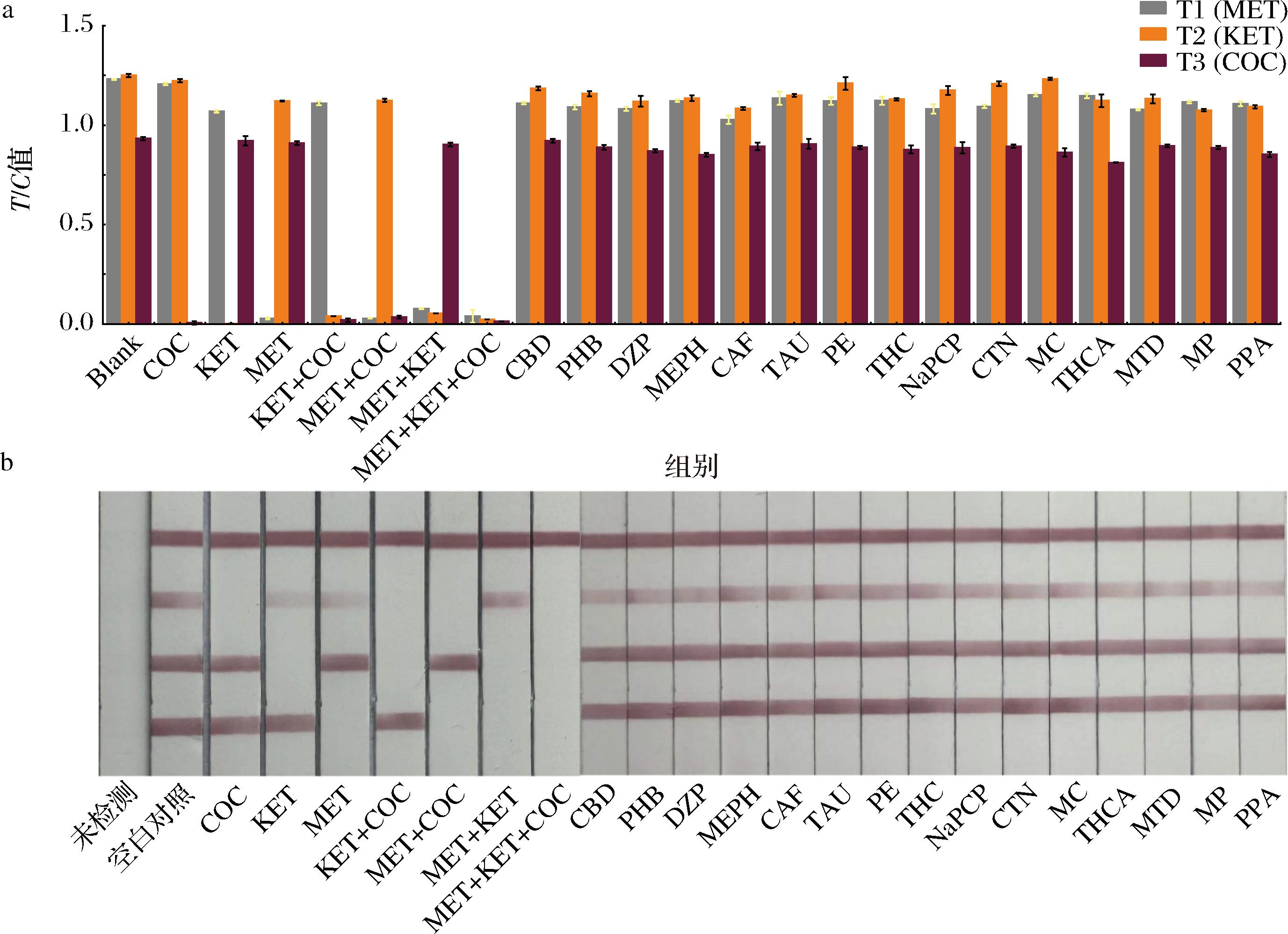
a-特异性分析柱状图;b-特异性分析实物图
图5 三重CG-LFIC特异性分析
Fig.5 Triple CG-LFIC specificity analysis
2.3.2 特异性
应用本方法分析CBD、PHB、DZP、MEPH、CAF、TAU、PE、THC、NaPCP、CTN、MC、THCA、MTD、MP、PPA等15种神经类药物。结果显示(图5),MET与T1处固定的抗原竞争结合单抗探针,导致T1线显色强度明显降低,T/C值显著减小。KET和COC分别与T2和T3处固定的抗原竞争结合探针,呈现出与T1线相似的结果。其他药物并不与T线固定的抗原竞争,因此,T线显色强度较高,T/C值较大。以上结果表明,三重CG-LFIC对MET、KET和COC的检测有良好的特异性。
2.4 加标回收实验
向经LC-MS/MS验证过的阴性奶茶样品中添加不同质量浓度的标准品,每个质量浓度重复测试6次。GC-LFIC方法的准确性与重复性,可以用相对标准偏差(relative standard deviation,RSD)表示。结果显示(表1),三重CG-LFIC方法的平均回收率为90%~109%,RSD均小于5%,表明该方法结果准确,重复性好。
表1 加标样品中MET、KET和COC的回收率测定结果
Table 1 Determination results of recoveries for MET, KET, and COC in spiked samples

编号添加质量浓度/(ng/mL)平均检测值±标准偏差/(ng/mL)平均回收率±RSD/%METKETCOCMETKETCOCMETKETCOC12.00——2.11±0.06 //106±3 //24.00——3.75±0.08 //94±2// 320.00——19.74±0.25 / /99±1// 4—2.00—/1.95±0.03 //98±1/5—4.00—/4.13±0.05 //103±1 /6—20.00—/20.15±0.44 / /101±2 /7——2.00//2.14±0.04 //107±28——4.00//3.78±0.11 //95±39——20.00//20.08±0.65 / /100±3102.002.00—2.14±0.04 2.16±0.03 /107±2108±1 /114.004.00—4.05±0.13 3.96±0.13 /101±399±3/1220.0020.00—21.05±0.45 19.78±0.45 /105±299±2/132.00—2.002.14±0.05 /1.85±0.04 107±2 /93±2144.00—4.003.77±0.06 /3.86±0.05 94±2/97±11520.00—20.0019.54±0.31 /18.75±0.68 98±2/94±316—2.002.00/1.95±0.09 2.15±0.02 /98±4108±117—4.004.00/3.74±0.09 4.14±0.09 /94±2104±218—20.0020.00/21.27±0.40 19.56±0.50 /106±298±3192.002.002.002.08±0.07 1.96±0.04 1.93±0.05 104±398±297±3204.004.004.004.18±0.13 4.19±0.10 4.24±0.13 105±3105±2106±32120.0020.0020.0020.08±0.87 21.04±0.23 19.85±0.65 100±4105±199±3
注:“—”为未添加;“/”为未检出。
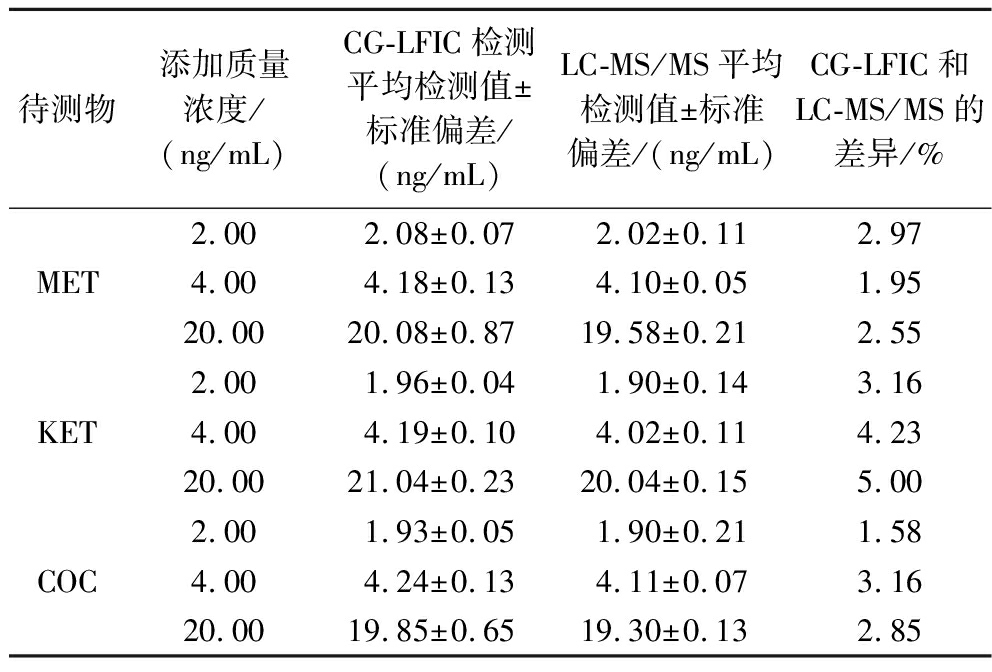
2.5 三重CG-LFIC与LC-MS/MS方法对比研究
向奶茶样品中添加不同质量浓度的标准品后,同时使用三重CG-LFIC和LC-MS/MS方法进行检测,每份样本重复测试6次。如表2所示,2种方法检测结果一致性良好,差异均在5%以内。使用三重CG-LFIC检测,无需大型仪器,可实现现场即时检测,而使用LC-MS/MS检测则需大型仪器和专业人员进行操作。应对现场快速灵敏检测的需求,三重CG-LFIC是检测奶茶中MET、KET和COC更好的选择。
表2 CG-LFIC和LC-MS/MS检测样品中MET、KET和 COC的结果对比
Table 2 Comparison of the results of CG-LFIC and LC-MS/MS for the detection of MET, KET, and COC in samples
待测物添加质量浓度/(ng/mL)CG-LFIC检测平均检测值±标准偏差/(ng/mL)LC-MS/MS平均检测值±标准偏差/(ng/mL)CG-LFIC和LC-MS/MS的差异/%2.002.08±0.072.02±0.112.97MET4.004.18±0.134.10±0.051.9520.0020.08±0.8719.58±0.212.552.001.96±0.041.90±0.143.16KET4.004.19±0.104.02±0.114.2320.0021.04±0.2320.04±0.155.002.001.93±0.051.90±0.211.58COC4.004.24±0.134.11±0.073.1620.0019.85±0.6519.30±0.132.85
3 结论
本研究基于胶体金免疫层析检测技术,成功建立了1种快速灵敏检测奶茶中甲基苯丙胺、氯胺酮和可卡因这3种毒品成分的方法。该方法可以在12 min内完成检测,借助胶体金读数仪可以实现3种毒品的定量检测,对甲基苯丙胺、氯胺酮和可卡因的检测限分别为1.60、1.59、1.39 ng/mL。该方法操作简单、灵敏度高、特异性良好,降低检测成本的同时缩短了检测时间,提高了检测效率,实现了食品中多种毒品成分的现场联合共检的目标,为降低消费者被动吸毒风险提供技术保障,具有极高的应用和推广价值。
[1] 杨昌彪, 李占彬, 阙云飞, 等.UPLC/MSMS内标法测定火锅食品中5种生物碱和15种喹诺酮类物质[J].食品与发酵工业, 2022, 48(15):288-294.
YANG C B, LI Z B, QUE Y F, et al.Determination of 5 alkaloids and 15 quinolones in hotpot food by UPLC/MSMS with internal standard method[J].Food and Fermentation Industries, 2022, 48(15):288-294.
[2] 舒俊宏. 运动营养食品中可卡因的检测[J].现代食品科技, 2019, 35(4):279-284.
SHU J H.Detection of cocaine in sports nutritional food[J].Modern Food Science and Technology, 2019, 35(4):279-284.
[3] 马姣, 胡娅琳, 赵益侠, 等.减肥保健品非法添加3种化学药物的TLC-Micro FTIR检测[J].中国测试, 2018, 44(5):53-57.
MA J, HU Y L, ZHAO Y X, et al.Determination of three chemical drugs added illegally into anti-obesity and healthcare products by TLC-Micro FTIR method[J].China Measurement &Test, 2018, 44(5):53-57.
[4] 王迪, 杜振霞. 分散液液微萃取-离子迁移-质谱联用方法对饮料中的毒品快速筛查[C]//中国化学会第十一届全国生物医药色谱及相关技术学术交流会(大会特邀报告及墙报)论文摘要集. 井冈山, 2016:88.
[5] 余晓琴, 李澍才. 超高效液相色谱-质谱联用法定量测定奶茶中的3种毒品成分[J]. 食品安全质量检测学报, 2019, 10(16):5517-5522.
YU X Q, LI S C. Quantitative determination of 3 related narcotic substances in milk tea by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety &Quality, 2019, 10(16):5517-5522.
[6] GLEBA J, KIM J. Determination of morphine, fentanyl and their metabolites in small sample volumes using liquid chromatography tandem mass spectrometry[J]. Journal of Analytical Toxicology, 2020, 44(4):325-330.
[7] LENDOIRO E, JIMÉNEZ-MORIGOSA C, CRUZ A, et al. An LC-MS/MS methodological approach to the analysis of hair for amphetamine-type-stimulant (ATS) drugs, including selected synthetic cathinones and piperazines[J]. Drug Testing and Analysis, 2017, 9(1):96-105.
[8] 罗耀, 张建莹, 黄昌雄, 等. 液相色谱-串联质谱法测定固体及液体药物中27种新型毒品芬太尼类物质[J]. 分析测试学报, 2020, 39(4):427-433.
LUO Y, ZHANG J Y, HUANG C X, et al. Determination of 27 novel fentanyl analogs and metabolites in solid and liquid drugs by liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2020, 39(4):427-433.
[9] LIU Y, FAN Y L, HUANG Z P, et al. Determination of ketamine, methamphetamine and 3, 4-methylenedioxymethamphetamine in human hair by flash evaporation-gas chromatography/mass spectrometry[J]. Journal of Chromatography B, 2020, 1153:122275.
[10] GAI Z R, LI F, YANG X Y. Electrochemiluinescence monitoring the interaction between human serum albumin and amyloid-β peptide[J]. Bioelectrochemistry, 2023, 149:108315.
[11] JI J H, ZHANG Y, WANG J F. Rapid detection of nine synthetic cathinones in blood and urine by direct analysis in real-time-tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry: RCM, 2021, 35(15): e9136.
[12] ANGELINI D J, BIGGS T D, PRUGH A M, et al. Detection of fentanyl and derivatives using a lateral flow immunoassay[J]. Forensic Chemistry, 2021, 23:100309.
[13] DEHGHANNEZHAD A, PAKNEJAD M, RASAEE M J, et al. Development of a nanogold-based immunochromatographic assay for detection of morphine in urine using the Amor-HK16 monoclonal antibody[J]. Hybridoma (2005), 2012, 31(6):411-416.
[14] 张婷婷, 吴健美, 乔宏伟, 等. 毛发中毒品检测技术及其在毒情监测中的应用[J]. 警察技术, 2022(5):19-21.
ZHANG T T, WU J M, QIAO H W, et al. Hair analysis for drug abuse and its application in drug situation monitoring and early warning[J]. Police Technology, 2022(5):19-21.
[15] 侯伟, 张蕾萍, 王继芬, 等. 人体毛发中氯胺酮及其代谢物的超高效液相色谱-串联质谱法检验及含量统计分析[J]. 分析测试学报, 2021, 40(10):1453-1459, 1466.
HOU W, ZHANG L P, WANG J F, et al. Determination and statistical analysis of ketamine and its metabolites in human hair by ultra-performance liquid chromatography coupled with mass spectrometry[J]. Journal of Instrumental Analysis, 2021, 40(10):1453-1459, 1466.
[16] 刘春叶, 王喆, 冯佳铭, 等. 污水流行病学调查辽宁和吉林两省甲基苯丙胺滥用量和流行率[J]. 环境化学, 2018, 37(8):1763-1769.
LIU C Y, WANG Z, FENG J M, et al. Methamphetamine consumption and prevalence in Liaoning and Jilin provinces investigated by sewage epidemiology[J]. Environmental Chemistry, 2018, 37(8):1763-1769.
[17] 张华方, 杨军, 杜鹏, 等. 北京水环境中氯胺酮和去甲氯胺酮的浓度水平[J]. 环境科学, 2016, 37(7):2522-2529.
ZHANG H F, YANG J, DU P, et al. Concentrations of ketamine and norketamine in the water environment in Beijing[J]. Environmental Science, 2016, 37(7):2522-2529.
[18] 邢广旭, 孙雪峰, 赵东, 等. 侧流胶体金免疫试纸快速测定牛奶中的泰乐菌素[J]. 食品与发酵工业, 2022, 48(12):261-266.
XING G X, SUN X F, ZHAO D, et al. Lateral flow colloidal gold immunoassay paper for rapid determination of tylosin in milk[J]. Food and Fermentation Industries, 2022, 48(12):261-266.
[19] 欧爱芬, 罗奕铭, 赵肃清. 联检速测卡快速检测保健食品中他达拉非与西地那非[J]. 食品与发酵工业, 2021, 47(23):258-264. OU A F, LUO Y M, ZHAO S Q. Research of synchronizating rapid determination of tadalafil and sildenafil in health caring foods[J]. Food and Fermentation Industries, 2021, 47(23):258-264.
[20] PANG Y M, ZHAO S J, LIU Z W, et al. An enhanced immunochromatography assay based on colloidal gold-decorated polydopamine for rapid and sensitive determination of gentamicin in animal-derived food[J]. Food Chemistry, 2022, 387:132916.
[21] POOSINUNTAKUL N, CHANMEE T, PORNTADAVITY S, et al. Silver-enhanced colloidal gold dip strip immunoassay integrated with smartphone-based colorimetry for sensitive detection of cardiac marker troponin I[J]. Scientific Reports, 2022, 12(1):19866.
[22] WANG W, FAN B C, ZHANG X H, et al. Development of a colloidal gold immunochromatographic assay strip using monoclonal antibody for rapid detection of porcine deltacoronavirus[J]. Frontiers in Microbiology, 2023, 13:1074513.
[23] LIU M M, MA B, WANG Y P, et al. Research on rapid detection technology for β2-agonists: Multi-residue fluorescence immunochromatography based on dimeric artificial antigen[J]. Foods, 2022, 11(6):863.