芬太尼是一种强效的阿片类止痛剂,芬太尼类新精神活性物质均为芬太尼的衍生物,因药性强、易成瘾、危害大而备受社会关注[1-2]。近些年,不断有报道[3-5]发现芬太尼类、合成大麻素类等新精神活性物质伪装成饮料、零食、香料等,极具隐蔽性。芬太尼类物质可通过水体等途径对水质、农产品原料甚至食品造成间接污染[6]。有报道[7-8]多个国家水样检出芬太尼类物质。目前对芬太尼物质检测基本依赖于权威部门实验室中的质谱等大型仪器,检测准确、灵敏[9-14];而快速检测技术较为缺乏,研究有化学比色测试[15-17]、酶联免疫吸附法[18-20]、免疫试纸条[21-23]、便携式拉曼光谱[24-26],操作较为简单。2019年我国发布了“关于将芬太尼类物质列入《非药用类麻醉药品和精神药品管制品种增补目录》的公告”[27],约1 400种芬太尼相关物质实行整类列管,极大增加了该类物质的检测和监管难度。基于特异性免疫识别的试纸条和试剂盒检测灵敏度较高,目前仅可进行单一芬太尼物质成分的检测,不适于列管背景下的整类快速筛查分析;拉曼光谱在低浓度检测时易受干扰物影响,准确度较低;化学比色法测定某些具有芬太尼相同官能团的甲基苯丙胺、合成卡西酮等其他毒物时,会得到相同的颜色结果[28],灵敏度和特异性较差。因此,迫切需要开发多种芬太尼及其总量的快速筛查方法。
本研究以芬太尼、阿芬太尼、瑞芬太尼3种重要芬太尼类物质的等比例混合物模拟总量芬太尼,研究具有核心结构特性的适配体为类特性识别元件,Fe3O4作为荧光猝灭剂,羧基荧光素(carboxyfluorescein, FAM)作为信号分子,利用荧光猝灭技术构建荧光快速传感平台,实现了对芬太尼类物质的广谱筛查,突破总芬太尼快检技术空白。
1 材料与方法
1.1 材料与试剂
芬太尼标准品、阿芬太尼标准品、瑞芬太尼标准品,北京芬格尔安公司;双酚A,上海迈瑞尔化学技术有限公司;PEG修饰的四氧化三铁磁性纳米颗粒(表面带羧基),阿拉丁试剂(上海)有限公司;甲醇,美国Honeywell公司;PBS磷酸缓冲液,上海生工生物工程有限公司。本实验所用FAM标记的适配体均合成于生工生物工程(上海)股份有限公司,S1:FAM-TGGGTGGTCAGGTGGGATAGCGTTCCGCGTATGGCCCA,S2:FAM-GGATAGCGGGTTCC;所用化学试剂均为分析纯,所用水均为超纯水。
1.2 仪器与设备
F-2500荧光分光光度计,日本日立公司;TU-1950紫外可见分光光度计,北京普析通用仪器有限公司;Synergy HTX多功能酶标仪,美国Bio-Rad公司;冷冻高速离心机,赛默飞世尔科技公司;HH-4J磁力搅拌恒温水浴锅,江苏金坛白塔新宝仪器厂;KQ3200DB超声波清洗器,昆山市超声仪器有限公司;Milli-Q 超纯水仪,美国Millipore公司;QL901涡旋振荡仪,海门市其林贝尔仪器制造有限公司。
1.3 实验方法
1.3.1 实验溶液的准备
用25 mmol/L的PBS将S1、S2配制成1 μmol/L的母液,4 ℃保存,每次使用前95 ℃退火10 min,冰浴10 min。将1 mg/mL的各种芬太尼类物质标品(甲醇溶解)稀释为1 mg/L,待用。用10 mL PBS溶液分散1 g PEG修饰的四氧化三铁磁性纳米颗粒(表面带羧基),每次使用超声分散30 min,4 ℃保存。
1.3.2 适配体性质测定
亲和性:将 Fe3O4分别加入10、20、50、100、200、500 nmol/L的适配体,配制成10 mg/mL猝灭溶液,再加入1 μmol/L目标溶液,室温避光振荡反应120 min。永磁体放置在离心管下方,取上清液测荧光值(Ex=494 nm,Em=520 nm)。应用Prism 8.0绘制饱和曲线,并根据公式(1)计算Kd值[29]:
(1)
式中:x,适配体浓度,μmol/L;Kd,平衡解离常数,μmol/L;Bmax,最大结合位点数。
稳定性:a)将25 nmol/L的S1、S2适配体溶液在不同温度(10、30、50、70、90 ℃)避光振荡1 h,检测S1、S2在不同温度下的荧光强度。b)25 ℃,在S1、S2适配体溶液中分别添加不同浓度(100、250、500、750、1 000 mmol/L)的Na+和Mg2+,避光振荡作用60 min,测定S1、S2的荧光强度。
1.3.3 荧光适配体传感器快速筛查芬太尼总量
100 nmol/L等体积的适配体加入离心管,加入Fe3O4溶液进行荧光猝灭,避光稳定60 min。加入目标溶液,室温避光振荡120 min。将永磁体放入离心管下方吸附稳定5 min,记录加入总芬太尼后的荧光强度变化值。
1.3.4 方法学评价
检测限和线性范围:按照1.3.3节构建的荧光传感器,分别加入100、200、300、400、500 μg/L的芬太尼类物质模拟溶液检测荧光强度。以总芬太尼的浓度为横坐标,以荧光强度为纵坐标,进行线性拟合,根据公式(2)计算检测限[30]:
检测限![]()
(2)
式中:δ,响应值的偏差;S,标准曲线的斜率。
精密度:使用荧光传感器每天检测总芬太尼类物质模拟溶液(200、300、400 μg/L),连续检测3 d,计算方法的批间精密度。
准确度:随机采集4份非居民用水、居民用水,分别混合均匀,离心10 min取上清液,以添加150、250、450 μg/L的总芬太尼类物质模拟溶液进行回收实验,计算回收率。
1.4 数据统计与分析
相关实验数据,使用Microsoft Office Excel 2016进行统计,并计算平均值和标准偏差。使用SPSS 22.0 (SPSS Inc., Chicago, IL, USA)对数据进行分析。使用Origin 2021进行绘图。使用Prism 5.0进行Kd值的拟合。
2 结果与分析
2.1 基于类特性的芬太尼荧光适配体传感器的检测原理
该荧光适配体传感器检测原理如图1。以FAM修饰的适配体作为荧光探针,该探针在检测体系中可发出强烈的荧光。加入Fe3O4后,由于静电相互作用Fe3O4稳定吸附荧光探针,导致探针荧光猝灭[31]。芬太尼类物质加入后可与荧光探针特异性结合,且结合能力强于探针与Fe3O4的结合力。荧光探针与芬太尼分子形成一定构象,荧光探针远离Fe3O4表面,无法和Fe3O4形成稳定的π-π堆积结构,能量传递效率降低,因而荧光探针荧光值恢复。根据加入目标物后的荧光强度变化值,对芬太尼总量进行定量。
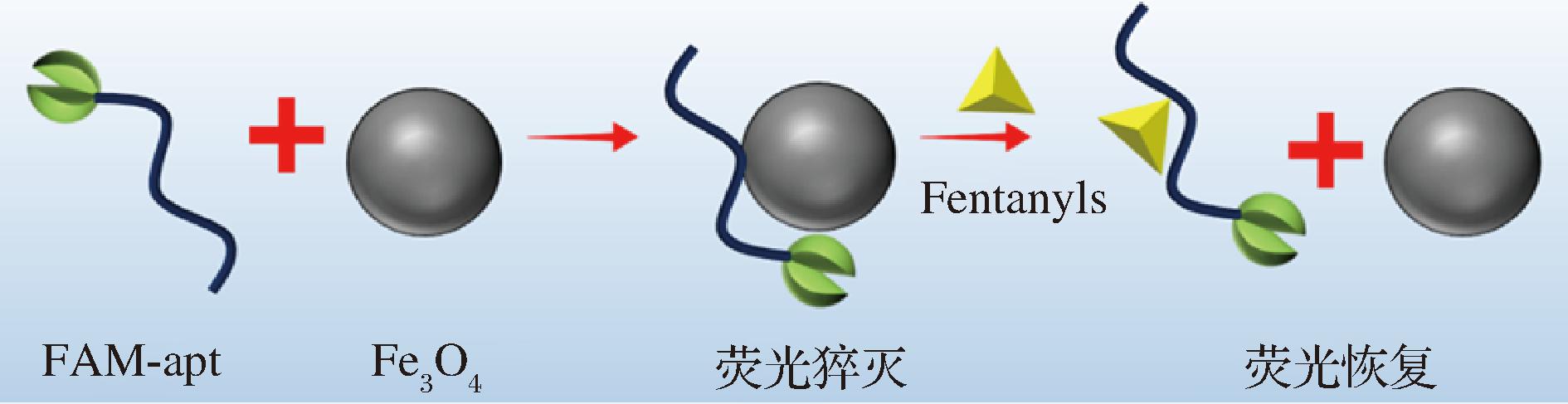
图1 检测原理
Fig.1 The construction principle
2.2 识别元件的确定
目前芬太尼相关的识别元件主要是其独特性抗体物质,没有类特性的识别元件,对各种芬太尼类物质识别作用较差,需要研究可以进行多种芬太尼类物质识别的识别元件。芬太尼、阿芬太尼、瑞芬太尼等结构均带有N-苯基-丙酰胺等产生氢键的芳香环结构(图2-a~图2-c),而双酚A中的苯酚基丙烷也具有产生氢键的芳香环结构(图2-d),识别物质均可通过π-π堆积及氢键作用力与其进行结合[32]。因此,研究采用双酚A适配体进行芬太尼及衍生物检测的研究。长链适配体结构的动态柔性会影响检测结果的准确度及灵敏度[33],本文选择剪裁后亲和力更高[33]的2条双酚A适配体链S1和S2进行试验,其构象如图3-a、图3-b所示。通过研究适配体的稳定性,以及与芬太尼、阿芬太尼、瑞芬太尼之间结合的亲和性,筛选出性质最好的双酚A适配体作为芬太尼总量的识别元件,利用Fe3O4的猝灭效果及磁分离效果,构建荧光传感平台。
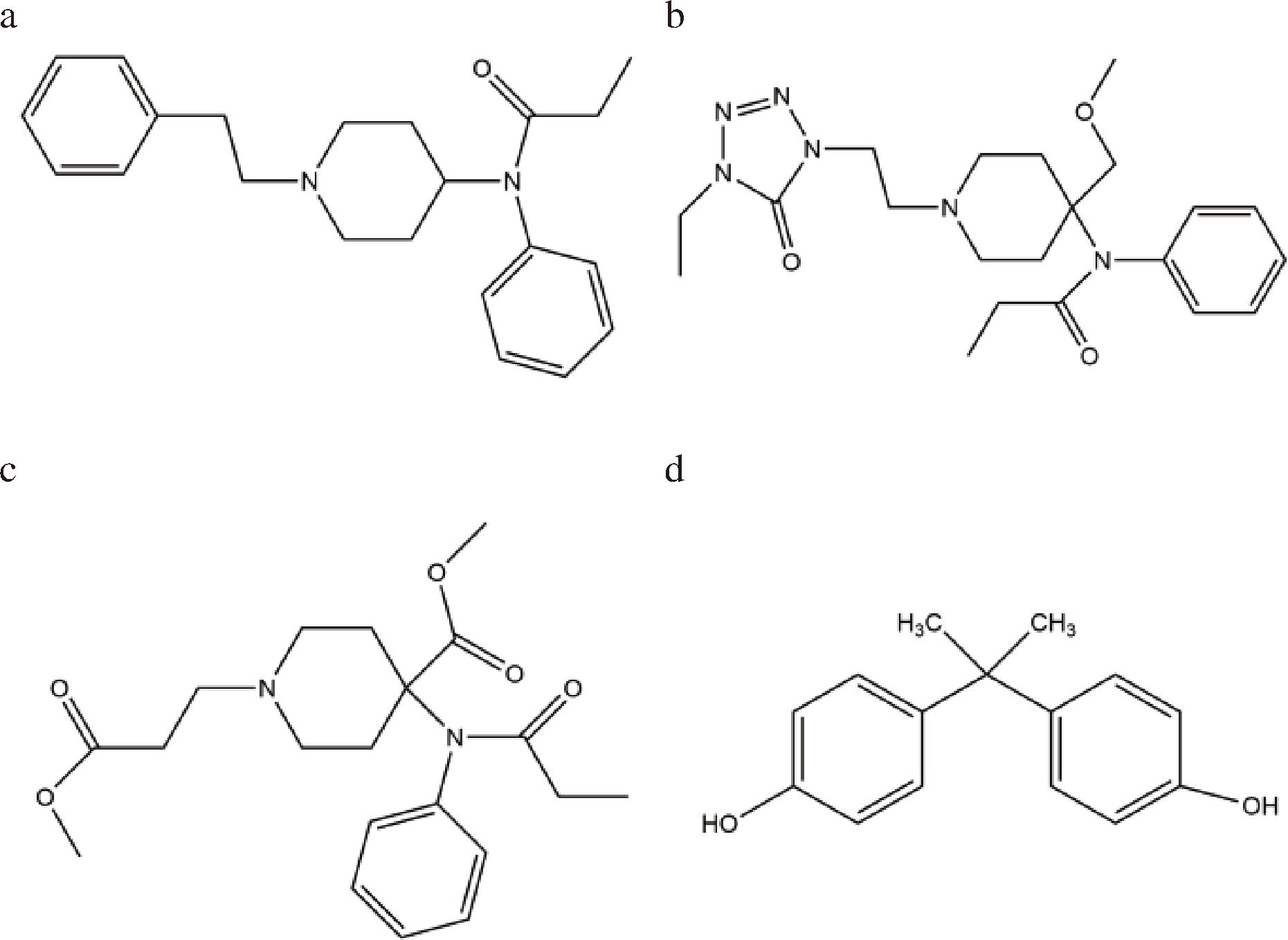
a-芬太尼;b-阿芬太尼;c-瑞芬太尼;d-双酚A
图2 化学结构式
Fig.2 Structural formula
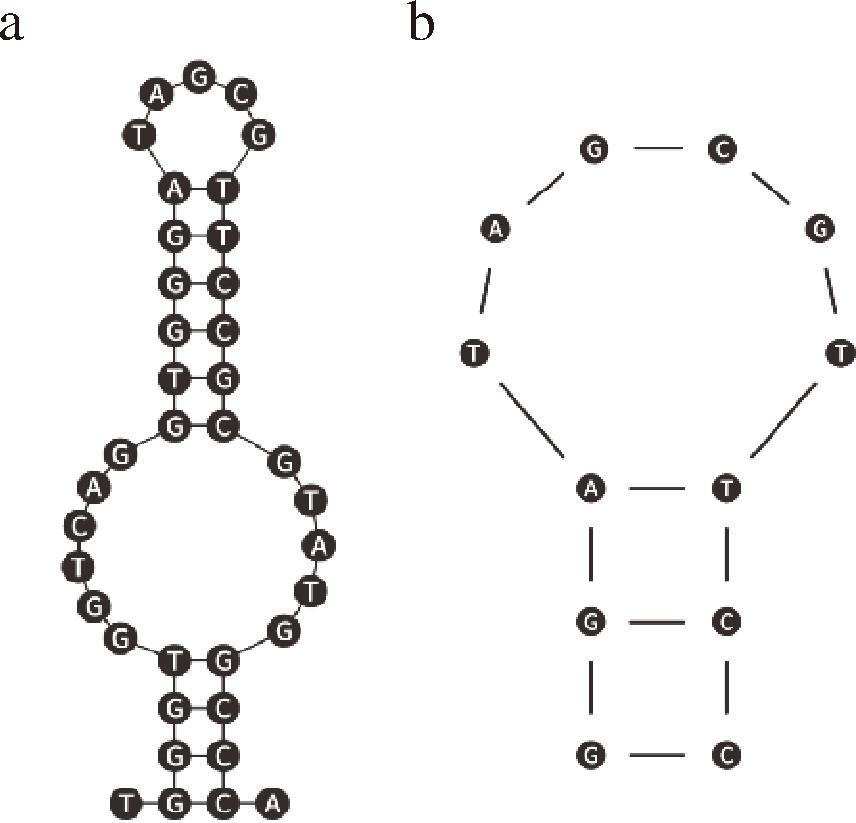
a-剪裁适配体S1;b-剪裁适配体S2
图3 适配体结构
Fig.3 Aptamer structure
2.2.1 适配体亲和性
由表1可知,S1、S2和芬太尼、阿芬太尼、瑞芬太尼的Kd值均符合GB/T 40187—2021《核酸适配体亲和性和特异性评价技术导则》中的核酸适配体的标准范围:数十nmol/L~μmol/L,说明双酚A适配体S1、S2对具有核心类似结构的芬太尼及衍生物具有较好的亲和性。其中,S1与瑞芬太尼的Kd值为(786.8±498.1) nmol/L,Kd值最小,亲和力最强,推测瑞芬太尼的化学结构中含有芳香族含氮碱、苯基,有助于碱基堆积中的疏水效应[34]。苯环的存在使得S1与芬太尼、阿芬太尼也表现出较强的亲和力,Kd值分别为(1 003.0±698.1)、(1 966.0±377.0) nmol/L。而S2与3种芬太尼的Kd值远大于S1,则对芬太尼、阿芬太尼、瑞芬太尼的识别效果小于S1,可能是因为S2只保留了一个茎环结构,相比于S1减少了与靶标分子相互识别的特征结构芳香族含氮碱的主要序列,降低了S2与芬太尼分子之间的识别能力,从而导致Kd值的升高。
表1 解离常数Kd值
Table 1 The dissociation constant Kd
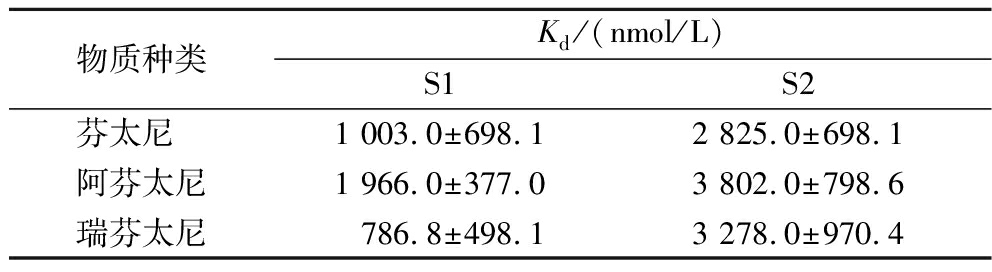
物质种类Kd/(nmol/L)S1S2芬太尼 1 003.0±698.1 2 825.0±698.1 阿芬太尼1 966.0±377.0 3 802.0±798.6 瑞芬太尼786.8±498.1 3 278.0±970.4
2.2.2 适配体稳定性
由图4可知,S1、S2在温度为10~90 ℃时荧光强度变化趋势相同。10 ℃时,二者荧光强度相差不大,30~90 ℃时,适配体荧光强度呈下降趋势,S1的荧光强度显著高于S2,且在70~90 ℃时S1荧光强度较稳定。
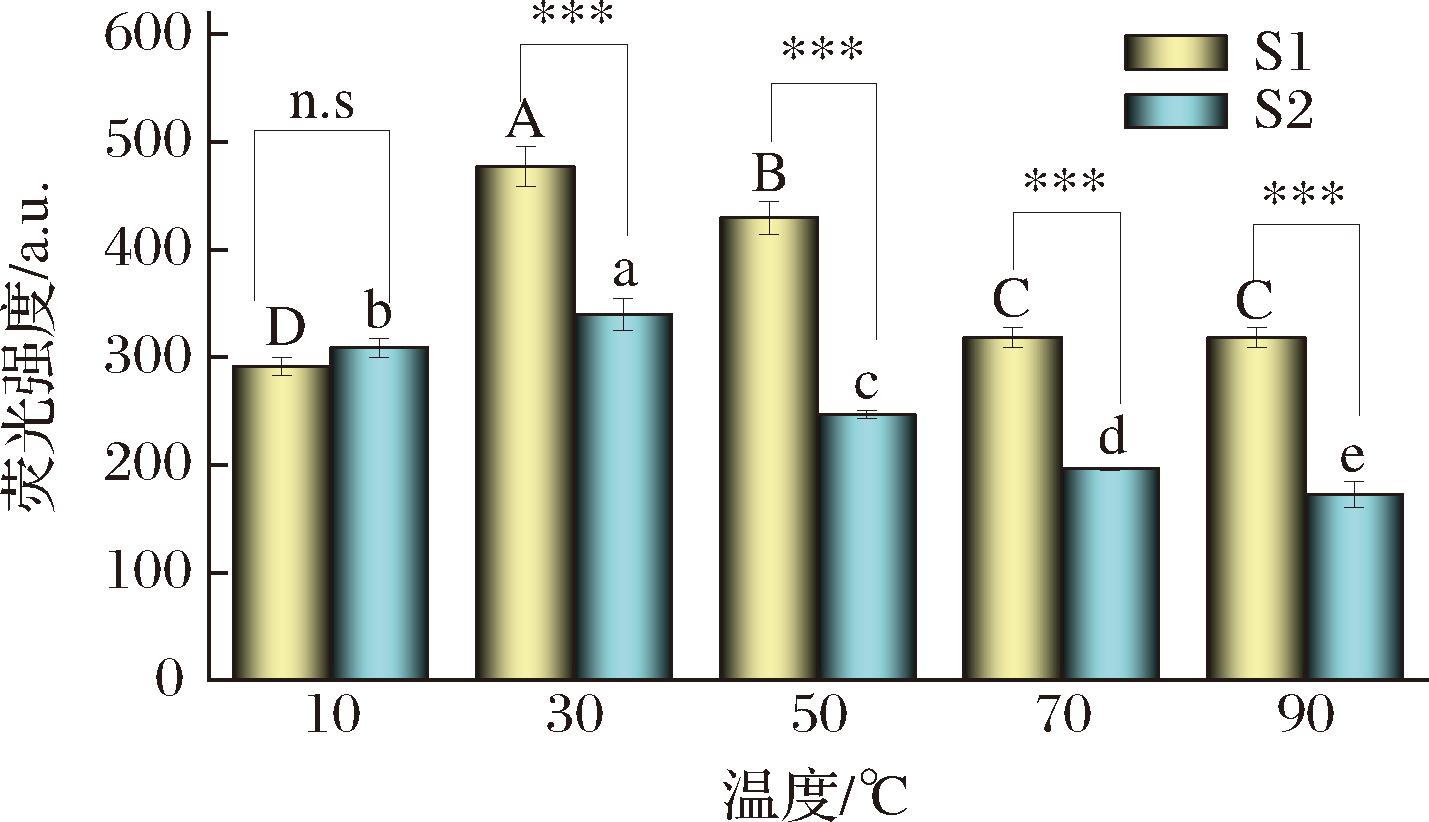
图4 温度对荧光强度稳定性的影响
Fig.4 Effect of temperature on fluorescence intensity stability
注:不同大写字母表示S1适配体不同温度下P<0.05有统计学差异; 不同小写字母表示S2配体在不同温度下P<0.05有统计学差异; n.s表示无显著性差异;***表示P<0.001,差异极其显著。
由图5-a可知,25 ℃下,在Na+浓度100~1 000 mmol/L的变化范围内,适配体S1、S2的荧光强度均呈缓慢降低趋势,在100~500 mmol/L时相同浓度下S1较S2荧光强度更高,建立传感器后会有更好的灵敏度。
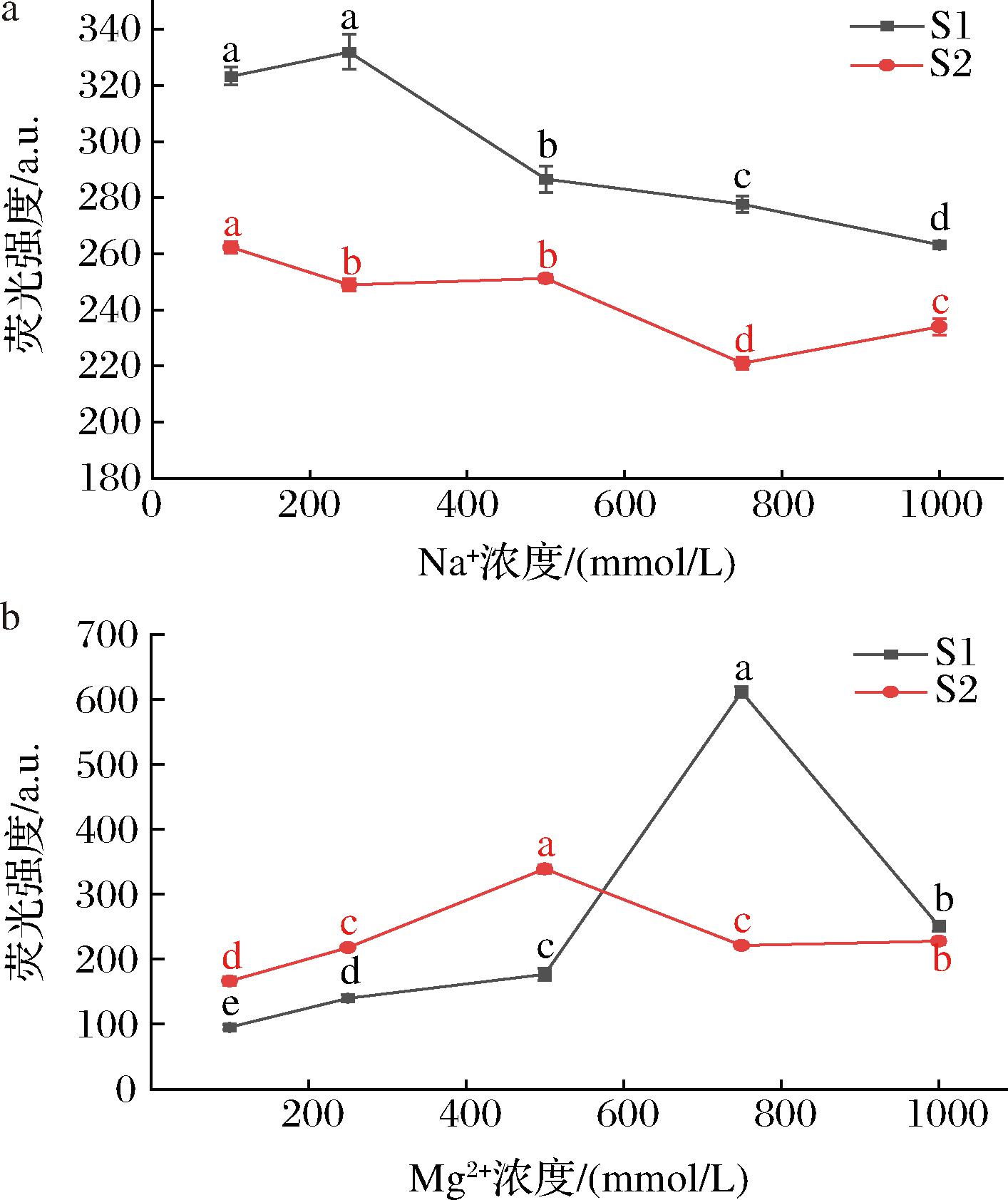
a-Na+浓度;b-Mg2+浓度
图5 离子浓度对荧光强度稳定性的影响
Fig.5 Effect of ion concentration on the stability of fluorescence intensity
注:不同小写字母表示组内P<0.05有统计学差异(下同)。
由图5-b可知,在Mg2+浓度为100~500 mmol/L时,S1、S2荧光强度变化较为稳定,在500~1 000 mmol/L荧光强度变化较大,原因可能为高浓度的Mg2+使适配体空间结构改变,从而导致适配体荧光强度不稳定。据文献报道[35-36],我国水样中Na+、Mg2+常见浓度均不超过500 mmol/L,在Mg2+浓度100~500 mmol/L内,适配体S1、S2的荧光强度相差不大,结合图5-a中Na+浓度100~500 mmol/L内S1荧光强度明显高于S2且Na+为环境中影响适配体稳定性的主要离子[37],故S1在实际检测中更有优势。
根据以上实验可知,适配体S1的环境稳定性和对多种芬太尼类物质的亲和性比S2更好,故选择适配体S1为荧光适配体传感器识别元件。
2.3 方法的可行性
如图6曲线a,FAM-S1表现出最高的荧光强度。当FAM-S1与芬太尼类物质混合孵育时,各种芬太尼的存在不会对FAM-S1的荧光强度有所影响,FAM-S1荧光强度几乎不变(曲线b)。当FAM-S1加入Fe3O4后(曲线d),荧光探针FAM-S1因为核心类似结构静电作用吸附在亲水性的Fe3O4表面,由于荧光共振能量转移导致荧光猝灭,因此用Fe3O4进行磁分离后上清液荧光强度大幅降低(曲线d)。而加入芬太尼类物质后,FAM-S1从Fe3O4表面释放,并与芬太尼分子结合,上清液荧光值增强(曲线c)。总芬太尼加入前后,荧光值出现显著性差异,说明本传感器对总芬太尼有明显的响应。结果表明,所构建的适配体荧光传感器可以进行总芬太尼的检测。
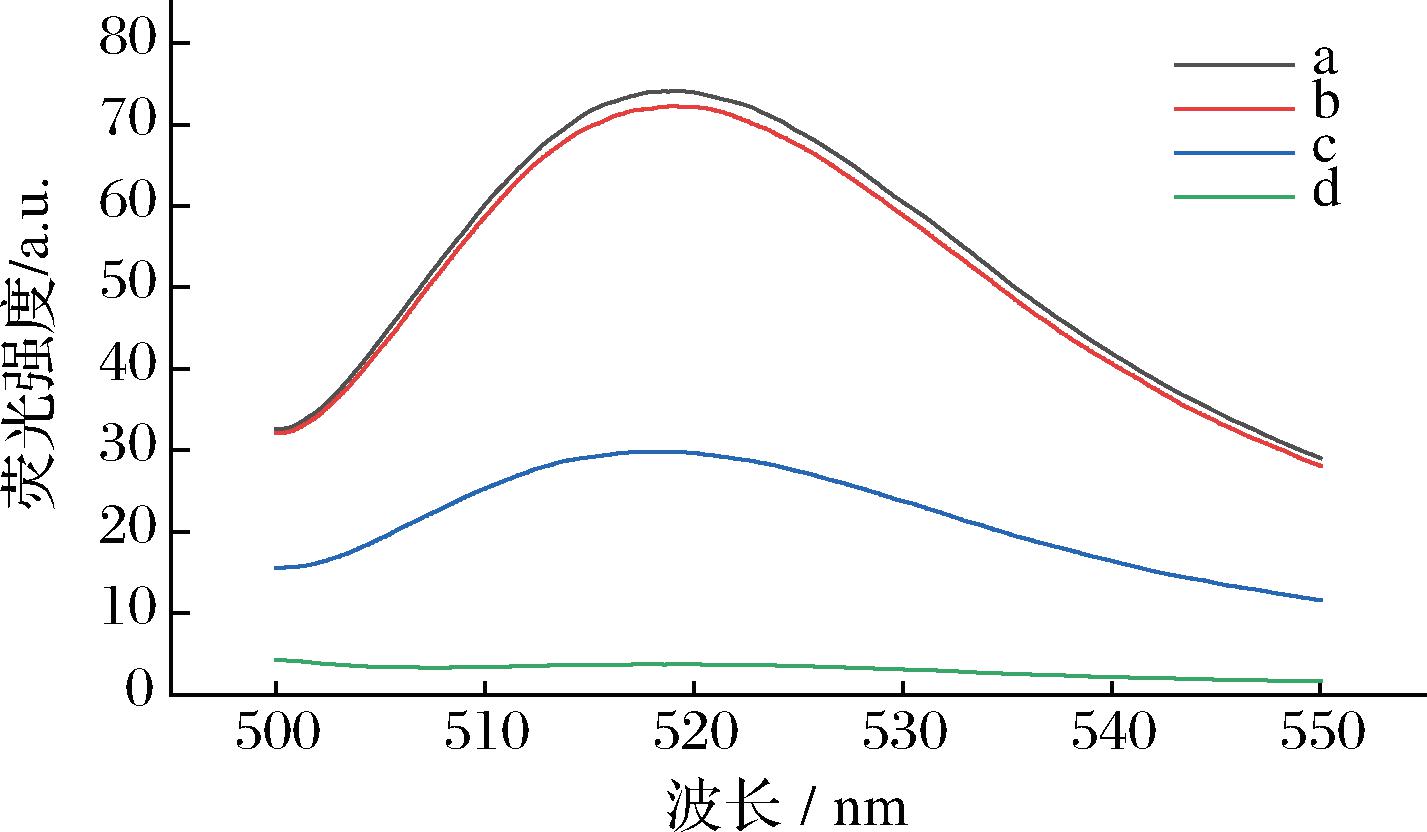
a-FAM-S1;b-FAM-S1+芬太尼类物质;c-FAM-S1+Fe3O4+ 芬太尼类物质;d-FAM-S1+Fe3O4
图6 构建过程的荧光分析
Fig.6 Fluorescence analysis of the construction process
2.4 实验条件研究
2.4.1 Fe3O4浓度
Fe3O4会影响猝灭FAM-S1的效率和检测灵敏度。按照1.3.3节方法,固定其他条件,分别加入不同质量浓度(0.1、0.5、1、2、4、8、10、15、20、30 mg/mL)Fe3O4溶液进行荧光猝灭,稳定后加入芬太尼总溶液取上清液测定荧光值(图7)。当Fe3O4浓度大于10 mg/mL时,荧光强度变化不大,推测体系中FAM-S1几乎完全被吸附到Fe3O4上,荧光猝灭达到平衡状态。过量的Fe3O4会增加检测成本,降低反应灵敏度,因此实验选择10 mg/mL为猝灭FAM-S1的最佳Fe3O4质量浓度。
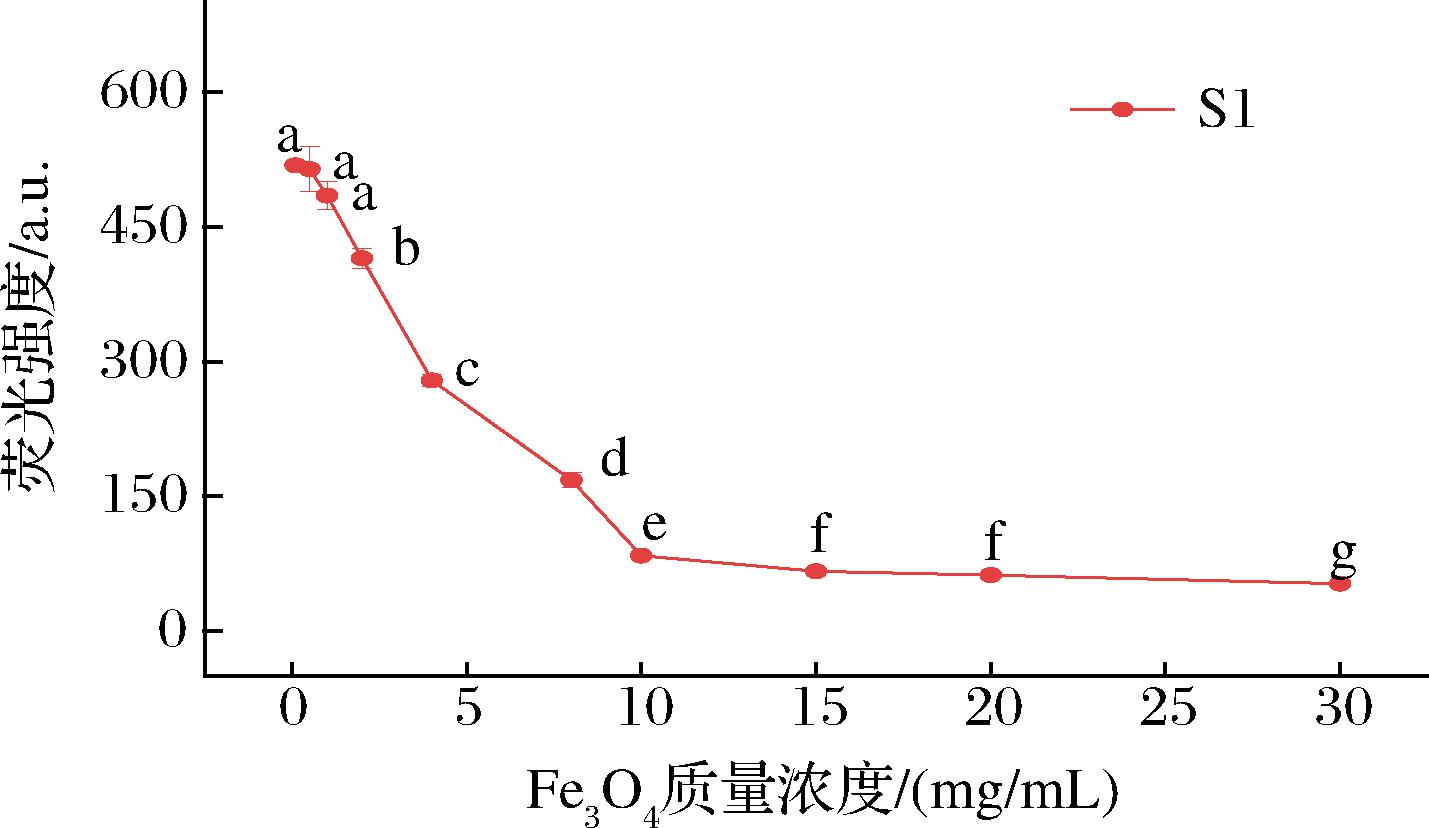
图7 Fe3O4浓度对荧光强度的影响
Fig.7 Effect of Fe3O4 concentration on fluorescence intensity
2.4.2 反应温度
反应温度的改变会导致FAM-S1中发生的局部折叠的现象,影响FAM-S1与芬太尼分子之间的结合。按照1.3.3节方法,固定其他条件,在不同温度下(10、30、50、70、90 ℃)避光振荡120 min,最终以加入识别分子前后的荧光变化情况确定最佳反应温度。由图8可知,30 ℃时达到两者结合的最适温度,荧光强度变化最大,因此实验选择为30 ℃为总芬太尼和FAM-S1反应的最佳温度。
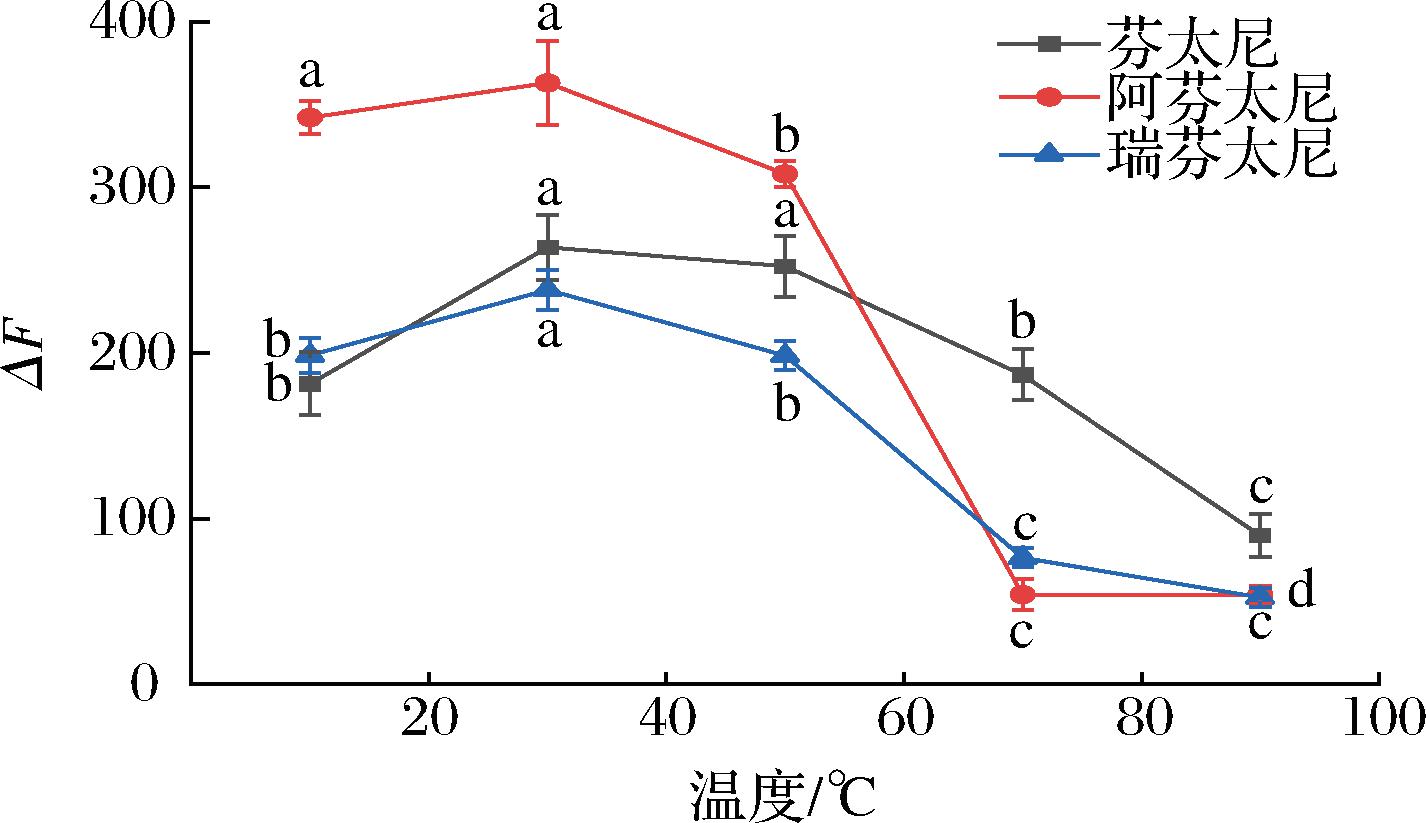
图8 反应温度对ΔF的影响
Fig.8 Effect of reaction temperature on ΔF
2.4.3 离子浓度
离子浓度会影响FAM-S1构象,从而影响FAM-S1和识别分子之间的亲和性。按照1.3.3节方法,固定其他条件,分别向体系内加入不同浓度(100、250、500、750、1 000 mmol/L)Na+、(20、50、100、200、250 mmol/L)Mg2+,通过识别分子(总芬太尼)加入前后的荧光强度变化确定最佳离子浓度。如图9-a所示,Na+浓度为100~1 000 mmol/L时,ΔF呈升高后降低趋势,当Na+浓度为500 mmol/L时,FAM-S1和芬太尼分子的结合效果最好,因为此时FAM-S1上的负电荷与Na+产生的强静电相互作用力最强,有利于 FAM-S1和芬太尼分子间的相互识别[38]。由图9-b可知,Mg2+浓度在20~250 mmol/L内,ΔF先升高后降低,在250 mmol/L时ΔF最高,推测是Mg2+抵消了带负电荷的磷酸盐与碱性残基之间的静电相互作用而导致两者紧密结合[39]。故选择500、200 mmol/L为反应的Na+、Mg2+浓度。
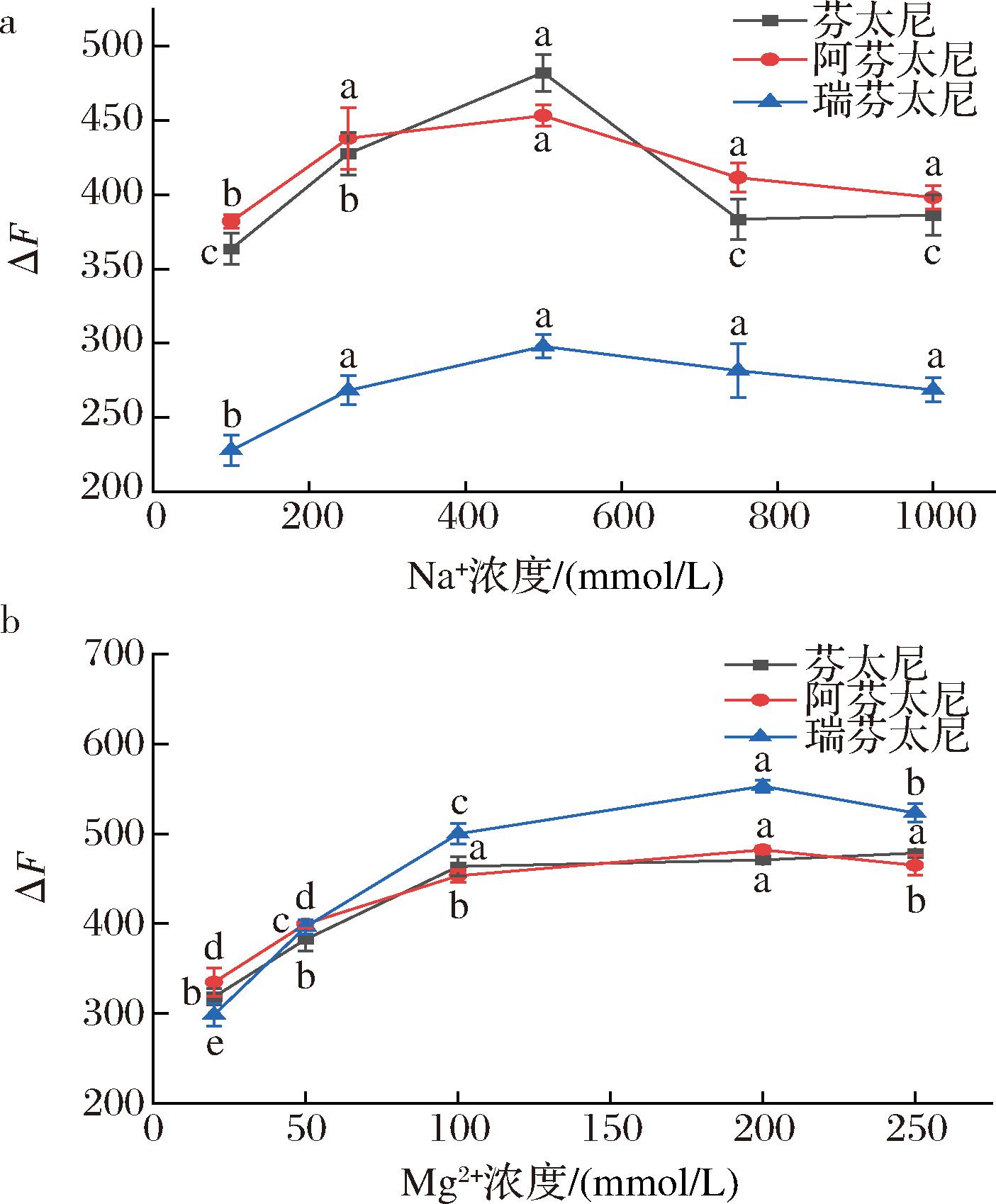
a-Na+浓度;b-Mg2+浓度
图9 离子浓度对ΔF的影响
Fig.9 Effect of ion concentration on ΔF
2.4.4 反应时间
反应时间包括识别分子在溶液中的扩散时间以及识别分子与FAM-S1的结合时间[40]。按照1.3.3节方法,固定其他条件,在不同时间下(30、60、90、120、150 min)进行室温避光稳定并测定ΔF。随着FAM-S1和芬太尼反应时间的延长,由图10可知,随着反应时间的增加,ΔF逐渐增加,其中芬太尼和阿芬太尼的ΔF在90 min时达到最高,此后ΔF开始逐渐降低,而瑞芬太尼ΔF在120 min时最高,但相比于90 min时增加不显著,同时为缩短快检技术检测时间,最终选择90 min为最佳反应时间。
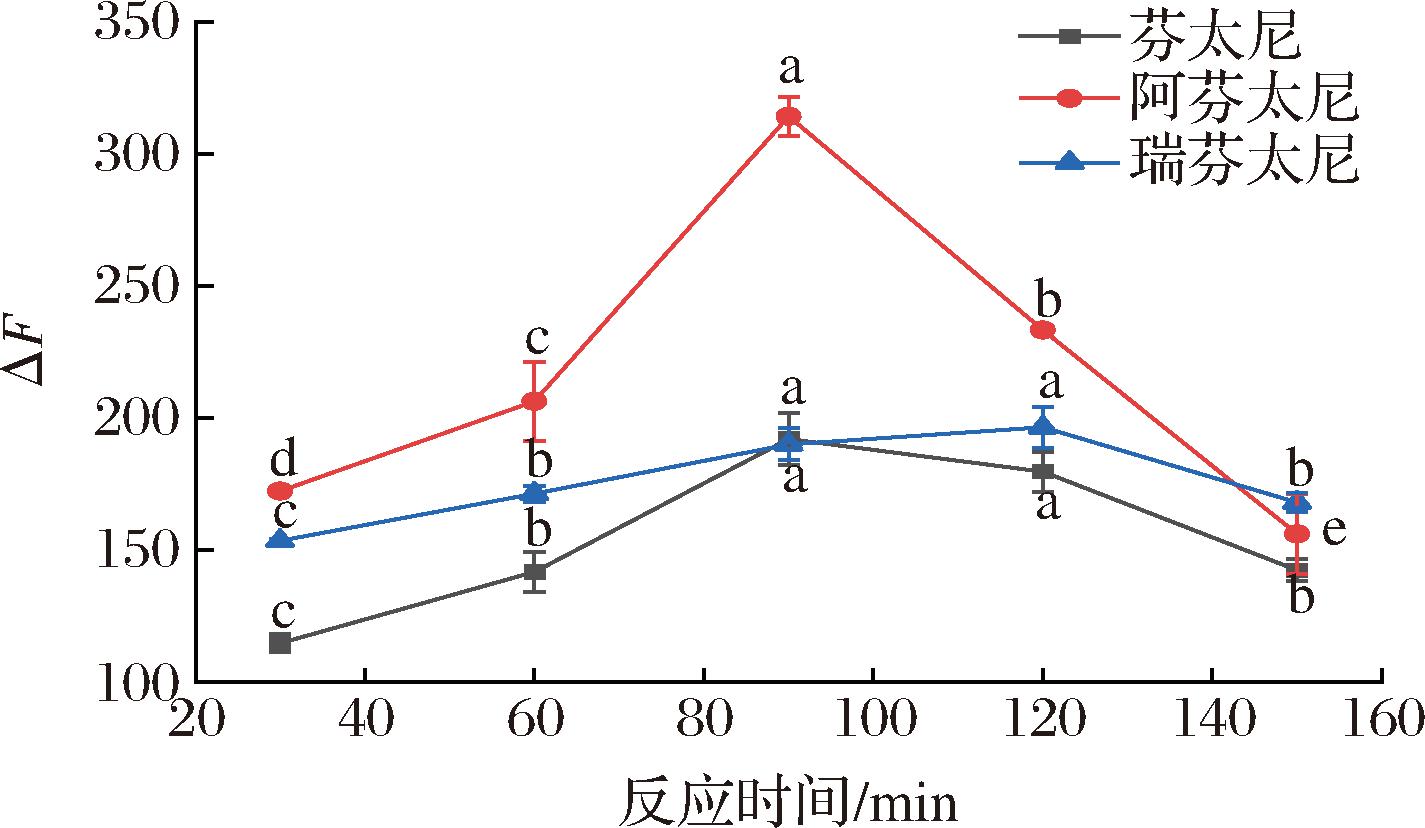
图10 反应时间对ΔF的影响
Fig.10 Effect of reaction time on ΔF
2.5 方法学评价
2.5.1 线性范围和检测限
按照1.3.4节中方法进行计算线性范围和检测限的计算。芬太尼总量为100~500 μg/L质量浓度时,该传感器芬太尼总量的质量浓度与荧光强度有较好的线性关系,线性方程为Y=0.503 8X-1.016,R=0.997 7,检测限为19.7 μg/L。对比现有芬太尼类物质快速检测方法[17-20,22-26],本方法线性范围较宽,灵敏度较高。
2.5.2 精密度
按照1.3.4节中方法进行传感器批间精密度的计算。结果如表2所示,相对标准偏差(relative standard deviation,RSD)(n=3)为5.91%~7.51%,均小于10%,说明本方法精密性良好。
表2 不同芬太尼总量的检测值
Table 2 Test values for different amounts of fentanyl

添加量/(μg/L)荧光强度(mean±SD)RSD/%20095.03±6.15 6.47300143.5±10.787.51400192.1±11.355.91
2.5.3 检测时间和准确度
在最佳实验条件下进行多次实验,该荧光适配传感器对芬太尼类物质的检测可以在150 min内完成,可以满足芬太尼类物质的快速筛查。
表3显示,实际样品检测本地抽样的水样中均未检出芬太尼类物质,非居民用水水样中加标回收率为81.14%~91.54%,在居民用水水样中加标回收率为106.7%~117.4%,可能是由于居民用水中除芬太尼类物质外还含有能与该适配体结合的干扰物质,回收率较高,但均在120%以内,符合快速检测技术要求,具有较好的准确度,可用于实际样品的检测。
表3 芬太尼类物质的加标回收率
Table 3 Standard recoveries of different total amounts of fentanyl
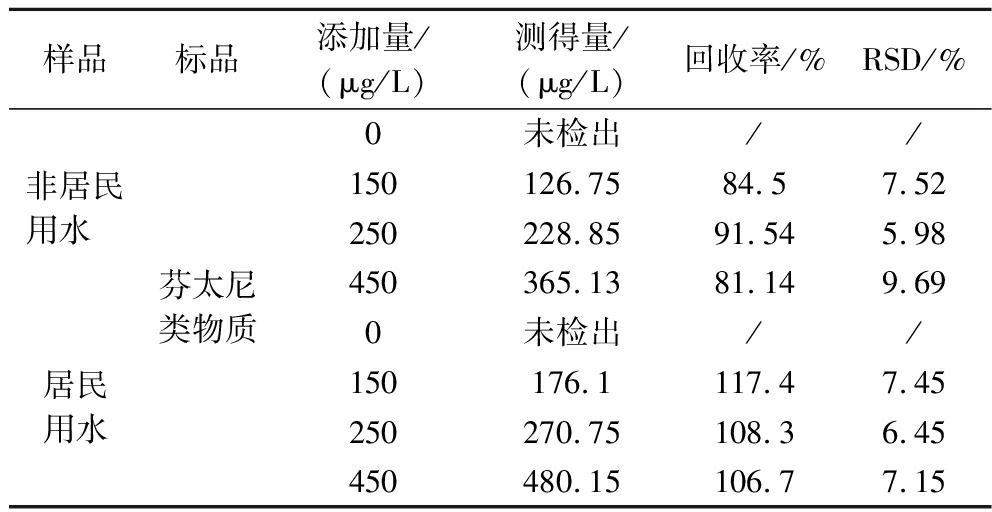
样品标品添加量/(μg/L)测得量/(μg/L)回收率/%RSD/%非居民用水 居民用水芬太尼类物质0未检出//150126.7584.57.52250228.8591.545.98450365.1381.149.690未检出//150176.1117.47.45250270.75108.36.45450480.15106.77.15
注:/表示无数据。
3 讨论
本研究在列管芬太尼类物质检测过程缺乏类特异性识别元件的情况下,以芬太尼、阿芬太尼、瑞芬太尼3种典型芬太尼类物质的等比例混合物模拟总芬太尼,研究采用芬太尼类物质可以产生氢键的芳香环结构类似物的裁剪适配体作为类特异性物质识别元件,以Fe3O4作为猝灭剂和磁分离剂,以FAM作为信号分子,构建了荧光传感平台对芬太尼总量进行广谱检测,检测线性范围为100~500 μg/L,检测限低至19.7 μg/L,具有较高的灵敏度,精密度在10%以内,准确度为80%~120%,可以初步满足芬太尼类物质现场快速筛查需求。未来可采用其他芬太尼混合物继续进行深入研究和验证。另外,深入研究列管芬太尼类物质的结构,针对性制备结构类特异性的适配体、抗体等识别分子是未来发展的一大趋势,这将为建立更加灵敏、准确的芬太尼类物质总量快速筛查方法、实现整类芬太尼类物质的有效检测做支撑。
[1] 李泽华, 王凯, 徐斌, 等.芬太尼及其衍生物的代谢转化研究进展[J].中国药理学与毒理学杂志, 2021, 35(3):223-234.
LI Z H, WANG K, XU B, et al.Advances in metabolic transformation of fentanyls[J].Chinese Journal of Pharmacology and Toxicology, 2021, 35(3):223-234.
[2] 张信仁. 液相色谱-串联质谱法检测食品中芬太尼类新精神活性物质[J].化学分析计量, 2023, 32(4):30-34.
ZHANG X R.Determination of fentanyl new psychoactive substances in food by liquid chromatography-tandem mass spectrometry[J].Chemical Analysis and Meterage, 2023, 32(4):30-34.
[3] 注意啦!披着饮料“外衣”这种含毒“上头潮饮”不能碰.中国食品安全网[EB/OL].https://www.cfsn.cn/2023/06/25/99367724.html.2023-06-25.
[4] “不给糖就捣蛋”——万圣节的糖可不能乱吃哦~.湖南禁毒宣传网络[EB/OL].https://mp.weixin.qq.com/s/mo1E7XVdZw7-MKPEVmUMcw.2022-10-31.
[5] 去年我国缴获毒品近90吨!男子吸毒后致幻 竟挥刀砍向家人!.央视新闻[EB/OL].https://mp.weixin.qq.com/s/duyp1QLdTz6X-tHMRr-DGg.2018-06-25.
[6] YE J F, WANG S, ZHANG Y J, et al.Surface-enhanced shifted excitation Raman difference spectroscopy for trace detection of fentanyl in beverages[J].Applied Optics, 2021, 60(8):2354-2361.
[7] XU L, WANG Y, WU D F, et al.Identification and monitoring of fentanyls-related substances in east China sewage water samples by LC-MS for drug enforcement[J].Science of the Total Environment, 2021, 797:149109.
[8] KAMIKA I, AZIZI S, MULEJA A A, et al.The occurrence of opioid compounds in wastewater treatment plants and their receiving water bodies in Gauteng province, South Africa[J].Environmental Pollution, 2021, 290:118048.
[9] SHOFF E N, ZANEY M E, KAHL J H, et al.Qualitative identification of fentanyl analogs and other opioids in postmortem cases by UHPLC-ion trap-MSn[J].Journal of Analytical Toxicology, 2017, 41(6):484-492.
[10] 吴健美, 乔宏伟, 刘文婧, 等.人毛发中36种芬太尼类物质的HPLC-MS/MS检测方法[J].中国司法鉴定, 2021(1):48-53.
WU J M, QIAO H W, LIU W J, et al.Determination of 36 fentanyl analogs in human hair by HPLC-MS/MS[J].Chinese Journal of Forensic Sciences, 2021(1):48-53.
[11] 罗耀, 张建莹, 黄昌雄, 等.液相色谱-串联质谱法测定固体及液体药物中27种新型毒品芬太尼类物质[J].分析测试学报, 2020, 39(4):427-433.
LUO Y, ZHANG J Y, HUANG C X, et al.Determination of 27 novel fentanyl analogs and metabolites in solid and liquid drugs by liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis, 2020, 39(4):427-433.
[12] 阎仁信, 石建忠, 朱国玉.UPLC-MS/MS检验尿液中7种芬太尼类物质[J].中国法医学杂志, 2020, 35(3):286-289.
YAN R X, SHI J Z, ZHU G Y.Simultaneous screening for 7 fentanyl analogues in urine by UPLC-MS/MS[J].Chinese Journal of Forensic Medicine, 2020, 35(3):286-289.
[13] QIAO J J, HU S D, CHEN L, et al.Cross-platform identification and classification of fentanyl analogs by tandem mass spectrometry (MS/MS)[J].Analytical Letters, 2023, 56(11):1727-1740.
[14] ANGI C, LURIE I S, MARGINEAN I.Analysis of fentanyl derivatives by ultra high performance liquid chromatography with diode array ultraviolet and single quadrupole mass spectrometric detection[J].Journal of Separation Science, 2019, 42(9):1686-1694.
[15] SMITH C D, GIORDANO B C, COLLINS G E.Assessment of opioid surrogates for colorimetric testing (Part I)[J].Forensic Chemistry, 2022, 27:100398.
[16] J KANGAS M.A new possible alternative colorimetric drug detection test for fentanyl[J].Organic &Medicinal Chemistry International Journal, 2017, 4(4):555645.
[17] O′NEAL C L, CROUCH D J, FATAH A A.Validation of twelve chemical spot tests for the detection of drugs of abuse[J].Forensic Science International, 2000, 109(3):189-201.
[18] MAO C L, ZIENTEK K D, COLAHAN P T, et al.Development of an enzyme-linked immunosorbent assay for fentanyl and applications of fentanyl antibody-coated nanoparticles for sample preparation[J].Journal of Pharmaceutical &Biomedical Analysis, 2006,41(4):1332-1341.
[19] WHARTON R E, CASBOHM J, HOFFMASTER R, et al.Detection of 30 fentanyl analogs by commercial immunoassay kits[J].Journal of Analytical Toxicology, 2021, 45(2):111-116.
[20] RUANGYUTTIKARN W, LAW M Y, ROLLINS D E, et al.Detection of fentanyl and its analogs by enzyme-linked immunosorbent assay[J].Journal of Analytical Toxicology, 1990, 14(3):160-164.
[21] MCCRAE K, TOBIAS S, GRANT C, et al.Assessing the limit of detection of Fourier-transform infrared spectroscopy and immunoassay strips for fentanyl in a real-world setting[J].Drug and Alcohol Review, 2020, 39(1):98-102.
[22] NORMAN C, MARLAND V, MCKENZIE C, et al.Evaluation of fentanyl immunoassay test strips for rapid in-situ detection of fentanyl and fentanyl analogs in seized samples and alternative matrices[J].The International Journal of Drug Policy, 2023, 118:104102.
[23] LEI X L, XU X X, LIU L Q, et al.Rapid quantitative determination of fentanyl in human urine and serum using a gold-based immunochromatographic strip sensor[J].Journal of Materials Chemistry.B, 2020, 8(37):8573-8584.
[24] GOZDZIALSKI L, RAMSAY M, LARNDER A, et al.Fentanyl detection and quantification using portable Raman spectroscopy in community drug checking[J].Journal of Raman Spectroscopy, 2021, 52(7):1308-1316.
[25] ARMENIAN P, VO K T, BARR-WALKER J, et al.Fentanyl, fentanyl analogs and novel synthetic opioids:A comprehensive review[J].Neuropharmacology, 2018, 134:121-132.
[26] WANG H, XUE Z L, WU Y X, et al.Rapid SERS quantification of trace fentanyl laced in recreational drugs with a portable raman module[J].Analytical Chemistry, 2021, 93(27):9373-9382.
[27] 中华人民共和国公安部禁毒局.关于将芬太尼类物质列入《非药用类麻醉药品和精神药品管制品种增补目录》的公告[EB/OL].000000000/2023-00426.2019-03-12.https://app.mps.gov.cn/gdnps/pc/content.jsp?id=9218851
[28] MURRAY R A, DOERING P L, BOOTHBY L A, et al.Putting an ecstasy test kit to the test:Harm reduction or harm induction?[J].Pharmacotherapy:The Journal of Human Pharmacology and Drug Therapy, 2003, 23(10):1238-1244.
[29] 张丽娜, 赵鹏, 田国英, 等.利用SELEX技术筛选小檗碱核酸适配体及其亲和力表征[J].北京化工大学学报(自然科学版), 2018, 45(6):48-52.
ZHANG L N, ZHAO P, TIAN G Y, et al.Systematic evolution of ligands by exponential enrichment (SELEX) screening and affinity characterization of berberine aptamers[J].Journal of Beijing University of Chemical Technology (Natural Science Edition), 2018, 45(6):48-52.
[30] XU J B, PENG J Y, WANG X T, et al.Enhanced peroxidase-like activity of Fe3O4@ MIL-100 (Fe) aroused by ATP for one-step colorimetric sensing toward cholesterol[J].ACS Sustainable Chemistry &Engineering, 2022, 10(29):9315-9324.
[31] 郭婷, 林淑凤, 马良, 等.基于磁性纳米材料和适配体的荧光传感器检测牛奶中黄曲霉毒素M1[J].食品与发酵工业, 2019, 45(5):218-223.
GUO T, LIN S F, MA L, et al.A fluorescent biosensor based on magnetic nanoparticles and aptamer for detecting AFM1 in milk[J].Food and Fermentation Industries, 2019, 45(5):218-223.
[32] YANG Y Y, LIU S Y, SHI P H, et al.A highly sensitive and selective label-free electrochemical biosensor with a wide range of applications for bisphenol A detection[J].Electroanalysis, 2022, 34(4):743-751.
[33] JIA M, SHA J Y, LI Z H, et al.High affinity truncated aptamers for ultra-sensitive colorimetric detection of bisphenol A with label-free aptasensor[J].Food Chemistry, 2020, 317:126459.
[34] GUCKIAN K M, SCHWEITZER B A, REN R X F, et al.Factors contributing to aromatic stacking in water:Evaluation in the context of DNA[J].Journal of the American Chemical Society, 2000, 122(10):2213-2222.
[35] 程芳琴, 张亚宁, 常慧敏, 等.紫外分光光度法测定盐湖卤水中钙镁离子含量[J].无机盐工业, 2006,38(4):54-56.
CHENG F Q, ZHANG Y N, CHANG H M, et al.UV spectrophotometric determination of magnesium and calcium in brine from salt lake[J].Inorganic Chemicals Industry, 2006,38(4):54-56.
[36] 崔杏雨, 秦育红, 田艳青, 等.用国产离子色谱仪测定几种水样中的钠、铵、钾离子[J].化学试剂, 2005,27(8):487-488.
CUI X Y, QIN Y H, TIAN Y Q, et al.Determination of Na+, ![]() and K+ in water by ion chromatography[J].Chemical Reagents, 2005,27(8):487-488.
and K+ in water by ion chromatography[J].Chemical Reagents, 2005,27(8):487-488.
[37] HUANG P J J, LIU J W.Flow cytometry-assisted detection of adenosine in serum with an immobilized aptamer sensor[J].Analytical Chemistry, 2010, 82(10):4020-4026.
[38] RUSSO KRAUSS I, MERLINO A, RANDAZZO A, et al.High-resolution structures of two complexes between thrombin and thrombin-binding aptamer shed light on the role of cations in the aptamer inhibitory activity[J].Nucleic Acids Research, 2012, 40(16):8119-8128.
[39] AMANO R, TAKADA K, TANAKA Y, et al.Kinetic and thermodynamic analyses of interaction between a high-affinity RNA aptamer and its target protein[J].Biochemistry, 2016, 55(45):6221-6229.
[40] PARK H, KWON N, PARK G, et al.Fast-response electrochemical biosensor based on a truncated aptamer and MXene heterolayer for West Nile virus detection in human serum[J].Bioelectrochemistry, 2023, 154:108540.