近年来,氰化物的污染事件不断发生,尤其是工业废水、一些食物和蔬菜如土豆、木薯、杏、李子、杏仁和苦味种子等类食品、蒸馏酒及其配制酒等样品中的氰化物对人类健康及环境安全造成严重威胁,对公共安全事件的监督和管理机制提出严峻的挑战[1-5]。CN-通过与细胞色素氧化酶的铁(Ⅲ)离子结合,可以抑制呼吸,改变呼吸系统和中枢神经系统的正常活动。世界卫生组织建议,饮用水中氰化物的含量不应超过1.9 μmol/L[3]。美国环境保护署规定饮用水中氰化物的上限为7.8 μmol/L[6]。食品安全国家标准规定包装饮用水、植物蛋白饮料、固体饮料、饮料(适用于杏仁或杏仁制品饮料)及代用茶中氰化物限量≤0.05 mg/L,白酒及蒸馏酒中氰化物限量≤2.0 mg/L。考虑到氰化物在生理系统中的毒性和生态问题,建立一种快速、灵敏、经济、环保的氰化物的快速检测方法具有重要的学术价值和社会意义[7]。
目前,氰化物检测方法主要有气相色谱法[8]、液相色谱-质谱法[9]、离子色谱法[3]等,MATEUS等[10]用柱前衍生高效液相色谱-质谱法测定血液中氰化物;刘芯韵等[11]建立了离子色谱法测定氰化物的检测方法。对于氰化物检测虽然国内外有研究报道,但这些方法在检测基质复杂的样品时,对样品的前处理技术要求高,导致检测效率低,基质干扰大,回收率低,易出现假阳性等,且实验操作必须在实验室进行,无法实现现场可视化快速检测,严重降低了氰化物检测的时效性[12]。目前,针对蒸馏酒及其配制酒、木薯、包装饮用水和矿泉水等基质简单的食品,可按照国家标准GB 5009.36—2023《食品安全国家标准 食品中氰化物的测定》进行检测。对于基质较为复杂的工业废水、杏仁类食品、乳品、啤酒中氰化物的检测,目前还没有相应的国家标准方法,据课题组所查阅的文献所示,对氰化物可视化快速检测文献报道稀少。
新型比色和荧光传感器具有操作简单、成本低、效率高等特点,具有重要的应用价值[13]。CN-荧光传感器检测原理可以通过分子间/分子内电荷转移、激发态分子内电荷转移、激发态分子内质子转移、光诱导电子转移和荧光共振能量转移来解释[14]。这些机制取决于传感器的类型和传感器与CN-之间的相互作用,如氢键、去质子化、亲核加成、位移方法和金属有机框架[15]。宋逸群等对国内外快速可视化识别氰化物的方法研究进展进行了总结,主要总结了构筑的电化学传感和荧光探针分子水质样品中氰化物的快速检测。赵庆武等[16]通过氰电极与217型双液接饱和甘汞电极组成一对原电池,利用电动势与离子活度负对数值的关系,在无需建立标准曲线的情况下,可直接求出水样中氰化物浓度。WEI等[17]设计并合成了一种基于吩嗪的氰离子开启型荧光化学传感器。该传感器对纯水中的氰化物具有高灵敏度和良好的选择性,其他阴离子对探测行为几乎没有影响。龙凌亮等[2]根据分子内电荷转移机理,合理构建了氰化物荧光比率探针化合物,检出限为0.126 mmol/L,可以应用于天然水样中氰化物的检测。但是实际上像乳品、白酒、杏仁露等复杂样品及工业废水中通常也会检测出少量的氰化物,对人体健康和生态环境造成了越来越严重的影响,因此,加强对这些样品及工业废水中氰化物进行快速检测具有重要研究意义。本研究利用水溶性的荧光素异硫氰酸酯(fluorescein isothiocyanate,FITC)覆盖石墨烯负载金纳米粒子复合材料,使探针分子FITC的荧光猝灭;然后,通过向体系中加入氰化物后,CN-对金纳米粒子的强络合作用形成稳定的络合物Au(CN)3-x而使探针分子荧光逐渐恢复,以此实现对复杂样品中氰化物的可视化快速检测。
1 材料与方法
1.1 材料与试剂
异硫氰酸荧光素(99.7%),宁波新芝生物科技股份有限公司;磷酸钠(99.6%)、过氧化氢(99.8%),西安市永红化工原料公司;盐酸(99.2%)、氯金酸(99.5%),深圳市时得佳科技有限公司;氰化物标准溶液(99.9%),北京振翔科技有限公司。
1.2 仪器与设备
CF16RXⅡ台式高速离心机,上海仪电科学仪器股份有限公司;涡旋振荡仪GENIUS3,常州国华电器有限公司;SB-100B超声波清洗机,苏州安泰空气技术有限公司;Talos F200X高分辨率透射电子显微镜,荷兰Philips-FEI公司;EDX-9000PRO荧光探测仪,无锡创想分析仪器有限公司。
1.3 实验方法
1.3.1 实验原理
荧光光化学传感器通常是借助具有特异性识别位点的荧光探针与氰化物作用检测氰化物,利用作用前后荧光探针的结构及光学性质的改变对氰化物进行定性和定量检测。如图1所示,光诱导电子转移荧光探针的连接体部分是非共轭键,激发态时荧光基团异硫氰酸酯与金纳米粒子存在着光诱导电子转移,对荧光有很强的猝灭作用。当向体系加入CN-时,CN-对金纳米粒子的强络合作用形成稳定的络合物Au(CN)3-x而使探针分子荧光逐渐恢复,以此实现对氰化物的快速可视化检测。
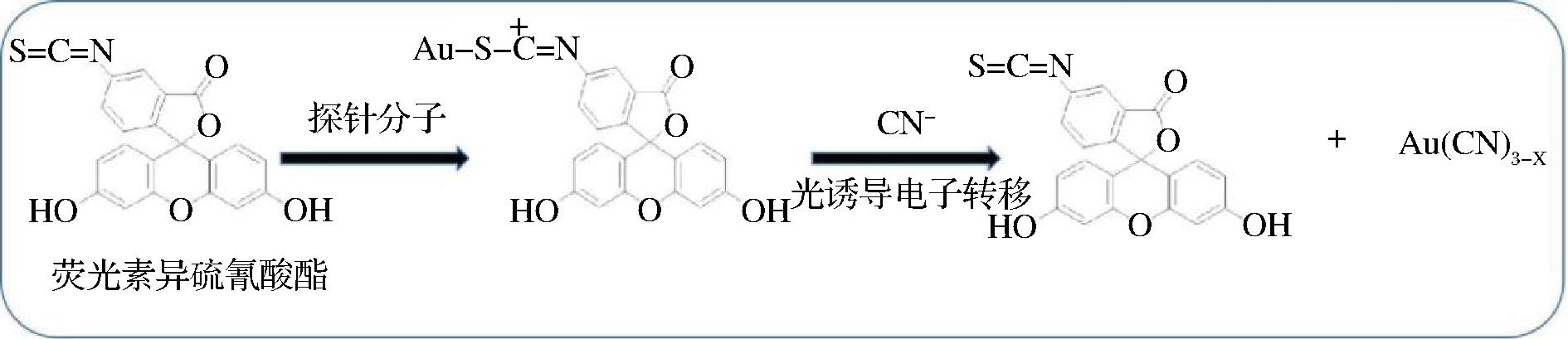
图1 光诱导电子转移识别机理
Fig.1 Recognition mechanism of photo induced electron transfer
1.3.2 石墨烯负载金纳米粒子复合材料的合成
在0.5 mL氧化石墨烯分散体(10 mg/L)和2 mL HAuCl4(40 mmol/L)的混合物中加入5 mL NaOH溶液(0.1 mol/L)。然后加入超纯水调节混合溶液的体积至100 mL,用锡纸包起来避光避超声放置8 h。将超声波溶液倒入干净的聚四氟乙烯衬里,将其置于180 ℃的反应釜中12 h。再自然冷却至室温后,成功制备了石墨烯/Au NPs复合材料。
1.3.3 氰化物阴离子的检测
一系列阴离子(0~10 μmol/L)FITC和石墨烯/Au NPs(0.5 nmol/L)的混合物(0.5 mL)在缓冲溶液(5 mmol/L磷酸钠,pH 10)中;在室温条件下平衡1 h,然后分别转移到96孔微滴板上。荧光光谱由Synergy 4型多模式微孔板阅读器记录。为了选择性测定CN-阴离子,在加入FITC-Au NPs探针之前,将掩蔽剂与阴离子溶液平衡10 min。
1.3.4 实际样品检测
称取一定量杏仁露和牛奶样品于50 mL离心管中,分别加入2 mL三氯醋酸(10 mmol/L)振荡 1 min,5 000 r/min下离心取上清液10 mL经0.2 μm膜过滤后备用。取等量上述制备好的杏仁露和牛奶上清液、白酒、饮用水等样品(用不同的代码标记)分别加入所需浓度的CN-标准溶液。然后,使用含有10 μmol/L的FITC,0.5 nmol/L的石墨烯/Au NPs和5 mmol/L磷酸钠(pH 10)的溶液将加标样品稀释至500 μL。加标样品的荧光光谱用Synergy 4型多模式微孔板读取仪记录。
2 结果与分析
2.1 石墨烯/Au NPs结构表征
图2-A显示了制备的氧化石墨烯、还原氧化石墨烯和石墨烯/Au NPs的紫外/可见吸收光谱。石墨烯/Au NPs的吸收光谱峰位于513 nm左右,表明Au NPs 的形成。Au NPs主要通过氧官能团或缺陷锚定在石墨烯表面。此外,石墨烯表面残留的带负电的氧官能团有利于石墨烯/Au NPs在水中的分散。图2-B和图2-C分别是制备的石墨烯/Au NPs复合材料的TEM图像和金纳米粒子粒径分布图,其中所有Au NPs均匀地锚定在石墨烯表面,且尺寸分布狭窄,金纳米粒子大小为10~20 nm。

A-氧化石墨烯、还原氧化石墨烯(rGO)和石墨烯/Au NPs的紫外/可见吸收光谱;B-石墨烯/Au NPs的透射电镜图;C-金纳米粒子的粒径分布图
图2 石墨烯/ Au NPs结构表征
Fig.2 Structural characterization of graphene/Au NPs
2.2 石墨烯/ Au NPs对荧光素异硫氰酸酯的猝灭效果研究
为了获得更好的传感性能,对石墨烯/Au NPs的浓度和反应时间进行了优化。由图3-A可以看出,随着石墨烯/Au NPs浓度的增加,FITC的发光强度逐渐降低,在添加石墨烯/Au NPs约30 μL时达到平稳。接下来,本试验进一步研究了反应时间对发光信号的影响。加入氰化物离子后,发光信号迅速增加,6 min后趋于稳定(图3-B)。这表明氰化物离子与金纳米粒子之间的化学反应是迅速的。因此,为了保证石墨烯/Au NPs在低浓度氰化物条件下也能与氰化物完全反应,将反应时间设定为10 min。
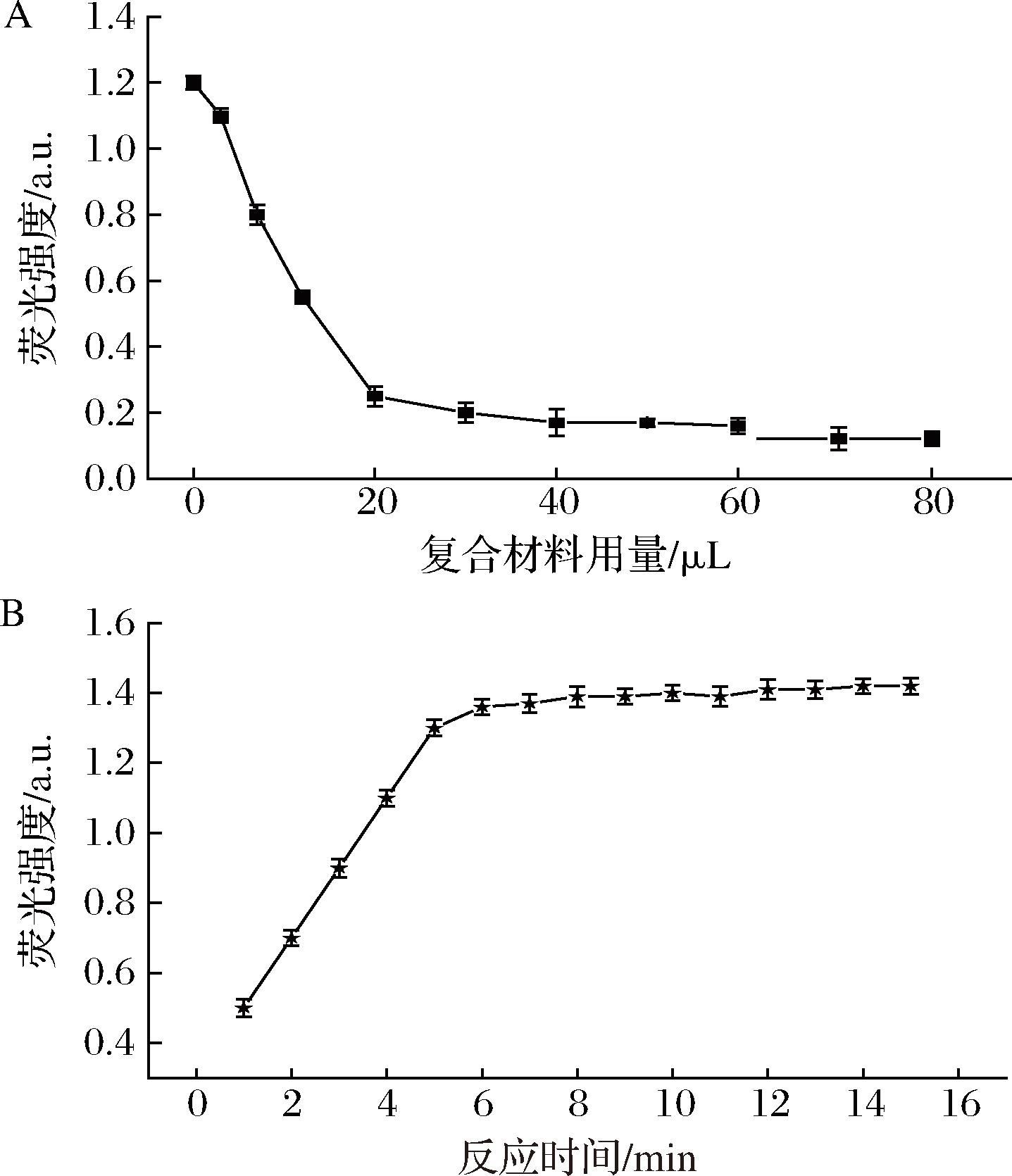
A-石墨烯/Au NPs对荧光素异硫氰酸酯的猝灭效果; B-反应时间对荧光强度的影响
图3 石墨烯/Au NPs对荧光素异硫氰酸酯的猝灭效果
Fig.3 Quenching effect of graphene/Au NPs on fluorescein isothiocyanate ester

A-溶液缓冲体系;B- PBS缓冲液浓度;C-pH值图谱
图4 不同缓冲体系、离子强度和pH条件下对氰化物的感知能力
Fig.4 Sensitivity to cyanide in different buffer systems, ionic strength, and pH
2.3 缓冲体系的选择
为了检验制备的荧光探针的实用性,还研究了它在不同缓冲体系、离子强度和pH条件下对氰化物的感知能力。结果表明,在纯水、PBS缓冲液(10 mmol/L,pH 7.4)、Tris-HCl(10 mmol/L,pH 7.4)和HEPES缓冲液(10 mmol/L,pH 7.4)的体系中可以实现相似的信噪比(图4-A)。离子强度方面,该探针在0~20 mmol/L PBS缓冲液中具有较高的传感性能,在30 mmol/L PBS缓冲液中,由于Au NPs的容易聚集,传感性能略有下降(图4-B)。同时,感知能力对pH值在5~10内较为敏感(图4-C)。当pH值为7或8时,发光信号最好。
2.4 选择性和稳定性
在优化条件下,对不同浓度氰化物的分析性能进行了评价。由图5-A可以清楚地观察到体系的荧光强度随着氰化物浓度的增加而增加。在0.05~80 μmol/L氰化物浓度,两者呈良好的线性关系(图5-B)。该方法的检出限为0.036 μmol/L(3σ,n=6),灵敏度高于已有的纳米颗粒氰化物测定方法[18-19]。因此,本方法具有线性范围好,检出限低,用量少,回收率高等优势。
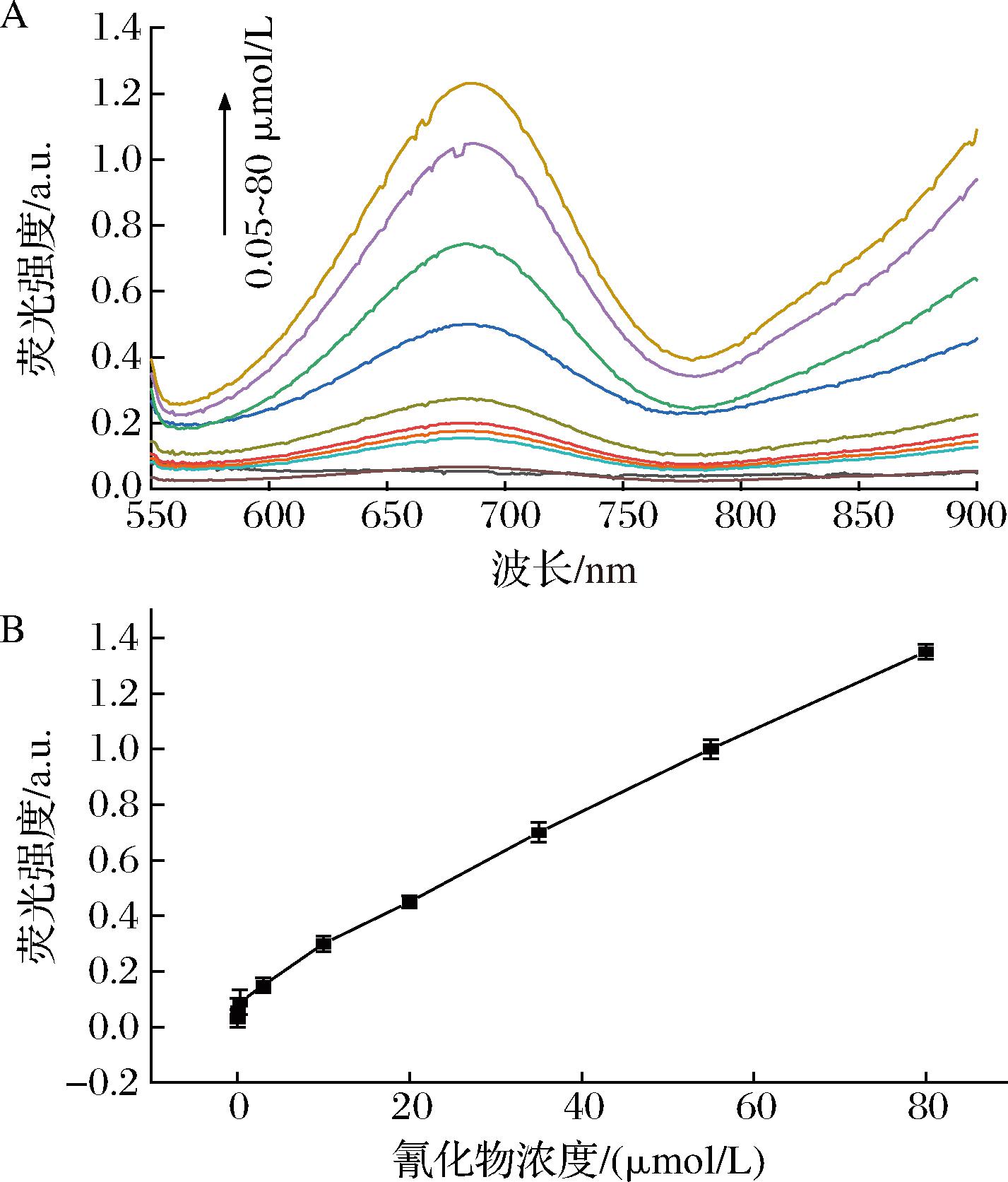
A-不同浓度氰化物的分析性能评价图谱;B-相应的线性关系
图5 不同浓度氰化物的性能分析
Fig.5 Performance analysis of cyanide with different concentration
为了测试该氰化物分析平台的选择性,本试验研究了其他一些常见阴离子![]()
![]() 和金属离子(K+、Na+、Ca2+、Mg2+、Zn2+、Cu2+、Fe2+、Mn2+、Al3+、Hg2+)作为干扰物。在16个混合阴离子(图6-A)或10个混合金属离子(图6-B)存在的情况下,干扰剂浓度比氰化物(100 μmol/L)高出10倍(1 mmol/L),结果显示干扰剂对传感探针的发光信号几乎没有影响。这表明该分析对氰化物的选择性高于其他阴离子和金属离子,这是由于在氰化物中CN之间为三键,sp杂化,N原子端电负性很强,把C原子端电子云大量极高的吸附过去,形成的CN偶极矩很高,使C原子端具有很强的正电荷,CN-导致C原子端稳定常数形成一孤对电子,该孤对电子容易被金属的d空轨道俘获形成配位[Au+0.5O2+2CN-+
和金属离子(K+、Na+、Ca2+、Mg2+、Zn2+、Cu2+、Fe2+、Mn2+、Al3+、Hg2+)作为干扰物。在16个混合阴离子(图6-A)或10个混合金属离子(图6-B)存在的情况下,干扰剂浓度比氰化物(100 μmol/L)高出10倍(1 mmol/L),结果显示干扰剂对传感探针的发光信号几乎没有影响。这表明该分析对氰化物的选择性高于其他阴离子和金属离子,这是由于在氰化物中CN之间为三键,sp杂化,N原子端电负性很强,把C原子端电子云大量极高的吸附过去,形成的CN偶极矩很高,使C原子端具有很强的正电荷,CN-导致C原子端稳定常数形成一孤对电子,该孤对电子容易被金属的d空轨道俘获形成配位[Au+0.5O2+2CN-+![]() 金与氰根离子具有极高的络合稳定常数
金与氰根离子具有极高的络合稳定常数![]() 远高于金与其他阴离子或化合物络合稳定常数,金与氰根离子的平衡常数K=4.9×1075,说明反应较为完全。因此,相比氰离子(CN-),其他阴离子或者食品中存在的化合物与金络合作用弱或者形成了不稳定的络合物。
远高于金与其他阴离子或化合物络合稳定常数,金与氰根离子的平衡常数K=4.9×1075,说明反应较为完全。因此,相比氰离子(CN-),其他阴离子或者食品中存在的化合物与金络合作用弱或者形成了不稳定的络合物。
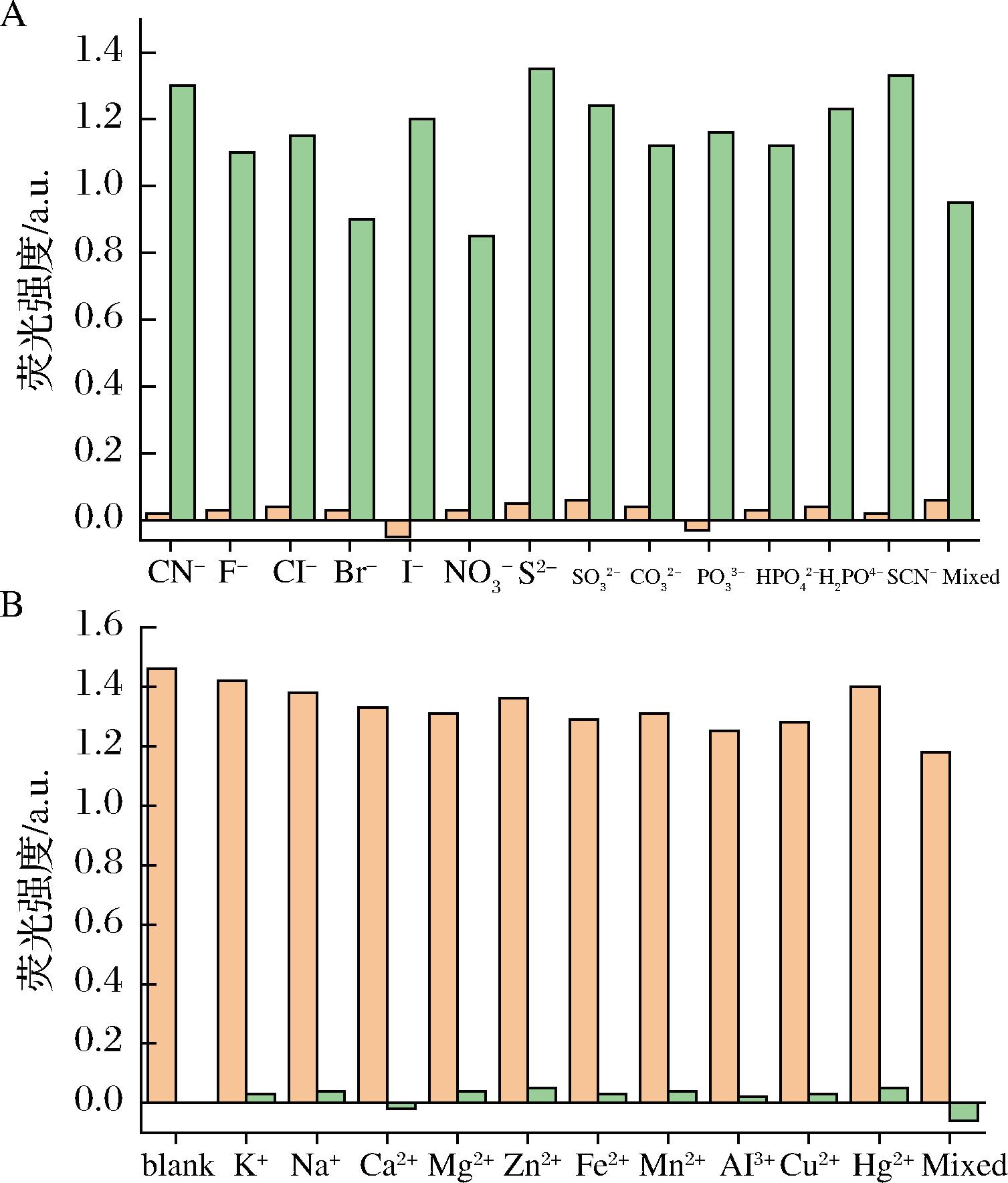
A-不同阴离子(1 mmol/L)在有氰化物(100 μmol/L,绿条)和 无氰化物(橙条);B-不同金属离子(1 mmol/L)在无氰化物 (绿条)和有氰化物(100 μmol/L,橙条)
图6 不同阴离子和金属离子情况下石墨烯/Au NPs的 发光响应图谱
Fig.6 Luminescence response map of graphene/Au NPs with different anions and metal ions
本试验进一步探索了该传感探针在实际样品中可靠性和准确性,选取白酒、工业废水、牛奶、杏仁露等4种阴性样品为研究对象,采用加标回收方法探索该传感探针在实际样品中可靠性和准确性。称取每一种样品3份,依次编号杏仁露为:A1、A2、A3,白酒为:B1、B2、B3,饮用水为:C1、C2、C3,牛奶为:D1、D2、D3。氰化物标准加标浓度依次为5、10、20 μmol/L,每一个点重复测6次,取其平均值。在样品中获得了98.20%~103.60%的平均回收率(表1),表明所开发的传感探针在实际常检出氰化物样品中具有一定的可靠性和准确性。
表1 不同样品中氰化物的分析结果
Table 1 Analysis results of cyanide in different sample
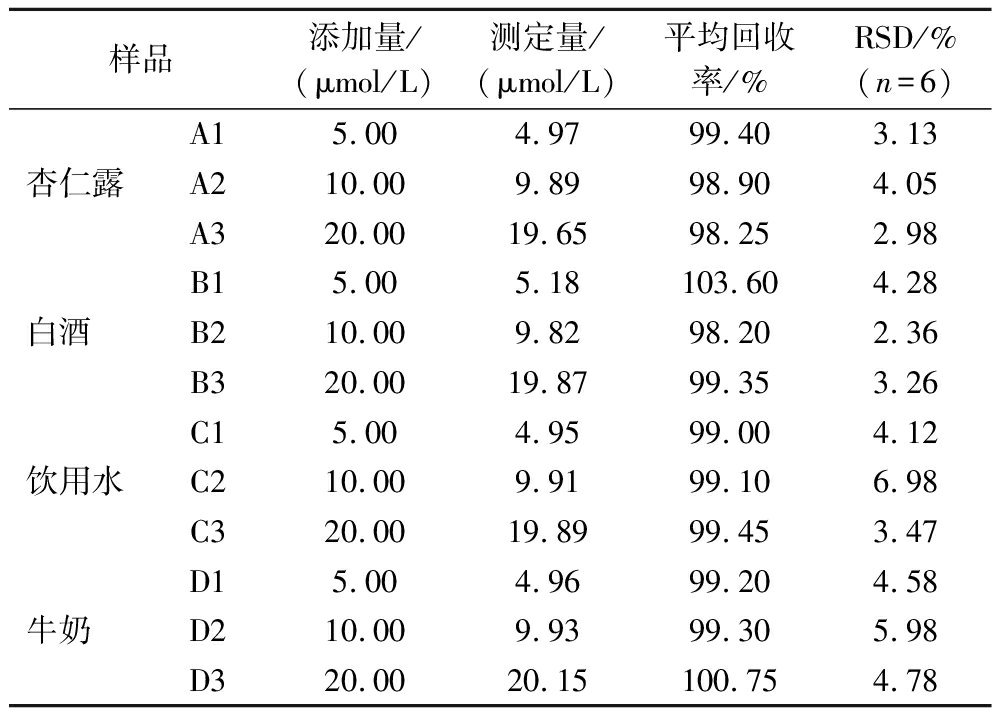
样品添加量/(μmol/L)测定量/(μmol/L)平均回收率/%RSD/%(n=6)A15.004.9799.403.13杏仁露A210.009.8998.904.05A320.0019.6598.252.98B15.005.18103.604.28白酒 B210.009.8298.202.36B320.0019.8799.353.26C15.004.9599.004.12饮用水C210.009.9199.106.98C320.0019.8999.453.47D15.004.9699.204.58牛奶 D210.009.9399.305.98D320.0020.15100.754.78
2.5 实际样品的检测
以上研究证明该荧光探针对氰化物的检测具有很高的灵敏度和选择性,但食物样品成分复杂,因此,本研究选取了白酒、杏仁露、饮用水等较易出现氰化物含量超标的食物样品作为代表,将该荧光探针法与国标(GB 5009.36—2023《食品安全国家标准 食品中氰化物的测定》、GB/T 5750.5—2023《生活饮用水标准检验方法 第5部分:无机非金属指标》)检测方法进行对比研究,以确定该方法的准确度。由表2可知,本研究的荧光探针方法与国标方法相比,在对白酒中氰化物检测上,误差率为1.94%,饮用水、杏仁露的误差率相对稍微高点,分别为7.69%和3.92%,原因主要为该类食品中氰化物的含量非常低,但即使有略高的误差值,其结果也完全不会影响到对食品中氰化物含量的判定。因此,从表2中的对比研究数据可以确定,本研究中的荧光探针方法能准确检测食品中氰化物的含量,其准确度与国标(GB 5009.36—2023《食品安全国家标准 食品中氰化物的测定》、GB/T 5750.5—2023《生活饮用水标准检验方法 第5部分:无机非金属指标》)检测方法一致。
表2 荧光探针对实际样品的检测
Table 2 Detection of cyanide in real sample
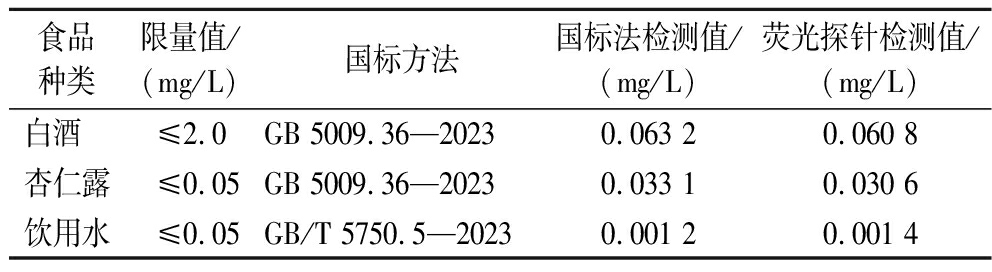
食品种类限量值/(mg/L)国标方法国标法检测值/(mg/L)荧光探针检测值/(mg/L)白酒 ≤2.0GB 5009.36—20230.063 20.060 8杏仁露≤0.05GB 5009.36—20230.033 10.030 6饮用水≤0.05GB/T 5750.5—20230.001 20.001 4
3 结论
本试验利用石墨烯/Au NPs和荧光素异硫氰酸酯开发了一个简单、快速、灵敏的荧光探针传感平台用于复杂样品中氰化物的可视化快速测定。试验结果表明,该荧光探针传感平台对氰化物的最低检出限为0.032 μmol/L,在0.05~80 μmol/L氰化物浓度内具有良好的线性关系,平均回收率为98.20%~103.60%,相对标准偏差<10%,具有很好的选择性和稳定性,有望应用于其他复杂样品中氰化物的快速检测。
[1] MA J, DASGUPTA P K. 氰化物检测的最新进展[J]. 分析化学学报, 2010, 673(2): 117-125.
MA J, DASGUPTA PK. Recent developments in cyanide detection: A review[J]. Analytic Chimica Acta, 2010, 673(2): 117-125.
[2] 龙凌亮, 周丽萍, 王琳. 一种高选择性灵敏的氰化物荧光比色探针及其在天然水和生物样品中氰化物检测中的应用[J]. 分析方法, 2013, 5(23): 6605-6610.
LONG L L, ZHOU L P, WANG L. A highly selective and sensitive fluorescence ratiometric probe for cyanide and its application for the detection of cyanide in natural water and biological samples[J]. Analytical Methods, 2013, 5(23): 6605-6610.
[3] TAHERI A, NOROOZIFAR M, KHORASANI M. 于三维溶胶-凝胶嵌入Ag纳米颗粒的新型电化学氰化物传感器的研究[J]. 电分析化学杂志, 2009, 628 (1): 48-54. TAHERI A, NOROOZIFAR M, KHORASANI M. Investigation of a new electrochemical cyanide sensor based on Ag nanoparticles embedded in a three-dimensional sol-gel[J]. Journal of Electroanalytical Chemistry, 2009, 628(1): 48-54.
[4] 牛力, 罗冠龙, 王婧. 白酒中氰化物的测定及不确定度的评定[J]. 酿酒, 2020, 47(2):100-103.
NIU L, LUO G L, WANG J. Determination of cyanide in liquor and evaluation of uncertainty[J]. Liquor Making, 2020, 47(2):100-103.
[5] 丁国强, 周辉, 徐建伟, 等. 用含苯并噻二唑的共轭共聚物电荧光法检测氰化物阴离子[J]. 化学通讯, 2014, 50(6): 655-657. DING G Q, ZHOU H, XU J W, et al. Electrofluorochromic detection of cyanide anions using a benzothiadiazole-containing conjugated copolymer[J]. Chemical Communications, 2014, 50(6): 655-657.
[6] 刘舒治, 杨敏, 刘毅江, 等. 基于三苯基咪唑半菁染料的新型“开启”荧光探针比色法检测100%水溶液中的CN-[J]. 危险材料, 2018, 344: 875-882.
LIU S Z, YANG M, LIU Y, et al. A novel “turn-on” fluorescent probe based on triphenylimidazole-hemicyanine dyad for colorimetric detection of CN- in 100% aqueous solution[J]. Journal of Hazardous Materials, 2018, 344: 875-882.
[7] TIGREROS A, ROSERO H A, CASTILLO J C, et al. 吡唑并[1,5-a]嘧啶-半花青体系作为比色和荧光化学传感器用于水中氰化物识别[J]. Talanta, 2018, 196: 395-401.
TIGREROS A, ROSERO H A, CASTILLO J C, et al. Integrated pyrazolo[1,5-a] pyrimidine-hemicyanine system as a colorimetric and fluorometric chemosensor for cyanide recognition in water[J]. Talanta, 2018, 196: 395-401.
[8] 何海茵, 李南, 熊含鸿, 等. 顶空气相色谱-质谱法测定白酒中的氰化物含量[J]. 食品安全质量检测学报, 2019, 10(13):4068-4073.
HE H Y, LI N, XIONG H H, et al. Determination of cyanide in liquor by headspace gas chromatography-mass spectrometry[J]. Journal of Food Safety &Quality, 2019, 10(13):4068-4073.
[9] 孟梁, 申贵隽, 张强. 金属配位剂衍生-高效液相色谱法测定粮食及白酒中的游离氰化物[J]. 分析科学学报, 2009, 25(5):587-589.
MENG L, SHEN G J, ZHANG Q. Metal-ligand reagent derivatization and high-performance liquid chromatography determination for free cyanide analysis[J]. Journal of Analytical Science, 2009, 25(5):587-589.
[10] LINDSAY A E, GREEBAUM AR, O’HARE D. 健康受试者和火灾受害者血液和公布的血液氰化物浓度的分析技术[J].分析化学学报, 2004, 511: 185-195.
LINDSAY A E, GREEBAUM A R, O’HARE D. Analytical techniques for cyanide in blood and published blood cyanide concentrations from healthy subjects and fire victims[J]. Analytic Chimica Acta, 2004, 511: 185-195.
[11] 刘芯韵, 张坤, 易啸, 等. 离子色谱法测定蒸馏酒中氰化物含量的方法性能分析[J]. 食品与发酵科技, 2017, 53(2):94-95; 126.
LIU X Y, ZHANG K, YI X, et al. Method performance analysis of determination of cyanide in distilled wines by ion chromatography[J]. Food and Fermentation Sciences &Technology, 2017, 53(2):94-95; 126.
[12] 黄华杰, 郭祥捷, 彦敏敏, 等. 在三维氮硫共掺杂石墨烯纳米带结构上生长的分散良好的Pt纳米颗粒:用于甲醇氧化的高活性电催化剂[J]. 材料能源, 2021, 21: 100814.
HUANG H J, GUO X J, YAN M, et al. Well-dispersive Pt nanoparticles grown on 3D nitrogen-and sulfur-codoped graphene nanoribbon architectures: highly active electrocatalysts for methanol oxidation[J]. Materials Today Energy, 2021, 21: 100814.
[13] 张贺, 李思容, 刘玉峰, 等. Fe3O4@GO磁性纳米复合材料保护间充质干细胞,促进大鼠骨髓间充质细胞向成骨分化[J]. 生物材料科学, 2020, 8 (21): 5984-5993.
ZHANGS H, LI S R, LIU Y F, et al. Fe3O4@GO magnetic nanocomposites protect mesenchymal stem cells and promote osteogenic differentiation of rat bone marrow mesenchymal stem cells[J]. Biomaterial Science, 2020, 8 (21): 5984-5993.
[14] 周彬彬, 张继红, 王芳斌, 等. 可视化分子探针的设计、合成及其对食品中氰化物的检测[J]. 食品科学, 2017, 38(12):304-309.
ZHOU B B, ZHANG J H, WANG F B, et al. Design, synthesis and application of colorimetric probe for cyanide detection in food[J]. Food Science, 2017, 38(12):304-309.
[15] 黄志成, 刘碧武, 刘觉文. 包覆部分磷酸铁壳提高金纳米粒子的过氧化物酶活性和稳定性[J]. 纳米尺度, 2020, 12 (44): 22467-22472.
HUANG Z C, LIU B W, LIU J W. Enhancing the peroxidase-like activity and stability of gold nanoparticles by coating a partial iron phosphate shell[J]. Nanoscale, 2020, 12 (44): 22467-22472.
[16] 赵庆武, 刘志新, 高坤, 等. 离子选择电极法测定生活饮用水中氰化物方法的研究[J]. 医学动物防制, 2018, 34(12):1172-1174. ZHAO Q W, LIU Z X, GAO K, et al. Study on the method of determining cyanide in drinking water by ion selective electrode[J]. Journal of Medical Pest Control, 2018, 34(12):1172-1174.
[17] 韦太宝, 李文婷, 李乔, 等. 开启式荧光化学传感器选择性检测纯水和食品样品中的氰化物[J]. Tetrahedron Letters, 2016, 57(25): 2767-2771.
WEI T B, LI W T, LI Q, et al. A turn-on fluorescent chemosensor selectively detects cyanide in pure water and food sample[J]. Tetrahedron Letters, 2016, 57(25): 2767-2771.
[18] PANJA S, PANJA A, GHOSH K. 氰化物传感中的超分子凝胶研究进展[J]. 材料化学前沿, 2021, 5 (2): 584-602.
PANJA S, PANJA A, GHOSH K. Supramolecular gels in cyanide sensing:A review[J]. Materials Chemistry Frontiers, 2021, 5(2): 584-602.
[19] LUCONI L, MERCURI G, ISLAMOGLU T, et al. 苯并噻唑功能化NU-1000:一种用于二氧化碳吸附和氰化物发光传感的通用材料[J]. 材料化学, 2020, 8 (22): 7492-7500.
LUCONI L, MERCURI G, ISLAMOGLU T, et al. Benzothiazolium-functionalized NU-1000: A versatile material for carbon dioxide adsorption and cyanide luminescence sensing[J]. Journal of Material Chemistry, 2020, 8 (22): 7492-7500.