纳米结构材料是指在一维上具有纳米尺度的材料,包括纳米颗粒、纳米棒、纳米线、具有纳米级厚度的薄膜以及具有纳米级构造的材料。纳米材料有着独特而新颖的功能特性,在食品领域已经得到了广泛的应用[1]。蛋白质属于两亲生物聚合物,当它受到外界环境的影响时,它的空间结构会发生部分展开,分子内的基团也会随之暴露出来,可通过共价键或非共价键相互作用来组装成具有更高分子质量的寡聚体或多聚体,形成纳米结构。因此,蛋白质被认为是一种制作纳米粒子的理想材料[2]。
丝素蛋白具有易于纯化、灭菌、无需使用化学交联剂的加工性、良好的生物相容性、可定制的生物降解性、低免疫原性和高稳定荷载能力等特性,因此备受广泛关注[3]。丝素蛋白可通过化学改性来改变表面性能,各种水性或有机溶剂加工方法也可用于生成丝素蛋白生物材料[4]。丝素蛋白溶液可以通过不同的方法加工以生产不同类型的递送系统,包括水凝胶、薄膜、支架、微球和纳米颗粒等[5]。其中丝素蛋白纳米颗粒的高表面体积比、可修饰和可调尺寸等特征[6],使其在食品领域中受到青睐。因此本文综述了丝素蛋白的结构与性质、丝素蛋白纳米颗粒的制备及其在食品领域的应用。
1 丝素蛋白结构与性质
1.1 结构
蚕丝蛋白主要由丝素蛋白和丝胶蛋白组成,丝素蛋白含量占65%~85%,丝胶蛋白占15%~35%[7]。丝素蛋白由3个基本亚基组成,即重链、轻链和P25基因编码的糖蛋白,2条链之间由二硫键连接,而P25编码的糖蛋白通过非共价疏水相互作用与它们连接[8],3个亚基的比例为6∶6∶1[9]。在丝素蛋白中,重链形成离散的β-折叠微晶,是优越机械性能的主要结构。此外,丝素蛋白的结晶形态也主要与重链有关,而轻链与丝素蛋白中结晶区域的形成无关。结构上,丝素蛋白重链由12个疏水结构域和11个亲水结构域组成,疏水结构域包含重复序列的氨基酸,亲水结构域包含非重复序列的氨基酸[10]。疏水结构域主要包括甘氨酸、丙氨酸、丝氨酸,以及较少的酪氨酸、缬氨酸和苏氨酸,它们以GSGAGA的方式排列[11],并组装成高度结晶的反平行式β-折叠结构[12],因此丝素蛋白中可形成高度有序的结晶区域。总之,丝素蛋白表现出结晶性和无定形。结晶区域赋予纤维强度和刚度,无定形区域赋予弹性[13]。
丝素蛋白的二级结构包括无规则卷曲、α-螺旋和β-折叠,其整体结构通过β-折叠之间的氢键来稳定[14]。丝素蛋白存在3种不同的结构形式:Silk Ⅰ、Silk Ⅱ和Silk Ⅲ。Silk Ⅰ是一种亲水性蛋白质,含有很大比例的α-螺旋结构以及无规则卷曲[15]。Silk Ⅱ具有高度有序的β-折叠结构,特别稳定且不溶于水,而Silk Ⅲ仅在水-空气界面占主导地位[7]。由于Silk Ⅱ结构稳定,不溶于水,不易被酸、碱和酶降解,具有很高的机械强度,生产中被大量应用。Silk Ⅰ结构在温度、有机溶剂、pH值、金属离子、物理剪切、电磁场等条件作用下可转化为Silk Ⅱ[16]。因此,可以通过调节丝素蛋白中不同晶体结构的比例来调节丝素蛋白的水溶性和降解速率[17]。具体见图1。

图1 丝素蛋白结构[18]
Fig.1 Fibroin protein[18]
1.2 性质
1.2.1 生物相容性
生物相容性是指生物体对材料产生反应(物理、化学、生物反应)的一种性能[19]。丝素蛋白是蚕丝腺内壁上内皮细胞分泌、合成的天然高纯度蛋白质,丝素蛋白显示出与人体组织的天然相容性。丝素蛋白降解衍生的肽链不会在生物体中引起大的超敏反应,因此,丝素蛋白被认为具有较强的生物相容性[20]。此外,丝素蛋白与不同细胞系(如肝细胞、成骨细胞、成纤维细胞、内皮细胞等)之间具有高度相容性[16]。
1.2.2 机械性能
丝素蛋白二级结构中β-折叠的肽链排列整齐,肽链间氢键数目多、分子间引力稳定,是丝素蛋白优异机械性能的基础[21]。由于丝素蛋白无需固定的交联程序,可以转化为多种形式,包括液体、水凝胶和支架,具体主要取决于β-折叠的含量[22],为丝素蛋白的应用奠定了基础。
1.2.3 可降解性
生物降解是指将聚合物分解成更小的化合物,降解过程差异大、机制复杂。通常包括物理、化学和生物等因素[23]。丝素蛋白的生物降解主要由蛋白水解酶进行降解,降解程度与丝素蛋白结构和形态特征以及酶的类型有关[24]。材料的降解速度与丝素蛋白中Silk Ⅱ结构的含量有关,降解时间可以通过调节丝素蛋白的结构和力学性能来控制[25]。
2 丝素蛋白纳米颗粒的制备
由于丝素蛋白有着天然的高稳定荷载优势,许多研究者关注丝素蛋白纳米颗粒递送系统。研究目的不同,选择的制备方法也不同,制备方法的选择在制备合适大小的丝素蛋白纳米颗粒中至关重要。丝素蛋白纳米颗粒的制备可采用自上而下的可控提取和自下而上的组织重建2种策略[26]。自上而下方法中,粗料通过喷射、球磨和珠磨等机械工艺减小尺寸使其成为丝素蛋白纳米颗粒。通过自上而下方法制备的丝素蛋白纳米颗粒性质难以控制,特别是颗粒形态、形状和尺寸等,很难在丝素蛋白纳米颗粒上负载或封装其他物质[27];在自下而上方法中,提取丝素蛋白后溶解得到再生丝素蛋白溶液,再通过加工改变其二级结构而得到不同的材料,通过丝素蛋白反平行式β-折叠的增加使丝素蛋白分子形成纳米颗粒。自下而上方法主要存在丝素蛋白容易结构变性、透析时间长以及溶剂易残留等问题[28]。
2.1 自上而下
将丝素蛋白加工成所需的丝素蛋白纳米颗粒通常采用气流铣削、珠铣削以及球磨。气流铣削是指将蚕茧脱胶,然后将提取的蚕丝纤维切成片段,最后进行研磨和空气喷射铣削,这种通过气流铣削获得的尺寸范围比以前使用标准铣削设备生产的尺寸范围小得多。但这种方法的缺点是尺寸分布不集中,存在研磨杂质,且可能会降低Silk Ⅱ的含量[29]。有研究发现使用球磨法也会存在同样的问题,球磨法是使用球磨将脱胶的丝纤维进行切碎和研磨从而产生细颗粒,虽然球磨法设备便宜,操作简单,且易于扩展,但得到的丝颗粒尺寸分布广,含有杂质[30]。与上述2种方法相比,珠铣削具有粒径分布较窄的特点,首先用研磨机将丝纤维碾磨至粒径大概为7 μm左右,再用珠铣削成亚微米颗粒,这样产生的颗粒粒径可控且无有机溶剂,但耗时较长[31]。
2.2 自下而上
自下而上是通过丝素蛋白的相分离或自组装制备纳米颗粒,增加反平行式β-折叠结构,再经疏水相互作用使溶液中的丝素蛋白聚集形成纳米颗粒。类别分为化学法(去溶剂化、盐析、微乳液法等)、仪器法(电喷涂、电场和超临界流体技术等)和其他方法(聚合物共混法)[32]。其中仪器法易于放大,可用于大批量纳米颗粒的制备。但制备的丝素蛋白纳米颗粒大多为Silk I晶型,需要通过甲醇或水蒸气处理来诱导Silk Ⅱ构象。化学法价格便宜、易于操作,具有温和的加工条件,特别适应于小规模制备纳米颗粒,但存在有机溶剂和表面活性剂的残留,透析时间长且安全性不足等问题[27]。下文是几种常见的自下而上制备丝素蛋白纳米颗粒的方法。
2.2.1 去溶剂化
去溶剂化是用于制备蛋白质纳米颗粒最常用的技术,其操作简单、条件温和,且能获得小颗粒[33]。再生丝素蛋白溶液中丝素蛋白均匀或不均匀地聚集在一起,形成松散的球状结构,当引入过量的有机溶剂时,液体中的松散小球迅速分散并同时在内部和外部脱水,导致产生链-链连接,小球内的疏水结构域不断排列,最终形成具有β-折叠结构的丝素蛋白纳米颗粒[34]。由于凝聚过程在蛋白质等电点时更快、更有效,因此,蛋白质溶液的pH值非常重要(图2)[35]。但这种方法药物滞留和装载能力低,且存在有机溶剂残留。KUNDU等[36]利用二甲基亚砜作为脱溶剂制备丝素蛋白纳米颗粒,平均直径为150~170 nm,粒径分布窄,带负电荷,在去离子水和含血清的培养基中稳定。体外释放实验显示丝素蛋白纳米颗粒可超过3周持续释放,并可在小鼠鳞状细胞癌细胞的细胞质中积累。
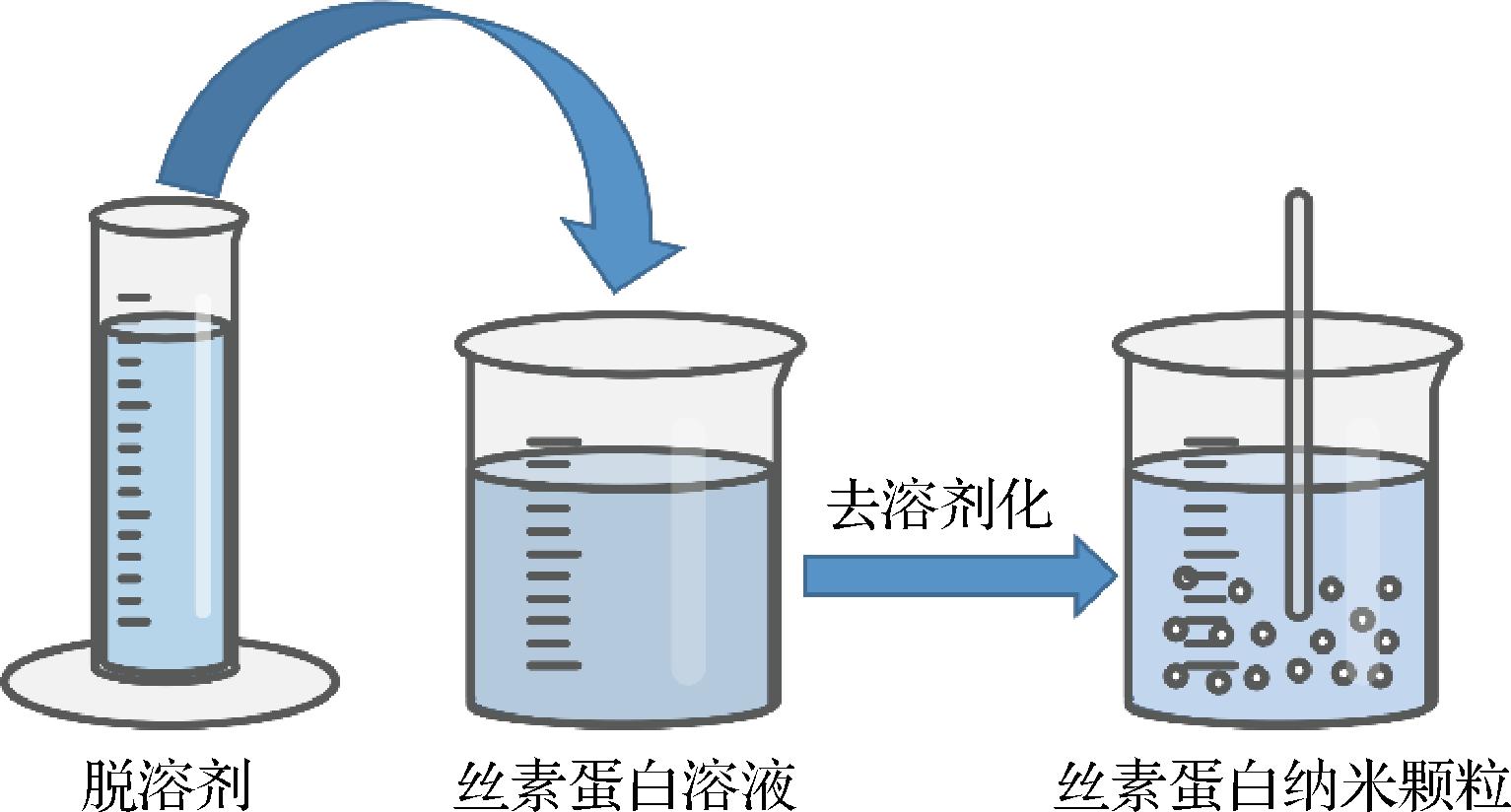
图2 制备丝素蛋白纳米颗粒的去溶剂化方法[35]
Fig.2 Schematic diagram of desolvation method for preparing silk fibroin nanoparticles[35]
2.2.2 盐析
蛋白质具有亲水和疏水部分,亲水部分与水分子相互作用形成胶束状结构,并与周围的水分子形成氢键。随着盐浓度的增加,盐离子夺走了蛋白质分子之间的一些水分,导致蛋白质分子之间的疏水相互作用增加,促使蛋白质聚集而形成沉淀(图3)[35]。盐析不需要高温,这一特性在处理热敏性物质时非常有用。盐析法具有低成本、简单和易于维持蛋白质活性等优点[33]。缺点是一般只应用于疏水化合物,且存在脱盐剂的残留。LAMMEL等[37]使用磷酸钾作为盐析剂制备可控尺寸的丝素蛋白颗粒,通过盐析产生的较大颗粒由较小的胶束状结构组成,颗粒表面带负电荷,这种特殊的性质使丝素蛋白负载带正电荷的物质成为可能。
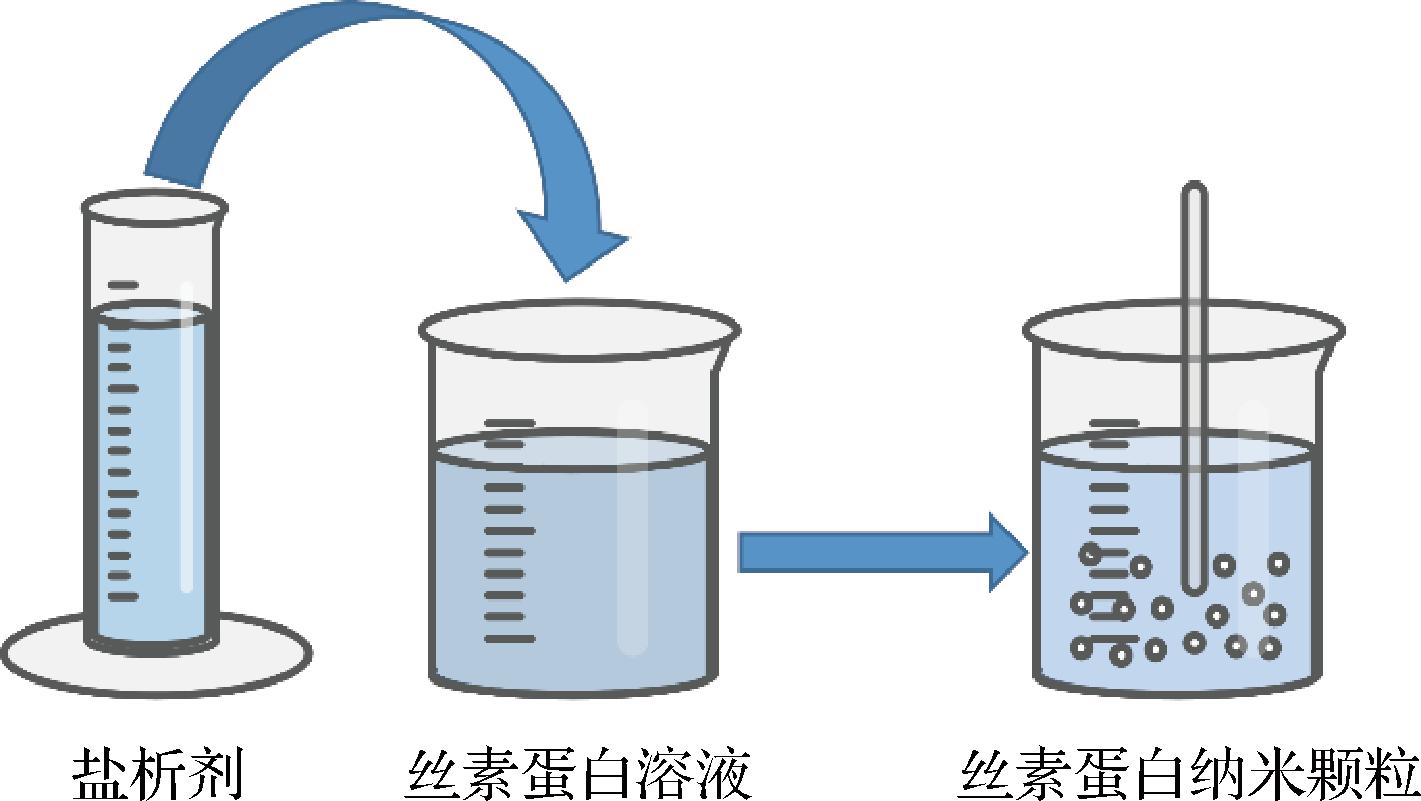
图3 制备丝素蛋白纳米颗粒的盐析方法示意图[35]
Fig.3 Schematic diagram of salting-out method for preparing silk fibroin nanoparticles[35]
2.2.3 微乳液法
微乳液是2种不混溶流体的热力学稳定分散体,通过添加表面活性剂来稳定。在微乳液中,水相在烃基连续相中形成纳米液滴,且通常位于水/油/表面活性剂三角相图的油顶点(图4)[35]。制备丝素蛋白纳米颗粒时,常使用环乙烷与活性剂混合,再加入丝素蛋白溶液形成胶束。这些球形反胶束可使表面最小化,被描述为“纳米反应器”,为纳米颗粒的形成提供了合适的环境,在纳米颗粒形成的后期,表面活性剂提供的空间位阻可防止纳米颗粒聚集[38]。向微乳液中加入乙醇等溶剂可产生丝素蛋白纳米颗粒,然后可通过过滤或离心来提取沉淀物。该方法的优点是,当表面活性剂浓度、油相和反应条件发生变化时,可以实现对粒径的控制[39]。MYUNG等[40]采用微乳液法制备了高负载荧光染料的丝素蛋白纳米颗粒,直径约为167 nm,显示丝素蛋白纳米颗粒可在分子成像领域产生重大影响。
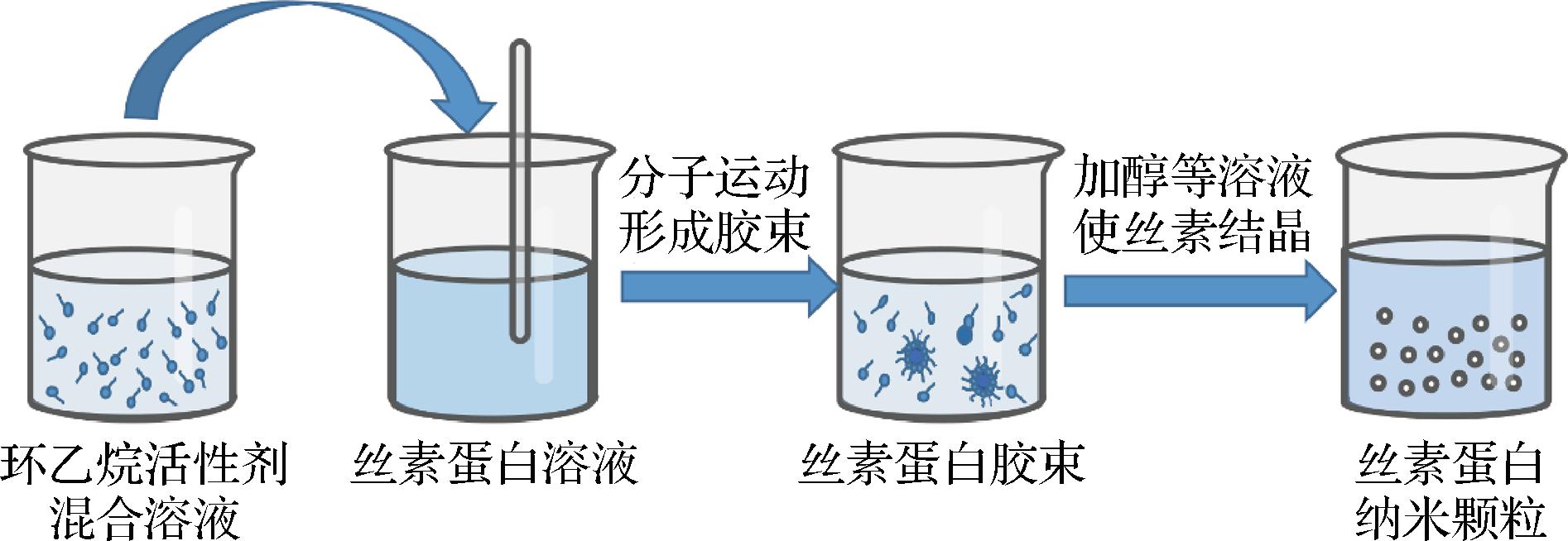
图4 制备丝素蛋白纳米颗粒的微乳液方法[35]
Fig.4 Schematic diagram of microemulsion method for preparing silk fibroin nanoparticles[35]
2.2.4 电喷涂
电喷涂是将电场施加到设备的喷嘴上,使液滴产生电荷[33]。通过使喷嘴保持高电势,喷嘴出口处的液体受到电剪切应力从而产生纳米颗粒。优点是液滴可以极小,可低至纳米级别,且液滴的电荷和大小一定程度上可以通过调节喷嘴流速和电场在控制[41]。电喷涂通过施加均匀的电流体动力将液体分解成细小射流来产生颗粒,但较高的流速和较低的喷涂电压容易导致形成有尾部结构的颗粒和纤维,因此,制备过程中控制流速很重要[42]。CAO等[43]使用电喷涂技术制造了具有聚乙烯醇内芯、涂有丝素蛋白涂层的纳米颗粒,这种纳米颗粒可以包载药物,并表现出pH依赖性释放,更多的药物可以在酸性介质中释放,药物的可控释放可能使细胞毒性药物在肿瘤中以更高的水平积累,副作用较少。具体见图5。
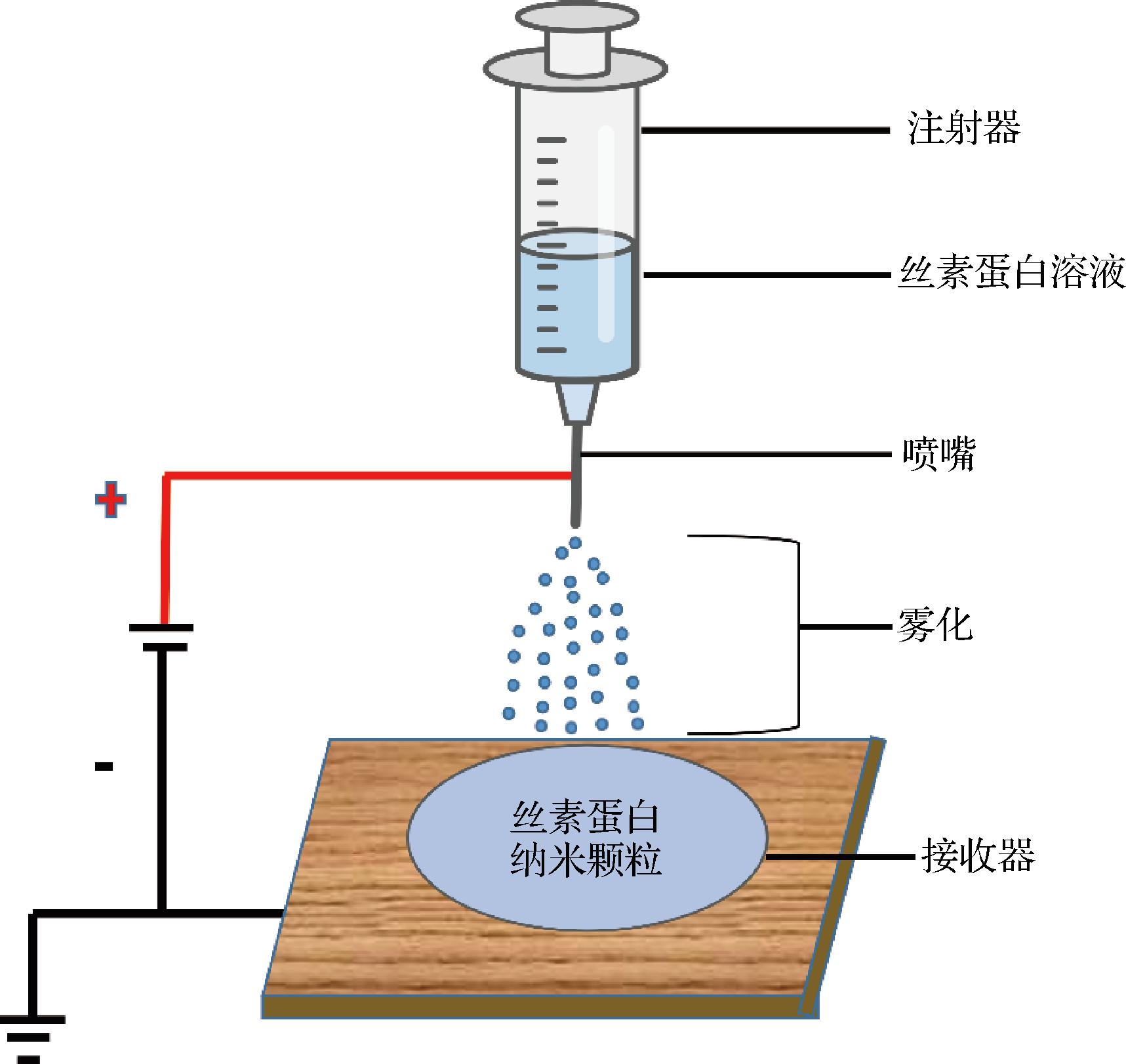
图5 电喷雾制备丝素蛋白纳米颗粒的方法[44]
Fig.5 Method diagram for preparing silk fibroin nanoparticles by electrospray[44]
2.2.5 电场
在中性水溶液中,丝素蛋白处于一种无规则的状态,其亲水基团和疏水基团会进行缓慢重排,进而组装成纳米颗粒。丝素蛋白本身带有负电荷,因此丝素蛋白纳米颗粒之间存在电荷斥力,会阻止颗粒的进一步聚集[45]。在电场作用下时,阳极附近质子含量增多,局部溶液的pH下降,丝素蛋白负电荷逐渐消失,从而快速组装成丝素蛋白纳米颗粒,在丝素蛋白纳米颗粒形成的同时,药物能够有效地负载到丝素蛋白纳米颗粒之中,该方法不仅具有良好的负载效率,且在制备过程中可以有效避免高温、高速搅拌、有机溶剂等对药物活性的损害,使丝素蛋白有望拓展为一种具有前景的生物活性药物递送系统[46]。WANG等[47]采用电场制备高生产率的丝素蛋白纳米颗粒。结果表明,载药的丝素蛋白纳米颗粒75 d内的累积释放率约为5%,为药物控释领域提供了一种新的药物载体。具体见图6。
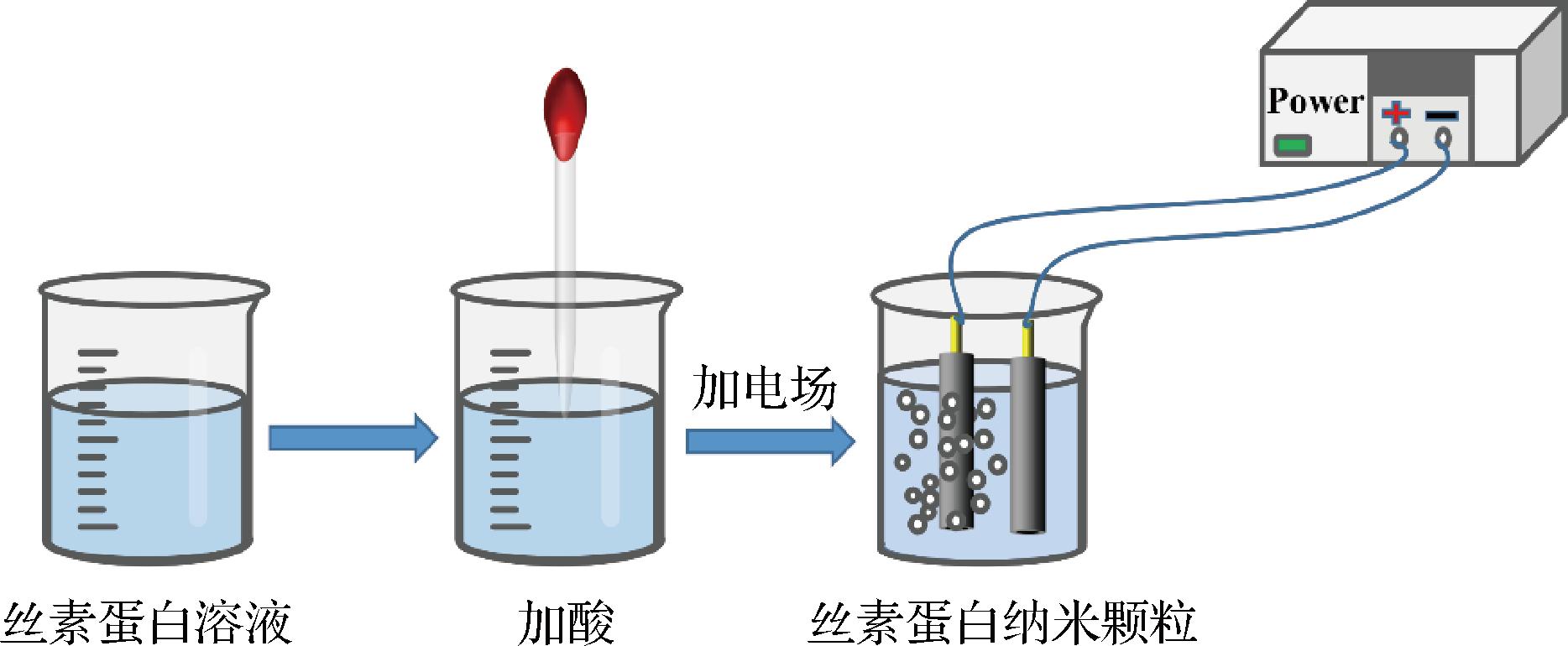
图6 电场制备丝素蛋白纳米颗粒的方法[35]
Fig.6 Schematic diagram of preparation of silk fibroin nanoparticles by electric field[35]
2.2.6 超临界流体技术
超临界流体是指高于临界温度和压力的物质,兼具液体和气体双重特性,拥有与液体近似的密度,与气体近似的黏度及较高的扩散系数。其位于临界温度和临界压力附近的密度仅仅与温度和压力呈函数关系,所以处于适当的温度和压力影响下,其可保证足够的密度来保证达到需要的溶解性,因此,其具有非常优异的溶解能力和流动能力[48]。CO2超临界流体工艺的实验装置由3个主要部分组成:CO2供应系统、有机溶液输送系统和高压容器。制备纳米颗粒的原理是将丝素蛋白溶液和超临界CO2通过专门设计的同轴喷嘴喷射到沉淀室中,丝素蛋白溶液通过喷嘴的内部泵送,而CO2通过外部输送,由于喷嘴特殊的几何形状,改善了2种流动体系之间的混合(图7)[49]。小液滴中的有机溶剂与超临界CO2之间的相互扩散产生溶液的高过饱和比导致丝素蛋白沉淀形成纳米颗粒[50]。ZHAO等[51]采用超临界流体技术制备了平均粒径约为50 nm、尺寸分布窄的丝素蛋白纳米颗粒,可用作递送药物的载体,且药物以稳定的方式释放。总之,超临界流体工艺制备的丝素蛋白纳米颗粒是生物医学领域的潜在药物载体[35]。
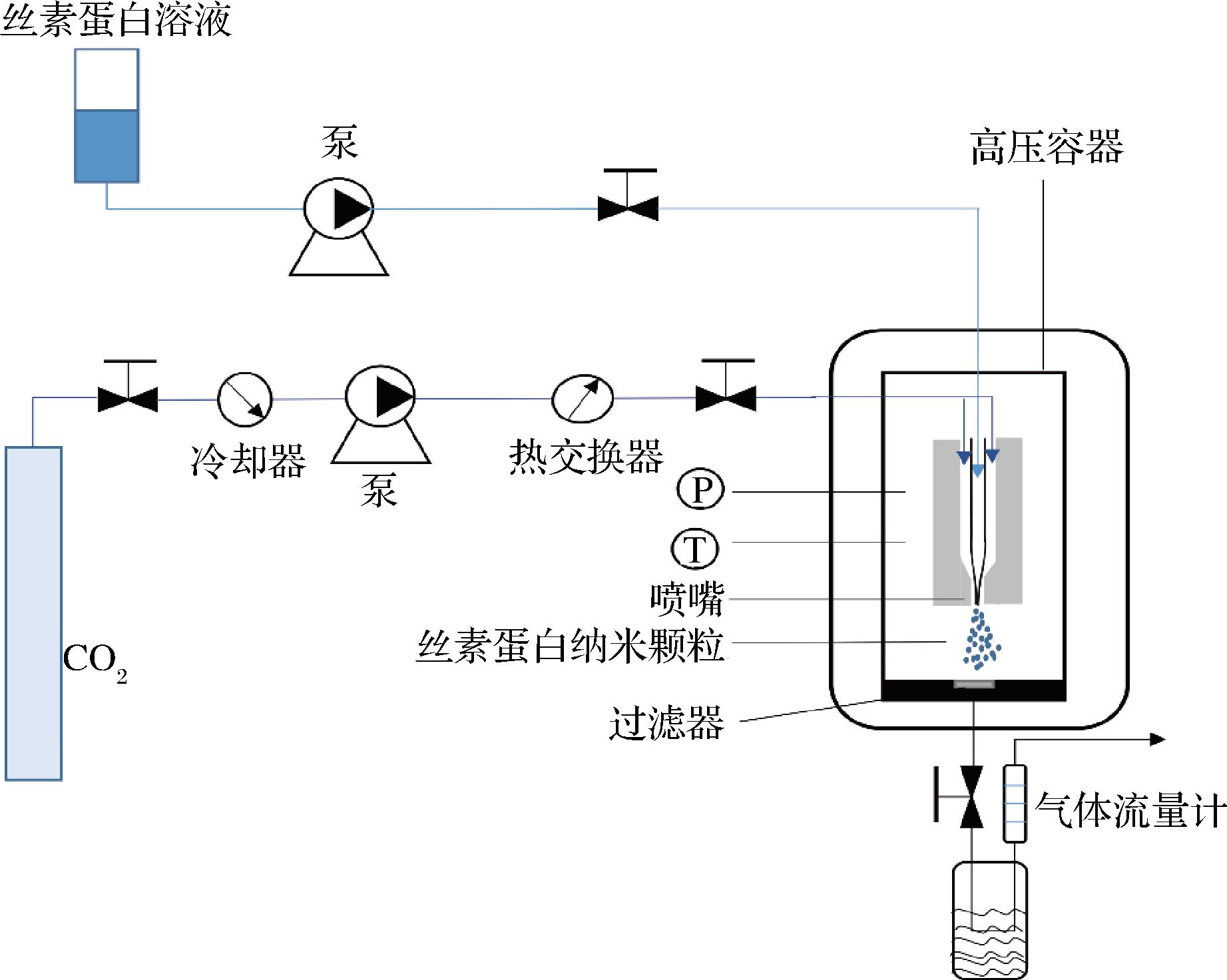
图7 超临界流体工艺设备[49]
Fig.7 Schematic diagram of supercritical fluid process equipment[49]
2.2.7 聚合物共混法
将丝素蛋白溶液与聚合物溶液(如聚乙二醇,聚乙烯醇)混合,制成薄膜。通过薄膜溶解和除去聚合物溶液就可以获得丝素蛋白纳米颗粒。改变丝素蛋白浓度和聚合物浓度或采用超声波处理混合溶液都能够控制颗粒尺寸和分布(图8)[35]。纳米颗粒的多孔内部空间和两亲性质促进了不同分子质量和疏水药物的截留,实现药物释放可控。该方法易于操作、安全、省时、节能,适用于多种药物。有研究利用聚合物共混法制备球体尺寸和形状可控的丝素蛋白纳米颗粒,主要是基于丝素蛋白和聚乙烯醇之间的相分离,制备尺寸可控、形状多变的微纳米球[52]。
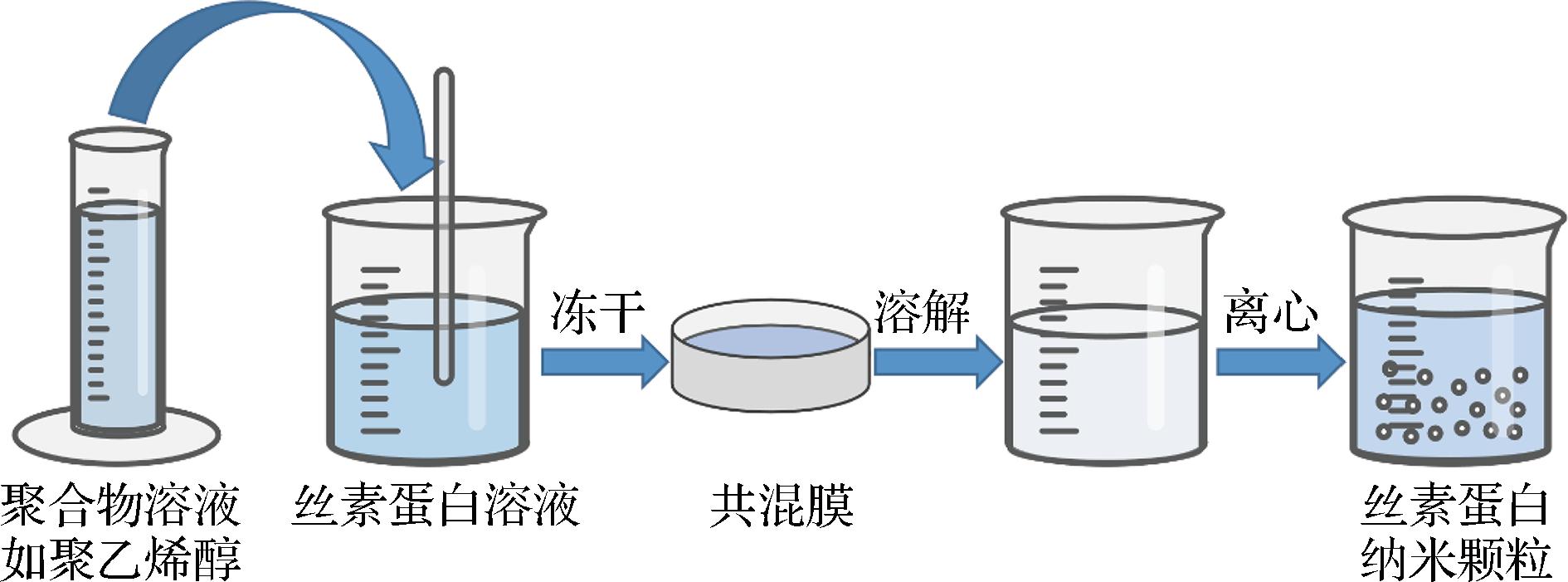
图8 共混膜制备丝素蛋白纳米颗粒的方法[35]
Fig.8 Method diagram for preparing silk fibroin nanoparticles by blending membrane[35]
3 丝素蛋白纳米颗粒在食品领域的应用
丝素蛋白纳米颗粒作为可降解、可再生的天然生物材料,在食品领域中的应用主要集中在食品活性包装、天然活性成分递送以及皮克林乳液稳定剂等方面。
3.1 应用于食品的活性包装
活性包装是通过包装、产品和环境三者之间相互作用来维持食品质量的包装技术。许多生物活性物质已被证实可作为食品天然防腐剂,但它们难溶、易挥发、易氧化和易分解的特性限制了其在食品活性包装中的应用。研究表明,利用丝素蛋白纳米颗粒可以形成包埋生物活性物质的纳米颗粒复合物,复合物中的生物活性物质可以起到抑菌、保鲜和延缓食品变质的作用,而丝素蛋白纳米颗粒则是用来调控生物活性物质的释放和吸附,充当生物活性物质的载体,从而实现食品的活性包装[53]。LIN等[54]将丁香酚包埋在丝素蛋白纳米颗粒中,通过静电纺丝制成食品包装,可延长食品的保质期。与传统的添加化学防腐剂或冷藏等方式相比,这种活性包装保鲜方式不会影响食品本身的风味外观特性,且更加绿色环保,具有较好的应用前景[53]。
3.2 应用于天然活性成分的递送
近年来,随着人们对人类健康的重视和对膳食营养的关注程度提高,含有天然生物活性成分的健康食品逐渐成为人们膳食营养的首要选择。然而大多数天然活性成分都是亲脂性成分,如姜黄素、β-胡萝卜素、番茄红素、虾青素、脂溶性维生素、不饱和脂肪酸等。这些化合物水溶性低、稳定性差、口服生物利用度差。因此,为了提高这些活性物质的稳定性和生物利用度,需要运用各种载体来对其活性成分进行保护[55]。丝素蛋白含有许多化学基团(如胺、酚、醇、硫醇和羧基),有助于与特定生物分子相互作用,在丝素蛋白内部或表面负载各种物质后被用来递送天然活性成分[22]。DIEZ-ECHAVE等[56]研究发现负载槲皮素的丝素蛋白纳米颗粒可以显著降低小鼠肠道中促炎因子的表达。FUSTER等[57]研究证实负载迷迭香酚的纳米颗粒可抑制海拉细胞株和乳腺癌细胞株的细胞增殖并诱导细胞凋亡,表现出抗癌特性。综上,丝素蛋白纳米颗粒对活性成分的负载和递送对于提升活性成分的功能价值具有重大意义。
3.3 应用于皮克林乳液的稳定剂
乳液是将一种液体以细液滴形式分散到另一种不混溶的液体中形成的系统,由于2种不混溶液体之间界面面积的增加,这种系统在热力学上通常是不稳定的,需要乳化剂进行稳定[53]。皮克林乳液是一种以胶体颗粒作为乳化剂的乳液,这种乳液主要通过胶体颗粒吸附于油水两相界面之间形成单层膜或多层膜,从而使乳液达到稳定状态[1]。传统稳定乳液常常使用两亲性表面活性剂,但它们具有一些缺点,包括潜在的毒性、炎症以及对pH、盐和温度的稳定性较差。因此,开发稳定性强、具有生物相容性和生物降解性的新型乳化剂对于食品行业来说是非常重要的。丝素蛋白具有优良的生物相容性和生物降解,可通过吸附于油水界面形成黏弹性保护膜实现乳液的稳定性,将丝素蛋白纳米颗粒应用于食品当中时,可进一步提升食物品质以达到良好的口感与风味。SUN等[58]在磷酸水溶液中制备了丝素蛋白纳米颗粒,并探讨了丝素蛋白纳米颗粒作为皮克林乳液乳化剂的潜力。结果表明,以丝素蛋白纳米颗粒作为乳化剂制备出的乳液可稳定长达1个月,可耐中等热和高离子强度,具有较好的稳定性。
3.4 其他
丝素蛋白纳米颗粒在食品领域中还有许多其他的应用,如丝素蛋白纳米颗粒可用于酶的固定。固定化酶具有良好的稳定性、可重复利用、容易分离的优点,是一种低能耗、高效率、容易实现自动化的酶催化反应工具[59]。丝素蛋白含有丰富的亲水和疏水基团,在不使用任何交联剂的情况下,就能实现基本的固定,在固定过程中几乎不需要引入其他的化学试剂,从而减小了酶失活的可能性,提高了酶的固定效率[60]。丝素蛋白还具有热稳定性好、变性程度可控以及生物安全性高等特点,使丝素蛋白成为固定化酶的优质材料[59]。CAO等[61]将β-葡萄糖苷酶固定到丝素蛋白纳米颗粒上,β-葡萄糖苷酶可以用于水解糖苷前体,以提高茶饮料的品质。当β-葡萄糖苷酶被包埋并固定在丝素蛋白纳米颗粒中时,β-葡萄糖苷酶的催化效率得到了很大的提高,这种基于丝素蛋白的固定化具有许多优点,即具有良好的操作稳定性以及可重复使用性。
4 总结与展望
随着纳米技术在生物医学和制药领域的不断深入发展,食品纳米技术也得到了迅速而显著的发展。食品纳米技术为食品工业带来了许多新的可能性。丝素蛋白有着良好的生物相容性、可定制的生物降解性、低免疫原性和无毒性等特点。因此,丝素蛋白纳米颗粒的优良性能使其在食品的活性包装、递送活性成分以及作为皮克林乳液的稳定剂方面具有巨大应用潜力,但仍有一些关键问题需要解决。每种纳米颗粒制备方法都有优点和缺点,因此还需继续开发新的纳米颗粒制造技术以满足不同的需求。此外,丝素蛋白纳米颗粒与活性成分的作用机理及其在食品领域的应用也需进行深入探究。今后,可进一步研究和完善丝素蛋白纳米颗粒的制备工艺,使其能够进行工业化生产,以期实现其在食品工业中的商业化应用;同时要对丝素蛋白纳米颗粒与活性成分的作用机理及其在食品中的实际应用进行深入的研究,设计并构筑更多的新型功能食品,最终实现产业化目标[53]。最后,需要努力进行更多的体内评估和临床研究,以确保安全性和验证丝素蛋白纳米递送系统的效力。总之,丝素蛋白纳米颗粒的优良特性决定了其良好的发展前景,应不断发掘其应用潜力。
[1] 向宁, 吴思弘, 夏久洁, 等.纳米结构大豆蛋白在食品中的应用进展[J].浙江工业大学学报, 2021, 49(5):582-590.
XIANG N, WU S H, XIA J J, et al.Progress in the application of nanostructured soy proteins in food[J].Journal of Zhejiang University of Technology, 2021, 49(5):582-590.
[2] 姚磊, 杨秋萍.大豆蛋白纳米粒子的制备及其在食品领域的应用进展[J].大豆科技, 2019(3):32-37.
YAO L, YANG Q P.Progress in soy protein nanoparticles preparation and its application in food industry[J].Soybean Science &Technology, 2019(3):32-37.
[3] FAROKHI M, MOTTAGHITALAB F, REIS R L, et al.Functionalized silk fibroin nanofibers as drug carriers:Advantages and challenges[J].Journal of Controlled Release, 2020, 321:324-347.
[4] ROCKWOOD D N, PREDA R C, YÜCEL T, et al.Materials fabrication from Bombyx mori silk fibroin[J].Nature Protocols, 2011, 6(10):1612-1631.
[5] SEIB F P.Reverse-engineered silk hydrogels for cell and drug delivery[J].Therapeutic Delivery, 2018, 9(6):469-487.
[6] MOTTAGHITALAB F, FAROKHI M, ALI SHOKRGOZAR M, et al.Silk fibroin nanoparticle as a novel drug delivery system[J].Journal of Controlled Release, 2015, 206:161-176.
[7] CRIVELLI B, PERTEGHELLA S, BARI E L, et al.Silk nanoparticles:From inert supports to bioactive natural carriers for drug delivery[J].Soft Matter, 2018, 14(4):546-557.
[8] ZHOU C Z, CONFALONIERI F, JACQUET M, et al.Silk fibroin:Structural implications of a remarkable amino acid sequence[J].Proteins, 2001, 44(2):119-122.
[9] INOUE S, TANAKA K, ARISAKA F, et al.Silk fibroin of Bombyx mori is secreted, assembling a high molecular mass elementary unit consisting of H-chain, L-chain, and P25, with a 6∶6∶1 molar ratio[J].Journal of Biological Chemistry, 2000, 275(51):40517-40528. [10] KOH L D, CHENG Y, TENG C P, et al.Structures, mechanical properties and applications of silk fibroin materials[J].Progress in Polymer Science, 2015, 46:86-110.
[11] WU R H, MA L Y, LIU X Y.From mesoscopic functionalization of silk fibroin to smart fiber devices for textile electronics and photonics[J].Advanced Science, 2022, 9(4):2103981.
[12] LOTZ B, COLONNA CESARI F.The chemical-structure and the crystalline-structures of Bombyx mori silk fibroin[J].Biochimie, 1979, 61(2):205-214.
[13] ARAMWIT P, KANOKPANONT S, NAKPHENG T, et al.The effect of sericin from various extraction methods on cell viability and collagen production[J].International Journal of Molecular Sciences, 2010, 11(5):2200-2211.
[14] ZHANG X N, CHEN Z Y, BAO H, et al.Fabrication and characterization of silk fibroin/curcumin sustained-release film[J].Materials, 2019, 12(20):3340.
[15] JIN H J, KAPLAN D L.Mechanism of silk processing in insects and spiders[J].Nature, 2003, 424(6952):1 057-1 061.
[16] TOMEH M A, HADIANAMREI R, ZHAO X B.Silk fibroin as a functional biomaterial for drug and gene delivery[J].Pharmaceutics, 2019, 11(10):494.
[17] CHEN K, LI Y H, LI Y B, et al.Silk fibroin combined with electrospinning as a promising strategy for tissue regeneration[J].Macromolecular Bioscience, 2023, 23(2):e2200380.
[18] GHALEI S, HANDA H.A review on antibacterial silk fibroin-based biomaterials:Current state and prospects[J].Materials Today Chemistry, 2022, 23:100673.
[19] 程佳玲, 叶军, 王洪亮, 等.天然来源丝素蛋白的体内外降解性与生物相容性研究进展[J].药学学报, 2022, 57(4):1002-1009. CHENG J L, YE J, WANG H L, et al.Research progress of natural silk fibroin’s degradability and biocompatibility in vitro and in vivo[J].Acta Pharmaceutica Sinica, 2022, 57(4):1002-1009.
[20] LI Z H, JI S C, WANG Y Z, et al.Silk fibroin-based scaffolds for tissue engineering[J].Frontiers of Materials Science, 2013, 7(3):237-247.
[21] 葛健文, 陈浩, 徐雅静, 等.丝素蛋白作为药物载体在抗肿瘤领域的应用进展[J].山东化工, 2022, 51(19):124-126;138. GE J W, CHEN H, XU Y J, et al.Application of silk fibroin as drug carrier in the field of antitumor[J].Shandong Chemical Industry, 2022, 51(19):124-126;138.
[22] WENK E, MERKLE H P, MEINEL L.Silk fibroin as a vehicle for drug delivery applications[J].Journal of Controlled Release, 2011, 150(2):128-141.
[23] NAIR L S, LAURENCIN C T.Biodegradable polymers as biomaterials[J].Progress in Polymer Science, 2007, 32(8-9):762-798.
[24] SUN W Z, GREGORY D A, TOMEH M A, et al.Silk fibroin as a functional biomaterial for tissue engineering[J].International Journal of Molecular Sciences, 2021, 22(3):1499.
[25] CHENG G, DAVOUDI Z, XING X, et al.Advanced silk fibroin biomaterials for cartilage regeneration[J].ACS Biomaterials Science &Engineering, 2018, 4(8):2704-2715.
[26] YAO X, ZOU S Z, FAN S N, et al.Bioinspired silk fibroin materials:From silk building blocks extraction and reconstruction to advanced biomedical applications[J].Materials Today Bio, 2022, 16:100381.
[27] PHAM D T, TIYABOONCHAI W.Fibroin nanoparticles:A promising drug delivery system[J].Drug Delivery, 2020, 27(1):431-448.
[28] PHAM D T, SAELIM N, TIYABOONCHAI W.Crosslinked fibroin nanoparticles using EDC or PEI for drug delivery:Physicochemical properties, crystallinity and structure[J].Journal of Materials Science, 2018, 53(20):14087-14103.
[29] RAJKHOWA R, WANG L J, KANWAR J, et al.Fabrication of ultrafine powder from eri silk through attritor and jet milling[J].Powder Technology, 2009, 191(1-2):155-163.
[30] RAJKHOWA R, WANG L J, WANG X G.Ultra-fine silk powder preparation through rotary and ball milling[J].Powder Technology, 2008, 185(1):87-95.
[31] KAZEMIMOSTAGHIM M, RAJKHOWA R, TSUZUKI T, et al.Production of submicron silk particles by milling[J].Powder Technology, 2013, 241:230-235.
[32] 陈智洋, 叶军, 王洪亮, 等.基于丝素蛋白的纳米粒药物递送系统研究进展[J].药学学报, 2022, 57(6):1792-1800.
CHEN Z Y, YE J, WANG H L, et al.Research progress of silk fibroin-based nanoparticulate drug delivery systems[J].Acta Pharmaceutica Sinica, 2022, 57(6):1792-1800.
[33] GIANNELLI M, GUERRINI A, BALLESTRI M, et al.Bioactive keratin and fibroin nanoparticles:An overview of their preparation strategies[J].Nanomaterials, 2022, 12(9):1406.
[34] ZHANG Y Q, SHEN W D, XIANG R L, et al.Formation of silk fibroin nanoparticles in water-miscible organic solvent and their characterization[J].Journal of Nanoparticle Research, 2007, 9(5):885-900.
[35] ZHAO Z, LI Y, XIE M B.Silk fibroin-based nanoparticles for drug delivery[J].International Journal of Molecular Sciences, 2015, 16(3):4880-4903.
[36] KUNDU J, CHUNG Y I, KIM Y H, et al.Silk fibroin nanoparticles for cellular uptake and control release[J].International Journal of Pharmaceutics, 2010, 388(1-2):242-250.
[37] LAMMEL A S, HU X, PARK S H, et al.Controlling silk fibroin particle features for drug delivery[J].Biomaterials, 2010, 31(16):4583-4591.
[38] EASTOE J, HOLLAMBY M J, HUDSON L.Recent advances in nanoparticle synthesis with reversed micelles[J].Advances in Colloid and Interface Science, 2006, 128:5-15.
[39] RAJENDRA P K M, NIDAMANURI B S S, BALAN A P, et al.A review on structure, preparation and applications of silk fibroin-based nano-drug delivery systems[J].Journal of Nanoparticle Research, 2022, 24(7):141.
[40] MYUNG S J, KIM H S, KIM Y, et al.Fluorescent silk fibroin nanoparticles prepared using a reverse microemulsion[J].Macromolecular Research, 2008, 16(7):604-608.
[41] JAWOREK A, SOBCZYK A T.Electrospraying route to nanotechnology:An overview[J].Journal of Electrostatics, 2008, 66(3-4):197-219.
[42] WU Y Q, MACKAY J A, MCDANIEL J R, et al.Fabrication of elastin-like polypeptide nanoparticles for drug delivery by electrospraying[J].Biomacromolecules, 2009, 10(1):19-24.
[43] CAO Y, LIU F Q, CHEN Y L, et al.Drug release from core-shell PVA/silk fibroin nanoparticles fabricated by one-step electrospraying[J].Scientific Reports, 2017, 7(1):11913.
[44] CHEN F J, DENG X L.Droplet breakup in electrostatic spray based on multiple physical fields[J].Advanced Powder Technology, 2022, 33(12):103842.
[45] 黄永利. 低压电场制备丝素微球及其应用[D].苏州:苏州大学,2011.
HUANG Y L.Preparation and applications of silk fibroin microspheres under electric fields[D].Suzhou:Soochow University, 2011.
[46] 黄永利, 吕强, 李明忠, 等.电场调控载药丝素蛋白微球的制备[J].科学通报, 2011, 56(13):1013-1018.
HUANG Y L, LYU Q, LI M Z, et al.Silk fibroin microsphere drug carriers prepared under electric fields[J].Chinese Science Bulletin, 2011, 56(13):1013-1018.
[47] WANG Q S, YAN S Q, HAN G C, et al.Facile fabrication of silk fibroin microspheres via electrostatic assembly[J].Materials Research Express, 2018, 5(7):075401.
[48] 李丰, 毓志超, 闵曼, 等.超临界流体技术研究进展及在中药检测中的应用[J].广东化工, 2021, 48(12):106-107.
LI F, YU Z C, MIN M, et al.The research progress of supercritical fluid technology and application in the detection of traditional Chinese medicine[J].Guangdong Chemical Industry, 2021, 48(12):106-107.
[49] ZHAO Z, LI Y, CHEN A Z, et al.Generation of silk fibroin nanoparticles via solution-enhanced dispersion by supercritical CO2[J].Industrial &Engineering Chemistry Research, 2013, 52(10):3752-3761.
[50] CHEN A Z, LI L, WANG S B, et al.Study of Fe3O4-PLLA-PEG-PLLA magnetic microspheres based on supercritical CO2:Preparation, physicochemical characterization, and drug loading investigation[J].The Journal of Supercritical Fluids, 2012, 67:139-148.
[51] ZHAO Z, CHEN A Z, LI Y, et al.Fabrication of silk fibroin nanoparticles for controlled drug delivery[J].Journal of Nanoparticle Research, 2012, 14(4):736.
[52] WANG X Q, YUCEL T, LU Q, et al.Silk nanospheres and microspheres from silk/pva blend films for drug delivery[J].Biomaterials, 2010, 31(6):1025-1035.
[53] 高琦, 张首央, 唐子程, 等.蛋白质纳米颗粒的制备及其在食品领域的应用研究进展[J].食品工业科技, 2023, 44(11):30-37.
GAO Q, ZHANG S Y, TANG Z C, et al.Research progress on preparation and application of protein nanoparticles in food field[J]. Science and Technology of Food Industry,2023, 44(11):30-37.
[54] LIN L, LUO C C, LI C Z, et al.Eugenol/silk fibroin nanoparticles embedded Lycium barbarum polysaccharide nanofibers for active food packaging[J].Food Packaging and Shelf Life, 2022, 32:100841.
[55] ZHANG R Y, HAN Y H, XIE W J, et al.Advances in protein-based nanocarriers of bioactive compounds:From microscopic molecular principles to macroscopical structural and functional attributes[J].Journal of Agricultural and Food Chemistry, 2022, 70(21):6354-6367.
[56] DIEZ-ECHAVE P, RUIZ-MALAG N A J, MOLINA-TIJERAS J A, et al. Silk fibroin nanoparticles enhance quercetin immunomodulatory properties in DSS-induced mouse colitis[J]. International Journal of Pharmaceutics, 2021, 606:120935.
N A J, MOLINA-TIJERAS J A, et al. Silk fibroin nanoparticles enhance quercetin immunomodulatory properties in DSS-induced mouse colitis[J]. International Journal of Pharmaceutics, 2021, 606:120935.
[57] FUSTER M G, CARISSIMI G, MONTALB N M G, et al. Antitumor activity of rosmarinic acid-loaded silk fibroin nanoparticles on HeLa and MCF-7 cells[J]. Polymers, 2021, 13(18):3169.
N M G, et al. Antitumor activity of rosmarinic acid-loaded silk fibroin nanoparticles on HeLa and MCF-7 cells[J]. Polymers, 2021, 13(18):3169.
[58] SUN S W, DENG Y Q, SUN F C, et al. Engineering regenerated nanosilk to efficiently stabilize Pickering emulsions[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022, 635:128065.
[59] 潘彩霞, 杨明英, 朱良均. 丝素作为固定化酶载体材料的研究进展[J]. 蚕桑通报, 2014, 45(3):9-11; 32.
PAN C X, YANG M Y, ZHU L J. Research on progress of fibroin as immobilized enzyme carrier materials[J]. Bulletin of Sericulture, 2014, 45(3):9-11; 32.
[60] 陈芳艳, 王伟贤, 纪平雄. 丝素作为固定化酶载体的研究进展与应用[J]. 广东蚕业, 2004, 38(1):44-49.
CHEN F Y, WANG W X, JI P X. Apply and progression of research the fibroin as the carrier of the fixed enzyme[J]. Guangdong Sericulture, 2004, 38(1):44-49.
[61] CAO T T, ZHOU Z Z, ZHANG Y Q. Processing of β-glucosidase-silk fibroin nanoparticle bioconjugates and their characteristics[J]. Applied Biochemistry and Biotechnology, 2014, 173(2):544-551.