姜黄素(curcumin,CUR)是从姜科、天南星科等姜黄属植物根茎中提取的一种多酚类物质,是植物界极其罕见的具有二酮的酮类化合物[1],其化学式为C21H20O6,分子量为368.38 g/mol,是一种酮-烯醇互变异构体(图1),在有机溶剂中以烯醇的形式存在,在水中则以酮的形式存在。姜黄素为橙黄色结晶粉末,具有姜黄特有的辛香味,略带胡椒、甜橙及麝香的混合味道,稍有苦味和生姜的辣味[2],具备食物的“色、香、味”3个要素,且安全无毒、无副作用,是国内外准许用于食品的天然色素,可应用于咖喱粉配料、鸡精调味料、膨化食品调味料、辣椒调味料、方便食品调味料及火锅调味酱等复合调味品中,也可用于果汁、饮料、冰淇淋、酸奶、膏状香精、烘焙、薯片、膨化制品及牛肉干制品等食品的增香、调色及保质,在食品加工领域具有广泛的应用前景[3]。此外,姜黄素分子中含有多个双键、羰基和酚羟基等活性基团,具有抗炎[4]、抗氧化[5]、抑菌[6]、抗肿瘤[7]、保护神经[8]、保护肝脏[9]、抗病毒[10]、降血脂[11]、抗凝血[12]及调节机体肠道菌群平衡[13]等生物和药理活性。但由于姜黄素难溶于水,且在加工贮藏过程中容易受光照、温度等外界因素的影响而降解,丧失原有的生物活性,导致其在机体内的吸收率差,生物利用率低,极大地限制了姜黄素在水溶性基质食品、生物医药及农业等相关领域的应用。因此,改善姜黄素的溶解度是提高其潜在应用价值的关键所在。
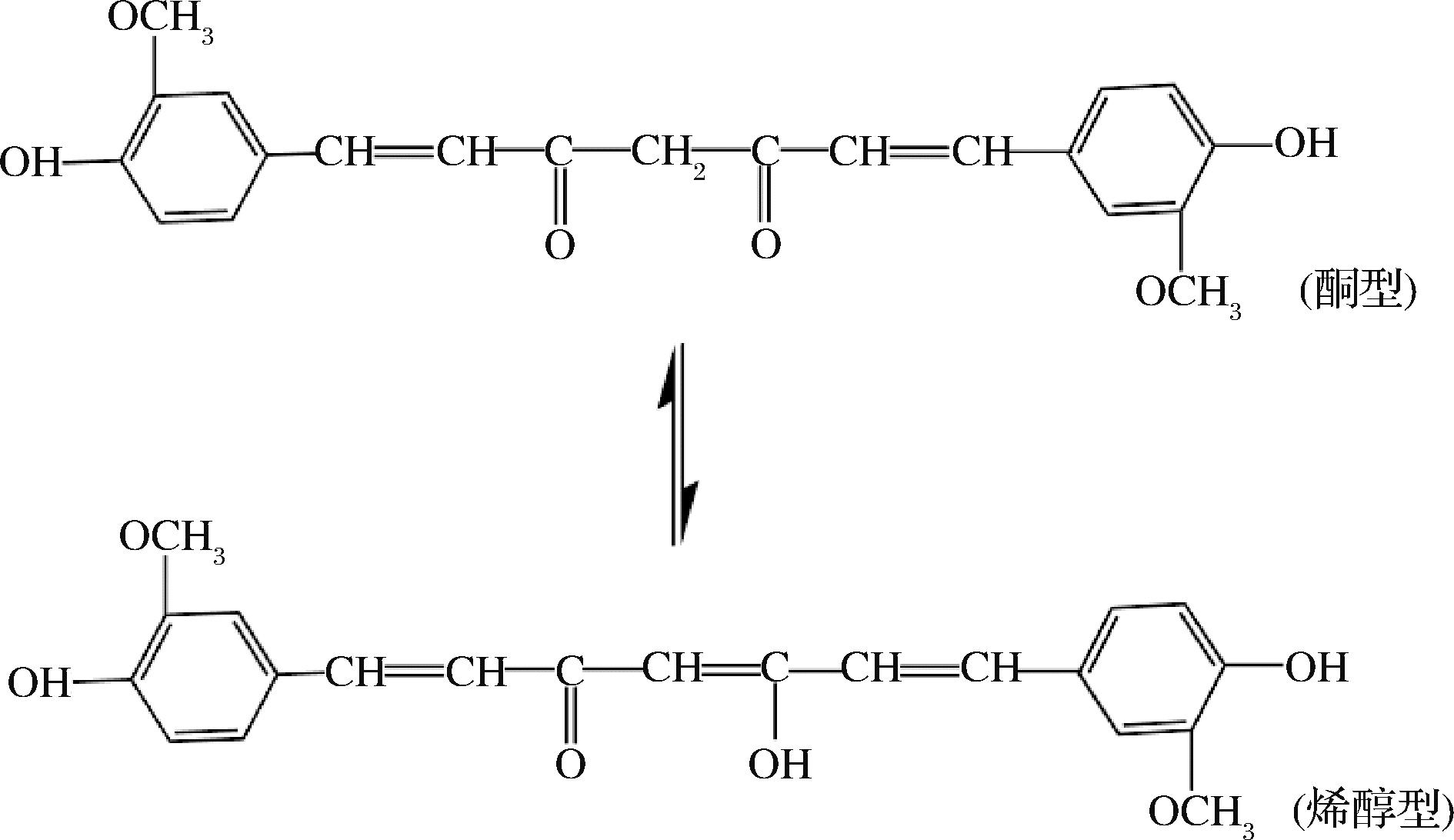
图1 姜黄色素化学结构式
Fig.1 Chemical structure of curcumin
随着食品科学的不断发展,涌现出多种改善姜黄素水溶性的新型食品载体材料和方法,为提高姜黄素的生物利用度、促进其应用提供了参考依据和理论基础。基于大量文献调研,本文对姜黄素增溶技术的研究进展进行了综述,将增溶方法概括为如下五大类。
1 包合增溶
包合技术可以将一种分子(客分子)包嵌于另一种分子(主分子)的空穴结构内形成包合物。天然食品疏水功能因子可以被包合或嵌入载体的空隙结构内,形成超微粒分散物,从而改善食品疏水功能因子的溶解度。
包合技术主要使用的载体材料为环糊精(cyclodextrin,CD)及其衍生物。环糊精是直链淀粉在环糊精葡萄糖基转移酶的作用下生成的一系列环状低聚糖的统称,是一类由葡萄糖单元组成的低聚糖,市场上的环糊精有3种形式:α-CD,β-CD和γ-CD,分别含有6、7和8个葡萄糖单元。凭借其外部亲水、内部疏水的独特空腔化学结构,环糊精能与食品疏水功能因子(客分子)形成包合物,显著增加功能因子的溶解度,同时对理化性质不稳定的功能因子具有保护和缓释作用。有研究者合成了姜黄素-β-环糊精(质量比1∶2)包合物,通过傅立叶变换红外光谱、紫外可见光谱及粒度仪证明了包合物的形成,以包合技术将姜黄素的水溶性提高了206倍,并首次报道了姜黄素在包合物中5 h内的缓释特性,表明β-CD是包合姜黄素的良好载体[14]。以β-CD的衍生物羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD)为包合材料,制备姜黄素-羟丙基-β-环糊精包合物(curcumin-cyclodextrin inclusion complexes,CCIC),显微观察、差示扫描量热及红外光谱技术证明了包合物的形成。以溶解度为评价指标优化CCIC的制备工艺,结果表明,CCIC的最优制备工艺为:包合投料比(摩尔比)为1∶1,研磨温度为40 ℃,包合时间为1.5 h,在此条件下CCIC中姜黄素的溶解度较游离姜黄素提高了3.82×104倍,且姜黄素的抗氧化活性也有所提高[15]。而李宁[16]制备的CCIC则以包合率为评价指标优化制备工艺,当姜黄素与HP-β-CD的摩尔比为1∶3,包合温度为40 ℃,包合溶剂体积比(无水乙醇/水)为1∶9,包合时间为12 h时,CCIC的包合率最高,可达到41.9%。傅里叶红外光谱、X-射线衍射及差示扫描量热试验证明,姜黄素被成功包合于环糊精空腔内,包合后姜黄素的溶解度显著增加,在强光照射、高湿、高温和不同pH溶液中的稳定性也明显高于游离姜黄素,且包合物保持了姜黄素抗肿瘤、抗炎、抗氧化等生物活性,显著提高了姜黄素的生物利用度[16]。此外,以羟丙基-γ-环糊精[17]、二甲基-β-环糊精[18]包合姜黄素,均能提高姜黄素的溶解度,并且显著改善姜黄素的抗氧化活性、抑菌活性及稳定性,可应用于调味料、饮料及糕点等食品的加工,促进姜黄素在食品工业领域的应用[19]。
环糊精单体的溶解性能、空腔刚性及包合适应性等问题,使环糊精的应用具有一定的局限性。相比于环糊精单体及其衍生物,环糊精聚合物具有更高的水溶性及生物相容性,对客体分子的空间构型及尺寸的包容性更强,可以包合尺寸大于环糊精腔体的客体分子,在包合能力上具有明显的优势[20]。将β-环糊精聚合物(β-cyclodextrin polymer,β-CDP)超分子主体化合物与姜黄素主客体包合,形成姜黄素与β-环糊精聚合物的包合物(CUR-β-CDP),不仅提高了姜黄素的水溶性和生物利用率,且细胞吞噬、免疫荧光及细胞划痕试验均表明,与游离姜黄素相比,包合物中的姜黄素抗肿瘤效果更佳[21]。此外,由支链淀粉通过酶解脱支制备的短链葡聚糖是一种小分子质量的亲水线性聚合物,能够改善食品疏水功能因子的溶解度[22]。研究者利用酶解蜡质玉米淀粉得到的短链葡聚糖包合姜黄素,改善了姜黄素的溶解度,提高了姜黄素的生物利用率,并通过分子动力学模拟,揭示了短链葡聚糖与姜黄素边解离边包合最后趋于稳定的包合机制[23]。包合增溶能够显著提高食品疏水功能因子的稳定性,但由于包合载体自身的局限性,该技术存在包合率较低、制备工艺复杂等缺陷。
2 微乳增溶
微乳是由水、油和两性分子组成的光学上均一、热力学上稳定的液态溶液。微乳可以增加食品疏水功能因子的溶解度,促进其在胃肠道的吸收。微乳增溶法大多需要具有乳化作用的表面活性剂。表面活性剂具有固定的亲水亲油基团,在溶液的表面能定向排列,使目标溶液表面张力显著下降。有报道称,在1种由非离子表面活性剂Triton X-100、四丁基氯化铵及正十一酸组成的新型油包水微乳液中,姜黄素的溶解度高达51 mg/mL,且这种微乳液体系还提高了姜黄素的光稳定性,更利于姜黄素的贮存[24]。另外,表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和非离子表面活性剂吐温20是广泛应用于食品和药品领域的增溶剂,以SDS和吐温20联合对食品疏水功能因子增溶,随着SDS所占摩尔分数的下降,姜黄素的水溶性持续增大,但对姜黄素的保护作用有所下降,当SDS所占摩尔分数为40%时,体系对姜黄素的增溶效果最佳[25]。但非离子表面活性剂通常都是低熔点的蜡状物或膏体,很难将其研制成粉状,这使其应用受到一定阻碍。以吐温20和β-乳球蛋白作为表面活性剂可以降低姜黄素的结晶度,得到无定形姜黄素微乳液,提高微乳液中姜黄素的溶解度[26]。与此同时,可按照实际需求将其制备成粉体,以便更好地应用于食品添加剂、调味品及药物等生产加工中[27]。除此之外,自微乳给药系统(self-microemulsion drug delivery systems,SMEDDS)在食品工业中有着巨大的应用潜力,但由于食用表面活性剂很少,使其应用受到极大限制。为了解决这一问题,研究人员利用南极磷虾油的磷脂(40.4%)和甘油三酯(54.7%)作为固有表面活性剂的油相,并结合甘油作为助表面活性剂,开发了一种新型可食用的表面活性剂SMEDDS。结果表明,与姜黄素单体相比,制备得到的微乳液能使姜黄素的水溶性提高了13.96倍,同时增强了抗氧化等生物活性,提高了生物利用度[28]。这种可持续且更为健康的食用表面活性剂SMEDDS促进了食品疏水功能因子在食品加工领域的应用。
由于目前可食用表面活性剂种类有限,因此如何减少对表面活性剂的依赖是微乳法增溶的研究热点。研究者构建了一种由苯甲酸乙酯(ethyl benzoate,EB)、乙醇和水组成的新型无表面活性剂水包油微乳液体系(surfactant-free microemulsion,SBME)。当EB含量为10%时,SBME体系中姜黄素的溶解度为17.54 mg/mL,相比于姜黄素单体,提高了17 000多倍,并且其贮藏稳定性、光稳定性、热稳定性和抗氧化活性均得到了显著提高[29]。这项研究对姜黄素和其他食品疏水功能因子的实际应用具有重要意义,促进了姜黄素在功能性饮料等食品加工领域的高值化应用。另外,为充分发挥姜黄素的生物及药理活性,研究人员通过制备十六烷基三甲基溴化铵纳米结晶纤维素微乳液,提高了姜黄素的水溶性及稳定性,并证明了这种微乳液体系适用于靶向治疗[30],这为开发局部递送姜黄素的新体系提供了重要参考。微乳增溶对姜黄素溶解度的改善效果颇为显著,但此法需要使用大量可食用的表面活性剂和助表面活性剂,而目前可食用的表面活性剂和助表面活性剂种类较少。此外,微乳液在稀释时经常会因原来各相比例的改变而遭到破坏,因此,如何保持微乳乳滴形态的完整和性质的稳定是应用此法增溶需要重点关注的问题。
3 固体分散增溶
将难溶性物质以无定型、分子或微晶等形态均匀地分散在某固体载体上,形成分散体系的现代化制剂技术称为固体分散技术[31],该技术能够改善食品疏水功能因子的溶解性,提高其生物利用度。羟丙基甲基纤维素(hydroxypropyl methylcellulose,HPMC)具有抑制姜黄素结晶的能力,采用HPMC[32]或者以HPMC为辅助剂,利用丙烯酸树脂E100(eudradit e100,E100)[33]均可制备相应的姜黄素无定形固体分散体。体外溶出实验表明,姜黄素的水溶性显著提高,且其贮存稳定性良好,不易降解,有利于姜黄素生物利用度的提高。有研究者以聚乙二醇6000(polyethylene glycol 6000,PEG6000)为载体制备姜黄素固体分散体,并对其制备工艺进行了优化。结果表明,在姜黄素的添加量为20 mg,姜黄素与PEG6000质量比为1∶9,无水乙醇添加量为10 mL,熔融温度为50 ℃的条件下,所制备的姜黄素固体分散体在25 min内的溶出度可达93%,极大地提高了姜黄素的水溶性,促进了姜黄素在体内的吸收[34]。另外,姜黄素与胡椒碱(piperine,PIP)[35]、甘草酸[36]、聚乙烯吡咯烷酮联合大豆磷脂[37],均可制备固体分散体,显著改善姜黄素的溶解度,提高姜黄素的生物利用度。将姜黄素制备成固体分散体应用于食品中,不仅可以增加食品的稳定性,还能利用姜黄素的抑菌性延长食品的保质期,促进姜黄素在食品加工中的应用。
姜黄素在固体分散体中以无定型形式存在,这增加了其溶解表面积,提高了溶解度,此外,固体分散体还能掩盖姜黄素的微苦味。与此同时,很多载体材料能够与姜黄素分子的酚羟基形成氢键,使姜黄素分子分散于大分子中,使其易于溶解。但固体分散体的载体用量大,生产成本高,且姜黄素的分散状态为分子、微晶以及无定型等热力学亚稳定状态,在生物体内如果不能及时吸收,容易重新转化为稳定的结晶状态,因此在实际应用中具有一定的局限性。
4 吸附增溶
姜黄素等食品疏水功能因子能与糖类、蛋白质原纤维等在机械化学作用的碰撞下,通过分子间相互作用而吸附结合在一起,以达到改善其水溶性的目的。木聚糖是植物半纤维素的一种主要结构,在罗望子(Tamarindus indica L.)籽胶(罗望子纸浆工业的副产品)中含量丰富。研究者比较了罗望子木聚糖与其他水溶性植物和藻类多糖(包括λ-卡拉胶、阿拉伯胶、瓜尔胶、果胶和直链淀粉)对姜黄素的增溶能力,结果显示罗望子木聚糖效果最佳[38]。此外,经过真菌纤维素酶消化后得到的聚合度为15.4~24.3的中长链罗望子木聚糖具有更优异地溶解姜黄素的能力,二者主要通过疏水相互作用吸附结合[38]。
蛋白质原纤维是蛋白质或多肽的自组装线性聚集体,具有极大的长宽比和表面积,其表面含有多种活性官能团[39]。因此,蛋白质原纤维在食品疏水功能因子的保存及递送方面具有广阔的应用前景。JI等[40]以大豆蛋白纤维(soybean protein fiber,SPF)为载体,在pH 3.2的条件下与姜黄素制备SPF-CUR复合物,二者主要以氢键和疏水相互作用结合,复合物中姜黄素的溶解度是其单体的400倍,表明SPF可以作为食品疏水功能因子的有效输送系统。类似的,通过加热乳清分离蛋白制备具有纳米直径和高表面疏水性的乳清蛋白纳米纤维(whey protein nanofibrils,WPN),并以WPN为载体与姜黄素合成WPN-CUR复合物,能使复合物中姜黄素的水溶性提高近1 200倍,并降低了贮藏过程中姜黄素的沉降。傅里叶红外光谱和荧光光谱结果显示,WPN-CUR复合物的形成主要依赖于氢键和疏水等非共价键的相互作用[41]。另外,研究者以乳清蛋白原纤维(whey protein fibril,WPF)和壳聚糖(chitosan,CTS)为载体,制备WPF-CTS-CUR复合物,显著提高了姜黄素在pH 3.5条件下的水分散性(297.8 μg/mL)[42]。分子动力学模拟结果表明,姜黄素与乳清蛋白原纤维的主要结合部位为纤维的疏水基团,CTS通过静电相互作用与WPF及姜黄素形成复合物,并增加了蛋白质原纤维之间的排斥力,从而形成了高稳定性的输送系统,促进了姜黄素在肠道中的释放。蛋白质原纤维这种潜在输送基质促进了姜黄素等食品疏水功能因子在复合调味品、果汁及无脂酸性功能饮料中的应用。植物蛋白在改善食品疏水功能因子的水溶性方面也发挥着巨大作用。蛋白质Z(protein Z,PZ)具有较高的表面黏度和弹性,最早在啤酒中发现,主要来源于大麦胚乳,PZ能与食品疏水因子通过分子间相互作用结合,从而达到改善其溶解度的目的。从麦芽中分离纯化PZ,并将其溶解于缓冲液中得到PZ溶液,将姜黄素粉末加入PZ溶液并充分搅拌振荡,能显著改善姜黄素的溶解度,且体外模拟小肠消化试验表明,PZ能增强姜黄素的消化稳定性,保持其生物活性,提高生物利用度[43]。植物蛋白具有维持泡沫的特性,将其作为食源性材料添加至气泡饮料、功能饮料、啤酒等食品饮料中,不仅可以赋予产品丰富的气泡、提高食品的感官特性,还能为开发具有抗氧化等功能性的饮料提供思路,有效拓展姜黄素在食品工业中的应用前景。不仅如此,蛋白质的酶解产物多肽也能够与姜黄素以氢键和疏水相互作用结合,例如,以去胺化玉米醇溶蛋白制作多肽,多肽复合物对姜黄素的载药量为31.9%,对其结晶的抑制可达100%,有效促进了姜黄素在水中的分散溶解[44]。此外,多肽具有美白、抗氧化、消炎、更新肌肤等功效,这促进了姜黄素在食品和医药及化妆品等行业的应用。整体来说,附增溶法的操作步骤较少,使用设备简单,制备的复合物稳定性高,但由于复合物的抗炎、抑菌等生物活性会受到分子间相互作用不同程度的影响,因此,其生物学特性还有待进一步研究。
5 胶束增溶
聚合物胶束是由两亲性聚合物在水中自组装形成的一种热力学稳定的胶体溶液。胶束作为一种药物递送系统,具有良好的自组装特性和对食品疏水功能因子增溶的能力[45]。聚合物胶束的形成依赖于表面活性剂,表面活性剂在水溶液中形成胶束后,能使不溶或微溶于水的有机化合物的溶解能力显著增大,且溶液呈均一透明状,利于在食品与医药等领域的应用。研究表明,表面活性剂辛烯基琥珀酸-燕麦β-葡聚糖酯(octenylsuccinate modified oat β-glucan ester, OSβG)能够自组装形成具有核壳结构的胶束,这种胶束对姜黄素具有很好的增溶作用[46]。研究者利用甘草酸二钠、果胶和单宁酸构建的核壳结构胶束能克服姜黄素溶解度低、生物利用度差的缺点,结晶状态分析表明,姜黄素以无定形态均匀分散在亲水载体中,其溶解度明显高于游离姜黄素[47]。将OSβG胶束增溶后的姜黄素添加于果汁体系中时,在4 ℃冷藏温度下的贮藏稳定性明显高于常温(25 ℃),其稳定性随着果汁加热温度的升高而降低(70~90 ℃),这为姜黄素类饮料的加工及贮存提供了参考[48]。此外,辛烯基琥珀化玉米糊精胶束可使姜黄素的表观溶解度提高至4.44 mg/mL,促进姜黄素的吸收,提高其生物利用度[49]。
食源性水解蛋白具有生物活性好、生物相容性高等特点,但是关于蛋白质水解产物胶束及其作为食品疏水功能因子载体的研究有限。WANG等[50]构建了乳铁蛋白(lactoferrin,LF)水解产物LF肽的自组装纳米胶束,体外模拟消化实验表明,LF肽纳米胶束能显著提高姜黄素的转化速度和生物可及性,是一种颇有前景的食品疏水功能因子递送体系,在食品和医疗行业具有潜在的应用价值。另外,利用双重改性(羟丙基化和脱支化)玉米淀粉制造自组装胶束,可将姜黄素的水溶性和稳定性分别比游离姜黄素提高200倍和3~6倍,这主要归功于自组装胶束中亲水性核的封装,以及羟丙基提供的疏水性和氢键[51]。类似的,利用乙酸酐修饰脱支淀粉,引入疏水性乙酰基后,通过乙酰化脱支淀粉的自组装获得胶束,能显著提高姜黄素的水溶性和生物利用度[52]。双改性淀粉自组装胶束可作为姜黄素纳米载体,提高姜黄素在食品、医疗领域的口服生物利用度。天然两亲性聚合物胶束有易合成、生物相容性高等特点,但胶束收集复杂、后处理麻烦,且成本较高,胶束贮存不稳定。
6 结论与展望
作为一种天然疏水性多酚类化合物,姜黄素具有抗肿瘤、抗氧化、抗炎、抑菌等广泛的生物和药理活性,可用于预防或治疗一些慢性疾病、神经疾病如鼻炎、厌食等,是一种公认的促进健康的生物活性化合物,在食品工业、生物医药及化妆品等领域具有极高的应用价值。但在实际生产应用中,姜黄素水溶性低、物理和化学稳定性差、胃肠道中降解快、肠道渗透性差、代谢和消除速度快等问题仍是其在饮料、面食制品、复合调味料与医药等领域的应用壁垒。近年来,有关于食品疏水功能因子增溶的研究工作已取得一定进展,作者在广泛查阅相关资料后,将其概括为包合增溶、微乳增溶、固体分散增溶、吸附增溶及胶束增溶五大类方法(表1),并详细阐述了各种方法在姜黄素增溶领域的进展。不同方法仍存在不同的问题,例如:用以包合姜黄素的大多数天然高分子载体需要修饰,合成的包合物通常生物相容性低;微乳法需要大量可食用的表面活性剂;另外部分方法还存在复合物稳定性低,难于贮存,制备过程复杂及制备成本高昂等一系列问题。如何克服相应问题、发挥不同增溶方法的优势,或探寻新的增溶方法,更好地改善姜黄素等食品疏水功能因子的水溶性,更大限度地提高其生物利用度,仍是生产应用中面临的重要挑战。在实际应用过程中,应充分考虑不同物质的增溶效果及主次目的,选择合适、高效的姜黄素增溶方式,以实现姜黄素等食品疏水功能因子的应用价值最大化。
表1 姜黄素的增溶方法优缺点对比
Table 1 Comparison of advantages and disadvantages of different curcumin solubilization methods

增溶方法优点缺点包合增溶包合物稳定性好包合率低、制备工艺复杂微乳增溶增溶效果显著可食用表面活性剂有限固体分散增溶能掩盖姜黄素的微苦味稳定性差,容易再次转化为结晶态吸附增溶复合物稳定性高生物学特性有待进一步研究胶束增溶可用于大量制备后处理工序复杂,成本较高
[1] 罗钰湲, 张欢, 陈媛, 等. 柠檬籽纤维素纳米晶/纳米纤丝协同稳定Pickering乳液包埋姜黄素研究[J]. 食品与发酵工业, 2022, 48(15):162-168.
LUO Y Y, ZHANG H, CHEN Y, et al. Research on embedding curcumin by lemon seed cellulose nanocrystals/nanofibrils co-stabilized Pickering emulsion[J]. Food and Fermentation Industries, 2022, 48(15):162-168.
[2] 陈帅, 高彦祥. 基于β-环糊精的姜黄素传递载体的研究进展[J]. 中国调味品, 2019, 44(1):154-158.
CHEN S, GAO Y X. Research progress on delivery carrier of curcumin based on β-cyclodextrins[J]. China Condiment, 2019, 44(1):154-158.
[3] 黄浩河, 黄崇杏, 张霖雲, 等. 姜黄素在食品保鲜中应用的研究进展[J]. 食品工业科技, 2020, 41(7):320-324;331.
HUANG H H, HUANG C X, ZHANG L Y, et al. Research progress of curcumin in food preservation application[J]. Science and Technology of Food Industry, 2020, 41(7):320-324;331.
[4] LAN X, LIU Y Y, WANG L, et al. A review of curcumin in food preservation: Delivery system and photosensitization[J]. Food Chemistry, 2023, 424:136464.
[5] HUA C Y, KAI K, BI W L, et al. Curcumin induces oxidative stress in Botrytis cinerea, resulting in a reduction in gray mold decay in kiwifruit[J]. Journal of Agricultural and Food Chemistry, 2019, 67(28):7968-7976.
[6] WANG L, MU R J, LI Y Z, et al. Characterization and antibacterial activity evaluation of curcumin loaded konjac glucomannan and zein nanofibril films[J]. LWT, 2019, 113:108293.
[7] LAN X, LIU Y Y, WANG L, et al. A review of curcumin in food preservation: Delivery system and photosensitization[J]. Food Chemistry, 2023, 424:136464.
[8] TANG C H. Nano complexation of proteins with curcumin: From interaction to nanoencapsulation (A review)[J]. Food Hydrocolloids, 2020, 109:106106.
[9] 王华瑜, 沈朝璐, 袁玥, 等. 负载姜黄素的玉米多孔淀粉微球的优化制备、理化性质及释放研究[J]. 食品与发酵工业, 2023, 49(3):182-188.
WANG H Y, SHEN C L, YUAN Y, et al. Optimized preparation, physicochemical properties, and in vitro release research of curcumin loaded corn porous starch microspheres[J]. Food and Fermentation Industries, 2023, 49(3):182-188.
[10] AI C, ZHAO C G, XIANG C H, et al. Gum Arabic as a sole wall material for constructing nanoparticle to enhance the stability and bioavailability of curcumin[J]. Food Chemistry: X, 2023, 18:100724.
[11] ZAREI A, KHAZDOOZ L, KHOJASTEGI A, et al. Oil soluble iron: Curcumin derivatives and their complex[J]. Food Chemistry, 2024, 431:137085.
[12] WANG H L, HAO L L, WANG P, et al. Release kinetics and antibacterial activity of curcumin loaded zein fibers[J]. Food Hydrocolloids, 2017, 63:437-446.
[13] ZENG Z, DENG S Q, LIU Y, et al. Targeting transportation of curcumin by soybean lipophilic protein nano emulsion: Improving its bioaccessibility and regulating intestinal microorganisms in mice[J]. Food Hydrocolloids, 2023, 142:108781.
[14] ARYA P, RAGHAV N. In-vitro studies of curcumin-β-cyclodextrin inclusion complex as sustained release system[J]. Journal of Molecular Structure, 2021, 1228:129774.
[15] 李艺, 梅虎, 赵春景, 等. 姜黄素环糊精分子包合物的构建和优化[J]. 食品与生物技术学报, 2017, 36(11):1197-1202.
LI Y, MEI H, ZHAO C J, et al. Preparation and process optimization of curcumin-cyclodextrin inclusion complexes[J]. Journal of Food Science and Biotechnology, 2017, 36(11):1197-1202.
[16] 李宁. 姜黄素-羟丙基-β-环糊精包合物的制备及药代动力学研究[D]. 合肥: 安徽医科大学, 2018.
LI N. Preparation of curcumin-hydroxypropyl-β-cyclodextrin inclusion complex and investigation on its oral bioavailability[D]. Hefei: Anhui Medical University, 2018.
[17] CELEBIOGLU A, UYAR T. Fast-dissolving antioxidant curcumin/cyclodextrin inclusion complex electrospun nanofibrous webs[J]. Food Chemistry, 2020, 317:126397.
[18] 李霄. 姜黄素/二甲基-β-环糊精包合物的制备、表征及其性质[D]. 重庆: 重庆师范大学, 2019.
LI X. Preparation, characterization and properties of curcumin/DM-β-CD inclusion complex[D]. Chongqing: Chongqing Normal University, 2019.
[19] WU C C, ZHANG H T, GAO Z X, et al. Enhanced solubility of curcumin by complexation with fermented cyclic β-1, 2-glucans[J]. Journal of Pharmaceutical and Biomedical Analysis, 2022, 211:114613.
[20] 张梦柯. 环糊精包合及大分子修饰对其包埋释放行为的影响研究[D]. 无锡: 江南大学, 2019.
ZHANG M K. Effects of cyclodextrin complexation and macromolecular modification on its encapsulation and release behavior[D]. Wuxi: Jiangnan University, 2019.
[21] 肖萍. 超分子主体分子/姜黄素类化合物包合作用及其抗肿瘤活性的研究[D]. 扬州: 扬州大学, 2021.
XIAO P. Study on the inclusion of supramolecular host molecules and curcuminoid and their anti-tumor activity[D]. Yangzhou: Yangzhou University, 2021.
[22] 王凯, 雷声, 蒋举兴, 等. 辛烯基琥珀酸短链葡聚糖包埋橙花叔醇的研究[J]. 食品研究与开发, 2019, 40(24):144-152.
WANG K, LEI S, JIANG J X, et al. Studies on the embedding of orange blossom tertiary alcohols with octenyl succinic acid short-chain dextran[J]. Food Research and Development, 2019, 40(24):144-152.
[23] 冯涛, 曾小兰, 张钰, 等. 短链葡聚糖包合姜黄素的分子机制[J]. 现代食品科技, 2018, 34(10):111-116;140.
FENG T, ZENG X L, ZHANG Y, et al. Molecular mechanism underlying inclusion complexation of curcumin with short-chain glucan[J]. Modern Food Science and Technology, 2018, 34(10):111-116;140.
[24] DHINGRA D, BISHT M, BHAWNA B, et al. Enhanced solubility and improved stability of curcumin in novel water-in-deep eutectic solvent microemulsions[J]. Journal of Molecular Liquids, 2021, 339:117037.
[25] 孔维恺忻, 鄢尤奇, 蔡文康, 等. 十二烷基硫酸钠和吐温20复配体系对姜黄素的增溶和保护作用[J]. 北京大学学报(医学版), 2021, 53(1):227-231.
KONG W, YAN Y Q, CAI W K, et al. Solubilization and protection of curcumin by sodium dodecyl sulfate and tween 20 complex system[J]. Journal of Peking University (Health Sciences), 2021, 53(1):227-231.
[26] ARANGO-RUIZ  , MARTIN
, MARTIN  , COSERO M J, et al. Encapsulation of curcumin using supercritical antisolvent (SAS) technology to improve its stability and solubility in water[J]. Food Chemistry, 2018, 258:156-163.
, COSERO M J, et al. Encapsulation of curcumin using supercritical antisolvent (SAS) technology to improve its stability and solubility in water[J]. Food Chemistry, 2018, 258:156-163.
[27] ADITYA N P, YANG H, KIM S, et al. Fabrication of amorphous curcumin nanosuspensions using β-lactoglobulin to enhance solubility, stability, and bioavailability[J]. Colloids and Surfaces B: Biointerfaces, 2015, 127:114-121.
[28] FU D W, TIAN Y, WANG Z H, et al. Development of an Antarctic krill oil based self-microemulsion drug delivery system and its enhancement of bioaccessibility for curcumin[J]. Food Bioscience, 2023, 53:102762.
[29] LIU W J, PAN N, HAN Y, et al. Solubilization, stability and antioxidant activity of curcumin in a novel surfactant-free microemulsion system[J]. LWT, 2021, 147:111583.
[30] ZAINUDDIN N, AHMAD I, ZULFAKAR M H, et al. Cetyltrimethylammonium bromide-nanocrystalline cellulose (CTAB-NCC) based microemulsions for enhancement of topical delivery of curcumin[J]. Carbohydrate Polymers, 2021, 254:117401.
[31] 包海蓉, 陈百科. 固体分散体的制备及其在保健食品中的应用[J]. 食品工业科技, 2021, 42(16):397-403.
BAO H R, CHEN B K. Preparation of solid dispersion and its application in functional food[J]. Science and Technology of Food Industry, 2021, 42(16):397-403.
[32] XI Z Y, FEI Y L, WANG Y X, et al. Solubility improvement of curcumin by crystallization inhibition from polymeric surfactants in amorphous solid dispersions[J]. Journal of Drug Delivery Science and Technology, 2023, 83:104351.[LinkOut]
[33] FAN N, MA P P, WANG X, et al. Storage stability and solubilization ability of HPMC in curcumin amorphous solid dispersions formulated by Eudragit E100[J]. Carbohydrate Polymers, 2018, 199:492-498.
[34] 任莉莉, 陈静, 李先君, 等. 姜黄素固体分散体高效制备工艺优选[J]. 食品与药品, 2022, 24(4):300-303.
REN L L, CHEN J, LI X J, et al. Optimization of efficient preparation technology of curcumin solid dispersion[J]. Food and Drug, 2022, 24(4):300-303.
[35] 韩加伟. 基于绿色工艺的姜黄素固体分散体制备与体内外评价[D]. 南京: 南京中医药大学, 2019.
HAN J W. Preparation of curcumin solid dispersion based on green technology and its evaluation in vivo and in vitro[D]. Nanjing: Nanjing University of Chinese Medicine, 2019.
[36] 常道潇. 姜黄素-甘草酸固体分散体的制备与评价[D]. 银川: 宁夏医科大学, 2018.
CHANG D X. Preparation and evaluation of curcumin-glycyrrhizin solid dispersion[D]. Yinchuan: Ningxia Medical University, 2018.
[37] PAN-ON S, TIYABOONCHAI W. Development, characterization and Caco-2 cells absorption of curcumin solid dispersion for oral administration[J]. Journal of Drug Delivery Science and Technology, 2023, 86:104574.
[38] LANG W, TAGAMI T, KANG H J, et al. Partial depolymerization of tamarind seed xyloglucan and its functionality toward enhancing the solubility of curcumin[J]. Carbohydrate Polymers, 2023, 307:120629.
[39] ANSARIFAR E, SHAHIDI F, MOHEBBI M, et al. Optimization of limonene microencapsulation based on native and fibril soy protein isolate by VIKOR method[J]. LWT, 2019, 115:107884.
[40] JI F Y, XU J J, LIU H H, et al. Improved water solubility, antioxidant, and sustained-release properties of curcumin through the complexation with soy protein fibrils[J]. LWT, 2023, 180:114723.
[41] MOHAMMADIAN M, SALAMI M, MOMEN S, et al. Enhancing the aqueous solubility of curcumin at acidic condition through the complexation with whey protein nanofibrils[J]. Food Hydrocolloids, 2019, 87:902-914.
[42] HU Y, HE C X, JIANG C J, et al. Complexation with whey protein fibrils and chitosan: A potential vehicle for curcumin with improved aqueous dispersion stability and enhanced antioxidant activity[J]. Food Hydrocolloids, 2020, 104:105729.
[43] 吕晨艳,江政辉,赵广华.一种提高姜黄素水溶性和小肠消化稳定性的方法:中国, CN113907353A[P].2022-01-11.
LYU C Y, JIANG Z H, ZHAO G H. A method for improving the water solubility and digestive stability of curcumin in small intestine: China, CN113907353A[P].2022-01-11.
[44] LI L, YAO P. High dispersity, stability and bioaccessibility of curcumin by assembling with deamidated zein peptide[J]. Food Chemistry, 2020, 319:126577.
[45] LANGRIDGE T D, GEMEINHART R A. Toward understanding polymer micelle stability: Density ultracentrifugation offers insight into polymer micelle stability in human fluids[J]. Journal of Controlled Release, 2020, 319:157-167.
[46] 赵晨阳. 氨基酸对辛烯基琥珀酸燕麦β-葡聚糖酯自聚集行为的影响及其机制研究[D]. 重庆: 西南大学, 2020.
ZHAO C Y. The effects of amino acids on the self-aggregation behavior of octenylsuccinated oat β-glucan micelles and its mechanisms[D]. Chongqing: Southwest University, 2020.
[47] ZHANG Q H, WANG H, FENG Z M, et al. Preparation of pectin-tannic acid coated core-shell nanoparticle for enhanced bioavailability and antihyperlipidemic activity of curcumin[J]. Food Hydrocolloids, 2021, 119:106858.
[48] 高丽, 刘嘉, 董楠, 等. OSG胶束增溶姜黄素在果汁中的热及贮藏稳定性[J]. 食品与发酵工业, 2016, 42(8):71-74.
GAO L, LIU J, DONG N, et al. Thermal and storage stability of solubilized curcumin in OSG micelles using in juices[J]. Food and Fermentation Industries, 2016, 42(8):71-74.
[49] YE F Y, LEI D D, WANG S M, et al. Polymeric micelles of octenylsuccinated corn dextrin as vehicles to solubilize curcumin[J]. LWT, 2017, 75:187-194.
[50] WANG Y Y, JIANG W, JIANG Y C, et al. Self-assembled nano-micelles of lactoferrin peptides: Structure, physicochemical properties, and application for encapsulating and delivering curcumin[J]. Food Chemistry, 2022, 387:132790.
[51] ZHI K K, WANG R X, WEI J Q, et al. Self-assembled micelles of dual-modified starch via hydroxypropylation and subsequent debranching with improved solubility and stability of curcumin[J]. Food Hydrocolloids, 2021, 118:106809.
[52] LIU Q, LI F, JI N, et al. Acetylated debranched starch micelles as a promising nanocarrier for curcumin[J]. Food Hydrocolloids, 2021, 111:106253.