多酚[1]、益生菌[2]、类胡萝卜素[3]等食品级生物活性物质具有多种对人体有益的功效,如增强免疫力、延缓衰老、抗肿瘤、预防心血管疾病、延缓阿尔兹海默症发展等,常作为有效成分添加到功能性食品或营养保健品中。但是大多数生物活性物质水溶性差,易受光、热、pH等环境条件影响而导致生物利用率低,而用于活性物质的包埋、缓释、输送的递送体系通常能够提高其生物利用度,具有很高的研究价值。
常见的递送体系有纳米颗粒、凝胶、乳液、脂质体等。植物蛋白基纳米颗粒是以植物蛋白为原料制备的粒径为10~1 000 nm的胶体颗粒。植物蛋白来源广泛、品种多样、价格低廉、营养价值高,且具有优异的两亲性、乳化性、凝胶性等功能特性。利用植物蛋白合成的纳米颗粒在稳定乳液、负载活性成分方面具有很大潜力。目前已有研究使用玉米醇溶蛋白、大豆蛋白等制备纳米颗粒,证明其对一些生物活性物质具有很好的包封效果[4],但随着研究的不断深入,越来越多的研究人员发现使用单一植物蛋白可能会存在包埋率低、对环境敏感、胃肠控释性差的现象,而利用植物蛋白与其他聚合物结合,不仅可以弥补单一植物蛋白基纳米颗粒的不足,还可以联合多种聚合物的优点,如缓释、延迟消化、增强黏膜黏附性,因此制备复合纳米颗粒逐渐成为研究趋势[5]。本文综述了植物蛋白基复合纳米颗粒的种类、特点以及制备方法,对其在生物活性物质递送中的应用进行了总结,最后对植物蛋白基复合纳米颗粒的发展前景进行了展望。
1 植物蛋白基复合纳米颗粒的种类与特点
1.1 蛋白质-蛋白质复合纳米颗粒
蛋白质表面有多种官能团(如胺基、羧基、硫醇基等),可修饰纳米颗粒,改变其表面化学性质,具有两亲性的蛋白质(分子上同时具有极性和非极性氨基酸残基)也可以作为其他植物蛋白基纳米颗粒的稳定剂。蛋白质之间存在共价相互作用和非共价相互作用,有些蛋白质(如豌豆蛋白、乳清蛋白)也会通过2种作用相结合,吸附在其他蛋白纳米颗粒表面提高其物理稳定性和氧化稳定性[6]。基于不同蛋白质开发的复合纳米颗粒也可以平衡氨基酸含量并提高营养价值[7]。
研究发现,乳清蛋白纳米原纤维可以通过氢键和疏水相互作用吸附在玉米醇溶蛋白(Zein)聚集体表面,改善了玉米醇溶蛋白纳米颗粒的热稳定性和抗氧化性[8]。牛血清白蛋白也可以吸附在玉米醇溶蛋白纳米颗粒表面,以提供空间排斥和静电稳定性,从而增强纳米颗粒对环境应力(如pH值、离子强度和热处理)的物理化学稳定性[9]。
1.2 蛋白质-多糖复合纳米颗粒
多糖通常包覆在蛋白质纳米颗粒表面,在颗粒之间提供有效的排斥作用,防止聚集和沉降,也可以减少胃蛋白酶与底物的接触来限制胃肠道中蛋白质的消化。蛋白质经过糖基化改性,其pH稳定性、热稳定性以及消化稳定性能有所改善。蛋白质与多糖之间可以通过非共价相互作用以及共价相互作用结合,如图1所示。多糖根据自身所带电荷不同,分为阳离子多糖(如壳聚糖)和阴离子多糖(如海藻酸钠、果胶等)。应根据研究目的选择使用,如壳聚糖具有良好的黏附性和渗透性,因此和蛋白质结合可以提高生物活性物质的肠道通透性,而带有羧基基团的海藻酸钠和果胶,在胃液的酸性条件下能够收缩保护活性物质,而在肠道近中性环境中溶胀释放,可提高生物利用度[10-11]。
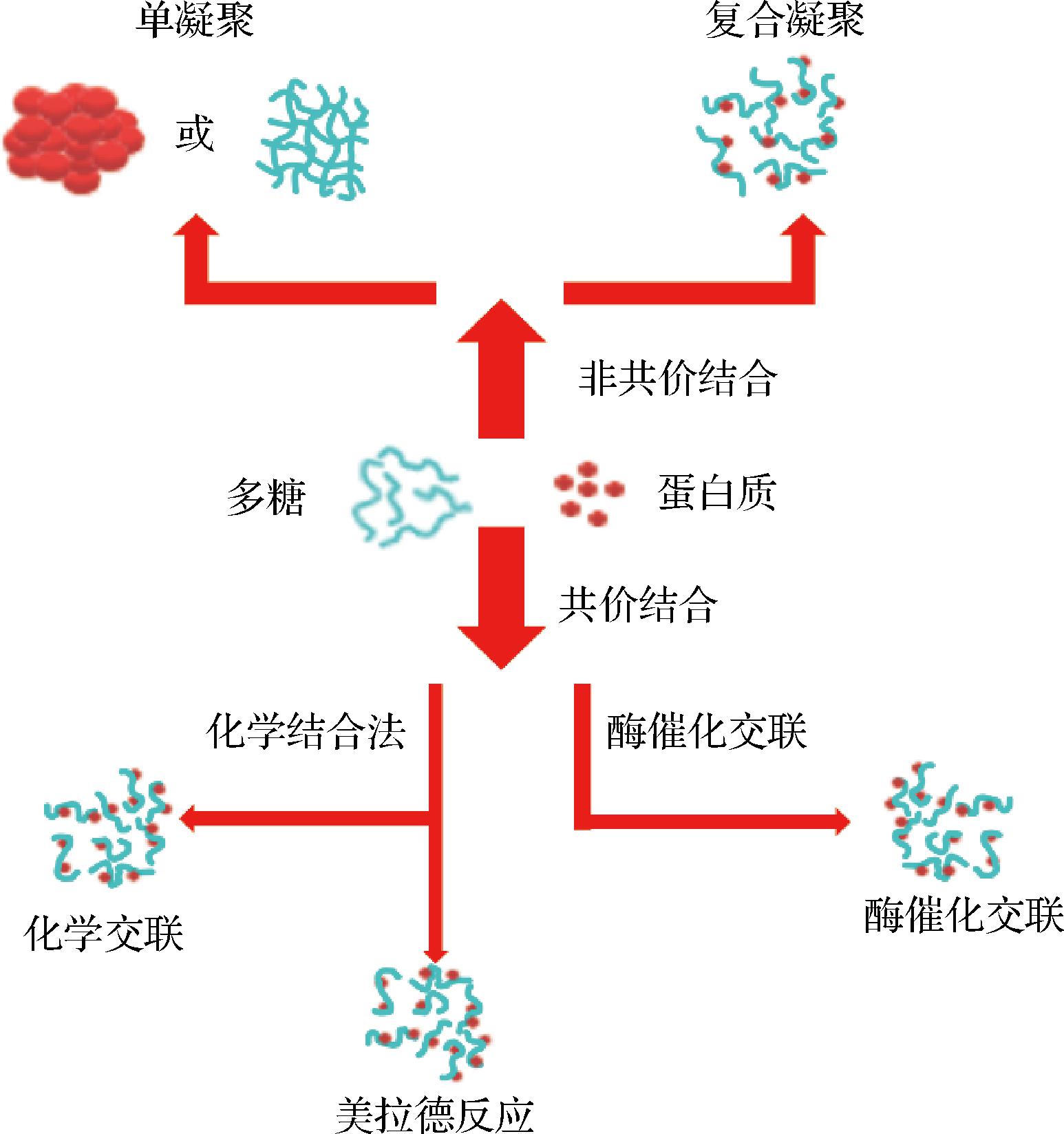
图1 多糖和蛋白质之间的相互作用[10]
Fig.1 Interaction between polysaccharides and proteins
可溶性大豆多糖(soluble soybean polysaccharides, SSPS)是一种天然阴离子多糖,具有水溶性好、黏度低、高温条件下稳定等优点。SSPS和纤维素纳米晶涂层可分别提高Zein和大豆分离蛋白(soy isolate protein, SIP)纳米颗粒的胶体稳定性、pH稳定性和盐稳定性[12-13]。羧甲基糊精也可沉积在Zein颗粒表面,二者通过静电引力结合,使纳米颗粒粒径增大[14]。同时,将羧甲基化玉米纤维胶包覆在高营养豌豆蛋白表面形成壳-核结构,这种纳米颗粒具有高负电荷和高稳定性[15]。
1.3 蛋白质-多酚复合纳米颗粒
多酚和植物蛋白可通过非共价相互作用结合形成配合物(图2),也可以通过共价相互作用结合形成共轭物(图3)。非共价相互作用是可逆的,主要涉及静电相互作用、疏水相互作用和氢键等非共价作用力。大多数植物蛋白的等电点为4~5,在酸性条件下(即pH![]() O键和多酚上的氢供体之间还可以形成氢键。共价相互作用是不可逆的,通常比非共价相互作用更稳定,共价复合物可通过碱法、酶法和自由基法制备,碱法与酶法的作用原理类似,酚类在碱性条件下被氧气氧化,或在酶促交联反应中被酶氧化,生成醌类化合物,随后醌类化合物被蛋白质的亲核基团攻击形成C—S或C—N共价键。对于自由基法,抗坏血酸首先被H2O2氧化形成自由基,自由基从蛋白质大分子的氨基或羟基上夺取氢原子,生成蛋白质大分子自由基,酚类与其共价结合就会生成偶联物[16]。
O键和多酚上的氢供体之间还可以形成氢键。共价相互作用是不可逆的,通常比非共价相互作用更稳定,共价复合物可通过碱法、酶法和自由基法制备,碱法与酶法的作用原理类似,酚类在碱性条件下被氧气氧化,或在酶促交联反应中被酶氧化,生成醌类化合物,随后醌类化合物被蛋白质的亲核基团攻击形成C—S或C—N共价键。对于自由基法,抗坏血酸首先被H2O2氧化形成自由基,自由基从蛋白质大分子的氨基或羟基上夺取氢原子,生成蛋白质大分子自由基,酚类与其共价结合就会生成偶联物[16]。
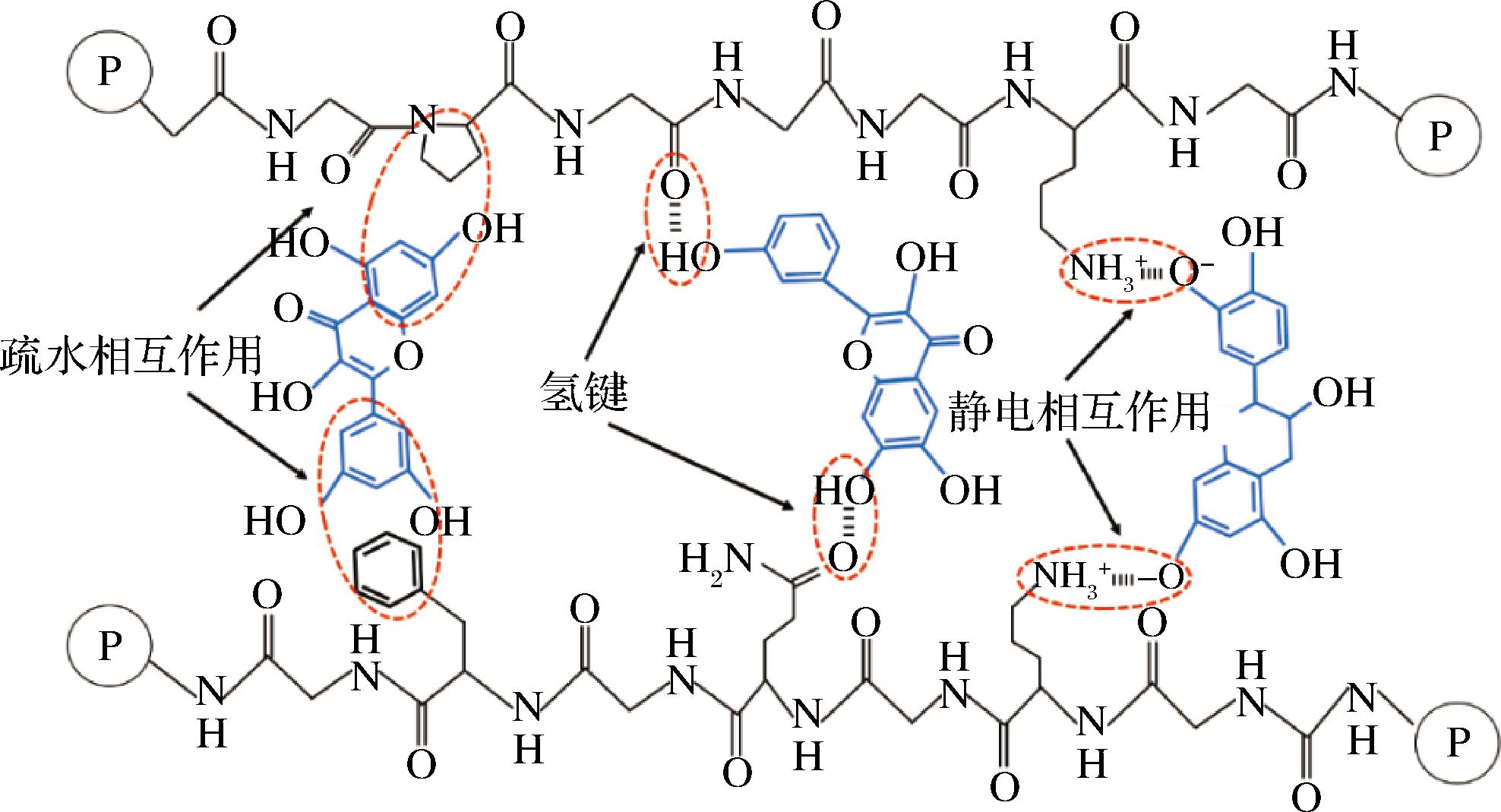
图2 多酚与蛋白质的非共价相互作用
Fig.2 Non-covalent interaction of polyphenols with proteins
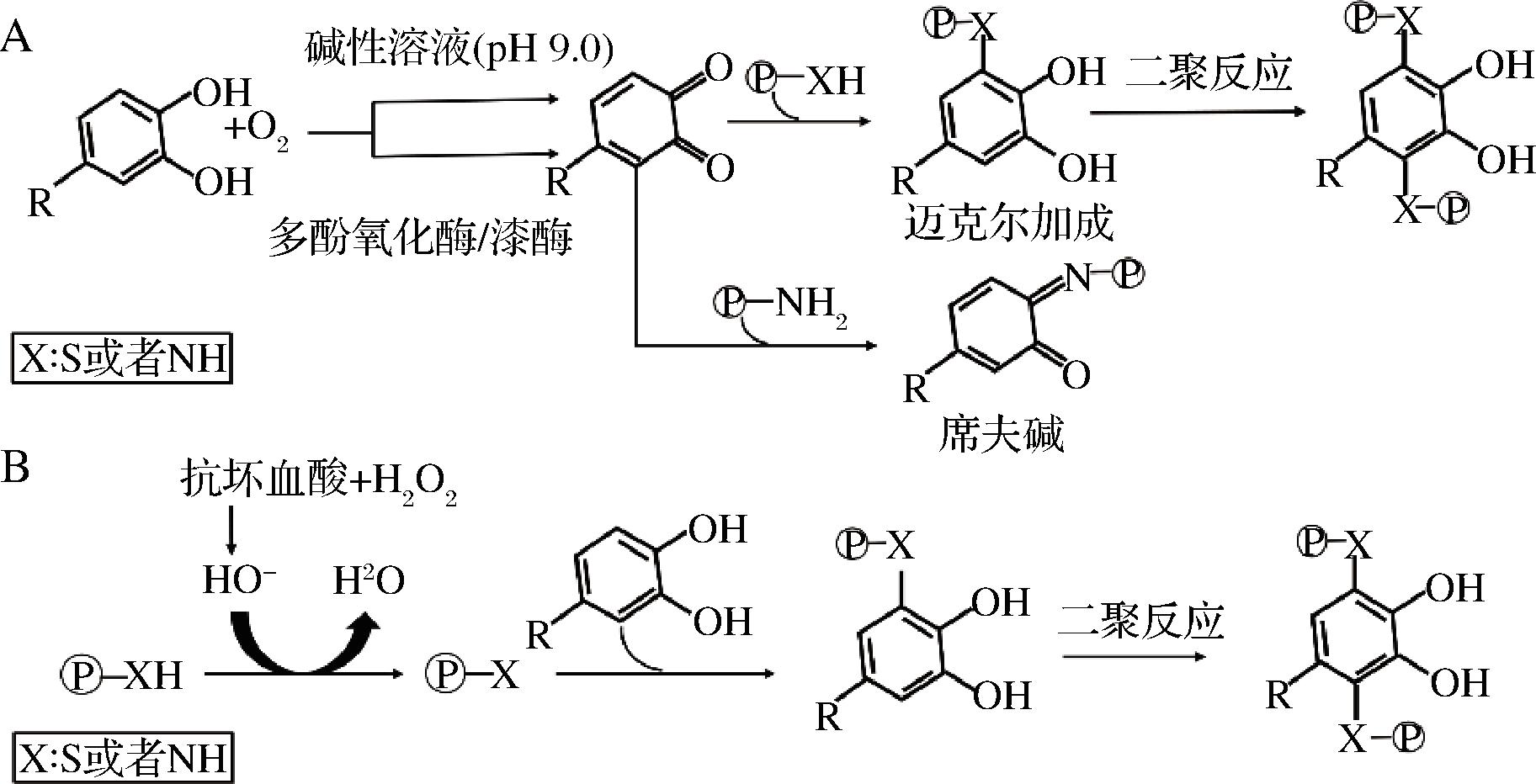
A-碱法和酶法;B-自由基法
图3 多酚与蛋白质的共价相互作用[16]
Fig.3 Covalent interaction of polyphenols with proteins
基于植物蛋白和多酚制备的胶体纳米颗粒,不仅可以改善蛋白质的功能特性(如抗氧化性、乳化性、发泡性等),还可以作为多酚的递送载体,增强其稳定性,并保持膳食多酚的相关健康特性(如抗炎和抗糖尿病特性),因此,蛋白质-多酚复合纳米颗粒在食品和医药领域研究广泛[17]。研究发现将表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和热处理改性SIP结合后,克服了单一SIP载体的不稳定性,SIP还可以和花青素共价交联,这种材料在稳定Pickering乳液方面具有优越的性能[18-19]。
1.4 蛋白质-表面活性剂复合纳米颗粒
表面活性剂通常由亲水性头部和疏水性尾部2部分组成,具有两亲性,可以吸附到汽/液、液/液等界面降低表面张力,从而产生良好的乳化、起泡性。表面活性剂包覆到蛋白质颗粒表面形成壳核结构,也可用于提高疏水性蛋白质纳米颗粒在水中的分散性和稳定性。蛋白质-表面活性剂体系相互作用的研究多集中于蛋白质与离子型表面活性剂,且阴离子型表面活性剂比阳离子型作用强,而非离子型表面活性剂仅能与水溶性蛋白质发生较弱的相互作用。一般而言,存在以下3种作用类型:一是表面活性剂通过静电作用或疏水作用与蛋白质的特异性位点结合;二是表面活性剂以协同作用吸附未发生构象转变的蛋白质;三是表面活性剂以协同作用吸附发生构象转变的蛋白质。
鼠李糖脂是一种阴离子表面活性剂,具有良好的表面活性。已有研究将鼠李糖脂和麦醇溶蛋白以及玉米醇溶蛋白结合,鼠李糖脂的存在显著提高了纳米颗粒的稳定性和对生物活性物质的包封效率[20]。卵磷脂是一种磷脂类两性离子表面活性剂,也是常用作和蛋白质复合的材料之一,卵磷脂可使玉米醇溶蛋白纳米颗粒的尺寸减小,结构更加致密,对生物活性物质的包封效率显著增强[21]。
1.5 植物蛋白基三元复合纳米颗粒
三元复合纳米颗粒即采用各种物理化学方法以3种不同物质(蛋白质/多糖/多酚/表面活性剂等)为原料制备的纳米颗粒,通常3种物质具有很好的协同效果,能更好的稳定纳米颗粒。YUAN等[22]设计了1种由玉米醇溶蛋白、硫酸软骨素、槐糖脂组成的三元复合纳米颗粒,其中使用的槐糖脂属于表面活性剂,这种复合材料在pH稳定性、热稳定性和化学稳定性方面表现出优异的性能,并具有良好的生物相容性和抗癌活性。有研究将Zein、果胶和茶多酚复合,制备的三元复合纳米颗粒在水中表现出良好的再分散性,对pH和离子应力表现出更高的稳定性[23]。
2 植物蛋白基复合纳米颗粒的制备方法
2.1 反溶剂沉淀法
反溶剂沉淀法是制备疏水性植物蛋白基纳米颗粒最常用的方法。通常以乙醇等有机溶液作为溶剂相,以水作为反溶剂相,将含有蛋白质的有机溶液在剪切作用下注入到反溶剂相中,由于极性的变化,蛋白质发生自组装,形成亲水外壳和疏水核心,之后通过蒸发或萃取去除有机溶剂,生物聚合物沉淀并产生纳米颗粒。其他的生物聚合物吸附在纳米颗粒表面,通过增加静电相互作用或降低疏水相互作用来提高其稳定性[7]。反溶剂沉淀法按照原料成分的混溶顺序不同可分为反溶剂共沉淀法和逐步反溶剂沉淀法。前者是先将制备纳米颗粒的不同原料成分(包括蛋白质、多糖、多酚等)共溶于溶剂相中形成溶液,然后再将溶液注入反溶剂相中,通过旋转蒸发等方法去除溶剂相后,原料成分由于溶解度降低会同时自发形成复合纳米颗粒;后者是先将蛋白质溶于溶剂相,再注入反溶剂相中,自发形成纳米颗粒后,再与含有其他原料的溶液混合,其他原料成分会附着在预先形成的蛋白质纳米颗粒上,再除去溶剂相,就制成了复合纳米颗粒[24],如图4所示。
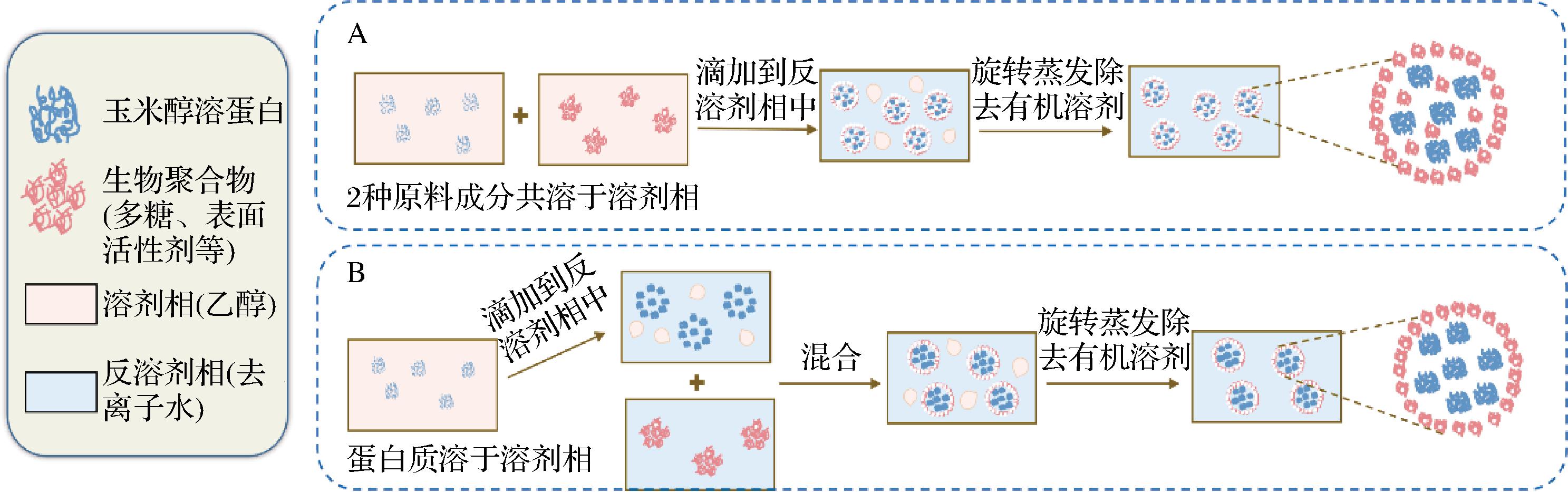
A-反溶剂共沉淀法;B-逐步反溶剂沉淀法
图4 以玉米醇溶蛋白为例,通过反溶剂沉淀法制备复合纳米颗粒
Fig.4 The preparation method of composite nanoparticles by anti-solvent precipitation with Zein as examples
反溶剂沉淀法操作简单,成本低廉,可通过控制条件来调整颗粒特性(如尺寸、形态、物理特性),但也有不足,一是需要使用大量乙醇作为溶剂相,乙醇易燃,可能有爆炸风险[25];二是有机溶剂去除较为困难,通过旋转蒸发或喷雾干燥又会造成一定程度上的颗粒聚集;三是制备出的纳米颗粒浓度低,在工业生产上有一定局限性[26]。
2.2 pH循环法
pH循环法也被称为pH驱动法或pH诱导法,原理是基于蛋白质在极端酸性或碱性条件下结构展开,而调至中性pH会发生分子折叠,以制备纳米颗粒。使用该方法制备复合纳米颗粒所选择的生物聚合物、可以与植物蛋白同时溶解于强碱性溶液或强酸性溶液中,也可以先各自溶于不同pH溶液,再混合溶液后滴定。如Zein易溶于pH 11~13的碱性水溶液,当pH调节到中性时,却表现出较差的分散性,会与其他大分子物质结合自组装形成纳米颗粒[27],如图5所示。
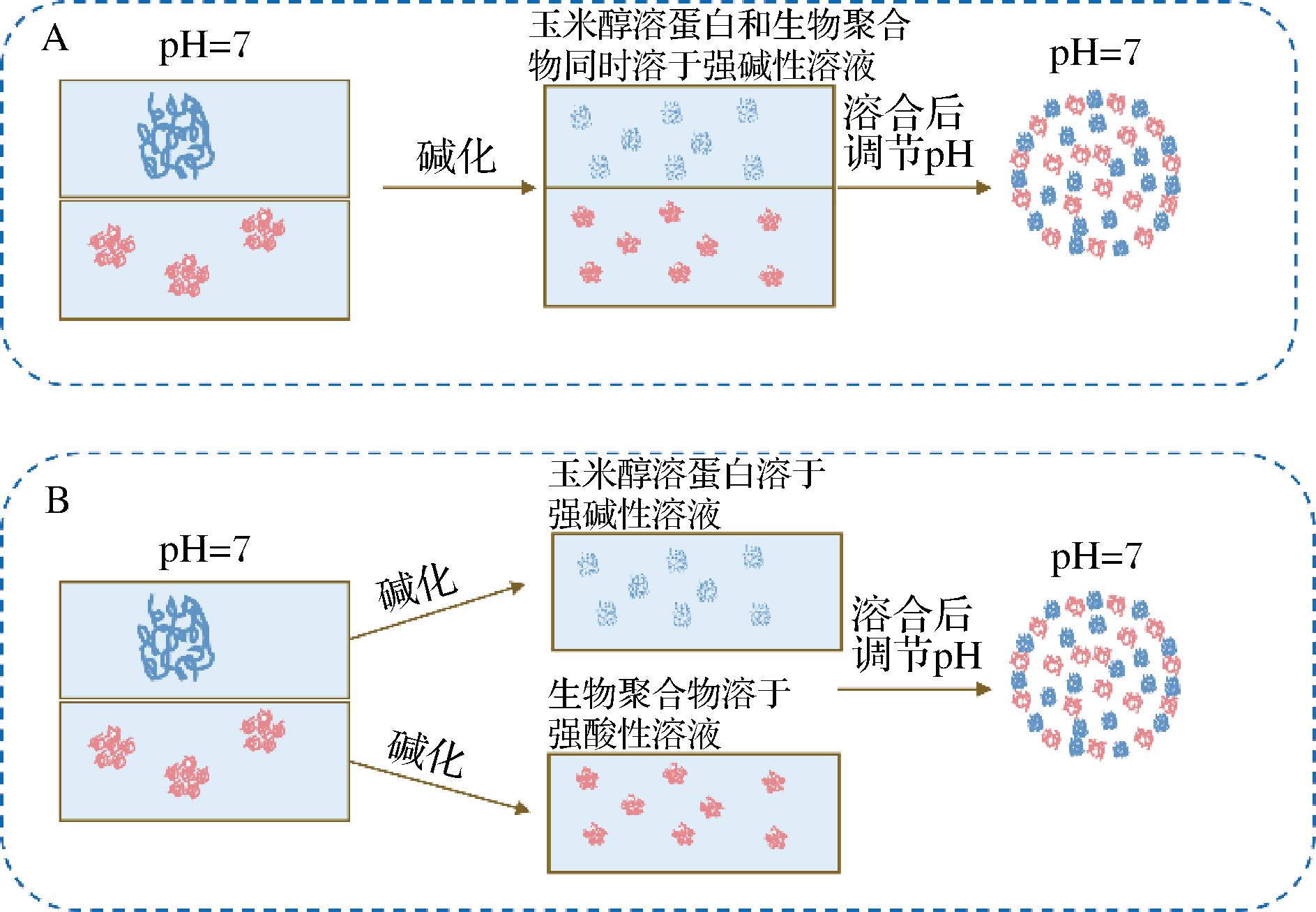
A-生物聚合物易溶于碱性溶液;B-生物聚合物易溶于酸性溶液
图5 以玉米醇溶蛋白为例,通过pH循环法制备复合纳米颗粒
Fig.5 The preparation method of composite nanoparticles by pH cycling with Zein as examples
pH循环法成本低、能量低、不需要使用有机溶剂,能够避免爆炸风险,是一种绿色、安全、高效的方法[28]。但是这种方法需要将强碱性溶液滴定至中性,比较耗时[7],而利用藻酸丙二醇酯的部分碱水解降低pH则免去了滴定过程。此外,纳米颗粒的稳定性易受酸化剂的影响,如盐酸作为酸化剂易导致大直径颗粒的形成和聚集,目前使用天然植酸代替盐酸,能够有效避免这种问题的发生[20,24]。
2.3 热诱导聚集法
蛋白质在等电点处的净电荷为零,此时静电斥力最小,疏水相互作用较强,在此pH条件下,将温度升至蛋白质变性温度以上,其结构改变,疏水基团暴露,疏水相互作用使蛋白质聚集,自组装形成纳米颗粒[29]。蛋白质在聚集过程中可以与其他大分子物质交联,如在等电点与多糖相互作用形成蛋白质-多糖复合纳米颗粒,可用于更好地包埋亲脂性生物活性物质[30],如图6所示。
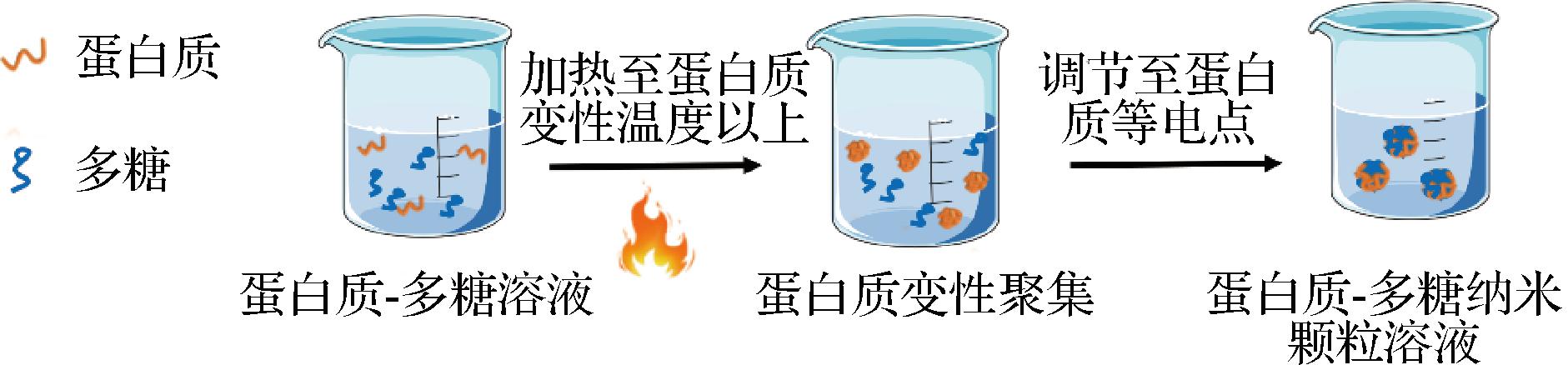
图6 热诱导法制备蛋白质-多糖纳米颗粒[30]
Fig.6 Preparation of protein-polysaccharide nanoparticles by heat-induced aggregation[30]
热诱导聚集法操作简单,成本低,适合在工业规模中应用,并且内部的疏水基团暴露有利于更好地与亲脂性生物活性物质结合。但是此种方法依赖于蛋白质分子的热变性和聚集以及静电相互作用,因此加热后最终复合纳米颗粒的特性受许多因素的影响,包括生物聚合物浓度和比例、电荷密度、pH、加热温度及离子强度等,此外,此种方法制备的纳米颗粒尺寸和形状不好控制[30-31]。
2.4 逐层组装法
逐层组装法是在反溶剂沉淀法的基础上建立的,通常涉及静电沉积原理。首先,采用反溶剂沉淀法,将蛋白质溶于溶剂相,再注入反溶剂相中,制备植物蛋白基纳米颗粒模板,接着将纳米颗粒溶液逐滴滴入第一种生物聚合物溶液中,聚合物附着到模板表面形成复合纳米颗粒;然后,再将复合纳米颗粒溶液逐滴滴入到带相反电荷的第二种生物聚合物溶液中,第二种生物聚合物通过静电吸引沉积到复合纳米颗粒外层,形成多层壳-核结构,最后通过旋转蒸发除去有机溶剂,再补充水分到溶液原有体积以维持各物质浓度不变,如图7所示。逐层组装法是制备多元复合纳米颗粒的常用方法,在中心纳米颗粒模板周围依次沉积阳离子和阴离子生物聚合物层,可以制备出具有不同功能属性的核壳纳米颗粒。
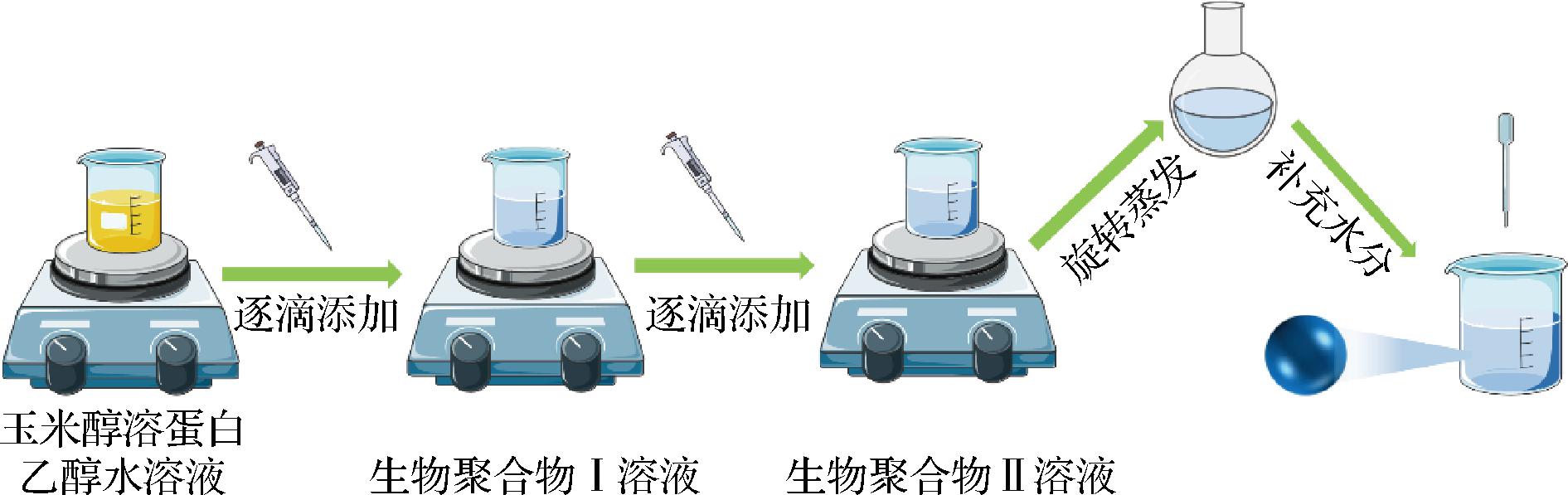
图7 逐层组装法制备复合纳米颗粒[33]
Fig.7 Preparation of composite nanoparticles by layer-by-layer assembly method[33]
逐层组合法作为一种封装药物和生物活性物质的新兴方法,具有以下优点:可选材料多样,可以通过涂覆表面或核心作为模板掺入不同的聚合物或活性物质,以改变生物活性物质的释放模式,增强胶体稳定性并改善渗透性[32],但是逐层组装法目前仍处于起步阶段,并未能在工业中大规模应用。
3 植物蛋白基复合纳米颗粒在生物活性物质递送中的应用
3.1 在多酚递送中的应用
多酚广泛存在于一些蔬菜、水果、谷物、茶和其他植物中,一般分为酚酸类、黄酮类、花色苷类、鞣质类等。膳食多酚对人体具有多种有益特性,如抗氧化、抗炎、抗癌等,还能够预防慢性疾病如糖尿性、高血压、动脉粥样硬化[34]。
但是许多酚类化合物水溶性差、易受环境条件影响,导致生物利用度低。而复合纳米颗粒可以提高多酚的封装效率,提高多酚稳定性。目前许多研究使用植物蛋白基复合纳米颗粒来对酚类化合物进行包封和递送,如表1所示。
表1 植物蛋白基复合纳米颗粒在多酚递送中的应用
Table 1 Application of plant protein-based composite nanoparticles in polyphenol delivery

酚类复合纳米颗粒材料制备方法效果参考文献姜黄素(Cur)谷醇溶蛋白-酪蛋白酸钠反溶剂/蒸发法增强了Cur热稳定性,抗氧化和抗肿瘤性能[35]SIP-纤维素纳米晶体pH循环法在模拟胃肠道消化过程中具有很好的持续释放性能[13]Zein-羧甲基糊精反溶剂沉淀法提高了Cur的稳定性和抗氧化活性[14]麦醇溶蛋白-鼠李糖脂pH循环法增强了Cur的光稳定性和热稳定性[20]EGCGZein-卵磷脂反溶剂共沉淀法包封效率高,缓释效果好,EGCG具有很好的抗氧化能力[36]壳聚糖-大麦粒蛋白液-液分散法提高了EGCG的跨细胞通透性[37]白藜芦醇(Res)海藻酸盐-壳聚糖-Zein反溶剂沉淀法提高了Res的光稳定性、缓释性和生物利用度[38]羧甲基壳聚糖-Zein-大豆卵磷脂雾化/反溶剂沉淀法Res的ABTS阳离子自由基清除活性增加,提高了生物可及性和贮存稳定性[5]槲皮素Zein-酪蛋白酸盐-κ-卡拉胶反溶剂沉淀法槲皮素的抗氧化活性和生物可及性增加[39]Zein-SSPS反溶剂沉淀法槲皮素化学稳定性和ABTS阳离子自由基清除能力增强[40]Zein-酪蛋白酸盐-壳聚糖逐层组装法槲皮素生物利用度和黏膜黏附性增强[11]叶黄素Zein-SSPS反溶剂沉淀法包封叶黄素的生物可利用性(32.11%)远高于非包封叶黄素(16.21%)[12]
注:Cur:curcumin;Res:resveratrol。
3.2 在精油递送中的应用
从植物中提取的精油具有优异的抗氧化活性和抗菌活性,但是精油水溶性差、易挥发,通常对外部环境敏感,大多数化合物在暴露于光、热和氧气的恶劣条件下时容易氧化和变质,在食品中应用有限[41]。此外,精油结构复杂,可能存在潜在的毒性,在临床药用方面也存在障碍。蛋白质作为两亲性化合物,将其制备成复合纳米颗粒包封精油,可以实现靶向递送,降低精油毒性[7,42]。植物蛋白基复合纳米颗粒在精油递送中的应用见表2。
表2 植物蛋白基复合纳米颗粒在精油递送中的应用
Table 2 Application of plant protein-based composite nanoparticles in essential oil delivery
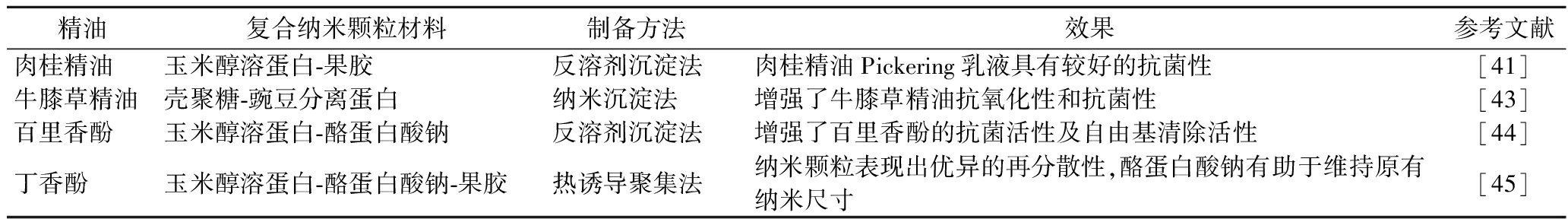
精油复合纳米颗粒材料制备方法效果参考文献肉桂精油玉米醇溶蛋白-果胶反溶剂沉淀法肉桂精油Pickering乳液具有较好的抗菌性[41]牛膝草精油壳聚糖-豌豆分离蛋白纳米沉淀法增强了牛膝草精油抗氧化性和抗菌性[43]百里香酚玉米醇溶蛋白-酪蛋白酸钠反溶剂沉淀法增强了百里香酚的抗菌活性及自由基清除活性[44]丁香酚玉米醇溶蛋白-酪蛋白酸钠-果胶热诱导聚集法纳米颗粒表现出优异的再分散性,酪蛋白酸钠有助于维持原有纳米尺寸[45]
3.3 在维生素递送中的应用
维生素是具有抗氧化特性的天然生物活性物质,是维持人类机体正常功能的必需品。维生素通常分脂溶性(维生素A、维生素D、维生素E和维生素K)和水溶性(维生素B和维生素C)。脂溶性维生素由于水溶性低、化学不稳定和生物利用度低等弊端限制了其在保健食品和药物中的应用。而对于水溶性维生素,使用单一蛋白质纳米颗粒作为递送材料存在负载能力低、容易在水环境中释放、在肠胃中不稳定、易降解等缺陷,所以就需要使用其他生物聚合物对蛋白质进行修饰。植物蛋白基复合纳米颗粒在维生素递送中的应用见表3。
表3 植物蛋白基复合纳米颗粒在维生素递送中的应用
Table 3 Application of plant protein-based composite nanoparticles in vitamin delivery

维生素复合纳米颗粒材料制备方法效果参考文献维生素D3羧甲基壳聚糖-Zein反溶剂沉淀法增强了维生素D3的控释性能和光化学稳定性[46]视黄醇壳聚糖-Zein反溶剂沉淀法增强了视黄醇的光化学稳定性[47]α-生育酚壳聚糖-Zein反溶剂沉淀法提高了α-生育酚在模拟胃肠道条件下的释放性能[48]核黄素Zein-海藻酸钠反溶剂沉淀法核黄素在模拟胃肠道条件下可延迟释放[13]维生素B12大麦蛋白-α-生育酚-磷脂高压均质法提高维生素B12在Caco-2细胞模型中的摄取和运输效率[49]
3.4 在类胡萝卜素递送中的应用
类胡萝卜素是一种异戊二烯类色素,具有优异的抗氧化性。有研究表明,食用富含类胡萝卜素的食物可以降低患动脉粥样硬化和某些癌症的风险。但是类胡萝卜素水溶性差、生物利用度低,从而在功能性食品中应用有限。β-胡萝卜素是最常见的类胡萝卜素,使用茶多酚作为交联剂,将Zein和羧甲基壳聚糖复合,能提升β-胡萝卜素的稳定性和模拟胃肠道条件下的释放性能[50]。使用Zein、海藻酸盐与磷脂酰胆碱复合来分别封装番茄红素和叶黄素,提高了2种物质的稳定性和分散性,减少了模拟胃pH值下的释放,而且在模拟肠道pH中能够实现持续释放[51]。虾青素是一种天然酮类胡萝卜素,因具有共轭双键结构导致其水溶性差,使用Zein、豌豆蛋白和果胶复合制备的三元纳米颗粒可增强虾青素的光热稳定性和贮存稳定性[52]。
4 结论与展望
植物蛋白基复合纳米颗粒可以克服单一植物蛋白递送材料的不足,其优异的功能特性在包封递送生物活性物质、提高生物利用度方面表现出巨大的潜力。植物蛋白基复合纳米颗粒常用的制备方法有:反溶剂沉淀法、pH循环法、热诱导聚集法、逐层组装法等,每种方法各有优缺点,应根据植物蛋白、聚合物和生物活性物质的种类和性质加以选择使用。
根据植物蛋白基复合纳米颗粒的研究现状,现提出以下几点展望:a)将不同方法结合,完善制备方法,克服单一方法的缺点,制备出性能更加优良的材料,并探究用于工业规模化的可能性;b)目前大多数对于纳米颗粒包封和递送效率的研究只是基于体外胃肠道模拟实验,所以应开展更多细胞实验和动物试验、结合代谢组学分析包封的活性成分及其代谢产物在体内的不同部位的生理活性;c)要评估材料的安全性及有效性,进而研究其在功能性食品、保健药品、临床药物等方面的应用。
[1] GARC A-CONESA M T, LARROSA M. Polyphenol-rich foods for human health and disease[J]. Nutrients, 2020, 12(2):400.
A-CONESA M T, LARROSA M. Polyphenol-rich foods for human health and disease[J]. Nutrients, 2020, 12(2):400.
[2] REQUE P M, BRANDELLI A. Encapsulation of probiotics and nutraceuticals: Applications in functional food industry[J]. Trends in Food Science &Technology, 2021, 114:1-10.
[3] YAO Y H, GOH H M, KIM J E. The roles of carotenoid consumption and bioavailability in cardiovascular health[J]. Antioxidants, 2021, 10(12):1978.
[4] LIU L L, LIU P Z, LI X T, et al. Novel soy β-conglycinin core-shell nanoparticles as outstanding ecofriendly nanocarriers for curcumin[J]. Journal of Agricultural and Food Chemistry, 2019, 67(22):6292-6301.
[5] ZHANG X, LI Y J, WU Z Y, et al. Development of carboxymethyl chitosan-coated zein/soy lecithin nanoparticles for the delivery of resveratrol[J]. Food &Function, 2023, 14(3):1636-1647.
[6] KRISTENSEN H T, CHRISTENSEN M, HANSEN M S, et al. Mechanisms behind protein-protein interactions in a β-lg-legumin co-precipitate[J]. Food Chemistry, 2022, 373:131509.
[7] WANG Y, WUSIGALE, LUO Y C. Colloidal nanoparticles prepared from zein and casein: Interactions, characterizations and emerging food applications[J]. Food Science and Human Wellness, 2023, 12(2):337-350.
[8] LIU Q G, CHENG J J, SUN X M, et al. Preparation, characterization, and antioxidant activity of zein nanoparticles stabilized by whey protein nanofibrils[J]. International Journal of Biological Macromolecules, 2021, 167:862-870.
[9] CHEN X, YU C, ZHANG Y, et al. Co-encapsulation of curcumin and resveratrol in zein-bovine serum albumin nanoparticles using a pH-driven method[J]. Food &Function, 2023, 14(7):3169-3178.
[10] 陈雅琼, 宋洪东, 吴懋, 等. 蛋白质-多糖复合体系在活性物质传递中的应用[J]. 化学进展, 2022, 34(10):2267-2282.
CHEN Y Q, SONG H D, WU M, et al. Application of protein-polysaccharide complex system in the delivery of active ingredients[J]. Progress in Chemistry, 2022, 34(10):2267-2282.
[11] ZHOU J F, ZHENG G D, WANG W J, et al. Physicochemical properties and bioavailability comparison of two quercetin loading zein nanoparticles with outer shell of caseinate and chitosan[J]. Food Hydrocolloids, 2021, 120:106959.
[12] LI H, YUAN Y K, ZHU J X, et al. Zein/soluble soybean polysaccharide composite nanoparticles for encapsulation and oral delivery of lutein[J]. Food Hydrocolloids, 2020, 103:105715.
[13] WANG S Y, LU Y Q, OUYANG X K, et al. Fabrication of soy protein isolate/cellulose nanocrystal composite nanoparticles for curcumin delivery[J]. International Journal of Biological Macromolecules, 2020, 165:1468-1474.
[14] MENG R, WU Z Z, XIE Q T, et al. Preparation and characterization of zein/carboxymethyl dextrin nanoparticles to encapsulate curcumin: Physicochemical stability, antioxidant activity and controlled release properties[J]. Food Chemistry, 2021, 340:127893.
[15] WEI Y, CAI Z X, WU M, et al. Core-shell pea protein-carboxymethylated corn fiber gum composite nanoparticles as delivery vehicles for curcumin[J]. Carbohydrate Polymers, 2020, 240:116273.
[16] YAN X H, ZENG Z L, MCCLEMENTS D J, et al. A review of the structure, function, and application of plant-based protein-phenolic conjugates and complexes[J]. Comprehensive Reviews in Food Science and Food Safety, 2023, 22(2):1312-1336.
[17] FOEGEDING E A, PLUNDRICH N, SCHNEIDER M, et al. Protein-polyphenol particles for delivering structural and health functionality[J]. Food Hydrocolloids, 2017, 72:163-173.
[18] LI J M, CHEN Z. Fabrication of heat-treated soybean protein isolate-EGCG complex nanoparticle as a functional carrier for curcumin[J]. LWT, 2022, 159:113059.
[19] JU M N, ZHU G, HUANG G, et al. A novel Pickering emulsion produced using soy protein-anthocyanin complex nanoparticles[J]. Food Hydrocolloids, 2020, 99:105329.
[20] CHEN S, MA Y C, DAI L, et al. Fabrication, characterization, stability and re-dispersibility of curcumin-loaded gliadin-rhamnolipid composite nanoparticles using pH-driven method[J]. Food Hydrocolloids, 2021, 118:106758.
[21] DAI L, SUN C X, LI R R, et al. Structural characterization, formation mechanism and stability of curcumin in zein-lecithin composite nanoparticles fabricated by antisolvent co-precipitation[J]. Food Chemistry, 2017, 237:1163-1171.
[22] YUAN Y K, MA M J, ZHANG S Z, et al. Effect of sophorolipid on the curcumin-loaded ternary composite nanoparticles self-assembled from zein and chondroitin sulfate[J]. Food Hydrocolloids, 2021, 113:106493.
[23] WANG X J, LI M, LIU F G, et al. Fabrication and characterization of zein-tea polyphenols-pectin ternary complex nanoparticles as an effective hyperoside delivery system: Formation mechanism, physicochemical stability, and in vitro release property[J]. Food Chemistry, 2021, 364:130335.
[24] ZHANG T, XU J M, CHEN J H, et al. Protein nanoparticles for Pickering emulsions: A comprehensive review on their shapes, preparation methods, and modification methods[J]. Trends in Food Science &Technology, 2021, 113:26-41.
[25] HU B, YANG Y S, HAN L Y, et al. Characterization of hydrophilic and hydrophobic core-shell microcapsules prepared using a range of antisolvent approaches[J]. Food Hydrocolloids, 2022, 131:107750.
[26] 佟臻, 高彦祥. 基于麦醇溶蛋白递送体系研究进展[J]. 食品工业科技, 2023, 44(14):448-456.
TONG Z, GAO Y X. Research progress based on gliadin delivery systems[J]. Science and Technology of Food Industry, 2023, 44(14):448-456.
[27] LIU Q, LI Y C, ZHOU Y, et al. Zein-whey protein isolate-carboxymethyl cellulose complex as carrier of apigenin via pH-driven method: Fabrication, characterization, stability, and in vitro release property[J]. Food Chemistry, 2022, 387:132926.
[28] 郑华明, 王江丽, 田宇航, 等. pH驱动法负载香芹酚纳米颗粒的制备及性能[J]. 高分子材料科学与工程, 2022, 38(8):177-184.
ZHENG H M, WANG J L, TIAN Y H, et al. Properties of carvacrol-loaded nanoparticles prepared by pH-driven method[J]. Polymer Materials Science &Engineering, 2022, 38(8):177-184.
[29] 陈杨玲, 焦叶, 崔波, 等. 蛋白基植物多酚纳米输送载体研究进展[J]. 食品与机械, 2022, 38(4):8-14.
CHEN Y L, JIAO Y, CUI B, et al. Research progress of protein-based plant polyphenol nano-delivery carriers[J]. Food &Machinery, 2022, 38(4):8-14.
[30] 梁洛丹, 曹伟伟, 李琳琳, 等. 蛋白质-多糖非共价及共价复合物包埋活性成分的研究进展[J]. 食品科学, 2023,44(21): 368-376.
LIANG L D, CAO W W, LI L L, et al. Progress in the study of bioactive compounds embedded by protein-polysaccharide non-covalent and covalent complex[J]. Food Science, 2023,44(21): 368-376.
[31] 高琦, 张首央, 唐子程, 等. 蛋白质纳米颗粒的制备及其在食品领域的应用研究进展[J]. 食品工业科技, 2023, 44(11):30-37.
GAO Q, ZHANG S Y, TANG Z C, et al. Research progress on preparation and application of protein nanoparticles in food field[J]. Science and Technology of Food Industry, 2023, 44(11):30-37.
[32] SHENDE P, PATIL A, PRABHAKAR B. Layer-by-layer technique for enhancing physicochemical properties of actives[J]. Journal of Drug Delivery Science and Technology, 2020, 56:101519.
[33] ALEHOSSEINI A, GHORANI B, SARABI-JAMAB M, et al. Principles of electrospraying: A new approach in protection of bioactive compounds in foods[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(14):2346-2363.
[34] ZHANG Z H, LI X J, SANG S Y, et al. Polyphenols as plant-based nutraceuticals: Health effects, encapsulation, nano-delivery, and application[J]. Foods, 2022, 11(15):2189.
[35] CHEN X, ZHANG T Y, WU Y C, et al. Foxtail millet prolamin as an effective encapsulant deliver curcumin by fabricating caseinate stabilized composite nanoparticles[J]. Food Chemistry, 2022, 367:130764.
[36] XIE H J, LIU C Z, GAO J, et al. Fabrication of Zein-Lecithin-EGCG complex nanoparticles: Characterization, controlled release in simulated gastrointestinal digestion[J]. Food Chemistry, 2021, 365:130542.
[37] SONG H D, HE A J, GUAN X, et al. Fabrication of chitosan-coated epigallocatechin-3-gallate (EGCG)-hordein nanoparticles and their transcellular permeability in Caco-2/HT29 cocultures[J]. International Journal of Biological Macromolecules, 2022, 196:144-150.
[38] KHAN M A, YUE C, FANG Z, et al. Alginate/chitosan-coated zein nanoparticles for the delivery of resveratrol[J]. Journal of Food Engineering, 2019, 258:45-53.
[39] ZOU Y, QIAN Y, RONG X Y, et al. Encapsulation of quercetin in biopolymer-coated zein nanoparticles: Formation, stability, antioxidant capacity, and bioaccessibility[J]. Food Hydrocolloids, 2021, 120:106980.
[40] LI H, WANG D F, LIU C Z, et al. Fabrication of stable zein nanoparticles coated with soluble soybean polysaccharide for encapsulation of quercetin[J]. Food Hydrocolloids, 2019, 87:342-351.
[41] JIANG Y, WANG D, LI F, et al. Cinnamon essential oil Pickering emulsion stabilized by zein-pectin composite nanoparticles: Characterization, antimicrobial effect and advantages in storage application[J]. International Journal of Biological Macromolecules, 2020, 148:1280-1289.
[42] ANGOURANI H R, HEYDARI M, YOUSEFI A R, et al. Nanoparticles based-plant protein containing Rosmarinus officinalis essential oil; fabrication, characterization, and evaluation[J]. Applied Sciences, 2022, 12(19):9968.
[43] HADIDI M, MOTAMEDZADEGAN A, JELYANI A Z, et al. Nanoencapsulation of hyssop essential oil in chitosan-pea protein isolate nano-complex[J]. LWT, 2021, 144:111254.
[44] LI K K, YIN S W, YANG X Q, et al. Fabrication and characterization of novel antimicrobial films derived from thymol-loaded zein-sodium caseinate (SC) nanoparticles[J]. Journal of Agricultural and Food Chemistry, 2012, 60(46):11592-11600.
[45] VENERANDA M, HU Q B, WANG T R, et al. Formation and characterization of zein-caseinate-pectin complex nanoparticles for encapsulation of eugenol[J]. LWT, 2018, 89:596-603.
[46] LUO Y C, TENG Z, WANG Q. Development of zein nanoparticles coated with carboxymethyl chitosan for encapsulation and controlled release of vitamin D3[J]. Journal of Agricultural and Food Chemistry, 2012, 60(3):836-843.
[47] PARK C E, PARK D J, KIM B K. Effects of a chitosan coating on properties of retinol-encapsulated zein nanoparticles[J]. Food Science and Biotechnology, 2015, 24(5):1725-1733.
[48] LUO Y C, ZHANG B C, WHENT M, et al. Preparation and characterization of zein/chitosan complex for encapsulation of α-tocopherol, and its in vitro controlled release study[J]. Colloids and Surfaces B: Biointerfaces, 2011, 85(2):145-152.
[49] LIU G Y, HUANG W J, BABII O, et al. Novel protein-lipid composite nanoparticles with an inner aqueous compartment as delivery systems of hydrophilic nutraceutical compounds[J]. Nanoscale, 2018, 10(22):10629-10640.
[50] WANG M, FU Y Y, CHEN G W, et al. Fabrication and characterization of carboxymethyl chitosan and tea polyphenols coating on zein nanoparticles to encapsulate β-carotene by anti-solvent precipitation method[J]. Food Hydrocolloids, 2018, 77:577-587.
[51] SHWETHA H J, ARATHI B P, BETO MUKHERJEE M, et al. Zein-alginate-phosphatidylcholine nano complex efficiently delivers lycopene and lutein over dietary-derived carotenoid mixed micelles in caco-2 cells[J]. Journal of Agricultural and Food Chemistry, 2022, 70(49):15474-15486.
[52] SHI T Y, JIA C S, WANG X S, et al. Formation mechanism and stability of low environment-sensitive ternary nanoparticles based on zein-pea protein-pectin for astaxanthin delivery[J]. Food Bioscience, 2023, 52:102409.