胶原蛋白是最丰富的细胞外基质蛋白,来源广泛,常提取于陆生生物和水生生物的皮肤、骨骼、肌腱等副产物,价格低廉、生物相容性高,且具有维持器官和组织结构的功能[1-2]。胶原蛋白常作为功能物质和营养成分被应用于食品和饮品生产中,可以提高产品的稳定性、产品质量和营养价值[3-5]。因抗氧化性、血糖调节和免疫调节等特性较为优异,胶原蛋白也在化妆品、生物医药和食品加工保藏等领域作为生物活性物质或生物材料广泛应用[6-8]。
多酚类物质多存在于水果、蔬菜中,种类多来源广,多酚具有较强的抗氧化性、抗菌性、抗过敏性和抗衰老性等生物活性,常作为天然食品添加剂或功能物质[9-10],应用于食品加工保藏、医疗、膳食补充剂和化妆品领域[11-13]。但多酚的不稳定性极大程度地限制了其在食品中的利用率和应用范围[14]。
胶原蛋白侧链具有丰富的羟基、氨基与羧基等活性基团,使其具有较高的反应活性,易于与其他物质结合生成复合物。多酚类物质由于其结构中丰富的酚羟基,具有较为突出的反应活性和生物活性。当多酚与胶原蛋白及其衍生物发生相互作用,胶原蛋白自身结构也会随之发生改变,所形成的复合物可改善二者的功能特性,不同结构变化就对应着复合物的不同性质,如图1所示。且复合物的形成能提高多酚在使用过程中的稳定性,从而改善了生物利用率[15]。因此近年来,大量研究者对胶原蛋白与多酚的相互作用及其在食品领域中的应用进行研究。
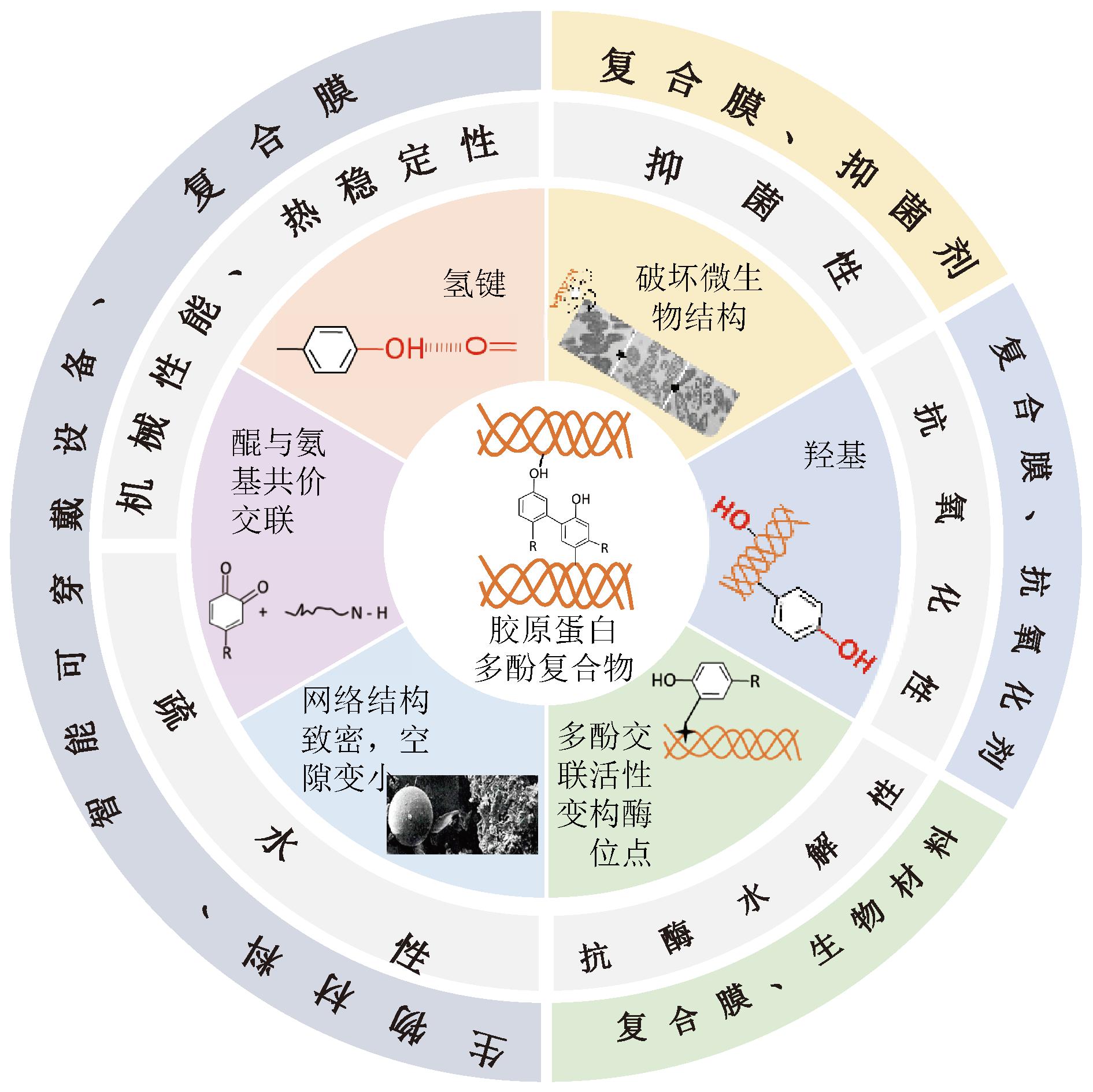
图1 胶原蛋白-多酚复合物性质及应用
Fig.1 Properties and applications of collagen-polyphenol complexes
1 胶原蛋白与多酚相互作用
1.1 胶原蛋白与多酚相互作用方式
胶原蛋白与多酚均为食品体系中的主要成分物质,在一定条件下二者常可以自发发生相互作用而结合形成复合物,复合物中通常存在非共价结合和共价结合作用力,但其中最主要的结合作用还是非共价作用力。
在探究中总结发现这些非共价作用力主要包括了氢键、静电作用力和疏水作用等[16],如图2所示。多酚中苯环与羟基相连接,即形成了多酚具有的酚羟基这一特征基团。在多酚与胶原蛋白互相作用过程中,其苯环结构能与胶原蛋白肽链中存在的疏水氨基酸残基产生疏水作用;多酚中的羟基(—OH)通常也作为优秀的供氢体,与胶原蛋白中的羰基(C![]() O)和氨基(—NH2)形成复合物中新的氢键;胶原蛋白中带有正电荷的氨基与多酚中带负电荷的羟基之间会形成静电作用力,在复合物形成过程中也发挥着次要作用[16-17]。胶原蛋白-多酚复合物中的共价结合作用则通常是发生在碱性条件、酶促反应或自由基诱导下。在碱性环境或酶促反应下,多酚类物质会被氧化成醌,醌会与胶原蛋白或肽中的亲核氨基酸残基(甲硫氨酸、赖氨酸、色氨酸和半胱氨酸)发生共价结合形成C—N键或C—S键。自由基诱导则是将反应物置于抗坏血酸和过氧化氢氧化还原引发体系中,利用体系中产生的羟基自由基来氧化胶原蛋白侧链的氨基酸形成自由基,与多酚中的羟基反应形成共价结合[16]。在研究中通常对比多种表征方法结果来验证胶原蛋白与多酚形成的复合物之间存在何种作用力[18-19]。
O)和氨基(—NH2)形成复合物中新的氢键;胶原蛋白中带有正电荷的氨基与多酚中带负电荷的羟基之间会形成静电作用力,在复合物形成过程中也发挥着次要作用[16-17]。胶原蛋白-多酚复合物中的共价结合作用则通常是发生在碱性条件、酶促反应或自由基诱导下。在碱性环境或酶促反应下,多酚类物质会被氧化成醌,醌会与胶原蛋白或肽中的亲核氨基酸残基(甲硫氨酸、赖氨酸、色氨酸和半胱氨酸)发生共价结合形成C—N键或C—S键。自由基诱导则是将反应物置于抗坏血酸和过氧化氢氧化还原引发体系中,利用体系中产生的羟基自由基来氧化胶原蛋白侧链的氨基酸形成自由基,与多酚中的羟基反应形成共价结合[16]。在研究中通常对比多种表征方法结果来验证胶原蛋白与多酚形成的复合物之间存在何种作用力[18-19]。

a-胶原蛋白;b-胶原蛋白-多酚复合物中的非共价结合作用;c-多酚;d-胶原蛋白-多酚复合物中的共价结合作用
图2 胶原蛋白与多酚复合物中的相互作用[18,20]
Fig.2 Interactions in collagen-polyphenol complexes[18,20]
1.2 胶原蛋白与多酚相互作用表征方法
胶原蛋白是由3条肽链形成的螺旋形纤维状蛋白质,拥有一级、二级、三级和四级结构,其具有特殊的三螺旋结构特征。通常研究中在制备了胶原蛋白-多酚复合物之后,为了印证二者是否发生了某种类型的结合,会采用多种表征方法来验证复合物的形成。其中大多用到的表征方法包括:SDS-PAGE、傅里叶变换红外光谱、荧光光谱、X射线衍射和圆二色谱等,表1中分别列出了不同表征方法的表征性能和原理。
表1 不同表征方法的性能及原理
Table 1 Performance and principles of different characterization methods

表征方法表征性能表征原理参考文献傅里叶变换红外光谱如表2所示5种特征吸收峰对应反应复合物的不同二级结构变化[21-23]荧光光谱反应到胶原蛋白的三级结构变化胶原蛋白中的内源荧光主要来自酪氨酸和色氨酸的氨基酸残基内部含有的共轭双键和苯环结构,当芳香族氨基酸含量一定程度上变化[21,24]圆二色谱针对胶原蛋白的二级结构变化研究中通常将圆二色谱(CD) 与红外光谱法结合对胶原蛋白的二级结构进行判断测定,在远紫外区提供对胶原蛋白的多肽主链的结构组成信息[18]十二烷基硫酸钠-聚丙烯酰胺凝胶电泳印证复合物中的作用力类型SDS-PAGE的原理就是通过SDS破坏分子内和分子间的氢键,导致分子展开,破坏胶原蛋白分子的二级和三级结构[25]X射线衍射反应胶原蛋白一级结构的变化与胶原蛋白分子形成的晶体结构有关的尖锐吸收峰,和由胶原蛋白非晶区的漫散射引起的宽衍射峰[23,26]
表2 傅里叶变换红外光谱的特征吸收峰及其对应的 二级结构[27]
Table 2 Characteristic absorption peaks of Fourier transform infrared spectra and their corresponding secondary structures[27]

特征吸收峰二级结构酰胺A氢键、N—H基团酰胺BCH2基团、N—H基团酰胺Ⅰ肽链之间的交联程度CO伸缩振动酰胺ⅡⅡ-螺旋、Ⅲ-折叠、转角和无规则卷曲酰胺Ⅲ肽链之间的交联程度、C—N基团、N—H基团
通过各探究方法的检测结果总结可得:在胶原蛋白本身二级结构中的分子内、分子间氢键被破坏后,多酚类物质会随即与胶原蛋白之间相结合形成二者之间新的氢键。而胶原蛋白与多酚类物质相结合并不只是氢键的作用,圆二色谱法结果表明,复合物中也存在共价结合作用力(C—N或C—S键),且荧光光谱与SDS-PAGE图谱检测结果显示二者之间也存在范德华力和疏水作用等非共价结合。
1.3 相互作用影响因素
胶原蛋白与多酚相互作用形成复合物,由于胶原蛋白、多酚本身来源丰富、种类各异,所以形成的复合物也存在差异。在制备复合物的过程中,复合物的性质会受到胶原蛋白类型、多酚类型、二者间复合的比例、pH值、时间等因素影响(图3)。
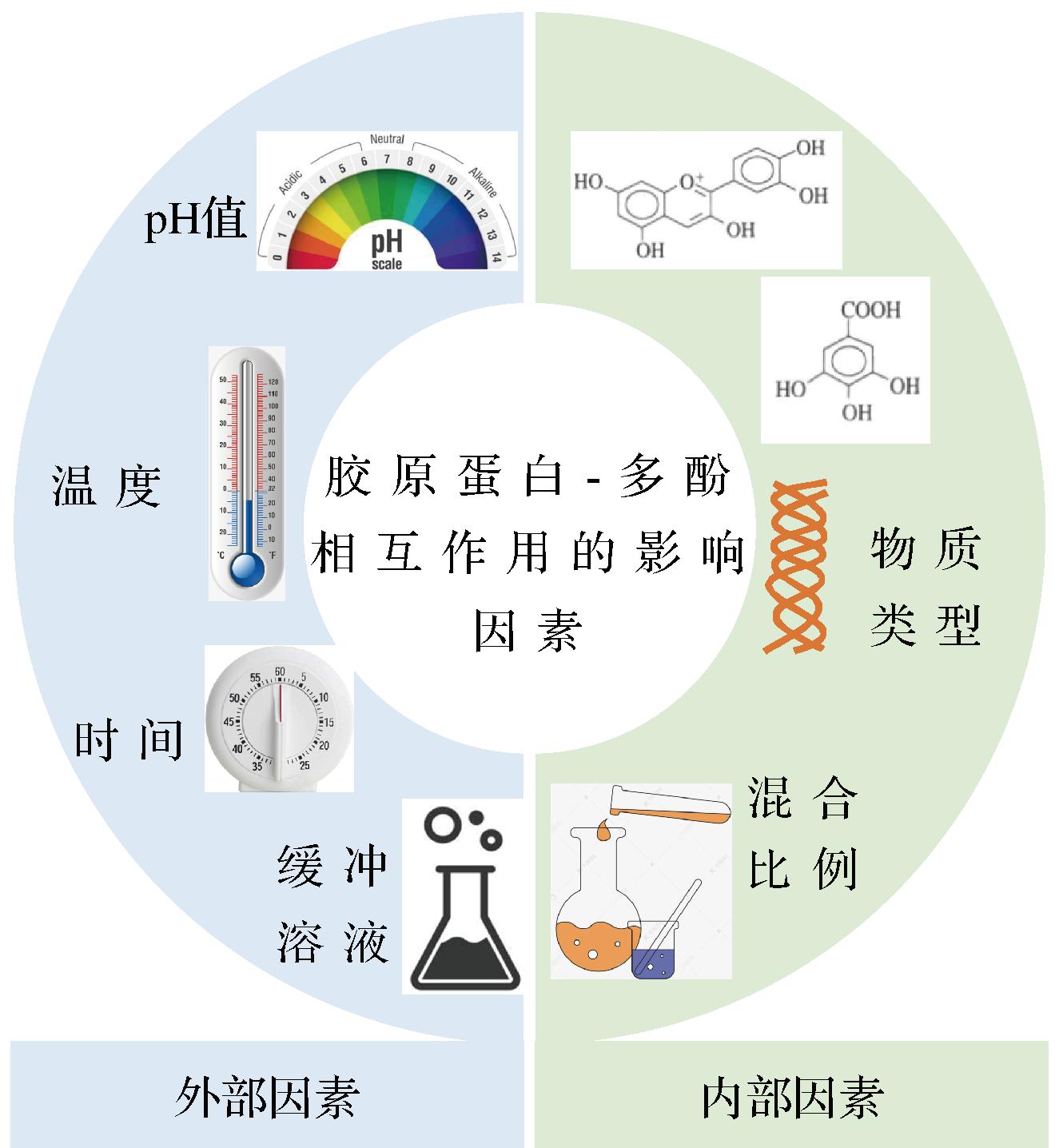
图3 胶原蛋白-多酚相互作用的影响因素
Fig.3 Factors influencing collagen-polyphenol interactions
1.3.1 内部因素
胶原蛋白与多酚之间的相互作用主要受二者复合比例、分子质量以及分子结构等因素的影响。胶原蛋白与多酚相互作用主要是发生在多酚中的苯环结构和酚羟基以及肽的芳香族氨基酸和羰基之上,从而氨基酸含量不同的各类型胶原蛋白或肽在与多酚互作时也存在差异,多数研究中也证明胶原蛋白中氨基酸的含量和组成能显著影响与多酚物质复合物的形成[16]。多酚类物质与胶原蛋白或肽的相互作用与其分子的复杂性和酚羟基的数目有关,其中酚羟基越多,对胶原蛋白的改性效果越好,有研究也指出,若是含有少量酚羟基的多酚化合物,应在碱性氧化条件下与胶原蛋白相结合[25]。AN等[28]的研究中对比了绿原酸和原花青素与罗非鱼胶原蛋白结合的强度,结果表明原花青素交联效应高于绿原酸,同时通过研究证实,原花青素中更多的酚羟基基团和罗非鱼胶原蛋白中的羰基基团之间氢键较强。充分证明多酚的类型也是其中较为重要的影响因素。ALBU等[29]将单宁酸与胶原蛋白相交联,研究中FTIR光谱显示,2种物质的交联程度随着单宁酸浓度的增加而增加。利用核磁共振和分子建模,对多酚的体积、柔韧性和疏水性对与肽交联的影响进行研究分析,结果表明,相互作用的强度与多酚疏水性以及柔韧性呈正相关[30]。
1.3.2 外部因素
当胶原蛋白或肽与多酚互相作用形成复合物时,pH值往往会显著影响到形成的复合物的性质。在不同pH条件下,胶原蛋白与多酚互作的机理存在差异,如在酸性条件下通常制备非共价复合物,其中主要的作用力是氢键、疏水作用等非共价结合力,因此此类复合物具有良好的疏水性、机械性能和热稳定性;而在碱性条件下,通常制备共价复合物,其中作用力以共价键(C—N或C—S键)为主,复合物的抗酶解活性、疏水性和热稳定性等较突出。
比如在采用离子凝胶法制备负载茶多酚的海藻酸盐-胶原蛋白微球过程中,当pH为7.4时对比pH值为1.2时释放的茶多酚量显著增加[31]。正如上文所言,在不同pH值下,胶原蛋白与多酚的结合方式也会存在不同,当pH值在中性或偏酸性条件下形成的复合物其中结合力以非共价作用力为主,而当pH值在碱性条件下,形成的便是多酚-胶原蛋白共价复合物。同时,在研究中运用的缓冲溶液类型也会影响到复合物的性质,比如在使用逐层技术制备单宁酸-胶原蛋白复合薄膜过程中, IQBAL等[32]发现使用相同pH值的不同缓冲液(乙酸盐或是柠檬酸盐缓冲液)不仅影响薄膜的物理化学性质,还影响薄膜的抗菌性能,同时也发现单宁酸和胶原蛋白之间的络合强度是不同的。
2 胶原蛋白-多酚复合物生物活性
多酚的抗氧化性、抗菌性等生物活性已被广泛证明并应用。但是在研究中常忽略了食品中的多酚与胶原蛋白相互作用形成复合物这类更复杂但常见的关系。食品行业在近年来也开始将注意力集中到物质互作上,发挥其优异的生物活性。
2.1 抗氧化性
胶原蛋白-多酚复合物的抗氧化活性主要表现在清除自由基、螯合过渡金属元素等方面。在利用多酚(单宁酸)与胶原蛋白互相作用形成一种复合生物材料的研究中,发现复合物的抗氧化性比单一物质的抗氧化性显著提高,且优于其他常用抗氧化剂[33]。胶原蛋白中的羟基、多酚结构中的酚羟基都是赋予复合物抗氧化性的来源,多酚与胶原蛋白结合之后,多酚在食品体系中的存在更加稳定,不易被破坏,二者本具有的抗氧化性便能发挥优异的作用。
多酚容易受到环境变化的不稳定性的阻碍,CHEN等[34]的研究中便选择采用美拉德反应制备明胶-壳低聚糖纳米颗粒包埋多酚物质,在后续对复合物性质的评价中发现负载多酚的纳米颗粒可作为良好的载体,且具有良好的抗氧化活性和稳定性。
2.2 抑菌性
多酚具有优秀的抗菌活性,也被广泛用于食品(特别是果蔬、肉制品和水产品)的保鲜保藏中。在多酚与胶原蛋白结合形成复合物后,多酚的保留率得到提高,即使胶原蛋白不具备这类性质,但多酚的抑菌性得到保护,使复合物具有良好的抑菌特性[35]。复合物抑菌性的表现在使微生物细胞膜的通透性改变,从而影响到其细胞内酶的表达,或破坏其细胞壁等,基于此作用达到抑菌的目的[16]。FENG等[15]的研究中使用胶原蛋白水解物添加到了海藻酸钠包埋的茶多酚中,结果表明,茶多酚的保留率从61.10%增加到80.21%,在67 ℃或72 ℃灭菌80 min之后保留率从47.98%增加到121.30%,且其在98 ℃或121 ℃灭菌30 min后的DPPH自由基和ABTS阳离子自由基清除能力和降低铁的抗氧化能力均显著升高。
2.3 其他生物活性
不仅是抗氧化性和抑菌性,随着多酚物质的加入,多酚-胶原蛋白(肽)复合物中形成的氢键、或是共价结合中的醌与氨基的交联以及复合物网络结构的改变均致使其具有较为优异的热稳定性、疏水性、机械性能和生物稳定性等特性。
HE等[36]研究了在酸性条件下用天然植物多酚原花青素对胶原蛋白的修饰,测试结果表明,原花青素修饰的胶原膜的疏水性可以得到改善,此外,还发现与纯胶原蛋白相比,胶原蛋白-原花青素薄膜具有更高的热稳定性。SHI等[37]通过多酚配位制备多功能胶原纳米复合膜,所制备的透明复合膜不仅表现出较强的耐酶性、水蒸气渗透性、热稳定性和疏水性,而且其抗拉强度和抗氧化性比单一胶原蛋白膜也显著提高了。LIU等[38]的研究中得到胶原原花青素-海藻酸二醛复合膜,通过差示扫描量热和热重分析表明,复合膜的热稳定性显著提高,力学性能也分别提高了约2~3倍。胶原蛋白-原花青素生物相容性薄膜的制备研究中,原花青素的加入显著提高了胶原膜的物理强度,且使其具有更强的伤口愈合能力[39]。
3 胶原蛋白-多酚复合物的应用
经过大量研究表明,胶原蛋白与多酚进行交联形成的复合物的各种生物活性都显著优于二者单独发挥作用,比如复合物较好的抑菌性、抗氧化性、乳化性和热稳定性等。复合物卓越的生物活性,使其广泛地应用于食品工业生产、生物医药领域中。胶原蛋白-多酚复合物可以作为活性物质直接添加至食品中,也可以作为新型抗氧化剂、抑菌剂以及乳化剂等新型复合食品添加剂运用于食品生产中[34-35]。复合物通常被制备成微胶囊、纳米颗粒等形式,用于药物或活性物质的递送,可以达到降低物质损失率的效果。有研究使用胶原蛋白作为基质材料包封槲皮素制备微胶囊,将该微胶囊作为外用制剂用于防止紫外线照射引发的氧化和炎症性皮肤改变,研究结果发现微胶囊化的复合物不论是在4 ℃、室温或是高温环境中均表现出较好的功能性抗氧化稳定性[40]。说明微胶囊化能在一定程度上保存多酚的生物活性。胶原蛋白-多酚复合膜也是复合物常被制备的形式,由于其优异的抗氧化、抑菌性和可降解性,使其在应用中能达到延长产品保质期的效果,且疏水性能、热稳定性、机械性能较好的复合膜可被用于智能可穿戴设备[38]。如通过利用铁离子交联诱导胶原纤维和没食子酸保护银纳米粒子自组装,制备一种具有良好机械强度、多孔网络结构和牢固固定银纳米粒子的,具有强杀菌活性的生物质基可再生薄膜,用于过滤水并实现水消毒[41];胶原蛋白-多酚复合膜用于鱼产品的保鲜,能减缓鱼产品的氧化[17]。由于胶原蛋白-多酚复合物不仅具有良好的抑菌性、抗氧化性和稳定性,还具有较高的生物相容性和较好的组织黏性等优点,常在医药领域被用作多种药物控制输送的载体,或作为医用材料用于支持细胞或组织再生、伤处抑菌等。如MANJARI等[42]通过使用多酚交联胶原蛋白制备成一种复合的医用支架,研究显示该支架上的成纤维细胞增殖增加,证明该支架的物理化学和生物学特性使其在组织工程和再生医学领域有研究前景。DEACONU等[43]利用胶原蛋白-多酚复合物负载二氧化硅制备成伤口敷料,能有效预防伤口处感染和炎症以及支持伤处细胞再生。研究表明多酚是治疗类风湿性关节炎的有效药物,但是其本身生物利用度较低,于是利用胶原蛋白与其结合,建立新的递送体系提高了其口服利用度[44]。
综上,胶原蛋白或肽与多酚的复合物不仅能运用在食品加工中,也能在医药生产中发挥重要作用,表3不完全列举出了胶原蛋白-多酚复合物不同形式的应用。目前多数研究重在探究二者相互作用的机理,但最终还应做到将复合物合理利用以造福人类,所以将这类复合物应用到食品或医药加工生产中也具有无限的探究前景。
表3 胶原蛋白-多酚复合物的应用
Table 3 Application of collagen peptide-polyphenol complexes

复合物类型胶原蛋白(肽)多酚应用主要作用力具体研究文献牛干灰皮胶原蛋白茶多酚复合膜氢键、疏水作用复合膜具有更优异的热稳定性、机械性能和疏水性[45]牛皮胶原蛋白酚酸复合膜—复合胶原膜的透湿性、抗酶降解性、力学性能和热稳定性优异[46]I型胶原蛋白单宁酸纳米复合膜氢键、离子键、疏水作用透明复合膜的热稳定性、耐酶性、拉伸强度和疏水性增强,而且具有良好的水蒸气渗透性和抗氧化性[37]鳀鱼胶原蛋白肽儿茶素、没食子酸、单宁酸复合乳剂共价键、离子键复合物乳剂能显著提高鱼产品的氧化稳定性[17]牛皮胶原蛋白单宁酸复合抗氧化剂—复合物的抗氧化性显著提高,且优于其他常用抗氧化剂[33]胶原纤维单宁酸复合抑菌剂氢键、共价键、离子键复合物热稳定性显著提高,也表现出较为优异的抗菌性能[35]草鱼鳞胶原蛋白水解物茶多酚微胶囊氢键、疏水作用、离子键其中茶多酚保留率以及自由基清除率都显著升高[15]牛胶原蛋白多酚混合物复合医用支架—复合支架的热分解和变性温度值增加,切该支架对胶原水解酶的抵抗力增加[41]胶原蛋白多酚纳米粒—多酚掺入胶原蛋白纳米粒新型递送体系,提高了其口服生物利用度,并发挥抗炎、免疫调节和抗类风湿作用[43]I型胶原蛋白单宁酸单宁酸/胶原珠支架氢键该支架植入大鼠体内,结果显示其具有良好的生物相容性和生物活性可作为脂肪细胞组织再生和重建装置[47]牛肌腱胶原蛋白原花青素医用愈合剂疏水作用、氢键研究表明复合愈合剂增强了体外伤口闭合的能力,且原花青素的加入改善了胶原成膜后的物理强度[39]
注:“—”表示文献中并未提及。
4 讨论与结论
多酚与胶原蛋白互相作用形成复合物,其中有非共价作用(氢键、离子键和疏水作用等)和共价作用力(C—N或C—S键)的存在。复合物性质往往会受到胶原蛋白和多酚类型、pH值、时间等因素影响。在多酚与胶原蛋白形成复合物的过程中,首先在胶原蛋白本身二级结构中的分子内、分子间氢键会被破坏,多酚类物质结构中的酚羟基会随即与胶原蛋白的羰基和氨基结构相结合形成二者之间新的氢键;多酚类物质中的苯环结构会与胶原蛋白中的芳香族氨基酸之间产生疏水作用。若是在碱性条件下,多酚会转变为醌结构,与胶原蛋白之间形成共价交联。这些价键和作用力的变化致使胶原蛋白-多酚复合物具有良好的抗氧化活性、抑菌性、热稳定性等生物活性。复合物通常被制备成复合膜、复合食品添加剂或微胶囊等,在食品加工保藏、生物医药等领域较大程度发挥出其生物活性。
在探究过程中,以下方面也值得关注:a)研究多注重于不同类型的多酚类物质与胶原之间互作的区别,但不同来源提取的胶原蛋白与多酚之间结合存在的差异的机理研究较少。b)体内消化环境对复合物稳定性的影响,以及提高复合物在体内的稳定性的方法均具有近一步研究的意义。c)胶原蛋白也可以与多种物质交联后形成复合物,其中的互作机理以及复合物的性质更需进一步探究,且这类多物质复合物在食品生产、加工和保藏领域也有较好的研究前景。
[1] GELSE K, PÖSCHL E, AIGNER T. Collagens—Structure, function, and biosynthesis[J]. Advanced Drug Delivery Reviews, 2003, 55(12):1531-1546.
[2] TANG C, ZHOU K, ZHU Y C, et al. Collagen and its derivatives: From structure and properties to their applications in food industry[J]. Food Hydrocolloids, 2022, 131:107748.
[3] HASHIM P, RIDZWAN M, BAKAR J, et al. Collagen in food and beverage industries[J]. International Food Research Journal, 2015, 22:1-8.
[4] LIN P, HUA N, HSU Y C, et al. Oral collagen drink for antiaging: Antioxidation, facilitation of the increase of collagen synthesis, and improvement of protein folding and DNA repair in human skin fibroblasts[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020:8031795.
[5] KUBYSHKIN V. Stabilization of the triple helix in collagen mimicking peptides[J]. Organic &Biomolecular Chemistry, 2019, 17(35):8031-8047.
[6] MARTINS E, REIS R L, SILVA T H. In vivo skin hydrating efficacy of fish collagen from Greenland halibut as a high-value active ingredient for cosmetic applications[J]. Marine Drugs, 2023, 21(2):57.
[7] LIU X H, ZHENG C, LUO X M, et al. Recent advances of collagen-based biomaterials: Multi-hierarchical structure, modification and biomedical applications[J]. Materials Science and Engineering: C, 2019, 99:1509-1522.
[8] XU S M, ZHAO Y P, SONG W S, et al. Improving the sustainability of processing by-products: Extraction and recent biological activities of collagen peptides[J]. Foods, 2023, 12(10):1965.
[9] BAE J Y, SEO Y H, OH S W. Antibacterial activities of polyphenols against foodborne pathogens and their application as antibacterial agents[J]. Food Science and Biotechnology, 2022, 31(8):985-997.
[10] CUTRIM C S, CORTEZ M A S. A review on polyphenols: Classification, beneficial effects and their application in dairy products[J]. International Journal of Dairy Technology, 2018, 71(3):564-578.
[11] JAYAWARDHANA H H A C K, JAYAWARDENA T U, SANJEEWA K K A, et al. Marine algal polyphenols as skin protective agents: Current status and future prospectives[J]. Marine Drugs, 2023, 21(5):285.
[12] ALMEIDA A F, DOS SANTOS C N, VENTURA M R. Polyphenols, their metabolites and derivatives as drug leads[J]. Current Pharmaceutical Design, 2018, 24(19):2188-2207.
[13] PÉREZ-RAM REZ I F, DE DIEGO E H, RIOMOROS-ARRANZ M, et al. Effects of acute intake of grape/pomegranate pomace dietary supplement on glucose metabolism and oxidative stress in adults with abdominal obesity[J]. International Journal of Food Sciences and Nutrition, 2020, 71(1):94-105.
REZ I F, DE DIEGO E H, RIOMOROS-ARRANZ M, et al. Effects of acute intake of grape/pomegranate pomace dietary supplement on glucose metabolism and oxidative stress in adults with abdominal obesity[J]. International Journal of Food Sciences and Nutrition, 2020, 71(1):94-105.
[14] WANG S, LI Y, MA C Y, et al. Enzymatic molecular modification of water-soluble polyphenols: Synthesis, structure, bioactivity and application[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(33):12637-12651.
[15] FENG Y P, NIU L Y, SUN C, et al. Collagen hydrolysates improve the efficiency of sodium alginate-encapsulated tea polyphenols in beads and the storage stability after commercial sterilization[J]. International Journal of Biological Macromolecules, 2023, 231:123314.
[16] 杨慧, 曲也直, 高雅然, 等. 植物多酚-蛋白质复合物生物活性及应用研究进展[J]. 食品科学, 2022, 43(3):258-266.
YANG H, QU Y Z, GAO Y R, et al. Recent advances in understanding the biological activities and applications of polyphenol-protein complexes[J]. Food Science, 2022, 43(3):258-266.
[17] ZHAO T T, HUANG L, LUO D H, et al. Fabrication and characterization of anchovy protein hydrolysates-polyphenol conjugates with stabilizing effects on fish oil emulsion[J]. Food Chemistry, 2021, 351:129324.
[18] ZHAO Q, YU X J, ZHOU C S, et al. Effects of collagen and casein with phenolic compounds interactions on protein in vitro digestion and antioxidation[J]. LWT, 2020, 124:109192.
[19] YU X Y, LI J L, YANG M T, et al. Role of epigallocatechin gallate in collagen hydrogels modification based on physicochemical characterization and molecular docking[J]. Food Chemistry, 2021, 360:130068.
[20] QUAN T H, BENJAKUL S, SAE-LEAW T, et al. Protein-polyphenol conjugates: Antioxidant property, functionalities and their applications[J]. Trends in Food Science &Technology, 2019, 91:507-517.
[21] 杨伟, 袁芳, 高彦祥. 鱼胶原蛋白肽与表没食子儿茶素没食子酸酯相互作用的研究[J]. 光谱学与光谱分析, 2015, 35(1):184.
YANG W, YUAN F, GAO Y X. Interaction of fish collagen peptide with epigallocatechin gallate[J]. Spectroscopy and Spectral Analysis, 2015, 35(1):184.
[22] 张奇, 唐春雪, 丁克毅, 等. 光谱分析在改性胶原蛋白结构表征中的应用(Ⅰ): 红外光谱和拉曼光谱[J]. 中国皮革, 2019, 48(6):12-16.
ZHANG Q, TANG C X, DING K Y, et al. Application of spectrum analysis on characterization of modified collagen′s structure (Ⅰ): FT-IR and Raman spectrum[J]. China Leather, 2019, 48(6):12-16.
[23] HE L, GAO Y F, WANG X Y, et al. Ultrasonication promotes extraction of antioxidant peptides from oxhide gelatin by modifying collagen molecule structure[J]. Ultrasonics Sonochemistry, 2021, 78:105738.
[24] YU X, CAI X H, LUO L Y, et al. Influence of tea polyphenol and bovine serum albumin on tea cream formation by multiple spectroscopy methods and molecular docking[J]. Food Chemistry, 2020, 333:127432.
[25] WU L P, SHAO H, FANG Z H, et al. Mechanism and effects of polyphenol derivatives for modifying collagen[J]. ACS Biomaterials Science &Engineering, 2019, 5(9):4272-4284.
[26] 司磊磊, 张燕, 侯虎, 等. 两种鱼皮胶原蛋白的比较及其降解物中多肽的识别[J]. 食品工业科技, 2018, 39(5):7-12.
SI L L, ZHANG Y, HOU H, et al. Comparison of two kinds of fish skin collagen and characterization of peptides from the digested collagen[J]. Science and Technology of Food Industry, 2018, 39(5):7-12.
[27] 蔡路昀, 史航, 曹爱玲, 等. 鲽鱼骨胶原蛋白的结构及流变学特性[J]. 中国食品学报, 2020, 20(3):66-73.
CAI L Y, SHI H, CAO A L, et al. The structure and rheological characteristics of collagen from flounder bone[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(3):66-73.
[28] AN X S, DUAN S J, JIANG Z C, et al. Role of chlorogenic acid and procyanidin in the modification of self-assembled fibrillar gel prepared from tilapia collagen[J]. Polymer Degradation and Stability, 2022, 206:110177.
[29] ALBU M G, GHICA M V, LECA M, et al. Doxycycline delivery from collagen matrices crosslinked with tannic acid[J]. Molecular Crystals and Liquid Crystals, 2010, 523(1):97/[669]-105/[677].
[30] RICHARD T, LEFEUVRE D, DESCENDIT A, et al. Recognition characters in peptide-polyphenol complex formation[J]. Biochimica et Biophysica Acta, 2006, 1760(6):951-958.
[31] RUAN J X, PEI H M, LI T, et al. Preparation and antioxidant activity evaluation of tea polyphenol-collagen-alginate microspheres[J]. Journal of Food Processing and Preservation, 2021, 45(2): e15187.
[32] IQBAL M H, SCHRODER A, KERDJOUDJ H, et al. Effect of the buffer on the buildup and stability of tannic acid/collagen multilayer films applied as antibacterial coatings[J]. ACS Applied Materials &Interfaces, 2020, 12(20):22601-22612.
[33] ALBU M G, GHICA M V, GIURGINCA M. Spectral characteristics and antioxidant properties of tannic acid immobilized on collagen drug-delivery systems[J]. Revista De Chimie, 2009, 60(7):666-672.
[34] CHEN H M, LIN S, WU J L, et al. The structure, antioxidant activity, and stability of fish gelatin/chitooligosaccharide nanoparticles loaded with apple polyphenols[J]. Journal of the Science of Food and Agriculture, 2023, 103(8):4211-4220.
[35] YU R Q, WANG H B, WANG R, et al. Polyphenol modified natural collagen fibrous network towards sustainable and antibacterial microfiltration membrane for efficient water disinfection[J]. Water Research, 2022, 218:118469.
[36] HE L R, MU C D, SHI J B, et al. Modification of collagen with a natural cross-linker, procyanidin[J]. International Journal of Biological Macromolecules, 2011, 48(2):354-359.
[37] SHI J B, ZHANG R Z, ZHOU J J, et al. Supramolecular assembly of multifunctional collagen nanocomposite film via polyphenol-coordinated clay nanoplatelets[J]. ACS Applied Bio Materials, 2022, 5(3):1319-1329.
[38] LIU T, SHI L, GU Z P, et al. A novel combined polyphenol-aldehyde crosslinking of collagen film—Applications in biomedical materials[J]. International Journal of Biological Macromolecules, 2017, 101:889-895.
[39] SIVARAMAN K, SUJITHA P, ARUNKUMAR A, et al. Biocompatible films of collagen-procyanidin for wound healing applications[J]. Applied Biochemistry Biotechnology, 2022, 194(9): 4002-4017.
[40] VALE D L, MARTINEZ R M, MEDEIROS D C, et al. A topical formulation containing quercetin-loaded microcapsules protects against oxidative and inflammatory skin alterations triggered by UVB irradiation: Enhancement of activity by microencapsulation[J]. Journal of Drug Targeting, 2021, 29(9):983-997.
[41] LIU G Y, JIANG J, YU R Q, et al. Silver nanoparticle-incorporated porous renewable film as low-cost bactericidal and antifouling filter for point-of-use water disinfection[J]. Industrial &Engineering Chemistry Research, 2020, 59(23):10857-10867.
[42] MANJARI M S, AARON K P, MURALIDHARAN C, et al. Highly biocompatible novel polyphenol cross-linked collagen scaffold for potential tissue engineering applications[J]. Reactive and Functional Polymers, 2020, 153:104630.
[43] DEACONU M, PRELIPCEAN A M, BREZOIU A M, et al. Novel collagen-polyphenols-loaded silica composites for topical application[J]. Pharmaceutics, 2023, 15(2):312.
[44] MAITY S, WAIRKAR S. Dietary polyphenols for management of rheumatoid arthritis: Pharmacotherapy and novel delivery systems[J]. Phytotherapy Research, 2022, 36(6):2324-2341.
[45] CHEN C X, CHEN G J, WAN P, et al. Characterization of bovine serum albumin and (-)-epigallocatechin gallate/3, 4-O-dicaffeoylquinic acid/tannic acid layer by layer assembled microcapsule for protecting immunoglobulin G in stomach digestion and release in small intestinal tract[J]. Journal of Agricultural and Food Chemistry, 2018, 66(42):11141-11150.
[46] 许伟, 海芳, 刘浩, 等. 茶多酚改性牛干灰皮胶原复合膜的制备及其性能[J]. 陕西科技大学学报, 2022, 40(4):16-21.
XU W, HAI F, LIU H, et al. Preparation and properties of tea polyphenol modified collagen composite films based on dry limed cowhide fibers[J]. Journal of Shaanxi University of Science &Technology, 2022, 40(4):16-21.
[47] BALDWIN A, UY L, FRANK-KAMENETSKII A, et al. The in vivo biocompatibility of novel tannic acid-collagen type I injectable bead scaffold material for breast reconstruction post-lumpectomy[J]. Journal of Biomaterials Applications, 2020, 34(9):1315-1329.