燕麦(Arena sativa L.)是一种具有较高营养价值的禾本科谷物植物。研究表明,燕麦籽粒中含有优质的蛋白质,主要表现为必需氨基酸含量高且配比均衡,符合世界卫生组织/联合国粮食及农业组织的推荐值[1]。此外,燕麦籽粒中还含有丰富的脂肪、淀粉、矿物质、维生素以及可溶性粗纤维等人体所需要的营养成分[2]。目前,我国对于燕麦的加工利用还处于初级阶段,最常见的产品是燕麦米、燕麦片、燕麦粉等基础食品,虽然燕麦乳产品正在不断地被开发,但是与欧美国家相比,技术仍相对落后。燕麦食品开发的主要问题表现为在加工过程中,不同的加工方式和条件对燕麦蛋白质的影响较大,过度的加工会导致燕麦产品中蛋白质的损失、聚集和变性。然而,热处理是燕麦加工前的常规步骤,在加热期间燕麦蛋白不仅会分解成小亚基,还会发生不同程度的热聚集从而影响燕麦蛋白的溶解特性[3-4],过度的热处理会限制其在食品工业中的应用,而燕麦制品的燕麦蛋白含量及功能特性与加工工艺密切相关。改变燕麦蛋白的理化特性以满足不同产品的加工需要已经成为一种研究趋势,物理改性、化学改性、酶改性均能通过改善蛋白质的结构和功能性质增加其在食品工业中的应用潜力。基于此,本文旨在综述燕麦蛋白的结构、功能特性及改性方式,重点讨论燕麦蛋白改性对其功能特性的影响机制以及在不同燕麦制品生产过程中加工方式对燕麦蛋白的影响。
1 燕麦蛋白的组成与结构
与其他谷物相比,燕麦中蛋白含量(12.4%~24.5%,质量分数)居于首位,且富含人体必需氨基酸[5]。根据Osborne的蛋白质组分分类,燕麦蛋白包含球蛋白(主要的贮存蛋白,70%~80%)、清蛋白(1%~12%)、醇溶蛋白(4%~15%)、谷蛋白(<10%)[6]。燕麦球蛋白可溶于中性盐溶液,占燕麦蛋白的比例最高[7],其主要组成部分是12S球蛋白,与豆类11S球蛋白结构相似[8-9],此外,燕麦蛋白中还有少量的3S和7S球蛋白[10]。燕麦球蛋白是由32 kDa的α-亚基(酸性多肽)和22 kDa的β-亚基(碱性多肽)通过二硫键连接组成54 kDa的二聚体后,6个二聚体再通过非共价键连接构成的320 kDa六聚体[9,11-12](图1[13-14])。燕麦球蛋白的变性温度在110 ℃左右,其耐受高温的原因是各亚基之间存在强烈的疏水相互作用,因此燕麦蛋白可以应用于蒸煮类食品[15]。燕麦清蛋白是水溶性部分,主要由具有生物活性的酶组成,如蛋白酶、脂肪酶、α-淀粉酶和磷酸酶等[7,16]。研究表明,燕麦清蛋白的分子质量为14~47 kDa,等电点在pH 4.0~7.0[13]。燕麦清蛋白含有丰富的赖氨酸、天冬氨酸和丙氨酸和少量的谷氨酸[17]。醇溶蛋白表现出较少的异质性且分子质量相对较小,大小为17~34 kDa,等电点为pH 5.0~9.0[13,18]。燕麦醇溶蛋白富含硫且含有大量的谷氨酸和脯氨酸,但赖氨酸、组氨酸含量低[17]。燕麦谷蛋白在燕麦蛋白质中含量很低,水溶性较差[19]。与其他燕麦蛋白组分相比,谷蛋白组分含有大量的天冬氨酸、酪氨酸和色氨酸[7]。
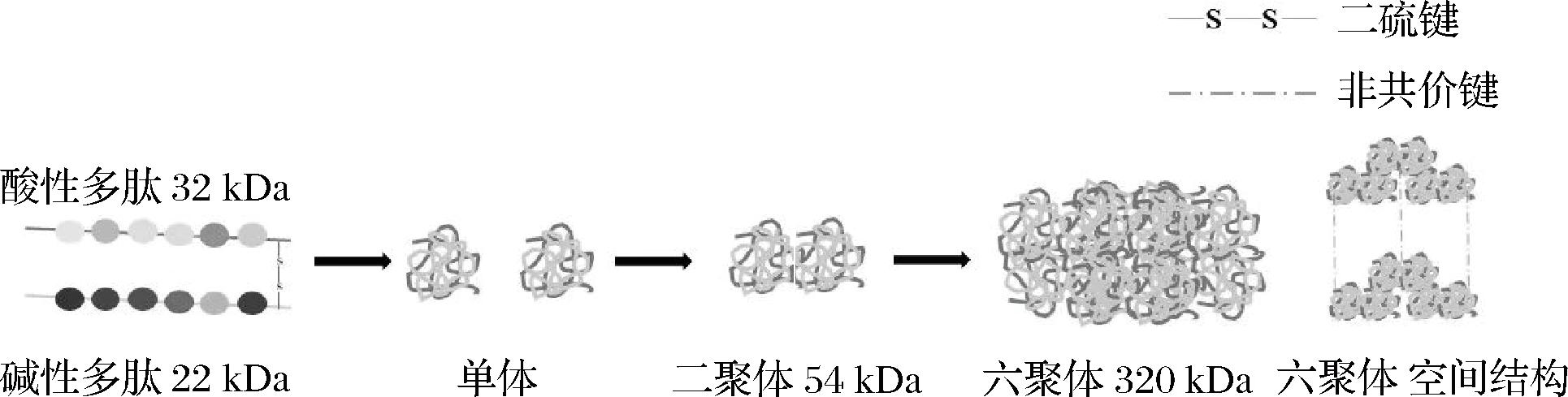
图1 燕麦球蛋白结构组成示意图[13,14]
Fig.1 Structural composition diagram of oat globulin
2 燕麦蛋白的功能特性
蛋白质由于其独特的功能特性在加工和贮藏过程中占据着非常重要的地位,蛋白质的功能特性包括溶解性、乳化性、起泡性、持水能力、胶凝性和脂肪结合能力。
溶解性是开发液体食品应首先考虑的关键因素,它可以决定其他功能特性在食品中作用的发挥。蛋白质的溶解度与蛋白质表面亲疏水性的平衡密切相关[20]。作为燕麦中主要的贮藏蛋白,燕麦球蛋白表面含有丰富的谷氨酰胺部分,其与溶剂的接触导致蛋白亲水性的降低[11],因此相较于其他植物蛋白,燕麦蛋白的溶解度较低。燕麦蛋白在低pH和高pH时具有良好的溶解度,但在pH 4.0~7.0时溶解性较差[13],从而致使其在食品中的应用具有局限性。
乳化活性是指蛋白质促进水和油相互作用发生乳化的能力,而乳化稳定性是指保持乳化状态的能力。燕麦蛋白的乳化性在等电点附近达到最小值,这是由于燕麦蛋白的溶解度下降,燕麦蛋白发生聚集,疏水基团包裹在蛋白分子内部造成的[21]。
蛋白质的起泡性包括起泡能力和泡沫稳定性2个方面。燕麦蛋白在接近其等电点的pH条件下,溶解度最小,起泡性最差。而在偏离其等电点的pH条件下,溶解度增大,起泡性随之增加[22]。管骁等[23]研究发现,燕麦清蛋白的起泡能力随pH值的升高而增强,且其起泡能力高于燕麦麸浓缩蛋白、球蛋白、醇溶蛋白和谷蛋白,但其泡沫稳定性较差。
水结合能力(water holding capacity,WHC)是蛋白质吸收水并保持水的能力。WHC是决定蛋白质凝胶特性的关键性质,这是由于水分的保留或吸收程度是影响最终产品的整体质量和感官特性的重要因素之一。未经改性的燕麦蛋白的WHC为每克样品保留1.72 g水[24]。脂肪结合能力是植物蛋白用作肉类替代品和补充剂的主要决定因素。燕麦球蛋白具有良好的脂肪结合能力,因此燕麦蛋白可应用于肉类替代食品[3]。
胶凝性是影响食品结构的功能特性。在90~100 ℃、pH 9.7的条件下加热燕麦蛋白,可以得到质地光滑和保水性良好的固体凝胶[25]。燕麦12S球蛋白结构与大豆球蛋白相似,因此其表现出优越的胶凝能力[13]。
3 燕麦蛋白的改性对其功能特性的影响
3.1 物理改性
蛋白质的物理改性是指选用热、电、射线、机械作用等物理作用方式,致使蛋白的高级结构以及分子之间的聚集发生变化。相较于化学改性,物理改性并未添加食品以外的物质,改性产物更安全。
热处理是最常用的蛋白质物理改性方式,其能导致蛋白质分子之间疏水和静电相互作用以及氢键和共价键发生变化,致使燕麦蛋白构象从天然状态转变为无序状态,进而影响其热稳定性。在加热过程中,过高的温度和过长的加热时间均会造成蛋白质分子之间二硫键连接从而形成蛋白质聚集体[26]。RUNYON等[27]研究发现热处理会显著降低燕麦提取物中可溶性蛋白含量,这可能是因为高于变性温度的热处理导致燕麦蛋白变性从而降低其溶解度。TORBICA等[26]研究结果表明140 ℃烘烤处理能引起蛋白质二级结构从α-螺旋到β-转角的转变,这是由于氢键的聚集以及二硫键构象变化造成的。然而HE等[28]研究表明焙烤温度的升高(140~240 ℃)会降低燕麦球蛋白二级结构中的β-折叠和β-转角的含量,并增加α-螺旋和无规卷曲的含量,推测可能是热处理期间球蛋白构象的转变和分子内氢键的解折叠产生了更无序的结构。
除了热加工改性外,非热加工技术如超声、高压、脉冲电场等,由于其具有经济、环保、高效的特点,在燕麦蛋白改性中也已广泛应用。
超声处理通过破坏蛋白质的结构影响其功能特性[29]。蛋白质构象的变化是由于超声破坏了蛋白质分子之间的氢键和疏水相互作用以及超声处理产生的空化效应促进蛋白质高级结构的展开,破坏了蛋白质之间的聚集[30]。LI等[15]发现高强度超声能显著降低燕麦蛋白的粒度,改善了燕麦蛋白在远离等电点的pH水平下的溶解度,这可能是由于蛋白质和水分子之间的流体动力学相互作用致使表面积的增加造成的。李健[31]研究表明在600 W下超声处理20 min可以显著提高燕麦球蛋白溶解度,从而提高其他功能特性(如乳化性、起泡性、凝胶性等),并认为超声导致蛋白质结构的展开,产生可溶性聚集体,但是功率过大或时间过长会降低燕麦蛋白的功能性。
MA等[32]在研究不同压力条件下燕麦蛋白的结构变化时发现,在400 MPa下,燕麦蛋白表面结构开始发生变化,然而在600 MPa下保温15 min时,超高压处理会破坏燕麦蛋白的二硫键交联,从而显著影响蛋白结构。HÜTTNER等[33]也发现200 MPa下对燕麦粉进行超高压处理会导致燕麦蛋白结构的弱化。CHENG等[34]发现动态高压微流化技术(dynamic high pressure microfluidization,DHPM)可以显著提高蛋白的溶解度、保水和保油性能以及乳化和发泡能力,其研究表明120 MPa的DHPM处理并未解离燕麦蛋白的亚基,而是造成α-螺旋、β-折叠和β-转角结构的增加以及随机螺旋结构的减少,此外,还显著增加了燕麦蛋白的表面疏水性和游离巯基数量,最终导致蛋白构象发生重排。
脉冲电场改性处理具有改变燕麦蛋白结构的能力,包括蛋白质的解折叠和解聚集。DUQUE等[35]研究发现脉冲电场改性可以诱导β-折叠转化为α-螺旋,促进蛋白质分子的解折叠或未折叠蛋白质的重新组装。
3.2 化学改性
化学改性是通过化学试剂引起蛋白质某些肽键的断裂或引入不同的功能性基团的方法,主要包括带负电荷基团、二硫基团和亲水亲油基团。与其他改性方式相比,化学改性更适用于工业大规模的生产。燕麦蛋白质常用的化学改性方法包括酰化改性、脱酰胺改性、糖基化改性等。
二硫键对燕麦球蛋白的构象稳定以及热稳定性起着重要的作用,然而其能降低蛋白质的分子柔韧性和阻碍疏水区域的暴露进而影响其乳化特性[36]。LI等[37]研究发现二硫苏糖醇、抗坏血酸、半胱氨酸和亚硫酸氢钠可以破坏燕麦蛋白亚基间高达90%的二硫键,其中半胱氨酸处理过的燕麦蛋白亚基解离后,乳化活性提高了37%,这可能是二硫键的裂解导致疏水性基团的暴露并使结构发生变化。
酰化改性增加蛋白质分子表面的负电荷,改变了多肽链伸展及空间结构,导致分子柔韧性的提高,从而增强蛋白质溶解性及其他功能特性。酰化改性最常见的酰化剂为琥珀酸酐和乙酸酐[11]。MA等[38]研究表明琥珀酰化和乙酰化可以改善燕麦中蛋白质的胶凝性质。ZHAO等[39]对燕麦分离蛋白进行乙酰化和琥珀酰化改性,基于红外光谱和内源荧光光谱分析,发现燕麦蛋白的二级结构和三级构象随酰化程度变化发生显著变化。酰化可促进β-折叠向α-螺旋和无规卷曲的转变,并降低三级构象的紧凑性。
自然界中大多蛋白质都含有丰富的酰胺基团,蛋白质的脱酰胺化作用是蛋白质改性的一种重要方式[40]。MIRMOGHTADAIE等[41]研究发现燕麦分离蛋白进行酸性脱酰胺化处理后具有了更好的水溶性和乳化性,但与此同时,其泡沫稳定性显著下降,这可能是由于净电荷的增加降低了蛋白质-蛋白质之间的相互作用,从而使其在空气-液体界面所形成的膜不具有足够的弹性、黏性和机械强度。
蛋白质的糖基化改性是基于美拉德反应的Amadori重排[42],反应方法包括干热法和湿热法。目前已有研究表明糖基化反应可以成功修饰蛋白质并改善其功能性质。ZHONG等[43]将燕麦分离蛋白与平菇β-葡聚糖在干热条件下进行糖基化反应,导致燕麦分离蛋白的表面结构疏松,表面疏水性降低,从而使得其溶解度和乳化性增加,同时提高了燕麦分离蛋白的热稳定性,这可能是由于美拉德反应扩展了燕麦分离蛋白的二级结构。ZHANG等[44]在90 ℃和pH 9.0下采用湿法糖基化反应制备燕麦分离蛋白-葡聚糖缀合物时发现,燕麦分离蛋白-葡聚糖缀合物在油水界面上的结合物增强了空间稳定性,阻止了油滴的聚集和聚结,从而提高了乳化性能。然而WANG等[45]的研究结果与先前的研究相矛盾,他们对燕麦籽粒进行烘烤和淀粉酶水解的预处理后发现,经过预处理的燕麦蛋白溶解度和乳化性降低,并认为这可能是由于蛋白质的来源差异造成的。糖化蛋白质的理化性质可以通过控制糖基化反应中的糖化程度而发生变化。还有一种可能的解释是,先前的研究采用了优化后的糖基化条件使得糖对蛋白质的接枝导致蛋白质表面亲水基团的增加,从而增加了溶解度和乳化性,然而该研究中所采用的热处理却导致蛋白质结构过度展开,暴露了更多的疏水基团,从而增强了蛋白质-蛋白质之间的相互作用。
美拉德反应是一个复杂的反应体系。学者们分析发现美拉德反应的最后阶段会产生大量有毒有害物质[46]。目前的研究目标是生产具有良好功能特性的糖基化蛋白质并控制最终产物的生成。基于此,研究不同工艺条件下燕麦蛋白所发生的糖基化反应机理对其在食品中的应用意义突出。
3.3 酶改性
酶改性破坏了植物蛋白的刚性结构,这使得多肽之间可以相互作用,也可以与水分子发生相互作用,最终改善了蛋白的溶解性和其他功能特性。
碱性蛋白酶是多种蛋白酶的混合物,对肽键具有广泛的特异性[47]。SHAHBAL等[48]在研究5%和10%质量分数的碱性蛋白酶对燕麦蛋白酶解的影响时发现,水解程度的增加会暴露更多的游离氨基酸,产生小尺寸的蛋白质分子从而增加了燕麦蛋白的溶解度。BRÜCKNER-GÜHMANN等[49]也发现在pH 4.0时,采用胰蛋白酶和碱性蛋白酶酶解燕麦蛋白均可以显著提高蛋白质溶解度。
燕麦球蛋白的α-亚基是影响燕麦蛋白的胶凝性的重要因素之一,胰蛋白酶对α-亚基的裂解作用很弱,因此在水解过程中α-亚基的完整保留使得燕麦球蛋白表现出良好的凝胶特性[50]。NIETO-NIETO等[50]研究发现在酸性和中性pH下,胰蛋白酶水解的燕麦蛋白所产生的凝胶与大豆蛋白凝胶具有相似的机械强度,并认为胰蛋白酶的限制性水解是通过平衡多肽间的静电斥力和疏水相互作用进而增强蛋白的凝胶强度。
蛋白质-谷氨酰胺酶(食品级)的水解具备增加燕麦蛋白的溶解度,延长乳液的稳定性的能力,能显著解决在中性和低盐条件下,燕麦蛋白难以溶解的问题,其主要原理为蛋白质-谷氨酰胺酶能在不影响天冬酰胺和游离的谷氨酰胺基团的基础上,特异性作用于蛋白质的谷氨酰胺基团,且不会导致蛋白质发生过度水解[51]。JIANG等[52]研究发现采用食品级蛋白质谷氨酰胺酶对燕麦蛋白进行脱酰胺处理,不仅可以提高蛋白的溶解度还会提高其乳化性。IMMONEN等[53]在提取燕麦浓缩蛋白并用蛋白质-谷氨酰胺酶对燕麦蛋白进行脱酰胺处理(pH 8.0)时发现,所提取的蛋白在中性pH下其溶解度显著提高。JIANG等[52]认为蛋白质-谷氨酰胺酶的脱酰胺作用使蛋白质表面形成了带负电荷的羰基侧链,导致了燕麦蛋白之间的静电斥力的增加。此外,他们还认为改善燕麦蛋白的水溶性的原因可能是由于蛋白质柔性结构的增加和蛋白质的净电荷增加,从而使得蛋白质的结构更加灵活。
表1列举了单一的物理、化学及酶改性对燕麦蛋白结构和特性的影响,然而在燕麦蛋白的改性过程中除了采用单一的改性方式,还可以采用联合处理的方式提高改性的效率或改性产物的功能特性。许英一等[54]在采用热处理和转谷氨酰胺酶对燕麦蛋白及其糖基化产物进行凝胶改性时发现,转谷氨酰胺酶处理的燕麦蛋白比热处理更能诱导燕麦蛋白的凝胶形成,这可能是由于转谷氨酰胺酶与燕麦蛋白发生交联,降低了蛋白之间的静电斥力,从而形成致密的凝胶网络结构。PÖRI等[55]研究用预热(95 ℃、15 min)联合转谷氨酰胺酶和蛋白-谷氨酰胺酶对燕麦浓缩蛋白进行改性时,预热增加了2种酶诱导的燕麦浓缩蛋白的交联,燕麦蛋白的溶解度从13%增加到76%,这可能是由于热处理改变了蛋白质分子柔韧性,促进了燕麦蛋白的脱酰胺化。NIVALA等[56]研究了谷氨酰胺转胺酶和酪氨酸酶对燕麦蛋白功能特性的影响差异,发现谷氨酰胺转胺酶增加了燕麦蛋白的zeta电位值,减小了蛋白的粒径,提高其胶体稳定性和起泡性能,然而酪氨酸酶对蛋白的zeta电位值和胶体稳定性无影响,仅对燕麦蛋白的发泡性能有影响。
表1 改性方式对燕麦蛋白结构和特性的影响
Table 1 Effects of modification methods on structure and properties of oat protein

改性方式处理方式燕麦蛋白的变化参考文献物理改性烘烤(140 ℃)α-螺旋降低,β-转角增加[26]烘烤(140~240 ℃)β-折叠、β-转角结构降低,α-螺旋、无规则卷曲增加[28]超声处理(600 W、20 min)溶解度增加[31]高压(120 MPa)α-螺旋、β-折叠、β-转角结构增加,随机螺旋结构减少,溶解度、乳化性、起泡性提高[32]脉冲电场(电场强度2.0~2.1 kV/cm、输入能量434~484 kJ/kg)β-折叠降低,α-螺旋增加[35]化学改性二硫苏糖醇、抗坏血酸、半胱氨酸、亚硫酸氢钠二硫键断裂,乳化活性提高[37]琥珀酸酐改善凝胶特性,β-折叠减少,α-螺旋、无规则卷曲增加[38]乙酸酐改善凝胶特性,β-折叠减少,α-螺旋、无规则卷曲增加[38]酸性脱酰胺化溶解度、乳化性提高,泡沫稳定性下降[41]干法糖基化(平菇β-葡聚糖)溶解度、乳化性提高[43]湿法糖基化(40 kDa葡聚糖)乳化性提高[44]酶改性碱性蛋白酶暴露游离氨基酸,溶解度增加[48-49]胰蛋白酶溶解度增加,凝胶强度增加[49-50]蛋白质-谷氨酰胺酶溶解度、乳化性提高[52-53]转谷氨酰胺酶凝胶强度增加,起泡性提高[54]转谷氨酰胺酶复合蛋白质-谷氨酰胺酶溶解度增加[55]酪氨酸酶起泡性提高[56]
4 不同燕麦制品的加工方式对燕麦蛋白结构和特性的影响
探索不同燕麦制品的加工对燕麦蛋白变化的影响是使燕麦蛋白能够更广泛地应用于各种食品的重中之重。表2总结了不同加工方式对燕麦蛋白结构和特性的影响。
表2 加工方式对燕麦蛋白结构和特性的影响
Table 2 Effects of processing methods on structure and properties of oat protein
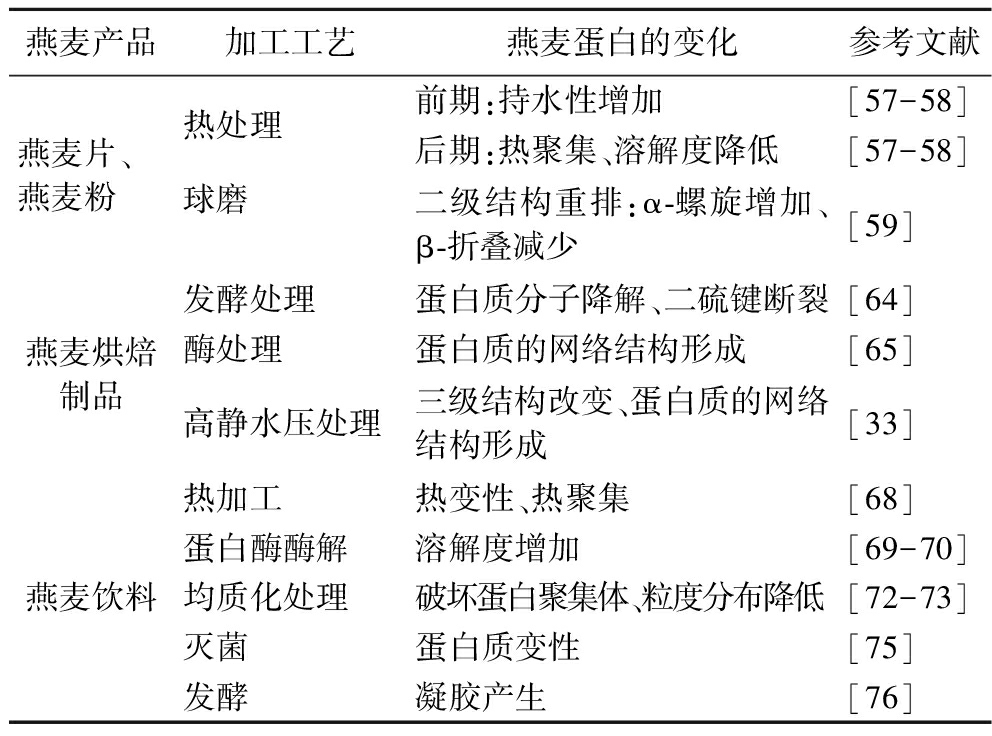
燕麦产品加工工艺燕麦蛋白的变化参考文献燕麦片、燕麦粉热处理球磨前期:持水性增加[57-58]后期:热聚集、溶解度降低[57-58]二级结构重排:α-螺旋增加、β-折叠减少[59]燕麦烘焙制品发酵处理蛋白质分子降解、二硫键断裂[64]酶处理蛋白质的网络结构形成[65]高静水压处理三级结构改变、蛋白质的网络结构形成[33]燕麦饮料热加工热变性、热聚集[68]蛋白酶酶解溶解度增加[69-70]均质化处理破坏蛋白聚集体、粒度分布降低[72-73]灭菌蛋白质变性[75]发酵凝胶产生[76]
4.1 燕麦粉、燕麦片
在中国,95%的燕麦用于加工成燕麦粉和燕麦片[57]。与其他谷物相比,燕麦具有较高的脂肪含量。为了确保贮存与后续加工过程的脂质稳定性,在加工过程中要对燕麦进行热处理(例如炒制或蒸煮),从而使得产生异味和酸败的内源性脂肪酶失活,然而热处理带来的高温能引起蛋白质的变性,并导致其功能特性发生改变[58],其功能特性发生改变的主要机理为高温引起燕麦蛋白结构的展开,热处理前期会使燕麦蛋白暴露出的亲水基团与水分子结合从而增加了燕麦蛋白的持水性,热处理后期则会造成燕麦蛋白发生热聚集从而降低燕麦蛋白的溶解度[59]。HE等[28]也发现热处理可导致球蛋白氨基酸含量的降低和体外消化率的增加,这可能是由于热处理会展开球蛋白的结构并暴露更多的酶位点。
相较于小麦制粉,燕麦的研磨加工工艺仍处于初级阶段。球磨所产生的高压和剪切力可导致燕麦蛋白的二级结构重排。RAMADHAN等[60]研究球磨对燕麦麸皮蛋白结构的影响时发现,球磨会增加α-螺旋并减少β-折叠结构。立式石磨则是一种改良版的研磨设备,与锤磨和辊磨相比,立式石磨加工更能保留燕麦麸皮和胚芽,因此立式石磨加工燕麦可以提高燕麦粉的蛋白含量[61]。
4.2 燕麦烘焙制品
由于燕麦蛋白面筋基质的缺乏,以燕麦粉为原料制备的燕麦面团无法形成能够包裹着淀粉的面筋网络结构,因此燕麦粉在烘焙制品中的应用受到了限制。大多数研究者在开发燕麦面包等烘焙产品时,仅将燕麦粉以配料的形式进行添加[62-63]。燕麦烘焙制品的研究多集中于发酵处理、酶处理以及高静水压处理对燕麦面团烘焙特性的改善。面团的发酵是面包制作过程中的重要环节,其可使面包组织蓬松,口感疏松。张庆[64]利用植物乳杆菌发酵燕麦酸面团改善其面包感官特性时发现,发酵会增加燕麦蛋白的溶解度,这可能是由于发酵降低了面团的pH并激活了谷物内源性蛋白酶造成蛋白质分子的降解以及二硫键的断裂。LI等[65]则是选用谷氨酰胺转氨酶改善燕麦面团的网络结构,增加其黏弹性,这可能是由于谷氨酰胺转氨酶可以改善燕麦蛋白的功能特性,促进蛋白质的网络结构的形成从而改善燕麦面团的烘焙特性。此外,高静水压处理可以通过提高蛋白质和淀粉的功能特性从而弥补燕麦面包面筋基质缺失的缺陷。HÜTTNER等[33]探究高静水压处理对燕麦面包品质的影响时,发现燕麦粉的添加量为10%且面团经过200 MPa的静水压处理改变了燕麦蛋白的三级结构,促进了蛋白质网络结构的形成并显著改善了面包的体积。
4.3 燕麦饮料
燕麦乳可以分为发酵型和非发酵型。燕麦制备燕麦乳存在的技术难度主要是燕麦中淀粉与β-葡聚糖容易形成胶体或凝胶,蛋白质发生聚集和沉淀等[66]。常在加工过程中通过酶解、均质处理、高温热处理等手段改善燕麦乳脂肪上浮和大颗粒沉淀等问题。
在燕麦乳的加工过程中进行酶解可以降低燕麦乳的黏度并延缓淀粉回生[67]。燕麦蛋白的溶解性和乳化活性较差,且燕麦乳加工过程中的热加工还会导致燕麦蛋白的变性和聚集,从而降低燕麦乳的稳定性[68],因此在酶解的过程中除了可以添加淀粉酶水解淀粉,还会加入蛋白酶将蛋白质水解成小分子,进而提高产品的质量和感官接受度[69]。孟凡欢[70]研究发现1‰的风味蛋白酶和0.5‰的复合蛋白酶混合酶解处理不仅使得燕麦乳口感提升,还增加了燕麦乳的贮藏稳定性,然而酶解后仍然会存在一些难以溶解的大分子物质,如蛋白质、膳食纤维,这会造成燕麦乳中的大颗粒沉淀[71],因此可以采用均质化处理的方法破坏聚集体并降低粒度分布[72]。汪丽萍等[73]在探究均质工艺对燕麦乳稳定性影响时发现,燕麦乳在50 MPa下均质2次后乳液平均粒径变小,稳定性提高,但过度的均质化处理会造成小尺寸颗粒的重新聚集,粒径分布增加[74]。灭菌处理是燕麦乳生产的最后一步,燕麦乳在经过巴氏灭菌或超高温处理可以延长产品的保质期,然而热处理会导致燕麦乳中蛋白质的变性以及风味和感官的变化[75]。此外,由于燕麦浓缩蛋白具有良好的凝胶性质,因此可单独作为乳酸菌发酵的燕麦基酸奶的功能性组分。BRÜCKNER-GÜHMANN等[76]发现含有燕麦浓缩蛋白(oat protein concentrate,OPC)的酸奶样品持水能力比含有燕麦分离蛋白的酸奶样品持水能力相比更高。并认为是OPC中的燕麦淀粉提高了酸奶样品的持水能力,并减少了脱水作用,同时,OPC使得酸奶产生更加光滑的质地。
5 结论与展望
近年来,随着人们对饮食结构及食品营养的重视,以燕麦为原料的食品越来越多,并且基于可持续发展的要求,食品加工企业也开始选用燕麦蛋白作为动物蛋白的替代性蛋白。在加工过程中,燕麦蛋白的功能特性可通过物理、化学、酶改性等方式进行改善从而增加其在营养食品中的应用。尽管学者们在该领域已经取得了一系列的研究进展,但是仍存在一些内容值得深入研究:a)探究加工方式对燕麦蛋白在燕麦制品中的变化,基于其变化规律,可通过优化燕麦加工工艺以及加工条件来提高燕麦制品的感官特性和营养价值;b)燕麦蛋白的改性方式可进一步拓展,开发绿色改性方法从而改变传统的加工方式,使得改性燕麦蛋白在食品中具有实用价值;c)探究不同的改性技术联合应用,促进相关机理探索,可有效地提高改性效率以及产物的功能特性;d)探索改性技术的工业化应用,推进燕麦蛋白以及燕麦产品规模化生产。
[1] 张丽萍, 翟爱华. 燕麦的营养功能特性及综合加工利用[J]. 食品与机械, 2004, 20(2):55-57.
ZHANG L P, ZHAI A H. Function feature and comprehesive processing utility of oats[J]. Food and Machinery, 2004, 20(2):55-57.
[2] 李桂霞, 王凤成, 邬大江. 我国杂粮的营养与加工(下)[J]. 粮食与食品工业, 2009, 16(6):5-7.
LI G X, WANG F C, WU D J. Nutrition and processing of coarse cereals in China (Ⅱ)[J]. Cereal &Food Industry, 2009, 16(6):5-7.
[3] ZHAO Y, MINE Y, MA C Y. Study of thermal aggregation of oat globulin by laser light scattering[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10):3089-3096.
[4] 高晓莉, 王丽丽, 刘丽娅, 等. pH值和温度对燕麦蛋白溶解与聚集特性的影响[J]. 核农学报, 2020, 34(11):2492-2498.
GAO X L, WANG L L, LIU L Y, et al. Effects of pH and temperature on the solubility and aggregation of oat protein[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(11):2492-2498.
[5] 许英一, 王宇, 林巍. 酶法提取燕麦蛋白理化性质研究[J]. 食品工业, 2018, 39(7):72-75.
XU Y Y, WANG Y, LIN W. Study on the physicochemical properties of oat protein by enzymatic method[J]. The Food Industry, 2018, 39(7):72-75.
[6] SCHULTES R E. Oats: Chemistry and technology[J]. Economic Botany, 1987, 41(2):203.
[7] L SZTITY R. Oat grain—a wonderful reservoir of natural nutrients and biologically active substances[J]. Food Reviews International, 1998, 14(1):99-119.
SZTITY R. Oat grain—a wonderful reservoir of natural nutrients and biologically active substances[J]. Food Reviews International, 1998, 14(1):99-119.
[8] BURGESS S R, SHEWRY P R, MATLASHEWSKI G J, et al. Characteristics of oat (Avena sativa L.) seed globulins[J]. Journal of Experimental Botany, 1983, 34(10):1320-1332.
[9] KLOSE C, ARENDT E K. Proteins in oats; their synthesis and changes during germination: A review[J]. Critical Reviews in Food Science and Nutrition, 2012, 52(7):629-639.
[10] LOPONEN J, LAINE P, SONTAG-STROHM T, et al. Behaviour of oat globulins in lactic acid fermentation of oat bran[J]. European Food Research and Technology, 2007, 225(1):105-110.
[11] M KINEN O E, SOZER N, ERCILI-CURA D, et al. Protein from Oat[M]. Amsterdam: Elsevier, 2017:105-119.
KINEN O E, SOZER N, ERCILI-CURA D, et al. Protein from Oat[M]. Amsterdam: Elsevier, 2017:105-119.
[12] GUAN X, YAO H Y, CHEN Z X, et al. Some functional properties of oat bran protein concentrate modified by trypsin[J]. Food Chemistry, 2007, 101(1):163-170.
[13] LI R N, XIONG Y L. Sensitivity of oat protein solubility to changing ionic strength and pH[J]. Journal of Food Science, 2021, 86(1):78-85.
[14] LI R N, XIONG Y L. Ultrasound-induced structural modification and thermal properties of oat protein[J]. LWT, 2021, 149:111861.
[15] MA C Y, HARWALKAR V R. Chemical characterization and functionality assessment of oat protein fractions[J]. Journal of Agricultural and Food Chemistry, 1984, 32(1):144-149.
[16] SAHASRABUDHE M R. Measurement of lipase activity in single grains of oat (Avena sativa L.)[J]. Journal of the American Oil Chemists’ Society, 1982, 59(8):354-355.
[17] PETERSON D M, BRINEGAR A C, WEBSTER F H. Oat Storage Proteins. in Oats Chemistry and Technology[M]. America: Webster F H, 1986.
[18] EGOROV T A, MUSOLYAMOV A K, KOCHERGIN A A, et al. Isolation, characterisation by mass spectrometry and partial amino acid sequencing of avenins[J]. Journal of Cereal Science, 1994, 20(2):107-117.
[19] LASZTITY, RADOMIR. The Chemistry of Cereal Proteins[M]. 2nd ed. Boca Raton, Florida: RADOMIRLASZTITY, 1995.
[20] AMAGLIANI L, O’REGAN J, KELLY A L, et al. The composition, extraction, functionality and applications of rice proteins: A review[J]. Trends in Food Science &Technology, 2017, 64:1-12.
[21] KONAK Ü ![]() ERCILI-CURA D, SIBAKOV J, et al. CO2-defatted oats: Solubility, emulsification and foaming properties[J]. Journal of Cereal Science, 2014, 60(1):37-41.
ERCILI-CURA D, SIBAKOV J, et al. CO2-defatted oats: Solubility, emulsification and foaming properties[J]. Journal of Cereal Science, 2014, 60(1):37-41.
[22] 李洋. 燕麦蛋白分离提纯工艺及功能性研究[D]. 郑州: 河南工业大学, 2012.
LI Y. The research on extraction process and functional studies of oat protein[D]. Zhengzhou: Henan University of Technology, 2012.
[23] 管骁, 姚惠源. 燕麦麸蛋白的组成及功能性质研究[J]. 食品科学, 2006, 27(7):72-76.
GUAN X, YAO H Y. Composition and functional properties of oat bran protein[J]. Food Science, 2006, 27(7):72-76.
[24] MEL R, GOUGH K M, NILSEN K T, et al. Determining the impact of genotype x environment on oat protein isolate structural and functional characteristics [J]. Cereal Chemistry, 2023, 100(4): 986-1000.
[25] 周立, 颜丹云, 赵祎瑾, 等. 燕麦蛋白的提取及功能特性研究进展[J]. 食品研究与开发, 2022, 43(17):210-217.
ZHOU L, YAN D Y, ZHAO Y J, et al. Extraction and functional properties of oat protein: A review[J]. Food Research and Development, 2022, 43(17):210-217.
[26] TORBICA A, ![]() S, et al. Insight in changes in starch and proteins molecular structure of non-wheat cereal flours influenced by roasting and extrusion treatments[J]. Food Hydrocolloids, 2023, 140:108591.
S, et al. Insight in changes in starch and proteins molecular structure of non-wheat cereal flours influenced by roasting and extrusion treatments[J]. Food Hydrocolloids, 2023, 140:108591.
[27] RUNYON J R, SUNILKUMAR B A, NILSSON L, et al. The effect of heat treatment on the soluble protein content of oats[J]. Journal of Cereal Science, 2015, 65:119-124.
[28] HE T, WANG J, HU X Z. Effect of heat treatment on the structure and digestion properties of oat globulin[J]. Cereal Chemistry, 2021, 98(3):740-748.
[29] LIN D R, ZHANG Q T, XIAO L J, et al. Effects of ultrasound on functional properties, structure and glycation properties of proteins: A review[J]. Critical Reviews in Food Science and Nutrition, 2021, 61(15):2471-2481.
[30] LEGAY M, GONDREXON N, LE PERSON S, et al. Enhancement of heat transfer by ultrasound: Review and recent advances[J]. International Journal of Chemical Engineering, 2011, 2011:670108.
[31] 李健. 超声波改性燕麦球蛋白的研究[D]. 福州: 福州大学, 2017.
LI J. Study on ultrasonic modification of oat globulin[D]. Fuzhou: Fuzhou University, 2017.
[32] MA S, ZHANG M L, SHI Y B, et al. Effects of ultrahigh pressure treatment on eating quality of steamed oat and oat protein structure[J]. CyTA-Journal of Food, 2021, 19(1):56-62.
[33] HÜTTNER E K, DAL BELLO F, ARENDT E K. Fundamental study on the effect of hydrostatic pressure treatment on the bread-making performance of oat flour[J]. European Food Research and Technology, 2010, 230(6):827-835.
[34] CHENG M M, LI Y N, LUO X H, et al. Effect of dynamic high-pressure microfluidization on physicochemical, structural, and functional properties of oat protein isolate[J]. Innovative Food Science &Emerging Technologies, 2022, 82:103204.
[35] DUQUE S M M, LEONG S Y, AGYEI D, et al. Understanding the impact of Pulsed Electric Fields treatment on the thermal and pasting properties of raw and thermally processed oat flours[J]. Food Research International, 2020, 129:108839.
[36] 田悦, 杜军保. 二硫键和巯基在蛋白质结构功能中的作用及分析方法[J]. 实用儿科临床杂志, 2007, 22(19):1499-1501.
TIAN Y, DU J B. Effect of disulfide bond and mercapto-group on structure and function of protein and analytical method[J]. Journal of Applied Clinical Pediatrics, 2007, 22(19):1499-1501.
[37] LI R N, XIONG Y L. Disulfide cleavage to improve interfacial behavior and emulsification properties of oat protein[J]. Food Chemistry, 2023, 404:134511.
[38] MA C Y, WOOD D F. Functional properties of oat proteins modified by acylation, trypsin hydrolysis or linoleate treatment[J]. Journal of the American Oil Chemists’ Society, 1987, 64(12):1726-1731.
[39] ZHAO C B, ZHANG H, XU X Y, et al. Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J]. Process Biochemistry, 2017, 57:117-123.
[40] MATSUDOMI N, KATO A, KOBAYASHI K. Conformation and surface properties of deamidated gluten[J]. Agricultural and Biological Chemistry, 1982, 46(6):1583-1586.
[41] MIRMOGHTADAIE L, KADIVAR M, SHAHEDI M. Effects of succinylation and deamidation on functional properties of oat protein isolate[J]. Food Chemistry, 2009, 114(1):127-131.
[42] YUAN F Z, AHMED I, LYU L T, et al. Impacts of glycation and transglutaminase-catalyzed glycosylation with glucosamine on the conformational structure and allergenicity of bovine β-lactoglobulin[J]. Food &Function, 2018, 9(7):3944-3955.
[43] ZHONG L, MA N, WU Y L, et al. Characterization and functional evaluation of oat protein isolate-Pleurotus ostreatus β-glucan conjugates formed via Maillard reaction[J]. Food Hydrocolloids, 2019, 87:459-469.
[44] ZHANG B, GUO X N, ZHU K X, et al. Improvement of emulsifying properties of oat protein isolate-dextran conjugates by glycation[J]. Carbohydrate Polymers, 2015, 127:168-175.
[45] WANG H L, XIANG L W, RAO P F, et al. Effects of pretreatments on structural and functional changes of oat protein isolate[J]. Cereal Chemistry, 2022, 99(1):90-99.
[46] 许朵霞, 许洪高, 毛立科, 等. 蛋白质多糖共价复合物的研究进展[J]. 食品研究与开发, 2008, 29(11):186-190.
XU D X, XU H G, MAO L K, et al. Research advances in the conjugation of protein and polysaccharide through covalent interaction[J]. Food Research and Development, 2008, 29(11):186-190.
[47] OSMAN A, EL-ARABY G M, TAHA H. Potential use as a bio-preservative from lupin protein hydrolysate generated by alcalase in food system[J]. Journal of Applied Biology &Biotechnology, 2016, 4(2): 76-81.
[48] SHAHBAL N, JING X P, BHANDARI B, et al. Effect of enzymatic hydrolysis on solubility and surface properties of pea, rice, hemp, and oat proteins: Implication on high protein concentrations[J]. Food Bioscience, 2023, 53:102515.
[49] BRÜCKNER-GÜHMANN M, HEIDEN-HECHT T, SÖZER N, et al. Foaming characteristics of oat protein and modification by partial hydrolysis[J]. European Food Research and Technology, 2018, 244(12):2095-2106.
[50] NIETO-NIETO T V, WANG Y X, OZIMEK L, et al. Effects of partial hydrolysis on structure and gelling properties of oat globular proteins[J]. Food Research International, 2014, 55:418-425.
[51] SCHEUPLEIN R J, MIZUTANI A, YAMAGUCHI S. Studies on the non-pathogenicity of Chryseobacterium proteolyticum and on the safety of the enzyme: Protein-glutaminase[J]. Regulatory Toxicology and Pharmacology, 2007, 49(2):79-89.
[52] JIANG Z Q, SONTAG-STROHM T, SALOVAARA H, et al. Oat protein solubility and emulsion properties improved by enzymatic deamidation[J]. Journal of Cereal Science, 2015, 64:126-132.
[53] IMMONEN M, MYLLYVIITA J, SONTAG-STROHM T, et al. Oat protein concentrates with improved solubility produced by an enzyme-aided ultrafiltration extraction method[J]. Foods, 2021, 10(12):3050.
[54] 许英一, 马鑫蕊, 王宇, 等. 热处理及转谷氨酰胺酶对糖基化燕麦蛋白凝胶性质的影响[J]. 食品科学, 2022, 43(18):62-68.
XU Y Y, MA X R, WANG Y, et al. Effects of heat treatment and transglutaminase on the gelation properties of glycosylated oat protein[J]. Food Science, 2022, 43(18):62-68.
[55] PÖRI P, NISOV A, NORDLUND E. Enzymatic modification of oat protein concentrate with trans- and protein-glutaminase for increased fibrous structure formation during high-moisture extrusion processing[J]. LWT, 2022, 156:113035.
[56] NIVALA O, M KINEN O E, KRUUS K, et al. Structuring colloidal oat and faba bean protein particles via enzymatic modification[J]. Food Chemistry, 2017, 231:87-95.
KINEN O E, KRUUS K, et al. Structuring colloidal oat and faba bean protein particles via enzymatic modification[J]. Food Chemistry, 2017, 231:87-95.
[57] HU X Z, ZHENG J M, LI X P, et al. Chemical composition and sensory characteristics of oat flakes: A comparative study of naked oat flakes from China and hulled oat flakes from western countries[J]. Journal of Cereal Science, 2014, 60(2):297-301.
[58] LAMPI A M, DAMERAU A, LI J, et al. Changes in lipids and volatile compounds of oat flours and extrudates during processing and storage[J]. Journal of Cereal Science, 2015, 62:102-109.
[59] 张政. 炒制对裸燕麦制粉及品质的影响[D]. 郑州: 河南工业大学, 2019.
ZHANG Z. Effects of stir-frying on naked oats milling and quality[D]. Zhengzhou: Henan University of Technology, 2019.
[60] RAMADHAN K, FOSTER T J. Effects of ball milling on the structural, thermal, and rheological properties of oat bran protein flour[J]. Journal of Food Engineering, 2018, 229:50-56.
[61] LIU S, ZHAO L P, ZHANG J, et al. Functional drink powders from vertical-stone-milled oat and highland barley with high dietary-fiber levels decrease the postprandial glycemic response[J]. Journal of Functional Foods, 2021, 83:104548.
[62] 李娜, 陈前, 李海峰, 等. 燕麦粉对小麦面团特性及饼干品质的影响[J]. 食品研究与开发, 2021, 42(1):134-140.
LI N, CHEN Q, LI H F, et al. Influence of oat flour on dough properties and biscuit quality[J]. Food Research and Development, 2021, 42(1):134-140.
[63] MOHD BASRI M S, MOHD JAIS N, SULAIMAN A, et al. Optimizing the processing factor and formulation of oat-based cookie dough for enhancement in stickiness and moisture content using response surface methodology and superimposition[J]. Processes, 2020, 8(7):797.
[64] 张庆. 植物乳杆菌燕麦酸面团发酵过程及其面包烘焙特性研究[D]. 无锡: 江南大学, 2012.
ZHANG Q. Studies on the properties of oat sourdough fermented by Lactobacillus plantarum and its breadmaking characteristics[D]. Wuxi: Jiangnan University, 2012.
[65] LI Y Q, SHI R R, QIN C, et al. Gluten-free and prebiotic oat bread: Optimization formulation by transglutaminase improvement dough structure[J]. Journal of Food Processing and Preservation, 2021, 45(9): e15684.
[66] BOCKER R, SILVA E K. Innovative technologies for manufacturing plant-based non-dairy alternative milk and their impact on nutritional, sensory and safety aspects[J]. Future Foods, 2022, 5:100098.
[67] 郭晓娜, 张少兵, 张晖, 等. 燕麦乳饮料制备工艺研究[J]. 粮食与油脂, 2011, 24(7):44-46.
GUO X N, ZHANG S B, ZHANG H, et al. Study on preparation technology of oat beverage[J]. Cereals &Oils, 2011, 24(7):44-46.
[68] 刘刚, 刘英, 陈季旺, 等. 燕麦粉蛋白的理化性质研究[J]. 食品科学, 2008, 29(6):70-74.
LIU G, LIU Y, CHEN J W, et al. Study on physico-chemical properties of oat flour protein[J]. Food Science, 2008, 29(6):70-74.
[69] 罗洁, 刘文华, 程李琳, 等. 酶法制备燕麦蛋白饮料的研究[J]. 食品科技, 2013, 38(11):154-158.
LUO J, LIU W H, CHENG L L, et al. Preparation of oat protein beverage by enzymatic hydrolysis method[J]. Food Science and Technology, 2013, 38(11):154-158.
[70] 孟凡欢. 燕麦品种及成分对燕麦乳稳定性的影响[D]. 天津: 天津科技大学, 2017.
MENG F H. Effects of oat varieties and components on the stability of oat milk[D]. Tianjin: Tianjin University of Science &Technology, 2017.
[71] DURAND A, FRANKS G V, HOSKEN R W. Particle sizes and stability of UHT bovine, cereal and grain milks[J]. Food Hydrocolloids, 2003, 17(5):671-678.
[72] MALAKI NIK A, TOSH S, POYSA V, et al. Physicochemical characterization of soymilk after step-wise centrifugation[J]. Food Research International, 2008, 41(3):286-294.
[73] 汪丽萍, 朱亚婧, 冯叙桥, 等. 均质工艺对燕麦浆稳定性影响的研究[J]. 食品工业科技, 2014, 35(18):324-327; 354.
WANG L P, ZHU Y J, FENG X Q, et al. Study on influence of homogenization parameters on the stability of oats milk[J]. Science and Technology of Food Industry, 2014, 35(18):324-327; 354.
[74] 关淳博, 刘婷婷, 樊红秀, 等. 高压均质对脱脂油莎豆乳品质及其稳定性的影响[J]. 食品与发酵工业, 2022, 48(23):173-178.
GUAN C B, LIU T T, FAN H X, et al. Effects of high-pressure homogenization on quality and stability of skimmed Cyperus esculentus milk[J]. Food and Fermentation Industries, 2022, 48(23):173-178.
[75] KWOK K C, NIRANJAN K. Review: Effect of thermal processing on soymilk[J]. International Journal of Food Science &Technology, 1995, 30(3):263-295.
[76] BRÜCKNER-GÜHMANN M, BENTHIN A, DRUSCH S. Enrichment of yoghurt with oat protein fractions: Structure formation, textural properties and sensory evaluation[J]. Food Hydrocolloids, 2019, 86:146-153.