我国的传统中药茯苓,是多孔菌科茯苓属(Poria cocos)的干燥菌核,最早见于《神农本草经》[1],并有“十方九苓”和“四时神药”的美誉[2]。《红楼梦》中最珍贵的药方“暖香丸”是由《景岳全书》中的“秘传大补元圆”增添带叶人参、紫河车、何首乌、茯苓配制而成,在书中被描述成可药到病除的“神药”[3]。《金匮要略》中的当归芍药散是由包括茯苓在内的六味中药组成,对多种癌症术后恢复具有良好效果[4]。韩国中药方kyeongok-go,是由人参、茯苓、地黄和蜂蜜组成,具有抗衰老、改善肝功能、降低血糖和胆固醇等功效,同时也具有治疗呼吸系统疾病的潜在功效[5]。中国药典记载茯苓在临床上常用于治疗多种症状,包括水肿组织、食欲不振、心悸、腹泻、精神焦虑和失眠[6]。茯苓是富含各种生物活性化合物的天然物质,这些化合物在过去十年里被证明对癌症治疗有很大的潜力和效果,不仅能杀死癌细胞,还具有抗氧化、抑制血管生成和调节免疫系统的功能[7]。
野生茯苓寄生或腐生于松树的根部,最早记载于西晋《博物志》:“松脂沦入地,千年化为伏苓”[8],于每年的7~9月成熟。而茯苓的人工栽培历史更为悠久,可追溯到距今已有1 500年历史的《本草经集注》[9]。我国的成品中药茯苓每年消耗约为3万~4万kg[10],目前人工栽培的主产区主要集中于我国鄂、豫、皖交界的大别山区及云贵地区[11],主要栽培模式为林地仿生栽培和松树椴木栽培,而茯苓的人工栽培仍然摆脱不了对松木资源的依赖。茯苓发酵技术成为了解决上述问题的主要手段,茯苓发酵活性物质主要是茯苓多糖(Poria cocos polysaccharide,PCP)、三萜(Poria cocos triterpenes,PCT)类化合物等,这些活性物质具有抗肿瘤、抗炎、抗氧化、降血糖、降血脂、调节免疫等作用。但是,茯苓的活性物质含量受到生长条件和采收时间等因素的影响,因此,利用发酵技术对茯苓进行改造是一种提高茯苓药用价值的有效方法。
该文通过知网、Web of Science、PubMed数据库总结了PCP、三萜发酵产物的制备过程,抗肿瘤药理活性的研究进展,提出了现有的研究差距并为未来的研究提供启示。
1 茯苓液体发酵
茯苓发酵菌丝体与人工栽培的茯苓菌核中均含有PCP、PCT等活性物质,茯苓发酵菌丝体中的PCP、PCT含量显著高于茯苓栽培菌核,并且通过菌株筛选、发酵条件优化及添加诱导剂等手段显著提高了菌丝体PCT的发酵产量[12]。JIN等[13]探讨了食用真菌茯苓的发酵菌丝中三萜酸的变化规律和影响因素,发现通过发酵可以显著提高茯苓菌丝中三萜酸的含量和多样性,菌丝体通过发酵产生的PCT产量显著高于茯苓菌核表皮及内部的PCT含量。JIN等[14]研究了不同培养基对茯苓菌丝体中多糖的化学和物理特性的影响,发现不同培养基对茯苓多糖的产量、分子质量、单糖组成、结构特征、溶解度、黏度和水溶液黏弹性等方面具有显著影响。很多研究者对茯苓液体发酵条件及培养基进行了研究及优化,详见表1。
表1 茯苓发酵工艺优化
Table 1 Optimization of Poria cocos fermentation process

优化结果考察指标参考文献糖27.51 g/L,蛋白胨47.35 g/L,初始pH=5.2茯苓酸产量[15]培养温度27 ℃、接种量4%、培养5 d菌丝体生物量[16]胞内羧甲基多糖发酵动力学模型建立胞内羧甲基茯苓多糖[17]24 h光照处理,添加橄榄油,接种量8%,发酵时间8 d茯苓酸产量[18]装液量50 mL/250 mL,接种体积分数6%,pH=5.5,温度26 ℃,转速130 r/min,发酵11 d胞内三萜[19]发酵第4天添加150 μmol/L的茉莉酸甲酯胞内三萜[20]30 g/L葡萄糖、7.5 g/L酵母浸粉、pH 5、0.01 g/L 2-硫代巴比妥酸多糖[21]葡萄糖47.1 g/L、酵母粉20.5 g/L、硫酸镁1.8 g/L、蛋白胨30 g/L、硝酸钠5 g/L、磷酸二氢钾1.0 g/L、VB1 1 g/L、无水氯化钙0.1 g/L多糖[22]pH=5.45、VB1 7.3 mg/L、转速132 r/min、温度26.6 ℃总三萜[23]
2 茯苓活性物质抗肿瘤机制
2.1 茯苓多糖
肿瘤的发生和发展与机体的免疫功能密切相关,免疫功能低下会导致肿瘤细胞逃避免疫监视和清除,从而促进肿瘤的生长和转移。PCP可以通过激活和增强机体的免疫细胞,如巨噬细胞、树突状细胞、T细胞、B细胞和自然杀伤细胞等提高机体的免疫应答能力,从而抑制肿瘤的发展。例如,PCP可以结合巨噬细胞和树突状细胞的TLR4受体,激活TRAF6/NF-κB信号通路,促进这些细胞的成熟和活化,从而提高其抗原呈递能力[24]。PCP还可以结合T细胞的Notch受体,激活Notch信号通路,促进T细胞的分化和增殖,提高其效应功能[25]。PCP还影响免疫细胞的分化和极化,诱导Th1型免疫应答,抑制M1型巨噬细胞极化,能够有效地清除肿瘤细胞[26]。除此之外,PCP还可以增强免疫细胞的效应功能,发挥免疫增强和免疫监视的作用,增加巨噬细胞和自然杀伤细胞的吞噬和杀伤能力,从而清除肿瘤细胞[27],促进各种免疫细胞分泌和表达多种具有抗肿瘤作用的细胞因子,如IFN-γ、TNF-α、IL-6、IL-12等[28-29]。这些细胞因子不仅可以直接对肿瘤细胞产生毒性作用,还可以协同其他免疫效应器对肿瘤细胞产生协同抑制作用。
肿瘤细胞的无限增殖是由于其对正常细胞周期调控失去了敏感性,从而导致细胞周期失衡和增殖过度。肿瘤细胞的凋亡是指细胞自身启动的一种程序性死亡过程,是机体清除异常细胞和维持组织稳态的重要方式。PCP可以通过干扰肿瘤细胞周期进程和激活内源性或外源性凋亡信号通路,抑制其增殖并诱导肿瘤细胞发生凋亡。例如,PCP能够显著抑制人癌细胞的增殖,其能够诱导A549和MCF-7细胞在G0/G1期停滞,并增加亚G1期(凋亡期)细胞比例。激活Caspase-3和Caspase-9途径,降低Bcl-2和Bcl-xl的表达,增加Bax和Bad的表达[30-33]。
肿瘤细胞的迁移和侵袭是指肿瘤细胞从原发灶脱离,通过血液或淋巴系统转移到其他部位形成转移灶的过程,是肿瘤发展的重要特征之一。肿瘤细胞的迁移和侵袭受到多种因素的调节,包括基质金属蛋白酶(matrix metalloproteinase, MMP)、细胞黏附分子、细胞骨架蛋白(如Filamentous actin,F-actin)等。PCP可以通过影响这些因素的表达或活性,抑制肿瘤细胞的迁移和侵袭能力,抑制肝癌细胞的增殖、迁移和侵袭,下调肿瘤细胞中MMP-2、MMP-9、VEGF-A等促进肿瘤迁移和侵袭的因子的表达,上调E-cadherin等抑制肿瘤迁移和侵袭的因子的表达[28,31,34]。
肿瘤细胞的自噬在肿瘤发生和发展中具有复杂和双重的作用,既可以促进肿瘤细胞的生存和适应,也可以诱导肿瘤细胞的死亡和清除。PCP可以通过影响肿瘤细胞自噬相关基因或蛋白的表达或活性,诱导或抑制肿瘤细胞的自噬。PCP可以减轻5-氟尿嘧啶(5-fluorouracil,5-FU)诱导的肝脏损伤和全身炎症反应[35],并通过上调HepG2和HT-29细胞中LC3-Ⅱ、Beclin-1等自噬相关蛋白的表达,下调p62等抑制自噬蛋白的表达,诱导其自噬[36-37]。其他研究进展见表2。
表2 茯苓多糖的药理活性
Table 2 Pharmacological activity of Poria cocos polysaccharides
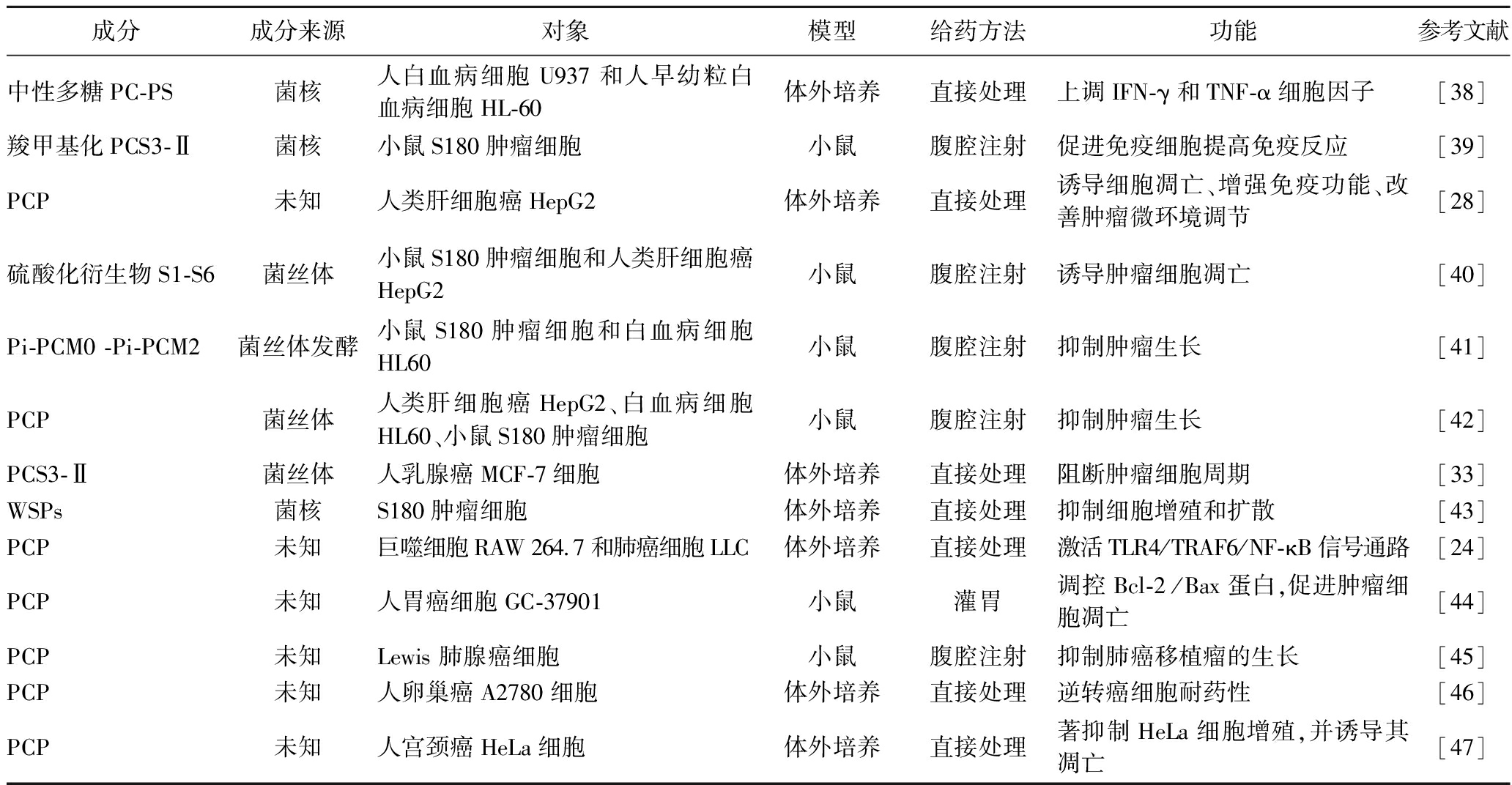
成分成分来源对象模型给药方法功能参考文献中性多糖PC-PS菌核人白血病细胞U937和人早幼粒白血病细胞HL-60体外培养直接处理上调IFN-γ和TNF-α细胞因子[38]羧甲基化PCS3-Ⅱ菌核小鼠S180肿瘤细胞小鼠腹腔注射促进免疫细胞提高免疫反应[39]PCP未知人类肝细胞癌HepG2体外培养直接处理诱导细胞凋亡、增强免疫功能、改善肿瘤微环境调节[28]硫酸化衍生物S1-S6菌丝体小鼠S180肿瘤细胞和人类肝细胞癌HepG2小鼠腹腔注射诱导肿瘤细胞凋亡[40]Pi-PCM0 -Pi-PCM2菌丝体发酵小鼠S180肿瘤细胞和白血病细胞HL60小鼠腹腔注射抑制肿瘤生长[41]PCP菌丝体人类肝细胞癌HepG2、白血病细胞HL60、小鼠S180肿瘤细胞小鼠腹腔注射抑制肿瘤生长[42]PCS3-Ⅱ菌丝体人乳腺癌MCF-7细胞体外培养直接处理阻断肿瘤细胞周期[33]WSPs菌核S180肿瘤细胞体外培养直接处理抑制细胞增殖和扩散[43]PCP未知巨噬细胞RAW 264.7和肺癌细胞LLC体外培养直接处理激活TLR4/TRAF6/NF-κB信号通路[24]PCP未知人胃癌细胞GC-37901小鼠灌胃调控 Bcl-2 /Bax 蛋白,促进肿瘤细胞凋亡[44]PCP未知Lewis 肺腺癌细胞小鼠腹腔注射抑制肺癌移植瘤的生长[45]PCP未知人卵巢癌A2780细胞体外培养直接处理逆转癌细胞耐药性[46]PCP未知人宫颈癌HeLa细胞体外培养直接处理著抑制HeLa细胞增殖,并诱导其凋亡[47]
2.2 茯苓三萜
PCT主要包括藿烷型、白桦型和4,5-去环藿烷型3种类型,其中以藿烷型为最多,如齐墩果酸、茯苓酸、德氏酸、茯苓醇、茯苓醇甲酯等。这些化合物均具有一定的水溶性和脂溶性,可以通过不同的提取方法得到,如水提取物、乙醇提取物、乙酸乙酯提取物等。这些提取物或纯化的化合物可以通过口服或注射给药,对体内外的肿瘤细胞产生抑制作用(表3)。
表3 茯苓三萜的药理活性
Table 3 Pharmacological activity of Poria cocos triterpenes
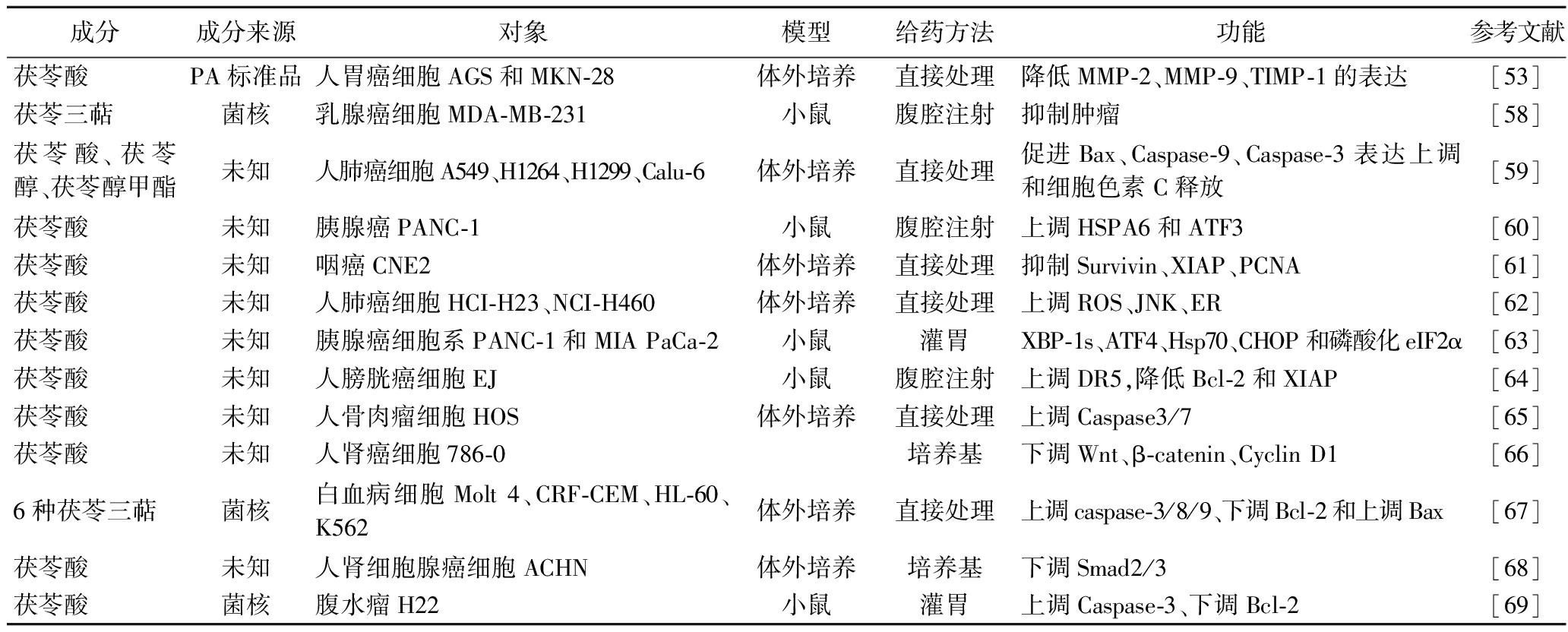
成分成分来源对象模型给药方法功能参考文献茯苓酸PA标准品人胃癌细胞AGS和MKN-28体外培养直接处理降低MMP-2、MMP-9、TIMP-1的表达[53]茯苓三萜菌核乳腺癌细胞MDA-MB-231小鼠腹腔注射抑制肿瘤[58]茯苓酸、茯苓醇、茯苓醇甲酯未知人肺癌细胞A549、H1264、H1299、Calu-6体外培养直接处理促进Bax、Caspase-9、Caspase-3表达上调和细胞色素C释放[59]茯苓酸未知胰腺癌PANC-1小鼠腹腔注射上调HSPA6和ATF3[60]茯苓酸未知咽癌CNE2体外培养直接处理抑制Survivin、XIAP、PCNA[61]茯苓酸未知人肺癌细胞HCI-H23、NCI-H460体外培养直接处理上调ROS、JNK、ER[62]茯苓酸未知胰腺癌细胞系PANC-1和MIA PaCa-2小鼠灌胃XBP-1s、ATF4、Hsp70、CHOP和磷酸化eIF2α[63]茯苓酸未知人膀胱癌细胞EJ小鼠腹腔注射上调DR5,降低Bcl-2和XIAP[64]茯苓酸未知人骨肉瘤细胞HOS体外培养直接处理上调Caspase3/7[65]茯苓酸未知人肾癌细胞786-0培养基下调Wnt、β-catenin、Cyclin D1[66]6种茯苓三萜菌核白血病细胞Molt 4、CRF-CEM、HL-60、K562体外培养直接处理上调caspase-3/8/9、下调Bcl-2和上调Bax[67]茯苓酸未知人肾细胞腺癌细胞ACHN体外培养培养基下调Smad2/3[68]茯苓酸菌核腹水瘤H22小鼠灌胃上调Caspase-3、下调Bcl-2[69]
PCT可以对多种肿瘤细胞产生细胞毒和诱导凋亡的作用,从而抑制肿瘤细胞的生长和存活。其也可以通过调节不同的信号通路和转录因子,影响肿瘤细胞的生存、增殖、周期和凋亡。CHOI等[48]从茯苓中提取出含有多种PCT的混合物,如茯苓酸、茯苓醇、茯苓四酮等。这些PCT混合物能够通过上调Bax、Caspase-3、Caspase-9和poly ADP-ribose polymerase(PARP)的表达,下调Bcl-2的表达,激活线粒体介导的凋亡途径抑制人肿瘤细胞的增殖,诱导其凋亡。CHENG等[49]从茯苓中分离出的3种PCT,茯苓酸、脱水茯苓酸和多孔酸C,具有较强的抗肿瘤活性,它们可以诱导肿瘤细胞周期在G0/G1期阻滞。除此之外,PCT能够通过抑制PI3K/Akt/mTOR信号通路以及JAK2/STAT3信号通路和PLA2/AA/PGE2/AKT信号通路,激活Apaf-1/Caspase-9/Caspase-3途径,促进肿瘤细胞的胞凋亡[50-52]。
PCT也可以抑制肿瘤细胞的迁移、侵袭,从而阻断肿瘤的扩散和转移。这些化合物可以通过下调基质MMP的表达,抑制肿瘤细胞附着在基质上并穿透基质的能力。WANG等[53]发现,PCT可以显著下调人胃癌细胞MKN-28和AGS细胞中的MMP-2、MMP-9和TIMP1的表达和活性,从而抑制肿瘤细胞附着在基质上并穿透基质的能力。CHENG等[49]发现,PCT可以显著下调MMP-7的表达水平,从而抑制肿瘤细胞附着在基质上并穿透基质的能力。CHEN等[54]从茯苓中分离得到了2种PCT,发现了这2个化合物对人肝癌细胞HepG2和人乳腺癌细胞MCF-7具有显著的抑制能力。PCT还可以通过靶向NF-κB信号通路,抑制MMP-9的表达,从而减少乳腺癌细胞的侵袭能力。
PCT也可以抑制肿瘤促进作用,从而阻断肿瘤发生过程中的某一个重要阶段。AKIHISA等[55-56]从茯苓中分离出了11种PCT,并测定了它们对人表皮角化细胞的增殖抑制活性和对12-O-四氢基四氮杂菲诱导的人白血病细胞(HL-60)分化抑制活性。作者发现这些化合物都具有一定的增殖抑制活性和分化抑制活性,其中由25-羟基或16-脱氧取代的三萜酸的活性最强。PCT能够抑制由四氢吡喃酮酸酯诱导的NF-κB的转录活性,减少四氢吡喃酶酸酯诱导的NF-κB信号通路上游信号分子IκB激酶的磷酸化,从而减少IκBα的降解,NF-κB亚基p65的核转位也相应减少,导致NF-κB的转录活性降低[57]。
3 展望
在过去的几十年里,茯苓作为一种重要的中药材,引起了越来越多的关注。
为了清楚地阐明其药理活性,研究者进行了许多研究。已证实其具有抗肿瘤、抗炎、抗氧化、免疫调节等多种生物活性,该文对PCP和PCT的抗肿瘤机制进行了总结(图1)。
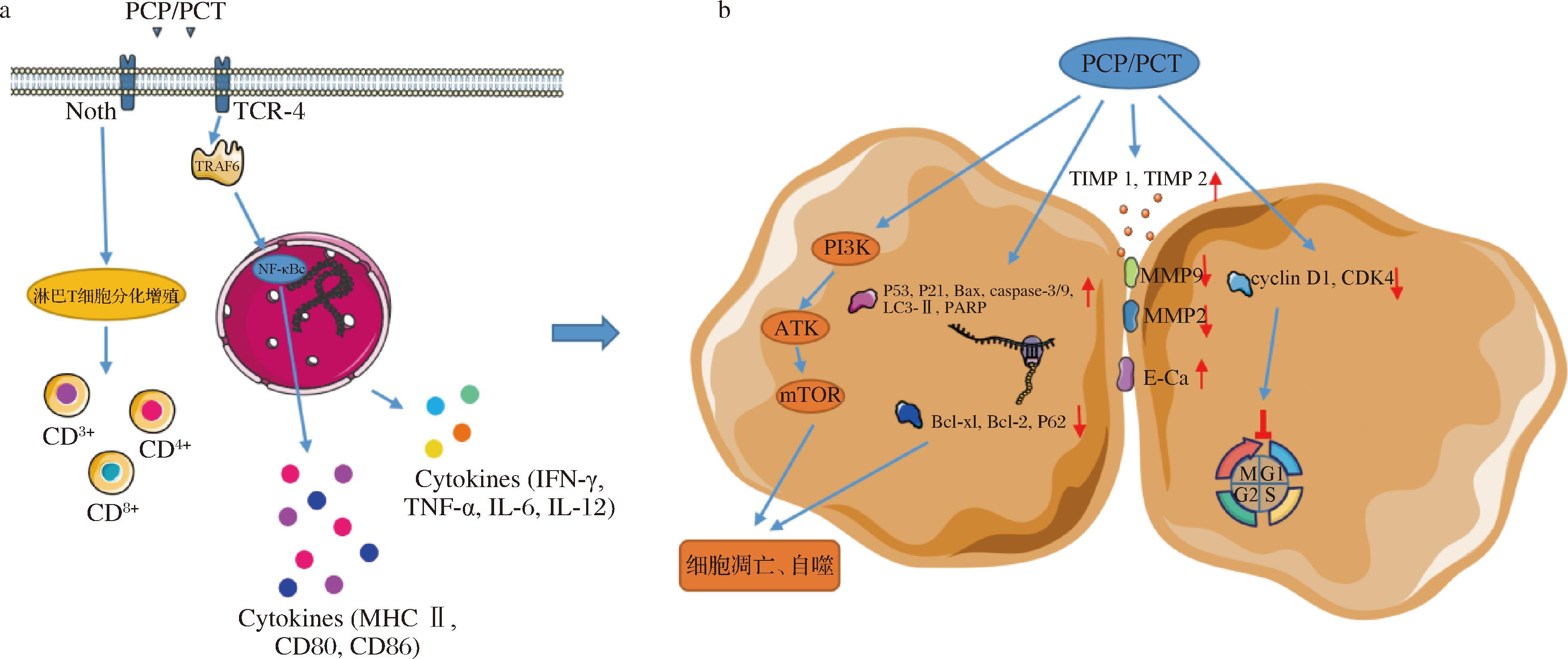
a-免疫细胞;b-肿瘤细胞
图1 茯苓多糖和三萜抗肿瘤作用机制
Fig.1 Mechanism of antitumor effects of Poria cocos polysaccharides and triterpenes
注:↑表示上调,↓表示抑制。
与茯苓活性产物的药理研究相比,茯苓液体发酵的研究相对较少、手段单一,大部分只使用响应面法或正交试验来优化茯苓的发酵工艺,培养基质方面也忽略了微量元素、生长因子、溶氧等因素对发酵的动力学、代谢、产物等产生的作用。并且这些研究大多只停留在了摇瓶阶段,没有考虑其他类型或规模的液体发酵设备,如搅拌罐、气升式反应器、流化床反应器等。在未来的研究中,发酵工艺的优化可采用更多的人工智能技术,如遗传算法或人工神经网络等,使得茯苓液体发酵产物具有稳定性和更高的可重复性。
目前对茯苓活性产物的抗肿瘤机制的研究不够深入和全面,有些只探讨了茯苓活性物质对肿瘤细胞的某一方面的作用,如抑制增殖、诱导凋亡、抑制迁移和侵袭等,没有考虑它们对肿瘤细胞的综合作用和相互作用。还有只考察了其对某一种或几种信号通路或转录因子的影响,未涉及对多种信号通路或转录因子的协同或拮抗作用。除此之外,在研究中也应该考虑茯苓活性物质对不同类型、来源、分化程度、耐药性等的肿瘤细胞或动物模型的差异和适应性。然而在茯苓活性产物的安全性和毒性方面也鲜见报道,虽然一些研究对它进行了初步的探究,但是并没有进行长期的、多剂量的、多指标的研究。在后续的研究中也应关注茯苓活性产物与其他药物或食物的相互作用,或者与机体自身的代谢和排泄的相互作用,可能导致茯苓活性产物的活性和稳定性的改变或丧失,或者引起不良反应或副作用。
总之,茯苓是一类具有广泛抗肿瘤活性和潜力的天然药物,它们可以通过多种途径和机制影响肿瘤细胞的生长、存活、迁移、侵袭、转移和血管生成等方面,从而达到抑制肿瘤的目的。然而,茯苓发酵产物的化学结构、纯度、活性、稳定性、安全性和毒性等方面还有许多问题需要进一步研究加以改进或创新。未来的科学研究应采用更加精密与先进的工具或技术,以细化并准确解析茯苓发酵产品的化学构成及其纯净度。同时,拓展研究范畴,纳入更多类型及来源的肿瘤细胞株或动物模型,用以全面评估其抗肿瘤效能,这将是关键一步。此外,深入探索茯苓发酵产物抑制肿瘤细胞的具体作用机理,借助更深层次及综合性的研究手段,对于揭示其抗癌机制至关重要。安全性与毒理学评估方面,则需实施更为周密且系统的策略,确保各方面都得到妥善考量。这些前瞻性的研究努力无疑将为茯苓发酵产物在临床实践中的应用奠定坚实基础,提供极具说服力与实用价值的科学依据。
[1] 王萌, 张毅, 李金田. 从《神农本草经》论茯苓在经方中的应用[J]. 中国中医基础医学杂志, 2017, 23(8):1149-1151.
WANG M, ZHANG Y, LI J T. Application rules of Poria in classical prescriptions analyzed based on Shennong Bencao Jing[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2017, 23(8):1149-1151.
[2] 李慧敏, 贺凯, 郑慧, 等. 中医药健脾的保健作用机制及药食资源[J]. 中草药, 2020, 51(3):780-787.
LI H M, HE K, ZHENG H, et al. Health-care mechanism and medicine and food resources of invigorating spleen in traditional Chinese medicine[J]. Chinese Traditional and Herbal Drugs, 2020, 51(3):780-787.
[3] 黄一农. 《红楼梦》中最珍贵的药方“暖香丸” 新探[J]. 中国科技史杂志, 2018, 39(1):1-10; 130.
HUANG Y N. The origins of the prized “Warm-fragrance Pill” (Nuanxiang Wan)in dream of the red chamber[J]. The Chinese Journal for the History of Science and Technology, 2018, 39(1):1-10; 130.
[4] 刘玉芳, 阳国彬. 《金匮要略》当归芍药散辨治疑难病验案举隅[J]. 山东中医杂志, 2023, 42(8):874-878.
LIU Y F, YANG G B. Case study on the differentiation and treatment for relapsed and refractory disease with Danggui Shaoyao Powder (当归芍药散) from synopsis of golden chamber [J]. Shandong Journal of Traditional Chinese Medicine, 2023, 42(8):874-878.
[5] HU J R, JUNG C J, KU S M, et al. Anti-inflammatory, expectorant, and antitussive properties of Kyeongok-go in ICR mice[J]. Pharmaceutical Biology, 2021, 59(1):321-334.
[6] 国家药典委员会. 中华人民共和国药典-四部: 2020年版[M]. 北京: 中国医药科技出版社, 2020.
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China, Volume IV: 2020 Edition[M]. Beijing: China Medical Science and Technology Press, 2020.
[7] WASSER S P. Current findings, future trends, and unsolved problems in studies of medicinal mushrooms[J]. Applied Microbiology and Biotechnology, 2011, 89(5):1323-1332.
[8] 孙宜孔. 汉至唐对茯苓的认识与使用[J]. 西安文理学院学报(社会科学版), 2017, 20(1):60-64.
SUN Y K. The understanding and using of Poria cocos from Han dynasty to Tang dynasty[J]. Journal of Xi’an University (Social Sciences Edition), 2017, 20(1):60-64.
[9] 徐雷, 刘常丽, 郭兰萍. 不同种植模式下茯苓土壤细菌多样性和功能预测分析[J]. 北方园艺, 2023(11):91-97.
XU L, LIU C L, GUO L P. Soil bacterial diversity and function prediction analysis of Poria cocos cultivating under different planting modes[J]. Northern Horticulture, 2023(11):91-97.
[10] ZHAO Y Y, FENG Y L, DU X, et al. Diuretic activity of the ethanol and aqueous extracts of the surface layer of Poria cocos in rat[J]. Journal of Ethnopharmacology, 2012, 144(3):775-778.
[11] 陈卫东, 彭慧, 王妍妍, 等. 茯苓药材的历史沿革与变迁[J]. 中草药, 2017, 48(23):5032-5038.
CHEN W D, PENG H, WANG Y Y, et al. Historical evolution and changes of Poria cocos[J]. Chinese Traditional and Herbal Drugs, 2017, 48(23):5032-5038.
[12] WANG D D, HUANG C G, ZHAO Y, et al. Comparative studies on polysaccharides, triterpenoids, and essential oil from fermented mycelia and cultivated Sclerotium of a medicinal and edible mushroom, Poria cocos[J]. Molecules, 2020, 25(6):1269.
[13] JIN J, ZHOU R R, XIE J, et al. Insights into triterpene acids in fermented mycelia of edible fungus Poria cocos by a comparative study[J]. Molecules, 2019, 24(7):1331.
[14] JIN Y, ZHANG L N, CHEN L, et al. Effect of culture media on the chemical and physical characteristics of polysaccharides isolated from Poria cocos mycelia[J]. Carbohydrate Research, 2003, 338(14):1507-1515.
[15] HAMZA ARMGHAN NOUSHAHI. 茯苓液体发酵条件优化及茯苓酸生物合成和菌丝生长相关基因表达研究[D]. 武汉: 华中农业大学, 2021.
HAMZA A. Optimization of liquid fermentation conditions of Poria cocos and study on biosynthesis of Poria acid and expression of genes related to mycelium growth[D].Wuhan: Huazhong Agricultural University, 2021.
[16] 张诗泉, 郭毓菲, 汪芷玥, 等. 茯苓液体发酵培养条件优化[J]. 食品工业, 2020, 41(4):135-138.
ZHANG S Q, GUO Y F, WANG Z Y, et al. Optimization of fermentation conditions for Poria cocos[J]. The Food Industry, 2020, 41(4):135-138.
[17] 张佩, 陈默, 胡国元. 胞内羧甲基茯苓多糖的发酵动力学[J]. 食品与发酵工业, 2020, 46(6):49-53.
ZHANG P, CHEN M, HU G Y. Study on fermentation kinetics of intracellular carboxymethylpachyman[J]. Food and Fermentation Industries, 2020, 46(6):49-53.
[18] 魏茹丹. 光温与植物油对茯苓液体发酵优化的研究[D]. 武汉: 华中农业大学, 2019.
WEI R D. Optimization of Temperature, Illumination and adding vegetable oil on Poria cocos liquid culture[D]. Wuhan: Huazhong Agricultural University, 2019.
[19] 周燕丽, 卢恒谦, 徐立伟, 等. 液态发酵茯苓菌丝体形态与产胞内三萜的关系[J]. 食品与生物技术学报, 2017, 36(6):635-641.
ZHOU Y L, LU H Q, XU L W, et al. Relationship between Mycelium morphology and intracellular triterpenoids production of Poria cocos in submerged culture[J]. Journal of Food Science and Biotechnology, 2017, 36(6):635-641.
[20] 陈林, 崔培梧, 鲁耀邦, 等. 茉莉酸甲酯对茯苓三萜生物合成的调控研究[J]. 湖南中医药大学学报, 2017, 37(6):606-610. CHEN L, CUI P W, LU Y B, et al. Study on regulation of triterpenoids biosynthesis in Wolfiporia cocos submerged fermentation system by methyl jasmonate[J]. Journal of Hunan University of Chinese Medicine, 2017, 37(6):606-610.
[21] 廖彦. 茯苓多糖的液态发酵及抗氧化研究[D]. 长沙: 湖南中医药大学, 2017.
LIAO Y. Study on liquid fermentation and antioxidation of Poria cocos polysaccharide[D]. Changsha: Hunan University of Chinese Medicine, 2017.
[22] 邹成梅, 王甜甜, 何思艳, 等. 响应面法优化茯苓多糖发酵培养基[J]. 中国酿造, 2018, 37(7):107-111.
ZOU C M, WANG T T, HE S Y, et al. Optimization of fermentation medium of polysaccharides from Poria cocos by response surface methodology[J]. China Brewing, 2018, 37(7):107-111.
[23] 高学玲, 杨素云, 严云梅, 等. 响应面法优化茯苓菌丝体总三萜的液态发酵工艺[J]. 食品与生物技术学报, 2012, 31(10):1112-1119.
GAO X L, YANG S Y, YAN Y M, et al. Optimical liquid fermentation conditions of total triterpenoids from Poria cocos mycelium by response surface methodology[J]. Journal of Food Science and Biotechnology, 2012, 31(10):1112-1119.
[24] TIAN H, LIU Z J, PU Y W, et al. Immunomodulatory effects exerted by Poria cocos polysaccharides via TLR4/TRAF6/NF-κB signaling in vitro and in vivo[J]. Biomedicine &Pharmacotherapy, 2019, 112:108709.
[25] DONG X X, LI B Y, YU B Y, et al. Poria cocos polysaccharide induced Th1-type immune responses to ovalbumin in mice[J]. PLoS One, 2021, 16(1): e0245207.
[26] HU X R, HONG B Z, SHAN X X, et al. The effect of Poria cocos polysaccharide PCP-1C on M1 macrophage polarization via the Notch signaling pathway[J]. Molecules, 2023, 28(5):2140.
[27] LI Y R, LIU S T, GAN Q, et al. Four polysaccharides isolated from Poria cocos mycelium and fermentation broth supernatant possess different activities on regulating immune response[J]. International Journal of Biological Macromolecules, 2023, 226:935-945.
[28] QIN L, HUANG D N, HUANG J, et al. Integrated analysis and finding reveal anti-liver cancer targets and mechanisms of pachyman (Poria cocos polysaccharides)[J]. Frontiers in Pharmacology, 2021, 12:742349.
[29] 汤建平, 杨吉成, 盛伟华, 等. 羧甲基茯苓多糖对人外周血淋巴细胞分泌IFN-α和IFN-γ的调节作用及中间体制备[J]. 中国生化药物杂志, 1998, 18(2):69-73.
TANG J P, YANG J C, SHENG W H, et al. Modelation of CMP on HPBL secretion of IFN-α and IFN-γ and preparation of their intermediates[J]. Chinese Journal of Biochemical Pharmaceutics, 1998, 18(2):69-73.
[30] KANAYAMA H, ADACHI N, TOGAMI M. A new antitumor polysaccharide from the mycelia of Poria cocos wolf[J]. Chemical &Pharmaceutical Bulletin, 1983, 31(3):1115-1118.
[31] JIANG H Y, DUANMU Z. Inhibitory effect of Poria cocos polysaccharides on proliferation, migration, and invasion of lung cancer cells, A549[J]. Current Topics in Nutraceutical Research, 2022, 20(1):147-152.
[32] CHU B F, LIN H C, HUANG X W, et al. An ethanol extract of Poria cocos inhibits the proliferation of non-small cell lung cancer A549 cells via the mitochondria-mediated caspase activation pathway[J]. Journal of Functional Foods, 2016, 23:614-627.
[33] ZHANG M, CHIU L C M, CHEUNG P C K, et al. Growth-inhibitory effects of a beta-glucan from the mycelium of Poria cocos on human breast carcinoma MCF-7 cells: Cell-cycle arrest and apoptosis induction[J]. Oncology Reports, 2006, 15(3):637-643.
[34] YANG J N, DONG X X, LI B Y, et al. Poria cocos polysaccharide-functionalized graphene oxide nanosheet induces efficient cancer immunotherapy in mice[J]. Frontiers in Bioengineering and Biotechnology, 2023, 10:1050077.
[35] YIN L, HUANG G X, KHAN I, et al. Poria cocos polysaccharides exert prebiotic function to attenuate the adverse effects and improve the therapeutic outcome of 5-FU in ApcMin/+ mice[J]. Chinese Medicine, 2022, 17(1):116.
[36] WANG C H, YANG S X, GAO L, et al. Carboxymethyl pachyman (CMP) reduces intestinal mucositis and regulates the intestinal microflora in 5-fluorouracil-treated CT26 tumour-bearing mice[J]. Food &Function, 2018, 9(5):2695-2704.
[37] LIU X F, WANG X Q, XU X F, et al. Purification, antitumor and anti-inflammation activities of an alkali-soluble and carboxymethyl polysaccharide CMP33 from Poria cocos[J]. International Journal of Biological Macromolecules, 2019, 127:39-47.
[38] CHEN Y Y, CHANG H M. Antiproliferative and differentiating effects of polysaccharide fraction from fu-Ling (Poria cocos) on human leukemic U937 and HL-60 cells[J]. Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association, 2004, 42(5):759-769.
[39] CHEN X Y, ZHANG L N, CHEUNG P C K. Immunopotentiation and anti-tumor activity of carboxymethylated-sulfated β-(1→3)-D-glucan from Poria cocos[J]. International Immunopharmacology, 2010, 10(4):398-405.
[40] HUANG Q L, ZHANG L N, CHEUNG P C K, et al. Evaluation of sulfated α-glucans from Poria cocos mycelia as potential antitumor agent[J]. Carbohydrate Polymers, 2006, 64(2):337-344.
[41] HUANG Q L, JIN Y, ZHANG L N, et al. Structure, molecular size and antitumor activities of polysaccharides from Poria cocos mycelia produced in fermenter[J]. Carbohydrate Polymers, 2007, 70(3):324-333.
[42] JIN Y, ZHANG L N, ZHANG M, et al. Antitumor activities of heteropolysaccharides of Poria cocos mycelia from different strains and culture media[J]. Carbohydrate Research, 2003, 338(14):1517-1521.
[43] BIAN C, XIE N N, CHEN F S. Preparation of bioactive water-soluble pachyman hydrolyzed from sclerotial polysaccharides of Poria cocos by hydrolase[J]. Polymer Journal, 2010, 42(3):256-260.
[44] 林丽霞, 薛银萍, 陈燕, 等. 茯苓多糖对人胃癌裸鼠移植瘤的抑制效应研究[J]. 解放军医药杂志, 2015, 27(11):60-63.
LIN L X, XUE Y P, CHEN Y, et al. Inhibitory effect of pachyman on human gastric cancer of xenografts in nude mice[J]. Medical &Pharmaceutical Journal of Chinese PLA, 2015, 27(11):60-63.
[45] 李琳琳. 茯苓多糖联合顺铂对Lewis肺腺癌移植瘤的抑瘤作用及VEGF、p-STAT3、CD31表达的影响[D]. 张家口: 河北北方学院, 2021.
LI L L. Inhibitory effect of Poria polysaccharide combined with cisplatin on transplanted Lewis lung adenocarcinoma and the expression of VEGF, p-STAT3 and CD31[D]. Zhangjiakou: Hebei North University, 2021.
[46] 闫霜, 王雅莉. 茯苓多糖影响卵巢癌细胞耐药性的机制[J]. 西北药学杂志, 2022, 37(3):94-100.
YAN S, WANG Y L. Study on the effect and mechanism of Poria cocos polysaccharides on drug resistance in ovarian cancer cells[J]. Northwest Pharmaceutical Journal, 2022, 37(3):94-100.
[47] 唐恩红, 蔡旺. 茯苓多糖对人宫颈癌HeLa细胞增殖、迁移、促凋亡的影响及其机制[J]. 肿瘤防治研究, 2019, 46(8):707-713.
TANG E H, CAI W. Effects of pachymaran on proliferation, migration and pro-apoptosis of human cervical carcinoma HeLa cells and its mechanism[J]. Cancer Research on Prevention and Treatment, 2019, 46(8):707-713.
[48] CHOI Y H. Induction of apoptosis by an ethanol extract of Poria cocos Wolf. in human leukemia U937 cells[J]. Oncology Reports, 2015, 34(5):2533-2540.
[49] CHENG S J, ELIAZ I, LIN J F, et al. Triterpenes from Poria cocos suppress growth and invasiveness of pancreatic cancer cells through the downregulation of MMP-7[J]. International Journal of Oncology, 2013, 42(6):1869-1874.
[50] ZHANG Y H, ZHANG Y, LI X Y, et al. Antitumor activity of the pachymic acid in nasopharyngeal carcinoma cells[J]. Ultrastructural Pathology, 2017, 41(3):245-251.
[51] GAPTER L, WANG Z S, GLINSKI J, et al. Induction of apoptosis in prostate cancer cells by pachymic acid from Poria cocos[J]. Biochemical and Biophysical Research Communications, 2005, 332(4):1153-1161.
[52] SUN K X, XIA H W. Pachymic acid inhibits growth and induces cell cycle arrest and apoptosis in gastric cancer SGC-7901 cells[J]. Oncology Letters, 2018, 16(2):2517-2524.
[53] WANG H B, LUO Y Y, CHU Z W, et al. Poria acid, triterpenoids extracted from Poria cocos, inhibits the invasion and metastasis of gastric cancer cells[J]. Molecules, 2022, 27(11):3629.
[54] CHEN T, HUA L, CHOU G X, et al. A unique naphthone derivative and a rare 4, 5-seco-lanostane triterpenoid from Poria cocos[J]. Molecules, 2018, 23(10):2508.
[55] AKIHISA T, NAKAMURA Y, TOKUDA H, et al. Triterpene acids from Poria cocos and their anti-tumor-promoting effects[J]. Journal of Natural Products, 2007, 70(6):948-953.
[56] AKIHISA T, UCHIYAMA E, KIKUCHI T, et al. Anti-tumor-promoting effects of 25-methoxyporicoic acid A and other triterpene acids from Poria cocos[J]. Journal of Natural Products, 2009, 72(10):1786-1792.
[57] LING H, ZHANG Y C, NG K Y, et al. Pachymic acid impairs breast cancer cell invasion by suppressing nuclear factor-κB-dependent matrix metalloproteinase-9 expression[J]. Breast Cancer Research and Treatment, 2011, 126(3):609-620.
[58] JIANG Y, FAN L P. Evaluation of anticancer activities of Poria cocos ethanol extract in breast cancer: in vivo and in vitro, identification and mechanism[J]. Journal of Ethnopharmacology, 2020, 257:112851.
[59] LEE S, LEE S, ROH H S, et al. Cytotoxic constituents from the Sclerotia of Poria cocos against human lung adenocarcinoma cells by inducing mitochondrial apoptosis[J]. Cells, 2018, 7(9):116.
[60] 李锐, 谭晓冬, 胡耀元. 茯苓酸对人胰腺癌PANC-1细胞迁移、侵袭和上皮间质转化的抑制作用[J]. 吉林大学学报(医学版), 2023, 49(2):315-323.
LI R, TAN X D, HU Y Y. Inhibitory effect of pachylic acid on migration, invasion, and epithelial-mesenchymal transition of human pancreatic cancer PANC-1 cells[J]. Journal of Jilin University (Medicine Edition), 2023, 49(2):315-323.
[61] 刘洁, 胡晶, 戴娜, 等. 益气解毒方主要三萜类化合物抑制鼻咽癌CNE2细胞增殖效应的比较[J]. 湖南中医药大学学报, 2019, 39(11):1315-1320.
LIU J, HU J, DAI N, et al. Comparison of inhibitory effects of main triterpenoids of Yiqi Jiedu formula on proliferation of nasopharyngeal carcinoma CNE2 cells[J]. Journal of Hunan University of Chinese Medicine, 2019, 39(11):1315-1320.
[62] MA J, LIU J, LU C W, et al. Pachymic acid induces apoptosis via activating ROS-dependent JNK and ER stress pathways in lung cancer cells[J]. Cancer Cell International, 2015, 15:78.
[63] CHENG S J, SWANSON K, ELIAZ I, et al. Pachymic acid inhibits growth and induces apoptosis of pancreatic cancer in vitro and in vivo by targeting ER stress[J]. PLoS One, 2015, 10(4): e0122270.
[64] JEONG J W, LEE W S, GO S I, et al. Pachymic acid induces apoptosis of EJ bladder cancer cells by DR5 up-regulation, ROS generation, modulation of bcl-2 and IAP family members[J]. Phytotherapy Research: PTR, 2015, 29(10):1516-1524.
[65] WEN H L, WU Z, HU H D, et al. The anti-tumor effect of pachymic acid on osteosarcoma cells by inducing PTEN and Caspase 3/7-dependent apoptosis[J]. Journal of Natural Medicines, 2018, 72(1):57-63.
[66] 董建设, 赵俊峰, 张林超, 等. 茯苓酸通过Wnt信号通路对肾癌细胞生物学特性的影响[J]. 中国老年学杂志, 2019, 39(9):2241-2244.
DONG J S, ZHAO J F, ZHANG L C, et al. Effect of pachymic acid on biological characteristics of renal cell carcinoma through Wnt signaling pathway[J]. Chinese Journal of Gerontology, 2019, 39(9):2241-2244.
[67] LAI K H, LU M C, DU Y C, et al. Cytotoxic lanostanoids from Poria cocos[J]. Journal of Natural Products, 2016, 79(11):2805-2813.
[68] 罗园园, 冯心怡, 褚泽文, 等. 茯苓酸通过Smads调控MMP/TIMP平衡抑制肾癌细胞侵袭转移的机制[J]. 中国实验方剂学杂志, 2023, 29(7):76-83.
LUO Y Y, FENG X Y, CHU Z W, et al. Mechanism of pachymic acid in inhibiting invasion and metastasis of renal carcinoma cells via regulating MMP/TIMP balance by smads[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2023, 29(7):76-83.
[69] 代君怡, 朱瑶, 尹灿, 等. 茯苓有效部位对H22腹水瘤小鼠肿瘤抑制作用的研究[J]. 时珍国医国药, 2022, 33(6):1288-1291.
DAI J Y, ZHU Y, YIN C, et al. Study on tumor inhibition effect of effective part of Poria cocos on mice with H22 ascites tumor[J]. Lishizhen Medicine and Materia Medica Research, 2022, 33(6):1288-1291.