近年来,流行病学的发展和实验研究表明,氧化应激是引起多项疾病如心脏病、癌症、糖尿病和阿尔茨海默症等疾病的关键因素之一。细胞在代谢过程中会产生大量自由基,而自由基的过量积累会对脂质、DNA和蛋白质等生物大分子造成氧化损伤[1]。研究表明谷物饮食在预防这些疾病方面起着重要的作用,谷物中含有大量的生物活性物质。苦荞中含有D-手性肌醇,可以抑制棕榈酸诱导的HepG2细胞的氧化应激[2];黑米中含有多酚类物质如花青素和黄酮类物质,对DPPH自由基和羟自由基具有良好的清除效果[3]。
尽管谷物和豆类富含生物活性成分,但由于其质地比较坚实,在食用之前一般要经过浸泡处理才更方便人们食用。而高温空气流化工艺(high-temperature air fluidization,HTAF)已被开发用于改善某些全谷物和豆类的烹饪品质和可消化性[4-5]。在以前的研究中,发芽糙米在经过HTAF处理后淀粉的晶体结构发生变化,发芽糙米的血糖生成指数值也降低[5]。然而,HTAF工艺对谷物和豆类中多酚和肌醇生物活性物质的含量以及抗氧化活性的影响尚未得到充分的研究。
在课题组前期的研究中,已经对多种谷物和豆类进行了HTAF工艺研究。通过对谷物和豆类硬度和蒸煮品质的感官评定,开发出了一种包含苦荞、黑米、血糯米、燕麦胚芽米、绿豆和白米的多谷物配方米(multi-grains formula,MGF)。为了研究HTAF处理对谷物抗氧化活性物质的影响,本文提取了MGF中多酚和肌醇物质,探究了MGF多酚和肌醇提取物在体外的抗氧化活性。用未经过HTAF处理的MGF(RMGF)和日常作为主食食用的白米(WR)作为对照,研究HTAF处理后的MGF(HFMGF)的抗氧化活性变化情况。同时,为了使MGF更加贴合进食时的情况,将HFMGF、RMGF和白米分别进行了蒸煮,得到了C-HFMGF、C-RMGF和C-WR,未经过蒸煮的样品分别记为U-HFMGF、U-RMGF和U-WR。利用多种体外模型探讨其抗氧化活性,丰富了谷物中多酚和肌醇类营养因子在抗氧化方面的内容。
1 材料与方法
1.1 材料与试剂
可口美膳食品(无锡)有限公司提供经HTAF处理前后的MGF产品,包括苦荞、黑米、血糯米、燕麦胚芽米、绿豆和白米。乙醇(分析纯)、过硫酸钾、硫酸亚铁、过氧化氢、氯化铁、铁氰化钾、三氯乙酸、碳酸钠(Na2CO3)、六水合氯化铝(AlCl3·6H2O)、亚硝酸钠,上海国药集团化学试剂有限公司。ABTS、DPPH、水杨酸、Folin-Ciocalteu试剂、没食子酸、芦丁,上海阿拉丁试剂有限公司;甲醇(色谱纯)、乙腈(色谱纯),美国TEDIA公司产品。
1.2 仪器与设备
多功能研磨机,杭州妙康科技有限公司;高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;R-20旋转蒸发仪,瑞士步琦有限公司;Cytation5多功能酶标仪,美国Bio Tek公司;DK-320恒温水浴锅、水浴摇床,上海精宏实验室设备有限公司;Agilent 1260液相色谱仪,美国安捷伦公司。
1.3 实验方法
1.3.1 多谷物配方米中多酚和肌醇提取物的制备
将MGF研磨并通过80目筛,-20 ℃贮存。将10 g样品与200 mL 50%乙醇混合,并在37 ℃水浴摇床中水浴2 h。混合物以2 811 ×g离心30 min。收集上清液,再次提取沉淀物。将合并的上清液浓缩并旋转蒸发干燥以获得固体提取物,然后将固体提取物溶解在去离子水中,离心后去除不溶物后取上清液得到多酚和肌醇提取液,并贮存在-20 ℃。
1.3.2 提取液中多酚和肌醇含量的测定
多酚和肌醇提取液中总多酚含量和总黄酮含量的检测采用比色法[6]。对于总多酚,将25 μL提取液与25 μL Folin-Ciocalteu溶液混合,在黑暗中静置5 min。加入100 μL蒸馏水和25 μL 2 mol/L Na2CO3溶液混合,黑暗中反应30 min。在760 nm处测量吸光度。总多酚含量用每克MGF或白米干重的没食子酸当量(gallic acid equivalent,GAE)表示(mg GAE/g干重)。对于总黄酮,将500 μL提取液加入150 μL 0.8 mol/L亚硝酸钠中,反应5 min。加入150 μL 0.4 mol/L AlCl3·6H2O混合反应5 min。随后立即加入1 mL 1 mol/L NaOH混合反应10 min,在510 nm处测量吸光度。不同提取液中的总黄酮含量用每克MGF或白米干重的芦丁当量(rutin equivalent,RE)表示(mg RE/g DW)。
肌醇的检测参考了CHENG等[2]的方法。通过苯甲酰氯柱前衍生化让肌醇分子带有特定的紫外吸收官能团。首先,将40 μL苯甲酰氯和200 μL 7 mol/L NaOH加入100 μL 提取液中,然后在25 ℃下涡旋反应10 min。加入6 mol/L磷酸溶液以停止衍生化。之后,加入400 μL乙酸乙酯,并在10 625×g下离心5 min以提取衍生化产物。将上清液通过0.22 μm微孔过滤器,并在C18柱(250 mm×4.6 mm,5 μm)上进行高效液相色谱分析,以检测提取物中肌-肌醇和D-手性肌醇的含量。
1.3.3 多酚和肌醇提取物体外抗氧化活性测定
1.3.3.1 ABTS阳离子自由基清除能力测定[7]
取20 μL不同浓度的提取液与200 μL ABTS稀释液混合,振荡摇匀,6 min后测定其在波长734 nm下的吸光度值,按公式(1)计算清除率。再根据不同浓度下的清除率计算IC50值,用于表示提取液对ABTS阳离子自由基的清除能力,IC50值用MGF多酚和肌醇固体提取物的质量浓度表示。维生素C标准品作为阳性对照。
ABTS阳离子自由基清除率![]()
(1)
式中:A1为20 μL样品溶液与200 μL ABTS稀释液混合反应后的吸光度值;A0为20 μL去离子水与200 μL ABTS稀释液混合后的吸光度值。
1.3.3.2 DPPH自由基清除能力测定[7]
取100 μL 0.26 mmol/L DPPH乙醇溶液与20 μL不同浓度的提取液于96孔板中混合,避光反应30 min后,在波长517 nm下测定吸光度值,按公式(2)计算清除率。并用IC50值表示提取液对DPPH自由基的清除能力,维生素C标准品作为阳性对照。
DPPH自由基清除率![]()
(2)
式中:A1为20 μL样品溶液与100 μL DPPH溶液混合反应后的吸光度值;A0为20 μL去离子水与100 μL DPPH混合溶液的吸光度值。
1.3.3.3 羟自由基清除能力测定[8]
取不同浓度的提取液50 μL,依次加入9 mmol/L FeSO4 溶液50 μL、9 mmol/L水杨酸-乙醇溶液50 μL、8.8 mmol/L H2O2 50 μL于混合液反应体系中,在37 ℃下反应0.5 h,之后在510 nm测定反应液的吸光度值B1。用去离子水替代提取液测定吸光度值B2,将反应体系中的H2O2替换为去离子水测定吸光值B3,按公式(3)计算清除率。并用IC50值表示提取液对羟自由基的清除能力,维生素C标准品作为阳性对照。
羟自由基清除率![]()
(3)
式中:B1为50 μL提取液与反应混合溶液的吸光度值;B2为50 μL去离子水与反应混合溶液的吸光度值;B3为50 μL提取液与不含H2O2的反应混合溶液的吸光度值。
1.3.3.4 总还原能力测定[9]
取100 μL不同浓度的提取液,用250 μL 0.2 mol/L PBS(pH 6.6)稀释后,加入250 μL 10 g/L的铁氰化钾溶液混匀,于50 ℃反应20 min,再加入250 μL 0.6 mol/L三氯乙酸溶液。取250 μL上清液与250 μL去离子水混匀,加入50 μL 1 g/L的氯化铁并涡旋,在700 nm处测定反应混合物的吸光度值,按公式(4)计算提取液的总还原能力。根据不同浓度维生素C标品的总还原能力绘制标准曲线,最终提取液的总还原能力用维生素C当量浓度表示。
总还原能力![]()
(4)
式中:B1为100 μL提取液与反应混合溶液的吸光度值;B0为100 μL去离子水与反应混合溶液的吸光度值。
1.3.3.5 Fe2+螯合能力测定[10]
取1 mL提取液与1 mL 0.2 mol/L PBS(pH 7.0)混合于试管中,加入1 mL 2.5 mmol/mL FeSO4·7H2O进行螯合反应,振荡10 min后加入1 mL 1.3 mg/mL菲啰嗪溶液终止反应。振荡1 min后取少量反应液于96孔板中在560 nm波长下检测其吸光度值,反映混合液中游离亚铁离子含量,再按公式(5)计算Fe2+螯合能力:
Fe2+螯合能力![]()
(5)
式中:M1为1 mL提取液与1 mL菲啰嗪反应后的吸光度值;M2为用1 mL去离子水代替提取液与1 mL菲啰嗪反应后(空白反应体系)的吸光度值;M3为1 mL提取液与用1 mL去离子水代替菲啰嗪反应后的吸光度值;2.5 mmol为空白反应体系中Fe2+的物质的量。
1.4 数据处理与分析
用Graph Pad Prism 8.0.2(美国)画图,通过双因素方差分析(two-way ANOVA)对所有数据进行显著性分析。用字母标注时,不同字母表示有显著性差异(P<0.01),存在一个相同字母时表示有显著性差异(P<0.05),相同字母表示无显著差异(P>0.05)。用Origin 2021(美国)对数据相关性进行分析,所有实验重复3次进行,结果以平均值±标准误差显示。
2 结果与分析
2.1 MGF提取液中的多酚和肌醇含量分析
不同提取液中多酚和肌醇物质含量如表1所示。HTAF处理前后MGF中的总多酚和总黄酮含量没有显著变化(P>0.05),表明HTAF处理是温和的,没有破坏多酚和黄酮类物质的结构。蒸煮后的MGF中的总多酚含量(4.14~4.17 mg GAE/g DW)略低于未蒸煮的MGF(4.75~4.76 mg GAE/g DW)(P<0.05),对于黄酮类物质,蒸煮后的MGF中的含量(3.81~3.83 mg RE/g DW)略高于未煮熟的MGF(3.51~3.61 mg RE/g DW)(P<0.05)。导致这种变化的原因可能是蒸煮过程中多酚物质发生了氧化、热分解和自聚合反应,研究报道过短时的高温会对不同的谷物中的多酚物质有着不同的影响,对黑米蒸煮后多酚物质含量增加了17.11%,而对糙米进行蒸煮后,糙米中的多酚物质降低了约24.29%[11]。蒸煮过程中会破坏谷物外部的结构,促进结合态酚类物质向游离态酚类物质转变,但高温过程又不可避免地导致酚类物质的热分解或一定程度的聚合。所以蒸煮后MGF中多酚和黄酮的含量变化是多种因素导致的结果。
表1 MGF中多酚和肌醇含量
Table 1 polyphenols and inositol content in MGF

样品总多酚/(mg GAE/g DW)总黄酮/(mg RE/g DW)肌-肌醇/(mg/g DW)D-手性肌醇/(mg/g DW)U-RMGF4.79±0.11a3.51±0.07ab0.32±0.09a0.33±0.08aU-HFMGF4.75±0.29a3.61±0.07ab0.28±0.01a0.32±0.01aU-WR0.55±0.03c0.30±0.02cNDNDC-RMGF4.14±0.11ab3.81±0.07a0.34±0.01a0.54±0.07aC-HFMGF4.17±0.22ab3.83±0.12a0.42±0.11a0.53±0.03aC-WR0.52±0.06c0.19±0.03cNDND
注:U-RMGF:未经过蒸煮和HTAF处理的MGF;U-HFMGF:未经过蒸煮但经过HTAF处理的MGF;U-WR:未经过蒸煮的白米;C-RMGF:经过蒸煮但未经过HTAF处理的MGF;C-HFMGF:经过蒸煮和HTAF处理的MGF;U-WR:经过蒸煮的白米。不同字母表示有显著性差异(P<0.01),存在一个相同字母时表示有显著性差异(P<0.05),相同字母表示无显著差异(P>0.05)(下同)。ND:表示在检测限以下,没有检测到该物质。
谷物中含量最丰富的肌醇是肌-肌醇和D-手性肌醇。因此,通过高效液相色谱法测定了MGF中肌-肌醇和D-手性肌醇含量。MGF经HTAF工艺处理或蒸煮后,肌-肌醇和D-手性肌醇的含量没有表现出显著差异。肌-肌醇的含量为0.28~0.42 mg/g DW,D-手性肌醇的含量为0.32~0.54 mg/g DW,这可能是由于绿豆和苦荞分别是肌-肌醇和D-手性肌醇的丰富来源[12]。
2.2 MGF多酚和肌醇提取物清除ABTS阳离子自由基能力
对ABTS阳离子自由基的清除能力见图1。不同前处理过程的MGF多酚和肌醇提取液对ABTS阳离子自由基的清除作用都随着浓度的增加而逐渐增强,但维生素C对ABTS阳离子自由基的清除作用要显著优于MGF提取液。在质量浓度为2.5 mg/mL时,蒸煮后的样品C-HFMGF和C-RMGF多酚和肌醇提取液对ABTS阳离子自由基的清除率最大,分别为92.28%和92.03%,要显著高于未蒸煮样品U-HFMGF和U-RMGF对ABTS阳离子自由基的清除率(P<0.01),分别为83.25%和80.53%,这可能与蒸煮后黄酮和肌醇物质的增加有关。通过非线性拟合可以得到每种提取物的IC50值,C-RMGF、C-HFMGF、U-HFMGF和U-RMGF的IC50分为0.58、0.64、0.65、0.75 mg/mL。与这些MGF相比,蒸煮前后白米均表现出很低的ABTS阳离子自由基清除率。
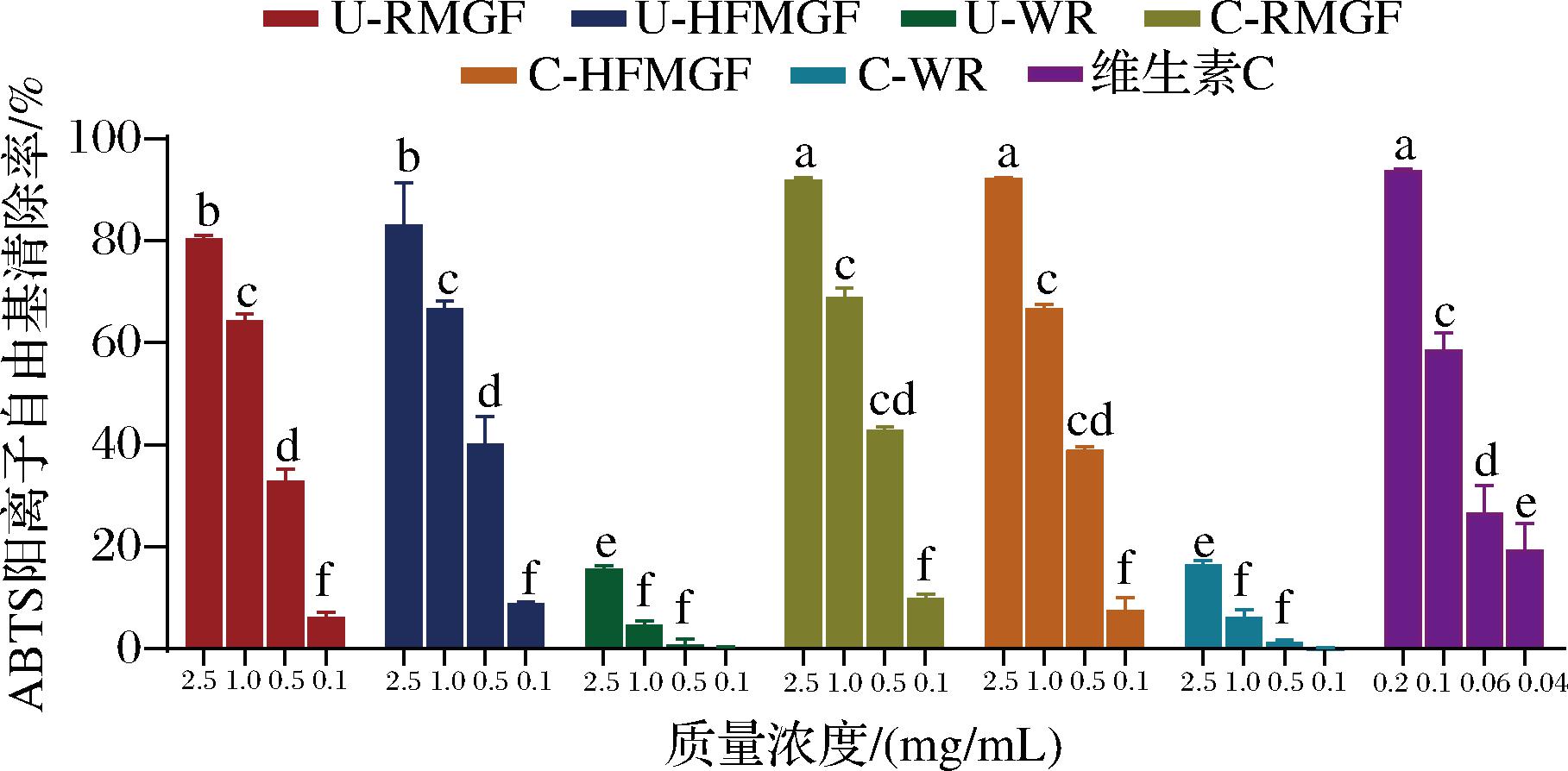
图1 ABTS阳离子自由基清除能力
Fig.1 ABTS cationic free radicals scavenging activity
注:不同字母表示有显著性差异(P<0.01),存在一个相同字母时表示 有显著性差异(P<0.05),相同字母表示无显著差异(P>0.05)(下同)。
2.3 MGF多酚和肌醇提取物清除DPPH自由基能力
DPPH自由基的清除能力见图2。当MGF多酚和肌醇提取液质量浓度在0.1~5.0 mg/mL时,DPPH自由基的清除率呈浓度依赖型增加,维生素C的清除作用要显著优于MGF提取液。在质量浓度为2.5~5.0 mg/mL时,4种MGF多酚和肌醇提取液对DPPH自由基的清除率都为65%~75%,没有显著性差异(P>0.05)。通过非线性拟合得到每种提取物的IC50值,C-HFMGF和U-HFMGF的IC50值分别为1.09、1.13 mg/mL,要低于未经过HTAF处理过的C-RMGF和U-RMGF,IC50值分别为1.17、1.42 mg/mL。表明经过HTAF处理的MGF蒸煮后表现出较优的DPPH自由基清除能力,与ABTS阳离子自由基清除结果一致。袁佐云等[13]对全麦粉蒸煮后发现黄酮物质增加,并在蒸煮时产生了具有抗氧化活性的美拉德反应产物,ABTS阳离子自由基和DPPH自由基清除率大幅增加,与本实验所得结果相一致。白米提取液对DPPH自由基的最高清除率仅为21.21%,远低于MGF多酚和肌醇提取液。
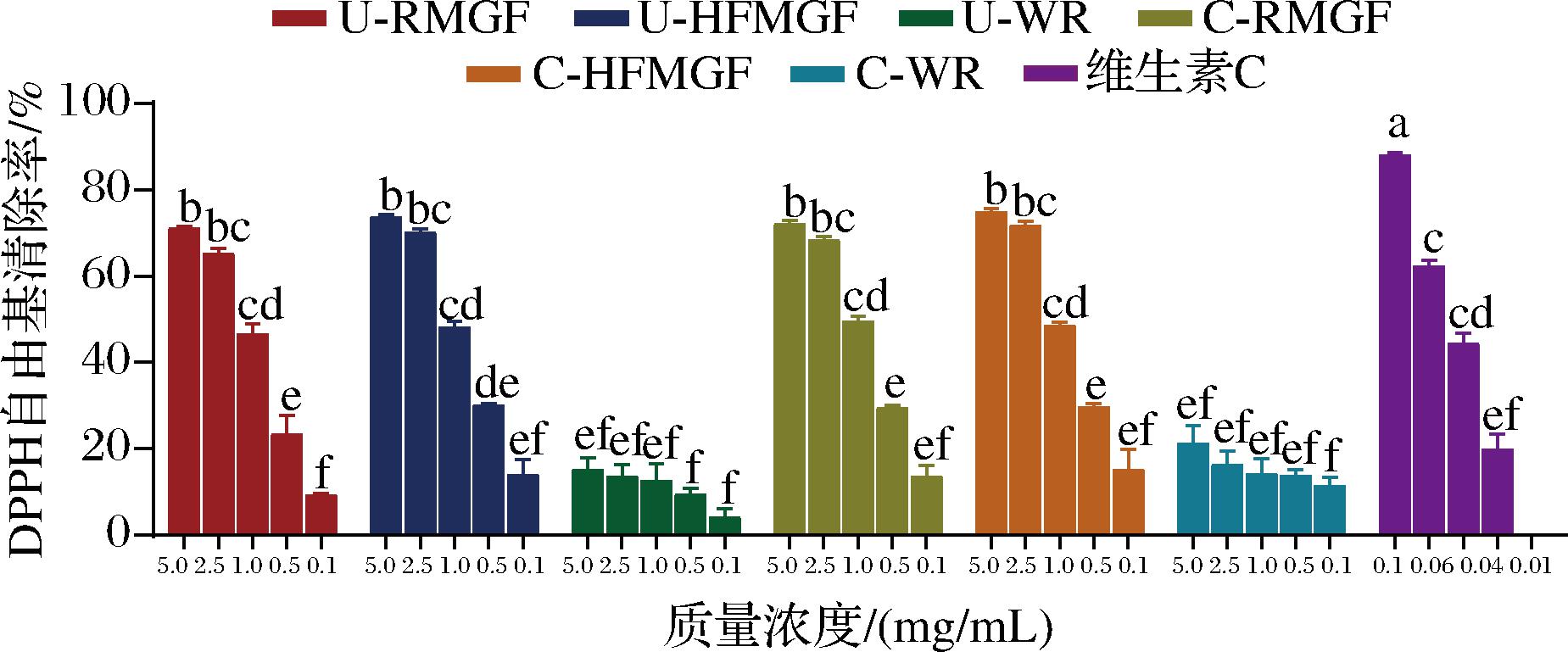
图2 DPPH自由基清除能力
Fig.2 DPPH free radicals scavenging activity
2.4 MGF多酚和肌醇提取物清除羟自由基能力
羟自由基的清除能力见图3,提取液对羟自由基的清除作用要低于维生素C。在质量浓度为1~15 mg/mL时,4种MGF提取液对羟自由基的清除率随着浓度的增加而提高,最高可达87.21%,为C-HFMGF,但4种提取物没有表现出显著性差异(P>0.05)。通过非线性拟合可以得到每种提取物的IC50值,C-HFMGF、C-RMGF、U-HFMGF和U-RMGF的IC50值分别为5.47、5.25、5.24、4.78 mg/mL,这表明未经过HTAF处理的和未煮熟的MGF表现出略高的羟自由基清除能力。HTAF处理工艺和蒸煮在一定程度上减少了MGF中的多酚类物质含量,可能会使羟自由基清除率降低,这与CHANDRASEKARA等[14]的研究结果一致,他们对7种小米进行30 min蒸煮后,总酚含量下降3%~36%,相应的羟自由基清除率下降了10%~65%。白米蒸煮前后多酚和肌醇提取物对羟自由基的清除率均显著低于MGF(P<0.01),U-WR和C-WR表现出的最大羟自由基清除率仅分别为26.44%和35.38%。
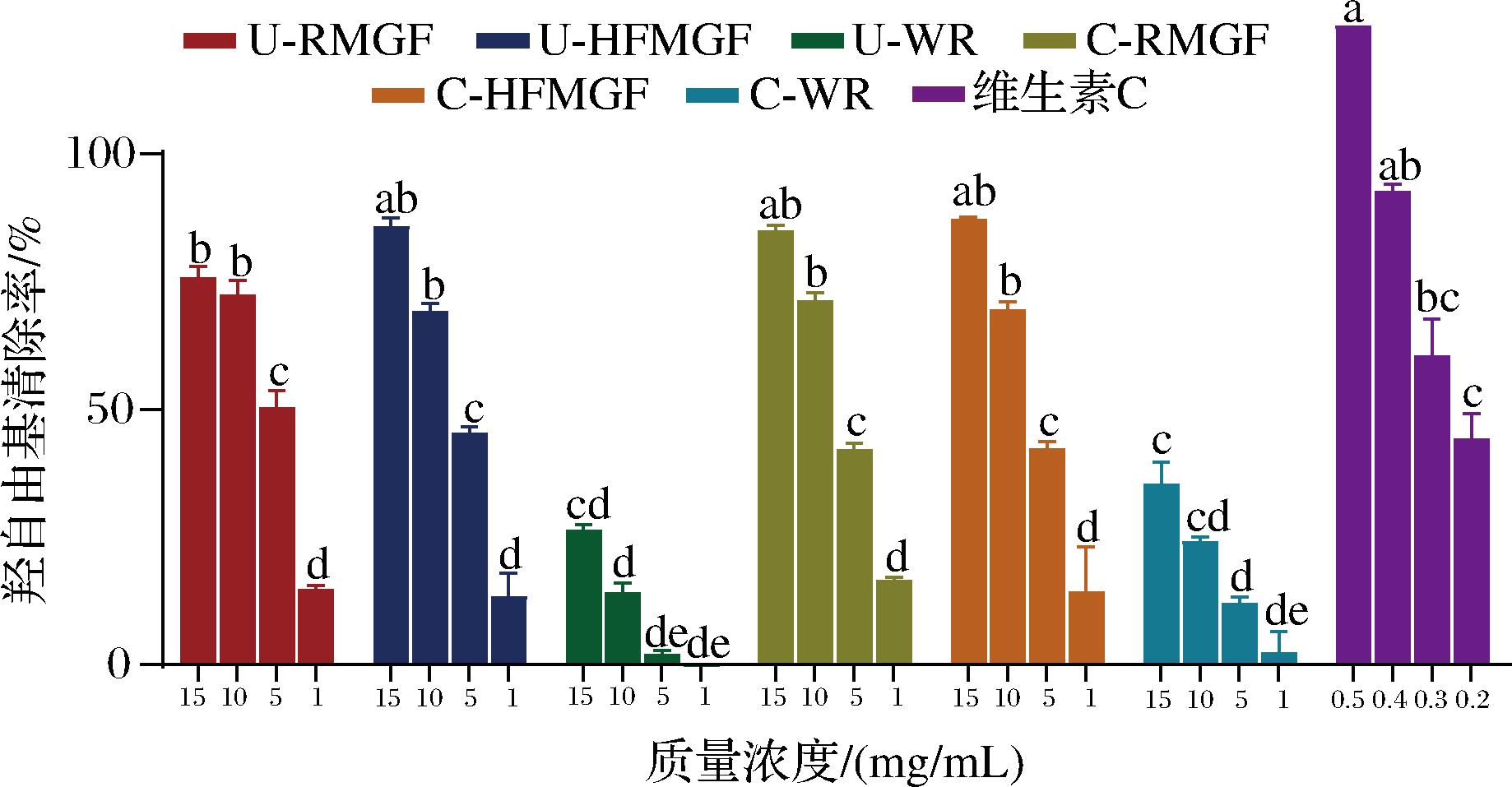
图3 羟自由基清除能力
Fig.3 Hydroxyl radical scavenging activity
2.5 MGF多酚和肌醇提取物总还原能力
总还原能力见图4。用维生素C作为阳性对照,提取液的总还原能力用维生素C当量浓度表示。当MGF多酚和肌醇提取液质量浓度为5~20 mg/mL时,还原能力呈浓度依赖型增加。当提取液质量浓度为15~20 mg/mL时,C-HFMGF肌醇和多酚提取液表现出的还原能力最强,维生素C当量浓度分别为1.26 mg/mL,显著高于其他3种MGF提取液的还原能力(P<0.05)。当提取液质量浓度为5~10 mg/mL时,4种MGF提取液的还原能力没有显著差异(P>0.05)。而白米蒸煮前后肌醇和多酚提取物显著低于MGF提取液的总还原能力(P<0.01),维生素C当量浓度最大仅为0.09 mg/mL。
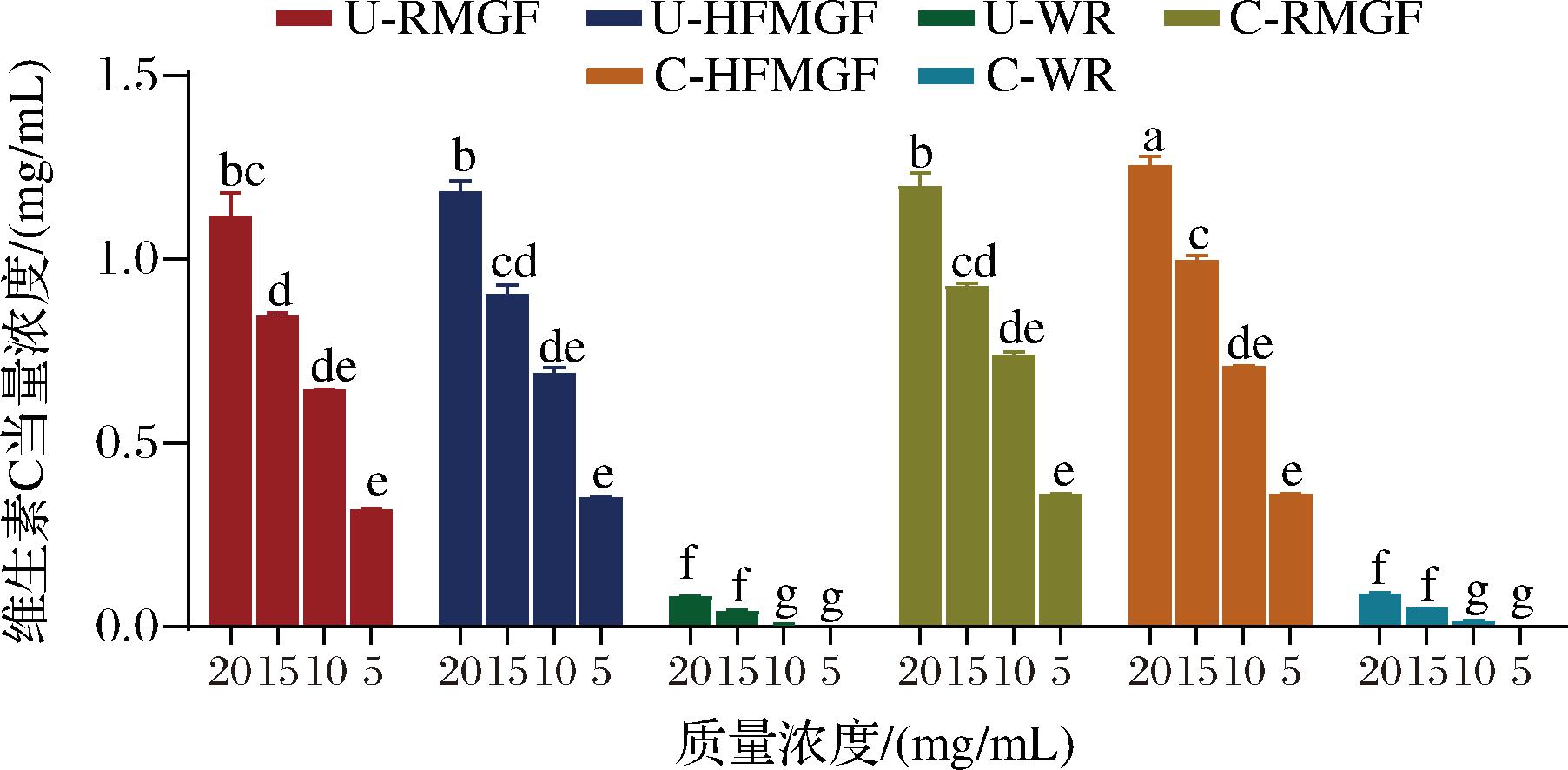
图4 总还原能力
Fig.4 Total reducing power capacity
2.6 MGF多酚和肌醇提取物Fe2+螯合能力
Fe2+螯合能力见图5。当提取液质量浓度为20 mg/mL时,4种MGF提取液的Fe2+螯合能力显著低于质量浓度为10、15 mg/mL的提取液(P<0.05),这可能是因为高质量浓度的提取液中还含有一些多糖类可溶性物质,这些物质对Fe2+螯合能力产生影响[15]。当提取液质量浓度为5~15 mg/mL时,C-HFMGF和C-RMGF对Fe2+螯合能力分别为1.67~1.85 mmol和1.63~1.77 mmol,但两者没有表现出显著性差异(P>0.05)。对于未蒸煮MGF,U-HFMGF对Fe2+螯合能力要显著高于U-RMGF(P<0.05)。MGF提取液的Fe2+螯合能力与总还原能力效应相似,都显著高于白米(P<0.05)。
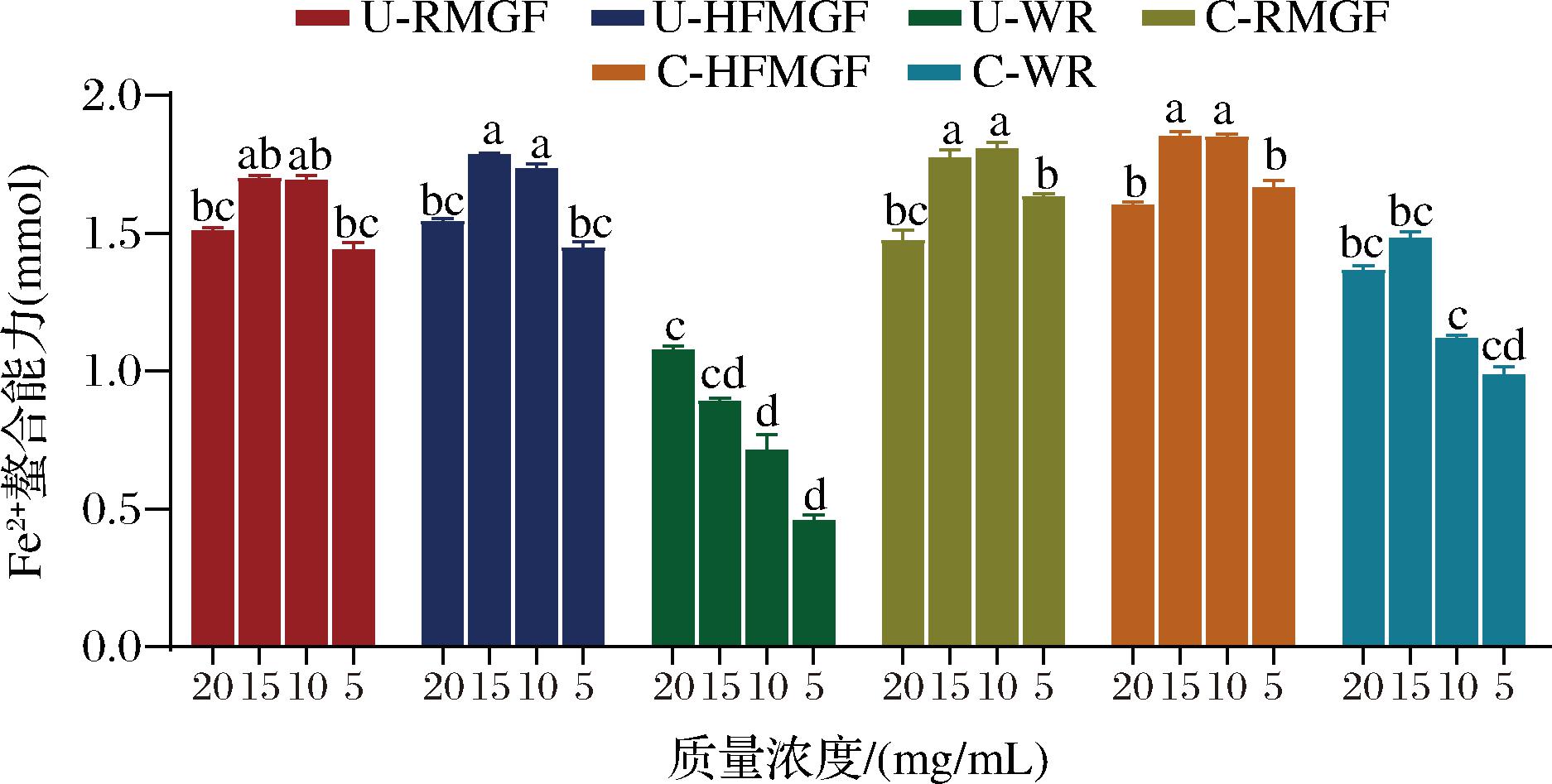
图5 Fe2+螯合能力
Fig.5 Fe2+ chelating capacity
2.7 相关性分析
将提取液中4种活性物质(总多酚、总黄酮、肌-肌醇、D-手性肌醇)含量与抗氧化活性进行相关性分析,结果如图6所示。ABTS阳离子自由基、DPPH自由基和羟自由基的清除能力用每种提取液的IC50值表示,IC50值越低则表示清除效果越好。分析结果表明提取物清除这3种自由基的IC50值与各活性物质含量呈负相关关系,因此各自由基的清除效果与各活性物质含量均呈正相关关系。总还原能力和Fe2+螯合能力与各活性物质含量也均呈正相关关系。
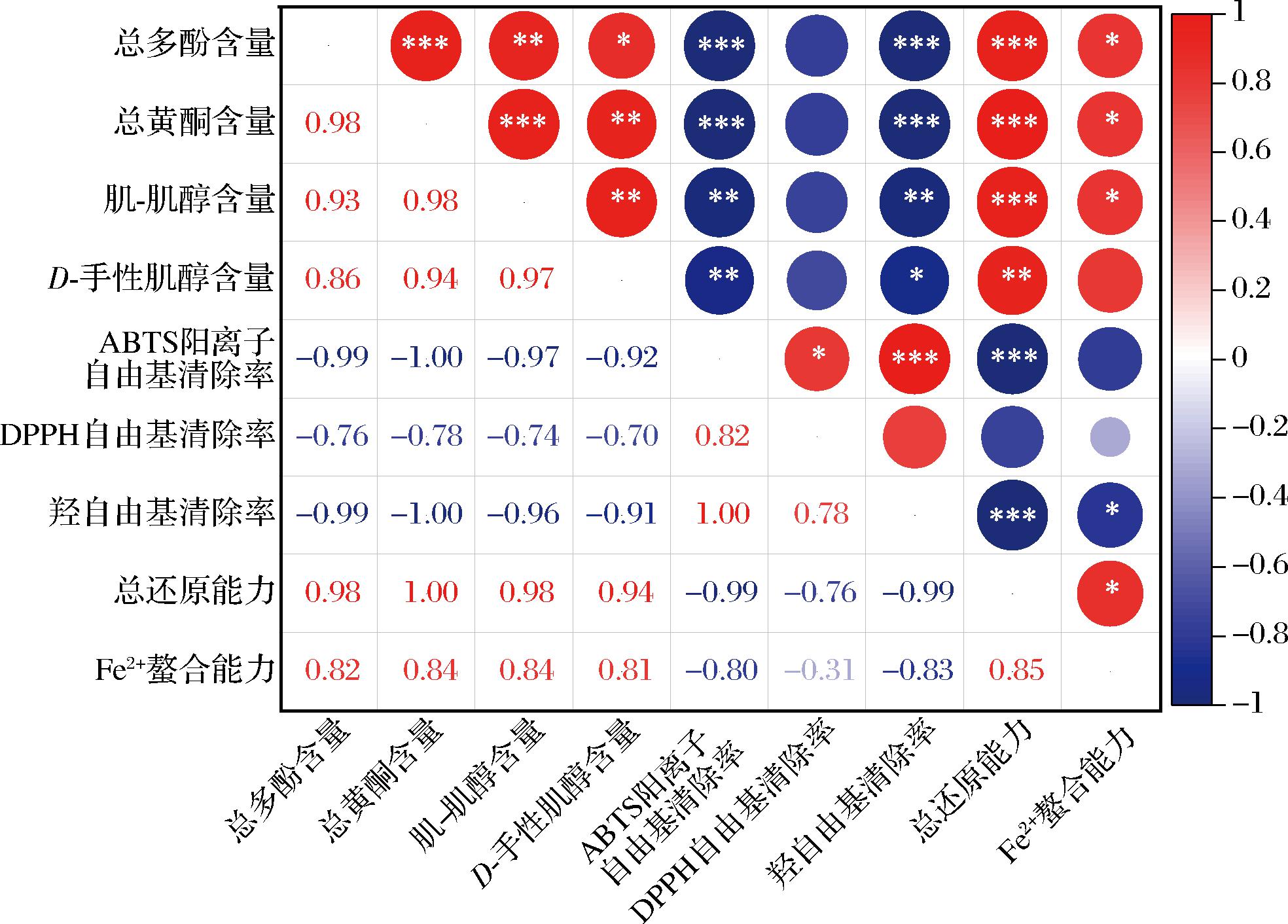
图6 各活性物质含量与抗氧化活性间相关性分析
Fig.6 Correlation analysis between the content of bioactive substances and antioxidant activity
注:*P≤0.05;**P≤0.01;***P≤0.001。
在4种活性物质中,总多酚含量和总黄酮含量与ABTS阳离子自由基清除率、羟自由基清除率和总还原能力呈极显著相关(P<0.001),相关性要高于肌-肌醇和D-手性肌醇,表明总多酚和总黄酮是影响提取物抗氧化活性的关键组分,特别是总黄酮。在4种组分中,总黄酮与各种抗氧化活性的相关性都是最高的。
在5种抗氧化指标中,ABTS阳离子自由基清除力、羟自由基清除率与总多酚和总黄酮含量呈极显著相关(P<0.001),与肌-肌醇含量呈显著相关(P<0.01)。DPPH自由基清除率和Fe2+螯合能力与4种活性物质含量的相关度较低。而总还原能力与总多酚、总黄酮和肌-肌醇含量呈极显著相关(P<0.001),与D-手性肌醇含量呈显著相关(P<0.01)。综合来看,总还原能力可以作为MGF多酚和肌醇提取物抗氧化活性最具代表性的评价方式。
3 结论与讨论
作者从一款由绿豆、苦荞、黑米、血糯米、燕麦胚芽米和白米组成的MGF中提取出富含多酚和肌醇的提取物,并在体外探究了提取物对ABTS阳离子自由基、DPPH自由基和羟自由基的清除作用,同时对总还原能力和Fe2+螯合能力也进行了研究。在一定的质量浓度范围内,ABTS阳离子自由基、DPPH自由基和羟自由基的清除率都随着MGF多酚和肌醇提取液质量浓度的增加而提高,C-HFMGF的多酚和肌醇提取液在DPPH自由基清除能力、总还原能力和Fe2+螯合能力方面表现出最佳的抗氧化效果,对于ABTS阳离子自由基和羟自由基的清除作用表现出与其他3种MGF多酚和肌醇提取液相似的效果。但与白米相比,MGF都表现出显著的抗氧化活性。相关性分析表明,MGF中总多酚、总黄酮、肌-肌醇和D-手性肌醇含量与ABTS阳离子自由基清除率、羟自由基清除率、总还原能力和Fe2+螯合能力都具有相关性,其中总还原能力的相关性最强,可以作为MGF最具代表性的抗氧化评价方式,而总黄酮和总多酚是最关键组分。综上所述,多谷物配方米MGF中的肌醇和多酚提取液在体外表现出较强的抗氧化活性,HTAF工艺处理后的多谷物其抗氧化活性会进一步提高,这也为多谷物饮食在抗氧化应激代谢疾病预防方面提供了一定的理论依据。
[1] MASISI K, BETA T, MOGHADASIAN M H. Antioxidant properties of diverse cereal grains: A review on in vitro and in vivo studies[J]. Food Chemistry, 2016, 196:90-97.
[2] CHENG F E, GE X H, GAO C F, et al. The distribution of D-chiro-inositol in buckwheat and its antioxidative effect in HepG2[J]. Journal of Cereal Science, 2019, 89:102808.
[3] 吴娟, 曾旭诺, 叶利利. 黑米色素抗氧化性能研究[J]. 安徽农业科学, 2023, 51(15):147-149.
WU J, ZENG X N, YE L L. Study on antioxidant activity of black rice pigment[J]. Journal of Anhui Agricultural Sciences, 2023, 51(15):147-149.
[4] LI Y N, LI Y F, CHEN Z X, et al. High-temperature air fluidization improves cooking and eating quality and storage stability of brown rice[J]. Innovative Food Science &Emerging Technologies, 2021, 67:102536.
[5] LI Y F, SU X, SHI F, et al. High-temperature air-fluidization-induced changes in the starch texture, rheological properties, and digestibility of germinated brown rice[J]. Starch - Stärke, 2017, 69(9-10):1600328.
[6] DOU J F, WU C E, FAN G J, et al. Insights into the pigment and non-pigment phenolic profile of polyphenol extracts of jujube peel and their antioxidant and lipid-lowering activities[J]. Food Bioscience, 2023, 52:102493.
[7] THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006, 19(6-7):669-675.
[8] 颜征, 张海晖, 李亚群, 等. 莲子壳多酚的抗氧化活性和稳定性[J]. 中国食品学报, 2019, 19(12):89-95.
YAN Z, ZHANG H H, LI Y Q, et al. Antioxidant properties and stability of polyphenols in Lotus seed hull[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(12):89-95.
[9] 赵亚刚, 吴殿辉, 彭郑聪, 等. 不同全谷物辅料对啤酒内源性抗氧化力的影响[J]. 食品与发酵工业, 2024, 50(1):73-79.
ZHAO Y G, WU D H, PENG Z C, et al. Effects of whole grain adjuncts on endogenous antioxidant capacity of beer[J]. Food and Fermentation Industries, 2024, 50(1):73-79.
[10] 范亦菲, 郭琳, 靳文会, 等. 枸杞酸奶体外抗氧化活性和保肝功能研究[J]. 食品与生物技术学报, 2022, 41(4):25-30.
FAN Y F, GUO L, JIN W H, et al. Study on antioxidant activity in vitro and hepatoprotective function of Lycium barbarum yogurt[J]. Journal of Food Science and Biotechnology, 2022, 41(4):25-30.
[11] TI H H, ZHANG R F, ZHANG M W, et al. Effect of extrusion on phytochemical profiles in milled fractions of black rice[J]. Food Chemistry, 2015, 178:186-194.
[12] MICHELL R H. Inositol derivatives: Evolution and functions[J]. Nature Reviews. Molecular Cell Biology, 2008, 9(2):151-161.
[13] 袁佐云, 朱运平, 俞伟祖, 等. 蒸煮与发酵对全谷物粉甲醇提取物抗氧化活性的影响[J]. 中国食品学报, 2016, 16(2):25-32.
YUAN Z Y, ZHU Y P, YU W Z, et al. Effect of steam and fermentation on the antioxidant activity of the methanol extract of whole grain[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(2):25-32.
[14] CHANDRASEKARA A, NACZK M, SHAHIDI F. Effect of processing on the antioxidant activity of millet grains[J]. Food Chemistry, 2012, 133(1):1-9.
[15] 贺诗茹, 王茜, 阿依努尔·白克热, 等. 新疆桑葚总黄酮含量与其抗氧化活性的研究[J]. 陕西农业科学, 2023, 69(9):13-21;74.
HE S R, WANG Q, AYINUER·Baikere, et al. Total flavonoid content and antioxidant activity of mulberries from Xinjiang[J]. Shaanxi Journal of Agricultural Sciences, 2023, 69(9):13-21;74.