陈皮是芸香科草本植物柑橘及其变种干燥处理后的成熟果皮,分为“陈皮”、“广陈皮”[1]。主产在广东、浙江、四川等地,采用的品种有广东茶枝柑、浙江蜜柑、重庆大红袍、福建芦柑等,其中广东新会生产出来的新会陈皮品质最佳,而福建芦柑因其黄酮类活性成分含量高、价格低廉,是市场普通陈皮的重要来源。陈皮是一种药食同源传统药材,制作时往往摘取秋末冬初时的熟果并取皮,通过曝晒等较低温的方式干燥后进行贮存,陈久为佳,故称“陈皮”[2]。然而,目前陈皮价格差异较大,市场造假严重,不仅在陈化年限上部分商家用烘烤、染色等方式伪造高年份陈皮,还在产地品种上用其他品种果皮伪造高价新会陈皮。因而,鉴定区分不同陈皮以及探索陈皮的陈化机制具有十分重要的意义。
陈皮丰富的挥发性化合物不仅能够给予陈皮特有的浓厚香味,还能提供抗氧化、抗菌、促消化、排除肠内积气等功效,是陈皮重要的生理活性成分[3]。目前除国家药典中现有规定的黄酮类成分为陈皮鉴定指标外,不少研究也将一些挥发性化合物作为鉴定区分不同陈皮的参考。欧小群等[4]发现广陈皮挥发油中D-柠檬烯的相对含量较其他品种最低, 而γ-萜品烯相对含量最高。胡继藤等[5]研究得出β-月桂烯与2-甲氨基-苯甲酸甲酯的含量比值与贮藏年份的对数函数相关性达到0.86以上。然而,目前基于游离态挥发性化合物来区分不同陈皮的结论仍存在争议[6]。天然植物中的挥发性化合物除游离态外还存在键合态形式。键合态挥发性化合物是以游离态成分为配基,通过糖苷键与糖苷部分键合而成,断裂糖苷键则可以使键合态转为游离态从而达到丰富香气或提高活性的效果[7-8]。目前已有葡萄酒[9]、橘汁[10]等多种样品的键合态挥发性化合物的研究,但尚未见陈皮中键合态挥发性成分的研究。有研究报道,茶叶键合态挥发性成分在加工过程中会释放出游离态成分,对茶叶品质的形成发挥重要作用[11];而陈皮在陈化过程中也存在挥发性成分种类和含量的变化[12]。因此,研究陈皮键合态挥发性成分的分析方法,不仅能够进一步探索基于键合态成分来区分不同陈皮的可能性,也对后续深入认识陈皮陈化过程中品质的形成具有重要的意义。
键合态挥发性化合物常采用酶解法和酸解法断裂糖苷键来释放,这2种方法生成的挥发性化合物差异较大。陈亦欣等[13]研究了酶水解与酸水解杨梅汁生成的挥发性化合物差异性,发现酶解产物主要以醇类和酯类为主,较为温和,而酸解产物主要以烷烃类为主,且不同的酶其水解效果也不同,果胶酶以酯类为主,β-葡萄糖苷酶以醇类为主;CHEN等[14]研究树番茄果酸解与酶解释放糖苷键合态挥发性成分的差异,发现酸解较强烈,生成了3-羟基-β-二氢大马酮等不愉悦气味的物质,而酶解键合态挥发性成分生成了许多萜烯类香气物质,且水解时间越长其浓度越高。
本文拟以前期研究的芦柑源陈皮为研究对象,采用Amberlite XAD-2树脂吸附洗脱分离得到陈皮中键合态挥发性化合物前体,将其在β-葡萄糖苷酶、果胶酶、混合酶(β-葡萄糖苷酶与果胶酶)和酸4种条件下进行水解释放,并采用GC-MS和气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry, GC-IMS)分析来比较其组成差异,为不同产地品种以及陈化年限陈皮的质量评价体系提供新的研究参考。
1 材料与方法
1.1 材料与试剂
陈皮样品,2021年11月17日取福建南平芦柑果皮自行晾干制得,于室温条件下密封保存。
甲醇、正戊烷、磷酸氢二钠、氯化钠、氢氧化钠(均为分析纯)、Amberlite XAD-2树脂(20~60目)、β-葡萄糖苷酶(来源于杏仁,10~30 U/mg),上海易恩化学技术有限公司;2-苯基乙酸乙酯标品(>98%)、果胶酶(来源于黑曲霉,30 U/mg),上海阿拉丁生化科技股份有限公司;乙酸乙酯(分析纯),成都市科隆化学品有限公司;无水乙醚(分析纯),西陇科学股份有限公司;盐酸(分析纯),衡阳市凯信化工试剂有限公司;柠檬酸(分析纯),天津大茂化学试剂厂;正构烷烃C7~C30混标(>98%),上海安谱实验科技股份有限公司;正酮C4~C9混标(>98%),国药集团化学试剂有限公司。
1.2 仪器与设备
Aglient 8890-7000D气相色谱串联质谱仪,美国Agilent公司;GAS FlavourSpec®气相色谱离子迁移谱风味分析联用仪,德国GAS公司;ME 104E/02电子天平、S210 pH计,梅特勒-托利多仪器(上海)有限公司;ZNCL-GS130×70智能磁力搅拌油浴锅,郑州华特仪器设备有限公司;SHZ-D(III)循环水式多用真空泵、LC-N-1100D旋转蒸发器,上海力辰邦西仪器科技有限公司;HH-4数显恒温水浴锅,常州金坛良友仪器有限公司;KQ-400DE数控超声波清洗器,昆山市仪器有限公司。
1.3 实验方法
1.3.1 游离态挥发性化合物前处理
参考杨旖旎等[15]的方法并稍作修改。称取15 g陈皮样品,剪碎后置于500 mL具塞锥形瓶中。加入300 mL沸水浸泡,密闭,间隔15 min轻微摇晃1次使其混匀,待其完全冷却后过滤分离陈皮滤渣得提取液。取其中6.5 mL提取液3份,分别置于顶空样品瓶中,各加入50 μL 2-苯基乙酸乙酯(1 μL/mL甲醇)与2 g NaCl后用聚四氟乙烯隔垫密封,待后续检测进行游离态成分分析。
1.3.2 键合态挥发性化合物前处理
参考范刚[16]的方法并稍作修改。称取Amberlite XAD-2树脂60 g,在索氏抽提器中分别用200 mL戊烷、200 mL乙酸乙酯和200 mL甲醇回流处理10 h,以甲醇为溶剂湿法装柱,再用水洗至无醇味后备用。
取200 mL样液通过树脂柱(3.3 cm×30 cm),用300 mL蒸馏水冲洗柱以除去糖、酸和其他水溶性化合物,然后用300 mL V(正戊烷)∶V(乙醚)=1∶1洗去游离态挥发性化合物,最后用300 mL甲醇洗脱键合态挥发性化合物前体物质并收集。将此部分于旋转蒸发器上(水浴温度35 ℃,0.9 MPa)浓缩几乎至干从而除去溶剂,再加入20 mL柠檬酸-磷酸盐缓冲溶液(pH 5.0,0.2 mol/L)溶解,并用80 mL V(正戊烷)∶V(乙醚)=1∶1分3次萃取可能残留的游离态挥发性化合物,收集到的水相部分为键合态挥发性化合物前体。
1.3.2.1 酶法水解
参考YANG等[17]的方法并稍作修改。将3组水相分别与β-葡萄糖苷酶、果胶酶、混合酶(β-葡萄糖苷酶与果胶酶)一同加入至50 mL离心管内,密封后于38 ℃水浴48 h。待酶解完成后将酶解液分为3份,各取6.5 mL于20 mL顶空进样瓶中,加2 g NaCl以促进挥发性成分的挥发,再加入50 μL 2-苯基乙酸乙酯(10-4 μL/mL甲醇)后用聚四氟乙烯隔垫密封,待后续检测进行键合态成分分析。
1.3.2.2 酸法水解
参考彭邦远[18]的方法并稍作修改。将水相用1 mol/L的HCl调整pH=1,置沸水浴中煮沸水解30 min,然后用1 mol/L NaOH调pH至中性。将水解液分为3份,各取6.5 mL于20 mL顶空进样瓶中,加入2 g NaCl以促进挥发性成分的挥发,再加入50 μL 2-苯基乙酸乙酯(10-4 μL/mL甲醇)后用聚四氟乙烯隔垫密封,待后续检测进行键合态成分分析。
1.3.3 HS-SPME-GC-MS分析
HS-SPME条件:参考梁淼等[19]的方法并稍作修改。50 ℃孵育20 min,插入萃取头(50/30 μm DVB/CAR/PDMS)吸附30 min,进样口解析5 min。
GC-MS条件:Aglient HP-5MS石英毛细管色谱柱(30 m×0.25 mm, 0.25 μm);载气为高纯度氦气(99.999%);程序升温条件为柱温60 ℃,维持3 min,以1 ℃/min升温至80 ℃,维持3 min,再以5 ℃/min升温至250 ℃,维持2 min;溶剂延迟8 min;进样量1 μL;游离态挥发性化合物样品采用分流进样,分流比为200∶1,键合态挥发性化合物样品不分流进样;电离方式为EI,电子能量70 eV,离子源温度为230 ℃,四级杆温度150 ℃,扫描范围m/z 30~450。
化合物定性:通过NIST 17数据库对谱图进行检索,并将计算的线性保留指数(retention index,RI)(根据C7~C30正构烷烃的保留时间得出)与文献报道的保留指数进行比对来定性。
化合物定量:通过比较总离子流图中化合物和内标物质特征离子的峰面积之比来对化合物进行半定量分析,同时假定所有化合物与内标物质具有相同的响应因子。虽然该定量法计算所得值不能代表反应液中挥发物的准确含量,但可用于探讨水解条件对键合态挥发性化合物释放的影响。
1.3.4 HS-GC-IMS分析
HS条件:参照梁天一等[20]的方法并稍作修改。75 ℃孵育20 min;进样500 μL;不分流模式;进样针温度85 ℃;载气为高纯度氦气(99.999%);孵化转速500 r/min。
GC条件:色谱柱为FS-SE-54-CB-1(15 m×0.53 mm, 1 μm);色谱柱温75 ℃;使用氮气(99.999%)作为载气,其流速首先设定为2 mL/min持续2 min,然后在8 min内增加至10 mL/min,然后在10 min内增加到100 mL/min,再在5 min内增加为150 mL/min,并保持20 min。待分析组分经色谱柱洗脱分离后送入IMS检测器(3H电离源,正离子模式,漂移管长度98 mm,漂移管温度45 ℃,漂移管电压5 kV)。
化合物定性:通过RI和漂移时间与GC-IMS库(NIST和IMS数据库)进行鉴定,使用正酮C4~C9作为外部参考计算每种化合物的RI。
1.4 数据统计分析
每组实验均进行3次平行试验,结果用mean±SD表示。采用IBM SPSS Statistics 27软件对实验结果进行差异显著性分析,并采用Origin 2022软件绘图。GC-IMS仪器配套的分析软件包括LAV(Laboratory Analytical Viewer)和Dynamic PCA插件、Gallery Plot插件、Reporter插件以及GC×IMS Library Search,可以分别从不同角度进行样品分析。
2 结果与分析
2.1 陈皮游离态挥发性化合物GC-MS分析
表1所示为陈皮经GC-MS分析鉴定出的主要游离态挥发性化合物,共15种化合物,包括4种单萜烯类,3种醇类,2种倍半萜烯类,2种酚类,以及4种其他类。D-柠檬烯(柑橘味、甜橙味)是检出含量最高的游离态香气物质,为11 620.31 μg/L,其次为γ-萜品烯(柑橘味、酸橙味)、β-月桂烯(木香味、松油味)、α-蒎烯(松木味、樟脑味)等单萜烯类化合物和p-伞花烃(柑橘味、木香味)等,这与先前研究一致[21-22]:单萜烯类化合物是陈皮游离态挥发性化合物中最主要的成分,以D-柠檬烯和γ-萜品烯含量最高,是陈皮特征香气的来源。
表1 陈皮游离态挥发性化合物
Table 1 Free volatile compounds in Citrus reticulata Blanco
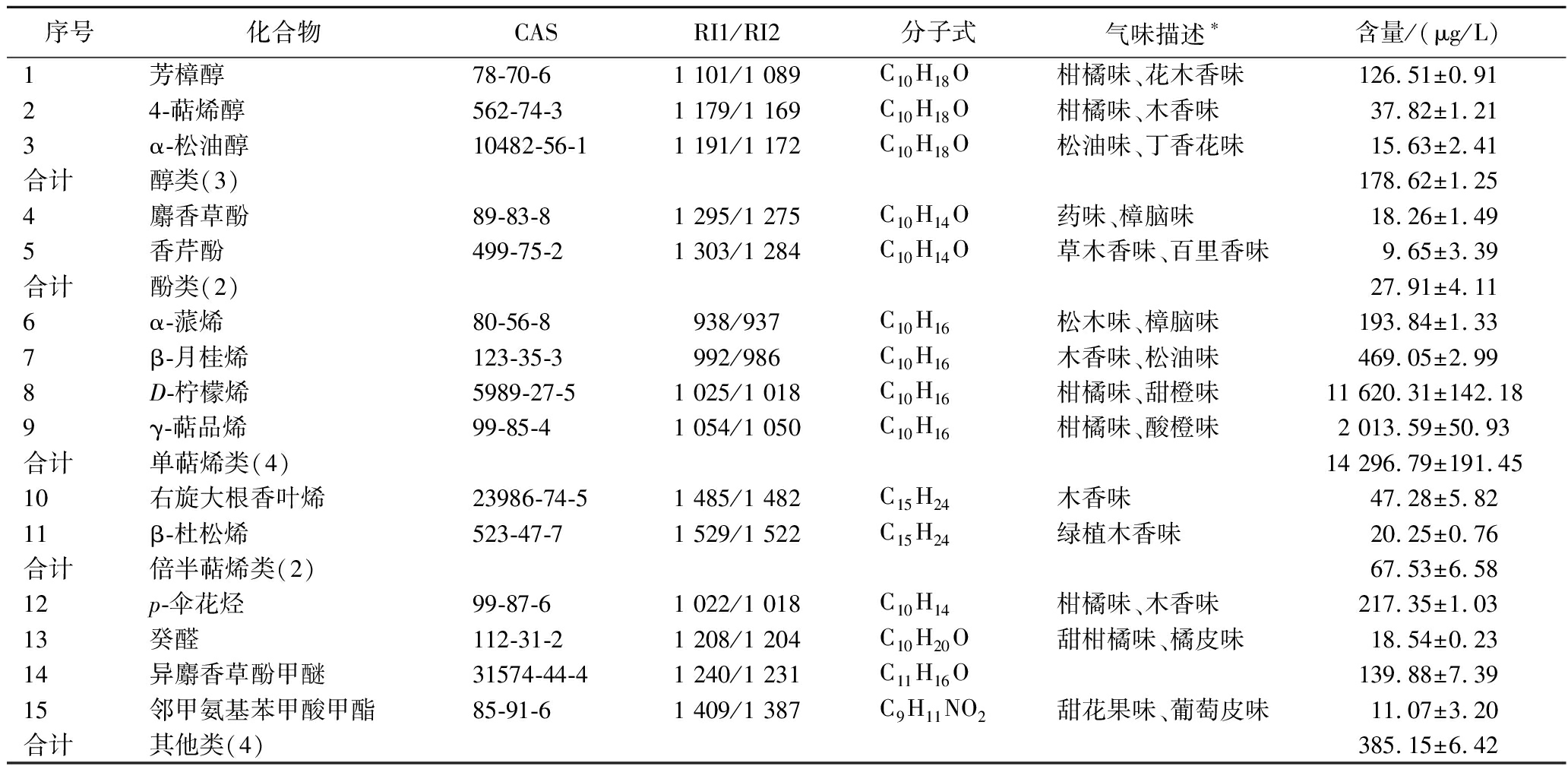
序号化合物CASRI1/RI2分子式气味描述∗含量/(μg/L)1芳樟醇78-70-6 1 101/1 089C10H18O柑橘味、花木香味126.51±0.9124-萜烯醇562-74-3 1 179/1 169C10H18O柑橘味、木香味37.82±1.213α-松油醇10482-56-11 191/1 172C10H18O松油味、丁香花味15.63±2.41合计醇类(3)178.62±1.254麝香草酚89-83-81 295/1 275C10H14O药味、樟脑味18.26±1.495香芹酚499-75-21 303/1 284C10H14O草木香味、百里香味9.65±3.39合计酚类(2)27.91±4.116α-蒎烯80-56-8938/937C10H16松木味、樟脑味193.84±1.337β-月桂烯123-35-3 992/986C10H16木香味、松油味469.05±2.998D-柠檬烯5989-27-51 025/1 018C10H16柑橘味、甜橙味11 620.31±142.189γ-萜品烯99-85-41 054/1 050C10H16柑橘味、酸橙味2 013.59±50.93合计单萜烯类(4)14 296.79±191.4510右旋大根香叶烯23986-74-51 485/1 482C15H24木香味47.28±5.8211β-杜松烯523-47-7 1 529/1 522C15H24绿植木香味20.25±0.76合计倍半萜烯类(2)67.53±6.5812p-伞花烃99-87-61 022/1 018C10H14柑橘味、木香味217.35±1.0313癸醛112-31-21 208/1 204C10H20O甜柑橘味、橘皮味18.54±0.2314异麝香草酚甲醚31574-44-41 240/1 231C11H16O139.88±7.3915邻甲氨基苯甲酸甲酯85-91-61 409/1 387C9H11NO2甜花果味、葡萄皮味11.07±3.20合计其他类(4)385.15±6.42
注:RI1为实验检测计算值;RI2为文献报道值,来源于NIST 17库;*所有物质的气味描述均来自“ The Good Scents Company ”(下同)。
2.2 陈皮键合态挥发性化合物GC-MS分析
果胶酶[23]和β-葡萄糖苷酶[15]是常用于水解键合态香气物质的2种酶。本节分别用这2种酶及β-葡萄糖苷酶/果胶酶混合酶对Amberlite XAD-2树脂吸附洗脱分离得到的陈皮键合态挥发性化合物前体进行水解释放,得到的键合态挥发性成分的GC-MS分析结果见表2。
表2 酶法水解释放的陈皮键合态挥发性化合物
Table 2 Enzymatic hydrolysis of bound volatile compounds in Citrus reticulata Blanco

序号化合物CASRI1/RI2分子式气味描述∗含量/(ng/L)β-葡萄糖苷酶果胶酶混合酶1芳樟醇78-70-61 101/1 089C10H18O柑橘味、花木香味132.22±31.87a174.43±43.88a210.92±21.33a2(E)-2,8-1-薄荷醇7212-40-01 121/1 111C10H16O鲜薄荷味84.02±31.14a127.44±26.65a124.96±13.49a3(Z)-2,8-薄荷二烯-1-醇3886-78-01 135/1 140C10H16O367.83±144.96ab304.05±85.39b635.50±86.81a4三环[4.4.0.0(2,8)]癸-3-醇-1 166/1 192C10H16O181.37±71.94a290.58±75.73a286.01±23.01a54-萜烯醇562-74-31 180/1 169C10H18O柑橘味、木香味139.57±61.74a199.30±67.46a241.52±21.58a63,9-环氧基-1,8(10)-二烯-对薄荷醇 -1 190/1 104C10H14O1 819.14±558.51a2 572.01±801.06a3 428.01±396.18a合计醇类(6)2 896.55±788.71a3 667.82±1093.53a4 926.91±531.94a73,4-二甲基苯乙烯27831-13-61 089/1 100C10H12709.01±313.31a850.22±283.63a1 329.75±190.84a81,5,8-对薄荷三烯21195-59-51 111/1 112C10H14烘烤味357.97±138.19ab261.15±69.30b596.69±74.08a9对薄荷三烯18368-95-11 140/1 119C10H14草木味、百里香味173.95±60.66a177.39±39.42a271.03±44.25a合计烯烃类(3)1 240.93±511.54a1 288.75±390.50a2 197.47±307.31a102-甲基烯丙基-4-甲基苯酚1786-08-91 161/1 140C10H16O绿植味、薄荷味156.24±75.94b85.04±35.88b294.30±26.29a11反式异胡椒酚74410-00-71 208/1 206C10H16O138.21±59.14a236.37±66.08a298.19±56.58a12麝香草酚89-83-81 296/1 275C10H14O药味、樟脑味278.54±56.08and361.69±18.16a13香芹酚499-75-21 304/1 284C10H14O草木香味、百里香味119.92±25.49bnd174.42±13.41a142-甲氧基-4-乙烯基苯酚7786-61-01 314/1 293C9H10O2丁香味、脂粉味294.07±58.43and331.90±35.37a合计酚类(5)940.90±303.02b270.89±63.51c1 460.49±143.01a15苯乙醛122-78-11 041/1 017C8H8O甜蜂蜜味、花香味510.41±106.80ab432.14±73.53b637.09±37.19a16α-环柠檬醛432-24-61 153/1 175C10H16O157.27±47.05a242.52±58.46a223.82±13.30a172,5-二甲基苯甲醛5779-94-21 213/1 208C9H10O293.31±41.86b412.23±19.82b1 378.46±89.55a合计醛类(3)960.99±194.84b1 086.89±150.39b2 239.37±126.76a18苯甲酸甲酯93-58-31 096/1 079C8H8O2樱桃味80 255.92±9 212.11bnd98 782.99±4 789.93a19辛酸甲酯111-11-51 129/1 110C9H18O2甜橙味、绿植味3 362.91±202.60and3 699.91±193.68a20乙酸[1S,(+)]-2,7,7-三甲基-1α,5α-亚甲基-2-环己烯-6β-酯50764-55-11 226/1 276C12H18O281.80±36.69a110.23±49.85a241.35±81.55a
续表2

序号化合物CASRI1/RI2分子式气味描述∗含量/(ng/L)β-葡萄糖苷酶果胶酶混合酶21(Z)-乙酸马鞭草酯29135-27-11 231/1 276C12H18O2578.82±279.59ab632.50±239.46b1 189.03±214.74a22癸酸甲酯110-42-9 1 329/1 310C11H22O2油味、水果味1 299.13±269.55and1 319.16±113.09a23肉桂酸甲酯1754-62-71 385/1 379C10H10O2香脂味、甜草莓味547.08±91.58a22.98±5.15b700.79±61.00a24月桂酸甲酯111-82-01 528/1 510C13H26O2奶油味、椰子味2 079.76±636.26and1 731.85±275.66a2512-甲基十三烷酸甲酯5129-58-81 691/1 678C15H30O2368.32±98.95a29.47±3.47b377.62±77.24a26肉豆蔻酸甲酯124-10-71 728/1 710C15H30O2花瓣味、油脂味2 259.87±615.10a214.90±37.26b2 240.74±436.99a2712-甲基十四烷酸甲酯5129-66-81 799/1 786C16H32O2282.36±74.01a21.22±4.61b295.32±66.45a28十五酸甲酯7132-64-11 829/1 810C16H32O2910.82±256.37a83.17±17.68b925.72±198.85a29棕榈油酸甲酯1120-25-81 906/1 892C17H32O2248.30±53.34and271.43±52.73a30棕榈酸甲酯112-39-01 930/1 911C17H34O2鸢尾草味、油脂味5 489.00±1 573.93a734.09±115.73b5 370.90±1 105.51a31硬脂酸甲酯112-61-82 131/2 113C19H38O2蜡味、油味388.06±74.54a41.75±6.05b376.76±58.69a合计酯类(14)105 569.57±5 171.13a1 890.30±247.08b11 7523.54±6 799.39a32p-伞花烃99-87-61 024/1 018C10H14柑橘味、木香味nd1 412.40±541.23nd33麝香草酚甲醚1076-56-81 192/1 208C11H16O烟熏味、泥土味667.95±328.51ab757.08±307.15b1 387.76±234.38a34正壬酸112-05-01 281/1 283C9H18O2奶酪味68.62±14.93ab107.49±24.17a52.50±10.73b35大马士酮23726-93-41 388/1 368C13H18O甜苹果味、玫瑰味nd13.71±4.99b22.48±1.36a合计其他类(4)736.57±330.71b2 101.68±607.85a1 462.75±230.29ab
注:“ nd ”表示未检出;不同肩标小写字母表示差异显著(P<0.05);“-”表示该化合物无相应CAS号(下同)。
由表2可知,经GC-MS分析,酶解条件下共检出35种陈皮键合态挥发性成分,包括14种酯类,6种醇类,5种酚类,3种烯烃类,3种醛类,以及4种其他类。其中在β-葡萄糖苷酶水解条件下,共检出33种键合态挥发性化合物,以苯甲酸甲酯(樱桃味)含量最高(80.26 μg/L),其次为棕榈酸甲酯(鸢尾草味、油脂味)、辛酸甲酯(甜橙味、绿植味)、肉豆蔻酸甲酯(花瓣味、油脂味)等脂肪酸甲酯(本课题组前期研究显示冷冻干燥陈皮有利于产生游离态的脂肪酸甲酯[22]);在果胶酶水解条件下,共检出28种挥发性化合物,以p-伞花烃(柑橘味、木香味)含量最高(1.41 μg/L),该物质在游离态挥发性化合物中也被检出,其次为麝香草酚甲醚(烟熏味、泥土味)、棕榈酸甲酯(鸢尾草味、油脂味)、苯乙醛(甜蜂蜜味、花香味)等;在混合酶水解条件下,共检出34种挥发性化合物,以苯甲酸甲酯含量最高(98.78 μg/L),其次为各种脂肪酸甲酯类,与β-葡萄糖苷酶类似。酯类化合物通常是水果主要的香气来源,张晨等[24]在7种柑橘的柑橘汁中也均检出键合态挥发性成分,以苯甲酸甲酯、辛酸甲酯为主。
值得注意的是,苯甲酸甲酯、辛酸甲酯和月桂酸甲酯存在于β-葡萄糖苷酶和混合酶水解组中,在果胶酶水解组中未被检出。果胶酶水解也产生了2种β-葡萄糖苷酶未释放出的香气成分:p-伞花烃(1.41 μg/L)和大马士酮(0.01 μg/L),含量远低于前者,提示β-葡萄糖苷酶较果胶酶更适合于陈皮键合态挥发性化合物的释放。CHEN等[14]研究树番茄果的键合态挥发性成分时也发现果胶酶水解所得香气物质损失率要高于β-葡萄糖苷酶,生成的独有香气物质种类少且含量低。推测其产物差异可能是因为β-葡萄糖苷酶和果胶酶的水解原理不同,β-葡萄糖苷酶直接作用于植物中的糖苷类挥发性前体物,通过切断苷元与糖基连接的糖苷键来释放出挥发性苷元[25];果胶酶则是作用于植物细胞壁,通过降解细胞壁促使内源酶被激活,进而与挥发性前体反应释放出挥发性组分[26]。
为与酶解比较,表3显示了酸水解条件下释放得到的键合态挥发性成分的GC-MS分析结果。由表3可知,酸解条件下共检出50种陈皮键合态挥发性成分,包括11种酮类,10种醇类,7种醛类,6种酯类,3种醚类、3种酚类和2种烯烃类,以及5种其他类。其中樱桃丙醇(樱桃味、甜花果味)含量最高(23.01 μg/L),其次为p-伞花烃、麝香草酚(药味、樟脑味)等。
表3 酸法水解释放的陈皮键合态挥发性化合物
Table 3 Acid hydrolysis of bound volatile compounds in Citrus reticulata Blanco
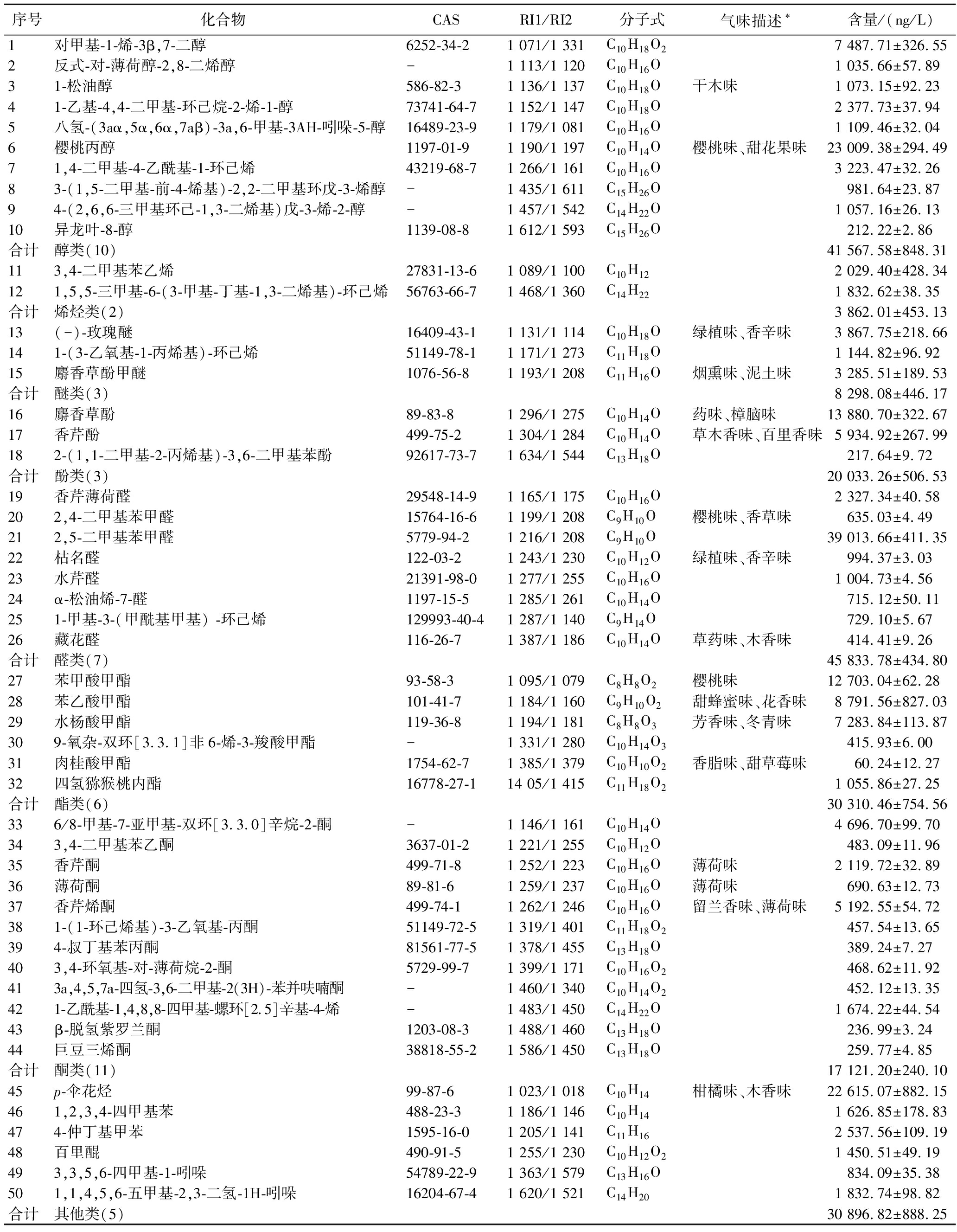
序号化合物CASRI1/RI2分子式气味描述∗含量/(ng/L) 1对甲基-1-烯-3β,7-二醇6252-34-21 071/1 331C10H18O27 487.71±326.552反式-对-薄荷醇-2,8-二烯醇-1 113/1 120C10H16O1 035.66±57.8931-松油醇586-82-31 136/1 137C10H18O干木味1 073.15±92.2341-乙基-4,4-二甲基-环己烷-2-烯-1-醇73741-64-7 1 152/1 147C10H18O2 377.73±37.945八氢-(3aα,5α,6α,7aβ)-3a,6-甲基-3AH-吲哚-5-醇16489-23-9 1 179/1 081C10H16O1 109.46±32.046樱桃丙醇1197-01-91 190/1 197C10H14O樱桃味、甜花果味23 009.38±294.4971,4-二甲基-4-乙酰基-1-环己烯43219-68-7 1 266/1 161C10H16O3 223.47±32.2683-(1,5-二甲基-前-4-烯基)-2,2-二甲基环戊-3-烯醇-1 435/1 611C15H26O981.64±23.8794-(2,6,6-三甲基环己-1,3-二烯基)戊-3-烯-2-醇-1 457/1 542C14H22O1 057.16±26.1310异龙叶-8-醇1139-08-81 612/1 593C15H26O212.22±2.86合计醇类(10)41 567.58±848.31113,4-二甲基苯乙烯27831-13-61 089/1 100C10H122 029.40±428.34121,5,5-三甲基-6-(3-甲基-丁基-1,3-二烯基)-环己烯56763-66-71 468/1 360C14H221 832.62±38.35合计烯烃类(2)3 862.01±453.1313(-)-玫瑰醚16409-43-11 131/1 114C10H18O绿植味、香辛味3 867.75±218.66141-(3-乙氧基-1-丙烯基)-环己烯51149-78-1 1 171/1 273C11H18O1 144.82±96.9215麝香草酚甲醚1076-56-8 1 193/1 208C11H16O烟熏味、泥土味3 285.51±189.53合计醚类(3)8 298.08±446.1716麝香草酚89-83-81 296/1 275C10H14O药味、樟脑味13 880.70±322.6717香芹酚499-75-21 304/1 284C10H14O草木香味、百里香味5 934.92±267.99182-(1,1-二甲基-2-丙烯基)-3,6-二甲基苯酚92617-73-71 634/1 544C13H18O217.64±9.72合计酚类(3)20 033.26±506.5319香芹薄荷醛29548-14-91 165/1 175C10H16O2 327.34±40.58202,4-二甲基苯甲醛15764-16-6 1 199/1 208C9H10O樱桃味、香草味635.03±4.49212,5-二甲基苯甲醛5779-94-2 1 216/1 208C9H10O39 013.66±411.3522枯名醛122-03-21 243/1 230C10H12O绿植味、香辛味994.37±3.0323水芹醛21391-98-01 277/1 255C10H16O1 004.73±4.5624α-松油烯-7-醛1197-15-51 285/1 261C10H14O715.12±50.11251-甲基-3-(甲酰基甲基) -环己烯129993-40-41 287/1 140C9H14O729.10±5.6726藏花醛116-26-71 387/1 186C10H14O草药味、木香味414.41±9.26合计醛类(7)45 833.78±434.8027苯甲酸甲酯93-58-31 095/1 079C8H8O2樱桃味12 703.04±62.2828苯乙酸甲酯101-41-71 184/1 160C9H10O2甜蜂蜜味、花香味8 791.56±827.0329水杨酸甲酯119-36-81 194/1 181C8H8O3芳香味、冬青味7 283.84±113.87309-氧杂-双环[3.3.1]非6-烯-3-羧酸甲酯-1 331/1 280C10H14O3415.93±6.0031肉桂酸甲酯1754-62-71 385/1 379C10H10O2香脂味、甜草莓味60.24±12.2732四氢猕猴桃内酯16778-27-114 05/1 415C11H18O21 055.86±27.25合计酯类(6)30 310.46±754.56336/8-甲基-7-亚甲基-双环[3.3.0]辛烷-2-酮-1 146/1 161C10H14O4 696.70±99.70343,4-二甲基苯乙酮3637-01-21 221/1 255C10H12O483.09±11.9635香芹酮499-71-81 252/1 223C10H16O薄荷味2 119.72±32.8936薄荷酮89-81-61 259/1 237C10H16O薄荷味690.63±12.7337香芹烯酮499-74-11 262/1 246C10H16O留兰香味、薄荷味5 192.55±54.72381-(1-环己烯基)-3-乙氧基-丙酮51149-72-51 319/1 401C11H18O2457.54±13.65394-叔丁基苯丙酮81561-77-5 1 378/1 455C13H18O389.24±7.27403,4-环氧基-对-薄荷烷-2-酮5729-99-7 1 399/1 171C10H16O2468.62±11.92413a,4,5,7a-四氢-3,6-二甲基-2(3H)-苯并呋喃酮-1 460/1 340C10H14O2452.12±13.35421-乙酰基-1,4,8,8-四甲基-螺环[2.5]辛基-4-烯-1 483/1 450C14H22O1 674.22±44.5443β-脱氢紫罗兰酮1203-08-31 488/1 460C13H18O236.99±3.2444巨豆三烯酮38818-55-21 586/1 450C13H18O259.77±4.85合计酮类(11)17 121.20±240.1045p-伞花烃99-87-61 023/1 018C10H14柑橘味、木香味22 615.07±882.15461,2,3,4-四甲基苯488-23-3 1 186/1 146C10H141 626.85±178.83474-仲丁基甲苯1595-16-01 205/1 141C11H162 537.56±109.1948百里醌490-91-51 255/1 230C10H12O21 450.51±49.19493,3,5,6-四甲基-1-吲哚54789-22-9 1 363/1 579C13H16O834.09±35.38501,1,4,5,6-五甲基-2,3-二氢-1H-吲哚16204-67-41 620/1 521C14H201 832.74±98.82合计其他类(5)30 896.82±888.25
综合表2和表3可知,酶解与酸解以及β-葡萄糖苷酶与果胶酶水解释放的化合物在组成上有明显差异。为进一步分析比较,图1显示了陈皮游离态挥发性化合物以及不同水解方式得到的陈皮键合态挥发性化合物中各类化合物的组成情况。由图1可知,陈皮游离态挥发性化合物与不同水解方式得到的键合态挥发性化合物在组成上也有明显差别:陈皮游离态挥发性化合物以单萜烯类为主,占总含量的95.61%,其次是醇类(1.19%);而β-葡萄糖苷酶和混合酶水解释放得到的键合态挥发性化合物均以酯类(包括苯甲酸甲酯和脂肪酸甲酯)为主(分别占总含量的93.42%和90.55%),其次是醇类(分别是2.55%和3.79%);果胶酶水解得到的键合态挥发性化合物以醇类为主,占总含量的32.83%,其次是酯类(19.32%);酸水解得到的键合态挥发性化合物以醛类(包括萜烯醛和芳香醛)为主,占总含量的23.16%,其次是醇类(包括樱桃丙醇和部分萜烯醇,21%)。
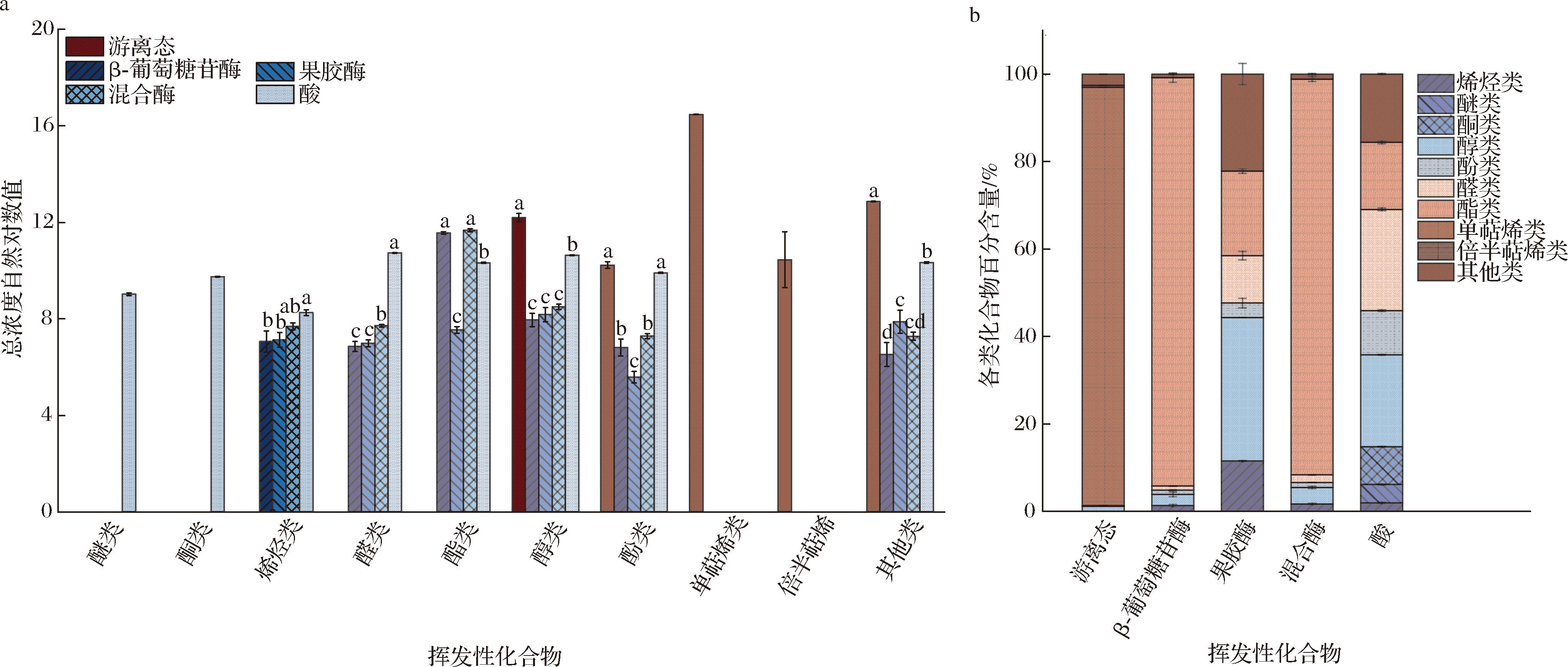
a-各组间挥发性化合物总浓度自然对数值对比;b-各组间各类挥发性化合物组成百分含量对比
图1 游离态挥发性化合物以及不同水解方式得到的键合态挥发性化合物对比
Fig.1 Comparison of free volatile compounds and bound volatile compounds obtained by different hydrolysis methods
注:图中游离态代表游离态挥发性化合物,β-葡萄糖苷酶、果胶酶、混合酶、酸均代表键合态挥发性化合物。
值得注意的是,酶解产生的芳樟醇、4-萜烯醇在游离态香气物质中有检出,但酸解产生的萜类物质(水芹醛、反式-对-薄荷醇-2,8-二烯醇等)在游离态和酶解产物中都未发现。酸解和酶解均通过断裂糖苷键来释放键合态挥发性化合物,其得到的组分不同可能与反应强度有关。酸解作用比较剧烈,其水解释放的挥发性化合物进一步发生了氧化,因此其生成的主要挥发性化合物是与游离态萜烯类结构相似的醛类化合物,如香芹薄荷醛,根据其结构可推测为糖苷键断裂生成的4-萜烯醇在酸性条件下进一步发生了氧化反应,因而酸解产物也失去了陈皮的原有特征香气。由此可见,对于陈皮样品,酶解条件比较温和,释放出的成分其香气更接近陈皮本身的风味,更适用于陈皮键合态挥发性化合物的释放。HAMPEL等[27]对含有游离态成分(如芳樟醇等)和键合态成分(如苯基-D-吡喃葡萄糖苷等)的混合样品进行酸解和酶解时也发现,酸水解条件下释放20%~60%的键合态成分,且50%的游离态成分发生了降解;而酶水解释放90%~100%的键合态成分,且对游离态成分影响不大。
2.3 陈皮挥发性化合物GC-IMS分析
GC-IMS可进一步完善陈皮挥发性化合物的分析,结果见表4和图2。表4显示共检出55种挥发性物质,包括14种醛类,10种醇类,10种酮类,8种酯类,5种酸类和3种单萜烯类,以及5种其他类。其中正己醇、2-甲基丁醇、己醛、糠醛、苯甲醛、戊醛、庚二烯醛、丙酮在先前陈皮GC-IMS分析中也被检出[20,22]。由表1和表4可知,GC-IMS与GC-MS检出的成分基本不重复,使得两者在分析挥发性化合物时能互为补充,这与文献报道一致[28]。其原因与2种方法的进样方式不同,以及GC-MS比GC-IMS具有更高的色谱柱温和检测器温度有关。结合图2进一步发现,所有样品均含有丰富的醛类化合物,游离态成分以醇类和酯类为主,酶水解的键合态成分以醇类为主,而酸水解的键合态成分以酮类和酸类为主,进一步证明游离态挥发性成分与键合态挥发性成分在组成上差异显著,且酸解较酶解更剧烈,醇类化合物在酸条件下可进一步氧化成酮、醛、酸类化合物。由图2可知,β-葡萄糖苷酶酶解生成的叔丁醇、正己醇、2-乙基己醇、苯甲醛、2-己烯醛、异戊酸甲酯、丁酸异丁酯、2,2,4,6,6-五甲基庚烷和玫瑰醚(方框标记)的含量显著高于果胶酶;且除异戊酸甲酯外,其他8种成分均在游离态成分中未检出;果胶酶酶解释放的化合物组成同空白类似,提示果胶酶不利于陈皮键合态挥发性成分的释放。综上所述,β-葡萄糖苷酶较果胶酶更利于陈皮键合态挥发性成分的释放,且水解条件较酸解温和,是释放陈皮键合态挥发性成分的较优选择。

图2 游离态挥发性化合物以及不同水解方式得到的键合态挥发性化合物的指纹图谱
Fig.2 Fingerprint spectra of free volatile compounds and bound volatile compounds obtained by different hydrolysis methods
表4 GC-IMS定性分析主要挥发性化合物
Table 4 Qualitative analysis of main volatile compounds by GC-IMS

序号化合物CAS分子式分子质量/Da保留指数保留时间/s迁移时间/ms醇类(10)1苯乙醇60-12-8C8H10O122.21 110832.6071.307 92叔丁醇75-65-0C4H10O74.1525.5121.6941.154 23正己醇111-27-3C6H14O102.2861.5373.6811.333 342-乙基己醇104-76-7C8H18O130.21 033.5685.6511.421 95顺-2-戊烯醇1576-95-0C5H10O86.1750.1248.0811.435 46仲丁醇78-92-2C4H10O74.1615.7158.3991.152 772-甲基丁醇137-32-6C5H12O88.1745.5243.7561.216 682-庚醇543-49-7C7H16O116.2897425.2041.369 192-己醇626-93-7C6H14O102.2822.2324.1761.280 4102,3-丁二醇513-85-9C4H10O290.1783.8282.3091.366 3醛类(14)11己醛66-25-1C6H12O100.2799.9299.1751.236 612糠醛98-01-1C5H4O296.1824.9327.4091.082 313庚二烯醛4313-03-5C7H10O110.21 003.4635.1371.187 914顺-6-壬烯醛2277-19-2C9H16O140.21 102.3816.5951.185 215苯甲醛单聚体100-52-7C7H6O106.1955.4532.5991.149 116苯甲醛二聚体100-52-7C7H6O106.1953.7529.191.457 517丁醛123-72-8C4H8O72.1597.5150.1991.114 1182-己烯醛505-57-7C6H10O98.1856.7367.2381.163 219戊醛110-62-3C5H10O86.1703.7207.71.169 320紫苏醛18031-40-8C10H14O2150.21 154.4932.1451.297 421香茅醛106-23-0C10H18O154.31 158.7942.3611.350 722庚烯醛单聚体18829-55-5C7H12O112.2956.1534.1061.251 723庚烯醛二聚体18829-55-5C7H12O112.2952.7527.1081.659 924异戊醛590-86-3C5H10O86.1653.9177.1051.188 3单萜烯类(3)25γ-萜品烯99-85-4C10H16136.21 057.2728.0671.215 826α-萜品烯单聚体99-86-5C10H16136.21 016.6656.7561.208 927α-萜品烯二聚体99-86-5C10H16136.21 016.9657.2981.728 5酯类(8)28乙基葫芦巴内酯698-10-2C7H10O3142.21 207.71 067.2091.268 629异戊酸甲酯556-24-1C6H12O2116.2766263.6211.209 230当归内酯591-12-8C5H6O298.1871.2386.9841.10531反式-2-己烯酸乙酯27829-72-7C8H14O2142.21 041.7700.0931.309 732丁酸丙酯105-66-8C7H14O2130.2896.4424.2051.267 533水杨酸甲酯119-36-8C8H8O3152.11 203.41 055.6291.217 934乙酸异丁酯110-19-0C6H12O2116.2762.3259.9821.232 135丁酸异丁酯539-90-2C8H16O2144.2953.9529.4261.338 4酮类(10)36酱油酮27538-09-6C7H10O3142.21 135.3887.9061.320 537异佛尔酮78-59-1C9H14O138.21 112.8838.6761.262 438樟脑/莰酮464-49-3C10H16O152.21 140.9900.671.349 4392-辛酮111-13-7C8H16O128.2991.5612.0151.335 940环己烯酮930-68-7C6H8O96.1910.9448.5961.096 141丙酮67-64-1C3H6O58.1510.7116.5361.11342乙基环戊烯醇酮21835-01-8C7H10O2126.21 122.6859.6441.187 443香芹酮99-49-0C10H14O150.21 228.41 124.8041.314 1443-辛酮106-68-3C8H16O128.2988.7605.6731.293 3452-甲基四氢呋喃-3-酮3188-00-9C5H8O2100.1805.9305.6911.071 5酸类(5)463-甲基戊酸105-43-1C6H12O2116.2944.9511.4671.274 247丁酸单聚体107-92-6C4H8O288.1797.1296.1611.168 248丁酸二聚体107-92-6C4H8O288.1820.4322.131.084 249甲基戊酸97-61-0C6H12O2116.21 031.2681.6051.255 450正己酸142-62-1C6H12O2116.2995.1620.8031.292 3其他类(5)511,2,4,5-四甲苯95-93-2C10H14134.21 128.8873.3411.211 5522,2,4,6,6-五甲基庚烷13475-82-6C12H26170.3989.4607.0961.04532-乙基呋喃3208-16-0C6H8O96.1698.5203.6311.05154麦芽酚118-71-8C6H6O3126.11 122.2858.9411.161 955玫瑰醚3033-23-6C10H18O154.31 106.2824.7261.363 4
3 结论与讨论
本文采用GC-MS和GC-IMS技术对陈皮中键合态挥发性化合物前体在β-葡萄糖苷酶、果胶酶、混合酶(β-葡萄糖苷酶与果胶酶)和酸4种条件下释放的键合态挥发性化合物进行比较分析。GC-MS分析显示,酶解条件下共检出35种陈皮键合态挥发性成分,其中β-葡萄糖苷酶与混合酶水解释放的化合物组成相似,以苯甲酸甲酯含量最高,其次为棕榈酸甲酯、辛酸甲酯等脂肪酸甲酯类化合物;果胶酶水解释放的化合物含量远低于β-葡萄糖苷酶与混合酶;酸解下共检出50种化合物,主要为萜烯结构的醛类、醇类。GC-IMS分析共检出55种挥发性成分,其中酶水解的键合态挥发性化合物以醛、醇类为主,而酸水解的键合态挥发性化合物以醛、酮、酸类为主,且果胶酶酶解释放的化合物组成同空白组类似。结合GC-MS和GC-IMS分析可知,对于陈皮样品,酸解较酶解条件剧烈,会引起水解产物进一步氧化成醛、酮、酸类化合物;果胶酶相比β-葡萄糖苷酶不利于陈皮键合态挥发性化合物的释放。综上所述,β-葡萄糖苷酶是释放陈皮键合态挥发性化合物的较优选择。
[1] 国家药典委员会. 中华人民共和国药典(一部)[M].北京:中国医药科技出版社, 2020.
Commission.Pharmacopoeia of People′s Republic of China[M].Beijing:China Medical Science Press, 2020.
[2] 梅全喜, 曾聪彦, 田素英, 等.陈皮、广陈皮、新会陈皮炮制历史沿革及现代研究进展[J].中药材, 2019, 42(12):2992-2996.
MEI Q X, ZENG C Y, TIAN S Y, et al.The history and modern research progress of the processing of Citri retriculatae pericarpium, Guang Tangerine peel and Xinhui Tangerine peel[J].Journal of Chinese Medicinal Materials, 2019, 42(12):2992-2996.
[3] YI L Z, DONG N P, LIU S, et al.Chemical features of Pericarpium Citri Reticulatae and Pericarpium Citri Reticulatae Viride revealed by GC- MS metabolomics analysis[J].Food Chemistry, 2015, 186:192-199.
[4] 欧小群, 王瑾, 李鹏, 等.广陈皮及其近缘品种挥发油成分的比较[J].中成药, 2015, 37(2):364-370.
OU X Q, WANG J, LI P, et al.Comparison among volatile oil compositions from tangerine peels and their kindreds[J].Chinese Traditional Patent Medicine, 2015, 37(2):364-370.
[5] 胡继藤, 赵志敏, 唐铁鑫, 等.不同贮藏年份新会陈皮中挥发性成分含量变化[J].中国实验方剂学杂志, 2014, 20(9):62-65.
HU J T, ZHAO Z M, TANG T X, et al.Content variation of volatile components in Xinhui Citrus reticulate ‘Chachi’ of different storage time[J].Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(9):62-65.
[6] 余祥英, 陈晓纯, 李玉婷, 等.不同产地和不同贮藏年限陈皮的化学成分研究进展[J].食品安全质量检测学报, 2020, 11(12):3809-3817.
YU X Y, CHEN X C, LI Y T, et al.Research progress on the chemical composition of Citri reticulatae of different regions and different storage time[J].Journal of Food Safety &Quality, 2020, 11(12):3809-3817.
[7] LIANG Z J, FANG Z X, PAI A, et al.Glycosidically bound aroma precursors in fruits:A comprehensive review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(1):215-243.
[8] 马亚琴, 张晨, 邓涂静, 等.水果及其加工产品中糖苷键合态香气物质的研究进展[J].食品与发酵工业, 2022, 48(6):290-298. MA Y Q, ZHANG C, DENG T J, et al.Research progress of glycoside bonded aroma compounds in fruits and their processed products[J].Food and Fermentation Industries, 2022, 48(6):290-298.
[9] RODR GUEZ-BENCOMO J J, CABRERA-VALIDO H M, PÉREZ-TRUJILLO J P, et al.Bound aroma compounds of Gual and Listán blanco grape varieties and their influence in the elaborated wines[J].Food Chemistry, 2011, 127(3):1153-1162.
GUEZ-BENCOMO J J, CABRERA-VALIDO H M, PÉREZ-TRUJILLO J P, et al.Bound aroma compounds of Gual and Listán blanco grape varieties and their influence in the elaborated wines[J].Food Chemistry, 2011, 127(3):1153-1162.
[10] SUN Y J, PENG W, ZENG L, et al.Using power ultrasound to release glycosidically bound volatiles from orange juice:A new method[J].Food Chemistry, 2021, 344:128580.
[11] YANG Z Y, BALDERMANN S, WATANABE N.Recent studies of the volatile compounds in tea[J].Food Research International, 2013, 53(2):585-599.
[12] 严寒静. 不同贮存时间广陈皮挥发油的成分分析[J].时珍国医国药, 2005, 16(3):218-219.
YAN H J.Component analysis on the volatile oils of Pericarpium Citri reticulatae stored for different years[J].Lishizhen Medicine and Materia Medica Research, 2005, 16(3):218-219.
[13] 陈亦欣, 陈虹吉, 叶兴乾, 等.酶解和酸解处理对杨梅汁键合态香气释放的影响[J].中国食品学报, 2021, 21(2):299-307.
CHEN Y X, CHEN H J, YE X Q, et al.Effect of enzymolysis and acidolysis on aroma release of Myrica rubra juice[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(2):299-307.
[14] CHEN X, QUEK S Y, FEDRIZZI B, et al.Characterization of free and glycosidically bound volatile compounds from tamarillo (Solanum betaceum Cav.) with considerations on hydrolysis strategies and incubation time[J].LWT-Food Science and Technology, 2020, 124:109178.
[15] 杨旖旎, 杨桂秋, 杨小洪, 等.老鹰茶游离和键合态挥发性成分的分析[J].食品与发酵工业, 2019, 45(3):254-260.
YANG Y N, YANG G Q, YANG X H, et al.Characterization of free and bound volatile compounds in Hawk Tea (Litsea coreana L.)[J].Food and Fermentation Industries, 2019, 45(3):254-260.
[16] 范刚. 柑橘及其加工制品中游离态和键合态挥发性物质的研究[D].武汉:华中农业大学, 2010.
FAN G.Study on free and bound volatile compounds in oranges and its processing products[D].Wuhan:Huazhong Agricultural University, 2010.
[17] YANG Y N, ZHENG F P, YU A N, et al.Changes of the free and bound volatile compounds in Rubus corchorifolius L.f.fruit during ripening[J].Food Chemistry, 2019, 287:232-240.
[18] 彭邦远. 刺梨果汁挥发性风味化合物组成及变化特性研究[D].贵州:贵州大学, 2018.
PENG B Y, Study on volatile flavor compounds and variation of Rosa roxburghii juice[D].Guizhou:Guizhou University, 2018.
[19] 梁淼, 杨艳, 石嘉悦, 等.酶/酸水解毛叶木姜子中键合态香味成分的比较[J].精细化工, 2020, 37(5):989-996.
LIANG M, YANG Y, SHI J Y, et al.Comparison of enzymatic and acid hydrolysis of bound aroma compounds in Litsea mollis Hemsl[J].Fine Chemicals, 2020, 37(5):989-996.
[20] 梁天一, 杨娟, 董浩, 等.基于GC-IMS技术鉴别不同年份新会陈皮中的挥发性风味物质[J].中国调味品, 2020, 45(4):168-173. LIANG T Y, YANG J, DONG H, et al.Identification of volatile flavor substances in Xinhui Tangerine peel in different years based on GC-IMS technology[J].China Condiment, 2020, 45(4):168-173.
[21] 余祥英, 陈晓纯, 李玉婷, 等.陈皮挥发油组成分析及其单体的抗氧化性研究[J].食品与发酵工业, 2021, 47(9):245-252. YU X Y, CHEN X C, LI Y T, et al.Chemical composition of volatile oil from Citri retriculatae pericarpium and its antioxidant activity analysis[J].Food and Fermentation Industries, 2021, 47(9):245-252.
[22] YU X Y, CHEN X C, LI Y T, et al.Effect of drying methods on volatile compounds of Citrus reticulata Ponkan and Chachi peels as characterized by GC-MS and GC-IMS[J].Foods, 2022, 11(17):2662.
[23] 孔慧娟. 六种水果中糖苷键合态香气成分的提取、分离与表征[D].杭州:浙江大学, 2016.
KONG H J, Studies on the extraction, isolation and identification of glycosidically bound aroma components in six kinds of fruits[D].Hangzhou:Zhejiang University, 2016.
[24] 张晨, 周佳, 马亚琴, 等.柑橘汁中游离态和键合态挥发性成分分析[J].食品与发酵工业, 2022, 48(17):256-264.
ZHANG C, ZHOU J, MA Y Q, et al.Analysis of free and bound volatile components in citrus juice[J].Food and Fermentation Industries, 2022, 48(17):256-264.
[25] TRIPATHI J, CHATTERJEE S, GAMRE S, et al.Analysis of free and bound aroma compounds of pomegranate (Punica granatum L.)[J].LWT-Food Science and Technology.2014, 59(1):461-466.
[26] ESSA H A, SALAMA M F.Effect of macerate enzymes on the yield, quality, volatile compounds and rheological property of prickly pear juice[J].Nahrung, 2002, 46(4):245-250.
[27] HAMPEL D, ROBINSON A L, JOHNSON A J, et al.Direct hydrolysis and analysis of glycosidically bound aroma compounds in grapes and wines:Comparison of hydrolysis conditions and sample preparation methods[J].Australian Journal of Grape and Wine Research, 2014, 20(3):361-377.
[28] FAN X J, JIAO X, LIU J G, et al.Characterizing the volatile compounds of different sorghum cultivars by both GC-MS and HS-GC-IMS[J].Food Research International, 2021, 140:109975.