糖尿病是以高血糖代谢为特征的代谢紊乱性疾病[1]。随着人民生活方式改善和营养水平的提高,糖尿病的患病率不断攀升并呈现年轻化趋势,其中以胰岛素低敏感性为特征的Ⅱ型糖尿病(diabetes mellitus type 2, T2DM)患者占95%,对人类健康造成很大的威胁[2],也极大增加了患病家庭经济负担,为社会经济带来巨大冲击。寻找安全、无毒副作用且能有效的预防和改善糖尿病的手段,是全球亟待解决的问题[3]。目前,除了许多预防和改善糖代谢紊乱的药物外,在研究天然活性产物改善糖尿病方面也取得了重要进展。
芦荟大黄素(aloe-emodin, AE)是一种食源性多酚,广泛存在于芦荟、大黄等植物中,具有抗癌、抗炎和抗氧化等多种生物学作用[4-5]。PÉREZ等[6]通过实验发现,AE可以调节糖尿病小鼠的血糖平衡,但具体作用机制尚不明确。
网络药理学可以通过系统生物学、生物信息学、多组学联用等多学科的理念,实现化合物-靶点-信号通路可视化分析,可在一定程度上揭示天然植物中各活性成分作用功效[7]。近年来,网络药理学被广泛应用于预测研究天然活性成分与疾病之间的作用机制。赵梦瑶等[8]通过网络药理学探讨金芪降糖片对T2DM的作用机制,结果表明金芪降糖片中的活性成分主要通过与蛋白激酶B1(serine/threonine-protein kinase-1, AKT1)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1, MAPK1)等多个靶点相互作用改善治疗T2DM,主要作用通路为胰岛素抵抗、脂质和动脉粥样硬化等。黄慧珍等[9]研究石斛在T2DM中的作用及相关分子机制,结果表明石斛可以通过调节氧化应激水平、改善胰岛素抵抗来治疗T2DM。
因此,本研究运用网络药理学研究了AE改善T2DM的作用机制,并结合分子对接技术进一步探究AE与靶点的结合机制,为AE作为糖尿病辅助治疗的新食品资源的开发提供了新的依据。
1 材料与方法
1.1 数据库和软件
数据库:TCMSP (http://lsp.nwu.edu.cn/)数据库、PharMapper (https://www.lilab-ecust.cn/pharmmapper)数据库、Uniprot数据库(https://www.uniprot.org)、DisGeNET(https://www.disgenet.org)数据库、GeneCards(https://www.genecards.org)数据库、OMIM(https://www.omim.org)数据库、DrugBank(https://www.drugbank.com/)数据库、RCSB PDB(http://www1.rcsb.org/)数据库。网络平台:STRING(https://www.string-db.org)平台、Metascape(https://www.omim.org)平台。软件:Cytoscape3.8.0;Autodock4.2.6、PyMOL1.5.0.3。
1.2 基于网络药理学挖掘AE和T2DM的共同靶点
通过TCMSP数据库和PharMapper数据库挖掘AE的潜在靶点,将2个数据库获得的靶点合并取去重,得到AE的潜在靶点。采用GeneCards和OMIM等数据库以“type 2 diabetes”、“T2DM”为关键词挖掘改善T2DM的靶点,将各个数据库挖掘出的靶点合并去重得出改善治疗T2DM的靶点基因。将上述获得的AE的潜在靶点和T2DM的靶点基因置入Venny2.1.0平台取交集,即得到AE改善治疗T2DM的潜在靶点。
1.3 潜在靶点的蛋白相互作用分析
将AE与T2DM的共同靶点置入STRING11.0平台进行蛋白质-蛋白质相互作用分析(PPI网络)[10],参数设置为“Homo sapiens”、“HIGH confidence(0.7)”,其余参数选择默认参数[11]。利用Cytoscape3.8.0软件中的CytoNCA插件对PPI网络进一步拓扑分析,并设置2倍中位数为最低阈值筛选核心靶点。
1.4 共同靶点基因功能与通路富集分析
将AE与T2DM的共同靶点通过Metascape数据库进行GO功能注释及KEGG通路富集分析。输入物种与分析物种均设置为“H.sapiens”(“智人”),设置参数P<0.01进行操作筛选其主要注释数据,通过微生信平台和Origin2018对结果进行可视化分析。
1.5 “AE-T2DM-通路”网络构建
将AE和T2DM的共同靶点及KEGG通路富集分析所得到的主要通路导入Cytoscape3.8.0软件,构建“AE-T2DM-通路”网络。
1.6 AE与关键靶点的分子对接验证
为了探究AE与核心靶点结合能和结合方式,将分析后的AE-T2DM-通路网络图中按Degree值进行排序,并取排名前5的关键靶点进行分子对接。分别从TCMSP和RCSB PDB数据库中获得AE和关键靶点的分子结构,通过PyMOL软件对靶点的蛋白进行预处理,Autodock用于分子对接操作,之后取能量最低的结果通过PyMOL对结合位点进行可视化分析。
2 结果与分析
2.1 AE和T2DM共同靶点的筛选
通过TCMSP数据库检索出AE的潜在靶点86个,通过PharMapper数据库挖掘出AE的潜在靶点116个,将二者合并去重,获得AE的潜在靶点127个。通过GeneCards等4个数据库检索T2DM的相关治疗靶点并合并去重后,获得改善治疗T2DM的相关靶点1830个。将AE的潜在作用靶点与改善治疗T2DM的相关靶点取交集,得到63个共同靶点,即为AE改善治疗T2DM的潜在靶点,并通过Venny2.1.0平台绘制韦恩图(图1)。
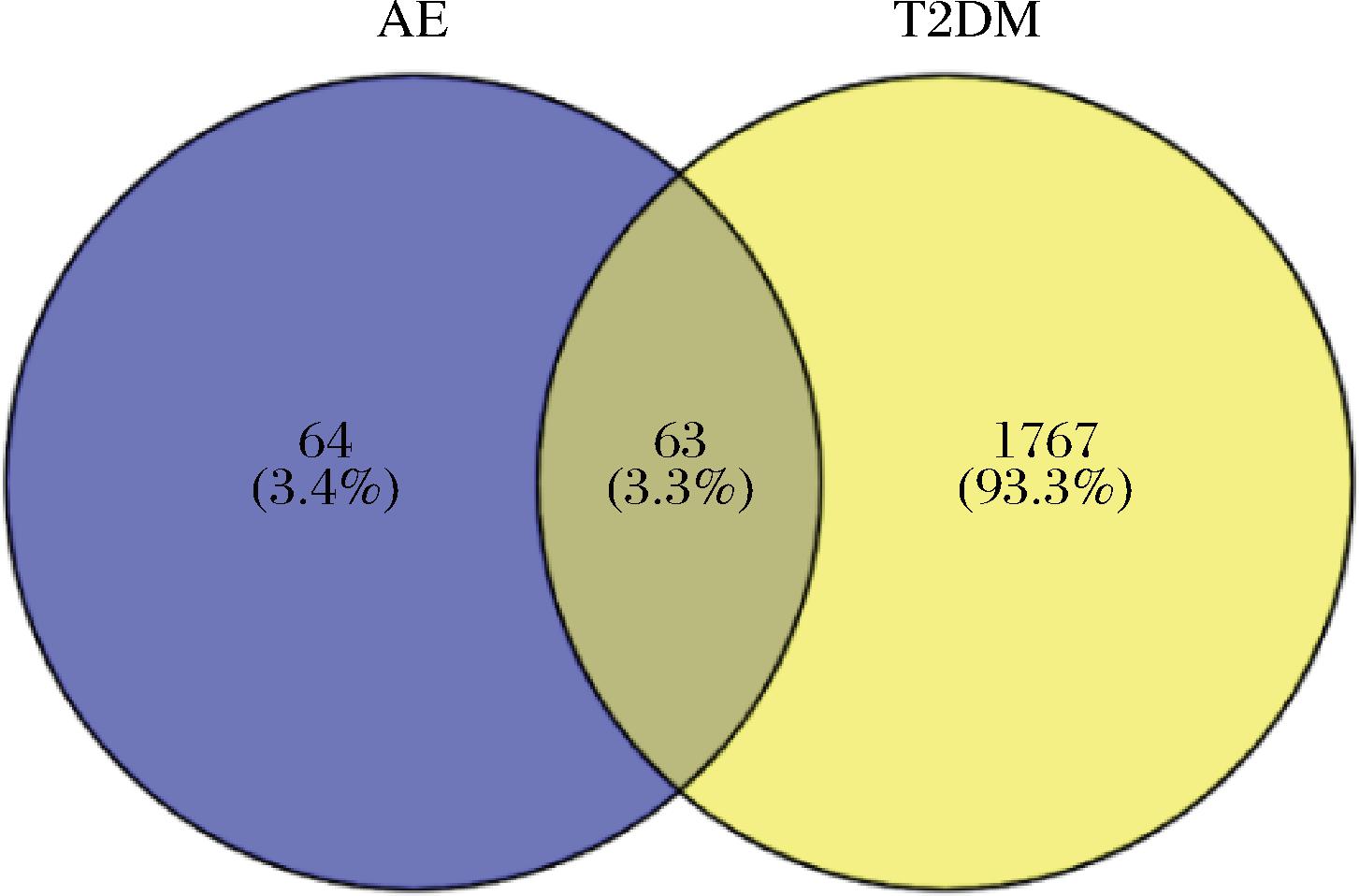
图1 AE与T2DM共同靶点韦恩图
Fig.1 Venn diagram of common targets of AE and T2DM
2.2 潜在靶点的蛋白相互作用分析
为了进一步研究AE对T2DM的作用机制,将筛选出改善治疗T2DM的潜在靶点导入STRING平台,并将分析结果保存为string-interaction.Tsv格式文件,将此文件导入Cytoscape3.8.0软件构建PPI网络,结果如图2所示。图中线代表蛋白之间相互作用关系,绿色的圆形代表靶点,PPI网络中共含有63个节点,575条边,平均节点数为17.7。利用CytoNCA插件对PPI网络进行拓扑分析,并设置2倍中位数为最低阈值对靶点进行筛选,筛选出22个核心靶点。
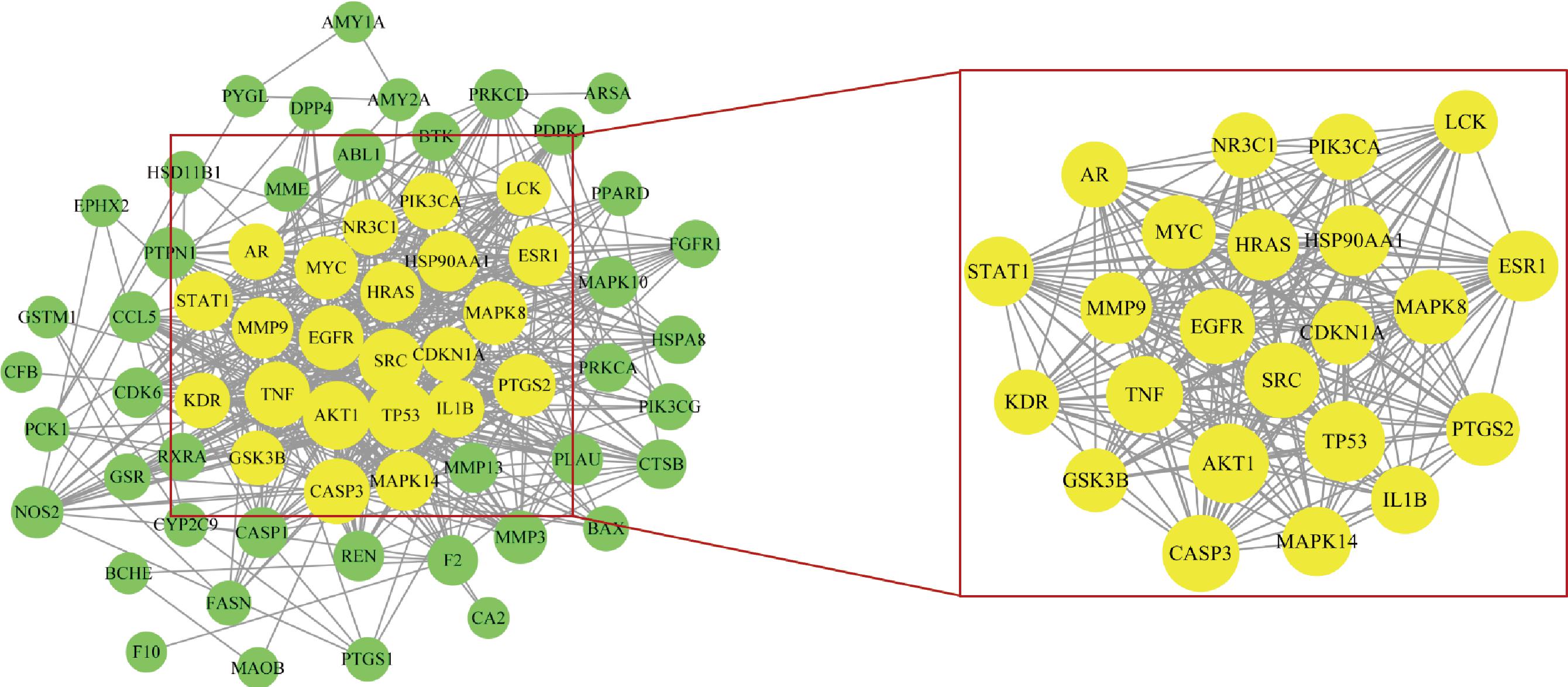
图2 AE与T2DM共同靶点韦恩图
Fig.2 Venn diagram of common targets of AE and T2DM
核心靶点的网络节点特征参数信息如表1所示。
表1 核心靶点网络节点特征参数
Tab.1 Core target network node characteristics parameters

基因名称节点度中心度紧密度AKT145314.70.744 186CASP344304.671 30.711 111TP5340252.967 20.752 941SRC38136.922 40.695 652EGFR38134.509 90.695 652MAPK837107.799 40.673 684MYC36107.9940.666 667PTGS235173.790 80.666 667MMP933141.690.653 061ESR13247.180 790.633 663HSP90AA13277.170 340.64HRAS3269.153 230.646 465STAT13046.319 980.615 385MAPK143097.951 20.609 524IL1B2896.850 980.609 524PIK3CA2649.192 870.603 774AR2571.046 850.592 593KDR2416.398 010.576 577NR3C12488.427 730.592 593CDKN1A2320.789 460.576 577LCK2214.916 60.566 372GSK3β2251.834 050.576 577
在22个核心靶点中,AKT1节点度最高。AKT1属于丝氨酸/苏氨酸激酶家族[12],是磷脂酰肌醇3激酶/蛋白激酶B信号通路(PI3K/AKT)的关键靶点之一,通路的上游靶点可使AKT1聚集到细胞膜上,使之被磷酸化,磷酸化的AKT1进一步激活下游靶点(糖转运蛋白),从而调控葡萄糖的转运[13]。除了改善胰岛素抵抗,维持胰岛β细胞的正常生长和功能状态、保证胰岛素的正常分泌对改善治疗T2DM至关重要[14]。蛋白糖化终末产物(advanced glycation end products, AGEs)水平过高会对影响胰岛β细胞的功能,诱导胰岛β细胞凋亡,导致胰岛素分泌不足[15]。胱天蛋白酶3(caspase-3, CASP3)是一种终端剪切酶,在细胞凋亡过程中发挥主要作用,减少CASP3的表达,可以减少胰岛β细胞的凋亡,维持胰岛β细胞正常的功能状态,从而改善胰岛素抵抗[16]。基质金属蛋白酶-9(matrix metalloprotein, MMP-9)可以降解和重塑细胞外基质的动态平衡、参与炎症反应等过程,属于基质金属蛋白酶的一种。MMP-9可以改善胰岛的血管化,通过重塑基质调节趋化因子和生长因子的可用性,从而维持胰岛的正常功能[17]。MMP-9的活性受到抑制会增加淀粉样蛋白沉积并导致胰岛β细胞凋亡[18]。研究表明,成年小鼠中MMP-9的缺失会损伤胰岛β细胞的功能,并导致胰岛血管被破坏,这也证明了MMP-9发挥基质重塑的重要性[19]。糖原合成激酶-3β(gycogen synthase kinase-3, GSK3β)是糖原合成过程中的关键限速酶,可以促进糖原的合成,还能抑制胰岛素的敏感性,GSK3β的过度表达会导致胰岛素抵抗[20]。丝裂原蛋白活化激酶8(MAPK8)属于MAPK家族成员,可以调节生物过程以响应包括胰岛素信号在内的各种细胞信号[21]。研究表明,MAPK8可通过介导肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)诱导胰岛素抵抗[22]。表皮生长因子受体(epidermal growth factor receptor, EGFR)的生理功能是调节上皮组织的发育和体内平衡[23]。研究表明,EGFR阻断可降低全身氧化应激,增加胰岛素敏感性,改善胰岛素抵抗[24]。
2.3 GO功能注释和KEGG通路富集分析
为了进一步探究AE改善T2DM的具体作用机制,通过Metascape平台对AE改善T2DM的靶点进行GO功能注释和KEGG通路富集分析(P<0.01)。根据P值大小筛选出20条GO注释及KEGG通路,利用条形图和气泡图对结果进行可视化分析。气泡图中气泡的颜色越深表示该通路富集的靶点越多,气泡越大说明P值越小。
GO分析包括生物过程(biological process,BP)、分子功能(molecular function, MF)、细胞组分(cellular component, CC)3部分,GO富集共得到1 495条记录,其中BP有1 281条,MF有150条,CC有66条,分别占比85.7%、10.0%和4.3%。前20条GO富集分析结果如图3所示。GO-BP中靶点主要集中在对类固醇激素的反应、细胞对激素刺激的反应、对脂多糖的反应、活性氧代谢过程的调控等生物过程。GO-MF靶点主要集中在磷酸转移酶活力;蛋白激酶活力、激酶活力、蛋白丝氨酸/苏氨酸激酶活力、蛋白丝氨酸激酶活力等分子功能。GO-CC主要涉及囊腔、细胞质核周区、细胞质囊腔、膜筏等细胞组分。

A-GO-BP;B-GO-MF;C-GO-CC
图3 GO富集分析
Fig.3 GO enrichment analysis
注:左列为气泡图;右列为条形图。
甲状腺激素是葡萄糖稳态的重要决定因素,LAMBADIARI等[25]通过研究发现甲状腺激素水平升高会损害胰岛素支持肝脏葡萄糖生成和增加肌肉中葡萄糖含量的能力,甚至诱发胰岛素抵抗。催乳素是一种由垂体前叶分泌的多肽激素,负责女性的泌乳以及男性和女性的生殖、代谢、行为和免疫功能[26]。新的研究表明,催乳素在调节葡萄糖代谢中具有潜在的作用,它通过胰腺β-细胞上的特定催乳素受体刺激胰岛素分泌[27]。研究表明,类固醇激素可通过多种机制诱导高血糖[28],类固醇可以干扰肌肉细胞中的信号级联反应,导致胰岛素介导的葡萄糖摄取和糖原合成减少[29],类固醇还可以诱导脂肪分解和蛋白质分解,增强胰高血糖素和肾上腺素等反调节激素的作用,并通过核过氧化物酶体增殖物激活受体诱导胰岛素抵抗[30]。内源性性激素水平与T2DM存在联系,女性雄激素分泌过多和男性雄激素分泌过少与胰岛素抵抗相关[31],性激素属于类固醇激素的一种,也再次证明了类固醇激素的改变可能在T2DM的发病机制中发挥作用。β细胞急性暴露于高葡萄糖浓度刺激胰岛素基因表达,慢性高血糖会增加活性氧的产生,高血糖和高浓度的ROS会使β细胞功能恶化,胰岛素抵抗增加,导致T2DM加重[32]。脂多糖属于一种内毒素,通过与Toll样受体(toll-like receptor, TLR4)结合,激活蛋白丝氨酸/苏氨酸激酶活性,之后刺激与炎症反应相关的信号因子,脂多糖水平的失调会导致胰岛素抵抗,引发T2DM[33]。
对AE进行的KEGG通路富集结果,根据P<0.01,筛选出164条与T2DM相关的信号通路。根据Degree值筛选出靶点主要涉及与T2DM相关的20条信号通路如图4所示。其中包括癌症通路、脂质和动脉粥样硬化、PI3K-Akt信号通路、MAPK信号通路、糖尿病并发症中的AGE-RAGE信号通路和胰岛素抵抗等信号通路。
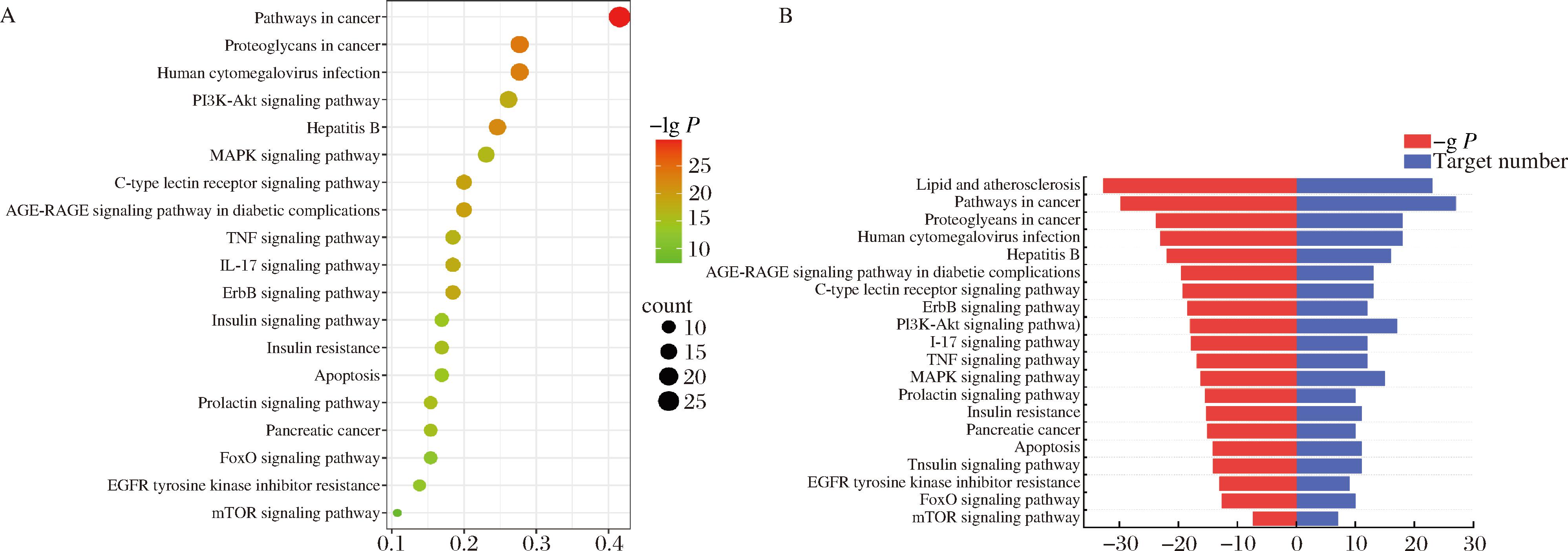
A-气泡图;B-条形图
图4 KEGG通路富集分析
Fig.4 KEGG pathway enrichment analysis
PI3K-AKT信号在细胞生理中发挥核心作用,在机体生长和关键细胞过程中介导生长因子信号,活化的PI3K-Akt信号通路也被证明可以增加胰岛素敏感性,调节糖脂代谢,保护血管内皮[34]。PI3K、GSK-3β、AKT1、糖转运蛋白(glucose linked transporter, GLUT4)和叉头蛋白(forkhead box, FoxO)均为PI3K-Akt信号通路上的靶点。PI3K可将PIP2转化为PIP3,进一步使AKT聚集到细胞膜上使之被磷酸化,磷酸化的AKT通过调节GSK-3促进糖原的合成,也可直接抑制FoxO1,从而降低体内葡萄糖的水平[35]。AGEs是糖尿病和炎症灶中积累的非酶糖基化和蛋白质和脂质氧化的产物,晚期糖基化终产物(the receptor of advanced glycation end products, RAGE)是AGEs的信号转导受体,AGEs主要通过RAGE激活引起细胞应激的信号机制,导致细胞功能障碍,损害靶器官,导致糖尿病并发症[36],通过减少AGEs的积累可以改善T2DM所引发的并发症。白细胞介素17(interleukin 17, IL-17)是由T辅助型17细胞(Th17)分泌的一种炎症因子,研究表明,IL-17的产生失调可导致促炎细胞因子的过度表达和慢性炎症,这些因子参与诱导胰岛素抵抗,会导致T2DM的发生[37]。雷帕霉素靶点(mammalian target of rapamycin, mTOR)是一种丝氨酸/苏氨酸激酶,控制着广泛的细胞过程,包括细胞生长、分化和代谢,mTOR通过调节生长因子受体结合蛋白10(growth factor receptor bound protein, Grb10)、胰岛素受体底物(insulin receptor substrate-1, IRS-1)、胰岛素受体(insulin receptor, IR)等下游组分来控制胰岛素信号传导[38]。EGFR是上皮生长因子细胞增殖和信号传导的受体,研究表明,阻断EGFR的信号通路可增加循环中的脂联素水平,从而提高胰岛素敏感性,此外,EGFR阻断也可能通过增加胰岛自噬活性,从而保护胰腺β细胞功能并随后改善代谢状态。
2.4 AE-T2DM-通路网络构建
将上述筛选的涉及T2DM的主要通路、靶点以及AE运用Cytoscape软件构建AE-靶点-通路网络图,将靶点和通路进一步可视化,如图5所示。绿色的倒三角表示通路,紫色的菱形代表富集在通路上的靶点,倒三角越大,说明富集在该通路上的靶点越多;菱形越大,说明该靶点所参与的通路越多。利用Network Analyzer插件对网络进行分析,其中连接度最高的5个靶点为AKT1、PIK3CA、HRAS、MAPK10和MAPK8,这是AE在通路中发挥作用的关键靶点。

图5 AE-靶点-通路网络
Fig.5 AE-Target-Pathway network
2.5 分子对接分析
为了进一步研究AE与通路中关键靶点之间的作用方式,利用Autodock4.2.6和PyMOL1.5.0.3软件分别对AE和AKT1、PIK3CA、HRAS、MAPK10和MAPK8进行分子对接,结合能小于-5.0 kcal/mol表明小分子与大分子之间有较好的结合活性,小于-7.0 kcal/mol说明小分子与大分子之间有强烈的结合活性。
AE与AKT1的对接能量为-8.26 kcal/mol,二者具有强烈的结合能力,对接结果如图6-A所示。结果显示AE对接在AKT1的活性位点附近,被Gln203、Ser205、Asn204、Leu210、Ala212、Thr211、Trp80、Val270和Lys268等氨基酸残基包围,并于Gln203、Ser205、Asn204和Thr211等氨基酸残基形成了4条氢键,并与TPR等芳香族氨基酸残基发生了π-π堆积,进而影响了AKT1在通路中的作用,从而达到改善T2DM的目的。AE与PIK3CA的对接能量为-7.28 kcal/mol,二者具有强烈的结合能力,其对接结果如图6-B所示。AE被Pro458、Cys604、Gly363、Ile459、Lys640、Thr462、Arg683、Gln643和Glu642等氨基酸残基包围,并与Ile459、Lys640和Thr462形成了3条氢键,与Gly363、Glu642、Pro458、Typ641和Val461等氨基酸残基形成了范德华力。AE与HRHS的对接能量为-6.38 kcal/mol,二者具有较好的结合能力,其对接结果如图6-C所示。AE结合到HRHS的结合腔中,被His2023、Tyr2021、Csx2113、Leu2036、Asn2112、Asp2111和Ala2058等氨基酸残基包围,并与结合位点处的氨基酸残基形成多种分子间作用力,与His2023、Asp2111、Csx2113、Cys2113和Asn2112等氨基酸残基形成了7条氢键,并于Ala2058、Leu2036发生了π-堆积,进一步稳定了AE于HRHS的结合作用。AE与MAPK8的对接能量为-6.55 kcal/mol,二者具有较好的结合能力,其对接结果如图6-D所示。AE被Arg69、Asn156、Ser155、Lys153、Tyr185、Ala36和Ser34等氨基酸残基包围,与Arg69、Asn156和Ser155形成3条氢键,同时与Lys153、Tyr185、Val187和Ala36等氨基酸残基发生了多种π-π相互作用。AE与MAPK10的对接能量为-6.88 kcal/mol,二者具有较好的结合能力,其对接结果如图6-E所示。AE结合到MAPK10的疏水结合腔中,与Arg266、Arg227和Gly265形成3条氢键,与Pro222、Tyr223、Thr221和Tyr268产生了范德华力,同时与Val224和Asp267产生了π-π相互作用。由对接结果可知AE主要通过氢键和范德华力与靶点结合,并辅之以多种π-π相互作用进一步稳定与结合位点处氨基酸残基的结合能力,从而影响靶点在各个通路中的作用,达到改善T2DM的目的。
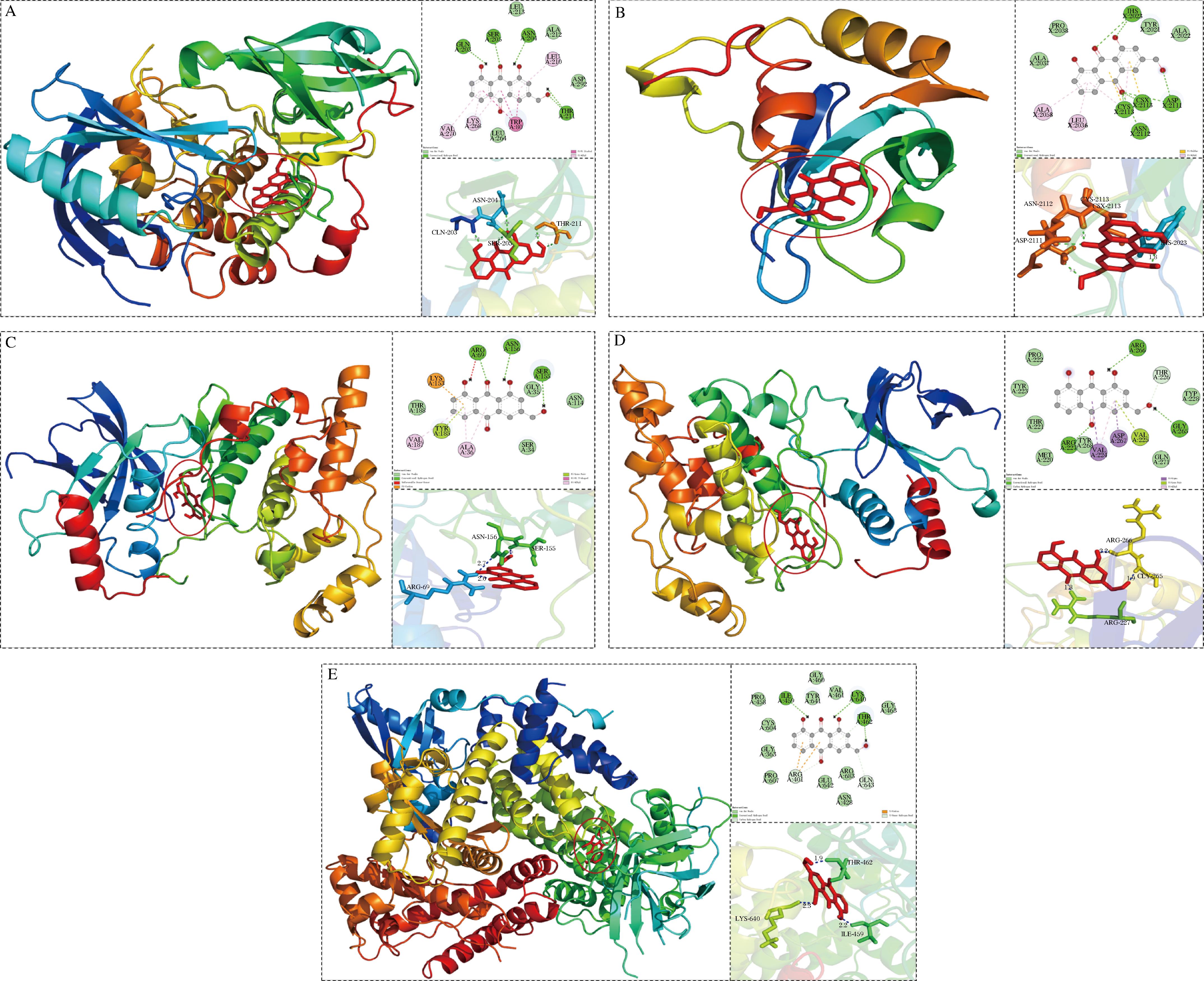
A-AKT1;B-PIK3CA;C-HRAS;D-MAPK8;E-MAPK10
图6 AE与关键靶点的分子对接
Fig.6 Results of molecular docking of AE to core targets
3 结论
本文通过网络药理学结合分子对接技术研究了AE改善T2DM作用方式。通过多个数据库筛选出AE的潜在靶点127个,改善治疗T2DM的相关靶点1 830个,将二者取交集,共获得63个靶点,交集靶点即为AE改善治疗T2DM的潜在靶点。根据KEGG通路富集分析,发现这些靶点主要富集在PI3K-Akt信号通路、AGE-RAGE信号通路、EGFR信号通路、MAPK信号通路等通路;根据Degree值筛选出AE-靶点-通路网络中连接度最高的5个靶点,分别为AKT1、PIK3CA、HRAS、MAPK10和MAPK8,这是AE发挥作用改善T2DM的关键靶点;通过分子对接发现AE主要通过氢键和范德华力与靶点蛋白结合,从而影响靶点在通路中的作用,达到改善T2DM的目的。总之,本研究揭示了AE改善T2DM的潜在作用靶点和作用机制,为以AE作为糖尿病辅助治疗的新食品资源的开发提供了新的依据。
[1] NAEMI R, SHAHMORADI L.Global experience of diabetes registries:A systematic review[J].Advances in Experimental Medicine and Biology, 2021, 1307:441-455.
[2] 杨玉洁, 刘静宜, 谭艳, 等.多糖降血糖活性构效关系及作用机制研究进展[J].食品科学, 2021, 42(23):355-363.
YANG Y J, LIU J Y, TAN Y, et al.Progress in understanding the structure-activity relationship and hypoglycemic mechanism of polysaccharides[J].Food Science, 2021, 42(23):355-363.
[3] GRUNBERGER G.Should side effects influence the selection of antidiabetic therapies in type 2 diabetes?[J].Current Diabetes Reports, 2017, 17(4):21.
[4] XIAN M H, CAI J L, ZHENG K N, et al.Aloe-emodin prevents nerve injury and neuroinflammation caused by ischemic stroke via the PI3K/AKT/mTOR and NF-κB pathway[J].Food and Function, 2021, 12(17):8056-8067.
[5] ABDELLATEF A A, FATHY M, MOHAMMED A E S I, et al.Inhibition of cell-intrinsic NF-κB activity and metastatic abilities of breast cancer by aloe-emodin and emodic-acid isolated from Asphodelus microcarpus[J].Journal of Natural Medicines, 2021, 75(4):840-853.
[6] PÉREZ Y Y, JIMÉNEZ-FERRER E, ZAMILPA A, et al.Effect of a polyphenol-rich extract from aloe vera gel on experimentally induced insulin resistance in mice[J].The American Journal of Chinese Medicine, 2007, 35(6):1037-1046.
[7] 丁浩轩, 赵阳, 冯杰.基于网络药理学探讨植物提取物在饲料添加剂领域的研究进展[J].动物营养学报, 2021, 33(6):3065-3071. DING H X, ZHAO Y, FENG J.Research progress on discussion of plant extracts in field of feed additives based on network pharmacology[J].Chinese Journal of Animal Nutrition, 2021, 33(6):3065-3071.
[8] 赵梦瑶, 潘芊钰, 曹颖.基于网络药理学探究金芪降糖片治疗2型糖尿病作用机制[J].中国医药科学, 2023, 13(5):45-48;56.
ZHAO M Y, PAN Q Y, CAO Y.Exploring the mechanism of jinqi Jiangtang Tablets in the treatment of type 2 diabetes mellitus based on network pharmacology[J].China Medicine, 2023, 13(5):45-48;56.
[9] 黄慧珍, 王松松, 林凡, 等.基于网络药理学探讨石斛治疗2型糖尿病的作用机制[J].世界中医药, 2022, 17(19):2718-2722. HUANG H Z, WANG S S, LIN F, et al.Mechanism of dendrobii caulis in treatment of type 2 diabetes based on network pharmacology[J].World Chinese Medicine, 2022, 17(19):2718-2722.
[10] SZKLARCZYK D, GABLE A L, LYON D, et al.STRING v11:Protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J].Nucleic Acids Research, 2018, 47(D1):D607-D613.
[11] ZHENG S C, BAAK J P, LI S, et al.Network pharmacology analysis of the therapeutic mechanisms of the traditional Chinese herbal formula Lian Hua Qing Wen in Corona virus disease 2019 (COVID-19), gives fundamental support to the clinical use of LHQW[J].Phytomedicine, 2020, 79:153336.
[12] 李佳芸, 王欣之, 韦源青, 等.基于网络药理学与分子对接研究马氏珍珠贝降糖活性肽[J].食品与发酵工业, 2022, 48(15):176-184.
LI J Y, WANG X Z, WEI Y Q, et al.Screening of potential anti-diabetic peptides from Pinctada martensii flesh based on network pharmacology and molecular docking techniques[J].Food and Fermentation Industries, 2022, 48(15):176-184.
[13] 董硕, 汤春波.PI3K/AKT信号通路在2型糖尿病患者种植体骨结合中作用机制的研究进展[J].口腔医学, 2022, 42(11):1026-1030;1035.
DONG S, TANG C B.Progress of research on the mechanism of PI3K/AKT signaling pathway in implant osseointegration in patients with type 2 diabetes mellitus[J].Stomatology, 2022, 42(11):1026-1030;1035.
[14] TOMITA T.Apoptosis in pancreatic β-islet cells in type 2 diabetes[J].Bosnian Journal of Basic Medical Sciences, 2016, 16(3):162-179.
[15] JUD P, SOURIJ H.Therapeutic options to reduce advanced glycation end products in patients with diabetes mellitus:A review[J].Diabetes Research and Clinical Practice, 2019, 148:54-63.
[16] HAYES H L, PETERSON B S, HALDEMAN J M, et al.Delayed apoptosis allows islet β-cells to implement an autophagic mechanism to promote cell survival[J].PLoS One, 2017, 12(2):e0172567.
[17] MIETTINEN P J, HUOTARI M A, KOIVISTO T, et al.Impaired migration and delayed differentiation of pancreatic islet cells in mice lacking EGF-receptors[J].Development, 2000, 127(12):2617-2627.
[18] MEIER D T, TU L H, ZRAIKA S, et al.Matrix metalloproteinase-9 protects islets from amyloid-induced toxicity[J].The Journal of Biological Chemistry, 2015, 290(51):30475-30485.
[19] NAGY V, BOZDAGI O, MATYNIA A, et al.Matrix metalloproteinase-9 is required for hippocampal late-phase long-term potentiation and memory[J].The Journal of Neuroscience, 2006, 26(7):1923-1934.
[20] WAGMAN A S, JOHNSON K W, BUSSIERE D E.Discovery and development of GSK3 inhibitors for the treatment of type 2 diabetes[J].Current Pharmaceutical Design, 2004, 10(10):1105-1137.
[21] BADER G D, BETEL D, HOGUE C W V.BIND:The biomolecular interaction network database[J].Nucleic Acids Research, 2003, 31(1):248-250.
[22] BELLINGER D A, MERRICKS E P, NICHOLS T C.Swine models of type 2 diabetes mellitus:Insulin resistance, glucose tolerance, and cardiovascular complications[J].ILAR Journal, 2006, 47(3):243-258.
[23] SIGISMUND S, AVANZATO D, LANZETTI L.Emerging functions of the EGFR in cancer[J].Molecular Oncology, 2018, 12(1):3-20.
[24] LI Z L, LI Y, OVERSTREET J M, et al.Inhibition of epidermal growth factor receptor activation is associated with improved diabetic nephropathy and insulin resistance in type 2 diabetes[J].Diabetes, 2018, 67(9):1847-1857.
[25] LAMBADIARI V, MITROU P, MARATOU E, et al.Thyroid hormones are positively associated with insulin resistance early in the development of type 2 diabetes[J].Endocrine, 2011, 39(1):28-32.
[26] AL-KURAISHY H M, AL-GAREEB A I, AWAD M S, et al.Assessment of serum prolactin levels in acute myocardial infarction:The role of pharmacotherapy[J].Indian Journal of Endocrinology and Metabolism, 2016, 20(1):72-79.
[27] RASHEED H A, AL-KURAISHY H M, AL-GAREEB A I, et al.Effects of diabetic pharmacotherapy on prolactin hormone in patients with type 2 diabetes mellitus:Bane or boon[J].Journal of Advanced Pharmaceutical Technology &Research, 2019, 10(4):163-168.
[28] TIWARI A, AL-ROBEH H, SHARMA H, et al.Steroid-induced diabetic ketoacidosis in a patient with type 2 diabetes mellitus[J].AACE Clinical Case Reports, 2018, 4(2):131-133.
[29] SHAH P, KALRA S, YADAV Y, et al.Management of glucocorticoid-induced hyperglycemia[J].Diabetes, Metabolic Syndrome and Obesity:Targets and Therapy, 2022, 15:1577-1588.
[30] CLORE J N, THURBY-HAY L.Glucocorticoid-induced hyperglycemia[J].Endocrine Practice: Official Journal of the American College of Endocrinology and the American Association of Clinical Endocrinologists, 2009, 15(5):469-474.
[31] LE T N, NESTLER J E, STRAUSS J F, et al.Sex hormone-binding globulin and type 2 diabetes mellitus[J].Trends in Endocrinology and Metabolism, 2012, 23(1):32-40.
[32] ELKSNIS A, MARTINELL M, ERIKSSON O, et al.Heterogeneity of metabolic defects in type 2 diabetes and its relation to reactive oxygen species and alterations in beta-cell mass[J].Frontiers in Physiology, 2019, 10:107.
[33] KHONDKARYAN L, MARGARYAN S, POGHOSYAN D, et al.Impaired inflammatory response to LPS in type 2 diabetes mellitus[J].International Journal of Inflammation, 2018, 2018:2157434.
[34] GAO J R, QIN X J, FANG Z H, et al.To explore the pathogenesis of vascular lesion of type 2 diabetes mellitus based on the PI3K/Akt signaling pathway[J].Journal of Diabetes Research, 2019, 2019:4650906.
[35] HUANG X J, LIU G H, GUO J, et al.The PI3K/AKT pathway in obesity and type 2 diabetes[J].International Journal of Biological Sciences, 2018, 14(11):1483-1496.
[36] ABDEL-MONEIM A, BAKERY H H, ALLAM G.The potential pathogenic role of IL-17/Th17 cells in both type 1 and type 2 diabetes mellitus[J].Biomedicine and Pharmacotherapy, 2018, 101:287-292.
[37] YOON M S.The role of mammalian target of rapamycin (mTOR) in insulin signaling[J].Nutrients, 2017, 9(11):1176.
[38] CUI W, XU B, CHEN F, et al. Effects of grape peel phenolics on lipid accumulation in sodium palmitate-treated HepG2 cells[J]. Journal of Functional Foods, 2024, 112: 105923.