苹果酸-乳酸发酵(malolactic fermentation,MLF)是优质红葡萄酒酿造中重要的生物过程,这一阶段L-苹果酸脱羧生成L-乳酸、CO2及其他副产物,降低酸度的同时避免腐败微生物的侵害,同时提高葡萄酒风味复杂性[1]。MLF往往由乳酸菌主导,包括酒球菌属(Oenococcus)、乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、明串珠菌属(Leuconostoc)和魏斯式菌属(Weissella)[2]。作为当前葡萄酒市场中最广泛使用的菌株,酒酒球菌对葡萄酒生境有很强的耐受能力,能够在高酸(pH 3.0~3.5)[3]、高乙醇(14%)(体积分数)、高SO2条件下生存[4]。其在发酵期间稳定的生物量也有利于糖苷酶、柠檬酸裂解酶等的释放,后者能够从丙酮酸中产生更多的双乙酰,低浓度下能赋予葡萄酒典型的黄油特征[5]。然而酒酒球菌发酵时间长、能量消耗大的问题也为其进一步商业化应用造成了一定阻碍[6]。近年来,植物乳杆菌由于其优良产香能力及较短的发酵周期等优势受到了广泛关注[4-7],G-ALEGR A等[8]和BRAVO-FERRADA等[9]在不同葡萄酒中筛选出的多株植物乳杆菌具有与酒酒球菌相似的胁迫耐受能力,可在pH 3.2的乳酸菌驯化培养基(lactic acid bacteria acclimation medium, MLO培养基)或添加了14%乙醇的MRS培养基中生长。同时,与酒酒球菌相比,植物乳杆菌的营养需求更低,大部分菌株均具有酯酶基因,而通常不会分泌产生葡萄酒中常见胺类的酶[10],降低了葡萄酒生物胺过量的风险。
A等[8]和BRAVO-FERRADA等[9]在不同葡萄酒中筛选出的多株植物乳杆菌具有与酒酒球菌相似的胁迫耐受能力,可在pH 3.2的乳酸菌驯化培养基(lactic acid bacteria acclimation medium, MLO培养基)或添加了14%乙醇的MRS培养基中生长。同时,与酒酒球菌相比,植物乳杆菌的营养需求更低,大部分菌株均具有酯酶基因,而通常不会分泌产生葡萄酒中常见胺类的酶[10],降低了葡萄酒生物胺过量的风险。
目前国内大部分酒庄仍采用单一菌株发酵剂进行MLF,导致了葡萄酒同质化,无法体现本土产区的典型性,难以满足市场的高品质需求。混菌发酵能够结合不同菌株优势产生更丰富的香气,增加葡萄酒差异性和复杂性。BRIZUELA等[11]使用酒酒球菌和植物乳杆菌共发酵改变了葡萄酒香气特征,显著增加了苯甲醇和琥珀酸二乙酯的含量,ZHANG等[12]在桑葚酒中也发现两菌株的共发酵能够获得更高的芳香酯含量,调节酒样的感官表现,因此进一步探究共发酵接种顺序对葡萄酒感官的影响十分必要。此外,菌株的自身发酵特性也影响着葡萄酒的香气特征[13],广泛使用的商业菌株可能导致葡萄酒风格的同质化,因此使用本土优良菌株发酵剂对于葡萄酒区域特色的塑造十分重要[11]。本课题组前期研究已筛选出一株能够高效降酸的植物乳杆菌XJ25,其对提升葡萄酒香气有积极作用,课题组保藏的酒酒球菌SD2a也具有良好的乙醇耐受能力,因此,进一步探究酒酒球菌和植物乳杆菌共发酵时的接种策略及发酵性能对MLF和葡萄酒香气的影响具有一定的引导意义。接种顺序的改变,实际上改变了菌株的生态位,影响了菌株的碳源利用率[14]。进一步探究酒酒球菌和植物乳杆菌在葡萄酒中共发酵时的接种策略及发酵性能对葡萄酒香气的影响具有一定的引导意义。
赤霞珠(Cabernet Sauvignon, CS)具有悠久的种植历史,是目前最为优良的酿酒葡萄品种之一[15];蛇龙珠(Cabernet Gernischt, CG)作为赤霞珠的姊妹品种,也在我国酿酒主产区广泛种植。因此,本研究以具有不同酸度特征的赤霞珠、蛇龙珠葡萄酒为实验材料,研究了不同接种顺序下酒酒球菌和植物乳杆菌共发酵对葡萄酒MLF进程中菌株生物量相对丰度的影响,从苹果酸代谢率、产香能力等方面进行综合评价,筛选出具有最佳发酵结果的接种顺序。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
供试酒样:实验所用原料为2021年张裕摩塞尔十五世酒庄赤霞珠葡萄酒及2021年陕西曹兴庄蛇龙珠葡萄酒,酒样均完成酒精发酵(未启动苹果酸-乳酸发酵,未添加SO2),基本理化指标如表1所示。
表1 供试酒样基础理化指标
Table 1 Basic physical and chemical parameters of wine samples

葡萄品种酒度/%(体积分数)还原糖/(g/L)总酸(以酒石酸计)/(g/L)挥发酸(以醋酸计)/(g/L)苹果酸/(g/L)pH值赤霞珠12.40±0.161.60±0.085.56±0.040.40±0.163.71±0.053.32±0.00蛇龙珠11.23±0.051.53±0.254.81±0.070.30±0.011.30±0.033.79±0.02
供试菌株:酒酒球菌SD2a(OeSD2a)和植物乳杆菌XJ25(LpXJ25)从赤霞珠葡萄酒中分离获得。
1.1.2 试剂与仪器
色谱纯L-苹果酸、L-乳酸、柠檬酸、乙酸、酒石酸、琥珀酸、D-果糖、D-葡萄糖、甘油、乙醇,美国Sigma公司;硫酸、甲酸和乙腈均为HPLC级,Tedia公司(上海,中国)。
UV-2450紫外分光光度计、BL-220H电子天平、AUX 220电子天平、GCMS-QP2010 Ultra气相色谱-质谱联用仪,日本岛津公司;PB-10 pH计,德国赛多利斯公司;HH-4恒温水浴锅,上海森信试验仪器有限公司;5417R1离心机,德国Eppendorf公司;Agilent 1260 Infinity Ⅱ高效液相色谱,安捷伦科技有限公司。
1.1.3 培养基
酸性番茄培养基(acid tomato juice medium, ATB培养基)(g/L):D-葡萄糖10,蛋白胨10,酵母浸粉5,盐酸半胱氨酸0.5,七水硫酸镁0.2,四水硫酸锰0.05,番茄汁250 mL,pH 4.6;
MRS培养基(g/L):D-葡萄糖20,蛋白胨10,酵母浸粉5,牛肉膏10,七水硫酸镁0.2,四水硫酸锰0.05,乙酸钠5,磷酸氢二钾2,柠檬酸氢二铵2,吐温80 1 mL,pH 6.2;
MLO培养基(g/L): D-果糖40,D-葡萄糖38.44,蛋白胨9.22,酵母浸粉4.61,牛肉膏9.22,七水硫酸镁0.18,四水硫酸锰0.046,乙酸钠4.61,磷酸氢二钾1.84,柠檬酸氢二铵1.84,L-苹果酸4,吐温80 1 mL,吡哆醇0.1,MLO-I培养基乙醇5%(体积分数),用于植物乳杆菌预驯化时pH 4.6,用于酒酒球菌预驯化时pH 3.5;MLO-Ⅱ培养基乙醇11%(体积分数),pH 3.5。
1.2 实验方法
1.2.1 菌株活化及预驯化
-80 ℃保藏的OeSD2a以4%的接种量接入ATB液体培养基中,26 ℃培养48 h,取4%转接至新鲜ATB液体培养基中继续培养48 h。-80 ℃保藏的LpXJ25以1%的接种量接种于MRS液体培养基中,37 ℃培养12 h后1%转接至新鲜MRS液体培养基中培养8 h。
转接培养后的OeSD2a和LpXJ25在8 000×g下离心5 min收集菌体,分别重悬于等体积MLO-Ⅰ液体培养基中,20 ℃培养48 h后以相同条件离心收集菌体,重新接入MLO-II液体培养基中,20 ℃培养24 h。
1.2.2 苹果酸-乳酸发酵
酒精发酵结束未添加SO2的葡萄酒用0.22 μm有机滤膜过滤得到无菌葡萄酒。MLO-II培养基中菌液8 000×g离心10 min收集菌体,0.85%生理盐水洗涤2次,重悬于等体积葡萄酒中。200 mL厌氧瓶中装有150 mL葡萄酒,按照不同接种顺序接入3% OeSD2a和LpXJ25,使各菌株活菌数为4×107CFU/mL。
接种比例按公式(1)计算:
(1)
式中:X1和X2分别为第二次序菌株接种时OeSD2a和LpXJ25的生物量。
1.2.3 基础理化指标测定
参照GB/T 15038—2006 《葡萄酒、果酒通用分析方法》测定酒度、总酸、挥发酸、游离SO2和总SO2含量。
1.2.4 生物量监测
发酵过程中每隔24 h取样,使用0.85%的生理盐水进行梯度稀释,取100 μL稀释液涂布于固体ATB平板培养基上,26 ℃下培养7 d后进行菌落计数。
1.2.5 有机酸含量测定
采用高效液相色谱法HPLC进行有机酸含量测定。
发酵酒样每隔24 h取样,样品用超纯水稀释5倍,0.22 μm的有机系滤膜过滤用于后续HPLC(Agilent 1260 Infinity Ⅱ HPLC)分析。色谱条件:色谱柱为BioRad Aminex HPX 87-H(300 mm×7.8 mm),流动相为5 mmol/L H2SO4溶液,流速为0.6 mL/min,柱温60 ℃,进样量20 μL,检测波长210 nm。酒石酸、苹果酸、柠檬酸、琥珀酸、乳酸、乙酸标准溶液质量浓度为0.05、0.1、0.2、0.4、0.6、0.8、1.0 g/L。
1.2.6 挥发性香气物质含量测定
发酵结束后取样,使用顶空固相微萃取法(HS-SPME)提取样品中的挥发性香气物质,通过气相色谱-质谱法(GC-MS)进行分析。
HS-SPME条件:5 mL葡萄酒样品、1 g NaCl和10 μL内标4-甲基-2-戊醇(1.008 3 g/L,Sigma-Aldrich)加入15 mL样品瓶中,以400 r/min的速度在40 ℃下连续搅拌30 min,相同条件下使用预处理的50/30 μm的二乙烯基苯/羧基/聚二甲基硅氧烷(DVB/CAR/PDMS)SPME萃取头(Supelco, Bellefonte, PA)对平衡后的样品在40 ℃下连续搅拌萃取30 min。随后,将萃取头注入气相色谱仪,在无分裂模式下解吸8 min。
GC-MS条件:使用Agilent GC 7890型仪器,配备了Agilent 5975 MS、7683自动采样器(Agilent, Santa Clara,CA)和DB-Wax毛细管柱(60 m×0.25 mm×0.25 μm;Agilent J &W,Santa Clara,CA)。进样口温度为250 ℃,载气流速(He,>99.999%)为1 mL/min。柱温在50 ℃下保持1 min,以3 ℃/min的速度升至220 ℃,并保持5 min。质谱界面和离子源温度分别为280 ℃和230 ℃。在m/z 20~350的扫描范围内记录70 eV的电子冲击光谱。
半定量分析:通过比较基于偶数正构烷烃(C7~C24)(Supelco,Bellefonte,PA,USA)的保留指数和挥发性化合物的质谱与纯标准品的质谱,来鉴定挥发性化合物。所有的质谱与美国国家标准与技术研究所图书馆(NIST 11)的质谱进行比较。根据内标法(4-甲基-2-戊醇)进行定量,使用5点法绘制标准曲线。
1.5 数据处理
采用SPSS 26.0对实验数据进行差异性分析(analysis of variance,ANOVA)检查各个结果的显著性差异,组间多重比较采用Duncan法,P<0.05表示差异显著。采用Origin 2023b作图。
2 结果与分析
2.1 不同接种顺序下酒酒球菌和植物乳杆菌生物量变化
对发酵过程中OeSD2a和LpXJ25生长量的动态变化进行了监测。单独接种OeSD2a时,其能够在葡萄酒中继续生长繁殖,发酵结束时生物量高于初始接种量,而LpXJ25单独接种时生物量始终呈下降趋势。
在较低苹果酸含量的葡萄酒(蛇龙珠)中(图1),除(0 h) LpXJ25+(48 h) OeSD2a组外,其他顺序接种处理组与1∶1同时接种的R值均无差异,表明苹果酸降解的前中期对两种乳酸菌生物量改变较小。OeSD2a的生物量在发酵过程中虽然也因适应环境或营养物质匮乏而出现下降,但其仍能保持较高数值,最终比初始接种量高出约1倍,而LpXJ25仅在接种后的第1天出现了生物量的短暂升高,之后则由于严苛生境而持续下降,最终比初始接种量低了1个CFU。改变接种策略后,OeSD2a接入后生物量均有增加趋势,但先接入LpXJ25时,OeSD2a的增长会出现一定迟滞(48 h),这可能是由于OeSD2a接种时LpXJ25已成为了发酵优势菌株,与其出现营养竞争,但OeSD2a更强的胁迫耐受能力使其能够在低营养环境中迅速占据生长优势,接替LpXJ25成为发酵主导菌株。这种混菌发酵时的营养竞争在酵母中也广泛存在,唐洁等[16]探究了无细胞系统中酿酒酵母和异常毕赤酵母间的相互影响,发现代谢物对菌株造成的生长抑制作用是影响菌株生长的主要因素。有趣的是,在LpXJ25发酵过程中接入OeSD2a短暂改变了LpXJ25生物量的变化趋势,使本来下降的生物量出现了上升趋势,并能在1~2 d内维持稳定,这可能是由于OeSD2a接入后对苹果酸的降解在一定程度上缓解了环境压力,同时共接种使两菌株在发酵过程中实现代谢物共享,营养胁迫下代谢物的交换促进了LpXJ25在胁迫环境下的生存[17]。

a-OeSD2a/LpXJ25初始接种比例;b-0 h (OeSD2a+LpXJ25)组生物量变化;c-(0 h) OeSD2a+(24 h) LpXJ25组生物量变化;d-(0 h) OeSD2a+(48 h) LpXJ25组生物量变化;e-(0 h) LpXJ25+(24 h) OeSD2a组生物量变化;f-(0 h) LpXJ25+(48 h) OeSD2a组生物量变化
图1 蛇龙珠葡萄酒中酒酒球菌和植物乳杆菌生物量变化
Fig.1 Biomass changes of OeSD2a and LpXJ25 in Cabernet Gernischt wine
注:不同小写字母表示差异显著(P<0.05)(下同)。
在较高苹果酸含量的葡萄酒(赤霞珠)中(图2),除(0 h) SD2a+(24 h)LpXJ25组外,R值都发生了显著改变,增大顺序接种的间隔时间使得酒酒球菌成为优势菌群。同时接种时,高酸的葡萄酒环境使两菌株生物量均出现显著下降,但OeSD2a经过2 d的适应后下降速率减缓,发酵后期活菌数稳定在2×107 CFU/mL左右。而顺序接种使两菌株生物量变化趋势发生了较大改变,OeSD2a先接种时生物量呈下降趋势,这可能是由于菌株接种时处于稳定生长阶段,接种后短暂保持了之前的生长状态,但很快就受到葡萄酒环境的营养限制,因此通过降低一定的生物量维持剩余活菌的正常生长代谢;而后接种时生物量呈上升趋势则与其接种时葡萄酒中苹果酸已部分代谢相关。先接种OeSD2a时,接入LpXJ25都使得OeSD2a生物量有较大幅度的降低,24 h后接入LpXJ25,此时正处于OeSD2a的适应阶段,LpXJ25对匮乏营养物质的争夺使OeSD2a生物量均出现快速下降(发酵第2天时OeSD2a和LpXJ25分别下降至初始接种量的40.85%和66.01%),24 h后菌株生物量则趋于平稳。而先接种LpXJ25的条件下,OeSD2a的接种能使LpXJ25保持在相对较高的生物量,48 h后接入,共培养5 d后(发酵第7天)LpXJ25的生物量下降趋势与1∶1同时接种时相似。

a-OeSD2a/LpXJ25初始接种比例;b-0 h (OeSD2a+LpXJ25)组生物量变化;c-(0 h) OeSD2a+(24 h) LpXJ25组生物量变化;d-(0 h) OeSD2a+(48 h) LpXJ25组生物量变化;e-(0 h) LpXJ25+(24 h) OeSD2a组生物量变化;f-(0 h) LpXJ25+(48 h) OeSD2a组生物量变化
图2 赤霞珠葡萄酒中酒酒球菌和植物乳杆菌生物量变化
Fig.2 Biomass changes of OeSD2a and LpXJ25 in Cabernet Sauvignon wine
群落中的生物可以共享其代谢产物,这些代谢物可以提高群落的生长和生产能力[18],在本研究中,共接种策略下,OeSD2a能保持其MLF优势,发酵期间始终维持较高生物量,LpXJ25也能在与OeSD2a的顺序发酵中减缓生物量下降速度,共同应对葡萄酒胁迫条件。但两种葡萄酒中相同接种顺序的不同结果也表明酸度会影响顺序接种中乳酸菌的组成,在高苹果酸的条件下,48 h间隔的顺序接种使得OeSD2a成为优势菌株。即接种顺序的影响不仅取决于菌株的自身发酵特性,也取决于葡萄酒特征,并且这种葡萄酒特性上的差异可能使菌群间的互作关系也发生了改变,从而改变了对代谢物的利用,影响菌株的发酵过程。
2.2 不同接种顺序下有机酸含量动态变化
发酵过程中有机酸含量的动态变化如图3所示。蛇龙珠葡萄酒中,各接种条件均能在发酵第4天时完成苹果酸的降解,而赤霞珠葡萄酒由于其高酸条件,需要5 d完成对苹果酸的降解。
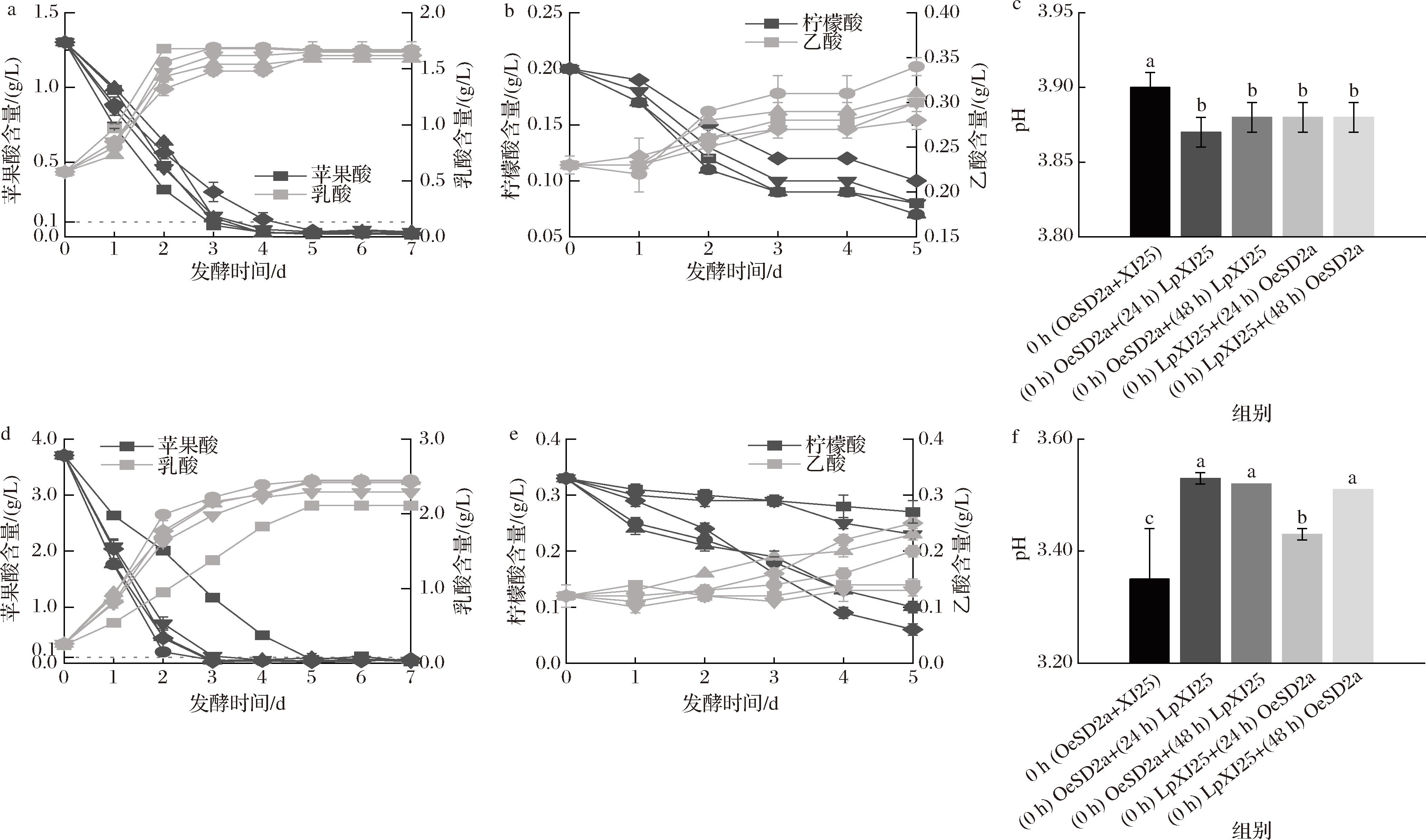
a-蛇龙珠葡萄酒苹果酸、乳酸含量变化;b-蛇龙珠葡萄酒柠檬酸、乙酸含量变化;c-蛇龙珠葡萄酒发酵结束时pH值; d-赤霞珠葡萄酒苹果酸、乳酸含量变化;e-赤霞珠葡萄酒柠檬酸、乙酸含量变化;f-赤霞珠葡萄酒发酵结束时pH值
图3 MLF过程中葡萄酒有机酸含量变化及MLF后葡萄酒pH值变化
Fig.3 The change of organic acids content in wine during MLF process and pH values after MLF
注:a、b、d、e图中方形(-▭-)、圆形(-○-)、正三角(-△-)、倒三角(-▽-)和菱形(-◇-)分别代表0 h (OeSD2a+LpXJ25)、 (0 h) OeSD2a+(24 h) LpXJ25、(0 h) OeSD2a+(48 h) LpXJ25、(0 h) LpXJ25+(24 h) OeSD2a、(0 h) LpXJ25+(48 h) OeSD2a发酵组。
蛇龙珠葡萄酒中,1∶1同时接种OeSD2a和LpXJ25可对苹果酸进行快速、完全的降解,发酵第3天苹果酸降解率就已达到94.1%(苹果酸含量0.08 g/L),完成了苹果酸-乳酸的转化,最终(发酵第7天)苹果酸降解率98.97%,为各组中最高。BRIZUELA等[11]的研究也发现植物乳杆菌和酒酒球菌共接种时可获得最高的苹果酸消耗量。顺序接种时发现,前3 d内苹果酸降解速率随着发酵过程中另一菌株的接入而显著变缓,但在OeSD2a接种48 h后接入LpXJ25使发酵进行的更为彻底,最终苹果酸降解率为98.21%,乳酸生成速率仅次于同时接种。LpXJ25发酵24 h后接入OeSD2a也使发酵中后期MLF速率有一定提高。发酵结束时,葡萄酒的pH有所升高(图3-c),但顺序接种的处理组pH变化显著低于同时接种,其中(0 h) OeSD2a+(24 h) LpXJ25组pH变化最小,维持了葡萄酒的原有酸度平衡。
赤霞珠葡萄酒中,1∶1同时接种OeSD2a和LpXJ25时,苹果酸降解速率最低,乳酸生成速率显著低于各顺序接种发酵组,第5天时才完成MLF(苹果酸含量0.06 g/L),这与菌株生物量下降相对应,苹果酸代谢能力减弱,延长了MLF周期。而先接种OeSD2a时,无论何时接入LpXJ25,都能在3 d之内代谢98%以上的苹果酸,LpXJ25的接入并未对发酵速率产生显著影响,其中(0 h) OeSD2a+(24 h) LpXJ25组获得了最高的乳酸生成速率(发酵第2天乳酸含量1.88 g/L)。反之,先接种LpXJ25的时候,顺序接入OeSD2a加快了苹果酸的降解速率,与1∶1同时接种相比MLF周期缩短了2~3 d,尤其是(0 h) LpXJ25+(48 h) OeSD2a组使最终苹果酸降解率达到99.24%。可以看出,在高苹果酸环境下,共接种策略的改变显著促进了苹果酸-乳酸的动态转化,使葡萄酒的pH值得到显著升高(图3-f),(0 h) OeSD2a +(24 h) LpXJ25组效果最佳,达到了降酸目的,柔和了葡萄酒口感。
MLF后酒样中酒石酸、琥珀酸、葡萄糖和果糖含量如表2所示,蛇龙珠葡萄酒中,MLF后酒石酸含量出现显著降低,发酵结束时(0 h) LpXJ25+(24 h) OeSD2a、(0 h) LpXJ25+(48 h) OeSD2a组酒石酸含量最低,分别为(2.38±0.13)、(2.94±0.29) g/L,此外,MLF后两种葡萄酒中均出现了果糖含量的显著降低。
表2 MLF后葡萄酒中酒石酸、琥珀酸、葡萄糖和果糖含量 单位:g/L
Table 2 The content of tartaric acid, succinic acid, fructose and glucose in wine after MLF

接种顺序酒石酸琥珀酸葡萄糖果糖蛇龙珠0 h (OeSD2a+LpXJ25)3.45±0.33ab2.33±0.13a2.24±0.17ab0.42±0.02a(0 h) OeSD2a+(24 h) LpXJ253.35±0.37ab2.4±0.02a2.22±0.17ab0.41±0.01a(0 h) OeSD2a+(48 h) LpXJ254.29±0.87a2.36±0.02a2.62±0.37a0.41±0a(0 h) LpXJ25+(24 h) OeSD2a2.38±0.13b2.39±0.02a1.78±0.07b0.43±0.01a(0 h) LpXJ25+(48 h) OeSD2a2.94±0.29b2.37±0.05a1.97±0.13b0.43±0.01a赤霞珠0 h (OeSD2a+LpXJ25)2.75±0.2ab3.85±0.03a1.43±0.07a0.7±0.26a(0 h) OeSD2a+(24 h) LpXJ252.32±0.24bc2.96±0.11d1.57±0.11a0.51±0.01a(0 h) OeSD2a+(48 h) LpXJ252.1±0.2c3.25±0.05c1.46±0.09a0.51±0.01a(0 h) LpXJ25+(24 h) OeSD2a3.08±0.22a3.02±0.03d1.59±0.09a0.5±0.01a(0 h) LpXJ25+(48 h) OeSD2a2.06±0.06c3.63±0.08b1.46±0.01a0.51±0.01a
注:同列不同小写字母代表差异显著(P<0.05)。
与卜潇等[7]的实验结果不同,预驯化后的菌株能够有效的进行苹果酸降解,不同接种顺序下菌株的相互作用也使苹果酸消耗率和降解速率发生变化,使MLF进行的更为彻底。蛇龙珠葡萄酒中顺序接种并未表现出显著优势,各顺序接种组中(0 h) OeSD2a+(24 h) LpXJ25组的苹果酸降解速率仅次于同时接种,但赤霞珠葡萄酒中,顺序接种显著加快了苹果酸代谢速率,其中以(0 h) LpXJ25+(24 h) OeSD2a组效果最佳,发酵第3天即完成了对苹果酸的降解。
2.3 接种顺序对葡萄酒挥发性香气成分的影响
MLF结束后,在蛇龙珠葡萄酒中通过GC-MS共检出58种香气物质,分别是酯(21种),醇(17种),酸(7种),萜烯(8种),醛(4种),酮(1种)。蛇龙珠葡萄酒各酒样挥发性香气物质总量在398.52~486.72 mg/L(表3),赤霞珠葡萄酒各酒样挥发性香气物质总量在396.50~504.24 mg/L(表4),两者均为(0 h) OeSD2a+(24 h) LpXJ25组含量最高,(0 h) LpXJ25+(24 h) OeSD2a组含量最低。
表3 蛇龙珠葡萄酒关键挥发性香气物质含量 单位:μg/L
Table 3 Content of key volatile aroma compounds in Cabernet Gernischt wine
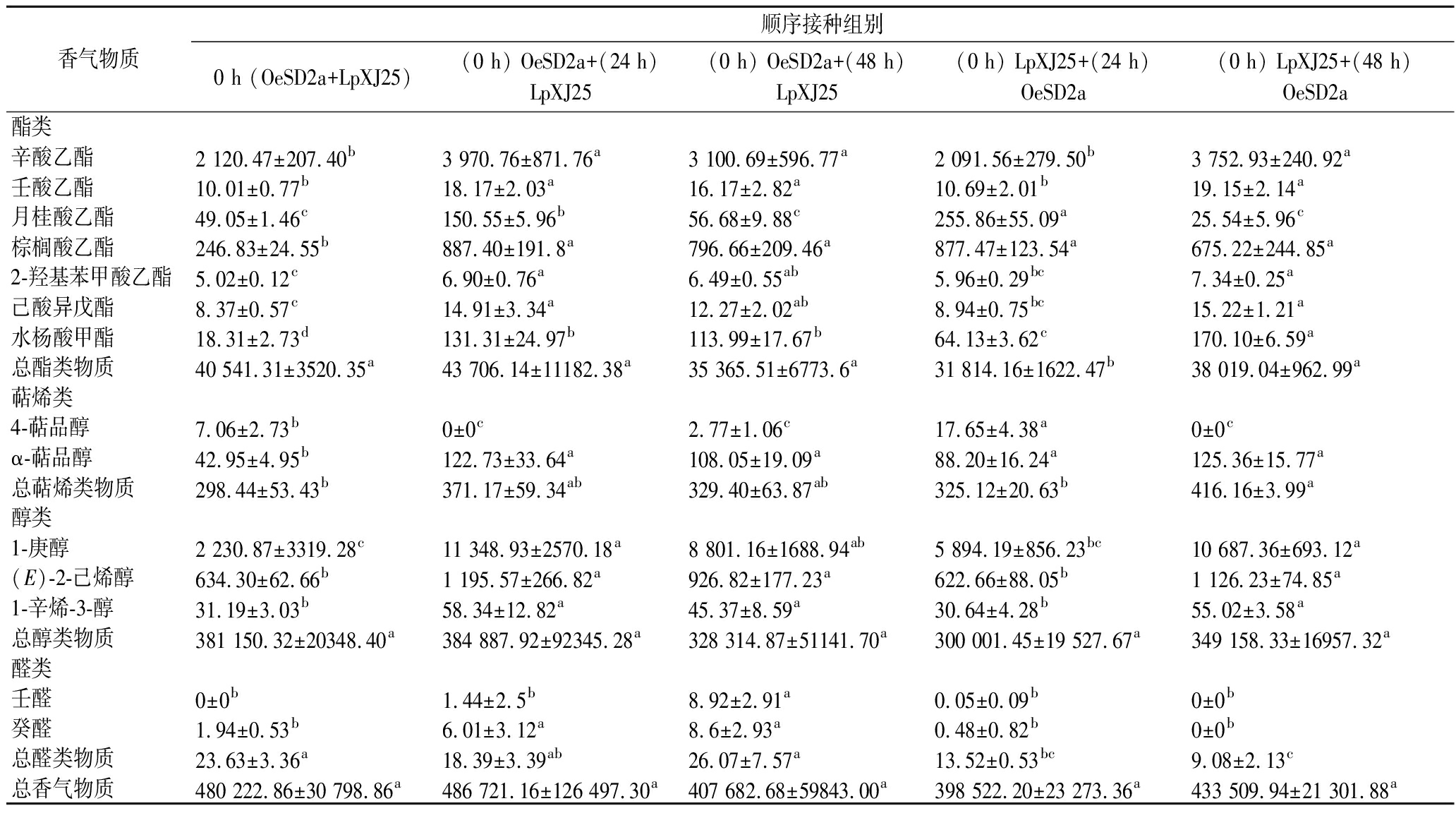
香气物质顺序接种组别0 h (OeSD2a+LpXJ25)(0 h) OeSD2a+(24 h)LpXJ25(0 h) OeSD2a+(48 h)LpXJ25(0 h) LpXJ25+(24 h)OeSD2a(0 h) LpXJ25+(48 h)OeSD2a酯类辛酸乙酯2 120.47±207.40b3 970.76±871.76a3 100.69±596.77a2 091.56±279.50b3 752.93±240.92a壬酸乙酯10.01±0.77b18.17±2.03a16.17±2.82a10.69±2.01b19.15±2.14a月桂酸乙酯49.05±1.46c150.55±5.96b56.68±9.88c255.86±55.09a25.54±5.96c棕榈酸乙酯246.83±24.55b887.40±191.8a796.66±209.46a877.47±123.54a675.22±244.85a2-羟基苯甲酸乙酯5.02±0.12c6.90±0.76a6.49±0.55ab5.96±0.29bc7.34±0.25a己酸异戊酯8.37±0.57c14.91±3.34a12.27±2.02ab8.94±0.75bc15.22±1.21a水杨酸甲酯18.31±2.73d131.31±24.97b113.99±17.67b64.13±3.62c170.10±6.59a总酯类物质40 541.31±3520.35a43 706.14±11182.38a35 365.51±6773.6a31 814.16±1622.47b38 019.04±962.99a萜烯类4-萜品醇7.06±2.73b0±0c2.77±1.06c17.65±4.38a0±0cα-萜品醇42.95±4.95b122.73±33.64a108.05±19.09a88.20±16.24a125.36±15.77a总萜烯类物质298.44±53.43b371.17±59.34ab329.40±63.87ab325.12±20.63b416.16±3.99a醇类1-庚醇2 230.87±3319.28c11 348.93±2570.18a8 801.16±1688.94ab5 894.19±856.23bc10 687.36±693.12a(E)-2-己烯醇634.30±62.66b1 195.57±266.82a926.82±177.23a622.66±88.05b1 126.23±74.85a1-辛烯-3-醇31.19±3.03b58.34±12.82a45.37±8.59a30.64±4.28b55.02±3.58a总醇类物质381 150.32±20348.40a384 887.92±92345.28a328 314.87±51141.70a300 001.45±19 527.67a349 158.33±16957.32a醛类壬醛0±0b1.44±2.5b8.92±2.91a0.05±0.09b0±0b癸醛1.94±0.53b6.01±3.12a8.6±2.93a0.48±0.82b0±0b总醛类物质23.63±3.36a18.39±3.39ab26.07±7.57a13.52±0.53bc9.08±2.13c总香气物质480 222.86±30 798.86a486 721.16±126 497.30a407 682.68±59843.00a398 522.20±23 273.36a433 509.94±21 301.88a
注:同行不同小写字母代表差异显著(P<0.05);乙酸香叶酯、乙酸乙酯、乙酸己酯、辛酸甲酯、乙酸异丁酯、乙酸异戊酯、己酸乙酯、癸酸乙酯、2-甲基丙酸乙酯、2-甲基丁酸乙酯、3-甲基丁酸乙酯、乳酸乙酯、琥珀酸二乙酯、威士忌内酯、D-柠檬烯、里那醇、香茅醇、橙花醇、β-紫罗兰酮、金合欢醇、1-庚醇、1-戊醇、1-己醇、1-辛醇、(Z)-3-己烯醇、异丁醇、异戊醇、4-甲基-1-戊醇、3-甲基-1-戊醇、(E)-3-己烯醇、2-乙基-1-己醇、3-甲硫基丙醇、苯乙醇、2,3-丁二醇、己酸、辛酸、癸酸、异丁酸、异戊酸、苯甲酸、辛醛、苯甲醛、乙偶姻含量在顺序接种组变化量<50%,未在表中呈现。
表4 赤霞珠葡萄酒关键挥发性香气物质含量 单位:μg/L
Table 4 Content of key volatile aroma compounds in Cabernet Sauvignon wine

香气物质顺序接种组别0 h (OeSD2a+LpXJ25)(0 h) OeSD2a+(24 h)LpXJ25(0 h) OeSD2a+(48 h)LpXJ25(0 h) LpXJ25+(24 h)OeSD2a(0 h) LpXJ25+(48 h)OeSD2a酯类壬酸乙酯10.33±2.37b8.58±0.13b8.77±1.02b19.90±3.01a8.92±0.39b癸酸乙酯295.32±41.09d472.57±36.69c476.78±84.67c1300.80±71.93a655.11±2.03b月桂酸乙酯82.84±8.88c138.08±10.99b147.05±9.91b242.42±37.98a124.64±10.98b棕榈酸乙酯1 300.49±66.37b2 056.71±255.16a1 722.27±368.94ab1 853.06±183.67a1 352.76±272.95b琥珀酸二乙酯4 701.35±248.73b6 095.33±632.48a6 345.77±333.37a4 837.31±46.55b5 744.72±237.69a2-羟基苯甲酸乙酯3.63±0.52b5.54±0.40a5.45±0.15a4.89±0.05a5.27±0.53a威士忌内酯71.59±9.64b152.65±25.96a88.15±15.16b89.74±4.98b95.58±5.97b总酯类物质29 706.38±3189.8ab32 286.32±2647.46a31 519.89±1400.09a27 148.11±100.89bc29 055.17±721.47abc萜烯类里那醇6.64±2.78b14.31±1.75a12.69±0.68a13.69±1.91a12.64±0.35aα-萜品醇45.51±16.43b56.42±2.27b46.98±5.09b86.61±5.92a48.41±3.88bβ-紫罗兰酮0.66±1.14b3.47±1.37a1.89±0.14ab2.93±0.24a2.88±0.83a金合欢醇77.19±5.63c127.17±8.27a108.81±0.61b79.42±5.01c128.57±8.97a总萜烯类物质227.15±40.14a332.33±110.28a304.74±47.73a304.58±14.78a305.49±30.33a醇类异丁醇14 330.22±279.87c18 352.23±1053.44a17 108.38±661.93b14 843.18±203.4c16 861.93±600.25b(E)-3-己烯醇59.55±18.51b98.66±10.13ab148.27±18.34a119.68±16.00ab101.94±72.26ab2-乙基-1-己醇4.71±2.17b16.34±5.97a5.07±2.26b6.32±1.00b4.69±1.65b总醇类物质373 922.75±34 883.96ab412 127.18±60 173.56a392 657.04±14 974.56a326 354.9±2 261.11b370 719.21±15 341.18ab醛类辛醛4.02±1.25b7.99±4.33ab9.23±6.11ab13.09±0.35a8.02±1.3ab癸醛1.34±0.08b3.61±0.22a2.09±1.29b1.15±0.17b1.5±0.39b总醛类物质6.15±1.04b12.78±4.28a12.23±4.64a14.81±0.50a10.35±1.31b总香气物质456 901.69±44 404.62ab504 238.05±65 736.00a482 335.21±18 797.28a396 498.35±2 948.53b452 927.29±18 795.54ab
注:同行不同小写字母代表差异显著(P<0.05),乙酸香叶酯、乙酸乙酯、乙酸己酯、乙酸异丁酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、辛酸甲酯、2-甲基丙酸乙酯、2-甲基丁酸乙酯、3-甲基丁酸乙酯、乳酸乙酯、己酸异戊酯、水杨酸甲酯、D-柠檬烯、橙花醇、4-萜品醇、香茅醇、1-丙醇、1-戊醇、1-己醇、1-庚醇、1-辛醇、异戊醇、4-甲基-1-戊醇、3-甲基-1-戊醇、(E)-2-己烯醇、(Z)-3-己烯醇、1-辛烯-3-醇、2,3-丁二醇、3-甲硫基丙醇、苯乙醇、己酸、辛酸、癸酸、异丁酸、异戊酸、苯甲酸、苯甲醛、乙偶姻含量在顺序接种组变化量<50%,未在表中呈现。
脂肪酸乙酯对葡萄酒香气的形成具有重要贡献[19],多项研究表明,MLF可通过增加酯含量来增强果香[20-21]。蛇龙珠葡萄酒中,与同时接种相比,(0 h) OeSD2a+(24 h) LpXJ25组酯类物质总含量提高了7.81%,为43.71 mg/L;而先接种LpXJ25[(0 h) LpXJ25+(48 h) OeSD2a组],辛酸乙酯和壬酸乙酯的含量提高了1.77倍和1.91倍,为葡萄酒带来了更丰富的果香(梨、荔枝、菠萝)。赤霞珠葡萄酒中,(0 h) OeSD2a+(24 h) LpXJ25组的接种顺序显著提升了乙酸酯和其他酯类的含量,棕榈酸乙酯和威士忌内酯含量比同时接种时提高了58.15%和113.23%(分别为2 056.71 μg/L和152.65 μg/L)。
高级醇能够为葡萄酒贡献植物类香气,300~400 mg/L能够增加葡萄酒香气的复杂度[22],高级醇对香气的贡献有限,更多是作为某些更强烈香气物质的合成底物[23],如C6醇会作为乙酸酯的前体出现[24]。本实验中,(0 h) OeSD2a+(24 h) LpXJ25组的接种顺序下两种葡萄酒均获得了最高的高级醇含量(蛇龙珠370.64 mg/L,赤霞珠403.52 mg/L),由于具有更丰富的前体物质,因此获得了最高的乙酸酯含量。此外,结果表明先接种OeSD2a能极大丰富部分支链醇类和反式不饱和醇的含量,在高级醇合成能力上显著优于LpXJ25先接种的组。
萜烯类物质含量在总香气物质中占比较少,但具有较低的气味阈值和较强的嗅觉特征[25]。结果显示,不同葡萄酒中萜烯类物质的差异与接种顺序显著相关,低酸蛇龙珠葡萄酒中,LpXJ25先接种更有利于萜烯类物质的合成,而高酸赤霞珠葡萄酒中则是OeSD2a先接种更具优势,两组萜烯类物质含量分别比同时接种提高了39.45%和46.30%(分别为416.16、332.33 μg/L),这表明接种顺序的选择与葡萄酒特征也密不可分。
中链醛类(C8~C10)能赋予葡萄酒柑橘类水果香气[23],OeSD2a先接种在该类物质合成方面优势显著。蛇龙珠葡萄酒中,壬醛仅在OeSD2a先接种的发酵组中检出,(0 h) OeSD2a+(48 h) LpXJ25组中含量最高,这可能是由于LpXJ25接入时环境胁迫已有所缓解(苹果酸含量0.64 g/L),有利于多种香气相关酶的分泌,促进香气物质合成。赤霞珠葡萄酒中,(0 h) LpXJ25+(24 h) OeSD2a组使辛醛含量增加了3.26倍(13.09 μg/L),增强了酒样的柑橘类风味。
总的来看,蛇龙珠和赤霞珠葡萄酒中,辛酸乙酯、月桂酸乙酯、棕榈酸乙酯、2-羟基苯甲酸乙酯、α-萜品醇、癸醛含量的显著提高,表明尽管在不同基质中进行发酵,顺序接种仍能保持其在部分挥发性香气物质的合成上的优势。根据香气活度值(odor active values,OAV)对贡献较大的香气物质进行了主成分分析(principal component analysis,PCA)。如图4所示,PC1正半轴上主要分布着酯类和醇类物质,PC2正半轴上主要分布着酸类、萜烯类和醛类物质,负半轴的香气信息则较少。可以看到,两种葡萄酒中,(0 h) OeSD2a+(24 h) LpXJ25组酒样均在PC1正半轴得分较高,果香特征更丰富,蛇龙珠葡萄酒中,(0 h) LpXJ25+(48 h) OeSD2a组酒样在PC2正半轴得分较高,具有更浓郁的花香。而(0 h) OeSD2a+LpXJ25组和(0 h) LpXJ25+(24 h) OeSD2a组酒样则离香气物质较远,说明混菌发酵有利于丰富葡萄酒香气物质含量、改善酒样香气表现,但接种顺序的选择同样影响着香气物质合成。
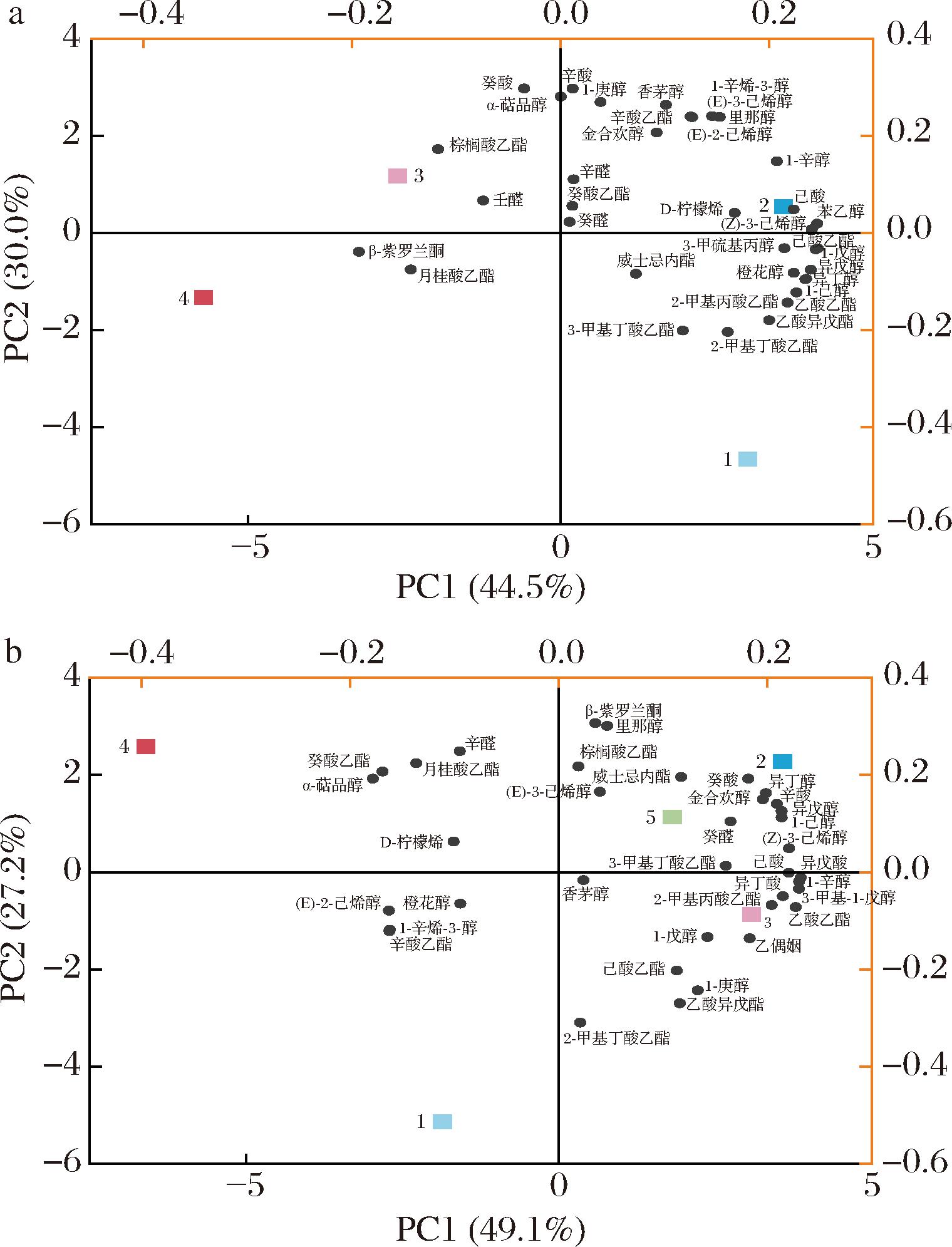
a-蛇龙珠葡萄酒;b-赤霞珠葡萄酒
图4 葡萄酒挥发性香气物质主成分分析
Fig.4 Principal component analysis of volatile compounds in wine samples
注:正方形1、2、3、4、5分别代表0 h (OeSD2a+LpXJ25)、 (0 h) OeSD2a+(24 h) LpXJ25、(0 h) OeSD2a+(48 h) LpXJ25、 (0 h) LpXJ25+(24 h) OeSD2a、(0 h) LpXJ25+(48 h) OeSD2a 发酵组,实心圆代表不同香气物质。
共接种作为一种改善葡萄酒感官质量的发酵方式在酒精发酵中已经得到了广泛应用,在MLF中的研究也日益增加,DEVI等[22]使用植物乳杆菌和酒酒球菌共接种的葡萄酒中获得更高的果味、花香、坚果味和烟熏味,并认为这些变化是两种细菌代谢差异的累积,此外,还发现顺序接种时比同时接种香气物质含量更丰富,包括丁酸乙酯、β-大马烯酮等,与本研究结果一致,即共接种顺序的差异对于发酵过程中香气物质的形成也有很大影响。因此,共发酵过程中菌株接种时间的选择至关重要。本研究中,OeSD2a接种后顺序接入LpXJ25对更有利于丰富香气特征,尤其是(0 h) OeSD2a+(24 h) LpXJ25发酵组,香气物质含量最高。
3 结论与讨论
LpXJ25的接种顺序影响了菌株的代谢活动,使两菌株表现出更显著的协同效应,在苹果酸降解和挥发性香气物质生成方面均有显著优势。(0 h) OeSD2a+(24 h) LpXJ25的接种顺序加快了发酵速度,提升了降酸效率,两种葡萄酒中均能在第3天时使苹果酸含量≤0.1 g/L。且在该接种顺序下,蛇龙珠葡萄酒中萜烯类物质含量是同时接种的3倍,赤霞珠葡萄酒中高级醇含量提高了10.85%。因此,在MLF时选择合适的共接种顺序,能够充分发挥本土菌株优势,为生产具有区域特色的葡萄酒提供有力帮助。
[1] 李俊娥, 毛亚玲, 祝霞, 等.苹果酸-乳酸发酵接种方式对赤霞珠干红葡萄酒香气品质的影响[J].食品与发酵工业, 2021, 47(19):126-136.
LI J E, MAO Y L, ZHU X, et al.Effects of different inoculation on aroma quality of Cabernet Sauvignon dry red wine[J].Food and Fermentation Industries, 2021, 47(19):126-136.
[2] VALDÉS LA HENS D, BRAVO-FERRADA B M, DELFEDERICO L, et al.Prevalence of Lactobacillus plantarum and O enococcus oeni during spontaneous malolactic fermentation in Patagonian red wines revealed by polymerase chain reaction-denaturing gradient gel electrophoresis with two targeted genes:Lactic acid bacteria diversity in Patagonian wines[J].Australian Journal of Grape and Wine Research, 2015, 21(1):49-56.
[3] 刘龙祥, 张克颖, 赵红玉, 等.酒酒球菌酸胁迫应答机制研究进展[J].食品与发酵工业, 2022, 48(22):299-304.
LIU L X, ZHANG K Y, ZHAO H Y, et al.Research progress on acid stress response mechanism of Oenococcus oeni[J].Food and Fermentation Industries, 2022, 48(22):299-304.
[4] KRIEGER-WEBER S, HERAS J M, SUAREZ C.Lactobacillus plantarum, a new biological tool to control malolactic fermentation:A review and an outlook[J].Beverages, 2020, 6(2):23.
[5] VIRDIS C, SUMBY K, BARTOWSKY E, et al.Lactic acid bacteria in wine:Technological advances and evaluation of their functional role[J].Frontiers in Microbiology, 2021, 11:612118.
[6] 陆文轩, 张碧颖, 巴旦加布, 等.植物乳杆菌在不同品种葡萄酒中苹果酸乳酸发酵性能的评价[J].食品与发酵工业, 2022, 48(12):82-89+96.
LU W X, ZHANG B Y, BA D J B, et al.Evaluation on malolactic fermentation performance of Lactobacillus plantarum in wine fermentation with different grape varieties[J].Food and Fermentation Industries, 2022, 48(12):82-89;96.
[7] 卜潇, 薛雪, 程静, 等.葡萄酒中植物乳杆菌苹果酸-乳酸发酵潜能评价[J].中国农业科学, 2017, 50(5):959-968.
BU X, XUE X, CHENG J, et al.Evaluation on malolactic fermentation potential of wine Lactobacillus plantarum[J].Scientia Agricultura Sinica, 2017, 50(5):959-968.
[8] G-ALEGR A E, L
A E, L PEZ I, RUIZ J I, et al.High tolerance of wild Lactobacillus plantarum and Oenococcus oeni strains to lyophilisation and stress environmental conditions of acid pH and ethanol[J].FEMS Microbiology Letters, 2004, 230(1):53-61.
PEZ I, RUIZ J I, et al.High tolerance of wild Lactobacillus plantarum and Oenococcus oeni strains to lyophilisation and stress environmental conditions of acid pH and ethanol[J].FEMS Microbiology Letters, 2004, 230(1):53-61.
[9] BRAVO-FERRADA B M, HOLLMANN A, DELFEDERICO L, et al.Patagonian red wines:Selection of Lactobacillus plantarum isolates as potential starter cultures for malolactic fermentation[J].World Journal of Microbiology and Biotechnology, 2013, 29(9):1537-1549.
[10] BRIZUELA N, TYMCZYSZYN E E, SEMORILE L C, et al.Lactobacillus plantarum as a malolactic starter culture in winemaking:A new (old) player?[J].Electronic Journal of Biotechnology, 2019, 38:10-18.
[11] BRIZUELA N S, BRAVO-FERRADA B M, CURILÉN Y, et al.Advantages of Using Blend Cultures of Native L.plantarum and O.oeni Strains to Induce Malolactic Fermentation of Patagonian Malbec Wine[J].Frontiers in Microbiology, 2018, 9:2 109-2 117.
[12] ZHANG S R, XING X, CHU Q, et al.Impact of co-culture of Lactobacillus plantarum and Oenococcus oeni at different ratios on malolactic fermentation, volatile and sensory characteristics of mulberry wine[J].LWT-Food Science and Technology, 2022, 169:113995.
[13] CAPPELLO M S, ZAPPAROLI G, LOGRIECO A, et al.Linking wine lactic acid bacteria diversity with wine aroma and flavour[J].International Journal of Food Microbiology, 2017, 243:16-27.
[14] GRANDEL N E, REYES GAMAS K, BENNETT M R.Control of synthetic microbial consortia in time, space, and composition[J].Trends in Microbiology, 2021, 29(12):1095-1105.
[15] 马宗桓, 李玉梅, 李彦彪, 等.‘赤霞珠’葡萄在河西走廊产区不同产地的品质分析[J].干旱地区农业研究, 2023, 41(3):80-87.
MA Z H, LI Y M, LI Y B, et al.Quality analysis of Cabernet Sauvignon grapes from different producing areas in Hexi Corridor[J].Agricultural Research in the Arid Areas, 2023, 41(3):80-87.
[16] 唐洁, 王海燕, 徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报, 2012, 39(7):921-930.
TANG J, WANG H Y, XU Y.Effect of mixed culture of Saccharomyces cerevisiae and Pichia anomala on fermentation efficiency and flavor compounds in Chinese Liquor[J].Microbiology China, 2012, 39(7):921-930.
[17] BENOMAR S, RANAVA D,C RDENAS M L, et al.Nutritional stress induces exchange of cell material and energetic coupling between bacterial species[J].Nature Communications, 2015, 6:6283.
RDENAS M L, et al.Nutritional stress induces exchange of cell material and energetic coupling between bacterial species[J].Nature Communications, 2015, 6:6283.
[18] IBRAHIM M, RAAJARAAM L, RAMAN K.Modelling microbial communities:Harnessing consortia for biotechnological applications[J].Computational and Structural Biotechnology Journal, 2021, 19:3892-3907.
[19] CARPENA M, FRAGA-CORRAL M, OTERO P, et al.Secondary aroma:Influence of wine microorganisms in their aroma profile[J].Foods, 2021, 10(1):51.
[20] FENG H, SKINKIS P A, QIAN M C.Pinot noir wine volatile and anthocyanin composition under different levels of vine fruit zone leaf removal[J].Food Chemistry, 2017, 214:736-744.
[21] COSTELLO P J., FRANCIS I L., BARTOWSKY E J.Variations in the effect of malolactic fermentation on the chemical and sensory properties of Cabernet Sauvignon wine:interactive influences of Oenococcus oeni strain and wine matrix composition[J].Australian Journal of Grape and Wine Research, 2012, 18(3):287-301.
[22] DEVI A, ANU-APPAIAH K A, LIN T F.Timing of inoculation of Oenococcus oeni and Lactobacillus plantarum in mixed malo-lactic culture along with compatible native yeast influences the polyphenolic, volatile and sensory profile of the Shiraz wines[J].LWT, 2022, 158:113130.
[23] WATERHOUSE A L, SACKS G L, JEFFERY D W.Understanding Wine Chemistry[M].Wiley, 2016.
[24] DENNIS E G, KEYZERS R A, KALUA C M, et al.Grape Contribution to Wine Aroma:Production of Hexyl Acetate, Octyl Acetate, and Benzyl Acetate during Yeast Fermentation Is Dependent upon Precursors in the Must[J].Journal of Agricultural and Food Chemistry, 2012, 60(10):2 638-2 646.
[25] JUAN F S, CACHO J, FERREIRA V, et al.Aroma chemical composition of red wines from different price categories and its relationship to quality[J].Journal of Agricultural and Food Chemistry, 2012, 60(20):5045-5056.