传统塑性脂肪主要来源于猪、牛、羊等动物的脂肪或经过氢化、分提、酯交换的植物油,常被应用于烘焙食品、冰淇淋、涂抹酱、巧克力等产品中,来支持其在食品中的特性和功能。然而,传统塑性脂肪常含有大量的饱和脂肪酸(saturated fatty acid,SFA)和一定的反式脂肪酸(trans fatty acid,TFA)[1-2]。目前有研究认为 SFA 在机体代谢方面有重要的功能,但过度摄入会对人体健康产生不良影响,增加患病的几率[3]。此外,摄入高水平的TFA会对人类心血管健康造成负面影响[4],因此低饱和零反式新型塑性脂肪的开发势在必行。
油凝胶是一种以油为连续相的凝胶,可以使高不饱和脂肪的液体油在不改变其不饱和度的情况下被结构化为固体状油凝胶[5],形成稳定的三维网络[6]。由于体系中仅存在少量的固体脂肪,油凝胶具有低饱和脂肪和零反式脂肪的优点,可用于替代传统塑性脂肪[7]。除替代饱和脂肪外,凝胶油脂也提供了诸如塑性、油结合能力、热可逆性质、运载生物活性物质等其他功能特性,具有广泛的应用前景。
先前的研究指出[8],不同凝胶因子形成的结晶纤维结构会导致油凝胶的物理化学性质存在差异。因此,本研究旨在通过分析脂肪酸链相同但酯化程度不同的凝胶因子硬脂酸(stearic acid, SA)、单硬脂酸甘油酯(glyceryl monostearate, GMS)、二硬脂酸甘油酯(glyceryl distearate, GDS)和三硬脂酸甘油酯(glycerol tristearate, GTS)制备油凝胶的差异性,系统研究各类凝胶因子浓度对油凝胶的流变性、固体脂肪含量、热行为以及微观下的结晶行为和分子相互作用力的影响。
1 材料与方法
1.1 材料与试剂
SA、GMS、GDS和GTS,苏州丹尼斯克有限公司;花生油,益海嘉里油业有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
分析天平,上海梅特勒-托利多有限公司;DHR-3旋转流变仪,多点磁力搅拌器,美国TA公司;DSC 204F1差示扫描量热仪,德国耐驰仪器制造有限公司;TG16A-WS离心机,卢湘仪离心机仪器有限公司;MQC-23低场脉冲式核磁共振仪(nuclear magnetic resonance spectroscopy, NMR),英国Oxford 公司;D8 Advance X-射线衍射仪,德国 Bruke 公司;DM2700P偏振光显微镜,德国 Leica 公司;IS10傅里叶红外光谱仪,美国尼高力仪器公司。
1.3 实验方法
1.3.1 油凝胶的制备
将SA、GMS、GDS和GTS分别添加到花生油中,制备含有不同质量分数凝胶因子的油凝胶。将混合物在80 ℃下保持30 min,同时以300 r/min搅拌。然后,将混合物立即储存在20 ℃,并在环境温度下平衡过夜。第2天,通过倾斜 90°检查管内凝胶是否有任何流动。选择具有最小凝胶浓度的无流动混合物以制备油凝胶,并贮存在20 ℃,备用。
1.3.2 油损失(oil loss,OL)
根据前人的方法[9],使用离心法测量油凝胶的油损失和油结合能力(oil binding capacity,OBC)。将1.0 g新鲜油凝胶样品以10 000 rad/s离心15 min,然后将离心管倒置24 h以除去泄漏的油。OL和OBC按公式(1)和公式(2)计算:
(1)
(2)
式中:m1是初始样品和离心管的质量,g;m2是去除泄漏油后样品和离心管的质量,g;m是离心管的质量,g。
1.3.3 线性和非线性流变测量
油凝胶的流变测量由旋转流变仪进行,该流变仪具有40 mm平行板几何形状(1 000 μm间隙)。在1 Hz 频率下测量0.01%~100%应变扫描,以确定线性黏弹性区域(linear viscoelastic region, LVR)。在0.1%应变下测量了0.1~10 Hz频率的小型动态振荡剪切(small amplitude oscillatory shear, SAOS)。采用1 Pa 的振荡应力和1 Hz的频率以5 ℃/min的速率从20 ℃升温至60 ℃来测量样品随温度变化下的储存模量(storage modulus,G′)和损耗模量(loss modulus,G″)。
1.3.4 差示扫描量热法(differential scanning calorimetry,DSC)测量
油凝胶的热性能使用差示扫描量热法进行测量。将油凝胶(~5.0 mg)密封在坩埚中。将油凝胶样品在20 ℃下保持5 min,然后以5 ℃/min加热至 85 ℃,在85 ℃下保持2 min,并以5 ℃/min冷却至20 ℃。所有分析均一式三份进行。
1.3.5 固体脂肪含量(solid fat content,SFC)测定
使用低分辨率脉冲核磁共振测量油凝胶的固体脂肪含量。pNMR管(直径=10 mm)充满4~5 cm的样品。使用校准标准品(29.3% SFC和70.5% SFC),按照AOCS Cd16b-93方法在5~60 ℃下以5 ℃的步长测量 SFC 值。
1.3.6 偏振光显微镜(polarized light microscope,PLM)
偏振光学显微镜测试:按照我们之前的方法获得油凝胶的晶体微观结构[10],将油凝胶样品(~20 μg)放在载玻片上并用盖玻片覆盖,样品在20×放大倍率下可视化获取。
1.3.7 X射线衍射(X-ray diffraction,XRD)
使用Cu-Ka辐射为1.540 6 Å的X射线衍射仪测量宽角度X射线衍射(wide-angel X-ray diffraction, WAXD),以识别油凝胶的晶体结构。扫描样品的2θ角度为 1.0~35.0°,步长为 0.02°。将所有样品小心地倒入直径为 20 mm、深度为 1 mm 的圆形凹槽的圆形样品架中。然后,使用干净的载玻片小心地从样品架上刮下表面多余的样品。
1.3.8 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)
采用傅里叶变换红外光谱分析油凝胶样品的分子间作用力,并配备衰减全反射(attenuated total reflection,ATR)采样附件。将样品放置在待测区,在 400~4 000 cm-1获得光谱。所有光谱均减去在空气背景下测量的背景光谱,并通过 OMNIC(Thermo, v8.0)软件根据之前的方法进行分析[11]。
1.4 数据处理
使用 Origin 2018 完成统计分析。
2 结果与分析
2.1 油凝胶的构建
如图1所示,在SA质量分数为3%时无法形成致密的油凝胶,质量分数提高(≥5%)后可形成透明色凝胶,当SA的质量分数>11%时,凝胶开始变成不透明的乳白色;GMS在3%时为透明油凝胶,质量分数大于5%后油凝胶转为乳白色;GDS则在质量分数大于7%后转为乳白色;GTS基油凝胶在质量分数为9%前无法胶凝,在15%后油凝胶的颜色为乳白色。可能是因为光学性质与凝胶的结晶度有关[12]。相比之下,GTS需更大的添加量才能成功制备束缚液油能力较强的GTS基油凝胶。因此,选择SA、GMS、GDS(质量分数3%、5%、7%、9%和11%)和GTS(质量分数9%、11%、13%、15%和17%)进行下一步分析。

a-SA;b-GMS;c-GDS;d-GTS
图1 各类凝胶因子制备得到油凝胶的倒置图
Fig.1 The inverted diagram of the oleogels was obtained by the preparation of various gelling agents
为进一步研究凝胶因子的类型和浓度对油凝胶形成的影响,我们进行了OL和OBC的测定,以确定凝胶因子捕获液油的能力。图2为SA、GMS、GDS、GTS 4种类型油凝胶的油损随含量的变化情况。由图2可知,油凝胶的OBC随着凝胶因子的加入而增加。在SA质量分数较低(<7%)阶段油损较高,具有较弱的凝胶能力,对液油的捕获能力较差。当质量分数高于7%时油凝胶油损失降为0,说明高浓度的SA可以形成较强的网络结构。GDS基油凝胶具有相似的结果,但其油损失略小于SA。GMS基油凝胶持油率均大于95%,表明GMS基油凝胶具有优异的凝胶能力,在质量分数较低时凝胶能力也比较强。11%及以上质量分数的GTS基油凝胶可以形成较好的凝胶网络。结果表明,GMS能更有效地将液油捕获到凝胶网络结构中。

a-SA基油凝胶;b-GMS基油凝胶;c-GDS基油凝胶;d-GTS基油凝胶
图2 四种油凝胶的持油率
Fig.2 Oil-binding capacity of four oleogels
2.2 流变特性
我们通过对样品的流变学研究进一步确认不同类型浓度油凝胶的形成,结果如图3所示。在一定的应力范围内,存储模量(G′)和损耗模量(G″)不随剪切应力的变化而变化,这个范围称为线性黏弹区(LVR)。首先通过应力扫描确定4种油凝胶的LVR,随后在 LVR 内,通过频率扫描得到样品的存储模量(G′)和损耗模量(G″)。样品的G′均高于相应的G″值,表明油凝胶对变形速率具有良好的容忍度,具有弹性的类固体行为[13],形成了强凝胶。相同浓度下油凝胶的G′值依次为GMS>GDS>SA>GTS,从流变学的角度来看,较强的凝胶具有较高的G′值,并且这些值与频率无关[14]。

a-SA基油凝胶;b-GMS基油凝胶;c-GDS基油凝胶;d-GTS基油凝胶
图3 四种油凝胶的应力扫描、频率扫描、温度扫描曲线
Fig.3 Amplitude sweeps, frequency sweeps and temperature sweep curves of four oleogels
2.3 热力学特性
2.3.1 流变分析
一旦成核发生,凝胶分子继续扩散到晶体表面,并积聚到生长的晶体表面。这一过程持续进行,直到自组装晶体缠结并形成一个连续的三维网络,能够固定液油。如图3所示,为了进一步验证油凝胶结构与脂质结晶特性的关系,扫描了样品从20 ℃升高到60 ℃的模量。同时,测量了油凝胶的凝胶温度(gelation temperature, Tg,定义为G′和G″曲线交点处的温度)[15]。随着温度的升高,在接近Tg时,4种油凝胶的G′和G″都有一个快速下降的阶段,表明样品网络结构的融化和塌陷。且Tg值随着凝胶因子含量的增加而增加,即弹性性质的网络结构的塌陷需要更高的温度,体系结构的热稳定性增加。油凝胶的G′和G″均在40 ℃左右突然下降,这与油凝胶的主要晶体在约40 ℃的熔化有关。这些结果与DSC和PLM的结果一致。其中,GMS基油凝胶的Tg较高,且随着浓度的增加,Tg升高的速率也较快,说明其网络结构更为稳定;SA基和GDS基油凝胶随温度的变化情况相似,不同浓度G′和G″的交点均出现在较低温度处,且交点对应的存储模量较低,晶体网络较为脆弱。从流变特性分析可得,形成油凝胶的稳定性为GMS>GDS>SA>GTS。
2.3.2 DSC分析
由图4可知,随着含量的增加,向温度升高的方向结晶峰逐渐变大,移动焓值也不断变大,油中的凝胶推动力更强从而形成更多的晶体和更大的熔化焓值[16],在4种油凝胶结晶图中也可以观察到类似现象。随着温度升高,SA基油凝胶熔融曲线由于晶体融化中出现单一的吸热峰,说明加入SA后凝胶只有一种晶体形态。而GMS基油凝胶的熔融、结晶曲线中在14 ℃左右额外出现了一个小的肩峰,这是因为GMS含有极性酯基,晶体形态增多。而长烃链与极性酯基之间的范德华相互作用远强于通过末端—CH3基团的分子相互作用,所以GMS基油凝胶分子间相互作用更强更易于结晶,在图中表现为主峰变宽。从GMS的结晶曲线中发现,结晶主峰对应的温度相较于SA、GDS和GTS有明显的右移至40~50 ℃。从前面的研究知道,在较低温度下的结晶转变,显示出多晶态转变为较不稳定的结晶形式[17],也说明了GMS晶体较其他油凝胶具有更好的网络结构。GDS基油凝胶的熔融曲线和结晶曲线差异较大,熔融曲线无明显峰形,没有明确的熔点,只有一个熔点区域。表明油的完全包裹没有发生,也没有形成连续的网络;而结晶曲线的峰较为平缓,也说明结晶较少。GTS基油凝胶的熔融曲线在30 ℃附近出现了结晶峰,主峰出现在60 ℃附近,表明酯基的增多,改变了凝胶的结晶行为。而其结晶曲线则类似于GDS基油凝胶的结晶曲线, 都出现了一个尖锐的放热峰,表明脂质在短时间内完成了初始成核和晶体生长[18]。
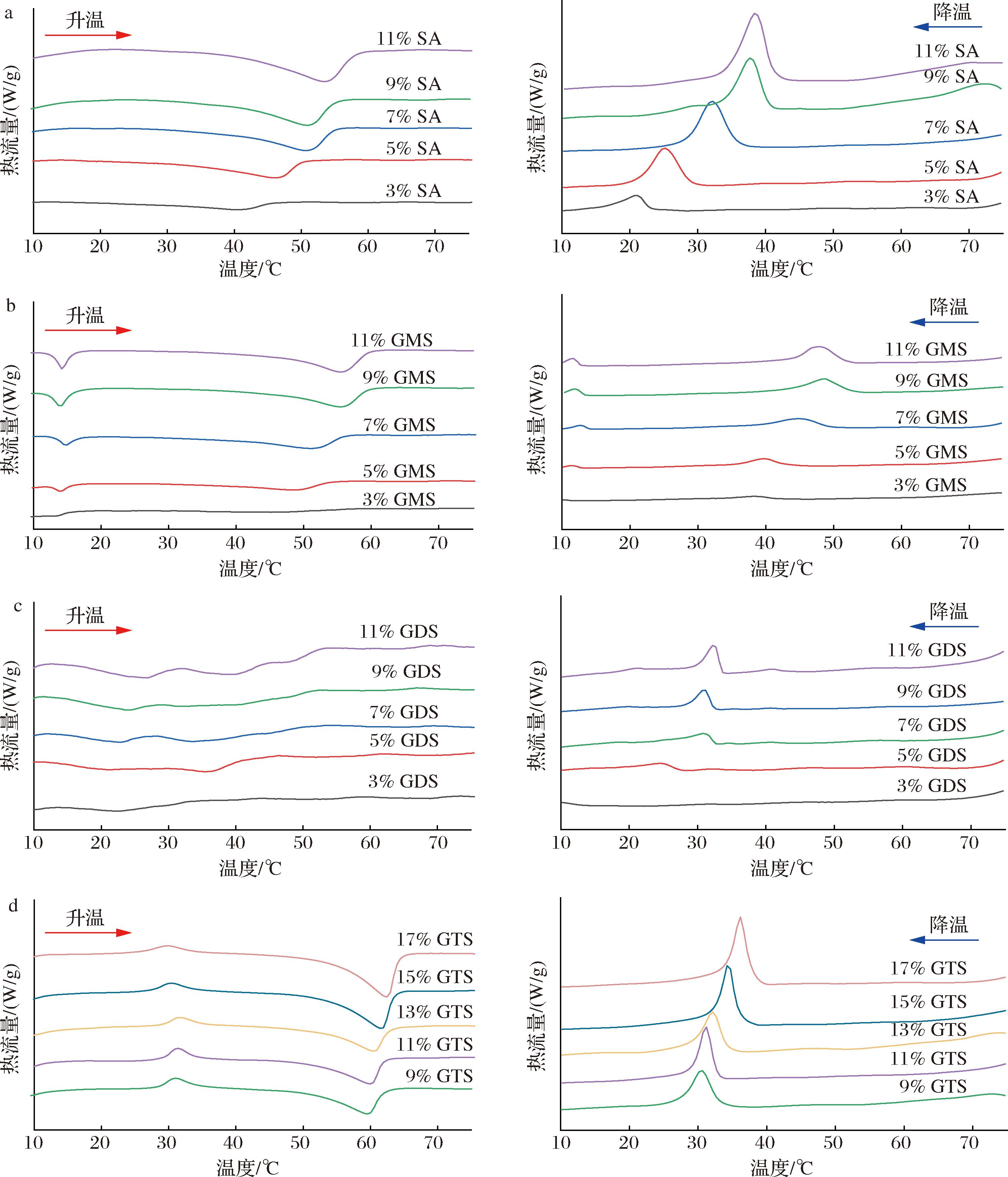
a-SA基油凝胶;b-GMS基油凝胶;c-GDS基油凝胶;d-GTS基油凝胶
图4 四种油凝胶的 DSC 熔融曲线、结晶曲线
Fig.4 DSC melting curves and DSC crystallization curves of four oleogels
2.3.3 SFC分析
油凝胶的固体脂肪含量(SFC)会影响其理化性质(稠度、可塑性等),而这些性质与油凝胶的类型、含量和环境温度有关。由图5可知,所有油样在 0~10 ℃都含有大量的固体脂肪,SFC均随温度的升高而降低。当温度达到 40 ℃以上时,SFC值接近于零,说明此时油凝胶形成的网络结构完全崩塌,以液态形式存在。
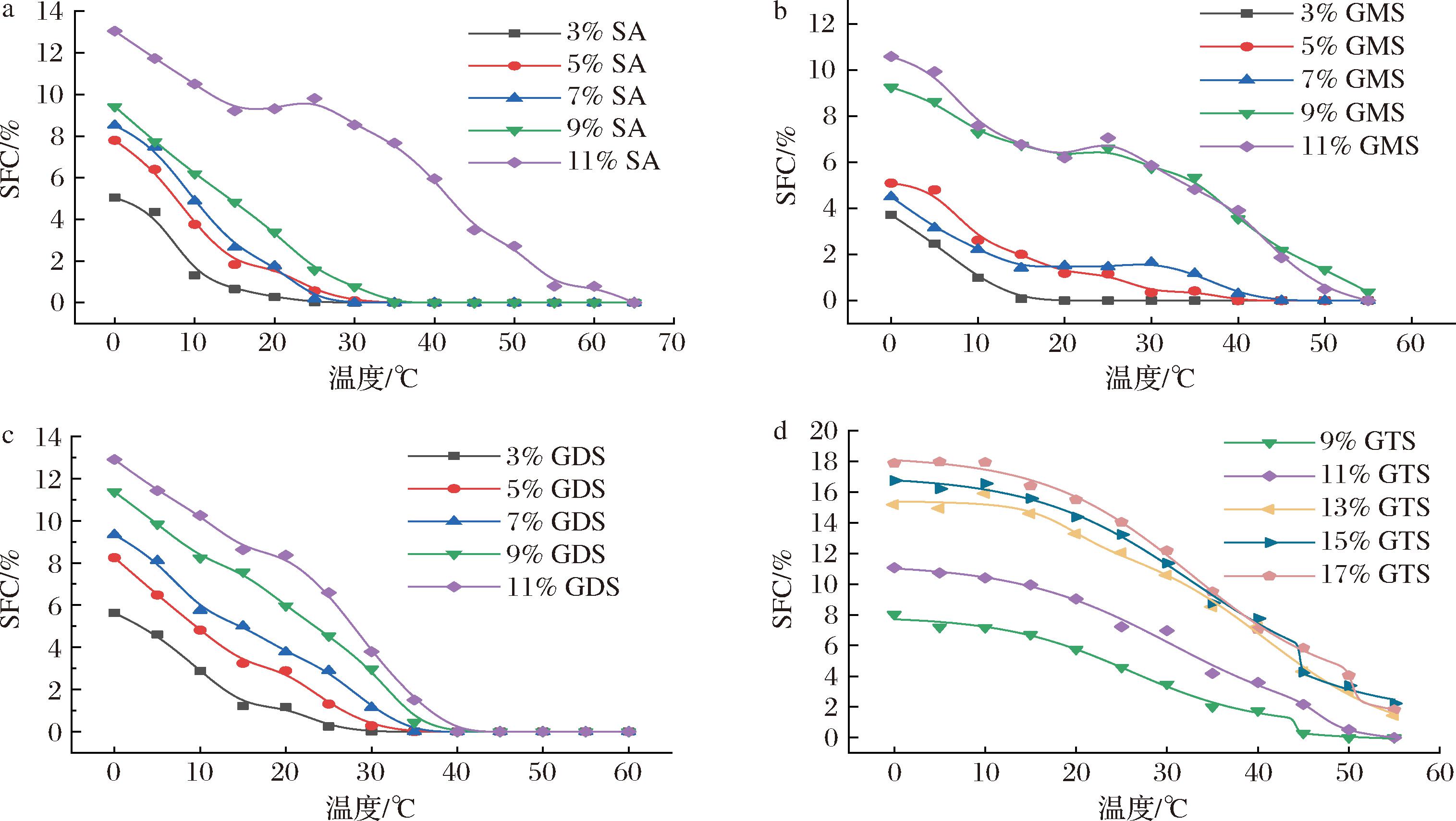
a-SA基油凝胶;b-GMS基油凝胶;c-GDS基油凝胶;d-GTS基油凝胶
图5 四种油凝胶的固体脂肪含量
Fig.5 SFC curves of four oleogels
随SA质量分数的增加,在熔融温度之前样品的SFC值增加,说明随SA含量增加形成的油凝胶的量也增加。当SA质量分数达到11%时,SFC曲线下降更平缓,这意味着含量增加时SA基油凝胶的晶体网络结构具有更强的稳定性;GMS基油凝胶的曲线,质量分数较小(<9%)时,SFC值随含量变化情况与SA基油凝胶趋势相同,但更为平缓。而质量分数为9%和11%的2条曲线下降均较为平缓且相似,说明二者的晶格网络稳定性较好且形成的晶体纤维类似无明显区别。GMS基与GTS基油凝胶的 SFC 曲线下降比GDS更平缓,这意味着当温度升高时GMS基与GTS基油凝胶的晶体网络结构具有更强的稳定性,同质量分数条件下GMS基油凝胶则更稳定。总体而言,4种类型的油凝胶存在差异且GMS优于SA、GDS、GTS。
2.4 微观结构
进一步采用PLM观察了4种油凝胶的微观结构,以探究微观晶体网络与其凝胶能力之间的关系。如图6所示,不同凝胶因子制备得到的油凝胶的晶体形态不同。随含量增加,4种类型的油凝胶结晶数目增多、尺寸增大,高质量分数凝胶因子会引起更高程度的过饱和,从而加速成核和随后的凝胶化,形成更紧密的油凝胶网络。同时,可以观察到不同样品的晶体形状和晶体直径存在显著差异,这可能是由于不同凝胶因子可以参与脂肪晶体的形成,影响脂肪晶体簇的生长,导致油凝胶呈现不同的晶体微观结构[19]。

a-SA基油凝胶;b-GMS基油凝胶;c-GDS基油凝胶;d-GTS基油凝胶
图6 四种油凝胶的微观晶体形态(标尺为 50 μm)
Fig.6 Crystal morphology of four oleogels
SA基油凝胶呈现出尺寸较大的线状晶体和大的羽毛状晶体,呈各向同性分散,随浓度增大,重新排列成非常有序和各向异性的纤维晶体[8],视野中大晶体的数量和尺寸增加。晶体尺寸越大,其结构内容纳液油的能力就越低[20]。GTS则为球晶型晶体,对应于晶片的聚集,它们从相同的中心核径向生长,并可能在老化过程中产生分枝,结晶颗粒趋于细腻、细小、均匀,不利于包裹液油,导致连接弱,凝胶不稳定[21]。
相比之下,GMS和GDS在低质量分数时都表现出针状结晶,纤维状的针状晶体形成一个强大的凝胶网络,导致高熔点和结晶点。而高质量分数的GMS与GDS 相比,GMS形成相对较长和较厚的球形团簇,在晶界面间啮合良好,这有助于形成强大的晶体网络,这些晶体排列可以解释GMS和GDS凝胶混合物在流变学上的差异。
2.5 晶型分析
α、β′和β是油脂3个基本的晶型,分别对应脂肪酸链主要的3种横截面排列形式。α晶型具有最低的排列密度、最快的生长速度、最低的熔点,因而是最不稳定的,α多晶型的短间距出现在4.10 Å附近;β晶型具有最高的排列密度和熔点,是最稳定的,但其晶体一般坚硬而粗大,β多晶型的间距出现在 3.70, 3.90和4.60 Å;β′晶型介于α和β晶型之间,β′晶型的晶体细小、均一,形成细腻的网络结构,因而其比表面积较大可以束缚液油,β′多晶型的特征在于3.80和4.20 Å的2个强间距[22]。
如图7所示,一定质量分数SA制备的油凝胶(>7%)观察到3.78、4.20和4.59 Å处的衍射峰,表明体系中同时存在β′和β晶型,7.94 Å处的衍射峰代表晶体单斜晶胞的b维度。同样的,GDS基油凝胶在3.88、4.24和4.66 Å处观察到较弱的衍射峰,表明体系中同时存在β′和β晶型。而GMS基油凝胶在3.80、3.98和4.57 Å处观察到衍射峰,GTS基油凝胶在3.70、3.87和4.62 Å处观察到衍射峰,表明体系中只存在β晶型,且随着浓度的增加,β晶型的数量增加。另外,8.43 Å的反射峰被认为与β多晶型的倾斜形式有关。这些结果表明SA、GDS、GTS和GMS分子在晶体内的排列方式不同。
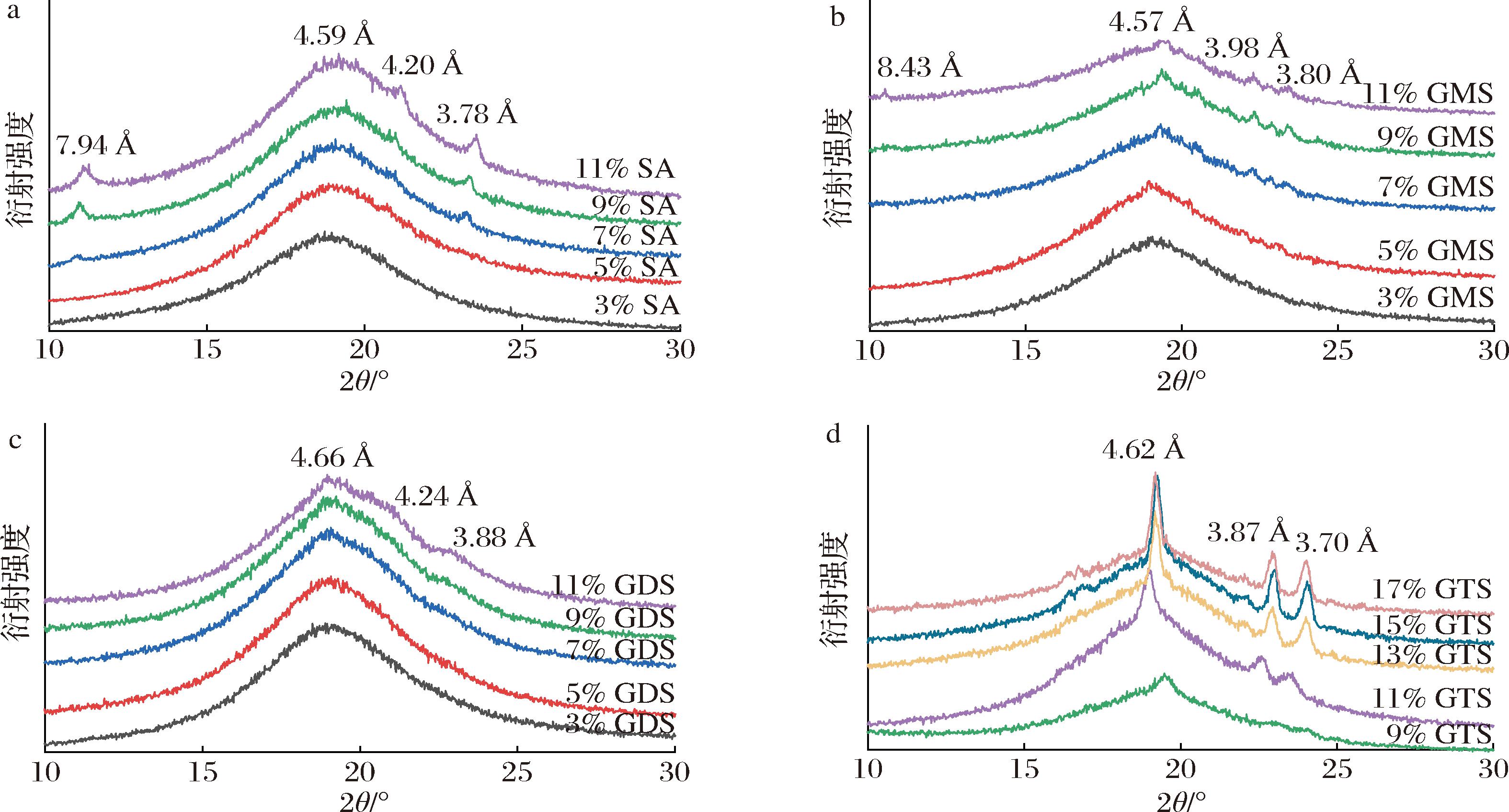
a-SA基油凝胶;b-GMS基油凝胶;c-GDS基油凝胶;d-GTS基油凝胶
图7 油凝胶的宽角度X射线衍射图谱
Fig.7 XRD patterns of oleogels with WAXD
2.6 分子间作用力
在XRD数据的基础上,为了进一步确定油凝胶体系中是否存在氢键相互作用,进行了FTIR测试。图8分别显示了不同浓度的SA基、GMS基、GDS基、GTS基油凝胶和纯油的FTIR光谱。所有油凝胶在1 750 cm-1左右都显示出强烈的峰,这可能与C![]() O拉伸有关,而SA基油凝胶在1 700 cm-1左右观察到1个弱峰,这是SA羰基的特征拉伸振动。在低质量分数(3%)下,未观察到SA的羰基特征峰,而高于质量分数时,SA的羰基特征峰强度随着SA质量分数的增加而增加。在2 938 cm-1和2 865 cm-1处观察到的峰值表明C—H拉伸,来自油凝胶中的CH3和CH2,而CH3和CH2的C—H弯曲则分别出现在1 438 cm-1和1 370 cm-1处。值得注意的是,基于GMS的油凝胶在3 320 cm-1和3 230 cm-1(O—H拉伸区)处显示出较宽的双峰吸收带,这表明分子间和分子内氢键的形成[23]。随着GMS质量分数的增加,宽双峰O—H吸收带向较低值移动。碳吸收峰(1 728 cm-1)向更高的波数值移动。O—H和羰基吸收峰的这种变化意味着GMS基油凝胶中分子间氢键的增强[8]。结果表明,油凝胶中GMS网络的形成主要是由甘油分子中—OH游离基团与脂肪酸C
O拉伸有关,而SA基油凝胶在1 700 cm-1左右观察到1个弱峰,这是SA羰基的特征拉伸振动。在低质量分数(3%)下,未观察到SA的羰基特征峰,而高于质量分数时,SA的羰基特征峰强度随着SA质量分数的增加而增加。在2 938 cm-1和2 865 cm-1处观察到的峰值表明C—H拉伸,来自油凝胶中的CH3和CH2,而CH3和CH2的C—H弯曲则分别出现在1 438 cm-1和1 370 cm-1处。值得注意的是,基于GMS的油凝胶在3 320 cm-1和3 230 cm-1(O—H拉伸区)处显示出较宽的双峰吸收带,这表明分子间和分子内氢键的形成[23]。随着GMS质量分数的增加,宽双峰O—H吸收带向较低值移动。碳吸收峰(1 728 cm-1)向更高的波数值移动。O—H和羰基吸收峰的这种变化意味着GMS基油凝胶中分子间氢键的增强[8]。结果表明,油凝胶中GMS网络的形成主要是由甘油分子中—OH游离基团与脂肪酸C![]() O基团之间的氢键促进的。通常,在油凝胶中,氢键被认为是形成三维凝胶网络的有效作用力[8]。在SA基、GDS基、GTS基油凝胶的光谱图谱中没有出现氢键,表明脂肪酸尾部之间的范德华相互作用是稳定结构的主要原因,这与以往研究一致[24]。
O基团之间的氢键促进的。通常,在油凝胶中,氢键被认为是形成三维凝胶网络的有效作用力[8]。在SA基、GDS基、GTS基油凝胶的光谱图谱中没有出现氢键,表明脂肪酸尾部之间的范德华相互作用是稳定结构的主要原因,这与以往研究一致[24]。
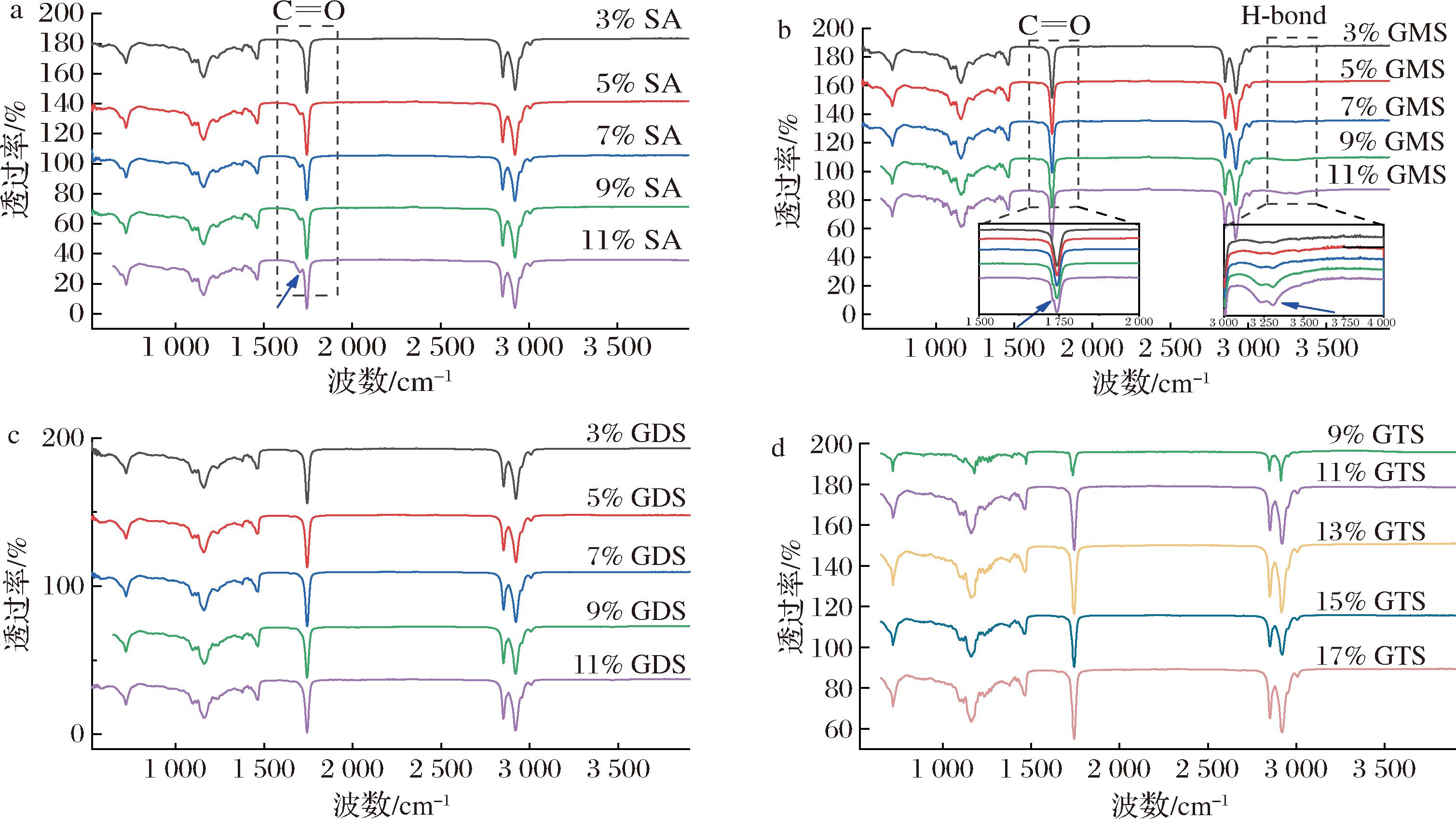
a-SA基油凝胶;b-GMS基油凝胶;c-GDS基油凝胶;d-GTS基油凝胶
图8 油凝胶的 FTIR
图
Fig.8 FTIR spectrum of oleogels
3 结论与讨论
本文选用SA、GMS、GDS和GTS研究其作为凝胶因子的结晶行为。流变测试表明,4种凝胶因子制备得到的油凝胶都具有强凝胶特性。热力学行为显示GMS基油凝胶具有更好的热稳定性能,GMS浓度对分解温度的影响更强。通过PLM观察到,不同凝胶因子制备的油凝胶的晶体形态不同,其中GMS基油凝胶表现出小针状结晶,更有利于形成强大的凝胶网络对液油进行有效束缚。XRD显示GMS基油凝胶呈现最稳定的β晶型。结合FTIR光谱分析,与SA基、GDS基和GTS基油凝胶相比,GMS基油凝胶具有更高的氢键形成能力。这些结果为SA基、GMS基、GDS基和GTS基油凝胶的氢键类型以及结构和油凝胶性能之间的关系提供了理论支持。
[1] BLACH C, GRAVELLE A J, PEYRONEL F, et al. Revisiting the crystallization behavior of stearyl alcohol:Stearic acid (SO∶SA) mixtures in edible oil[J].RSC Advances, 2016,6(84):81151-81163.
[2] HWANG H S, FHANER M, WINKLER-MOSER J K, et al. Oxidation of fish oil oleogels formed by natural waxes in comparison with bulk oil[J] .European Journal of Lipid Science and Technology, 2018,120(5):1700378.
[3] O′SULLIVAN C M, BARBUT S, and MARANGONI A G, Edible oleogels for the oral delivery of lipid soluble molecules:Composition and structural design considerations[J].Trends in Food Science &Technology, 2016,57:59-73.
[4] WANDERS A J, ZOCK P L, BROUWER I A, Trans fat intake and its dietary sources in general populations worldwide:A systematic review[J].Nutrients, 2017,9(8):840.
[5] CO E D, MARANGONI A G. Organogels:An alternative edible oil-structuring method[J].Journal of the American Oil Chemists Society, 2012,89(5):749-780.
[6] SINGH A, AUZANNEAU F I, ROGERS M A. Advances in edible oleogel technologies—A decade in review[J].Food Research International, 2017,97:307-317.
[7] SIRAJ N, SHABBIR M A, AHMAD T, et al. Organogelators as a saturated fat replacer for structuring edible oils[J].International Journal of Food Properties, 2015,18(9):1973-1989.
[8] ROSEN-KLIGVASSER J, DAVIDOVICH-PINHAS M. The role of hydrogen bonds in TAG derivative-based oleogel structure and properties[J].Food Chemistry, 2021,334:127585.
[9] SHI Y F, LIU C H, ZHENG Z J, et al. Gelation behavior and crystal network of natural waxes and corresponding binary blends in high-oleic sunflower oil[J].Journal of Food Science, 2021,86(9):3987-4000.
[10] LIU C H, ZHENG Z J, MENG Z, et al., Beeswax and carnauba wax modulate the crystallization behavior of palm kernel stearin[J].LWT, 2019,115:108446.
[11] LIU C H, ZHENG Z J, SHI Y F, et al. Development of low-oil emulsion gel by solidifying oil droplets:Roles of internal beeswax concentration[J].Food Chemistry, 2021,345:128811.
[12] TERECH P, PASQUIER D, BORDAS V, et al. Rheological properties and structural correlations in molecular organogels[J].Langmuir, 2000,16(10):4485-4494.
[13] MARTINS A J, CERQUEIRA M A, CUNHA R L, et al. Fortified beeswax oleogels:Effect of β-carotene on the gel structure and oxidative stability[J].Food &Function, 2017,8(11):4241-4250.
[14] PALLA C, GIACOMOZZI A, GENOVESE D B, et al. Multi-objective optimization of high oleic sunflower oil and monoglycerides oleogels:Searching for rheological and textural properties similar to margarine[J].Food Structure-Netherlands, 2017,12:1-14.
[15] LUPI F R, GABRIELE D, GRECO V, et al. A rheological characterisation of an olive oil/fatty alcohols organogel[J].Food Research International, 2013,51(2):510-517.
[16] DOAN C D, TAVERNIER I, BIN SINTANG M D, et al. Crystallization and gelation behavior of low- and high melting waxes in rice bran oil:A case-study on berry wax and sunflower wax[J].Food Biophysics, 2017,12(1):97-108.
[17] CHEN C H, VAN DAMME I, TERENTJEV E M. Phase behavior of C18 monoglyceride in hydrophobic solutions[J].Soft Matter, 2008,5(2):432-439.
[18] LEI M T, ZHANG N, LEE W J, et al. Non-aqueous foams formed by whipping diacylglycerol stabilized oleogel[J].Food Chemistry, 2020,312:126047.
[19] DOAN C D, TO C M, DE VRIEZE M, et al. Chemical profiling of the major components in natural waxes to elucidate their role in liquid oil structuring[J].Food Chemistry, 2017,214:717-725.
[20] KANAGARATNAM S, ENAMUL HOQUE M, MAT SAHRI M, et al. Investigating the effect of deforming temperature on the oil-binding capacity of palm oil based shortening[J].Journal of Food Engineering, 2013,118(1):90-99.
[21] DOAN C D, VAN DE WALLE D, DEWETTINCK K, et al. Evaluating the oil-gelling properties of natural waxes in rice bran oil:Rheological, thermal, and microstructural study[J].Journal of the American Oil Chemists Society, 2015,92(6):801-811.
[22] TAVERNIER I, NORTON I T, RIMAUX T, et al. Effect of high cooling and shear rate on the microstructural development of hybrid systems containing diacylglycerols and triacylglycerols of palm origin[J].Journal of Food Engineering, 2019,246:141-152.
[23] GUNASEKAR V, RESHMA K R, TREESA G, et al. Xanthan from sulphuric acid treated tapioca pulp:Influence of acid concentration on xanthan fermentation[J].Carbohydrate Polymers, 2014,102:669-673.
[24] MENG Z, GUO Y, WANG Y, et al. Oleogels from sodium stearoyl lactylate-based lamellar crystals:Structural characterization and bread application[J].Food Chemistry, 2019,292:134-142.