糖尿病是一种由胰岛素分泌缺陷、作用缺陷所引起的以高血糖为特征的慢性代谢疾病[1],主要包括1型糖尿病、2型糖尿病、单基因糖尿病、继发性糖尿病、妊娠期糖尿病和未定型糖尿病6种类型[2]。据统计,2021年全球糖尿病患者约为5.366亿人,预计到2045年将增至7.832亿人[3]。我国是糖尿病患者数量最多的国家,2021年患者达1.4亿人,占全球报告患者总人数的26.2%,十年间增幅高达56%[4]。此外,糖尿病还伴有多种并发症,如眼睛微血管瘤、心脑血管疾病、肾功能异常等[5],严重危害人体健康,同时给社会及经济体系带来巨大压力。目前,治疗高血糖的药品大多是磺脲类、双胍类、胰岛素增敏剂等,这类药物虽然能够有效控制餐后血糖的升高,但价格昂贵,且长时间使用容易产生肠胃胀气、腹泻等副作用和耐药性问题[6]。近年来,通过高安全性的天然产物成分抑制α-葡萄糖苷酶和α-淀粉酶活力来降低餐后高血糖已成为缓解糖尿病的重要途径之一。因此,从植物资源中提取安全有效的α-葡萄糖苷酶和α-淀粉酶抑制剂已成为食品、生物及医药领域关注的热点。
海红米也被称为海稻米,属于禾本科稻属(Oryza)杂草稻,是禾本科稻属植物,富含淀粉、蛋白质及各类营养素[7]。区别于普通红米,海红米生长在海边滩涂地区,是通过海水浇灌的具有耐盐碱特性的水稻,比普通栽培水稻更具生长优势和生存竞争能力[8]。目前,海红米的研究主要是关于栽培技术和米质分析方面[9],对生理活性方面研究较少,且主要集中在调控肠道微生物组成、改善小鼠抑郁行为、增强抗炎、抗氧化及免疫调节机能等[10-11]。海红米的生理功能活性成分主要集中在种皮部分,研究显示其种皮富含黄酮类化合物、花青素、维生素E和谷胱甘肽等,其中因其花青素含量尤为丰富而呈现出胭脂红色[12]。植物中游离的花青素稳定性差,在受不同因素影响时的颜色变化较大,在自然界中一般以其糖苷即花色苷的形式存在。花色苷是以黄酮核为基础的类黄酮物质[13],广泛存在于果蔬中,在清除体内自由基、抗炎症、抗肿瘤、降血糖及保护视力[14-15]等方面具有显著优势,且具有天然绿色、无副作用的特点。研究表明,富含花色苷的黑米、红米、黑豆等能有效调节小鼠的血脂和血糖水平,并提高其抗氧化酶活性[16-17]。
目前,在有色大米中,大多以黑米和普通红米中的花色苷为对象进行降血糖作用研究,而有关海红米及其花色苷降糖活性的研究较少。本研究采用单因素和正交试验优化海红米花色苷的制备提取条件,并通过体外α-葡萄糖苷酶和α-淀粉酶抑制模型与酶抑制动力学方法研究海红米花色苷的体外降糖作用及酶抑制方式,可为海红米资源的综合利用奠定一定的基础。
1 材料与方法
1.1 材料与试剂
海红米于2022年9月购自广东省湛江市遂溪县建新镇苏二村;α-葡萄糖苷酶(70万 U/mL)、α-淀粉酶(猪胰腺,5 U/mg)、可溶性淀粉、对硝基苯-β-D-吡喃葡萄糖苷(nitrophenyl β-D-glucopyranoside, p-NPG)、PBS磷酸盐缓冲液(0.1 mol/L,pH=6.8),上海源叶生物科技有限公司;阿卡波糖与3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂,北京索莱宝科技有限公司;无水乙醇、冰醋酸、盐酸与正己烷均为分析纯。
1.2 仪器与设备
6L-15C型胶辊砻谷机,广东饶平县万盛粮食机械有限公司;ATY 124型电子天平,日本岛津公司;PHS-3C型pH计,上海雷磁-上海仪电科学仪器有限公司;Varioskan Flash型全自动酶标仪,美国Thermo公司;N-4000型旋蒸浓缩系统,东京理化器械公司;KQ-500DB型数控超声仪,昆山市超声仪器有限公司;GM-0.33A型隔膜真空泵过滤器,天津市津腾实验设备有限公司;5810R型高速台式冷冻离心机,美国Eppendorf公司。
1.3 海红米花色苷的提取与含量测定
1.3.1 海红米种皮的脱脂
海红米用蒸馏水洗净,采用砻谷机将海红米脱皮,得脱皮海红米及海红米种皮。种皮用蒸馏水洗净晾干,粉碎后过60目筛,得到种皮粉末。称取一定量种皮按料液比1∶5(g∶mL)加入正己烷混合均匀,在室温下浸提3 h脱脂。用布氏漏斗抽滤去除正己烷,自然晾干至有机溶剂完全挥发,得脱脂海红米种皮粉,于封口袋内密封保存。
1.3.2 海红米花色苷的提取
采用超声提取法,考察不同条件:乙醇pH值、乙醇体积分数、提取温度、提取时间对海红米花色苷提取的影响。收集合并提取液在3 000 r/min条件下离心15 min并真空抽滤,获得含有花色苷的澄清提取液,于适宜温度条件下减压浓缩去除乙醇,获得海红米花色苷粗提取物,保存于4 ℃冷藏备用。
1.3.3 海红米花色苷的含量测定
海红米花色苷的含量测定参考陈忠琴[18]的研究采用pH示差法。准确吸取1 mL提取物溶液2份,分别用pH 1.0和pH 4.5的缓冲溶液稀释,并分别平衡50和80 min,以蒸馏水作空白对照,分别在520、700 nm波长下测定样品液的吸光度值。
总花色苷含量按矢车菊素-3-O-葡萄糖苷记,计算如公式(1)所示:
(1)
式中:ρ,总花色苷含量,mg/mL;A=(A520nm-A700nm)pH 1.0-(A520nm-A700nm)pH 4.5;DF,稀释因子;MW,矢车菊花青素-3-O-葡萄糖苷的分子质量,449.2 g/mol;L,比色皿光程的距离,1 cm;ε,矢车菊花青素-3-O-葡萄糖苷的摩尔消光系数,26 900 L/(mol·cm)。
1.4 单因素试验
1.4.1 乙醇pH值的考察
称取脱脂海红米种皮粉末5份,每份10 g,分别加入pH值为0.25、0.5、0.75、1、2的75%(体积分数)乙醇150 mL,调节提取温度为45 ℃,超声提取30 min后,参照1.3.3节方法测定海红米中花色苷含量。
1.4.2 乙醇体积分数的考察
称取脱脂种皮粉末5份,每份10 g,分别加入pH值为0.75的45%、65%、75%、85%、95%乙醇150 mL,调节提取温度为45 ℃,超声提取30 min后,参照1.3.3节方法测定海红米中花色苷含量。
1.4.3 提取温度的考察
称取脱脂种皮粉末4份,每份10 g,加入75%乙醇150 mL,调节pH值为0.75,分别在25、35、45、55 ℃ 的条件下,超声提取30 min后,参照1.3.3节方法测定海红米中花色苷含量。
1.4.4 提取时间的考察
称取脱脂种皮粉末5份,每份10 g,加入75%乙醇150 mL,在45 ℃,pH值为0.75的条件下,进行超声提取,分别提取15、20、25、30、35 min后,参照1.3.3 节方法测定海红米中花色苷含量。
1.5 正交试验的考察
根据单因素试验筛选出4个因素中对海红米花色苷含量影响较大的3个水平,设计4因素3水平正交试验,实验结果使用Microsoft Excel 2021软件分析,确定花色苷的最佳提取工艺,详见表1。
表1 正交试验设计表
Table 1 Design table of orthogonal test
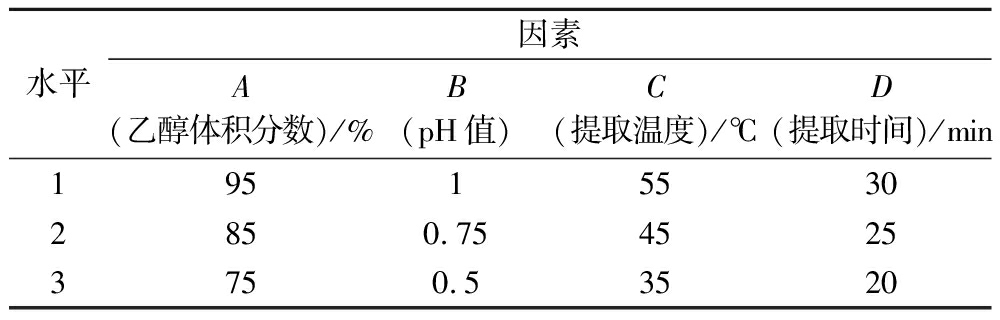
水平因素A(乙醇体积分数)/%B(pH值)C(提取温度)/℃D(提取时间)/min195155302850.7545253750.53520
1.6 海红米花色苷对α-葡萄糖苷酶和α-淀粉酶的抑制作用
将提取出的海红米花色苷按梯度浓度溶于蒸馏水中,配制成样品标准液,采用体外α-葡萄糖苷酶和α-淀粉酶抑制模型中酶抑制率为指标,评价海红米花色苷的体外降糖能力。
1.6.1 α-葡萄糖苷酶抑制率测定
参照蒋美龄等[19]的方法并稍作调整,采用p-NPG法测定样品的α-葡萄糖苷酶抑制能力。用移液枪吸取110 μL PBS磷酸盐缓冲液(0.1 mol/L,pH=6.8)于96孔板中,分别加入20 μL样品标准液和20 μL α-葡萄糖苷酶溶液(1 U/mL),轻振孔板使溶液混合均匀,置于37 ℃层析柜孵育10 min。加入20 μL PNPG底物(1.25 mmol/L),再次孵育20 min后,加入80 μL碳酸钠溶液(0.1 mol/L)终止反应。以阿卡波糖作为阳性对照品,对以上操作进行重复性实验。采用酶标仪在405 nm处测定其吸光度值,实验设置样品组、样品空白组、对照组、空白组,因花色苷在光照条件下不稳定,所以实验全过程避光进行。按公式(2)计算花色苷的α-葡萄糖苷酶抑制率:
α-葡萄糖苷酶抑制率![]()
(2)
1.6.2 α-淀粉酶抑制率测定
参照蒋美龄等[19]的方法并稍作调整,采用DNS比色法测定样品的α-淀粉酶抑制能力。在10 mL离心管中分别加入200 μL样品标准液和淀粉酶溶液(1 U/mL),置于37 ℃水浴锅中充分反应10 min后,加入200 μL体积分数为1%的可溶性淀粉,再次反应20 min后,加入1.0 mL DNS试剂,沸水浴反应10 min。迅速冷却,加入蒸馏水漩涡混匀终止反应。以阿卡波糖作为阳性对照品,对以上操作进行重复性实验。移取200 μL反应后溶液于96孔板中,在540 nm处检测其吸光度值,实验设置样品组、样品空白组、对照组、空白组,因花色苷在光照条件下不稳定,所以实验全过程避光进行。并按公式(3)计算花色苷的α-淀粉酶抑制率:
α-淀粉酶抑制率![]()
(3)
1.7 海红米花色苷的酶抑制动力学研究
1.7.1 α-葡萄糖苷酶抑制动力学研究
设定α-葡萄糖苷酶溶液浓度为1 U/mL,以不添加和添加海红米花色苷溶液(0、0.12、0.14 mg/mL)为实验条件,测定不同PNPG浓度下(1.25、2.5、5、10 mmol/L)的吸光度值,对以上操作进行重复性实验,得到其反应体系的反应速率。以底物浓度的倒数(1/ [S])为横坐标,反应速率的倒数(1/v)为纵坐标,绘制Lineweaver-Burk曲线(双倒数曲线),并根据Lineweaver-Burk方程计算判断海红米花色苷对α-葡萄糖苷酶的抑制类型。
1.7.2 α-淀粉酶抑制动力学研究
设定α-淀粉酶溶液浓度为1 U/mL,以不添加和添加海红米皮花色苷溶液(0、0.03、0.06 mg/mL)为实验条件,测定不同可溶性淀粉含量下(0.50%、0.75%、1%、1.25%、1.50%,质量分数)的吸光度值,对以上操作进行重复性实验,得到其反应体系的反应速率。以底物浓度的倒数(1/ [S])为横坐标,反应速率的倒数(1/v)为纵坐标,绘制Lineweaver-Burk曲线,并根据Lineweaver-Burk方程计算判断海红米花色苷对α-淀粉酶的抑制类型。
1.8 统计分析
所有试验数据经Microsoft Excel 2021初步处理后,用Origin 2017软件处理及生成图像。所有数据均以平均值±标准差呈现,并用IBM SPSS Statistics 26进行单因素方差分析(One-way ANOVA),差异显著性采用Duncan分析并进行多重比较,P<0.05表示组间差异显著。
2 结果与分析
2.1 海红米花色苷提取的单因素试验结果
海红米花色苷提取工艺优化的单因素试验结果如图1所示。由图1-A可知,当乙醇pH值为0.75时,提取的花色苷含量达到最大值,为1.38 mg/mL,而一旦pH>1.0,提取的花色苷含量呈断崖式下降,表明强酸性条件更有利于保持海红米花色苷的稳定性,减少其分解。图1-B结果表明,当乙醇体积分数为85%时,海红米花色苷含量最高,为1.49 mg/mL,可能85%乙醇的极性与海红米花色苷的极性更为相似,在同一条件下提取的花色苷含量更高。而花色苷含量在乙醇体积分数>85%时显著下降,这可能与花色苷中的糖苷在过高浓度的乙醇溶剂中溶解率会下降有关。图1-C反映的是提取温度对提取海红米花色苷含量的影响,图中曲线呈现先上升后下降的趋势,在提取温度为45 ℃时含量达到最大值,为0.92 mg/mL。这可能是随着温度的升高体系黏度下降,传质过程加快,海红米花色苷能更好地溶于乙醇溶液中。而由于花色苷的不耐热性,当温度高于45 ℃时,花色苷发生分解,导致提取的花色苷含量随之下降[20]。图1-D显示,提取时间为25、30 min时,花色苷含量没有显著性差异,考虑到节能环保因素,选择25 min为提取时间,此时提取物液花色苷含量为1.05 mg/mL。
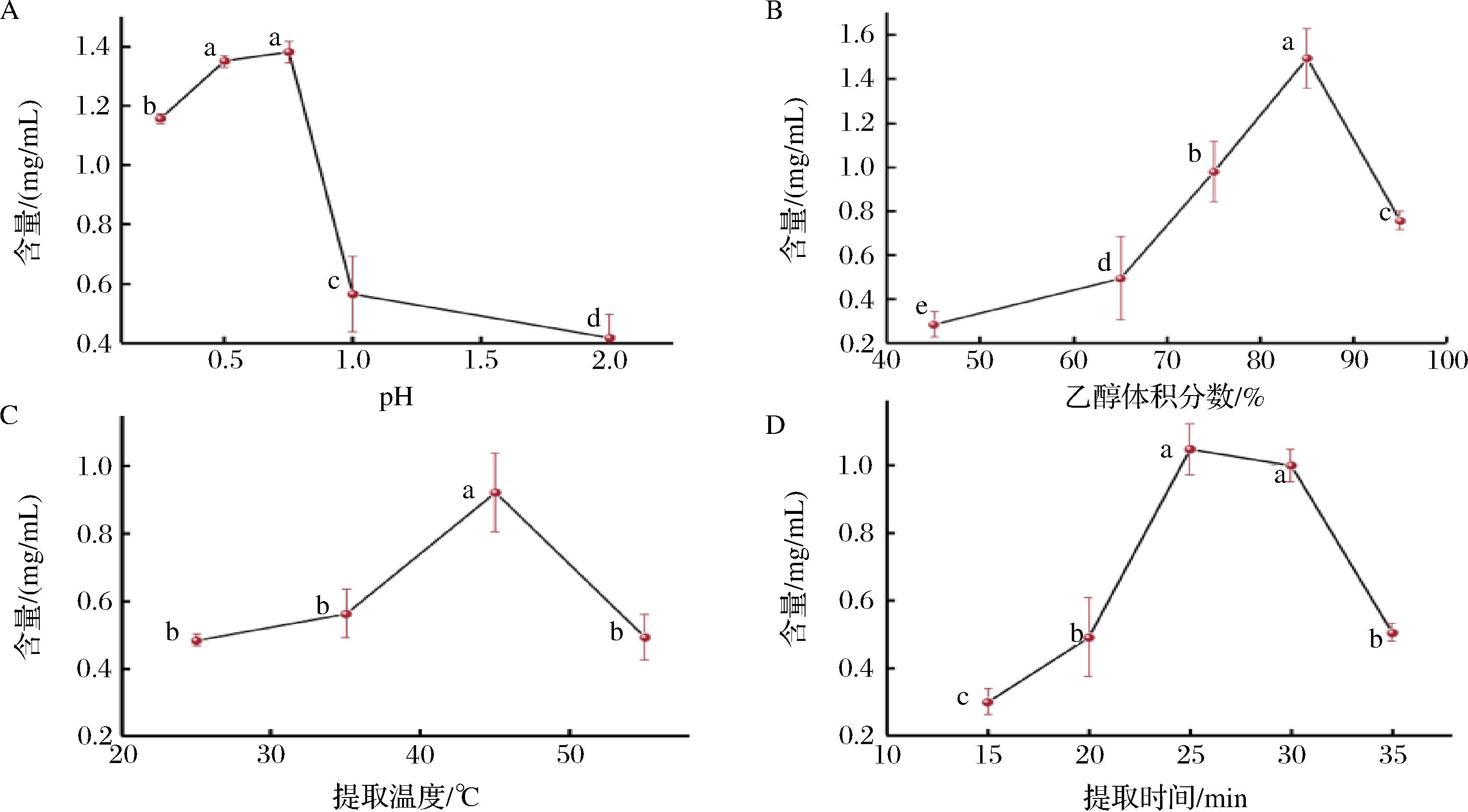
A-pH值;B-乙醇体积分数;C-提取温度;D-提取时间
图1 不同提取条件对海红米花色苷含量的影响
Fig.1 Effect of different extraction conditions on the content of anthocyanins from sea red rice
注:不同小写字母表示差异(P<0.05)(下同)。
2.2 海红米花色苷提取的正交试验结果
由表2结果可知,影响花色苷提取含量的因素主次顺序为:乙醇pH>提取温度>提取时间>乙醇体积分数,海红米花色苷提取的最佳工艺组合为A2B2C2D1(表2),即乙醇体积分数为85%、pH值为0.75、提取温度为45 ℃、提取时间为30 min,此条件下提取的海红米花色苷含量为1.66 mg/mL(通过测定密度后,相当于质量分数2.51 mg/g)。蒋海伟等[21]通过微波辅助提取法,在微波功率400 W、微波时间100 s、料液1∶22(g∶mL)、乙醇体积分数85%的条件下提取红米花色苷,测得含量为3.82 mg/100 g;郭晓宇等[22]采用回流提取法优化红米花色苷的提取工艺实验得出,在提取温度45 ℃,pH值0.7,提取时间2.5 h,料液比1∶7(g∶mL),乙醇体积分数75%的条件下,花色苷平均含量可达2.52 mg/g,与本研究提取物含量相似,说明这2种方法都能对花色苷进行充分的提取。
表2 正交试验结果设计表
Table 2 Design table of orthogonal test results
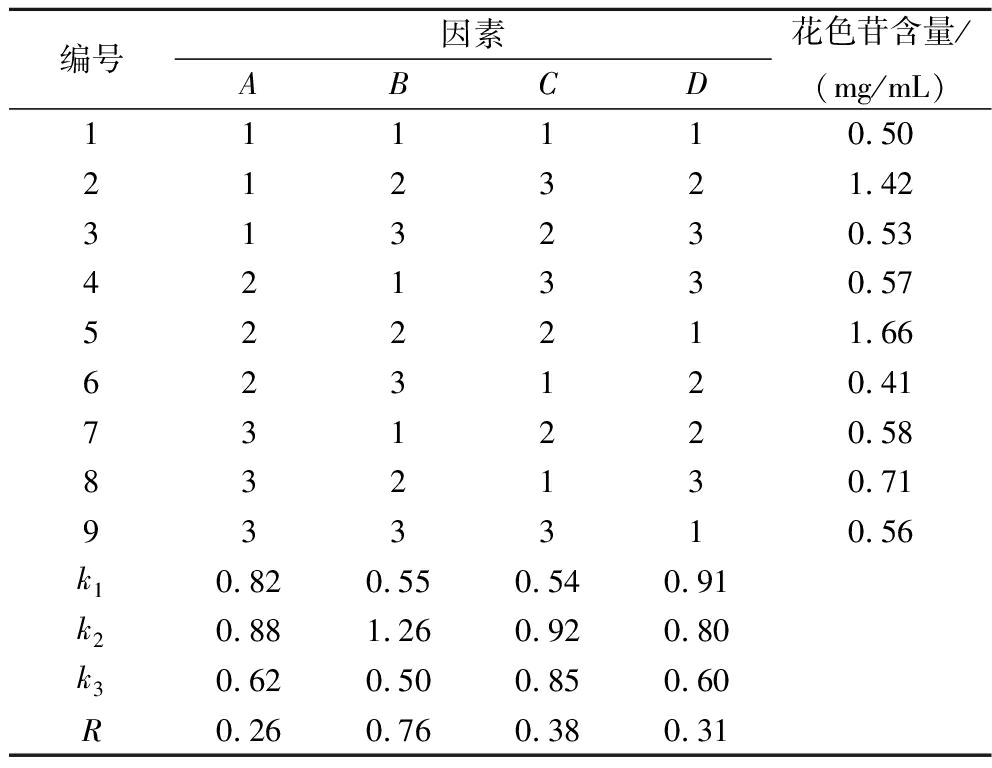
编号因素ABCD花色苷含量/(mg/mL)111110.50212321.42313230.53421330.57522211.66623120.41731220.58832130.71933310.56k10.820.550.540.91k20.881.260.920.80k30.620.500.850.60R0.260.760.380.31
2.3 海红米花色苷对α-葡萄糖苷酶和α-淀粉酶的抑制能力
α-葡萄糖苷酶和α-淀粉酶存在于人体肠道内,是影响饮食中淀粉等主要碳水化合物消化、吸收的关键酶。因此,通过抑制这2种酶活力来延缓人体对糖类和淀粉的消化与吸收是减缓血糖快速升高的有效策略[23-24]。由图2可知,海红米花色苷具有较强的α-葡萄糖苷酶和α-淀粉酶抑制作用,且随着花色苷质量浓度增加,其抑制能力提高,呈现一定的质量浓度依赖关系。当质量浓度为0.10~0.13 mg/mL时,花色苷对α-葡萄糖苷酶的抑制能力提升,从0.13 mg/mL开始趋于稳定,抑制率达98.68%,其IC50为0.11 mg/mL;当质量浓度0.02~0.10 mg/mL时,花色苷对α-淀粉酶的抑制能力提升,在质量浓度为0.10 mg/mL时抑制率达93.78%,其IC50为0.05 mg/mL。陈忠琴[18]在研究中发现,在质量浓度为0.25~1.25 mg/mL范围内,黑豆皮花色苷提取物对α-淀粉酶的IC50约为0.74 mg/mL,并呈质量浓度依赖关系。张玉[25]发现绿萝花提取物对α-葡萄糖苷酶有较好的抑制能力,IC50为267 μg/mL。与上述研究相比,本研究制备的海红米花色苷对α-葡萄糖苷酶和α-淀粉酶的抑制能力更强,说明其在降糖作用方面具有良好的应用前景。
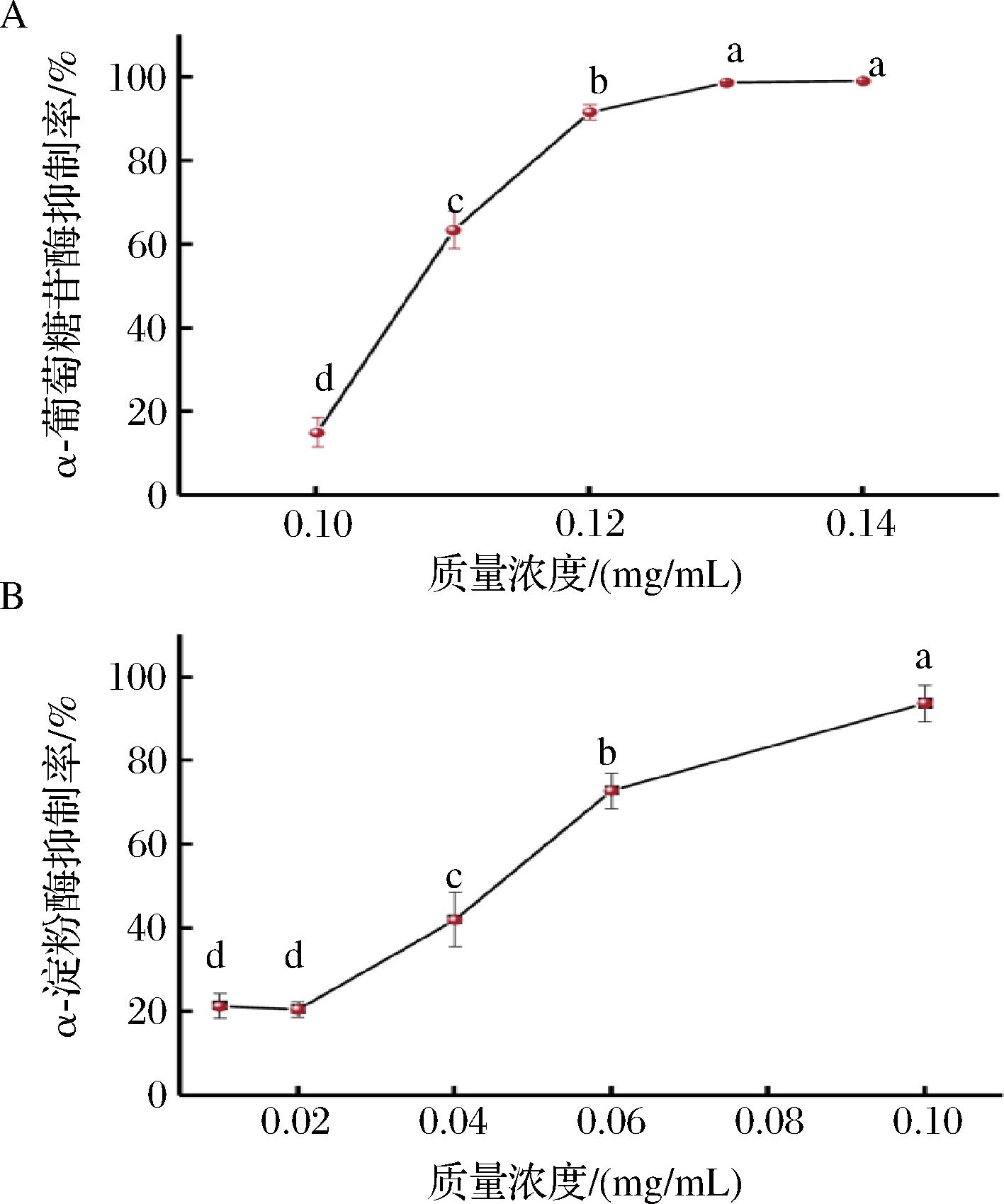
A-α-葡萄糖苷酶;B-α-淀粉酶
图2 海红米花色苷对α-葡萄糖苷酶和α-淀粉酶的 抑制作用
Fig.2 α-Glucosidase and α-amylase inhibitory effects of anthocyanins derived from sea red rice
2.4 海红米花色苷对α-葡萄糖苷酶和α-淀粉酶的抑制动力学研究
通过Lineweaver-Burk分析海红米花色苷对α-葡萄糖苷酶和α-淀粉酶的抑制方式。Lineweaver-Burk曲线中,若拟合直线于Y轴上交汇,表明抑制剂的化学结构与底物相似,抑制剂会与底物竞争酶的活性位点,使底物被排斥在反应中心外,属于竞争性抑制;若交于X轴,则表明此酶既可以与底物结合,同时也可以与抑制剂结合,生成的三元中间产物不能进一步分解,导致酶活力降低,此时抑制类型为非竞争性抑制;若拟合直线既不交于Y轴也不交于X轴,而是交于某一象限中,说明酶抑制方式属于非竞争性和竞争性混合型抑制方式[26]。
如图3-A所示,海红米花色苷的双倒数曲线表现出良好的线性关系,随着海红米花色苷质量浓度的增加,vmax和Km均减小,双倒数曲线均交于第三象限上一点,说明花色苷对α-葡萄糖苷酶的抑制类型属于非竞争性和竞争性混合型抑制;根据表3可知,花色苷对α-葡萄糖苷酶的竞争性抑制常数Kic值与非竞争性抑制常数Kiu分别为0.017与7.5×10-4 mg/mL,Kic>Kiu,且Lineweaver-Burk曲线与Y轴相交甚远,证明其混合抑制类型中非竞争性抑制占主导作用。
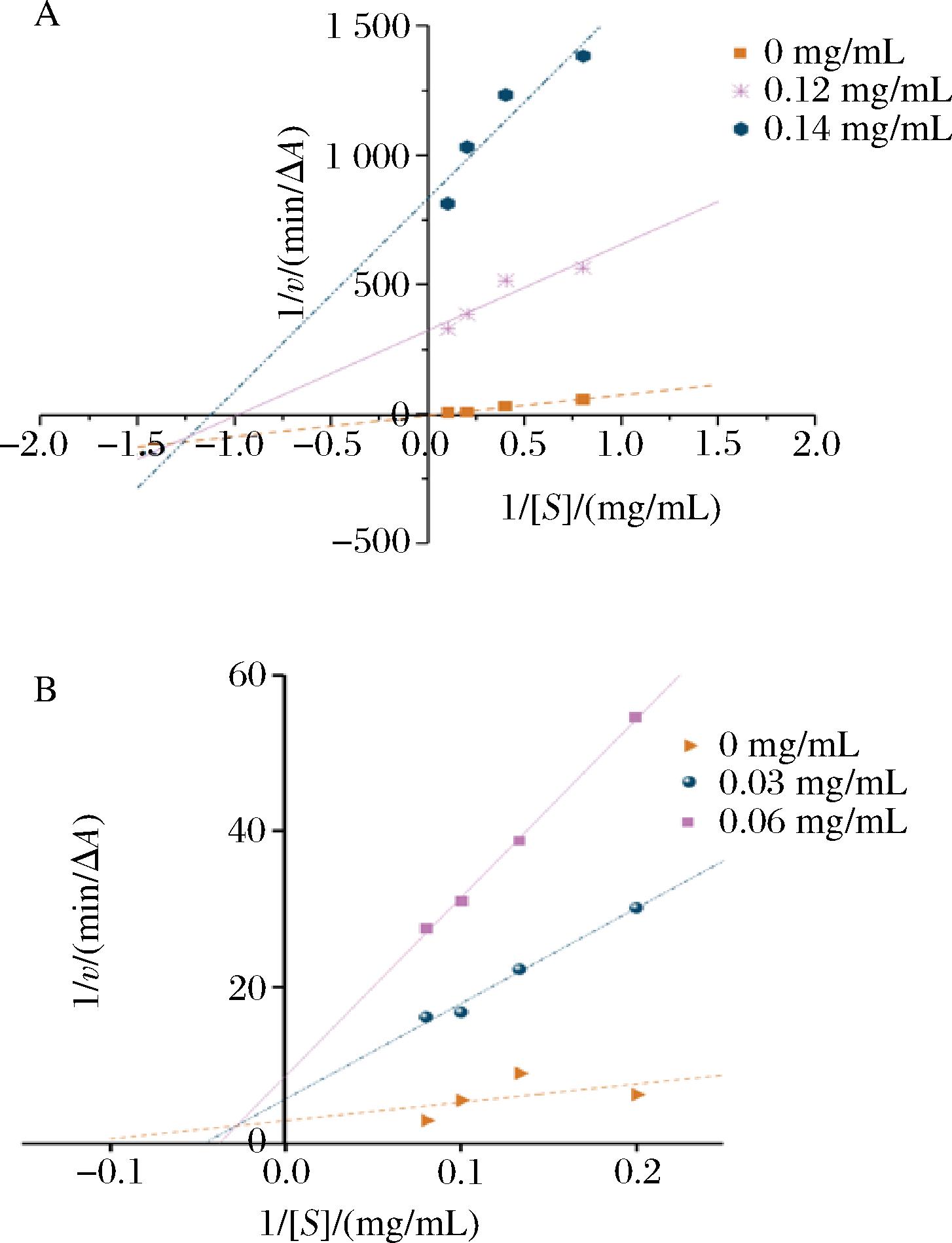
A-α-葡萄糖苷酶;B-α-淀粉酶
图3 海红米花色苷对α-葡萄糖苷酶与α-淀粉酶抑制 作用的Lineweaver-Burk曲线
Fig.3 Lineweaver-Burk plot for inhibition of anthocyanins derived from sea red rice against α-glucosidase and α-amylase
α-淀粉酶抑制动力学结果显示(图3-B),随着海红米花色苷质量浓度的增加,vmax减小,Km增大,双倒数曲线均交于第二象限上一点,表明海红米花色苷对α-淀粉酶的抑制类型同样为非竞争性和竞争性混合型抑制,其Kic值与Kiu分别为0.006 9与0.03 mg/mL,Kic<Kiu,表明花色苷对α-淀粉酶的混合抑制类型中竞争性抑制占主导作用,与花色苷对α-葡萄糖苷酶的抑制情况相反,这可能是由于α-葡萄糖苷酶和α-淀粉酶的结构存在差异[27],所以花色苷对二者的抑制机理不同。Kic值的倒数(1/Kic)越高,即Kic值越小,抑制剂与相关酶的结合程度越高,抑制作用越强[28]。通过比较海红米花色苷对α-葡萄糖苷酶和α-淀粉酶的Kic值可以发现,花色苷与α-淀粉酶的结合强度较α-葡萄糖苷酶更高,此结果与α-葡萄糖苷酶和α-淀粉酶抑制活性实验的结果一致。
表3 海红米花色苷抑制α-葡萄糖苷酶与α-淀粉酶的动力学参数
Table 3 Kinetic parameters of α-glucosidase and α-amylase inhibition by anthocyanins from sea red rice

样品质量浓度/(mg/mL)α-葡萄糖苷酶α-淀粉酶Km/(mg/mL)vmax/min-1Kic/(mg/mL)Kiu/(mg/mL)Km/(mg/mL)vmax/min-1Kic/(mg/mL)Kiu/(mg/mL)017.970.228.060.340.03--21.520.180.06--0.0177.5×10-426.450.120.006 90.030.121.090.003--0.140.890.001 3--
注:-表示未检测。
3 结论
本研究优化了海红米花色苷的提取工艺,通过α-葡萄糖苷酶和α-淀粉酶体外抑制实验及酶抑制动力学模型探究了花色苷的降糖作用及酶抑制方式。结果表明,海红米花色苷对α-葡萄糖苷酶和α-淀粉酶均具有显著的抑制作用,降糖应用潜力较大,且酶抑制动力学研究表明海红米花色苷主要通过非竞争性和竞争性混合抑制方式发挥酶抑制作用。本研究为海红米花色苷降血糖产品的开发提供了数据支撑,同时为海红米资源的综合利用奠定了一定的基础。
[1] Geneva: World Health Organization. World health statistics 2021: Monitoring health for the SDGs, sustainable development goals, 2021. Licence: CC BY-NC-SA 3.0 IGO.
[2] 中国医师协会内分泌代谢科医师分会, 国家代谢性疾病临床医学研究中心. 糖尿病分型诊断中国专家共识[J]. 中华糖尿病杂志, 2022, 14(2): 120-139. Endocrine Metabolic Branch of Chinese Medical Doctor Association, National Clinical Medical Research Center for Metabolic Diseases. Classification of diabetes mellitus in China: An expert consensus statement[J]. Chinese Journal of Diabetes Mellitus, 2022, 14(2): 120-139.
[3] SUN H, SAEEDI P, KARURANGA S, et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2022, 183:109119.
[4] 尤莉莉, 赵金红, 陈新月, 等. 国家基本公共卫生服务项目十年评价(2009—2019年)系列报告(二): 国家基本公共卫生服务项目实施十年的进展与成效[J]. 中国全科医学, 2022, 25(26):3209-3220.
YOU L L, ZHAO J H, CHEN X Y, et al. National essential public health services programs over the past decade research report two: Progress and achievements of the implementation of national essential public health services programs over the past decade[J]. Chinese General Practice, 2022, 25(26):3209-3220.
[5] 张丽雯, 阮梅花, 刘加兰, 等. 糖尿病领域研发态势分析[J]. 遗传, 2022, 44(10):824-839.
ZHANG L W, RUAN M H, LIU J L, et al. Progress on research and development in diabetes mellitus[J]. Hereditas(Beijing), 2022, 44(10):824-839.
[6] 张宏图, 董伟进, 陈南, 等. 茶多酚对α-淀粉酶的抑制作用及分子机理[J]. 食品工业科技, 2022, 43(4):90-96.
ZHANG H T, DONG W J, CHEN N, et al. Inhibition effect and molecular mechanism of tea polyphenols on the α-amylase[J]. Science and Technology of Food Industry, 2022, 43(4):90-96.
[7] 马丽华, 王英俊, 周浓. 番石榴海红米复合营养粉的研制[J]. 食品工业, 2022, 43(5):51-55.
MA L H, WANG Y J, ZHOU N. The preparation of multiplicate nutrition powder of guava and sea red rice[J]. The Food Industry, 2022, 43(5):51-55.
[8] 陈俏媛, 李斯琪, 梁慧琳, 等. 海水稻的栽培及价值[J]. 农技服务, 2016, 33(6):19.
CHEN Q Y, LI S Q, LIANG H L, et al. Cultivation and value of sea rice[J]. Agricultural Technology Service, 2016, 33(6):19.
[9] 黄就才. 海红米栽培技术及发展策略探究[J]. 南方农业, 2021, 15(26):5-6.
HUANG J C. Study on cultivation techniques and development strategy of sea red rice[J]. South China Agriculture, 2021, 15(26):5-6.
[10] 李晓红, Rabia Parveen, 杨志友, 等. 海红米米糠对慢性应激诱导小鼠抑郁样行为和异常肠道微生物及神经递质的改善作用[J]. 中国粮油学报, 2022, 37(3):25-30.
LI X H, PARVEEN R, YANG Z Y, et al. Sea red rice bran improved depression-like behavior, abnormal gut microbes and monoamine neurotransmitters induced by chronic unpredictable mild stress[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(3):25-30.
[11] HENDERSON A J, KUMAR A, BARNETT B, et al. Consumption of rice bran increases mucosal immunoglobulin A concentrations and numbers of intestinal Lactobacillus spp.[J]. Journal of Medicinal Food, 2012, 15(5):469-475.
[12] 赖双定, 龙宇, 陈逸君, 等. 海水稻营养功能成分与加工利用研究进展[J]. 粮食与油脂, 2022, 35(6):13-15;35.
LAI S D, LONG Y, CHEN Y J, et al. Research progress on nutritional functional components and processing utilization of seawater rice[J]. Cereals &Oils, 2022, 35(6):13-15;35.
[13] 熊艳珍, 黄紫萱, 马慧琴, 等. 黑米的营养功能及综合利用研究进展[J]. 食品工业科技, 2021, 42(7):408-415.
XIONG Y Z, HUANG Z X, MA H Q, et al. Advanceson nutritional functions and comprehensive utilization of black(pericarp) rice(Oryza sativa L.)[J]. Science and Technology of Food Industry, 2021, 42(7):408-415.
[14] LEE S G, BROWNMILLER C R, LEE S O, et al. Anti-inflammatory and antioxidant effects of anthocyanins of Trifolium pratense (red clover) in lipopolysaccharide-stimulated RAW-267.4 macrophages[J]. Nutrients, 2020, 12(4):1089.
[15] CHEN Z Q, WANG C, PAN Y X, et al. Hypoglycemic and hypolipidemic effects of anthocyanins extract from black soybean seed coat in high fat diet and streptozotocin-induced diabetic mice[J]. Food &Function, 2018, 9(1):426-439.
[16] 卓学铭. 黑米花色苷组分的基因型差异及调节血脂和血糖作用的研究[D]. 福州: 福建农林大学, 2012.
ZHUO X M. Study on genotype difference of anthocyanin components from black rice and effect on regulating serum lipid and blood glucose levels[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012.
[17] RAHAYU W M, ASTUTI M, MARSONO Y. Improved hypoglycemic effect of anthocyanin extract combination from red rice and black soybean[J]. Journal of Physics: Conference Series, 2019, 1146:012015.
[18] 陈忠琴. 豆类蛋白功能性质及黑豆肽与花青苷的制备与活性研究[D]. 天津: 天津大学, 2017.
CHEN Z Q. Studies on the functional properties of legume proteins and preparation and activities of black soybean peptides and anthocyanins[D]. Tianjin: Tianjin University, 2017.
[19] 蒋美龄, 陈忠琴, 秦小明, 等. 牡蛎降糖肽的结构表征及其协同花色苷的活性增效作用[J]. 大连海洋大学学报, 2023, 38(3):455-463.
JIANG M L, CHEN Z Q, QIN X M, et al. Structural characterization and the synergistic effects with anthocyanin of oyster hypoglycemic peptides[J]. Journal of Dalian Ocean University, 2023, 38(3):455-463.
[20] 陈泽芳. 红米红色素的分离纯化及其组成的研究[D]. 天津: 天津科技大学, 2012.
CHEN Z F. Study on the purification of red kermel pigment and analysis of composition[D]. Tianjin: Tianjin University of Science & Technology, 2012.
[21] 蒋海伟, 杨婷婷, 李佳桥, 等. 响应面法优化红米花色苷微波辅助提取工艺及其抗氧化活性研究[J]. 中国食品学报, 2015, 15(5):74-81.
JIANG H W, YANG T T, LI J Q, et al. Response surface methodology for optimization of microwave-assisted extraction and antioxidant activity of anthocyanins from red rice[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(5):74-81.
[22] 郭晓宇, 胡宇恒, 古丽斯坦·阿不来提, 等. 红米中花色苷的提取工艺及其体外降糖活性研究[J]. 新疆医科大学学报, 2019, 42(11):1464-1468.
GUO X Y, HU Y H, GULSTAN A, et al. Study on the extraction process of anthocyanin from red rice and its hypoglycemic activity in vitro[J]. Journal of Xinjiang Medical University, 2019, 42(11):1464-1468.
[23] ZHENG Y X, YANG W H, SUN W X, et al. Inhibition of porcine pancreatic α-amylase activity by chlorogenic acid[J]. Journal of Functional Foods, 2020, 64:103587.
[24] 廖彭莹, 李承曼, 黄志祥, 等. 杨桃不同部位提取物抑制α-葡萄糖苷酶的作用[J]. 大众科技, 2018, 20(10):36-37; 58.
LIAO P Y, LI C M, HUANG Z X, et al. α-glucosidase inhibitory activities of the extracts from different parts of Averrhoa carambola[J]. Popular Science &Technology, 2018, 20(10):36-37; 58.
[25] 张玉. 藏药绿萝花活性成分及其降血糖活性研究[D]. 江门: 五邑大学, 2016.
ZHANG Y. Study on the active components of Tibetan medicine Lolita and its hypoglycemic activity[D]. Jiangmen: Wuyi University, 2016.
[26] 敬爽, 宋百灵, 张婷婷, 等. 酶催化产物对蒜酶活力抑制动力学研究[J]. 食品科技, 2021, 46(9):271-276.
JING S, SONG B L, ZHANG T T, et al. Inhibitory kinetics of enzyme catalyzed product on alliinase[J]. Food Science and Technology, 2021, 46(9):271-276.
[27] ZHENG Y X, TIAN J H, YANG W H, et al. Inhibition mechanism of ferulic acid against α-amylase and α-glucosidase[J]. Food Chemistry, 2020, 317:126346.
[28] 周婷. 黄杞叶醇提物生物活性研究及功能性食品开发[D]. 成都: 成都大学, 2022.
ZHOU T. Study on the biological activity of the ethanol extract of Engelhardia roxburghiana Wall leaves and functional food development[D]. Chengdu: Chengdu University, 2022.