纳米银(Ag nanoparticles, AgNPs)是一种基于纳米材料技术的新型抗菌产品,具有比银离子更稳定的物理化学特性,并具有优异的电学、光学和催化性能[1]。纳米银的合成途径主要有机械研磨法[2]、激光烧蚀法[3]、蒸发冷凝法[4]、电化学还原法[5]、液相化学还原法[6]和光化学法[7]等。这些方法大多存在费用昂贵、反应条件苛刻、易产生有毒副产品且对环境造成污染等问题。植物提取物合成纳米银可以有效避免使用有毒的还原剂和有机溶剂,产物不存在毒性残留、无提纯步骤,此法制备纳米银具有重要意义。早在2002年GARDEA-TORRESDEY等[8]发现苜蓿的根能够吸附溶液中的银离子,将其还原为2~3 nm的银纳米颗粒。在这之后,被报道可用于合成纳米银颗粒的植物越来越多。MANIK等[9]用紫檀、印楝叶提取物生物合成形态稳定、平均粒径为20~40 nm的纳米银。RAJA等[10]利用红缨花叶提取物为还原剂,合成平均粒径为70 nm且具有良好的抑菌性和抗氧化性的纳米银颗粒。杨紫浓[11]以石榴皮和石榴叶提取物为还原剂和稳定剂,发现两个部分的提取物制备的纳米银都对金黄色葡萄球菌、大肠杆菌、β-内酰胺酶阳性金黄色葡萄球菌和β-内酰胺酶大肠杆菌具有明显的抑菌性。
染料废水成分复杂、色度高、有机物含量高,公认的难处理。因此,寻求高效、简单的染料废水处理技术对环境的治理具有重要的意义。研究表明,生物合成的AgNPs具有高效去除有机染料的效果,如JHA等[12]用苦瓜果提取物(Momordica charantia L.)合成AgNPs对甲基橙、罗丹明B、亚甲基蓝进行催化脱色,其催化反应速率常数k分别为0.269、0.162、0.277 min-1,显示出了较好的催化性能。但目前关于生物合成AgNPs在有机染料催化降解中的应用研究仍然较少,因此研究提取物合成AgNPs对有机染料的催化降解能力很有必要。
菊苣(Cichorium intybus L.)菊科菊苣属,多年生草本植物,富含倍半萜内酯类、酚酸类和黄酮类等成分[13]。菊苣具有抗氧化、抗癌、抗炎、抗寄生物、抑菌等功效[14]。利用菊苣中多种天然抗氧化成分为还原剂,同时利用菊苣中的多糖、氨基酸、蛋白质等作为稳定剂,生物合成AgNPs。探讨不同合成条件对制备AgNPs的影响,并对优化后的产物进行理化表征以及抗氧化活性和催化活性分析,为提升菊苣叶的综合利用度和附加值提供新的途径,同时为生物合成AgNPs的推广应用奠定基础。
1 材料与方法
1.1 材料与试剂
菊苣,贵州省草业科学研究所提供。
DPPH(97%),梯希爱化成工业发展有限公司;硝酸银、4-硝基苯酚(4-nitrophenol,4-NP)、甲基蓝、硼氰化钾、罗丹明B(均为分析纯),国药集团化学试剂有限公司;甲基橙(分析纯),天津科密欧化学试剂有限公司;KBr(光谱纯),德国默克公司。
1.2 仪器与设备
SDTC-72C8气浴恒温培养箱,成都瑞昌仪器制造有限公司;TGL16M台式高速冷冻离心机,盐城市凯特实验仪器有限公司;GZL食品型冻干机,北京松源华兴科技发展有限公司;UH5300紫外分光光度计,日立高新技术公司;ZN-500A高速中药粉碎机,中南制药机械厂;iS5傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR),美国-赛默飞公司;ZEISS sigma500型场发射扫描电镜,(scanning electron microscope,SEM),德国蔡司公司;D8 Advanced型X射线多晶衍射仪(X-ray diffraction, XRD),德国布鲁克公司;101-3A电热鼓风干燥箱,天津天泰仪器有限公司。
1.3 实验方法
1.3.1 菊苣叶提取物的制备
采摘叶面完整未染病菊苣叶,用自来水多次冲洗叶片表面,以除去叶面黏附的灰尘及其他杂物。将洗净的菊苣叶切段置于50 ℃的电热鼓风干燥箱中进行充分干燥(约12 h)。将完全干燥的菊苣叶取出,粉碎。准确称取8.0 g碎叶放入洗净的锥形瓶中,加入100 mL超纯水,置于可加热的磁力搅拌器上煮沸,保持沸腾状态10 min。取下,室温下静置30 min。经滤纸过滤,得到淡黄色的菊苣叶提取物,置于4 ℃下储存待用。
1.3.2 AgNPs 的绿色合成
将50 mmol/L AgNO3与菊苣叶提取物按10∶1、10∶3、10∶5、8∶1、6∶1、4∶1(体积分数)的比例进行混匀。操作时,将提取物缓慢加入到AgNO3溶液中,并用1 mol/L的NaOH调节pH(7、8、9、10、11)。将混合溶液置于37 ℃的恒温培养振荡器中,调整转速为200 r/min,于黑暗条件下反应一段时间。通过溶液的颜色变化来指示AgNPs的生成,即当混合溶液由淡黄色变为红棕色,反应完成。通过紫外可见吸收光谱(ultraviolet visible light,UV-Vis)对产物进行验证。
1.3.3 AgNPs 结构及性能表征
通过AgNPs的紫外可见吸收光谱分析AgNO3与菊苣叶提取物比列、pH、时间对制备AgNPs的影响,再表征AgNPs的结构和性能。
1.3.3.1 紫外吸光光谱的测定
将菊苣叶提取物溶液稀释一定倍数后,使用紫外分光光度计测定其在300~800 nm范围内的UV-Vis,分辨率为1 nm。
1.3.3.2 紫外-可见分光光度法对AgNPs进行表征
取1.3.2节中制备的AgNPs,在300~800 nm范围内测其紫外吸收波长,分析AgNPs紫外吸收的特点。
1.3.3.3 XRD对AgNPs进行表征
取1.3.2节中制备的AgNPs,经干燥、研磨后,放在X射线衍射测定的玻璃样品盒中,按压结实后进行测定,分析AgNPs的X射线衍射图谱特点。
1.3.3.4 SEM对AgNPs进行表征
取1.3.2节中制备的AgNPs,经干燥、研磨后,取小拇指甲盖大小,一面切平,吹干粉末,贴上胶布,将AgNPs置于其上,压实按紧,放扫描电镜下观察,分析其结构形状特点。
1.3.3.5 FTIR分析
取适量AgNPs溶液,离心(12 000 r/min,10 min)后用超纯水洗涤,弃上清液,重复3次,沉淀物经冷冻干燥除去水分获得 AgNPs粉末。将AgNPs粉末与KBr粉末混合,于玛瑙研钵中混合研磨进行压片,室温下用FTIR在400~4 000 cm-1扫描测定,扫描速度和间隔为5 kHz和2 nm。
1.3.3.6 DPPH自由基清除活性
参照文献[15]方法稍作修改。取AgNPs溶液各2.00 mL于试管中,配制质量浓度为0.2、0.4、0.6、0.8、1.0 mg/L,加2.00 mL 0.1 mmol/L DPPH,避光反应30 min,于517 nm处测的吸光度;准确取出2.00 mL DPPH,加200 mL无水乙醇,反应30 min后,测吸光度。以抗坏血酸(维生素C)作阳性对照,重复3次。DPPH自由基清除能力的计算如公式(1)所示:
DPPH自由基清除活性![]()
(1)
式中:OD样品,样品与DPPH混合溶液OD值;OD0,去离子水同DPPH混合溶液OD值;OD对照,样品同去离子水混合溶液OD值。
1.3.3.7 AgNPs对4-硝基苯酚的催化还原
本实验选择4-NP作为目标底物,考察菊苣叶提取物合成AgNPs的催化性能,具体方法为:4-NP水溶液(0.2 mmol/L,2.5 mL)加入比色皿中,再加入KBH4水溶液(0.5 mol/L,100 μL),在室温条件下活化30 min后测试其吸光度,随后加入50 μL的AgNPs(0.1 mg/L),在室温下,使用UV-vis连续全波扫描对反应过程进行监测,通过400 nm左右处峰的吸光度变化来监测4-NP浓度随时间的变化,扫描范围为200~600 nm,扫描间隔1 nm,以2 min的时间间隔记录吸收光谱。
参照文献[16],4-NP的降解速率通过Langmuir-Hinshelwood模型获得。吸光度催化反应速率的计算,如公式(2)所示。因为在反应体系中加入了过量的KBH4,反应速率Kt可看为只由4-NP的浓度决定。用ln(At/A0)对时间t作图,所得直线斜率即为表观速率常数。
(2)
式中:C0,4-NP的初始浓度;Ct,4-NP在t时刻的浓度;A0,4-NP的初始吸光度;At,4-NP在t时刻的吸光度;K,催化反应速率常数,min-1。
1.3.3.8 AgNPs对有机染料的催化降解
考察菊苣叶提取物合成AgNPs对3种有机染料(甲基橙、罗丹明B、亚甲基蓝)的催化脱色效果。具体方法为:在石英比色皿中,将0.5 mL浓度为0.06 mol/L的KBH4溶液中(现配现用)分别添加至2 mL浓度为0.1 mmol/L的3种有机染料的溶液,二者混合均匀,随后加入一定量的AgNPs(0.1 mg/L)。在室温下,使用UV-vis连续全波扫描对反应过程进行监测。甲基橙检测范围为300~600 nm,扫描间隔1 nm,以2 min的时间间隔记录吸收光谱的变化;罗丹明B检测范围为400~650 nm,扫描间隔1 nm,以1 min的时间间隔记录吸收光谱的变化;亚甲基蓝检测范围为400~800 nm,扫描间隔1 nm,以3 min的时间间隔记录吸收光谱的变化。
1.3.4 数据统计分析
使用 Origin与Excel软件进行数据统计与分析,采用单因素方差(analysis of variance,ANOVA)对数据进行显著性分析(P<0.05)。所有实验数据均测定3次,结果以平均值±标准差表示。
2 结果与分析
2.1 AgNPs 制备参数优化
反应时间对AgNPs的影响结果如图1-a所示。反应35 min时AgNPs吸收峰开始出现,随着反应时间的增加吸收峰逐渐升高,反应进行75 min时吸收峰值较高且吸收峰较窄,表明合成的AgNPs状态较为理想。若继续延长加热时间,AgNPs溶液的颜色和吸收峰在短期内均不再发生显著变化,因此确定75 min为生物合成AgNPs的反应时间。
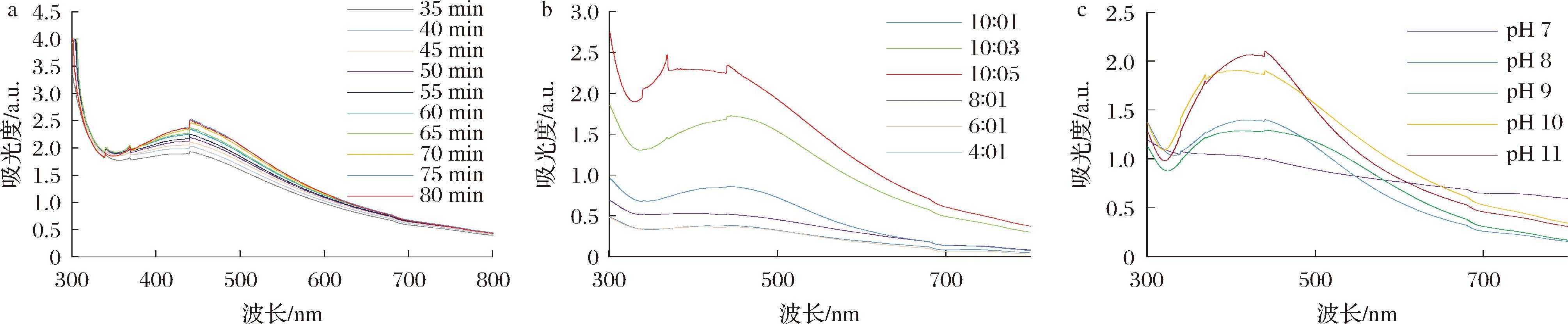
a-反应时间;b-AgNO3与菊苣叶提取物加入量;c-反应pH
图1 AgNPs反应条件的优化
Fig.1 Optimization of AgNPs reaction conditions
研究AgNO3与菊苣叶提取物比列对AgNPs合成的影响,结果如图1-b所示。AgNO3与菊苣叶提取物比列为10∶5时,吸收峰最大。因此,AgNO3与菊苣叶提取物比列为10∶5为宜。
反应pH对AgNPs的影响结果如图1-c所示。pH值为11时吸收峰值较高且吸收峰较窄,表明合成的AgNPs状态较为理想。因此确定pH值为11为生物合成AgNPs的反应pH。
2.2 AgNPs 的表征分析
2.2.1 紫外吸收光谱
对最佳合成条件制备的AgNPs进行颜色观察和UV-vis光谱表征。AgNPs呈现棕褐色的特征颜色,并形成特征吸收光谱[17]。由图2可知,菊苣叶提取物为深红色透明,合成产物为棕褐色,可初步判定AgNPs的产生。由图2可知,AgNPs在426 nm左右显现出显著的特征吸收峰,而菊苣叶提取物无吸收峰,进一步验证了AgNPs的成功制备。
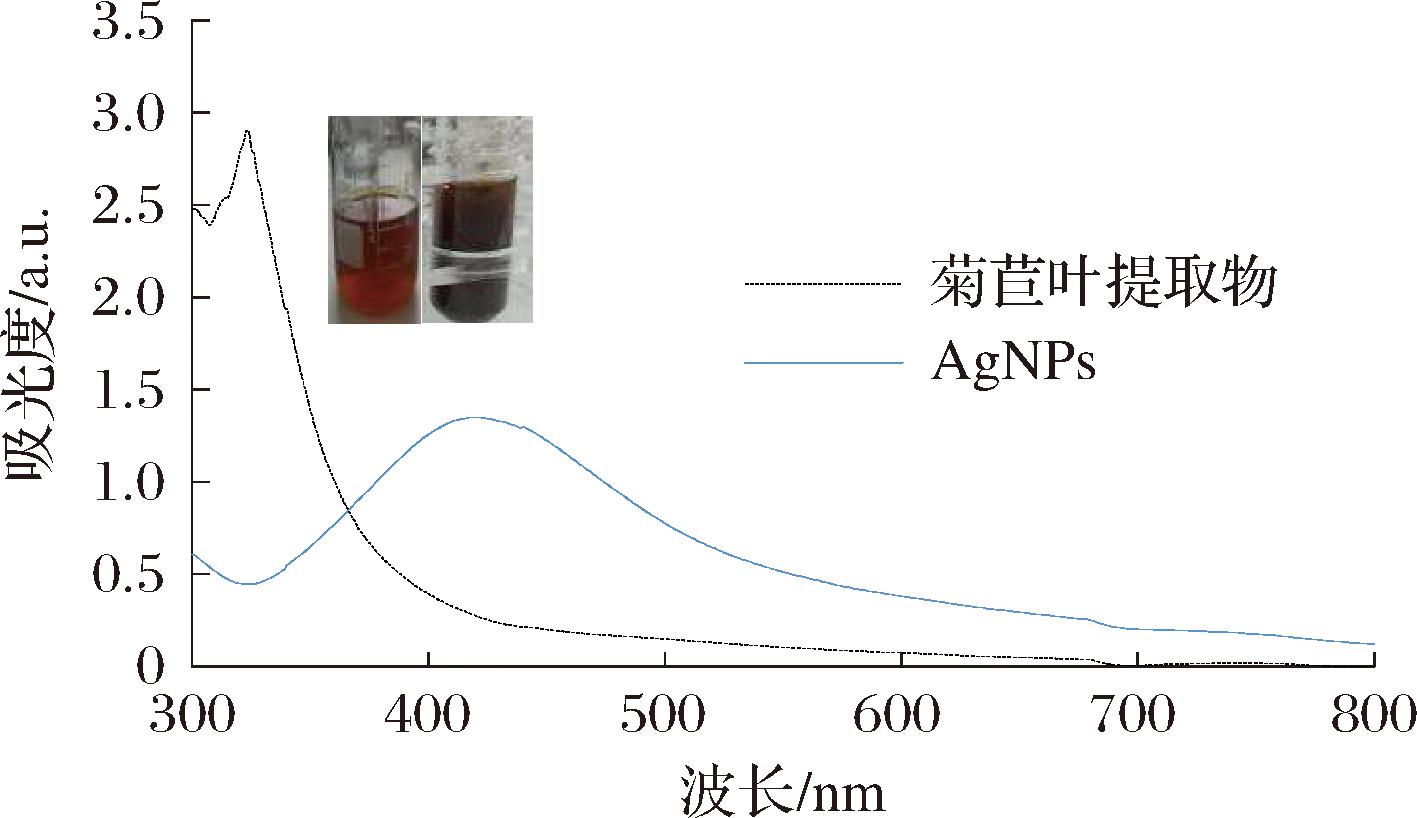
图2 菊苣叶提取物和生物合成AgNPs的UV-Vis图
Fig.2 UV-Vis absorption spectra of chicory leaf extract and biosynthetic AgNPs
2.2.2 XRD分析对AgNPs表征结果
通过XRD对生物合成AgNPs的晶型结构进行表征,如图3所示,制备的AgNPs在2θ角为38.18°、44.36°、64.50°、77.45°和81.33°的4个位置产生明显衍射峰,依次与标准银晶态的(111)、(200)、(220)、(311)和(222)的晶面相对应(参照JCPDS卡编号04-0783),表明生物合成的AgNPs具有面心立方晶型结构。图中杂峰在32.33°、46.18°、54.52°、57.22°有AgCl的衍射峰,可能是菊苣叶提取物中存在Cl-与AgNO3发生了反应,这在其他关于AgNPs生物合成的研究中很常见[18]。
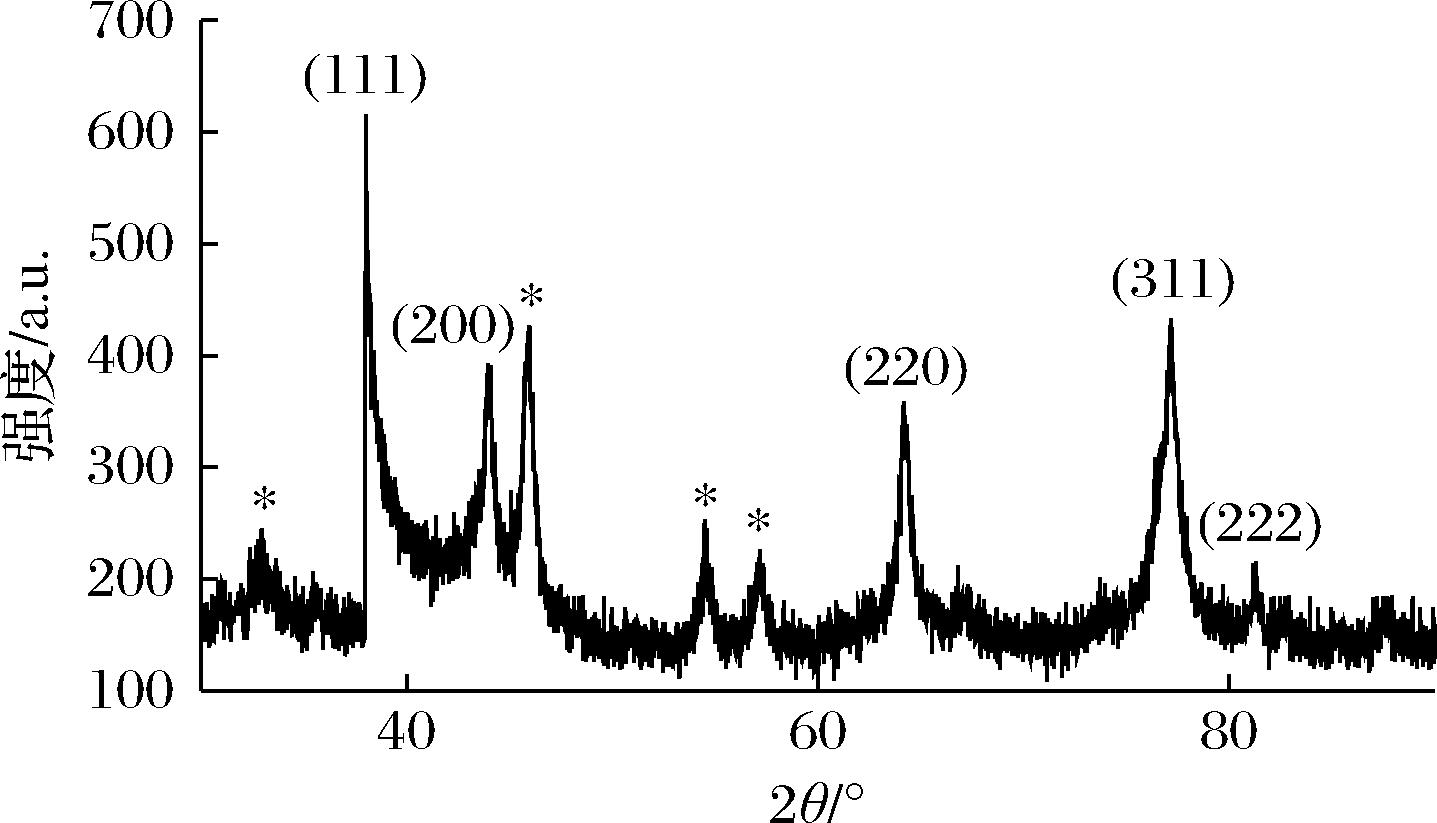
图3 纳米银的XRD图谱
Fig.3 XRD pattern of AgNPs
2.2.3 SEM对AgNPs表征结果
AgNPs的粒径、形貌和分散性可以使用透射电镜直接有效地观察。如图4-a所示,AgNPs多为球形,粒径均匀。如图4-b所示,合成的AgNPs平均尺寸为11.22 nm,36%的AgNPs粒径在10 nm左右,粒径分布较为集中。图中出现一些较大的粒子聚集,可能由于AgNPs之间的强相互作用引起[19]。
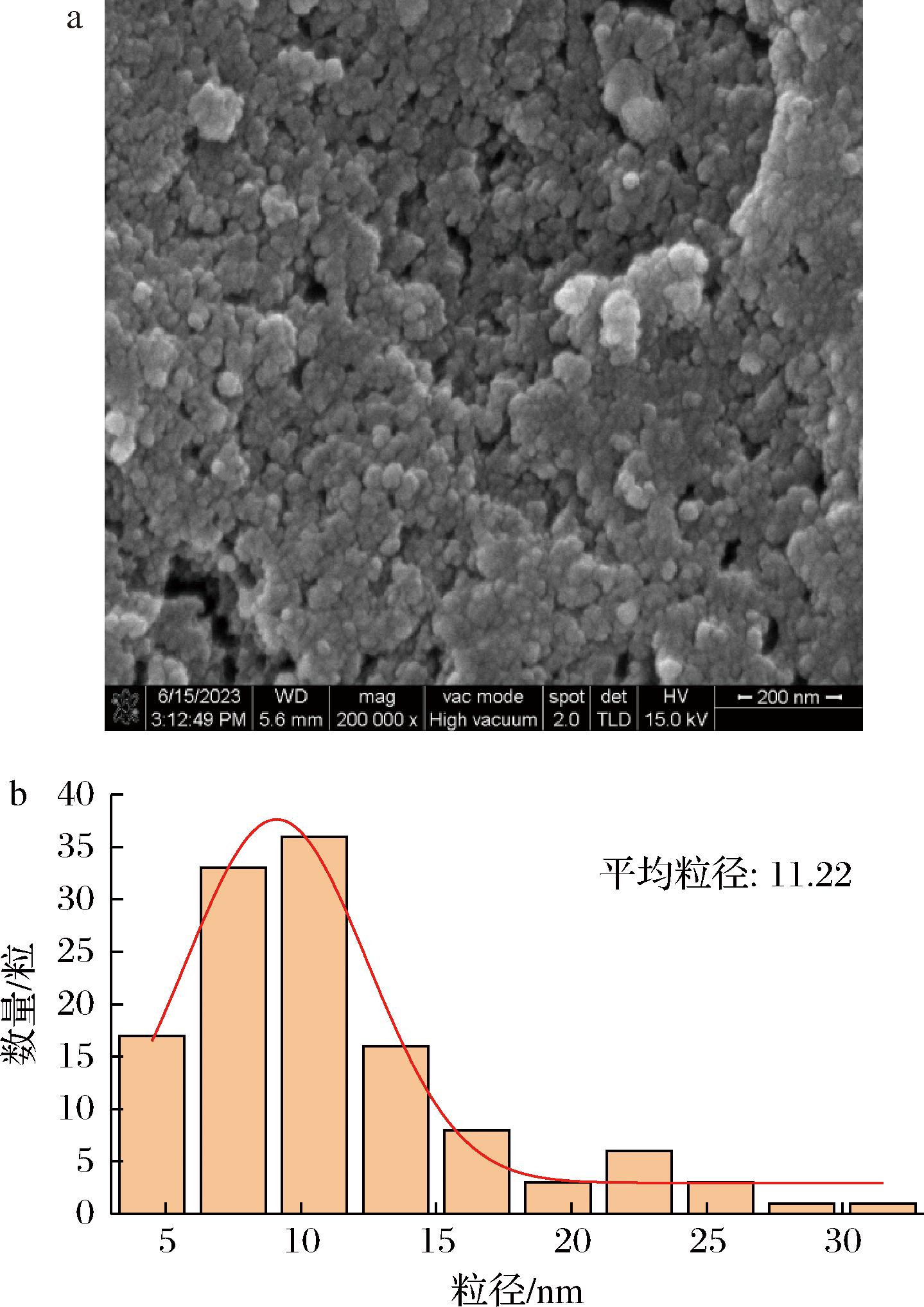
a-透射电镜照片;b-粒径分布图
图4 生物合成AgNPs透射电镜照片与粒径分布图
Fig.4 Transmission electron microscopy and particle size distribution of biosynthetic AgNPs
2.2.4 FTIR分析结果
如图5所示,AgNPs的FTIR图可在3 439.95、1 725.65、1 630.34、1 384.19、1 052.14 cm-1处观察到吸收峰,分别对应于—OH,—C![]() O的伸缩振动、C
O的伸缩振动、C![]() C伸缩振动,—C—H键变形振动、以及—C—O键伸缩振动。这些有机基团可能源自于菊苣叶中富含的多酚、类黄酮等活性物质,这些活性物质在还原Ag后,可附着于生成的AgNPs表面,增加了其表面极性,使其可稳定分散于水溶液中[20]。
C伸缩振动,—C—H键变形振动、以及—C—O键伸缩振动。这些有机基团可能源自于菊苣叶中富含的多酚、类黄酮等活性物质,这些活性物质在还原Ag后,可附着于生成的AgNPs表面,增加了其表面极性,使其可稳定分散于水溶液中[20]。
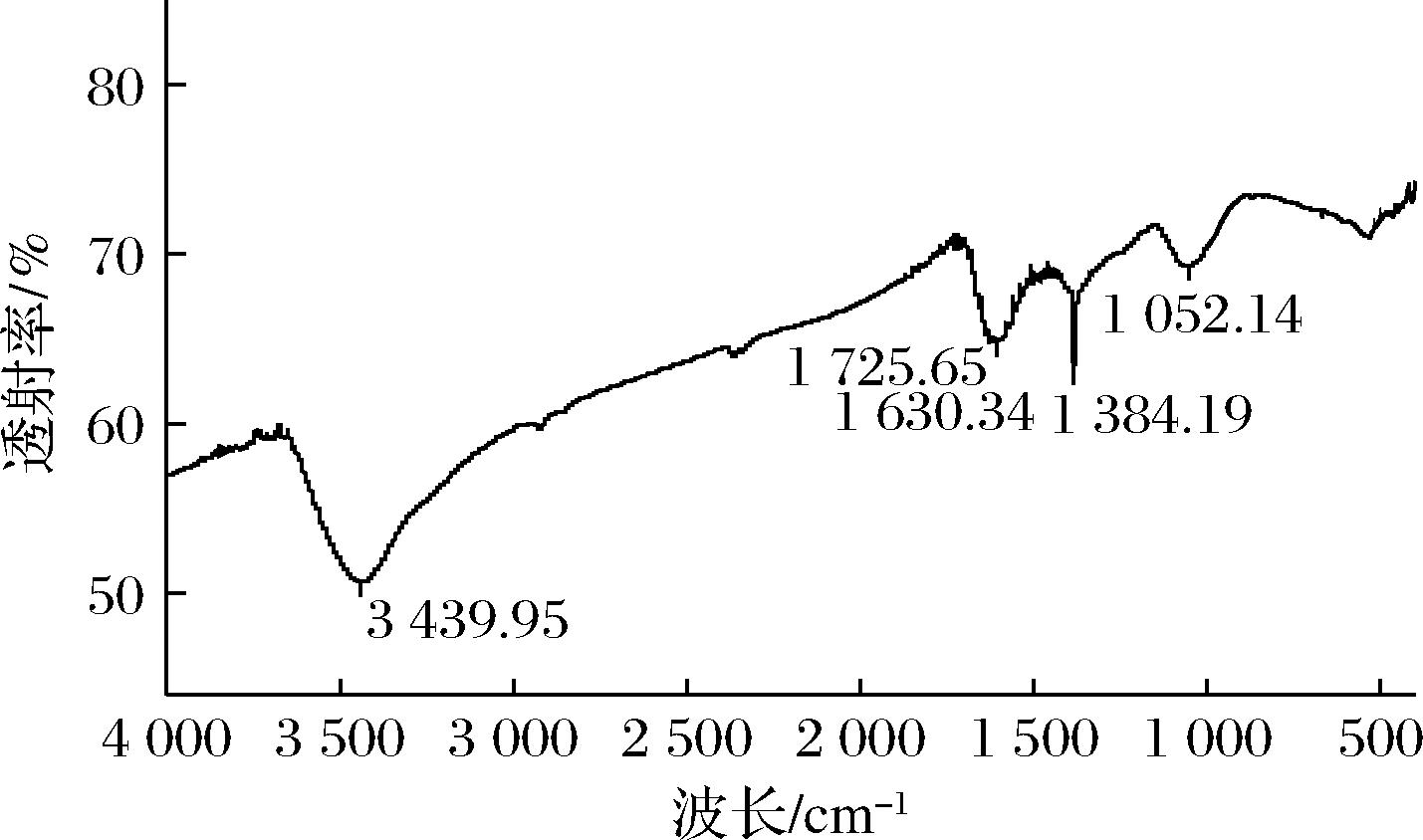
图5 生物合成AgNPs FTIR图
Fig.5 FTIR image of biosynthetic AgNPs
2.2.5 DPPH自由基清除活性
如图6所示,AgNPs对DPPH自由基有清除活性,当质量浓度为0.01~0.1 mg/mL时,清除率缓慢上升,当质量浓度为0.1 mg/mL时,清除能力明显较强,AgNPs质量浓度增加,抗氧化活性增强。抗坏血酸具有良好的DPPH自由基清除活性,从图中可以看出其最大值为98%,AgNPs的DPPH自由基清除活性的最大清除率为59%。抗坏血酸对DPPH的IC50为0.015 mg/mL,AgNPs的IC50为0.053 mg/mL,表明抗坏血酸对超氧自由基的清除能力比AgNPs强。
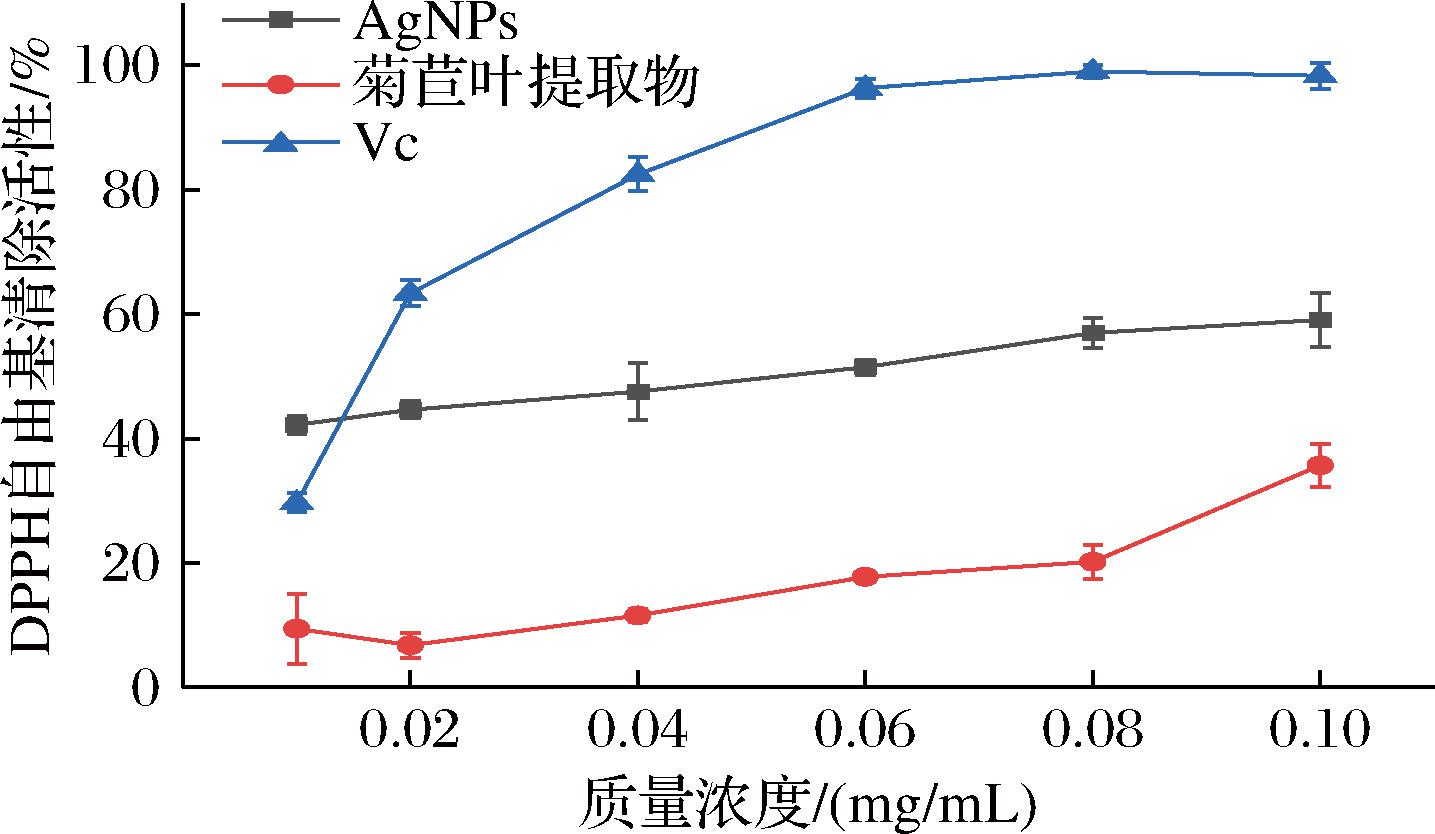
图6 生物合成AgNPs DPPH自由基清除活性图
Fig.6 DPPH radical scavenging activity diagram of AgNPs
2.2.6 AgNPs对4-NP的催化还原
由图7-a可知,4-NP溶液(0.125 mmol/L)本身呈淡黄色,其紫外特征吸收峰在327.0 nm,在加入KBH4进行去质子化后混合液会由淡黄色变为亮黄色,其特征峰移到了410.0 nm。未加入任何催化剂的时候,4-NP溶液很难实现还原反应。在本实验中,向混合液添加少量AgNPs后,410 nm处的特征吸收峰强度逐渐减弱,同时在310 nm左右处出现了一个新的特性吸收峰,证明生成了新物质4-氨基苯酚(4-aminophenol,4-AP),反应22 min后,410 nm处的特征吸收峰基本消失(图7-b),去除效率达91.87%,反应溶液颜色也由亮黄色逐渐变为无色。由图7-c可知,通过动力学方程式(2)计算可以得到,在该反应条件下,即AgNPs的用量为50 μL、4-NP溶液的浓度为0.125 mmol /L、4-NP的体积为2.5 mL时,AgNPs对4-NP的催化反应速率常数为0.119 8 min-1,表明AgNPs具有催化活性。
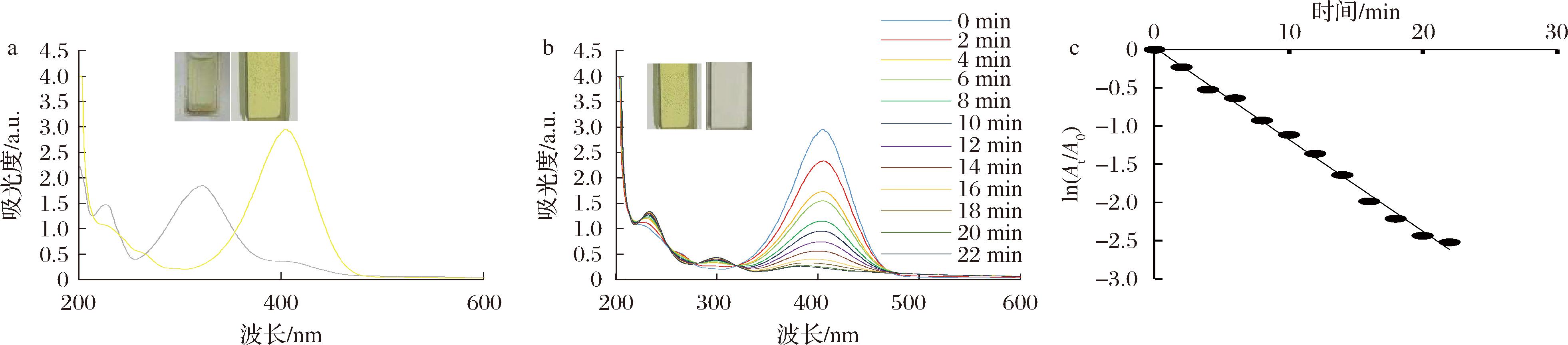
a-4-NP水溶液的UV-Vis图;b-AgNPs催化还原4-NP的紫外吸收光谱;c-一级动力学分析图
图7 AgNPs对4-NP的催化还原能力图
Fig.7 Plot of catalytic reduction of 4-NP by AgNPs
2.2.7 AgNPs对有机染料的催化降解
如图8所示,在还原剂KBH4的条件下,加入25 μL AgNPs后,甲基橙仅在反应10 min后,467 nm处的特征吸收峰就基本消失,根据吸光度值变化计算出脱色率为87.52%,反应溶液颜色也由橙色逐渐变为无色,证明反应完全(图8-a)。罗丹明B在加入50 μL AgNPs反应4 min后,557 nm处的特征吸收峰基本消失,脱色率为88.66%,溶液颜色由紫红色逐渐变为无色,表明反应完全(图8-c)。亚甲基蓝在加入100 μL AgNPs反应24 min后,669 nm处的特征吸收峰基本消失,脱色率为96.58%,溶液颜色也由蓝色逐渐变为无色,证明该反应结束(图8-e)。反应体系中染料的浓度远低于KBH4的浓度,可认为在整个反应过程中KBH4的量保持不变,该反应遵循假一级反应,根据动力学方程式(2)对每种染料进行拟合动力学曲线计算AgNPs的催化速率,结果如图8-b、图8-d、图8-f所示,其催化反应速率常数k分别为:甲基橙(0.189 min-1)、罗丹明B(0.567 min-1)、亚甲基蓝(0.098 6 min-1)。
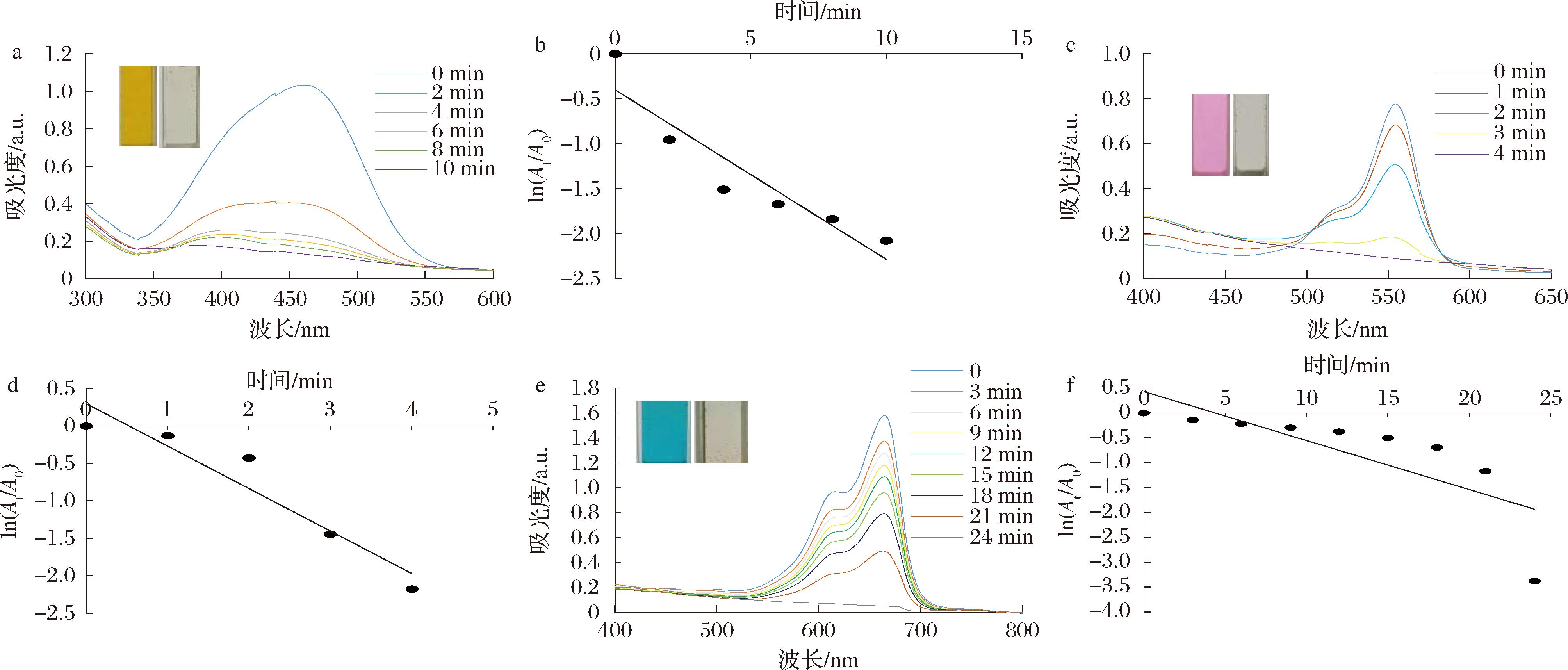
a-AgNPs催化降解甲基橙的UV-Vis光谱;b-AgNPs催化降解甲基橙的一级动力学分析;c-AgNPs催化降解罗丹明B的UV-Vis光谱;d-AgNPs催化降解罗丹明B的一级动力学分析;e-AgNPs催化降解亚甲基蓝的UV-Vis光谱;f-AgNPs催化降解亚甲基蓝的一级动力学分析
图8 AgNPs催化降解3种有机染料的UV-Vis光谱及一级动力学分析图
Fig.8 UV-Vis spectra and first-order kinetic analysis of three organic dyes catalyzed by AgNPs
3 结论
本研究利于菊苣叶提取物通过一步法生物合成AgNPs,确定AgNO3与菊苣叶提取物比列为10∶5、pH为11、常温反应75 min即可合成AgNPs,合成迅速高效、绿色环保,表明利用菊苣叶提取物生物合成AgNPs的可行性。实验结果表明制备的AgNPs粒径较小且均匀、分散性良好。对DPPH具有显著的抗氧化活性,且对4-硝基苯酚、甲基橙、罗丹明B、亚甲基蓝展示出了较好的催化性能。AgNPs因抗氧化活性显著、无耐药性等优点,对开发新的抗氧化剂及一种廉价高效的催化剂对治理污染及工业生产都有着重要的现实意义。本研究将为AgNPs的绿色合成及菊苣叶的高效利用提供新的途径,同时为AgNPs在临床、工业染料废水处理等领域的应用奠定基础。
[1] 陈婧雯, 张芯.纳米银的制备方法和应用现状[J].山东化工, 2019, 48(2):58-60;63.CHEN J W, ZHANG X.Preparation and application of silver nanoparticles[J].Shandong Chemical Industry, 2019, 48(2):58-60;63.
[2] XU J, YIN J S, MA E.Nanocrystalline Ag formed by low-temperature high-energy mechanical attrition[J].Nanostructured Materials, 1997, 8(1):91-100.
[3] ZHANG S, TANG Y A, VLAHOVIC B.A review on preparation and applications of silver-containing nanofibers[J].Nanoscale Research Letters, 2016, 11(1):80.
[4] BAKER C, PRADHAN A, PAKSTIS L, et al.Synthesis and antibacterial properties of silver nanoparticles[J].Journal of Nanoscience and Nanotechnology, 2005, 5(2):244-249.
[5] RODR GUEZ-S
GUEZ-S NCHEZ L, BLANCO M C, L
NCHEZ L, BLANCO M C, L PEZ-QUINTELA M A.Electrochemical synthesis of silver nanoparticles[J].The Journal of Physical Chemistry B, 2000, 104(41):9683-9688.
PEZ-QUINTELA M A.Electrochemical synthesis of silver nanoparticles[J].The Journal of Physical Chemistry B, 2000, 104(41):9683-9688.
[6] OUYANG L, ZHU L H, JIANG J Z, et al.Three-dimensional plasmonic hydrogel architecture:Facile synthesis and its macroscale effective space[J].RSC Advances, 2015, 5(3):2231-2238.
[7] REMITA S, FONTAINE P, LACAZE E, et al.X-ray radiolysis induced formation of silver nano-particles:A SAXS and UV-visible absorption spectroscopy study[J].Nuclear Instruments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms, 2007, 263(2):436-440.
[8] GARDEA-TORRESDEY J L, PARSONS J G, GOMEZ E, et al.Formation and growth of Au nanoparticles inside live alfalfa plants[J].Nano Letters, 2002, 2(4):397-401.
[9] MANIK U P, NANDE A, RAUT S, et al.Green synthesis of silver nanoparticles using plant leaf extraction of Artocarpus heterophylus and Azadirachta indica[J].Results in Materials, 2020, 6:100086.[10] RAJA S, RAMESH V, THIVAHARAN V.Green biosynthesis of silver nanoparticles using Calliandra haematocephala leaf extract, their antibacterial activity and hydrogen peroxide sensing capability[J].Arabian Journal of Chemistry, 2017, 10(2):253-261.
[11] 杨紫浓. 石榴皮和石榴叶提取物制备银纳米粒及其应用研究[D].开封:河南大学, 2017.YANG Z N.Pomegranate peel and pomegranate leaf aqueous extract mediated synthesis of silver nanoparticles and their potential applications[D].Kaifeng:Henan University, 2017.
[12] JHA M, SHIMPI N G.Spherical nanosilver:Bio-inspired green synthesis, characterizations, and catalytic applications[J].Nano-Structures &Nano-Objects, 2018, 16:234-249.
[13] AZAY-MILHAU J, FERRARE K, LEROY J, et al.Antihyperglycemic effect of a natural chicoric acid extract of chicory (Cichorium intybus L.):A comparative in vitro study with the effects of caffeic and ferulic acids[J].Journal of Ethnopharmacology, 2013, 150(2):755-760.
[14] GHARARI Z, HANACHI P, SADEGHINIA H, et al.Cichorium intybus bio-callus synthesized silver nanoparticles:A promising antioxidant, antibacterial and anticancer compound[J].International Journal of Pharmaceutics, 2022, 625:122062.
[15] 滕欢欢, 王仁中, 吴德玲, 等.多花黄精炮制前后不同极性部位抗氧化与降血糖活性研究[J].食品与发酵工业, 2022, 48(8):70-75.TENG H H, WANG R Z, WU D L, et al.The study on the antioxidant and hypoglycemic activities of different polar extracts from crude and steam-processed Polygonatum cyrtonema Hua[J].Food and Fermentation Industries, 2022, 48(8):70-75.
[16] QIAO Z P, WANG M Y, LIU J F, et al.Green synthesis of silver nanoparticles using a novel endophytic fungus Letendraea sp.WZ07:Characterization and evaluation of antioxidant, antibacterial and catalytic activities (3-in-1 system)[J].Inorganic Chemistry Communications, 2022, 138:109301.
[17] 朱雨婕, 代安然, 李佳铭, 等.金针菇无细胞滤液合成纳米银颗粒[J].食品与发酵工业, 2021, 47(5):71-78.ZHU Y J, DAI A R, LI J M, et al.Synthesis of silver nanoparticles using cell-free filtrate of Flammulina velutipes[J].Food and Fermentation Industries, 2021, 47(5):71-78.
[18] MIRI A, SARANI M, REZAZADE BAZAZ M, et al.Plant-mediated biosynthesis of silver nanoparticles using Prosopis farcta extract and its antibacterial properties[J].Spectrochimica Acta.Part A, Molecular and Biomolecular Spectroscopy, 2015, 141:287-291.
[19] VIJAY KUMAR P P N, PAMMI S V N, KOLLU P, et al.Green synthesis and characterization of silver nanoparticles using Boerhaavia diffusa plant extract and their anti bacterial activity[J].Industrial Crops and Products, 2014, 52:562-566.
[20] 乔自鹏. 胜红蓟内生真菌的分离鉴定、生物活性及其合成纳米银的研究[D].泉州:华侨大学, 2021.QIAO Z P.Isolation and identification of endophytic fungi from ageratum conyzoides and its biological activity and biosynthesis of silver nanoparticles[D].Quanzhou:Huaqiao University, 2021.