糖皮质激素是一类甾体药物家族,有着相似的化学结构、功效和副作用。因其具有抗炎、抗过敏作用,并且能促进动物生长,常被滥用于经济动物养殖中[1-2]。鉴于长期食用糖皮质激素残留的食物可能导致人体代谢功能异常、骨质疏松,影响发育等问题[3-5],联合国粮食及农业组织、世界卫生组织和欧盟等均对食品中糖皮质激素残留制定了限量标准。GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》也对动物源性食品中地塞米松和倍他米松2种糖皮质激素残留限量进行了规定。其中地塞米松在动物肌肉和肝脏中的残留限量为1.0 μg/kg和2.0 μg/kg,倍他米松在动物肌肉和肝脏中的残留限量分别为0.75 μg/kg和2.0 μg/kg。然而由于糖皮质激素种类众多,不法养殖者往往使用其他糖皮质激素进行替代以逃避监管,其中莫米松糠酸酯(mometasone furoate,MF)以其低价和速效的优势,在养殖用药中屡见不鲜,需要对其进行重点监控。
目前,对于MF的检测主要采用液相色谱法[6-8]、液相色谱-质谱联用法[9]、分光光度法[10]、薄层层析法[11]等。然而这些方法在面对大规模样品筛查时,均有成本高,检测时间长,操作复杂等缺点。酶联免疫分析方法作为一种高通量、低成本检测技术,被广泛应用于糖皮质激素的风险监控[12-13]。然而目前未见MF免疫学检测方法的相关报道,并且由于糖皮质激素各种药物之间结构差异较小,现有的糖皮质激素抗体存在明显的交叉识别,特异性不足。为准确监控动物养殖环节中MF的滥用情况,本研究利用MF的五元环上同时含有糠酸酯和氯丙酮2条支链而有别于其他64种糖皮质激素的特征,设计半抗原和全抗原,通过动物免疫、细胞融合等过程获得高特异性单克隆抗体,并建立基于异源包被的MF间接竞争酶联免疫检测方法(indirect competitive enzyme linked immunosorbent assay, ic-ELISA)。
1 材料与方法
1.1 试剂与材料
糖皮质激素标准品,伊诺凯公司;1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐[1-ethyl-3-(3-dimethyllaminopropyl)carbodiiMide hydrochloride,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS),阿拉丁公司产品;牛血清白蛋白(bovine serum albumin, BSA)、钥孔血蓝蛋白(keyhole limpet hemocyanin, KLH)、四甲基联苯胺(tetramethylbenzidine, TMB)、辛酸、NH4(SO4)2、弗氏完全佐剂与不完全佐剂,MECK公司产品;羊抗鼠IgG-HRP,洛阳佰奥通实验材料中心;实验动物Balb/C小鼠,广东医学实验动物中心;其他试剂均为国产分析纯。
96孔高吸附酶标细胞板、6孔细胞培养板、细胞培养瓶,Corning公司;玻璃仪器、层析硅胶薄板、一次性注射器、透析袋(截留分子质量20 000 Da),深圳新拓扑生物有限公司。
1.2 仪器设备
Synergy H1酶标仪、405LS自动洗板机,美国BioTek公司;Allegra 64R高速离心机,美国贝克曼公司;Milli-Q IQ 7003 超纯水机,美国Merck Millipore公司。
1.3 糖皮质激素半抗原和抗原的合成
取MF(1.809 3 g, 3.470 mmol)至试管中,加入胺氧乙酸(17.1 mg, 0.156 mmol),再加入甲醇1 000 μL和吡啶40 μL,室温反应过夜,薄层层析监控MF原料反应完全。加入100 μL 0.1 mol/L盐酸,使用乙酸乙酯萃取反应液。旋转蒸发乙酸乙酯萃取液得到白色固体,为免疫半抗原MF-COOH。按相同的方法将MF替换为莫米松二糠酸酯(mometasone difuroate,MDF),合成包被半抗原MDF-COOH(图1)。
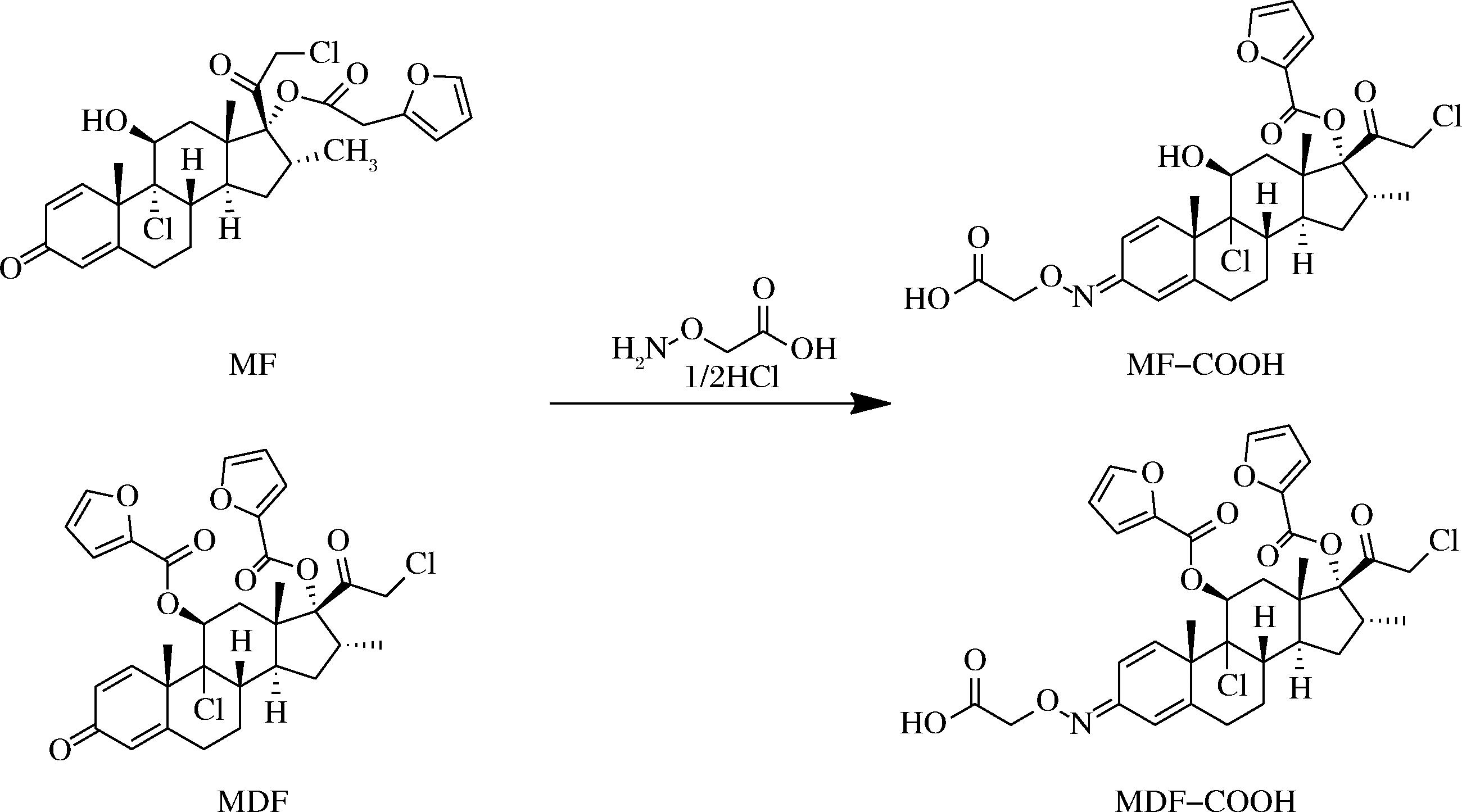
图1 免疫半抗原和包被半抗原的合成
Fig.1 Synthetize of immune hapten and coating antigen
按参考文献[10]所述的活泼酯法进行全抗原合成。MF-COOH与KLH偶联得到免疫抗原,MDF-COOH与BSA偶联得到包被抗原,分别命名为MF-COOH-KLH和MDF-COOH-BSA。经蛋白质定量试剂测定全抗原浓度后于-20 ℃保存备用。
1.4 单克隆抗体制备
参照《抗体:实验室手册》记载方法建立杂交瘤细胞株[14]。通过小鼠免疫、细胞融合及筛选程序,获得能稳定分泌MF单克隆抗体的细胞株。通过动物体内生产法制备腹水单克隆抗体。
1.5 ic-ELISA方法
将合适浓度的包被原溶液加入酶标板中,每孔100 μL,室温包被过夜。弃去包被液,用含2% BSA(体积分数)的PBS(pH 7.4)37 ℃下封闭2 h后洗板3次。在酶标板中加入50 μL标液或样液,再加入50 μL 抗体溶液,37 ℃孵育30 min后洗板3次。加入100 μL 羊抗鼠IgG-HRP,37 ℃孵育30 min后洗板3次。加入TMB显色液,37 ℃孵育15 min后加入50 μL 2 mol/L硫酸终止反应。使用酶标仪读取450 nm下吸光度。以标准品浓度的对数值为横坐标,各标准品浓度的吸光值(B)与0标准品浓度的吸光度值(B0)比值为纵坐标建立标准曲线。使用20个空白样品的平均值加3倍标准差计算检出限。
1.6 交叉反应测定
使用表1所列的64种糖皮质激素和MDF代替MF,采用同样的方法分别建立各药物的标准曲线,通过计算半抑制浓度(half inhibition concentration,IC50)评估ELISA方法对各糖皮质激素和MDF的交叉反应。
表1 用于交叉反应测试的64种糖皮质激素
Table 1 64 glucocorticoids for cross-reaction testing

药物名称地塞米松泼尼松龙氢化可的松二氟拉松双醋酸酯地塞米松戊酸酯泼尼松龙醋酸酯可的松氟尼缩松地塞米松棕榈酸酯甲基泼尼松龙可的松乙酸酯氟氢缩松地塞米松乙酸酯甲基泼尼松龙醋酸酯氟氢可的松乙酸酯双氟拉松倍他米松乙酸酯甲基泼尼松龙乙丙酸酯氢化可的松丁酸酯阿氯米松
续表1

药物名称倍他米松戊酸酯泼尼松氢化可的松醋酸酯帕拉米松倍他米松二丙酸酯泼尼卡酯氢化可的松戊酸脂利美达松倍他米松丙酸酯丙酸氯倍他索氢氟可的松双氟泼尼酯倍他米松苯甲酸酯氟米龙醋酸酯氟轻松乙酸酯双氟美松乙酸酯倍他米松氟米龙氟轻松阿氯米松双丙酸酯卤米松氟米松地索奈德氯倍他松丁酸酯醋酸泼尼松地夫可特地索奈德乙酸酯安西奈德异氟泼尼松倍氯米松曲安奈德醋酸酯哈西奈德甲基泼尼松曲安西龙双醋酸酯曲安奈德布地奈德氟替卡松丙酸酯倍氯米松双丙酸酯环索奈德糠酸氟替卡松卤倍他索丙酸酯双氟可龙戊酸酯瑞美松龙莫米松EP杂质K
1.7 添加回收检测
在MF阴性样品中加入MF标液。称取2 g均质的猪肉或猪肝样品,使用含不同甲醇浓度的水溶液定容至10 mL。振荡混匀5 min后4 000 r/min离心,取上清液进行ELISA检测。
1.8 数据处理
采用Origin 7.5 软件四参数拟合法绘制MF等药物的标准曲线,计算各药物ELISA方法的IC50值。
2 结果与分析
2.1 MF半抗原的合成
半抗原的合成应尽可能的保持待测化合物的整体结构。针对糖皮质激素抗体的制备,大部分研究都采用从糖皮质激素的五元环处连接半抗原[15-18]。项目组曾使用莫米松EP杂质K(图2)为原料,从其五元环长链羟基处通过丁二酸酐连接出带羧基的手臂,再用糠酰氯进行酯化。然而该方案制备的抗体对其他糖皮质激素交叉反应过高,特异性不足。因此,在本研究中,选用了从六元环与载体蛋白连接的新路线,即通过胺氧乙酸从MF环己二烯环的羰基处引出连接臂。使用ESI-MS对免疫半抗原进行负离子模式扫描。从一级质谱图谱(图3-a)得到分子离子峰592[M-H]-,且丰度较大。二级质谱(图3-b)证明其裂解规律与目标半抗原相同,证明该化合物合成成功。
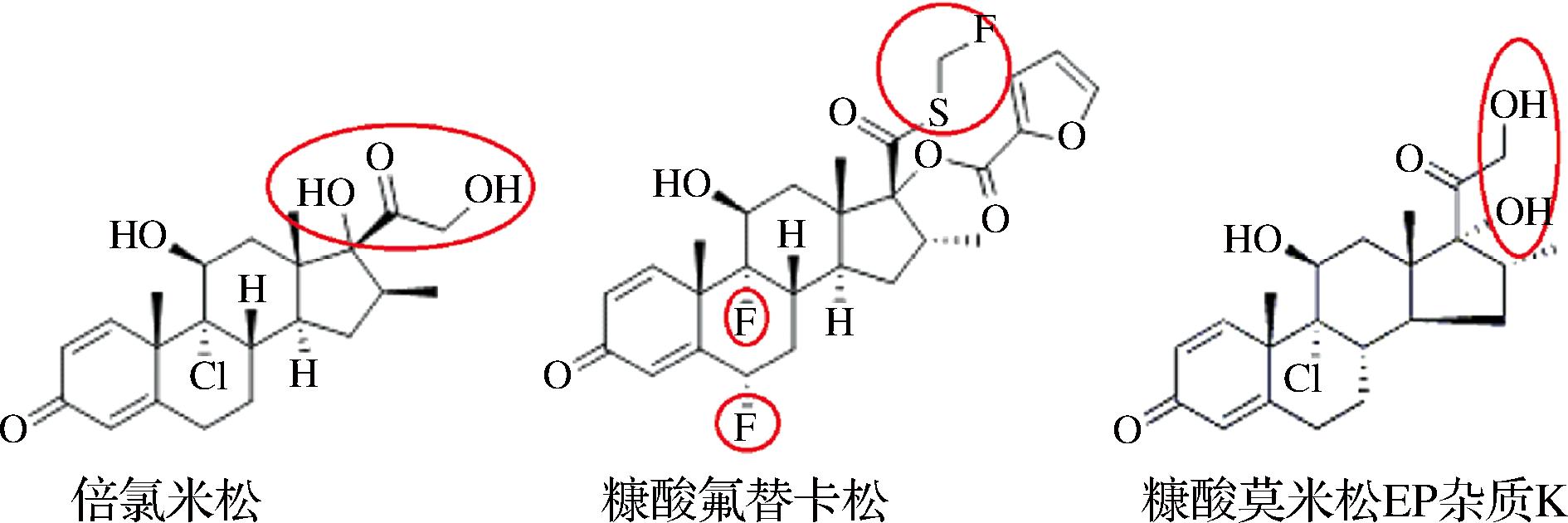
图2 三种MF结构类似物
Fig.2 Three structural analogues of mometasone furoate
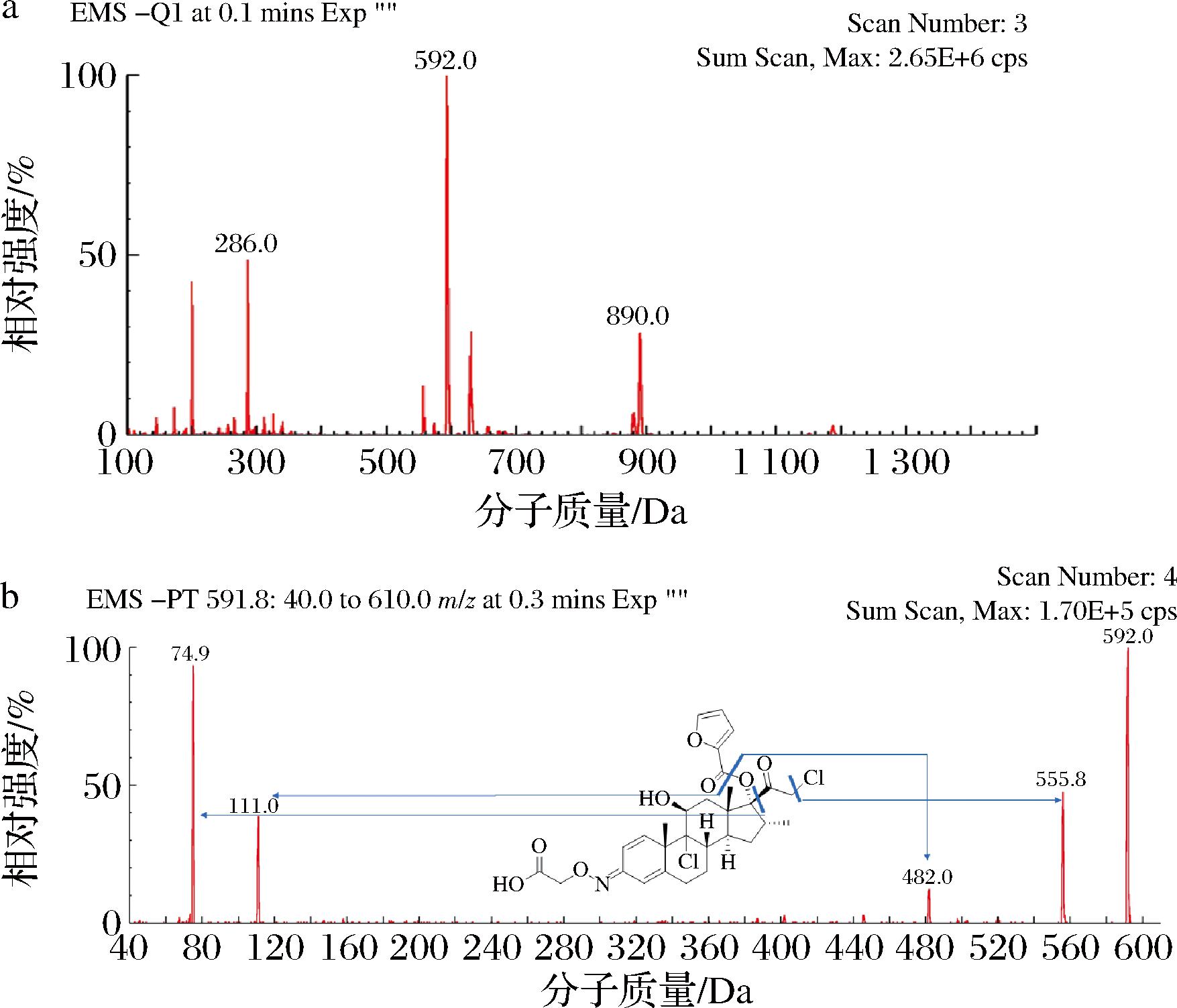
a-一级谱;b-二级谱
图3 免疫半抗原MF-COOH质谱图
Fig.3 Mass spectrometry of immunohapten MF-COOH
2.2 单克隆抗体的识别特性
糖皮质激素是一个以甾体结构为骨架的结构类似物家族,具有特有的11β-OH和17α-OH基本结构[19]。因此,很多糖皮质激素抗体都表现为对糖皮质激素的广谱识别特性,例如前人[12,15-17]制备的地塞米松抗体、曲安奈德抗体、氢化可的松抗体、双福米松抗体分别能识别6种、4种、12种、5种糖皮质激素。这些抗体均由在五元环上羟基位点衍生出的半抗原制备而来,而3个六元环远离连接臂,更容易产生识别该六元环结构的抗体。很多糖皮质激素的六元环结构接近甚至完全相同,因此这种半抗原制备方法无法获得高特异性抗体。
本研究从MF己二烯环的羰基处与载体蛋白连接构建人工抗原,使得五元环部分远离连接臂。所产生的抗体和表1所列的64种糖皮质激素均不产生交叉反应(交叉反应率<1%)。其中,倍氯米松、莫米松EP杂质K的3个六元环和MF完全相同(图2),证明六元环区域不是抗体的主要识别区域。MDF是合成MF时,过度酯化产生的副产物,其在五元环区域和MF完全相同,只是多了一条糠酸酯侧链,增加了抗体结合位阻,因此观察到64%的交叉反应。糠酸氟替卡松在五元环支链上同样含有糠酸酯结构,但并不产生交叉反应,表明抗体亲和区域包含了整个五元环。目前商品化的糖皮质激素,只有MF的五元环上同时含有糠酸酯和氯丙酮2条支链,因此不会和其他常见糖皮质激素产生交叉反应。
近期,ZHANG等[20]通过分子建模解析利福霉素半抗原和抗体的构效关系,认为半抗原设计时暴露靶标的特异结构有利于特异性识别抗体的制备。糖皮质激素的4个环形结构使得其分子主体不会发生空间折叠,远离连接臂的结构必为暴露结构。本研究通过暴露五元环这一MF的特异结构获得了高特异性的抗体,再一次验证了上述推论。
2.3 ic-ELISA方法
异源包被源因其与抗体的亲和力低于同源包被原,使得在竞争体系中,抗体展现出对游离待测物的优先选择性,往往能获得更高的灵敏度[21-22]。由于所获得的抗体对MF的五元环具有高度识别特异性,MDF成为理想的包被半抗原合成原料。MDF在保持了和待测药物的主体结构同时,因六元环上含有的糠酸酯侧链增加了其和抗体结合的空间位阻。当目标待测物和包被原同时竞争结合抗体时,抗体更倾向于优先与目标待测物亲和,而不含目标待测物时,抗体仍能与包被原结合。由图4可知,使用MDF构建异源包被能大幅度提高ic-ELISA的灵敏度。相较于同源包被24 ng/mL的IC50值,异源包被的IC50达到1.2 ng/mL,提升了20倍。以IC10计算该方法的灵敏度为0.15 ng/mL,方法的线性范围为0.20~10 ng/mL(R2=0.99)。该方法对肌肉样品的检出限为0.52 μg/kg,对肝脏样品的检出限为0.59 μg/kg。
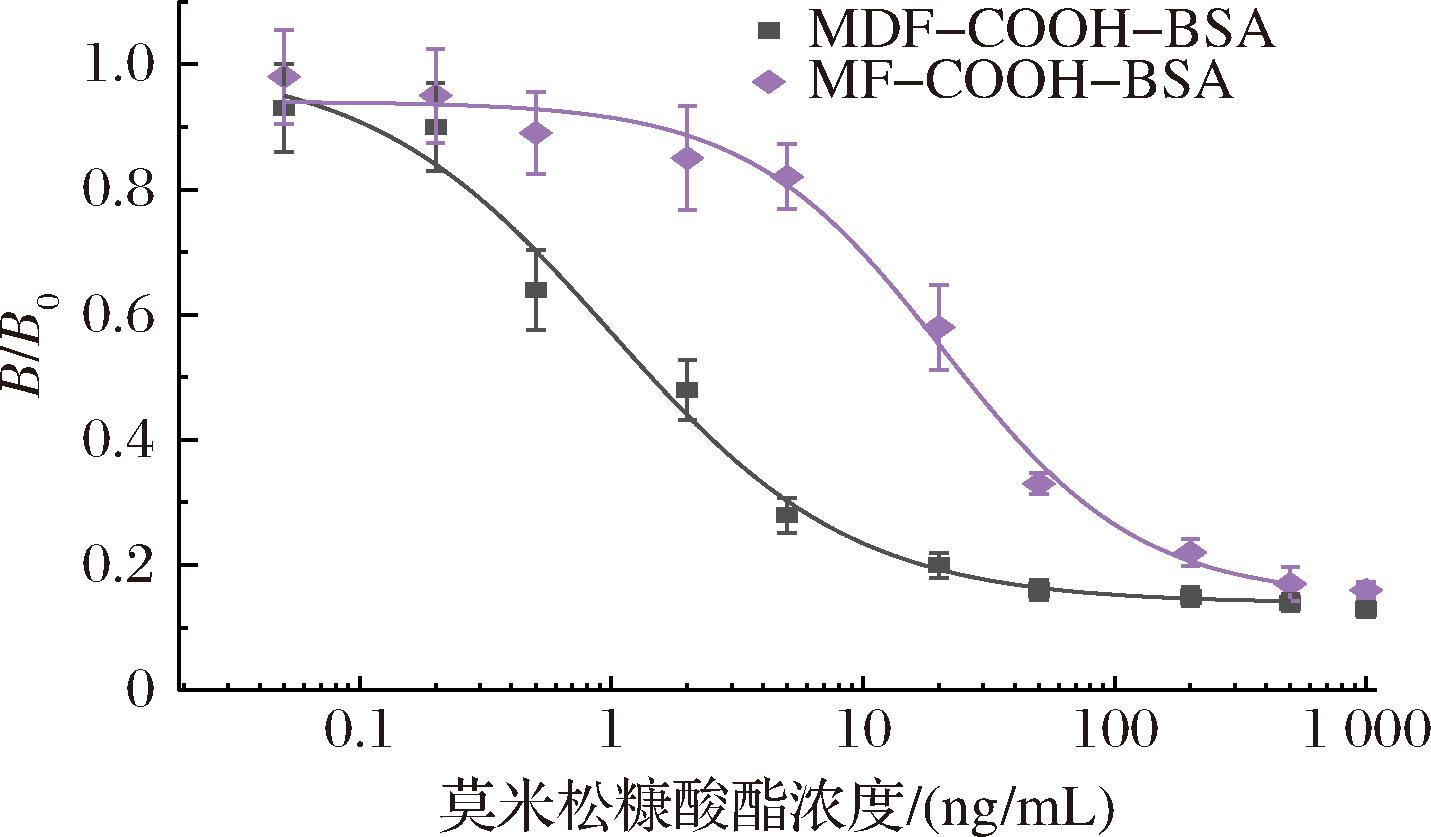
图4 基于同源和异源策略的MF标准曲线(n=6)
Fig.4 Standard curves of mometasone furoate base on homologous and heterologous strategy(n=6)
2.4 添加回收率
糖皮质激素均为脂溶性药物,因此色谱法一般采用氯仿或乙酸乙酯提取法进行前处理[23-24]。然而免疫分析必须在水相条件下进行反应,因此需要对氯仿或乙酸乙酯提取液进行吹干复溶,不仅操作繁琐、时间较长,还会产生不利于环境的有机蒸汽。很多研究证明,采用甲醇水溶液可以对组织中的地塞米松、曲安奈德等糖皮质激素进行有效的提取,采用20%[16]~30%[15]的甲醇水作为提取液的回收率在75%~90%。不同于地塞米松和曲安奈德,MF五元环上的2个亲水的羟基分别取代和酯化,因此其亲水性更差。由图5可知,使用40%的甲醇水溶液回收率仍然小于50%。使用60%的甲醇水溶液时,回收率明显提高。当添加量分别为1.0 μg/kg和5 μg/kg时,肌肉的添加回收率分别为82%和80%,肝脏的添加回收率分别为71%和70%,回收率的平均相对标准偏差为9%(n=6)。肌肉高于肝脏的原因可能在于,本研究选用的组织为猪里脊肉部分,相比于肝脏,脂肪含量更低,对脂溶性药物亲和性也更弱。由于ELISA样品提取液和抗体溶液是1∶1(体积比)混合的,即ELISA时甲醇的终体积分数为30%。当继续提高甲醇体积分数时,ELISA吸光度值明显下降(<0.5),已无法满足检测要求。因此,样品提取液含有体积分数60%甲醇即能有效提取动物组织中的MF,也不会影响ELISA结果。
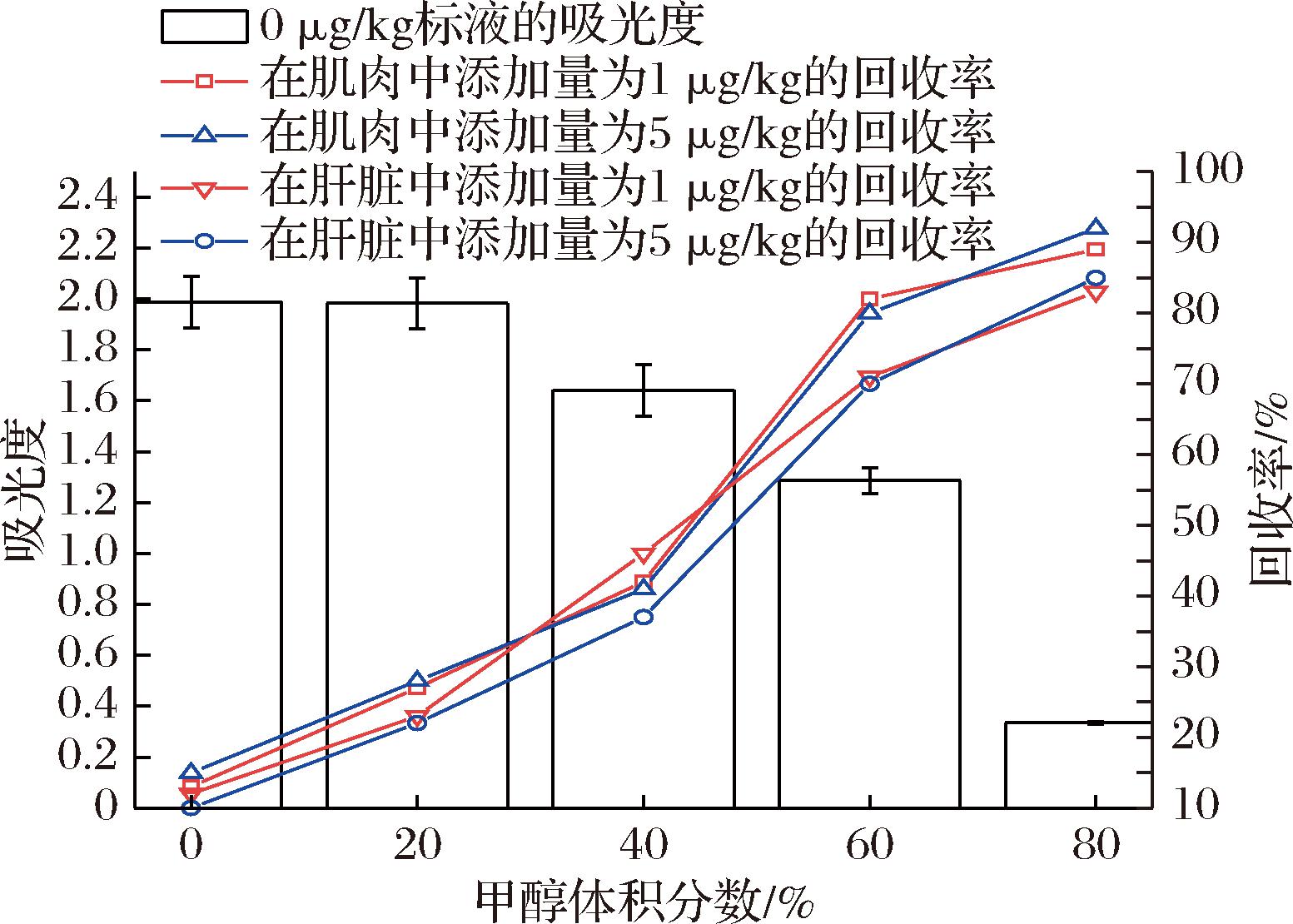
图5 不同体积分数甲醇水溶液ic-ELISA 吸光度和回收率(n=6)
Fig.5 Absorbance and recovery rate using different volume fraction of methanol(n=6)
3 结论
本研究从MF的己二烯环的羰基处引出带羧基的连接臂制备MF全抗原,获得了MF单克隆抗体,并通过大量的交叉反应实验,推测出该抗体的结合位点为MF的整个五元环区域,因此表现出极高的特异性——不与常见的64种糖皮质激素产生交叉反应。使用异源包被方法能大幅度提升ic-ELISA方法的灵敏度,从而能识别低至0.15 ng/mL的待测物。前处理无需使用脂溶性有机溶剂提取,避免了吹干、复溶步骤,更加简单方便。
[1] XIANG Q Y, SHEN X Y, LI K, et al.Occurrence, distribution, and environmental risk of 61 glucocorticoids in surface water of the Yellow River Delta, China[J].Science of the Total Environment, 2024, 906:167504.
[2] 陈凤燕, 盘焯晖, 陆曼芝, 等.食品中糖皮质激素残留检测方法的研究进展[J].食品安全质量检测学报, 2021, 12(19):7541-7548.CHEN F Y, PAN Z H, LU M Z, et al.Research progress on the detection methods of glucocorticoids in food[J].Journal of Food Safety &Quality, 2021, 12(19):7541-7548.
[3] LI J X, CUMMINS C L.Fresh insights into glucocorticoid-induced diabetes mellitus and new therapeutic directions[J].Nature Reviews Endocrinology, 2022, 18:540-557.
[4] CHEN Y W, WANG H.The changes in adrenal developmental programming and homeostasis in offspring induced by glucocorticoids exposure during pregnancy[J].Vitamins and Hormones, 2024, 124:463-490.
[5] CHEN M, FU W Y, XU H Y, et al.Pathogenic mechanisms of glucocorticoid-induced osteoporosis[J].Cytokine &Growth Factor Reviews, 2023, 70:54-66.
[6] TAREK M, WAGDY H A, ELZANFALY E S, et al.A validated ultra-performance liquid chromatographic method for the simultaneous determination of nadifloxacin, mometasone furoate and miconazole nitrate in their combined dosage form and spiked human plasma samples[J].Journal of Chromatographic Science, 2020, 57(10):867-873.
[7] GALAL M M, ABDULLAH S A, MOHAMED O Y, et al.Greenness assessment of two chromatographic methods developed for the determination of Mupirocin in two binary mixtures along with its impurity[J].BMC Chemistry, 2023, 17(1):145.
[8] ZANWAR A S, ASHIS K S, MAHESHWARI R A, et al.A new analytical hplc method for quantification of mometasone furoate, nadifloxacin and miconazole nitrate in semisolid dosage form[J].International Journal of Pharmaceutical Research, 2020,12:570-576.
[9] JAHANI M, AKABERI M, HEIDARI T, et al.Simultaneous determination of mometasone furoate and calcipotriol in a binary mixture by validated HPLC and chemometric-assisted UV spectrophotometric methods and identification of degradation products by LC-MS[J].Iranian Journal of Basic Medical Sciences, 2023, 26(1):37-47.[10] LEVIN M, OSTANINA N, GUMENIUK O, et al.Development of simple and fast UV-method for the quantitative determination of mometasone furoate in a large number of metered doses of an aqueous nasal spray of mometasone furoate[J].Heliyon, 2019, 5(11):e02748.
[11] ZANWAR A S, SEN D B, MAHESHWARI R A, et al.Simultaneous analysis of mometasone furoate, miconazole nitrate, and nadifloxacin in cream formulation by HPTLC[J].Journal of Applied Pharmaceutical Science, 2020,10(7):108-115.
[12] 胡拥明, 王利兵, 袁媛, 等.糖皮质激素ELISA检测方法的建立及群选性抗体的筛选[J].食品科学, 2009, 30(24):331-336.HU Y M, WANG L B, YUAN Y, et al.Development of an ELISA for detection of dexamethasone and screening of polyclonal antibody[J].Food Science, 2009, 30(24):331-336.
[13] ZHANG S W, WU Z Y, ZHOU K, et al.Development of a competitive indirect ELISA for high-throughput screening of hydrocortisone in cosmetic sample[J].Food and Agricultural Immunology, 2019, 30(1):594-605.
[14] HARLOW E, LANE D.Antibodies:A Laboratory Manual [M].Cold Spring Harbor:Cold Spring Harbor Laboratory Press, 1988:139-242.
[15] ZHANG S W, YAO T Q, WANG S F, et al.Development of an upconversion luminescence nanoparticles-based immunochromatographic assay for the rapid detection of dexamethasone in animal tissue[J].Food Analytical Methods, 2019, 12(3):752-760.
[16] 王英姿, 闫剑勇, 张世伟.基于异源包被的曲安奈德竞争酶联免疫检测方法[J].食品工业科技, 2020, 41(8):263-267.WANG Y Z, YAN J Y, ZHANG S W.Detection of triamcinolone acetonide indirect competitive ELISA based on heterology coating strategy[J].Science and Technology of Food Industry, 2020, 41(8):263-267.
[17] 姚添淇, 劳翠瑜, 王士峰, 等.糖皮质激素广谱特异性单克隆抗体的制备及其ic-ELISA方法的建立[J].食品科学, 2019, 40(14):186-191.YAO T Q, LAO C Y, WANG S F, et al.Establishment of indirect competitive-enzyme linked immunosorbent assay to detect glucocorticoids:Preparation of broad-spectrum monoclonal antibody[J].Food Science, 2019, 40(14):186-191.
[18] WANG Z X, ZHENG Q K, GUO L L, et al.Preparation of an anti-dexamethasone monoclonal antibody and its use in development of a colloidal gold immunoassay[J].Food and Agricultural Immunology, 2017, 28(6):958-968.
[19] QUAX R A, MANENSCHIJN L, KOPER J W, et al.Glucocorticoid sensitivity in health and disease[J].Nature Reviews.Endocrinology, 2013, 9(11):670-686.
[20] ZHANG Y J, WU W L, LI Q, et al.The hapten rigidity improves antibody performances in immunoassay for rifamycins Immunovalidation and molecular mechanism[J].Journal of Hazardous Materials, 2024, 469:133977.
[21] XU Z H, WANG J K, YE Q X, et al.Highly selective monoclonal antibody-based fluorescence immunochromatographic assay for the detection of fenpropathrin in vegetable and fruit samples[J].Analytica Chimica Acta, 2023, 1246:340898.
[22] WU H L, WANG B Z, WANG Y, et al.Monoclonal antibody-based icELISA for the screening of diazinon in vegetable samples[J].Analytical Methods:Advancing Methods and Applications, 2021, 13(16):1911-1918.
[23] HUETOS O, RAMOS M, MART N DE POZUELO M, et al.Determination of dexamethasone in feed by TLC and HPLC[J].The Analyst, 1999, 124(11):1583-1587.
N DE POZUELO M, et al.Determination of dexamethasone in feed by TLC and HPLC[J].The Analyst, 1999, 124(11):1583-1587.
[24] SEFID-SEFIDEHKHAN Y, JOUYBAN A, KHOSHKAM M, et al.A mini review on materials used for the colorimetric detection of corticosteroids[J].Chemical Papers, 2022, 76(8):4627-4643.