花旗松素(taxifolin,TAX),又名二氢槲皮素、紫杉叶素、紫杉醇,属于植物二氢黄酮类化合物[1],具有抗氧化[2]、抗炎[3]、抗癌等多种生物活性。葛根素(puerarin,PUE)属于异黄酮类化合物[4],具有抗氧化,抗炎等多种生物学功能[5-6]。两者在结构上主要区别为,TAX基本母核为2-苯基色原酮,即B环连接在C环的2位上,而PUE为3-苯基色原酮,即B环连接在C环的3位上,见图1。黄酮类化合物作为一类重要的植物化合物,因其结构上有较多的羟基基团而表现出较强的抗氧化能力[7]。具有抗氧化活性的植物成分在复配之后,主要表现为协同、加和和拮抗的作用效果[8]。但同种物质在不同比例或浓度复配后,其产生的相互作用可能会不一致[9]。例如,ENKO等[10]通过DPPH和铁还原力(ferric ion reducing antioxidant power,FRAP)等方法评价抗坏血酸与不同红茶和绿茶提取物的抗氧化能力,发现不同比例复配后相关作用有差异。木质素和槲皮素在比例为4∶1时,协同抗氧化能力最强且超过了纯槲皮素,但当比例大于6∶1时,两者相互作用表现为拮抗[11]。而槲皮素和白藜芦醇在低质量浓度(80 μg/mL)下按照1∶1复配后,协同抗氧化作用显著[12]。RUTKOWSKA等[9]研究表明,槲皮甙与表儿茶素在1∶2混合时则呈现较强的协同作用,在其他比例下表现为加和或拮抗作用。这些研究都表明复配比例和浓度是影响两种或多种活性成分复配后相互作用非常重要的因素。
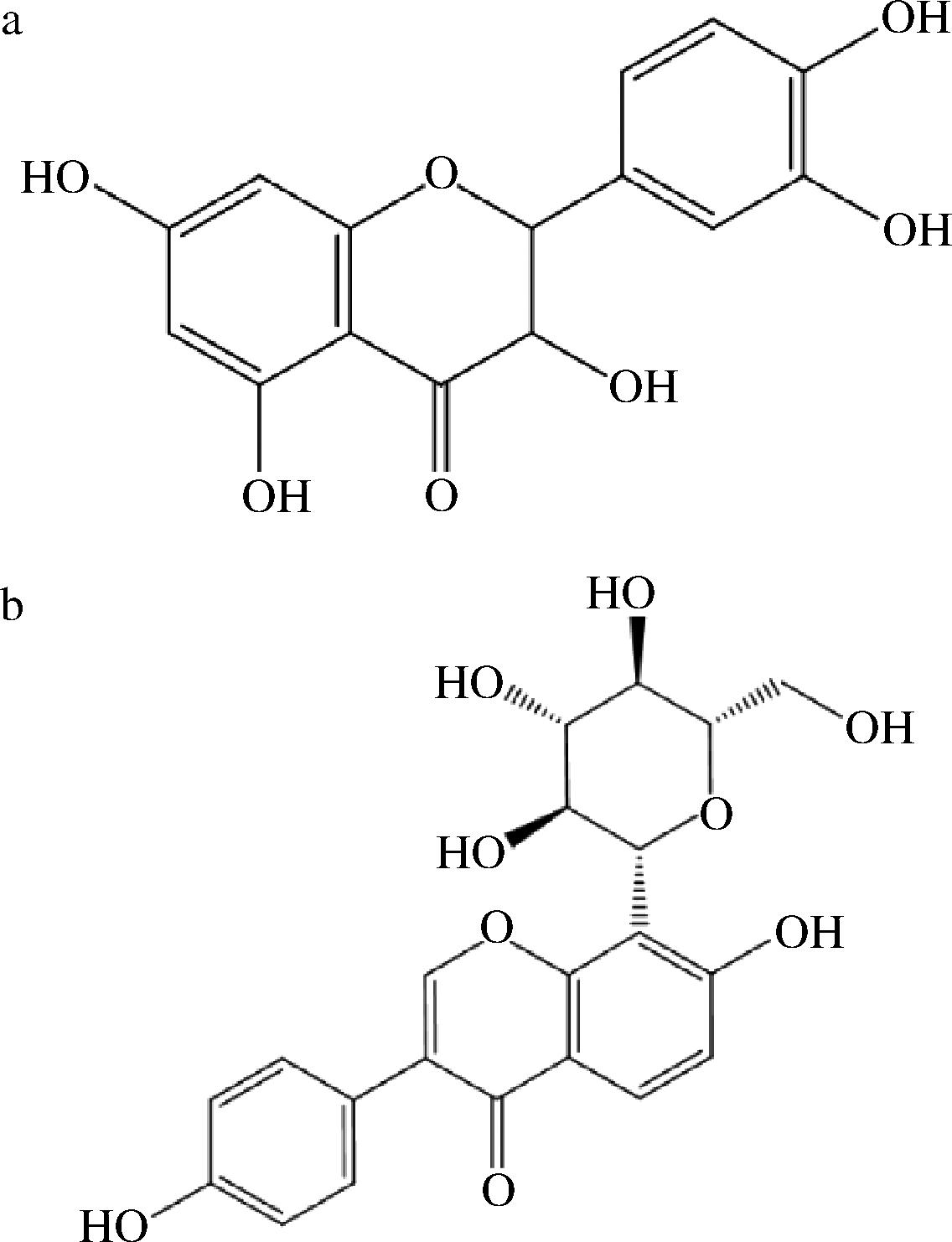
a-TAX;b-PUE
图1 两种黄酮类化合物结构
Fig.1 The structure of taxifolin and puerarin
SynergyFinder是一种可用于多药物(2种或多种药物)多剂量组合反应数据的交互式分析和可视化网络应用程序[13-14]。在评估联合药物的潜在协同作用时,SynergyFinder通常将药物组合反应与通过协同评分模型计算的预期组合反应进行比较,从而根据观察到的反应和预期反应的偏差,将药物组合分类为协同作用或拮抗作用[14]。SynergyFinder中,协同作用得分(δ-得分)和表面图是通过协同模型(HSA、Loewe、Bliss和ZIP模型)而得出的,同时表面图中还显示了由于药物相互作用引起的平均过度反应[15]。δ-得分>10、<-10和-10~10分别表示药物组合具有协同、拮抗和加和作用[16]。
本研究拟将TAX和PUE在一定浓度内按照不同比例进行复配,通过DPPH、FRAP、ABTS等方法测定抗氧化活性,基于SynergyFinder软件及HSA协同评分模型分析两者在不同比例复配下的协同抗氧化能力,为后续深层次探究植物化合物协同抗氧化能力提供理论基础。
1 材料与方法
1.1 主要材料与试剂
TAX(纯度≥98%),上海阿拉丁试剂公司;PUE(纯度98%),上海源叶公司;DPPH,上海梯希爱公司;ABTS,上海瑞永生物科技公司;2,4,6-三吡啶基-1,3,5-三嗪[2,4,6-tri(2-pyridyl)-s-triazine,TPTZ],麦克林生化科技有限公司;无水乙醇、甲醇、FeCl3等均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
UV-5200紫外可见分光光度计,上海元析仪器有限公司;AR423CN电子分析天平,奥豪斯仪器(上海)有限公司产品;KQ-800DE数控超声清洗机,昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 TAX和PUE抗氧化能力比较
1.3.1.1 TAX和PUE的DPPH自由基清除能力
参考PA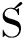 KO等[17-18]的方法略加改进,取0.2 mmol/L DPPH标准溶液2.5 mL,分别与0.5 mL不同质量浓度的TAX(6.25~50 μg/mL)和PUE(2~50 mg/mL)混合均匀,避光反应1 h,于517 nm处测吸光值。DPPH自由基清除率计算如公式(1)所示:
KO等[17-18]的方法略加改进,取0.2 mmol/L DPPH标准溶液2.5 mL,分别与0.5 mL不同质量浓度的TAX(6.25~50 μg/mL)和PUE(2~50 mg/mL)混合均匀,避光反应1 h,于517 nm处测吸光值。DPPH自由基清除率计算如公式(1)所示:
清除率/%=[(A0-A1)/A0]×100
(1)
式中:A0,不加样品时吸光值;A1,加样品时吸光值。
1.3.1.2 TAX和PUE的ABTS阳离子自由基清除能力
参考文献[19-20]的方法略加改进,7 mmol/L ABTS溶液和4.9 mmol/L过硫酸钾溶液按照体积比1∶1混合配制成ABTS工作液。取ABTS工作液2.5 mL,分别与0.5 mL不同质量浓度的TAX(3.12~25 μg/mL)和PUE(3.12~25 μg/mL)混合均匀,避光反应4 min,于734 nm处测吸光值。ABTS阳离子自由基计算如公式(2)所示:
清除率/%=[(A2-A3)/A2]×100
(2)
式中:A2,不加样品时吸光值;A3,加样品时吸光值。
1.3.1.3 TAX和PUE的FRAP还原能力
参考文献[21-22]的方法略加改进,按V(0.1 mol/L醋酸钠缓冲液)∶V(10 mmol/L TPTZ)∶V(20 mmol/L FeCl3)=10∶1∶1配制FRAP试剂。取FRAP试剂4.9 mL,分别与0.5 mL不同质量浓度的TAX(2.5~15 μg/mL)和PUE(123~1 000 μg/mL)混合均匀,37 ℃水浴条件下反应10 min,593 nm下测定吸光度。FRAP还原能力计算如公式(3)所示:
FRAP还原能力/%=[(A4-A5)/A4]×100
(3)
式中:A4,加样品时吸光值;A5,不加样品时吸光值。
1.3.2 SynergyFinder分析TAX和PUE的协同抗氧化能力
参考1.3.1节中DPPH、ABTS、FRAP中花旗松素和葛根素试验质量浓度,将不同质量浓度的花旗松素和葛根素分别按照体积比1∶1、1∶2、2∶1复配成0.5 mL混合溶液,按照1.3.1节中试验方法测定DPPH、ABTS、FRAP的抗氧化能力,运用SynergyFinder分析两者是否具有协同抗氧化作用。
1.4 数据统计
所有的试验重复3次,结果以平均值±标准差表示,采用SPSS 27软件进行单因素方差分析,P<0.05表示处理之间具有显著性差异。
2 结果与分析
2.1 TAX和PUE的抗氧化能力
2.1.1 TAX和PUE的DPPH自由基清除能力
由图2-a、图2-b可知,在TAX 6.25~50 μg/mL和PUE 2~50 mg/mL范围内,两者随着添加质量浓度的增加,其DPPH自由基清除率也呈增加趋势。TAX在质量浓度50 μg/mL时,清除率最高为44.32%,而PUE在质量浓度高达50 mg/mL时,清除率仅有40.6%。TAX和PUE均具有一定的DPPH自由基清除能力,但TAX对DPPH自由基的清除能力远远强于PUE。
a-TAX;b-PUE
图2 TAX与PUE DPPH自由基清除率
Fig.2 DPPH radical scavenging rates of taxifolin and puerarin
注:图中字母不同表示显著差异(P<0.05)(下同)。
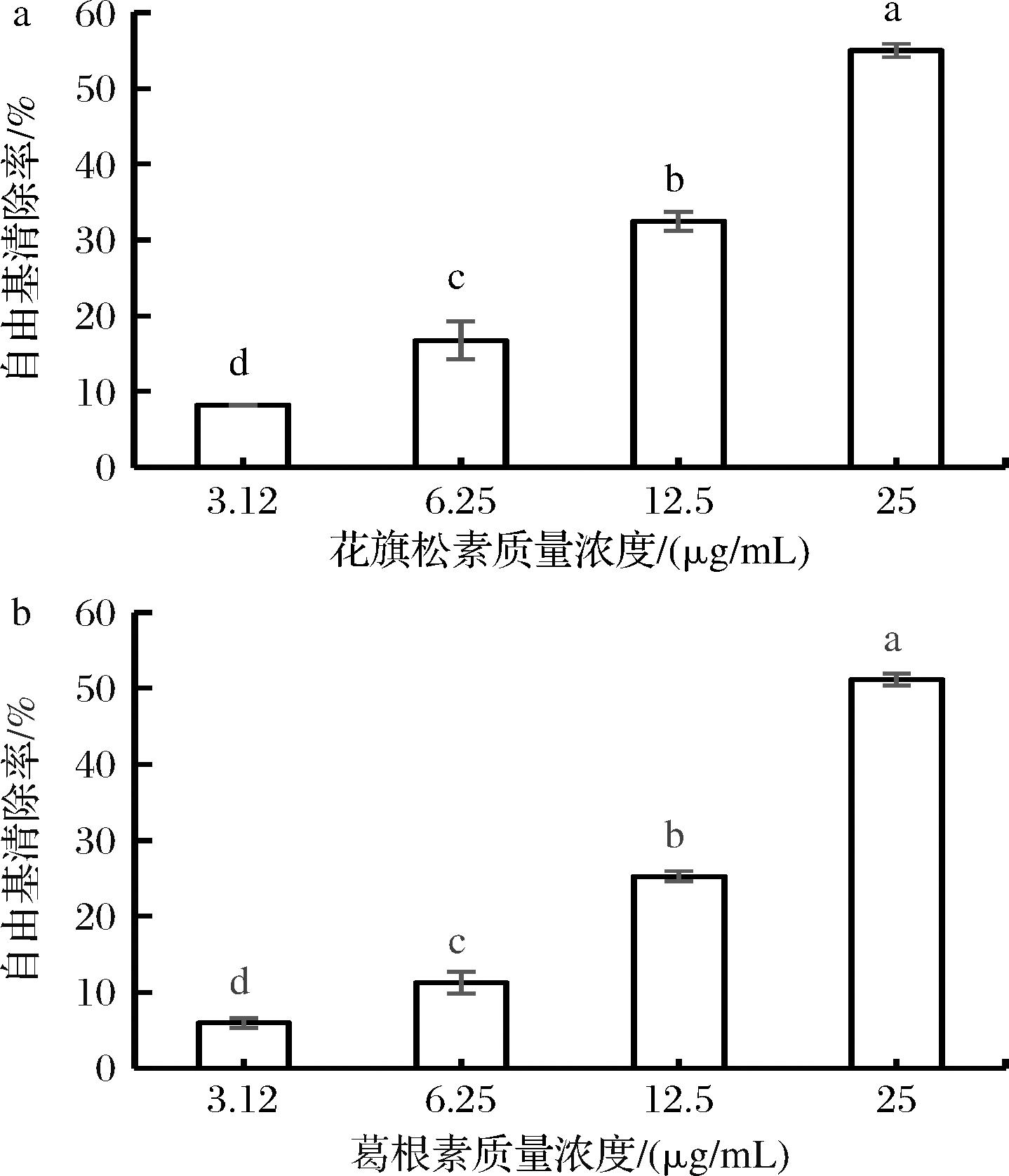
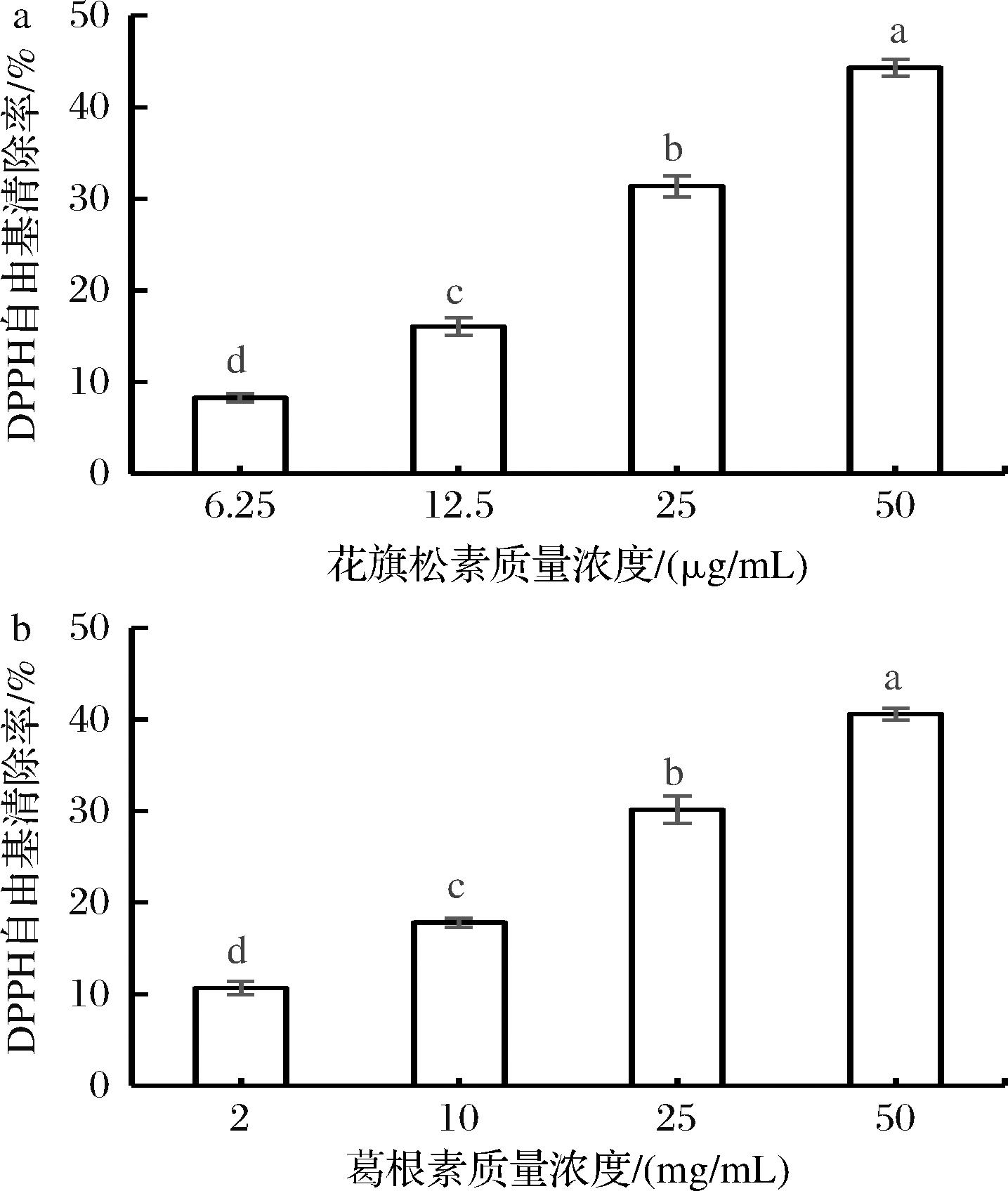
a-TAX;b-PUE
图3 TAX与PUE的ABTS阳离子自由基清除率
Fig.3 ABTS cationic radical scavenging rates of taxifolin and puerarin
2.1.2 TAX和PUE的ABTS阳离子自由基清除能力
由图3-a、图3-b可知,在3.12~25 μg/mL范围内TAX和PUE的ABTS阳离子自由基清除能力与其浓度呈正比关系,但TAX在各个浓度下自由基清除能力略强于PUE,25 μg/mL下两者均达到50%以上的ABTS阳离子自由基清除率。
2.1.3 TAX与PUE的FRAP还原能力
由图4-a、图4-b可知,TAX的FRAP还原能力远强于PUE还原能力。在质量浓度为15 μg/mL时,TAX还原能力可达69.79%。而PUE在125 μg/mL时,还原能力仅为22.34%,在1 000 μg/mL时,才能达到70.29%。
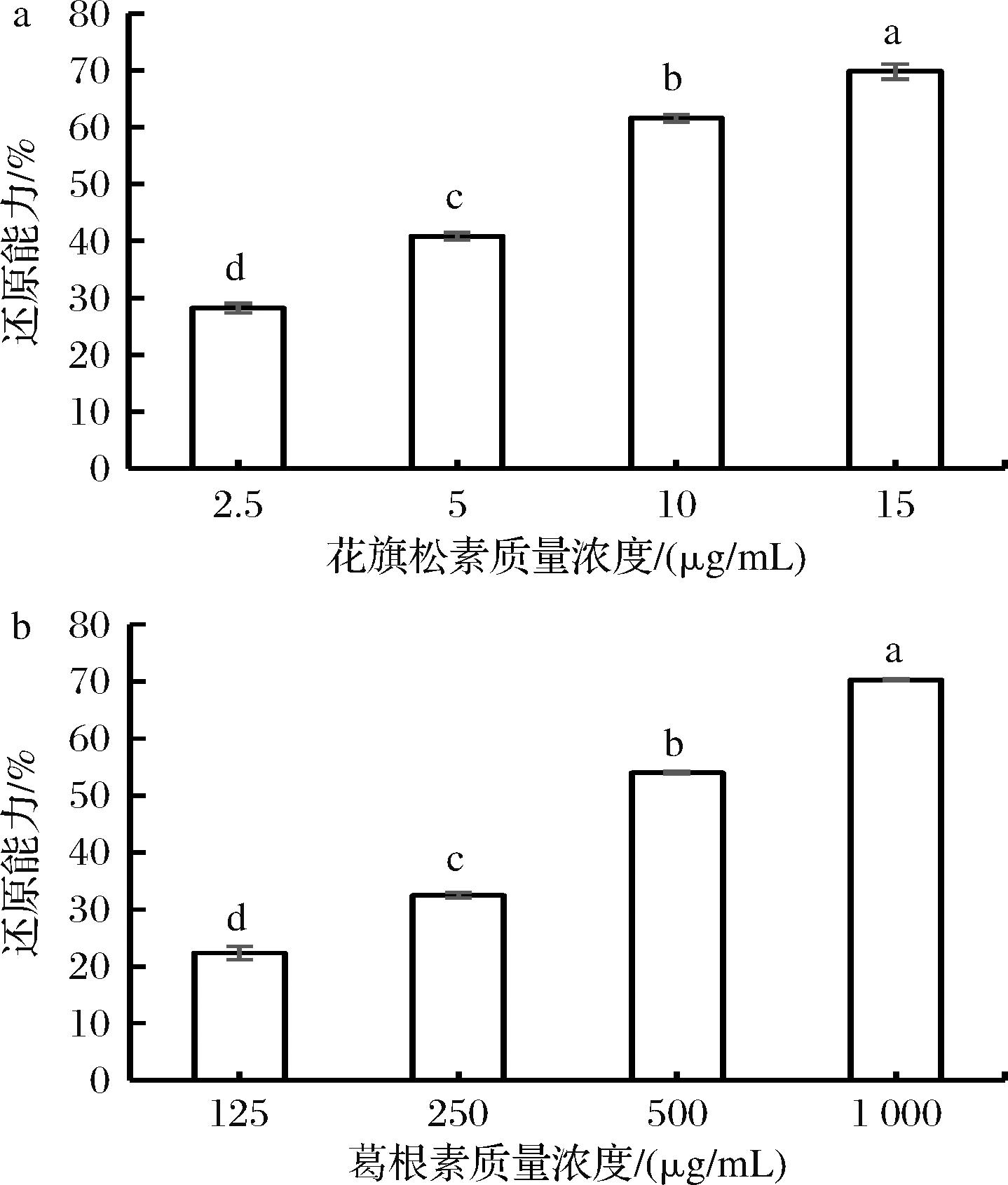
a-TAX;b-PUE
图4 TAX与PUE的FRAP还原能力
Fig.4 FRAP reducing power of taxifolin and puerarin
2.2 TAX联合PUE协同抗氧化能力研究
通过TAX和PUE的独立体外抗氧化实验结果可知,TAX的抗氧化能力远强于PUE。将TAX与PUE按照1∶1、1∶2、1∶3、1∶4、1∶5、2∶1、3∶1、4∶1、5∶1等复配进行体外抗氧化预实验,根据实验结果,选取了3组复配效果最佳的处理(1∶1、1∶2和2∶1),继续通过SynergyFinder分析其是否具有协同抗氧化作用。选用最高单体(HSA)模型进行协同性评分,HSA模型表示预期的联合效应等于单个药物的更高效应,任何高于单个药物处理的额外效应都表示为HSA的协同作用[23]。在HSA模型表面图中,红色区域表示协同,白色为加和,绿色则表示拮抗。红色或绿色颜色越深,表示药物组合协同或拮抗作用越强。同时,SynergyFinder也会自动选择出最佳协同区域,在此区域内,协同能力为所选浓度范围内最强。
2.2.1 TAX与PUE对DPPH自由基清除能力的协同效果
图5-a~图5-c分别为TAX与PUE按照比例为1∶1、1∶2、2∶1进行复配时的DPPH自由基清除率。由图5-a可知,在1∶1复配时,50 μg/mL TAX和10 mg/mL PUE混合,DPPH自由基清除率可达59.54%,比相同浓度下两者单独处理时最高清除率高出15.22%。在图5-b中,50 μg/mL TAX和50 mg/mL PUE按1∶2复配时,自由基清除率最大为48.13%。而当2∶1复配时,50 μg/mL TAX和50 mg/mL PUE混合时具有最强的自由基清除率,为67.2%。因此,在TAX 50 μg/mL,PUE 50 mg/mL质量浓度下2∶1进行复配,具有最强的DPPH自由基清除率,比相同浓度下独立处理时最高清除率高出22.88%。

a-TAX∶PUE=1∶1;b-TAX∶PUE=1∶2;c-TAX∶PUE=2∶1
图5 TAX与PUE不同比例复配下DPPH自由基清除率
Fig.5 DPPH radical scavenging in different ratios of taxifolin and puerarin
进一步利用SynergyFinder选择HSA模型进行协同性评价,得到协同效应图6。图6-a~图6-c三图分别表示TAX与PUE 1∶1、1∶2和2∶1复配而得的效果图及其最佳协同区域评分图。由图6-a可知,比例为1∶1复配时,协同评分为9.362,在此比例下两者协同能力较好。同时,在TAX质量浓度为6.25~25 μg/mL,PUE在2~25 mg/mL区间内,两者协同性最好,协同评分为13.486。两者复配比例为1∶2时,由图6-b可知,协同评分较低,仅为-1.136,但在最佳协同区域,TAX为0~12.5 μg/mL、PUE为2~25 mg/mL内,两者具有一定的协同能力,协同评分为9.355。由图6-c可知,两者比例为2∶1时,整体协同评分为0.515,但在最佳协同区域,TAX 12.5~50 μg/mL、PUE 10~50 mg/mL内,协同评分为6.263。DPPH试验证实,在单个浓度下DPPH清除能力最高为50 μg/mL TAX和50 mg/mL PUE 2∶1复配时,清除率最高为67.2%。HSA协同模型进一步证明,协同DPPH自由基清除能力最强为TAX 6.25~25 μg/mL、PUE 2~25 mg/mL质量浓度范围内1∶1复配时,该范围内协同评分最高为13.486,表现出明显的协同作用。
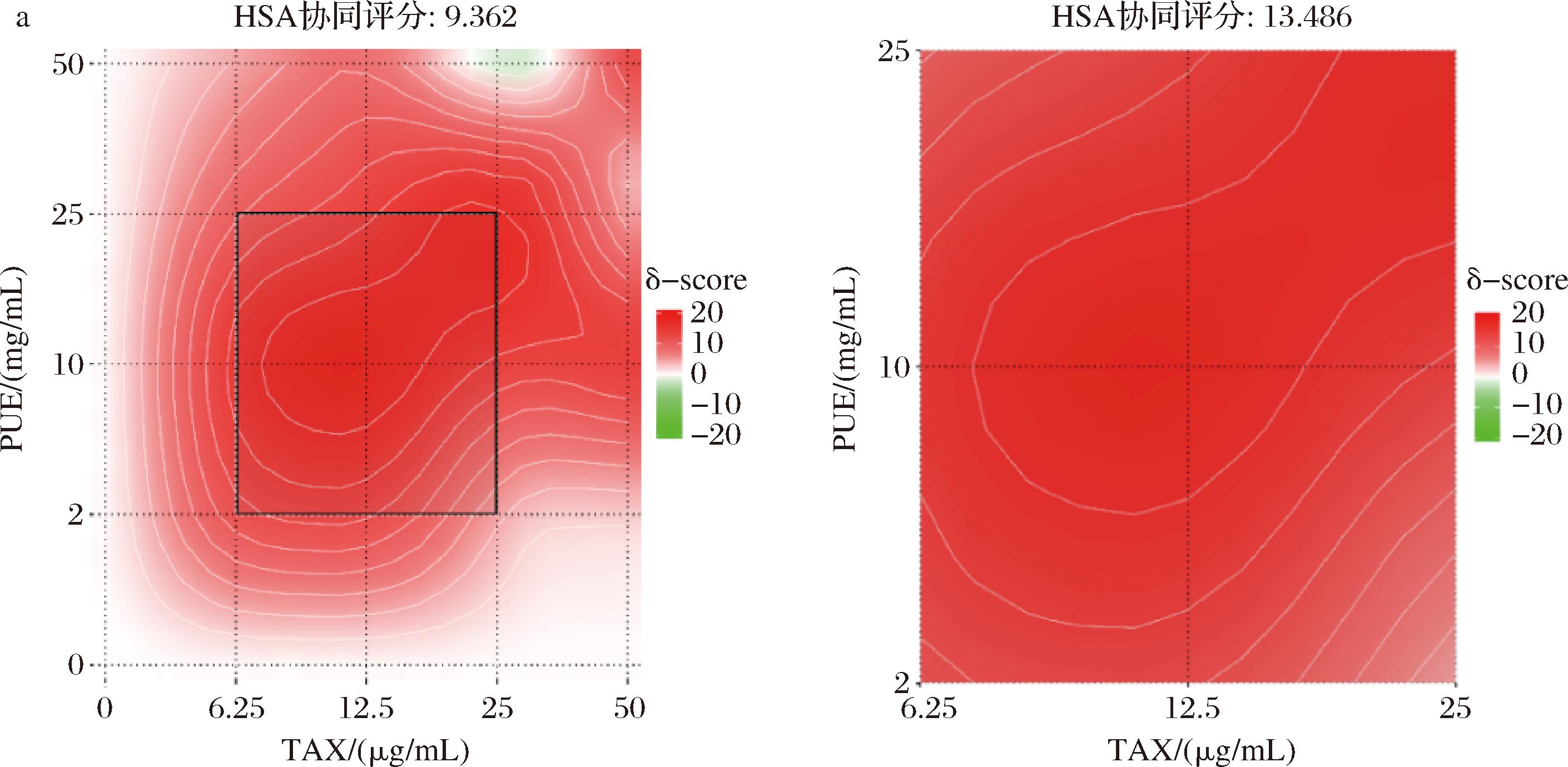
a-TAX∶PUE=1∶1;b-TAX∶PUE=1∶2;c-TAX∶PUE=2∶1
图6 TAX与PUE不同比例复配下DPPH协同效应图
Fig.6 DPPH synergistic effect of different ratios of taxifolin and puerarin
关于抗氧化物质之间的协同作用已有一些研究,如:槲皮素和儿茶素按照不同浓度比例复配之后,在一定范围浓度内,浓度比例为1∶1、1∶2、2∶1时存在协同抗氧化作用,这主要是两者联用处理后超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶等活性显著降低[24]。将11种黄酮类化合物两两混合的抗氧化能力与每种单一抗氧化能力进行对比,发现等比例混合的表儿茶素与槲皮素-3-β-葡萄糖苷之间的相互作用显示出最高的协同作用[25]。
2.2.2 TAX与PUE对ABTS阳离子自由基清除能力的协同效果
由图7-a可知,25 μg/mL TAX与25 μg/mL PUE按体积比1∶1复配时,对ABTS阳离子自由基清除率最大,为51.04%。但小于两者单独处理时的清除率。当按1∶2复配时,在所有组合混合下最高清除率仅为38.91%。在图7-c中,25 μg/mL TAX和25 μg/mL PUE 2∶1复配时,出现最大ABTS阳离子自由基清除率为56.59%。
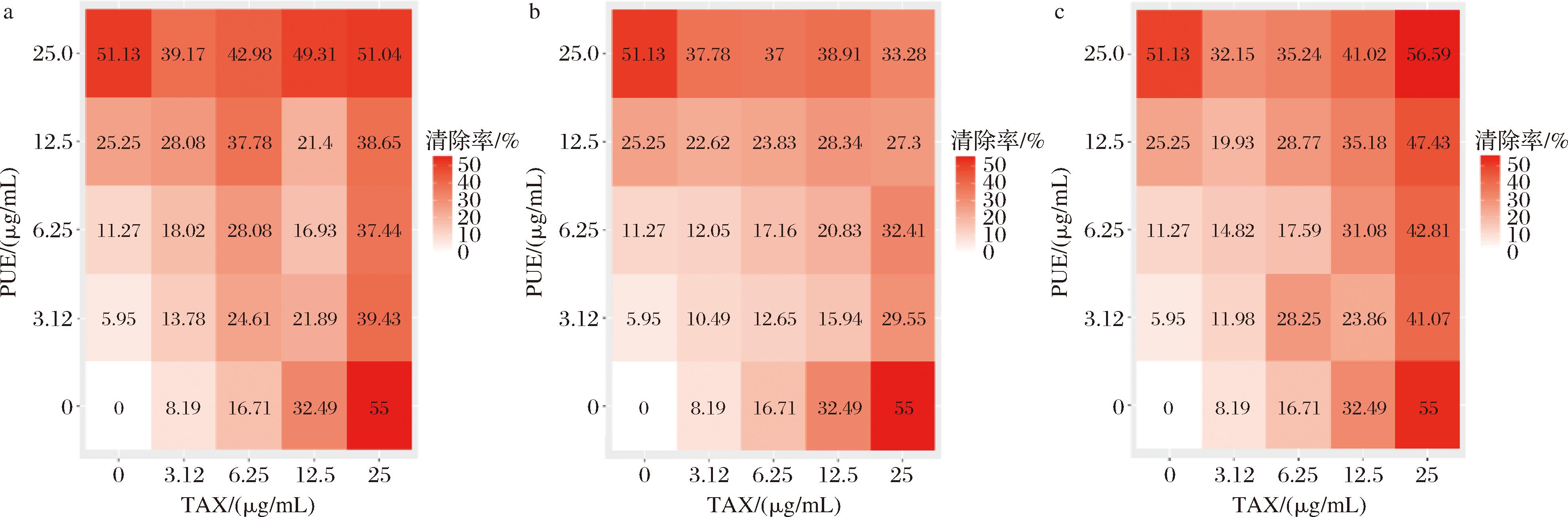
a-TAX∶PUE=1∶1;b-TAX∶PUE=1∶2;c-TAX∶PUE=2∶1
图7 TAX与PUE不同比例复配下ABTS阳离子自由基清除率
Fig.7 ABTS cationic radical scavenging in different ratios of taxifolin and puerarin
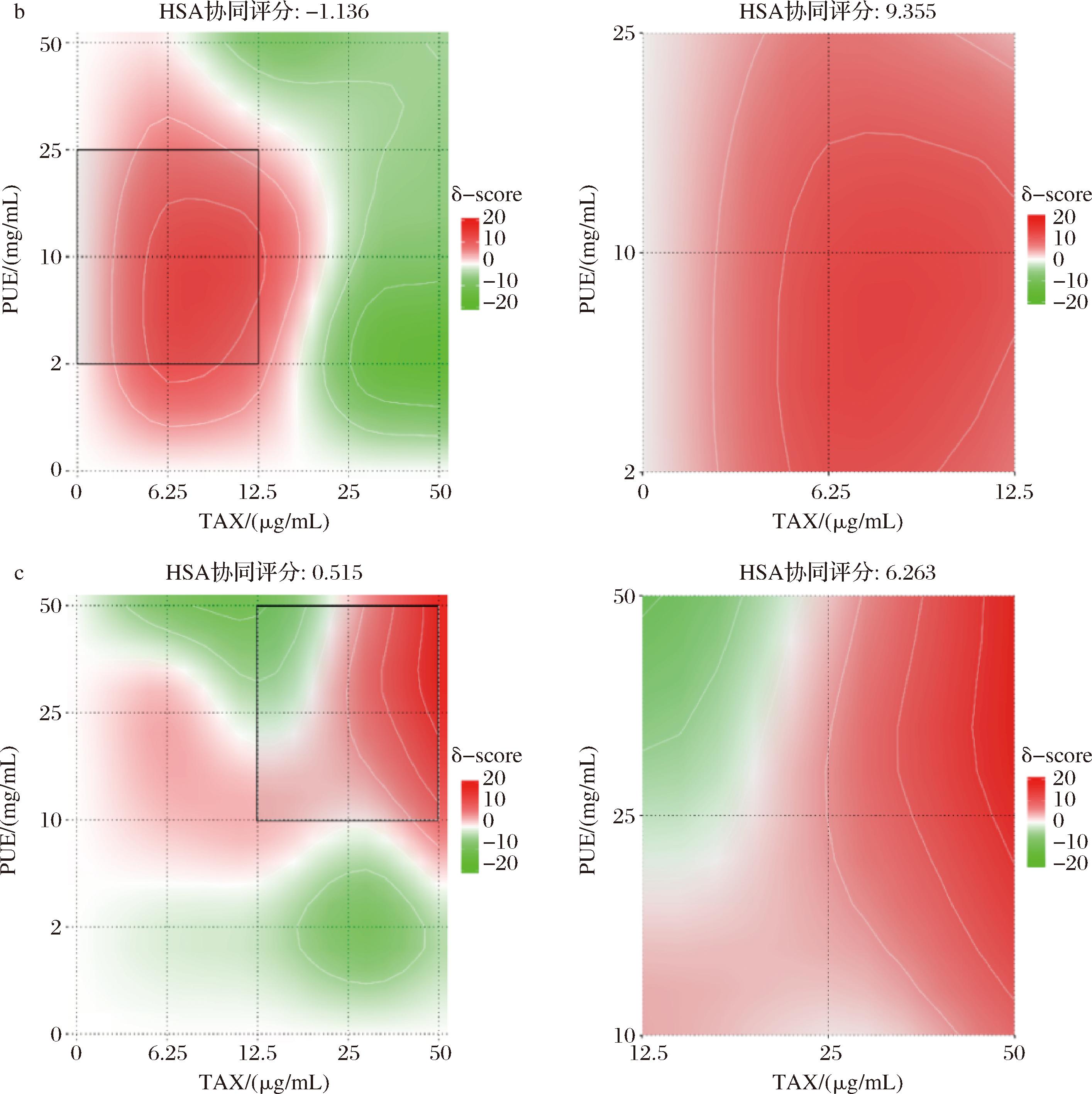
由SynergyFinder进行协同性分析得到图8。3种比例复配情况下,协同评分均小于0。但进一步HSA模型筛选出的最佳协同区域发现,在1∶1、2∶1时协同评分均大于0,显示其在最佳协同区域内亦有一定的协同作用。在1∶1复配情况下,最佳协同区域范围TAX为0~6.25 μg/mL、PUE 3.12~12.5 μg/mL,协同评分为8.383。在2∶1复配时,最佳协同区域范围TAX为0~6.25 μg/mL、PUE 0~6.25 μg/mL,协同评分为5.283。TAX和PUE在这些质量浓度范围内具有一定协同ABTS自由基清除能力。

a-TAX∶PUE=1∶1;b-TAX∶PUE=1∶2;c-TAX∶PUE=2∶1
图8 TAX与PUE不同比例复配下ABTS协同效应图
Fig.8 ABTS synergistic effect of different ratios of taxifolin and puerarin
因此,在单个浓度下ABTS阳离子自由基清除率最高为2∶1复配时, 25 μg/mL TAX和25 μg/mL PUE混合下,出现最大ABTS阳离子自由基清除率,为56.59%。HSA模型证实最强的协同ABTS阳离子自由基清除能力范围,在TAX为0~6.25 μg/mL、PUE 3.12~12.5 μg/mL区域内按1∶1复配。
2.2.3 TAX与PUE对FRAP还原能力的协同效果
由图9-a、图9-b可知,TAX为10 μg/mL、PUE为1 000 μg/mL两者1∶1复配,以及TAX为15 μg/mL、PUE为 1 000 μg/mL两者按1∶2复配时表现出最大还原力,分别为67.76%和59.91%,但均小于同浓度下它们单独处理时的最大还原力。当TAX为10 μg/mL、PUE为1 000 μg/mL按照2∶1复配时,出现最大FRAP还原力为72.87%。

a-TAX∶PUE=1∶1;b-TAX∶PUE=1∶2;c-TAX∶PUE=2∶1
图9 TAX与PUE不同比例复配下FRAP还原能力
Fig.9 FRAP reduction power in different ratios of taxifolin and puerarin
通过SynergyFinder进行协同性分析得到图10。由效果图可知,3种不同比例复配情况下,TAX与PUE的协同效应都不强。这可能是由于FRAP反应体系为酸性[26],TAX与PUE在酸性环境下相互作用能力受到影响,因此导致两者协同能力降低。但进一步HSA分析最佳协同区域发现,在1∶1和1∶2的复配时,协同评分均大于0,显示有一定的协同能力。1∶1复配时,最佳协同区域为TAX 2.5~10 μg/mL、PUE 0~250 μg/mL,协同评分为1.93。1∶2复配时,最佳协同区域为TAX 0~5 μg/mL,PUE 0~250 μg/mL,协同评分为1.778。因此,在单个浓度下FRAP还原力最高为10 μg/mL TAX和1 000 μg/mL PUE 2∶1复配时,出现最大FRAP还原力为72.87%。HSA模型分析最强的协同FRAP还原能力范围,在TAX 2.5~10 μg/mL、PUE 0~250 μg/mL区域内按1∶1复配。

a-TAX∶PUE=1∶1;b-TAX∶PUE=1∶2;c-TAX∶PUE=2∶1
图10 TAX与PUE不同比例复配下FRAP协同效应图
Fig.10 FRAP synergistic effect of different ratios of taxifolin and puerarin
提取物中的酚类和黄酮类化合物是协同抗氧化的关键。JAIN等[27]通过将绿茶提取物和5种草药按照不同比例组合发现,当比例为5∶3∶3∶3∶3时具有协同抗氧化作用,这主要与提取物的酚类和黄酮类化合物存在有关。WANG等[28]从金露梅叶子中获得抗氧化活性最高组分C-3,与银杏叶提取物组合后具有协同抗氧化作用,进一步通过高效液相色谱法探究其协同作用机制,发现C-3中的咖啡酸和银杏叶提取物中的异鼠李素在不同比例下均表现出最大协同作用。在银杏叶提取物中,原花青素与银杏黄酮1∶9复配后,协同抗氧化能力最强[29]。在本实验中,TAX和PUE作为结构不同的黄酮类化合物,通过体外抗氧化试验证实,在TAX 6.25~25 μg/mL和PUE 2~25 mg/mL,TAX 0~6.25 μg/mL和PUE 3.12~12.5 μg/mL,TAX 2.5~10 μg/mL和PUE 0~250 μg/mL 3个质量浓度范围内1∶1复配时,分别对DPPH、ABTS和FRAP的协同抗氧化能力最强。
目前对植物化合物协同抗氧化机制解释主要有:(1)植物化合物复配之后,较不活跃植物化合物会牺牲自己与自由基结合而保护活性较强的化合物;同时,不活跃的植物化合物也可还原再生为抗氧化活性更强的化合物[30]。如,茶多酚EGCG可以还原再生为抗氧化活性较强的α-生育酚[31],从而两者协同使抗氧化能力增强。在葵花籽油甘油三酯100 ℃自氧化过程,α-生育酚再生杨梅素,两者协同抗氧化能力增强[32]。(2)不同抗氧化成分分子结构中相互作用[24]。如,在银杏叶提取物中,原花青素与银杏黄酮复配后协同抗氧化能力最强,通过分子相互作用分析两者的抗氧化分子之间存在密切相互作用[29]。(3)不同抗氧化剂之间形成稳定的分子复合物,从而表现出更强的抗氧化活性[33]。推测TAX与PUE协同抗氧化机制可能为,抗氧化活性较弱的PUE与自由基结合保护了TAX,同时其抗氧化分子之间也存在相互作用,目前对活性物质抗氧化协同作用的机制研究非常有限,现有协同机制的阐述局限性很大,还需进一步在结构、分子方面对机制进行深入研究。后续将通过细胞或动物实验来验证这一结论,为植物化合物协同抗氧化研究提供理论基础。
3 结论
通过测定自由基清除能力和还原力,探究了TAX与PUE单独使用以及两者在不同比例复配之后的抗氧化能力,并运用协同性分析软件SynergyFinder分析了两者之间的协同抗氧化能力。结果显示,在DPPH自由基清除实验中,TAX 6.25~25 μg/mL、PUE 2~25 mg/mL质量浓度范围内1∶1复配时,该范围内协同评分最高,为13.486,表现出明显的协同作用。在ABTS阳离子自由基清除实验中,在TAX为0~6.25 μg/mL、PUE 3.12~12.5 μg/mL区域内按1∶1复配时协同评分最高,为8.383。在还原力测定实验中,3种比例复配情况下,HSA模型评分均不高。但在TAX与PUE 1∶1复配时,最佳协同区域TAX 2.5~10 μg/mL、PUE 0~250 μg/mL范围内,协同评分为1.930,显示其在该范围浓度内具有相对较弱的协同作用。本研究结果表明,TAX与PUE按照体积比1∶1进行复配,3种体外抗氧化评价实验均显示其具有一定的协同抗氧化能力。
[1] 张晓利, 赵瑞香, 姜建福, 等.葡萄皮渣中花旗松素提取工艺优化及其抗氧化能力测定[J].食品工业科技, 2021, 42(5):200-205;220.ZHANG X L, ZHAO R X, JIANG J F, et al.Optimization of extraction process of taxifolin from grape pomace and determination of its antioxidant capacity[J].Science and Technology of Food Industry, 2021, 42(5):200-205;220.
[2] BRUI M, PIRKOVI
M, PIRKOVI A, VILOTI
A, VILOTI A, et al.Cytoprotective and genoprotective effects of taxifolin against oxidative damage in HTR-8/SVneo human trophoblast cells[J].Mutagenesis, 2023, 38(1):64-70.
A, et al.Cytoprotective and genoprotective effects of taxifolin against oxidative damage in HTR-8/SVneo human trophoblast cells[J].Mutagenesis, 2023, 38(1):64-70.
[3] GONG S Y, ZHENG J C, ZHANG J J, et al.Taxifolin ameliorates lipopolysaccharide-induced intestinal epithelial barrier dysfunction via attenuating NF-kappa B/MLCK pathway in a Caco-2 cell monolayer model[J].Food Research International, 2022, 158:111502.
[4] WANG L, SONG B H, HU Y, et al.Puerarin ameliorates 5-fluorouracil-induced intestinal mucositis in mice by inhibiting JAKs[J].The Journal of Pharmacology and Experimental Therapeutics, 2021, 379(2):147-155.
[5] 施璇, 余应梅, 欧阳经鑫, 等.葛根素对饲喂氧化大豆油黄羽肉鸡免疫器官抗氧化功能的影响[J].中国兽医学报, 2022, 42(1):120-127;148.SHI X, YU Y M, OUYANG J X, et al.Effects of puerarin on the antioxidant capacity of immune organs in yellow-feathered broilers fed with oxidized soybean oil[J].Chinese Journal of Veterinary Science, 2022, 42(1):120-127;148.
[6] 余应梅, 施璇, 欧阳经鑫, 等.葛根素对饲喂氧化大豆油肉鸡小肠黏膜屏障功能及抗氧化能力的影响[J].畜牧兽医学报, 2021, 52(12):3512-3523.YU Y M, SHI X, OUYANG J X, et al.Effects of puerarin on intestinal barrier function and antioxidant capacity of broilers fed with oxidized soybean oil[J].Acta Veterinaria et Zootechnica Sinica, 2021, 52(12):3512-3523.
[7] APAK R, ÖZYÜREK M, GÜÇLÜ K, et al.Antioxidant activity/capacity measurement.2.hydrogen atom transfer (HAT)-based, mixed-mode (electron transfer (ET)/HAT), and lipid peroxidation assays[J].Journal of Agricultural and Food Chemistry, 2016, 64(5):1028-1045.
[8] CHEN X, LI H Y, ZHANG B, et al.The synergistic and antagonistic antioxidant interactions of dietary phytochemical combinations[J].Critical Reviews in Food Science and Nutrition, 2022, 62(20):5658-5677.
[9] RUTKOWSKA M, OLSZEWSKA M A, KOLODZIEJCZYK-CZEPAS J, et al.Sorbus domestica leaf extracts and their activity markers:Antioxidant potential and synergy effects in scavenging assays of multiple oxidants[J].Molecules, 2019, 24(12):2289.[10] ENKO J, GLISZCZY SKA-
SKA- WIG
WIG O A.Influence of the interactions between tea (Camellia sinensis) extracts and ascorbic acid on their antioxidant activity:Analysis with interaction indexes and isobolograms[J].Food Additives &Contaminants.Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2015, 32(8):1234-1242.
O A.Influence of the interactions between tea (Camellia sinensis) extracts and ascorbic acid on their antioxidant activity:Analysis with interaction indexes and isobolograms[J].Food Additives &Contaminants.Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2015, 32(8):1234-1242.
[11] LIU D, LI Y, QIAN Y, et al.Synergistic antioxidant performance of lignin and quercetin mixtures[J].ACS Sustainable Chemistry &Engineering, 2017, 5(9):8424-8428.
[12] MURUGESAN N D C, KRISHNAMOORTHY S.In-vitro evaluation of synergism in antioxidant efficiency of quercetin and resveratrol[J].Chemical Biology Letters, 2023, 10(2):534.
[13] IANEVSKI A, GIRI A K, AITTOKALLIO T.SynergyFinder 2.0:Visual analytics of multi-drug combination synergies[J].Nucleic Acids Research, 2020, 48(W1):W488-W493.
[14] IANEVSKI A, GIRI A K, AITTOKALLIO T.SynergyFinder 3.0:An interactive analysis and consensus interpretation of multi-drug synergies across multiple samples[J].Nucleic Acids Research, 2022, 50(W1):W739-W743.
[15] TANDOH A, DANQUAH C A, BENNEH C K, et al.Effect of diclofenac and andrographolide combination on carrageenan-induced paw edema and hyperalgesia in rats[J].Dose-Response:a Publication of International Hormesis Society, 2022, 20(2):15593258221103846.
[16] NEAL A, LAI T, SINGH T, et al.Combining ReACp53 with carboplatin to target high-grade serous ovarian cancers[J].Cancers, 2021, 13(23):5908.
[17] PA KO P, BARTO
KO P, BARTO H, ZAGRODZKI P, et al.Anthocyanins, total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J].Food Chemistry, 2009, 115(3):994-998.
H, ZAGRODZKI P, et al.Anthocyanins, total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J].Food Chemistry, 2009, 115(3):994-998.
[18] WANG F, ZHAO S C, LI F, et al.Investigation of antioxidant interactions between Radix astragali and Cimicifuga foetida and identification of synergistic antioxidant compounds[J].PLoS One, 2014, 9(1):e87221.
[19] LUO J G, LI L, KONG L Y.Preparative separation of phenylpropenoid glycerides from the bulbs of Lilium lancifolium by high-speed counter-current chromatography and evaluation of their antioxidant activities[J].Food Chemistry, 2012, 131(3):1056-1062.
[20] SRIDHAR K, CHARLES A L.In vitro antioxidant activity of Kyoho grape extracts in DPPH and ABTS assays:Estimation methods for EC50 using advanced statistical programs[J].Food Chemistry, 2019, 275:41-49.
[21] 崔文玉, 丰程凤, 夏智慧, 等.蒸汽爆破对葡萄皮渣酚类物质含量及抗氧化活性的影响[J].食品与发酵工业, 2023, 49(5):157-163.CUI W Y, FENG C F, XIA Z H, et al.Effect of steam explosion on phenolics and antioxidant activities in grape pomace[J].Food and Fermentation Industries, 2023, 49(5):157-163.
[22] WANG S N, MECKLING K A, MARCONE M F, et al.Synergistic, additive, and antagonistic effects of food mixtures on total antioxidant capacities[J].Journal of Agricultural and Food Chemistry, 2011, 59(3):960-968.
[23] YADAV B, WENNERBERG K, AITTOKALLIO T, et al.Searching for drug synergy in complex dose-response landscapes using an interaction potency model[J].Computational and Structural Biotechnology Journal, 2015, 13:504-513.
[24] 于佳成. 黄芪白芍协同调控细胞抗氧化作用机制的研究[D].泰安:山东农业大学, 2015.YU J C.Synergistic mechanism of astragalus and peony in the regulation of cellular antioxidant[D].Taian:Shandong Agricultural University, 2015.
[25] HIDALGO M, S NCHEZ-MORENO C, DE PASCUAL-TERESA S.Flavonoid-flavonoid interaction and its effect on their antioxidant activity[J].Food Chemistry, 2010, 121(3):691-696.
NCHEZ-MORENO C, DE PASCUAL-TERESA S.Flavonoid-flavonoid interaction and its effect on their antioxidant activity[J].Food Chemistry, 2010, 121(3):691-696.
[26] MUZOLF-PANEK M, GLISZCZY SKA-
SKA- WIG
WIG O A, SZYMUSIAK H, et al.The influence of stereochemistry on the antioxidant properties of catechin epimers[J].European Food Research and Technology, 2012, 235(6):1001-1009.
O A, SZYMUSIAK H, et al.The influence of stereochemistry on the antioxidant properties of catechin epimers[J].European Food Research and Technology, 2012, 235(6):1001-1009.
[27] JAIN D P, PANCHOLI S S, PATEL R.Synergistic antioxidant activity of green tea with some herbs[J].Journal of Advanced Pharmaceutical Technology &Research, 2011, 2(3):177-183.
[28] WANG S S, WANG D M, LIU Z H.Synergistic, additive and antagonistic effects of Potentilla fruticosa combined with EGb761 on antioxidant capacities and the possible mechanism[J].Industrial Crops and Products, 2015, 67:227-238.
[29] ZHANG L H, ZHU C Y, LIU X Q, et al.Study on synergistic antioxidant effect of typical functional components of hydroethanolic leaf extract from Ginkgo biloba in vitro[J].Molecules, 2022, 27(2):439.
[30] PHAN M A T, PATERSON J, BUCKNALL M, et al.Interactions between phytochemicals from fruits and vegetables:Effects on bioactivities and bioavailability[J].Critical Reviews in Food Science and Nutrition, 2018, 58(8):1310-1329.
[31] ZHOU B, WU L M, YANG L, et al.Evidence for alpha-tocopherol regeneration reaction of green tea polyphenols in SDS micelles[J].Free Radical Biology &Medicine, 2005, 38(1):78-84.
[32] MARINOVA E, TONEVA A, YANISHLIEVA N.Synergistic antioxidant effect of α-tocopherol and myricetin on the autoxidation of triacylglycerols of sunflower oil[J].Food Chemistry, 2008, 106(2):628-633.
[33] OLSZOWY-TOMCZYK M.Synergistic, antagonistic and additive antioxidant effects in the binary mixtures[J].Phytochemistry Reviews, 2020, 19(1):63-103.