母乳寡糖(human milk oligosaccharides, HMOs)是母乳中含量第三丰富的固体成分[1],在婴儿生长发育过程中有着积极的影响[2]。乳酰-N-三糖Ⅱ(lacto-N-triose Ⅱ, LNT Ⅱ)由N-乙酰氨基葡萄糖(N-acetylglucosamine, GlcNAc)和乳糖通过β-1,3-糖苷键连接而成,它是HMOs的核心结构单元。LNT Ⅱ不仅可以通过Toll 样受体(Toll like receptor, TLR)途径激活核因子κB,即LNT Ⅱ在一定程度上显示出对免疫细胞的调控作用[3],还能与人的肠道上皮细胞发生作用,有效减少炎症的发生率[4]。然而,天然母乳和牛乳中LNT Ⅱ的丰度极低,不能满足大规模合成HMOs的需求,因此,LNT Ⅱ的廉价生产对多样化HMOs的商业化生产具有重要意义。
目前LNT Ⅱ合成方法有化学法、酶催化法和微生物发酵法。尹晓娟[5]利用化学法来以乳糖和GlcNAc为起始原料,采用“1+2”的策略获得LNT Ⅱ,收率为14%。化学法需要激活、保护和去保护等多个步骤,且收率低[6],并不适合工业化生产LNT Ⅱ。早在1999年,BLIXT等[7]鉴定出一种来自脑膜炎奈瑟球菌(Neisseria meningitidis)的β-1,3-N-乙酰氨基葡萄糖转移酶(LgtA),可以催化尿苷二磷酸乙酰氨基葡萄糖(uridine diphosphate acetylglucosamine, UDP-GlcNAc)上的GlcNAc残基转移到乳糖受体生成LNT Ⅱ;LIU等[8]从巴斯德毕赤酵母(Pichia pastoris)中异源表达并纯化出β-N-乙酰氨基己糖苷酶(HaHex74),该酶以N-乙酰壳二糖和乳糖作为底物在5 L发酵罐中孵育168 h后获得7.1 g/L LNT Ⅱ。虽然酶催化法转化率高,但酶制剂制备冗长繁琐以及价格昂贵等缺点限制了其工业应用。
近年来,通过构建微生物细胞工厂来生产LNT Ⅱ受到极大关注。DONG等[9]构建了一株用于生产LNT Ⅱ和乳酰-N-新四糖(lacto-N-neotetraose, LNnT)的重组枯草芽孢杆菌,过表达关键前体UDP-GlcNAc和尿苷二磷酸半乳糖代谢途径中的相关基因,并利用木糖诱导的CRISPRi干扰系统调控竞争途径中靶基因沉默,经优化培养条件后,通过3 L发酵罐分批补料发酵的培养方式同时产生LNT Ⅱ和LNnT的效价分别为2.64~2.98 g/L和4.52~5.41 g/L。此外,PRIEM等[10]在Escherichia coli JM109(pCWLgtA)(lacY+ lacZ-)中过表达来源于N.meningitidis的lgtA基因,以甘油替代葡萄糖为碳源生产LNT Ⅱ,最终LNT Ⅱ产量为6 g/L,产率73%。单一细胞工厂生产LNT Ⅱ存在着操作复杂、代谢途径复杂不利于产物合成且产物难以向胞外释放导致反馈抑制等问题。因此,如何优化发酵生产体系组成与工艺以实现LNT Ⅱ的高效合成成为亟需解决的问题。
本研究利用含有来源于Bifidobacterium infantis ATCC 15697的N-乙酰氨基己糖1-位激酶基因(nahK)的重组E.coli JM109(DE3)/pET28a-nahK将GlcNAc和ATP一步转化成N-乙酰氨基葡萄糖-1-磷酸(N-acetylglucosamine-1-phosphate,GlcNAc-1-P)。然后对不同种属来源的3种UDP-HexNAc焦磷酸化酶进行筛选,获得编码最适应本生产体系的UDP-HexNAc焦磷酸化酶基因agx1,并构建含agx1的重组大肠杆菌。接着将自主构建的E.coli JM109(DE3)/pET28a-nahK和E.coli JM109(DE3)/pET28a-agx1耦合发酵,结合辅因子(UTP和ATP)添加策略,实现绿色高效地耦合发酵合成UDP-GlcNAc,最后将UDP-GlcNAc生产体系与含有lgtA基因的重组E.coli JM109(DE3)/pET28a-lgtA耦合,成功建立三菌株耦合发酵合成LNT Ⅱ的生产体系(图1)。

图1 三菌株耦合发酵合成LNT Ⅱ的设计路线
Fig.1 Design route of LNT Ⅱ synthesis by coupling fermentation of three strains
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
实验所需基因来源于婴儿双歧杆菌(B.infantis)、脑膜炎奈瑟菌(N.meningitidis)、人(Homo sapiens)、多杀巴斯德杆菌(Pasteurella multocida)、E.coli JM109(DE3),天根生化科技公司;表达载体pET28a为本实验室保存。
1.1.2 主要试剂与仪器
质粒提取试剂盒、细菌基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒、BCA(二辛可酸)法蛋白质浓度测定试剂盒、卡那霉素、异丙基硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG),上海生工生物工程有限公司;ATP、GlcNAc、GlcNAc-1-P、UDP-GlcNAc、UTP、乳糖,武汉糖智药业有限公司;LNT Ⅱ,中国海洋大学曹鸿志教授馈赠。
C1000 TouchTM PCR仪、Mini PROTEAN Tetra Cell蛋白电泳仪,Bio-Rad公司;LC-2010A高效液相色谱仪,岛津公司;Scientiz超声波细胞粉碎机,宁波新芝生物公司;Multiskan FC酶标仪,Thermo科技公司;Ultrafle Xtreme型基质辅助激光解析电离飞行时间质谱仪,德国Bruker公司。
1.1.3 培养基及培养条件
LB培养基(g/L):胰蛋白胨10,NaCl 10,酵母粉5,pH 7.0。
MRS琼脂平板(g/L):胰蛋白胨10,牛肉膏10,酵母粉5,K2HPO4 2,柠檬酸二铵2,乙酸钠5,葡萄糖20,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,琼脂20,吐温-80 1 mL,pH 6.2。
BYP琼脂平板(g/L):胰蛋白胨10,酵母粉5,葡萄糖3,蔗糖3,NaCl 4,Na2SO3 0.1,L-半胱氨酸盐0.5,琼脂15,pH 7.0。
巧克力色琼脂平板(g/L):胰蛋白胨10,牛肉膏3,NaCl 5,琼脂20,脱纤维羊血50 mL,pH 7.2。
培养条件:B.infantis培养在MRS琼脂平板上,37 ℃培养24 h;P.multocida接到BYP琼脂平板上,25 ℃培养24 h;N.meningitidis培养在巧克力色琼脂平板上,37 ℃、5% CO2培养24 h。重组大肠杆菌培养在LB培养基,抗性筛选抗生素为卡那霉素(质量浓度为20 μg/mL),37 ℃培养24 h。
1.2 实验方法
1.2.1 工程菌E.coli JM109(DE3)/pET28a-nahK的构建
以B.infantis ATCC 15697中nahK基因(GenBank登录号:LR655210.1)序列为模板,设计引物nahKF(5′-ACCCCATATGAACAACACCAATGAAGCC-CTG-3′,下划线部分为Nde I酶切位点)和nahKR(5′-TGACCTCGAGTCTTGGTCGTCTCCATGACGTCG-3′,下划线部分为Xho I酶切位点),将得到的PCR产物纯化回收后,用Nde I和Xho I对PCR产物和pET28a空质粒载体消化后连接,连接产物转化到E.coli JM109(DE3)。取适量转化液涂布在含卡那霉素的选择培养基平板上,37 ℃过夜培养,菌落PCR正确后挑取单菌落摇瓶培养、提取重组质粒pET28a-nahK并酶切验证,将重组质粒pET28a-nahK进行送样测序鉴定。
1.2.2 重组E.coli JM109(DE3)/pET28a-agx1,agx2,pmglmU的构建
以分别来源于H.sapiens的agx1基因(Gene ID:6675)与agx2基因(GenBank登录号:AAH09377.1)、P.multocida来源的pmglmU基因(GenBank登录号:LR134514.1)序列为模板,设计相应引物(表1)进行PCR,将纯化后的PCR产物与pET28a空质粒载体用限制性内切酶消化后连接,将连接产物转化E.coli JM109(DE3)。
表1 用于克隆和表达的引物序列
Table 1 Primer sequences for cloning and expression
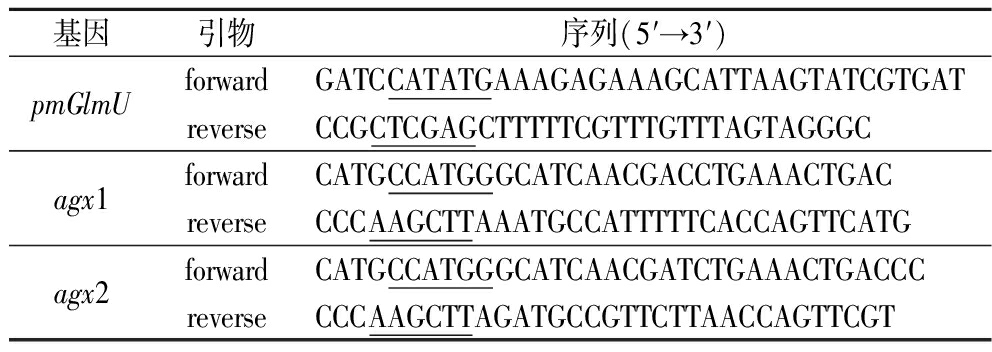
基因引物序列(5′→3′)pmGlmUforwardGATCCATATGAAAGAGAAAGCATTAAGTATCGTGATreverseCCGCTCGAGCTTTTTCGTTTGTTTAGTAGGGCagx1forwardCATGCCATGGGCATCAACGACCTGAAACTGACreverseCCCAAGCTTAAATGCCATTTTTCACCAGTTCATGagx2forwardCATGCCATGGGCATCAACGATCTGAAACTGACCCreverseCCCAAGCTTAGATGCCGTTCTTAACCAGTTCGT
1.2.3 工程菌E.coli JM109(DE3)/pET28a-lgtA的构建
以N.meningitidis中lgtA基因(GenBank登录号:AAC44084.1)序列为模板,设计引物lgtAF(5′-CATG-CCATGGCATCGGAAGCGTTTCGCCGTCAT-3′,下划线为Nco I酶切位点)和lgtAR(5′-GGAATTCCATATG-TTAGCGATTCTTTAATAAGCGATGCAA-3′,下划线为Nde I酶切位点)。PCR产物纯化回收后,用Nco I和Nde I对PCR产物和pET28a空质粒消化后连接,将连接产物转化E.coli JM109(DE3)。
1.2.4 重组蛋白的表达与鉴定
将工程菌株接种至含卡那霉素的10 mL LB液体培养基中,37 ℃、200 r/min摇瓶培养12 h,再按2%的接种量转接到含卡那霉素的200 mL LB液体培养基中继续培养至OD600值约0.7,加入终浓度为0.2 mmol/L的IPTG进行诱导,16 ℃,200 r/min摇瓶诱导20 h,4 ℃、12 000 r/min离心10 min收集菌体。用Tris-HCl缓冲液(pH 7.2)重悬,超声破碎细胞后,4 ℃、8 000 r/min离心20 min,该上清液即为粗酶液。通过12% SDS-PAGE检测目的蛋白的表达。
1.2.5 蛋白质质量浓度的测定
使用BCA法蛋白质浓度测定试剂盒,在96孔板中测定蛋白质浓度,并以牛血清白蛋白作为标准蛋白质,使用酶标仪在562 nm处测量其吸光度。
1.2.6 LNT Ⅱ及其中间产物的合成
1.2.6.1 GlcNAc-1-P的生成
单菌合成GlcNAc-1-P转化条件:2 mL体系中包含60 mmol/L GlcNAc、20 mmol/L ATP、100 mmol/L Tris、10 mmol/L MgCl2、10 mL/L甘油、4 g/L十八胺聚氧乙烯醚、4 g/L乙醇、50 g/L E.coli JM109(DE3)/pET28a-nahK,37 ℃,200 r/min,催化16 h。
1.2.6.2 UDP-GlcNAc的生成
AGX1/AGX2/PmGlmU粗酶液催化合成UDP-GlcNAc的条件:1 mL反应体系含100 mmol/L Tris-HCl(pH 8.5),30 mmol/L GlcNAc-1-P,30 mmol/L UTP,10 mmol/L MgCl2,4 mmol/L DTT,分别补加AGX1/AGX2/PmGlmU粗酶液(按照1.2.4节的方法制成粗酶液)到3个反应体系中,使酶的质量浓度达到1.5 mg/mL。37 ℃水浴20 h,12 000 r/min离心5 min收集上清液。
双菌耦合合成UDP-GlcNAc的转化条件:2 mL体系中包含50 mmol/L UTP、50 mmol/L ATP、100 mmol/L GlcNAc、100 mmol/L Tris、30 mmol/L MgCl2、10 mL/L甘油、4 g/L十八胺聚氧乙烯醚、4 g/L乙醇、50 g/L E.coli JM109(DE3)/pET28a-nahK、50 g/L E.coli JM109(DE3)/pET28a-agx1,37 ℃,200 r/min,催化20 h。
1.2.6.3 LNT Ⅱ的生成
单菌合成LNT Ⅱ的条件:2 mL体系中包含1 mL按照1.2.6.2节的方法合成的含UDP-GlcNAc溶液、60 mmol/L乳糖、100 mmol/L Tris、10 mmol/L MgCl2、10 mL/L甘油、4 g/L十八胺聚氧乙烯醚、4 g/L乙醇和50 g/L E.coli JM109(DE3)/pET28a-lgtA,30 ℃,200 r/min,24 h。
双菌耦合合成LNT Ⅱ的条件:2 mL体系包含1 mL按照1.2.6.1节的方法合成的含GlcNAc-1-P溶液、60 mmol/L乳糖、60 mmol/L UTP、10 mmol/L MgCl2、10 mL/L甘油、4 g/L十八胺聚氧乙烯醚、4 g/L乙醇、50 g/L E.coli JM109(DE3)/pET28a-agx1和50 g/L E.coli JM109(DE3)/pET28a-lgtA,30 ℃,200 r/min,24 h。
三菌耦合合成LNT Ⅱ的条件:2 mL体系中包含100 mmol/L GlcNAc、50 mmol/L ATP、60 mmol/L UTP、60 mmol/L乳糖、100 mmol/L Tris、10 mmol/L MgCl2、10 mL/L甘油、4 g/L十八胺聚氧乙烯醚、4 g/L乙醇、50 g/L E.coli JM109(DE3)/pET28a-nahK、50 g/L E.coli JM109(DE3)/pET28a-agx1、50 g/L E.coli JM109(DE3)/pET28a-lgtA,30 ℃,200 r/min,24 h。
1.2.7 LNT Ⅱ及其中间产物的分析检测
1.2.7.1 GlcNAc-1-P的分析检测
薄层层析(thin layer chromatography, TLC)检测:参考COYNE等[11]的方法。展开剂:V(正丁醇)∶V(乙酸)∶V(水)=2∶1∶1;显色剂为对茴香醛染色液。
HPLC检测:Bio-Rad Aminex HPX-87H柱(300 mm×7.8 mm)有机酸离子层析柱;流动相5 mmol/L H2SO4;流速0.6 mL/min;柱温60 ℃;进样量10 μL;紫外检测波长210 nm[12]。
1.2.7.2 UDP-GlcNAc的分析检测
TLC检测:与1.2.7.1节的方法相同,使用紫外分析仪照射显色。
HPLC检测:汉邦Lichrospher-5-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇-6‰(体积分数)磷酸水溶液(用三乙胺调节至pH 6.6),体积比为3∶97,流速0.6 mL/min;检测波长261 nm;柱温30 ℃;进样量10 μL[13]。
1.2.7.3 LNT Ⅱ的分析检测
TLC检测:与1.2.7.1节的方法相同。
HPLC检测:与1.2.7.1节的方法相同,示差检测器检测。
1.2.7.4 LNT Ⅱ的分离与鉴定
发酵液用HyperSep Hypercarb固相萃取小柱进行分离。收集的洗脱液用基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry, MALDI-TOF MS)在正离子模式下对产物的质荷比进行分析[14]。
2 结果与分析
2.1 单菌合成GlcNAc-1-P及合成体系优化
2.1.1 重组E.coli JM109(DE3)/pET28a-nahK的构建及NahK的表达
将构建的重组质粒pET28a-nahK双酶切验证(图2-a)。送样测序验证正确后,pET28a-nahK转化E.coli JM109(DE3)中。诱导表达结束后其SDS-PAGE结果如图2-b所示,与对照组相比,诱导组在35~45 kDa有明显的条带,其分子质量与LI等[15]的报道一致,说明nahK基因在重组菌株中成功表达。
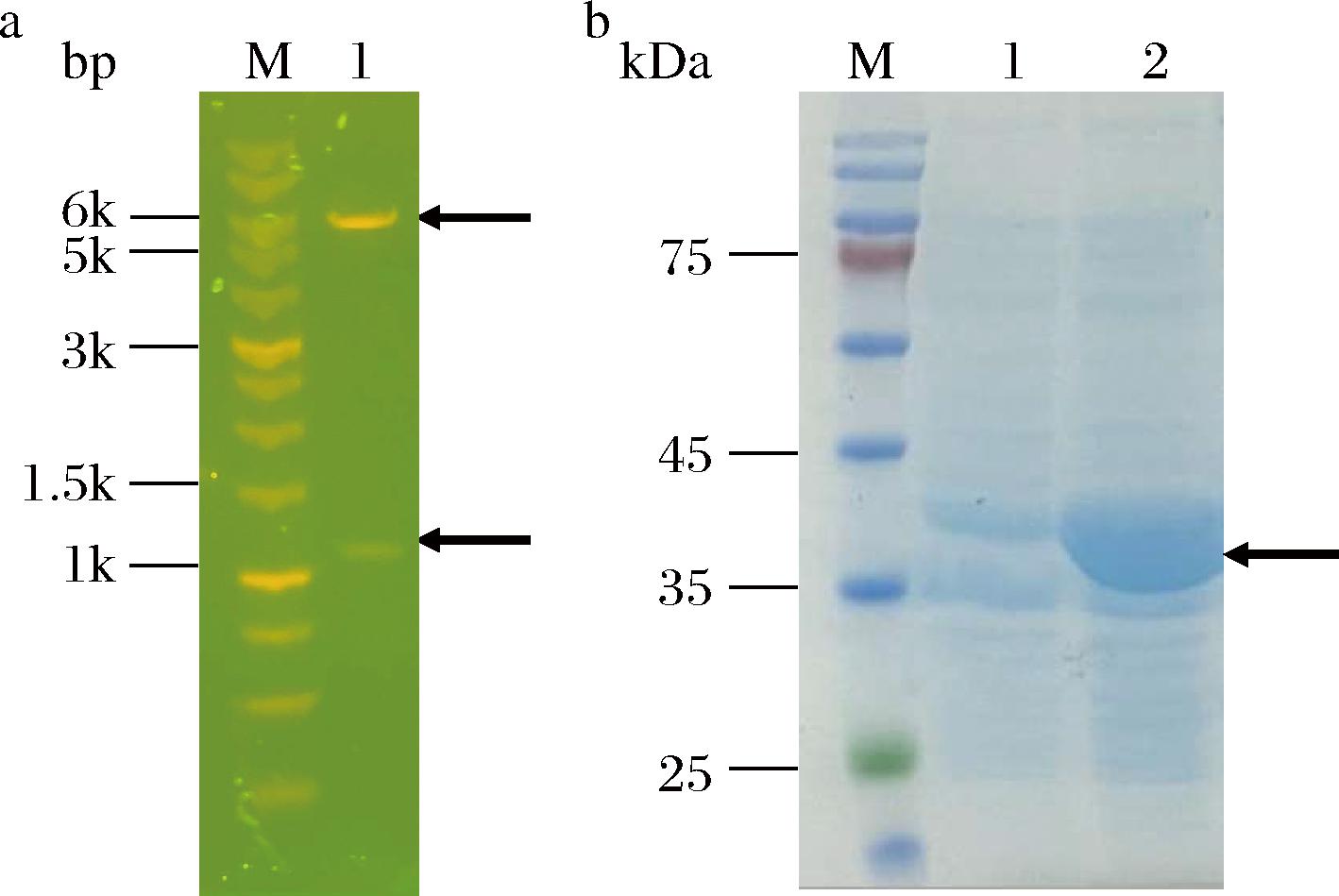
a-重组质粒pET28a-nahK双酶切图(M-DL 10 000 DNA Marker;1-Nde I/Xho I双酶切);b-重组酶NahK的SDS-PAGE图(M-Marker;1-诱导前全细胞;2-诱导20 h的全细胞)
图2 酶切产物电泳检测和重组酶NahK的SDS-PAGE分析
Fig.2 Electrophoresis detection of enzyme-digested product and SDS-PAGE analysis of recombinant enzyme NahK
2.1.2 单菌合成GlcNAc-1-P体系的建立
重组E.coli JM109(DE3)/pET28a-nahK以GlcNAc和ATP为底物全细胞合成G1cNAc-1-P和ADP,用TLC分析催化液(图3-a),结果表明催化液中生成的新化合物(L5)Rf值与标准品GlcNAc-1-P相同。为进一步确定产物,利用HPLC检测催化液,存在与标准品GlcNAc-1-P保留时间相同的化合物(图3-d),结果表明E.coli JM109(DE3)/pET28a-nahK能以GlcNAc和ATP为底物合成G1cNAc-1-P。
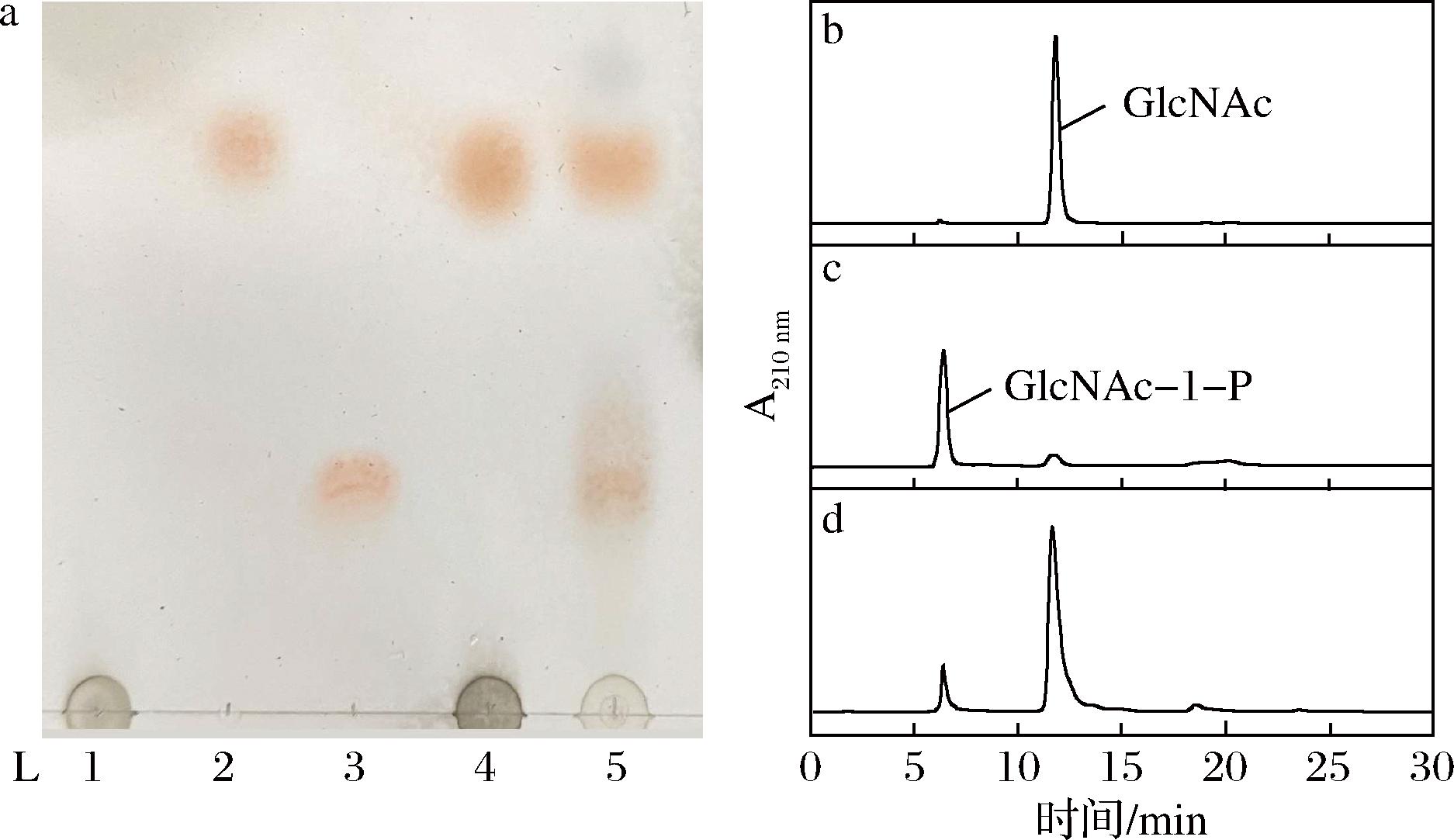
a-TLC图(L1-ATP;L2-GlcNAc;L3-GlcNAc-1-P;L4-空白对照;L5-单菌合成GlcNAc-1-P产物);b-GlcNAc HPLC图;c-GlcNAc-1-P HPLC图;d-单菌合成GlcNAc-1-P产物HPLC图
图3 E.coli JM109(DE3)/pET28a-nahK合成GlcNAc-1-P的TLC、HPLC检测
Fig.3 TLC and HPLC detection of GlcNAc-1-P synthesized by E.coli JM109(DE3)/pET28a-nahK
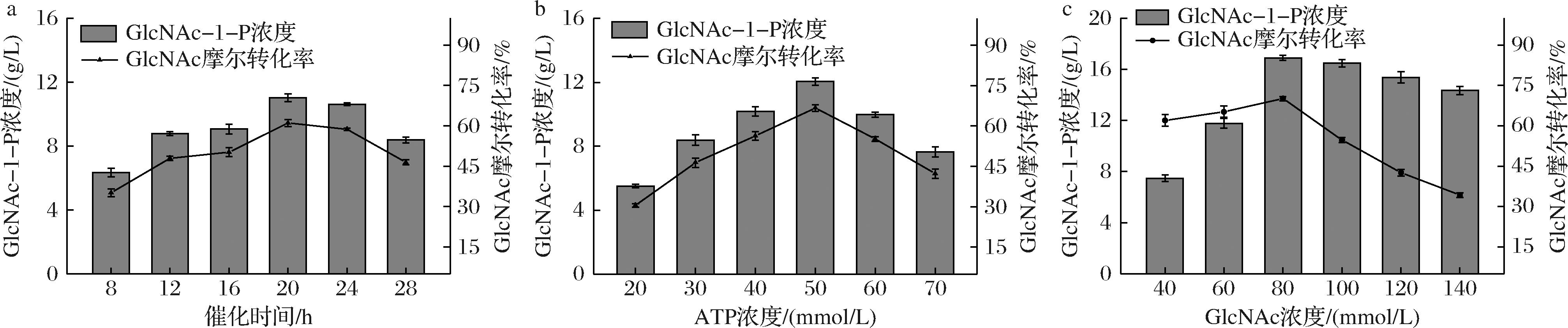
a-催化时间;b-ATP浓度;c-GlcNAc浓度
图4 不同因素对E.coli JM109 (DE3)/pET28a-nahK合成GlcNAc-1-P的影响
Fig.4 Effects of different factors on the synthesis of GlcNAc-1-P by E.coli JM109 (DE3)/pET28a-nahK
2.1.3 单菌合成GlcNAc-1-P体系优化
为提高E.coli JM109(DE3)/pET28a-nahK合成GlcNAc-1-P的产量,主要对催化时间、ATP浓度、GlcNAc浓度这3个因素进行单因素催化条件优化,结果如图4所示。随着时间增加GlcNAc-1-P的产量也随之增加,直至20 h达到最大值(图4-a)。在此条件下,继续对ATP添加量进行优化(图4-b),当发酵液中ATP终浓度<50 mmol/L时,GlcNAc-1-P的产量逐渐上升,在50 mmol/L达到最高值为12.04 g/L,但随着ATP浓度持续增加,GlcNAc-1-P的产量减少,原因可能是高浓度ATP对NahK的酶活性有一定抑制作用,故选取50 mmol/L ATP较益。接着探究了不同GlcNAc浓度对GlcNAc-1-P合成的影响,结果如图4-c所示,GlcNAc-1-P的产量随着GlcNAc浓度增加而增加,在80 mmol/L达到最高值为16.88 g/L,此时对GlcNAc摩尔转化率为70.05%,因此,选择80 mmol/L GlcNAc较好。
2.2 双菌耦合合成UDP-GlcNAc及合成体系优化
2.2.1 重组E.coli JM109(DE3)/pET28a-agx1、agx2、pmglmU的构建及表达
分别将质粒上携带不同种属来源的编码UDP-HexNAc焦磷酸化酶基因的3株重组大肠杆菌进行诱导表达,SDS-PAGE结果如图5所示,分别与其诱导前对比,这3种诱导20 h的全细胞均具有明显的表达条带,其蛋白质分子质量分别与BOURGEAUX等[16]、WANG-GILLAM等[17]、和CHEN等[18]报道的一致,说明这3种编码UDP-HexNAc焦磷酸化酶的基因在重组大肠杆菌中均成功表达。
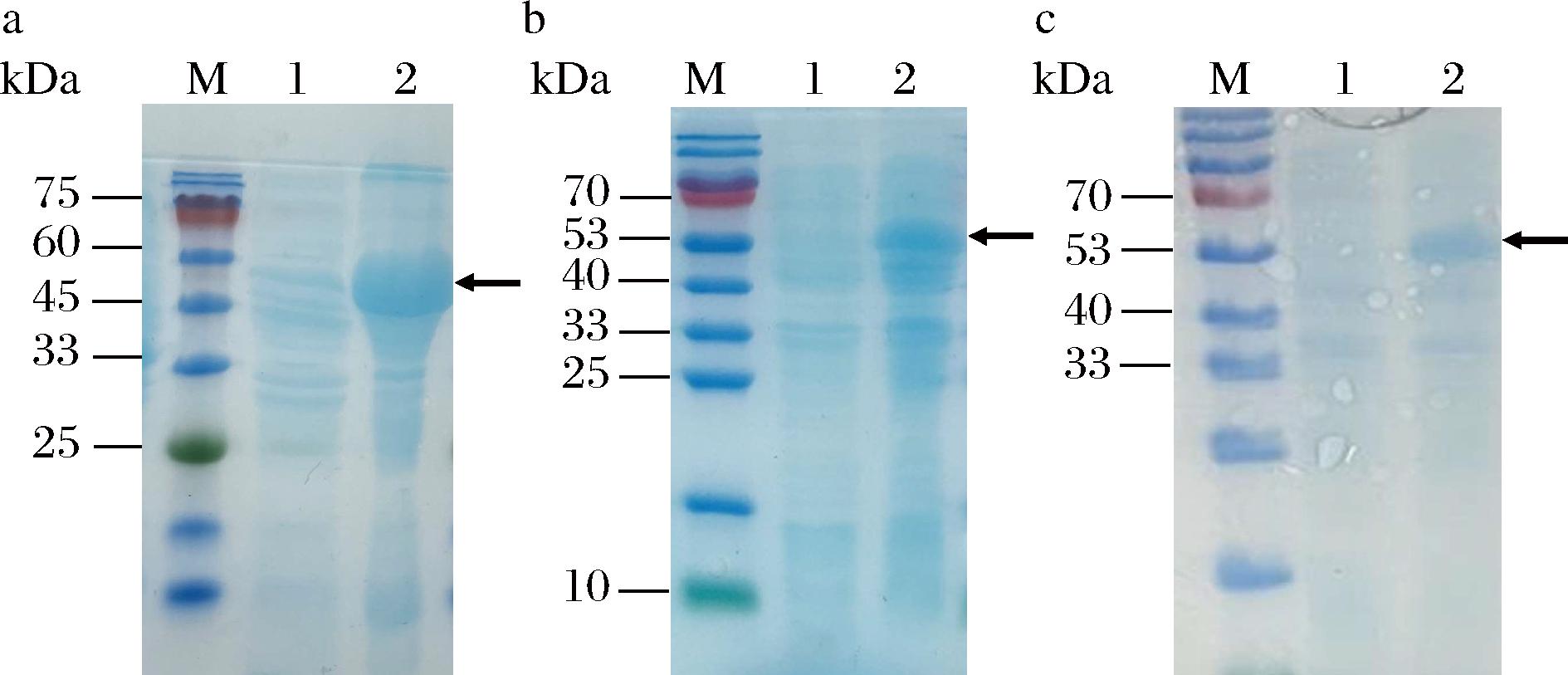
M-Marker;1-诱导前全细胞;2-诱导20 h的全细胞a-重组酶AGX1;b-重组酶AGX2;c-重组酶PmGlmU
图5 重组酶AGX1、AGX2、PmGlmU分别在E.coli JM109(DE3)中表达的SDS-PAGE分析
Fig.5 SDS-PAGE analysis of expression of recombinant enzyme AGX1, AGX2, and PmGlmU in E.coliJM109(DE3) respectively
2.2.2 不同种属来源的UDP-HexNAc焦磷酸化酶催化活性比较为获得最适应本生产体系的UDP-HexNAc焦磷酸化酶,现对研究较多的3种不同种属来源的UDP-HexNAc焦磷酸化酶的催化能力做比较。以GlcNAc-1-P作为受体底物,UTP作为供体底物,使用相同浓度但不同种属来源的UDP-HexNAc焦磷酸化酶液进行催化,催化液用TLC和HPLC进行分析,结果如图6-a所示。发现L5中UDP-GlcNAc含量相对较高,进一步由图6-d的峰面积计算可知,AGX1粗酶催化液中的UDP-GlcNAc含量最高,即AGX1催化合成UDP-GlcNAc的能力最好,重组酶AGX1被证明最适宜于本生产体系。因此,接下来的实验选用E.coli JM109(DE3)/pET28a-agx1为最适合成UDP-GlcNAc的工程菌株。
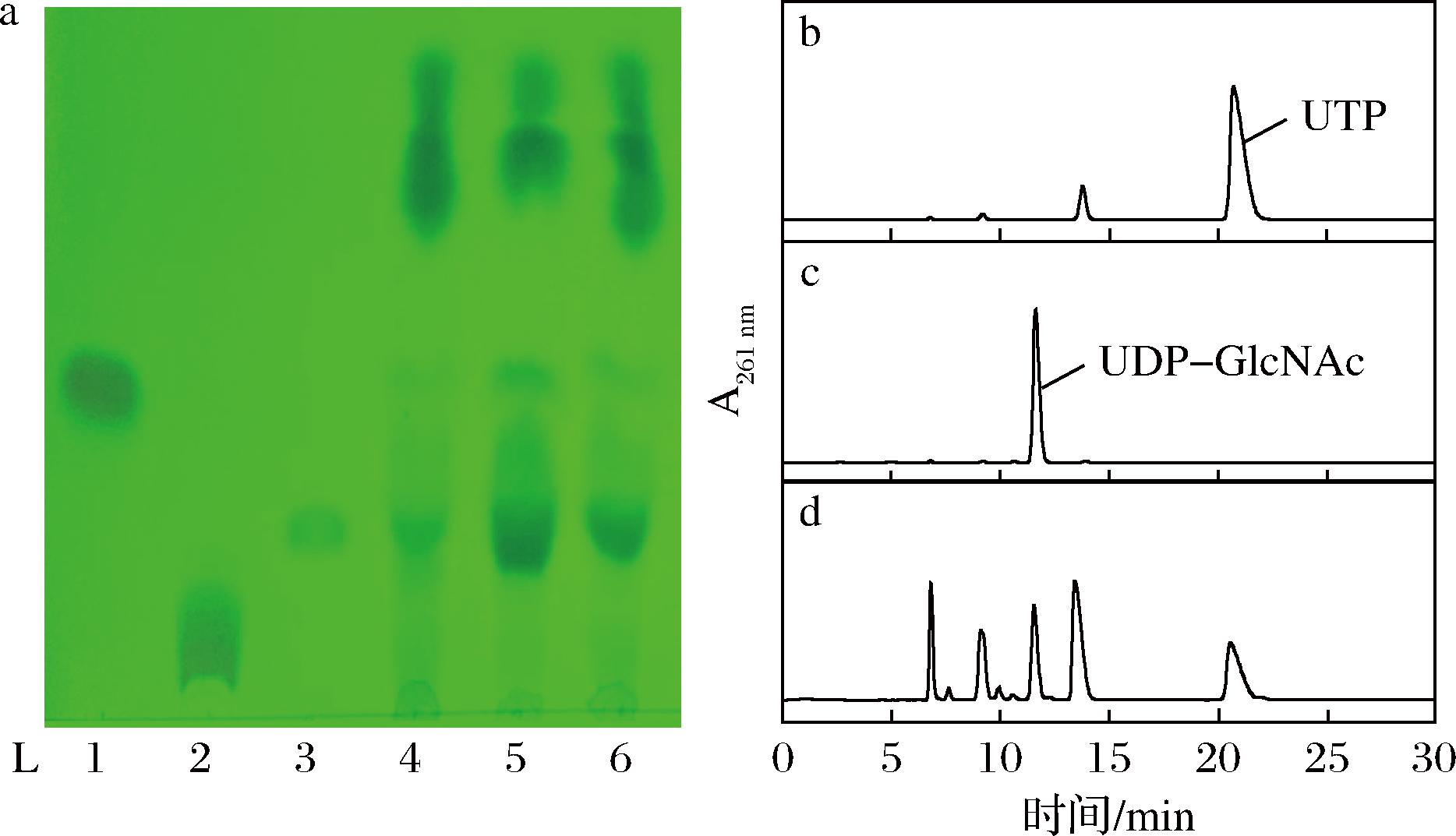
a-TLC图(L1-UDP;L2-UTP;L3-UDP-GlcNAc;L4-PmGlmU粗酶催化产物;L5-AGX1粗酶催化产物;L6-AGX2粗酶催化产物);b-UTP HPLC图;c-UDP-GlcNAc HPLC图;d-AGX1粗酶催化产物HPLC图
图6 UDP-HexNAc焦磷酸化酶催化合成UDP-GlcNAc的
TLC、HPLC检测
Fig.6 TLC and HPLC detection of UDP-HexNAc pyrophosphorylase catalyzed synthesis of UDP-GlcNAc
2.2.3 双菌耦合合成UDP-GlcNAc体系的优化
为顺利实现双菌[E.coli JM109(DE3)/pET28a-nahK和E.coli JM109(DE3)/pET28a-agx1]耦合发酵高效合成UDP-GlcNAc,对耦合发酵条件也进行了研究。以2.1.3节优化的单菌合成GlcNAc-1-P体系为基础,分别探索了2种工程菌的生物量比例和底物UTP浓度对UDP-GlcNAc合成的影响,结果如图7-a所示。当E.coli JM109(DE3)/pET28a-nahK和E.coli JM109(DE3)/pET28a-agx1的生物量比为1∶2时,UDP-GlcNAc的产量最高为16.5 g/L。而当其中一种菌的生物量是另一种菌的3倍(3∶1或1∶3),反应20 h时UDP-GlcNAc的产量最高只有8.98 g/L;这可能是因为体系中菌株质量浓度超过临界浓度时将会对产物合成产生抑制作用。在此优化条件的基础上,仅通过改变UTP浓度来探索最佳UTP浓度,结果由图7-b可知,产物UDP-GlcNAc浓度随着UTP浓度的增加而逐渐增大,在60 mmol/L时达到最大数值为24.78 g/L,对GlcNAc摩尔转化率为51.03%。因此,60 mmol/L为最佳添加浓度。
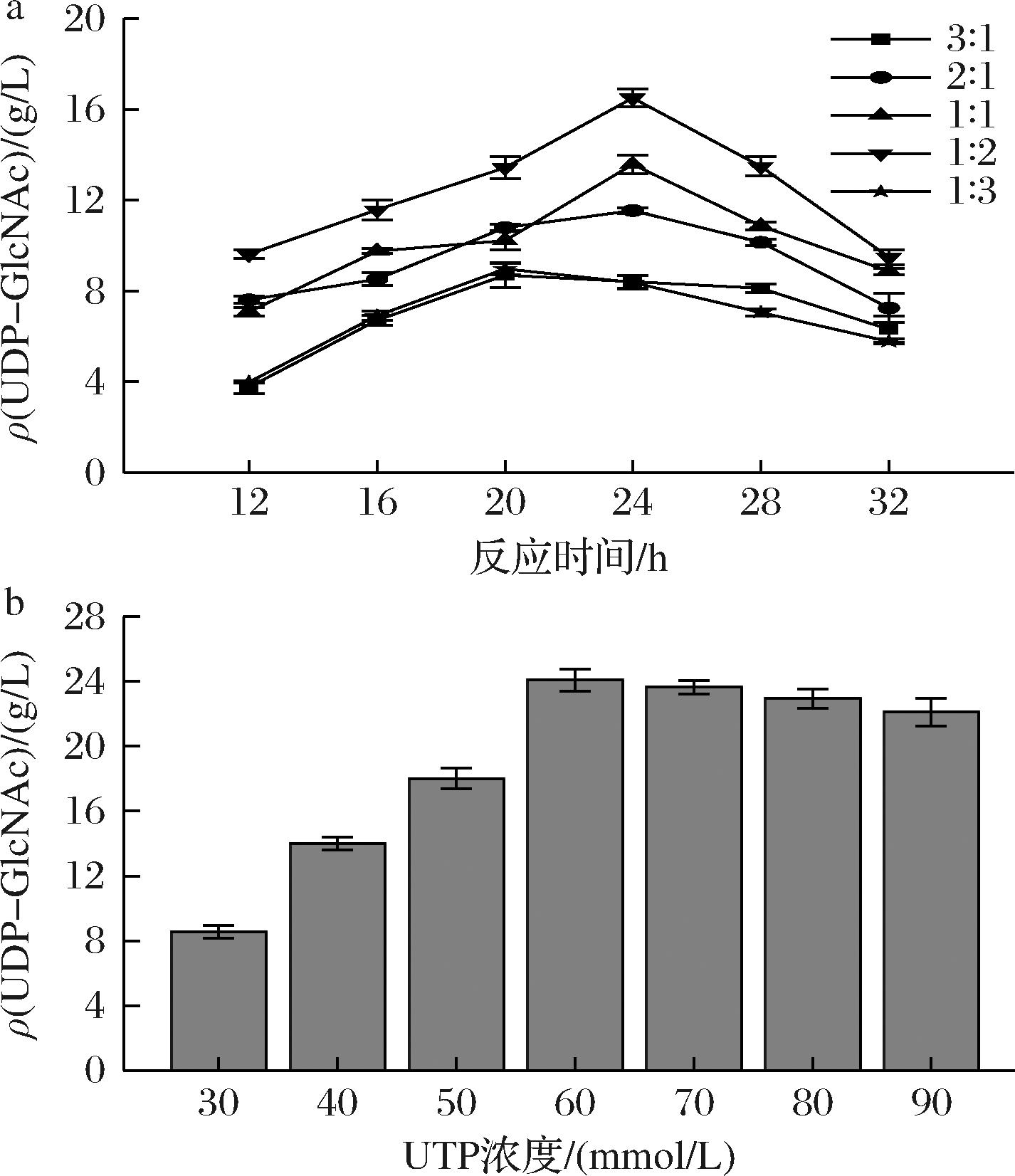
a-生物量比例;b-UTP浓度
图7 不同因素对E.coli JM109(DE3)/pET28a-nahK和E.coli JM109(DE3)/pET28a-agx1双菌耦合合成UDP-GlcNAc的影响
Fig.7 Effects of different factors on the synthesis of UDP-GlcNAc by coupling of E.coli JM109 (DE3)/pET28a-nahK and E.coli JM109 (DE3)/pET28a-agx1
2.3 三菌株耦合发酵合成LNT Ⅱ及合成体系优化
2.3.1 重组E.coli JM109(DE3)/pET28a-lgtA的构建及LgtA的表达
将自主构建的重组质粒pET28a-lgtA双酶切验证(图8-a)。送样测序验证正确后,将重组质粒pET28a-lgtA转化到E.coli JM109(DE3)中。低温诱导表达结束后其SDS-PAGE结果如图8-b所示。与对照组相比,诱导组在35~45 kDa有明显的表达条带,分子质量与BLIXT等[7]报道的一致,表明lgtA基因在重组菌株中成功表达。
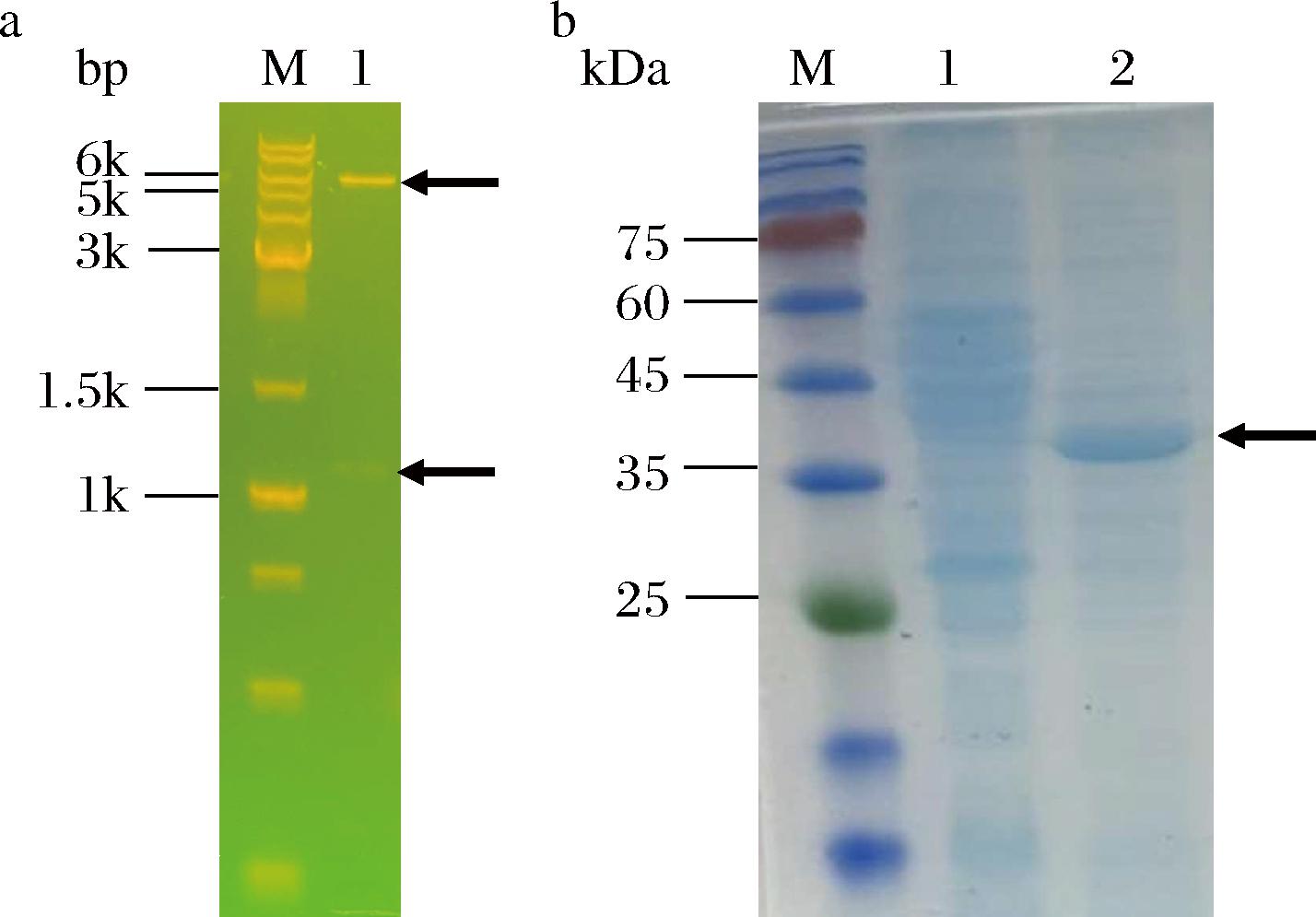
a-重组质粒pET28a-lgtA双酶切图(M-DL 10 000 DNA Marker;1-Nco I/Nde I双酶切);b-重组酶lgtA SDS-PAGE图(M-Marker;1-诱导前全细胞;2-诱导20 h的全细胞)
图8 酶切产物电泳检测和重组酶LgtA的SDS-PAGE分析
Fig.8 Electrophoresis detection of enzyme-digested product and SDS-PAGE analysis of recombinant enzyme LgtA
2.3.2 三菌株耦合发酵合成LNT Ⅱ体系的建立
为确保顺利建立三菌株耦合发酵合成LNT Ⅱ体系,目前采用“单菌合成LNT Ⅱ—双菌耦合合成LNT Ⅱ—三菌耦合发酵合成LNT Ⅱ”的递进思路进行。分别按照1.2.6.3节方法中单菌合成和双菌耦合合成LNT Ⅱ的条件进行实验,结果如图9-a所示。以UDP-GlcNAc和乳糖为底物,在菌浓度为100 g/L E.coli JM109(DE3)/pET28a-lgtA的条件下,其单细胞发酵液(L4)中存在与标准品LNT Ⅱ Rf值相同的物质,表明利用单菌可以合成LNT Ⅱ;以GlcNAc-1-P、UTP以及乳糖为底物,在菌浓均为100 g/L E.coli JM109(DE3)/pET28a-agx1和E.coli JM109(DE3)/pET28a-lgtA存在的条件下,其双菌耦合发酵液(L5)中具有与LNT Ⅱ Rf值一致的化合物,表明双菌耦合可以成功合成出LNT Ⅱ;接着,开展用廉价的GlcNAc(替代价格昂贵的GlcNAc-1-P/UDP-GlcNAc)作为起始底物,添加辅因子ATP和UTP,在2.2.3节已优化的双菌耦合合成UDP-GlcNAc体系基础上,探索建立三菌耦合发酵合成LNT Ⅱ体系的可行性。
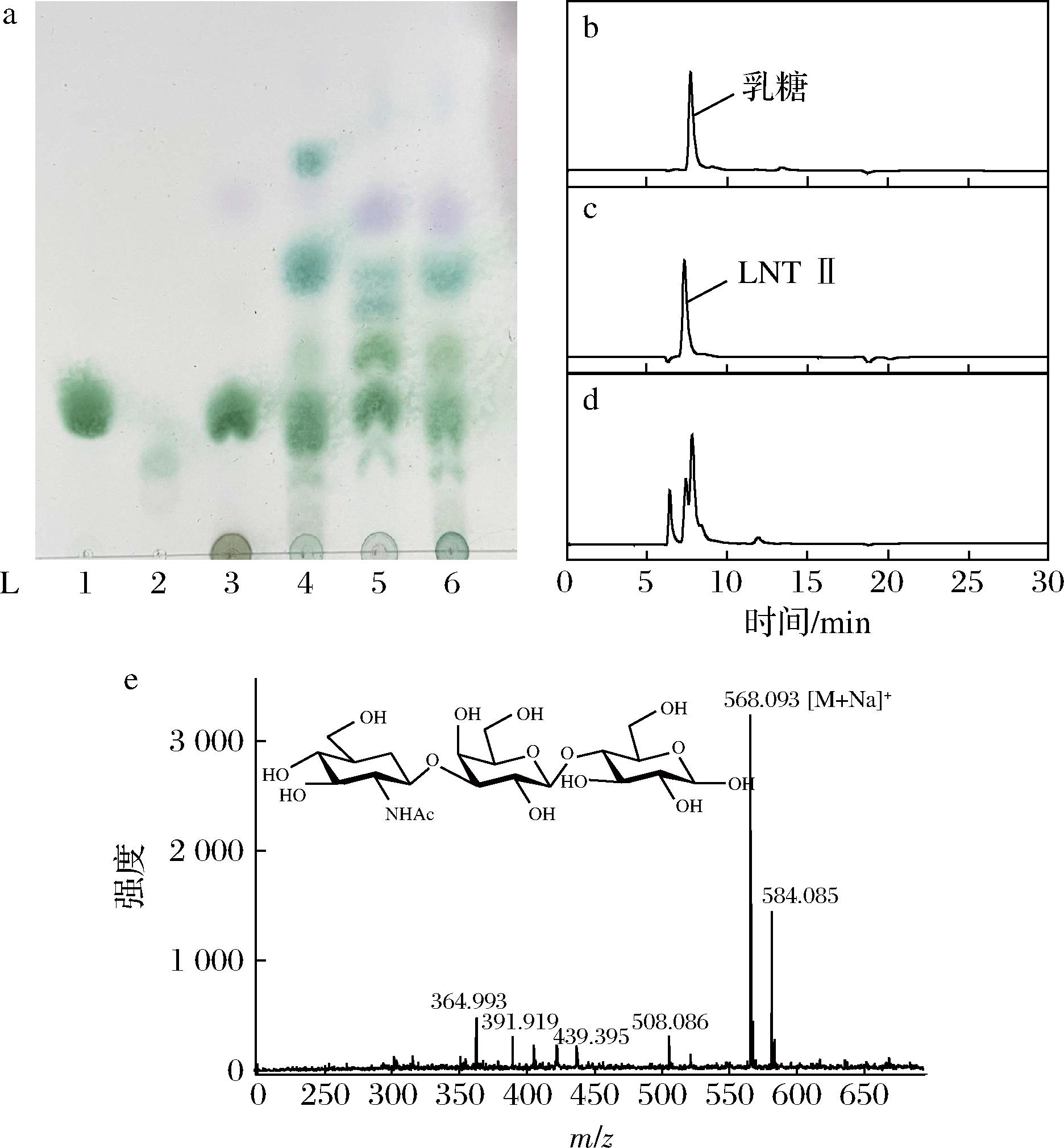
a-TLC图(L1-乳糖;L2-LNT Ⅱ;L3-空白对照;L4-单菌合成产物;L5-双菌耦合合成产物;L6-三菌株耦合发酵产物);b-乳糖HPLC图;c-LNT Ⅱ HPLC图;d-三菌株耦合合成产物HPLC图;e-LNT Ⅱ的MALDI-TOF MS分析
图9 三菌株耦合发酵合成LNT Ⅱ的TLC、HPLC、MALDI-TOF MS分析
Fig.9 TLC, HPLC, and MALDI-TOF MS analysis of LNT Ⅱ synthesized by coupling fermentation of three strains
发酵液(L6)中存在与LNT Ⅱ Rf值一致的化合物。将该发酵液分离纯化后,采用HPLC和MALDI-TOF MS进一步分析检测,发酵液中存在与标准品LNT Ⅱ保留时间相同的峰(图9-d),LNT Ⅱ质量浓度为0.75 g/L,且在质荷比m/z 568.093位置出现目标离子峰(图9-e),即为LNT Ⅱ(Mr 545),表明“三菌株耦合发酵体系”成功实现了LNT Ⅱ的合成。
2.3.3 三菌株耦合发酵合成LNT Ⅱ体系优化
初步的三菌株耦合发酵检测结果发现LNT Ⅱ的产量较低。为进一步提高产量,分别从反应温度、Mg2+浓度、菌株质量浓度和乳糖浓度对LNT Ⅱ生成的影响进行评估。文献报道NahK和AGX1的最适温度均为37 ℃[19],而LgtA的最适温度为20~30 ℃[7],由于最适温度不一致,因此,首先对三菌耦合发酵合成LNT Ⅱ体系的催化温度进行适配筛选。结果如图10-a所示,当催化温度为30 ℃时,LNT Ⅱ的产量最高。在三菌株耦合发酵体系中,NahK与其他激酶类似需要Mg2+来实现其催化活性[20];而二价金属离子对于AGX1发挥其催化活性并不是必须的,但当其存在时会明显使AGX1的催化能力增强,其中作用最明显的是Mg2+[19]。LgtA对二价金属离子有绝对要求,其中Mg2+是较为有效的激活剂[7]。因此,继续探究了MgCl2浓度对三菌耦合发酵合成LNT Ⅱ的影响,结果如图10-b所示,当20 mmol/L MgCl2时,LNT Ⅱ的浓度最高。接下来,探索E.coli JM109(DE3)/pET28a-lgtA菌体浓度对LNT Ⅱ合成的影响,结果如图10-c所示。菌株质量浓度为100 g/L时,催化28 h时的效果最突出,达到1.91 g/L LNT Ⅱ。在GlcNAc、ATP、UTP、MgCl2浓度分别为80、50、60、20 mmol/L以及菌浓为50 g/L E.coli JM109(DE3)/pET28a-nahK、100 g/L E.coli JM109(DE3)/pET28a-agx1和100 g/L E.coli JM109(DE3)/pET28a-lgtA,30 ℃发酵28 h的条件下,仅将乳糖浓度设置为40、60、80、100、120、140 mmol/L,考察乳糖浓度对三菌耦合发酵合成LNT Ⅱ的影响,结果如图10-d所示。在乳糖浓度≤80 mmol/L的条件下,LNT Ⅱ浓度随着乳糖浓度增加而增加,最大值达3.03 g/L,故选择80 mmol/L LNT Ⅱ为三菌耦合发酵体系的较佳浓度。但同时可以观察到发酵液中大部分乳糖未被利用,因此,下一步需要考虑如何提高LNT Ⅱ转化率以及进一步降低成本的问题。
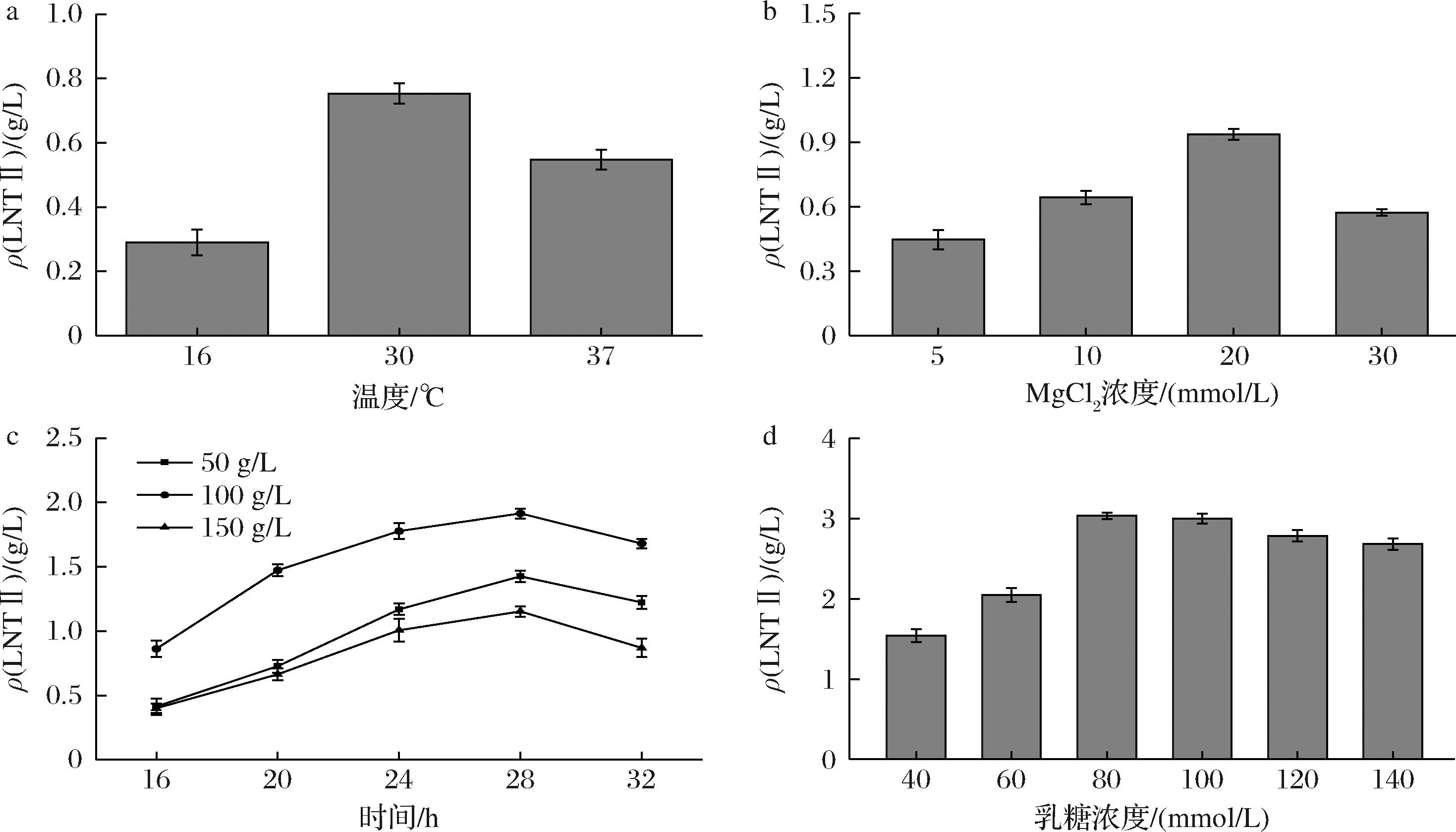
a-温度;b-MgCl2浓度;c-菌株质量浓度;d-乳糖浓度
图10 不同因素对三菌耦合发酵合成LNT Ⅱ的影响
Fig.10 Effects of different factors on the synthesis of LNT Ⅱ by coupling fermentation of three strains
3 结论
LNT Ⅱ是HMOs合成中的重要前体物质。据报道,LNT Ⅱ对巨噬细胞TLR可诱导细胞因子IL-10和TNF-α产生,显示出LNT Ⅱ作为HMOs中的成分在功能食品配料中应用的巨大潜在性。目前LNT Ⅱ的酶法合成已经实现了公斤级的生产,但生产成本相对较高。本研究通过自主构建的3株工程菌E.coli JM109(DE3)/pET 28a-nahK、E.coli JM109(DE3)/pET28a-agx1及E.coli JM109(DE3)/pET28a-lgtA耦合发酵,成功将廉价易得的底物GlcNAc和乳糖转化为具有高附加值的LNT Ⅱ。通过对合成体系进行层层递进式的优化,最终获得LNT Ⅱ的最大产量为3.03 g/L,相较优化前提高了接近4倍。
经发酵条件优化后,在耦合发酵体系中GlcNAc-1-P和UDP-GlcNAc的产量最高分别为16.88 g/L和24.78 g/L,但LNT Ⅱ的最大产量为3.03 g/L,这主要是LgtA酶的催化活性较低造成,因此,下一步将聚焦高活性LgtA酶的筛选。此外,已有报道发现内源性大肠杆菌转运基因(setA、setB、ydeA和mdfA)能显著提高细胞内小分子物质的细胞外排,后续将引入大肠杆菌转运基因到LNT Ⅱ合成细胞,用于加速合成LNT Ⅱ的外排,以此提高发酵液中LNT Ⅱ的浓度。考虑到需要添加价格昂贵的辅因子ATP和UTP,未来可以将本课题组筛选的ATP和UTP原位再生酵母系统加入到本体系中,以提高LNT Ⅱ的转化率和进一步降低成本。本研究通过建立“三菌株耦合发酵合成LNT Ⅱ体系”用于实现LNT Ⅱ的大规模合成,该系统具有成本低廉以及可以实现对每个步骤酶进行实时可调等优点,“耦合发酵策略”将为LNT Ⅱ的规模化、经济化合成提供新思路。
[1] BODE L.Human milk oligosaccharides:Prebiotics and beyond[J].Nutrition Reviews, 2009, 67(suppl.2):S183-S191.
[2] BODE L.Human milk oligosaccharides:Every baby needs a sugar Mama[J].Glycobiology, 2012, 22(9):1147-1162.
[3] CHENG L H, KIEWIET M B G, GROENEVELD A, et al.Human milk oligosaccharides and its acid hydrolysate LNT2 show immunomodulatory effects via TLRs in a dose and structure-dependent way[J].Journal of Functional Foods, 2019, 59:174-184.
[4] CHENG L H, KONG C L, WANG W J, et al.The human milk oligosaccharides 3-FL, lacto-N-neotetraose, and LDFT attenuate tumor necrosis factor-α induced inflammation in fetal intestinal epithelial cells in vitro through shedding or interacting with tumor necrosis factor receptor 1[J].Molecular Nutrition &Food Research, 2021, 65(7):e2000425.
[5] 尹晓娟. 化学酶法合成LNT系列人乳寡糖[D].济南:山东大学, 2012.YIN X J.Chemoenzymatic synthesis LNT series HMOs[D].Jinan:Shandong University, 2012.
[6] BANDARA M D, STINE K J, DEMCHENKO A V.The chemical synthesis of human milk oligosaccharides:Lacto-N-neotetraose (Galβ1→4GlcNAcβ1→3Galβ1→4Glc)[J].Carbohydrate Research, 2019, 483:107743.
[7] BLIXT O, VAN DIE I, NORBERG T, et al.High-level expression of the Neisseria meningitidis lgtA gene in Escherichia coli and characterization of the encoded N-acetylglucosaminyltransferase as a useful catalyst in the synthesis of GlcNAc β 1:→3Gal and GalNAc β 1:→3Gal linkages[J].Glycobiology, 1999, 9(10):1061-1071.
[8] LI Y H, XUE M Y, SHENG X, et al.Donor substrate promiscuity of bacterial β1-3-N-acetylglucosaminyltransferases and acceptor substrate flexibility of β1-4-galactosyltransferases[J].Bioorganic &Medicinal Chemistry, 2016, 24(8):1696-1705.
[9] DONG X M, LI N, LIU Z M, et al.CRISPRi-guided multiplexed fine-tuning of metabolic flux for enhanced lacto-N-neotetraose production in Bacillus subtilis[J].Journal of Agricultural and Food Chemistry, 2020, 68(8):2477-2484.[10] PRIEM B, GILBERT M, WAKARCHUK W W, et al.A new fermentation process allows large-scale production of human milk oligosaccharides by metabolically engineered bacteria[J].Glycobiology, 2002, 12(4):235-240.
[11] COYNE M J, REINAP B, LEE M M, et al.Human symbionts use a host-like pathway for surface fucosylation[J].Science, 2005, 307(5716):1778-1781.
[12] LEE Y C, CHIEN H C R, HSU W H.Production of N-acetyl-D-neuraminic acid by recombinant whole cells expressing Anabaena sp.CH1 N-acetyl-D-glucosamine 2-epimerase and Escherichia coli N-acetyl-D-neuraminic acid lyase[J].Journal of Biotechnology, 2007, 129(3):453-460.
[13] 曹海萍. 酿酒酵母全细胞催化合成尿苷二磷酸-N-乙酰葡糖胺的机理研究[D].南京:南京工业大学, 2008.CAO H P.Study on the mechanism of synthesis of uridine diphosphate-N-acetylglucosamine catalyzed by Saccharomyces cerevisiae[D].Nanjing:Nanjing University of Technology, 2008.
[14] LIU Y H, MA J W, SHI R, et al.Biochemical characterization of a β-N-acetylhexosaminidase from Catenibacterium mitsuokai suitable for the synthesis of lacto-N-triose Ⅱ[J].Process Biochemistry, 2021, 102:360-368.
[15] LI Y H, YU H, CHEN Y, et al.Substrate promiscuity of N-acetylhexosamine 1-kinases[J].Molecules, 2011, 16(8):6396-6407.
[16] BOURGEAUX V, PILLER F, PILLER V.Two-step enzymatic synthesis of UDP-N-acetylgalactosamine[J].Bioorganic &Medicinal Chemistry Letters, 2005, 15(24):5459-5462.
[17] WANG-GILLAM A, PASTUSZAK I, ELBEIN A D.A 17-amino acid insert changes UDP-N-acetylgalactosamine pyrophosphory lase specificity from UDP-GalNAc to UDP-GlcNAc[J].Journal of Biological Chemistry, 1998, 273(42):27055-27057.
[18] CHEN Y, THON V, LI Y H, et al.One-pot three-enzyme synthesis of UDP-GlcNAc derivatives[J].Chemical Communications, 2011, 47(38):10815-10817.
[19] 薛梦阳. 氨基糖核苷酸的酶法合成研究及其在糖缀合物制备中的应用[D].济南:山东大学, 2014.XUE M Y.Study of enzymatic synthesis of amino sugar nucleotides and their applications in preparation of glycoconjugates[D].Jinan:Shandong University, 2014.
[20] NISHIMOTO M, KITAOKA M.Identification of N-acetylhexosamine 1-kinase in the complete lacto-N-biose I/galacto-N-biose metabolic pathway in Bifidobacterium longum[J].Applied and Environmental Microbiology, 2007, 73(20):6444-6449.