随着生活水平的不断提高,人们对医学美容的需求也越来越高。目前,人们正在寻求天然抗氧化产品,以延缓衰老。卷丹百合富含多种生物活性物质,包括黄酮类、萜类、生物碱和挥发油等。其中,黄酮类化合物是人们日常饮食中最为常见的酮类活性物质之一。这些黄酮类化合物具有良好的抗氧化和抗衰老功效,能够有效地保护人体各个器官和组织免受氧化的损害,因此被认为是一种天然的抗氧化剂。
卷丹百合是一种极具药用价值的植物,在我国种质资源极其丰富,卷丹百合繁殖快,综合抗性强,是理想的药食兼用百合种质资源。卷丹百合整个植株都含有活性成分,且黄酮的含量最高[1]。研究表明卷丹花、鳞茎等器官营养丰富,富含多种矿质元素、氨基酸等,具有养阴润肺,清心安神的功效,能治疗阴虚燥咳、失眠心悸及心肺阴虚内热等[2-5]。黄酮类化合物、酚类化合物、多糖和皂甙是卷丹鳞茎中的主要活性成分,具有独特的化学性质和生物活性,如抗肿瘤[6]、抗氧化[7]、降血糖[8]、消炎[9]等作用,是决定百合食用品质和药用价值的重要功能物质,具有广阔的应用前景。何纯莲等[10]研究认为,百合提取物对羟自由基有较好的清除效果。雷卢恒等[11]通过对卷丹百合鳞茎中的活性成分和抗氧化能力研究发现,黄酮类化合物是主要的活性成分。张希平[12]采用比色法、凯氏定氮法及原子吸收法等对其鳞茎的多酚类物质含量、抗氧化活性进行测定分析,发现百合总多酚、总黄酮和总花色苷含量和DPPH清除力呈显著正相关。同时,国外关于百合属植物中黄酮类化合物的抗氧化性研究较少[13],大多数都是对卷丹百合中的多酚和多糖进行研究。因此本研究选取以黄酮类化合物为主要成分的卷丹百合提取物为原料,对其进行抗氧化活性测试。以化学法、秀丽隐杆线虫模型为评价方法,测定自由基清除率,探究低、中、高剂量组卷丹百合提取物对线虫模型的抗氧化影响。以此推动卷丹百合抗氧化性研究,为卷丹百合资源合理有效开发与推广提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
野生型秀丽隐杆线虫株系(N2)、线虫CF1553、线虫LD1171、大肠杆菌E.coli OP50,本课题组线虫室。
卷丹百合提取物,百利鑫种苗有限公司;芦丁标准品,北京索莱宝科技有限公司;福林酚、ABTS试剂(98%),上海麦克林生化科技股份有限公司;DPPH试剂,北京博奥拓达科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、谷胱甘肽(glutathione,GSH)测定试剂盒,南京建成生物科技有限公司;BCA蛋白浓度测定试剂盒,北京鼎国昌盛生物技术有限责任公司。
1.2 仪器与设备
TU-190紫外分光光度计,北京普析通用仪器有限责任公司;SW-CJ-3F超净工作台,上海沪静医疗器械有限公司;XFH-50CA全自动高压灭菌锅,浙江新丰医疗器械有限公司;WL荧光显微镜,微特视界科技(深圳)有限公司;RE20旋转蒸发仪,郑州长城科工贸有限公司;EnSpire酶标仪,美国PerkinElmer公司。
1.3 实验方法
1.3.1 卷丹百合黄酮提取物制备与含量测定
1.3.1.1 卷丹百合提取物活性物质的制备
将400 mL的卷丹百合提取物[料液比为1∶10 (g∶mL)]放在旋转蒸发仪上经37 ℃减压旋转蒸发除去乙醇和水,后经真空冷冻干燥成粉末。准确称取5份5.00 g卷丹百合提取物制成的粉末,按照1∶10、1∶20、1∶30、1∶40、1∶50的料液比分别加入50、100、150、200、250 mL的体积分数70%的乙醇溶液(分析纯),测定该提取物中总黄酮的含量,确定最佳料液比组[14]。
1.3.1.2 卷丹百合提取物活性物质的测定
参照李莲芳等[15]的方法绘制芦丁标准曲线,然后在波长为510 nm下分别测定上述溶液的吸光度值,记录数据、绘制标准曲线。
量取卷丹百合提取物1 mL放入10 mL的离心管中,按照待测液配制方法加入1 mL质量浓度为10 g/L的AlCl3溶液,用体积分数95%的乙醇定容至刻度,放置10 min后进行提取物吸光度值测定。
分别配制葡萄糖标准溶液、没食子酸标准溶液、抗坏血酸标准溶液、L-精氨酸标准溶液,绘制标准曲线。以适当方法处理各料液比梯度样液,采用紫外分光光度法分别测定其吸光度,带入标准曲线并绘制黄酮、多酚、多糖、氨基酸、抗坏血酸物质含量曲线[16]。测定活性物质含量实验均做3次平行实验,结果取平均值。
1.3.2 卷丹百合黄酮提取物化学法抗氧化活性测定
1.3.2.1 DPPH自由基清除能力测定
将卷丹百合黄酮提取物配成不同质量浓度的储备液。将2 mL不同浓度卷丹百合黄酮提取物与2 mL DPPH溶液(1×104 mol/L)混合并在暗处反应30 min,利用空白溶剂作为参照,以抗坏血酸作为阳性对照。在517 nm波长处测定吸光度,并使用3个平行样品。按公式(1)计算DPPH自由基清除率。
DPPH自由基清除率![]()
(1)
式中:A0,2 mL无水乙醇+2 mL DPPH溶液的吸光值;A1,2 mL样品溶液+2 mL DPPH溶液的吸光值;A2,2 mL样品溶液+2 mL无水乙醇的吸光值。
1.3.2.2 ABTS阳离子自由基清除率测定
制备ABTS储备液再配制成ABTS工作液,现配现用,734 nm波长处的吸光度值(记为A1)。将不同浓度的卷丹百合黄酮提取物取2 mL加入试管中,再加2 mL ABTS工作液,振荡混匀10 s后避光反应10 min。使用空白溶剂作为参考,以抗坏血酸作为阳性对照,在405 nm波长处测定每个样品的吸光度值,每个样品进行3次平行实验。采用公式(2)计算ABTS阳离子自由基的清除率[17]。
ABTS阳离子自由基清除率![]()
(2)
式中:B1,2 mL样品溶液+2 mL ABTS工作液的吸光度;B2,2 mL空白溶剂+2 mL ABTS工作液的吸光度。
1.3.3 卷丹百合黄酮提取物对线虫抗氧化能力测定
1.3.3.1 线虫培养
将适量的E.coli OP50细菌悬浮液施加到一个线虫生长培养基(nematode growth medium,NGM)板的中心,放在超净工作台上吹干后放置于温度为37 ℃的培养箱中培养24 h并且倒置。待NGM平板温度降至常温后,用线虫挑针挑取适量的线虫株系接种在该NGM平板上,然后在培养箱中于20 ℃下培养至NGM平板上长满大量线虫后,用酒精灯火焰灼烧金属勺末端,温度降下来后切割有线虫的培养基,将其接在新的NGM平板上。为了培养线虫的数量多,一般选择倒置放入那一块培养基,最后在20 ℃条件下继续培养。
1.3.3.2 线虫抗氧化酶活测定
线虫同步化后,再用96孔平板培养。每孔加入100 μL S-complete培养基,并设置不同浓度的百合药物组和空白对照组。用挑针将同步化到L4时期的线虫挑取至S-complete培养基中,每孔挑取线虫10~15条,挑取线虫的时间设置为第0天。并且在96孔板最外面一圈每孔加入200 μL M9缓冲液防止水分蒸发,用封条纸密封96孔板后放入20 ℃培养箱中培养。待培养3 d过后,收集不同组的线虫,用M9缓冲液清洗3遍,并且在冰上研磨破碎,然后置于离心机上在4 ℃下10 000 r/min离心2 min,取上清液。然后按照SOD试剂盒和GSH试剂盒上的操作方法测定。
1.3.3.3 氧化应激抗性测定
线虫氧化应激抗性测定实验前面的步骤与线虫抗氧化能力测定实验相同,只是线虫培养时间不同。当线虫培养至第7天时,将不同处理组的线虫收集起来,然后随机挑取线虫转移至96孔板中,每孔10~15条线虫,每个处理组都应不少于50条线虫。在进行氧化应激实验时,将线虫暴露于20 ℃ 1 mmol/L H2O2溶液中,并且每隔2 h记录线虫生存情况,直到所有线虫死亡。
1.3.3.4 抗氧化蛋白SOD-3、GCS-1荧光可视化定量
使用带有绿色荧光蛋白(green fluorescent protein,GFP)报告基因的线虫株系CF1553测定SOD-3的表达、LD1171测定GCS-1的表达。首先对转基因线虫株系CF1553、LD1171进行同步化处理,将处于L1期的幼虫在S-complete培养基(不含FuDR)中分别培养72 h至成虫早期,收集不同处理组的线虫,并且用M9洗3次除去虫体黏附的杂质,然后用NaN3溶液麻醉线虫并用倒置荧光显微镜采集图片。然后用Image J软件处理图片,分析不同组别的线虫身上的荧光强度[18]。每组实验至少计数30条线虫。
1.4 数据统计与分析
数据结果以平均值±标准差表示,采用SPSS 18.0软件进行单因素方差分析并用最小显著性差异法进行多重比较,显著水平设置为P<0.05和P<0.01。用GraphPad软件绘制生存曲线并用log-rank(Mantel-Cox)分析方法分析数据。
2 结果与分析
2.1 卷丹百合提取物中活性成分含量
由图1-a可知,卷丹百合提取物在不同的料液比下,总黄酮含量呈现出明显的差异。随着料液比的增加,总黄酮含量逐渐减少。在料液比为1∶10(g∶mL)时,总黄酮含量最高,为49.3 mg/g。
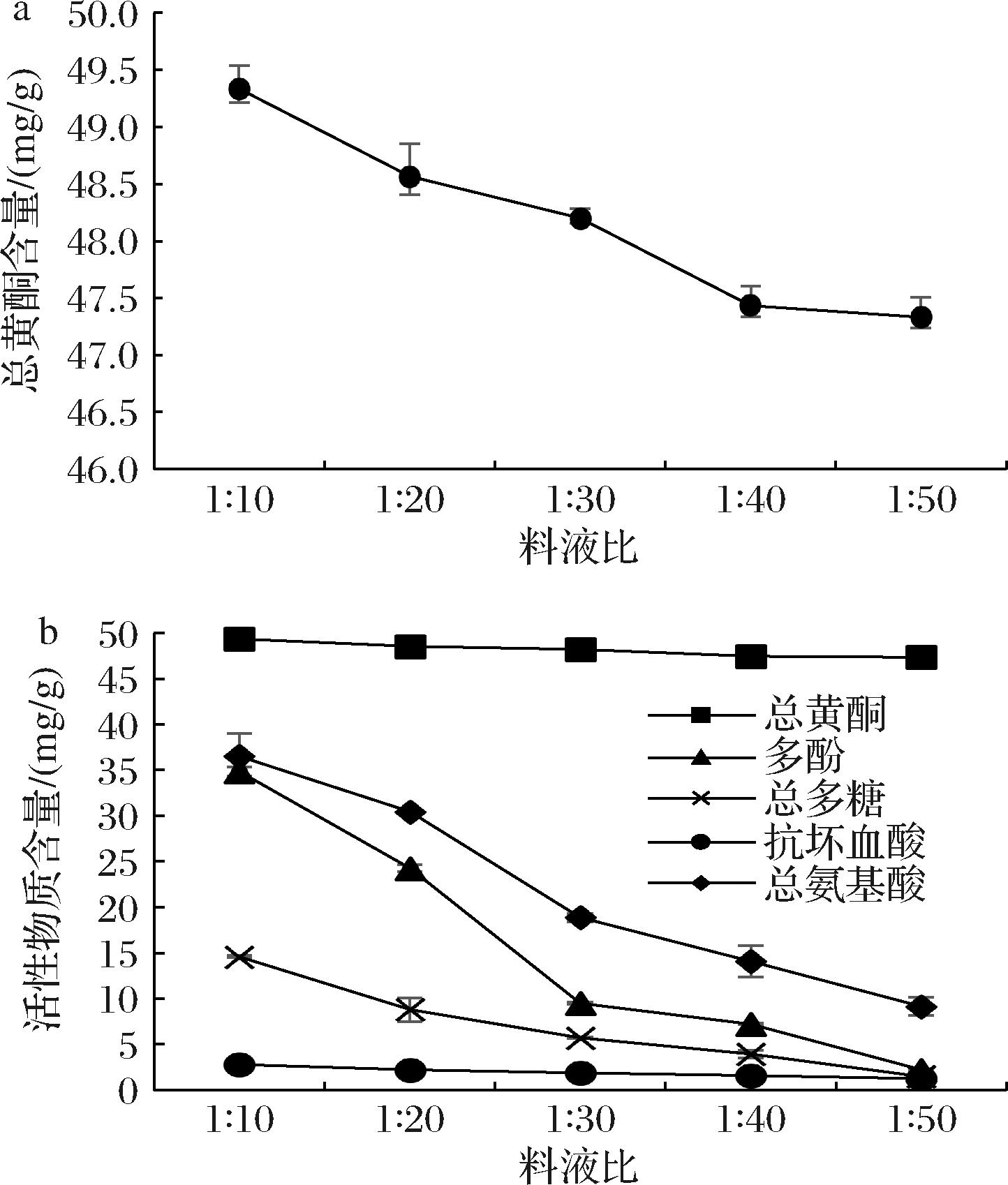
a-总黄酮含量;b-活性物质含量
图1 卷丹百合提取物活性物质含量
Fig.1 Determination of active substance content in L. lancifolium extract
由图1-b可知,卷丹百合提取物中的活性物质都会随着料液比的增加而减少,只有总黄酮含量趋于稳定,下降的含量少。该提取物是活性物质粗提物,而卷丹百合提取物的抗氧化活性主要是由黄酮类和多酚类起作用,但是从图中可知,多酚类物质稳定性差,随着料液比的增加含量少,并且在料液比为1∶10(g∶mL)时含量没有黄酮类物质高,所以我们初步认为卷丹百合提取物中起抗氧化作用的主要是总黄酮。
2.2 卷丹百合提取物体外抗氧化活性
根据图2-a,随着提取溶剂体积(料液比)的增加,卷丹百合提取物对DPPH自由基清除能力的影响逐渐降低。当料液比为1∶10 (g∶mL)时,DPPH自由基清除率为83.46%。这表明卷丹百合黄酮提取物在一定的质量浓度下能够有效清除DPPH自由基。卷丹百合黄酮提取物的清除机理可能涉及到多种供氢体,在这个过程中能够还原DPPH自由基成黄色的DPPH-H化合物。随着卷丹百合黄酮提取物质量浓度的增加,黄酮化合物的供氢能力也相应增强,表现出高效的DPPH自由基清除率。
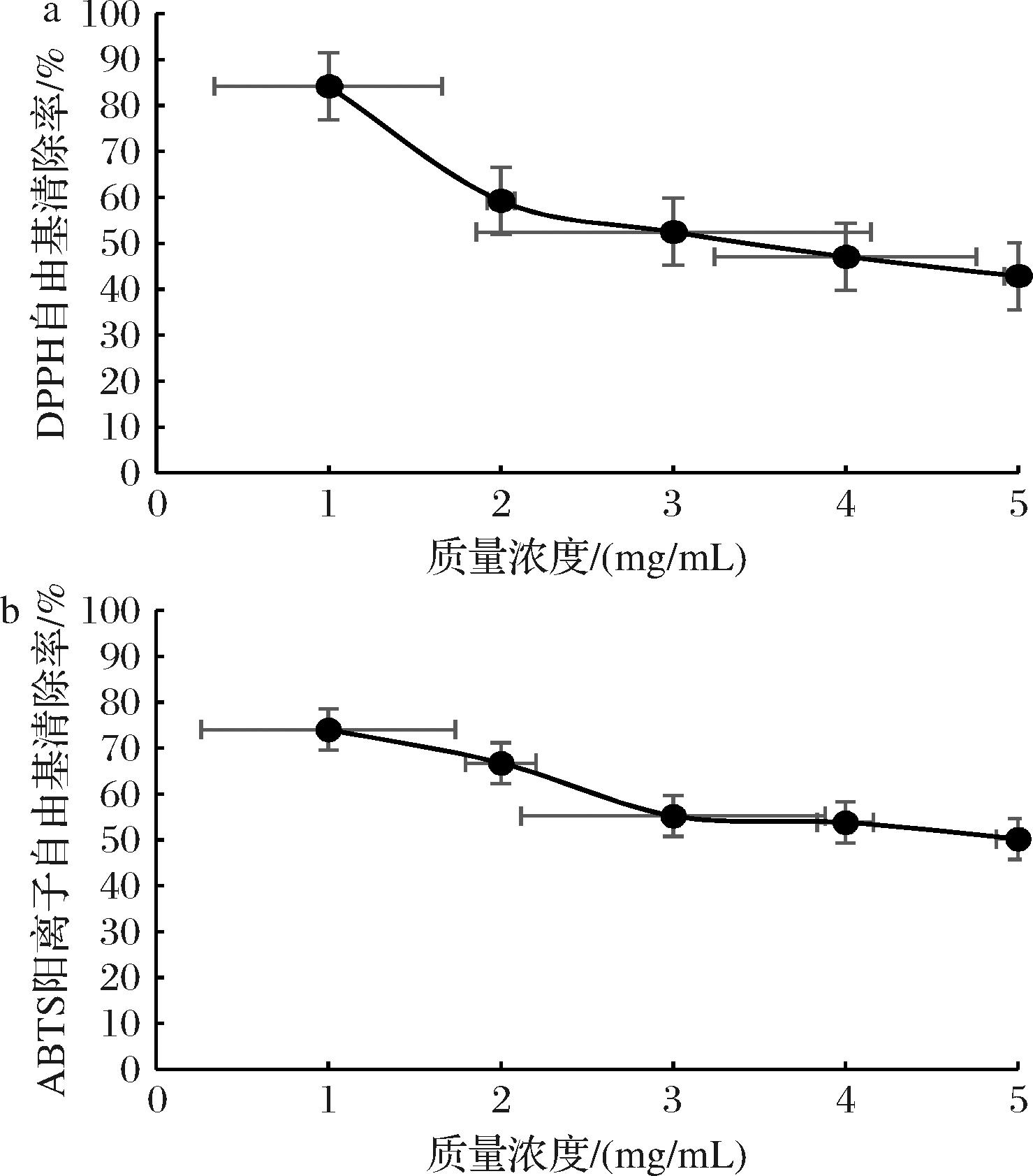
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图2 卷丹百合黄酮提取物抗氧化能力
Fig.2 Chemical antioxidant capacity of flavonoid extract ofL. lancifolium dampanigan
根据图2-b显示,随着提取溶剂体积(料液比)的增加,卷丹百合提取物对ABTS阳离子自由基的清除能力下降。当料液比达到1∶10 (g∶mL)时,该提取物对ABTS阳离子自由基的清除率为73.26%。需要注意的是,卷丹百合提取物清除ABTS阳离子自由基的机理不同于清除DPPH自由基,其主要涉及电子转移过程;ABTS也更容易反应,因为它既亲水也亲脂[19]。可能是因为卷丹百合黄酮提取物具有强大的电子供给能力,因此在本实验中表现出良好的ABTS阳离子自由基清除能力。
将卷丹百合提取物与抗氧化相关性进行分析,结果见表1,卷丹百合提取物对ABTS阳离子自由基、DPPH自由基清除能力与提取物中不同活性物质含量均显示正相关。ABTS阳离子自由基和DPPH自由基清除能力与总黄酮、总多酚、总多糖、氨基酸和抗坏血酸含量显示相关性较高。但是ABTS阳离子自由基和DPPH自由基清除能力与黄酮的相关性较高(>0.9),说明卷丹百合中黄酮的抗氧化活性较强,更进一步确定黄酮类化合物在卷丹百合提取物中起抗氧化作用。
表1 Pearson相关-标准格式
Table 1 Pearson correlation-standard format
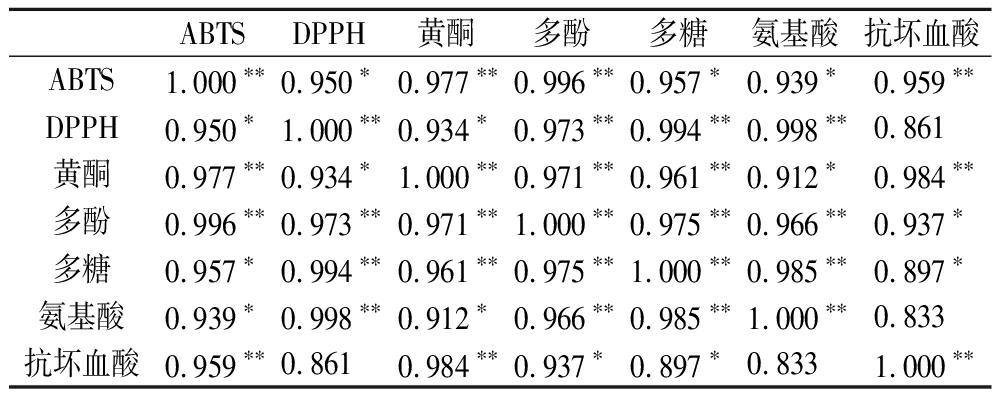
ABTSDPPH黄酮多酚多糖氨基酸抗坏血酸ABTS1.000∗∗0.950∗0.977∗∗0.996∗∗0.957∗0.939∗0.959∗∗DPPH0.950∗1.000∗∗0.934∗0.973∗∗0.994∗∗0.998∗∗0.861黄酮0.977∗∗0.934∗1.000∗∗0.971∗∗0.961∗∗0.912∗0.984∗∗多酚0.996∗∗0.973∗∗0.971∗∗1.000∗∗0.975∗∗0.966∗∗0.937∗多糖0.957∗0.994∗∗0.961∗∗0.975∗∗1.000∗∗0.985∗∗0.897∗氨基酸0.939∗0.998∗∗0.912∗0.966∗∗0.985∗∗1.000∗∗0.833抗坏血酸0.959∗∗0.8610.984∗∗0.937∗0.897∗0.8331.000∗∗
注:*P<0.05,**P<0.01。
卷丹百合黄酮提取物是一种具有良好抗氧化活性的天然活性物质,有研究表明卷丹百合黄酮提取物能有效清除DPPH自由基、ABTS阳离子自由基,提高铁离子还原能力和抗脂质过氧化能力[20]。本实验通过测定不同料液比(1∶10、2∶10、3∶10、4∶10、5∶10,g∶mL)的卷丹百合提取物的抗氧化能力,得到料液比为1∶10(g∶mL)下的黄酮具有较高的抗氧化性。然而仅仅以化学法测得的抗氧化指标为评价方法是不全面的,需要系统研究卷丹百合黄酮提取物的抗氧化能力,因此利用线虫模型为评价方法进一步开展卷丹百合黄酮提取物的抗氧化能力。
2.3 卷丹百合黄酮提取物对线虫抗氧化能力的影响
2.3.1 卷丹百合黄酮提取物对线虫体内抗氧化酶活力的影响
线虫体内的抗氧化酶活性水平可以反应其生长发育状态。受到抗氧化应激或衰老过程时,细胞内抗氧化酶活性会降低,从而导致氧自由基过度积累,引发氧化应激从而加速衰老[21]。由图3可知,与空白组对照,样品组线虫体内的SOD活力、GSH含量均显著增加,而且中剂量组的显著性效果最好。说明卷丹百合提取物具有抗氧化效果,其中的黄酮提取物可能通过提高线虫体内的抗氧化酶活性、减少积累的氧自由基含量以延缓线虫衰老增强其抗氧化能力。
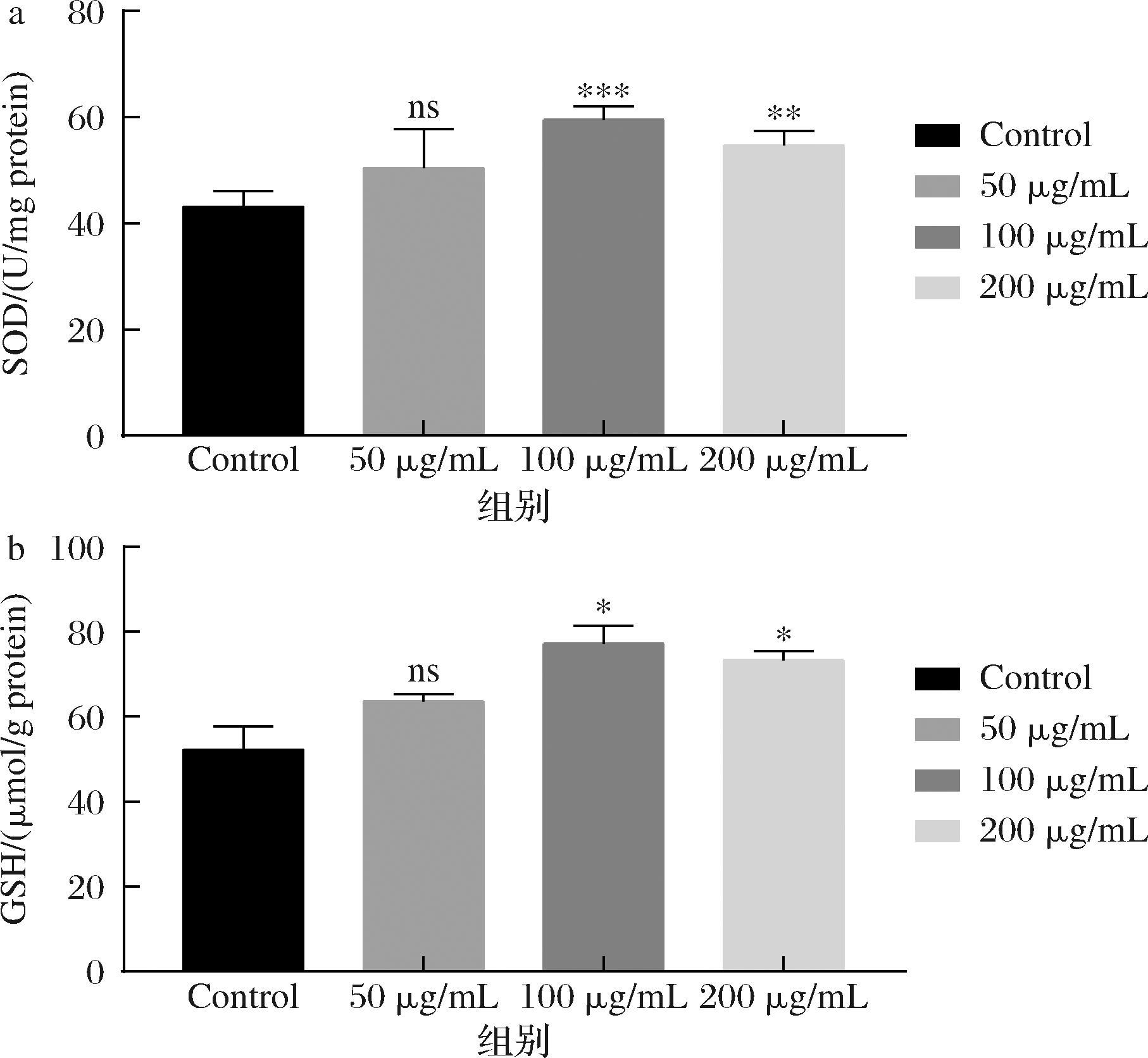
a-SOD活力;b-GSH含量
图3 卷丹百合黄酮提取物对线虫体内抗氧化酶活力的影响
Fig.3 Effect of flavonoid extract of L. lancifoliumon antioxidant enzyme activity in nematodes
注:与对照组相比,*差异显著(P<0.05);**差异极显著(P<0.01);***差异非常显著(P<0.000 1)。
细胞内过量的氧自由基会使细胞膜损伤,引起细胞衰老,而SOD和GSH可以抑制这些物质对细胞的氧化损伤作用[22]。因此,生物的抗氧化损伤能力可以通过测定SOD和GSH活性来评估。本次实验对象为氧化应激处理后的N2品系秀丽隐杆线虫,3种质量浓度分别为50、100、200 μg/mL的卷丹百合提取物,空白对照组质量浓度为0 μg/mL。由结果可知,在测定线虫抗氧化能力实验中,卷丹百合提取物在100 μg/mL的质量浓度下,能够使线虫体内的抗氧化酶含量增加。通过与空白对照组比较,100 μg/mL的卷丹百合提取物组线虫体内SOD和GSH含量分别提高了38%和48%,说明卷丹百合提取物可以提高线虫体内SOD和GSH的含量,而且显示出一定的剂量依赖性,减少氧自由基的过度积累,从而增强抗氧化损伤能力,达到防止氧化、延长衰老的目的。
2.3.2 氧化应激抗性测定
当机体遭受各种有害刺激时,由于活性氧(reactive oxygen species,ROS)过度积累和细胞清除氧化物能力不足,可能会导致氧化系统和抗氧化系统失衡,从而引发氧化应激,这种现象可能会导致细胞氧化老化和组织损伤。
测定卷丹百合提取物的氧化应激能力时,所有的线虫处于同一个时期。由表2可知,将卷丹百合提取物分为4个浓度对线虫进行加药处理,在H2O2应激下,空白组的线虫的平均存活时间为8 h,而加入卷丹百合提取物组的线虫平均存活时间达到10 h。由图4可知,对照组在H2O2的刺激下最多存活18 h,而卷丹百合提取物加药组的存活时间均超过18 h,其中100 μg/mL的卷丹百合提取物能使线虫存活24 h。表明卷丹百合提取物组的加入可提高线虫的抗氧化应激能力,能够清除机体受到氧化刺激时产生的自由基,从而阻止ROS过度积累,使其含量降低,延缓线虫衰老,进而提高秀丽隐杆线虫在H2O2应激条件下的存活率。即中剂量卷丹百合提取物组不仅能够提高秀丽隐杆线虫抗应激的能力,而且能最大程度地使其寿命得到延长。
表2 不同浓度的卷丹百合对线虫氧化应激抗性的影响
Table 2 Effects of different concentrations of L. lancifolium on oxidative stress resistance in nematodes

处理组平均寿命/h百分比/%对照组8.24±0.23a-提取物(50 μg/mL)10.04±0.31b21.84提取物(100 μg/mL)10.79±0.35c30.95提取物(200 μg/mL)10.34±0.37bc25.48
注:小写字母不同表示差异显著(P<0.05)。
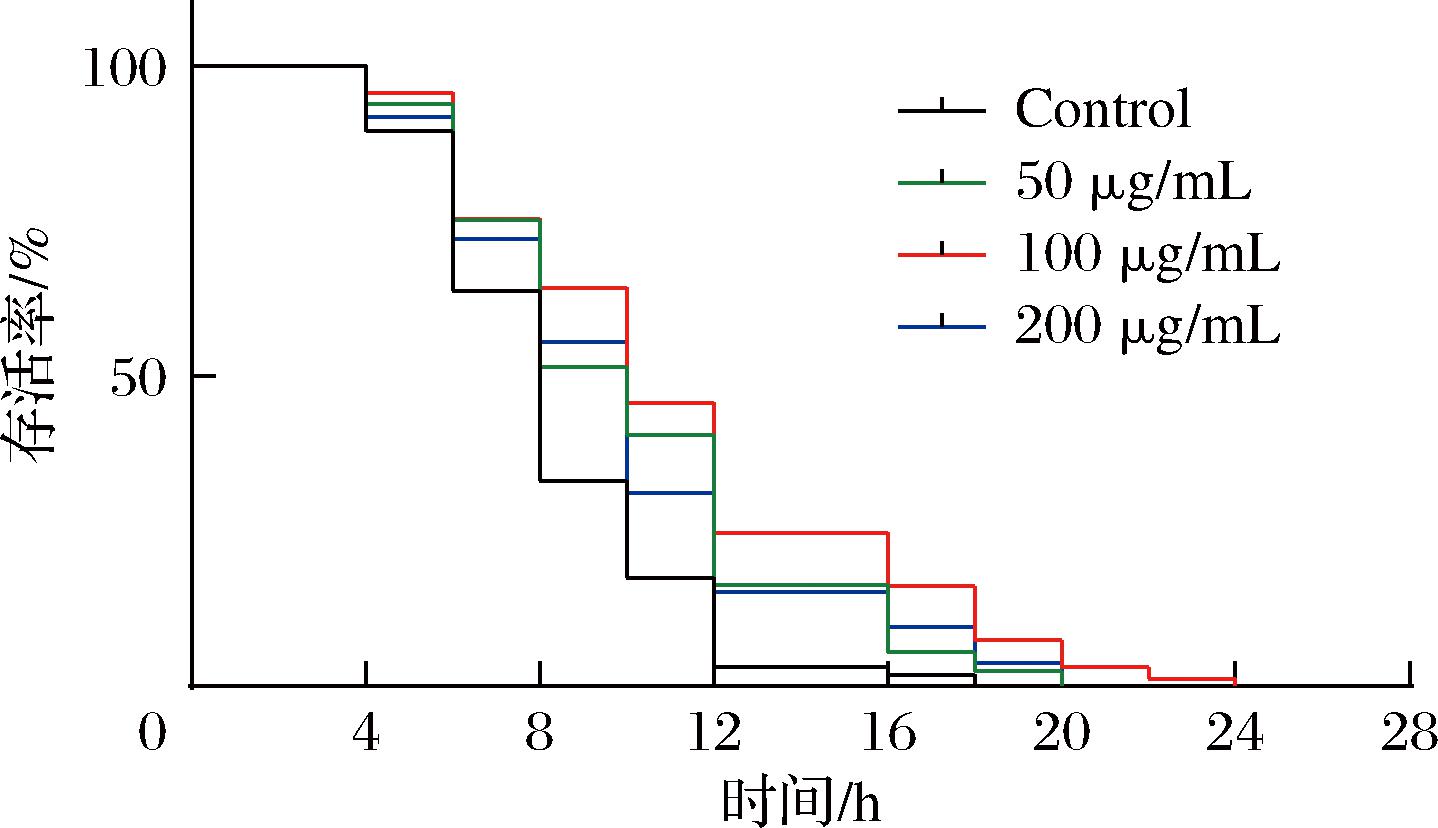
图4 卷丹百合黄酮提取物对线虫氧化应激抗性的影响
Fig.4 Effects of L. lancifolium flavonoid extract on oxidative stress resistance in nematodes
2.3.3 抗氧化蛋白SOD-3、GCS-1荧光可视化定量结果
CF1553线虫是一种GFP标记SOD-3蛋白的线虫、LD1171线虫是一种GFP标记GCS-1蛋白的线虫,在荧光显微镜下观察线虫中绿色荧光强度即可直接反映出SOD-3和GCS-1蛋白的表达情况。
SOD-3∷GFP突变体线虫(CF1553)、GCS-1∷GFP突变体线虫(LD1171)表型为若体内含有抗氧化活性成分时,在蓝光激发下,其 SOD-3、GCS-1高度表达部位发出绿色荧光,而没有或者活性成分含量不足或者过高时会不显现绿色或者绿色颜色较浅,见图5。
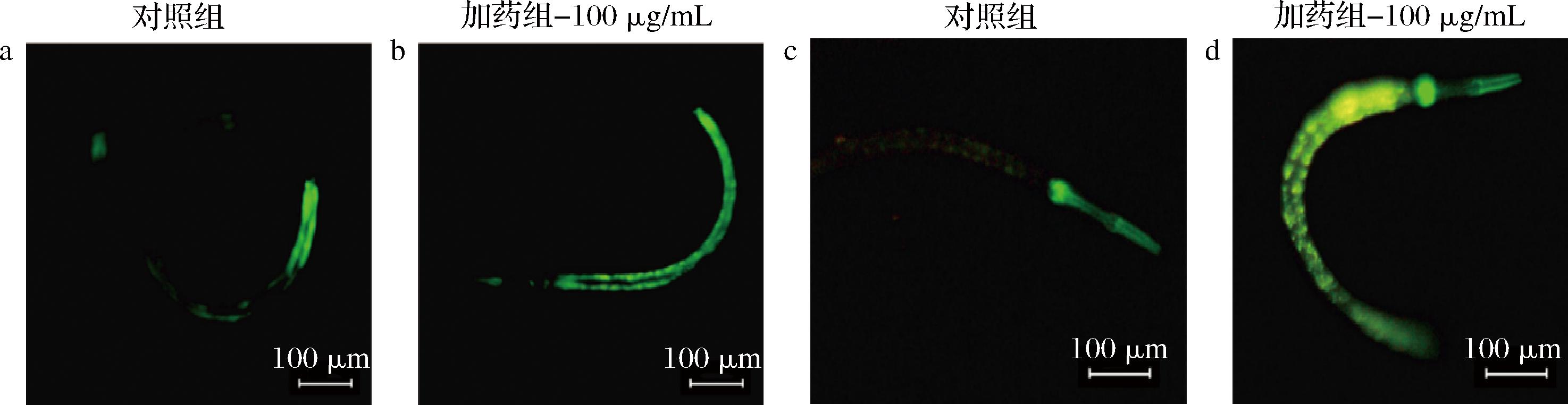
a-CF1553线虫对照组;b-CF1553线虫加药组-100 μg/mL;c-LD1171线虫对照组;d-LD1171线虫加药组-100 μg/mL
图5 抗氧化蛋白荧光可视化
Fig.5 Visualization of antioxidant protein fluorescence
通过利用SOD-3∷GFP的转基因线虫CF1553观察SOD-3蛋白的表达情况和利用GCS-1∷GFP的转基因线虫LD1171观察GCS-1蛋白的表达情况,来进一步确认卷丹百合提取物具有抗氧化能力的原因是否是通过影响DAF-16的转录活性来实现[18]。实验发现这2种线虫在添加卷丹百合提取物后,能有明显的绿色荧光。结果如表3所示,向线虫中添加卷丹百合提取物3 d后,通过与空白组比较发现中剂量组卷丹百合提取物能使线虫的荧光强度有所增高,其差异程度最为显著,具有统计学意义。进一步的研究表明,样本能够刺激DAF-16转录因子的活性,导致其在线虫体内被转录和进入细胞核,进而促进SOD-3和GCS-1蛋白的表达。表明卷丹百合黄酮提取物具有抗氧化的能力[23]。
表3 线虫的荧光表达量
Table 3 The amount of fluorescence relative intensity

实验相对荧光强度处理组93.597113.036100.134111.144104.03697.50399.46897.17894.934加药组(100 μg/mL)117.779112.706128.109116.556119.709115.789107.839105.567109.899
3 结论
研究表明,卷丹百合黄酮提取物具有良好的还原能力,能有效清除DPPH自由基和ABTS阳离子自由基。线虫实验结果表明,该提取物能够提高线虫体内SOD活力和GSH含量,清除过量自由基和有害物质,从而保护氧化损伤细胞。线虫实验发现卷丹百合黄酮提取物能提高抗氧化酶活力(SOD、GSH),延长线虫在氧化应激条件下的寿命。未来的研究可以进一步探究卷丹百合黄酮中的活性成分与其生理功能之间的关系。本实验初步表明卷丹百合黄酮提取物具有良好的抗氧化能力,具有一定的研究价值。
[1] 王云霞. 施肥对卷丹百合生长发育、养分吸收及活性成分的影响[D].银川:宁夏大学, 2021.WANG Y X.Effects of fertilization on growth, nutrient absorption and active components of Lilium lancifolium Thunb[D].Yinchuan:Ningxia University, 2021.
[2] 王涵, 王云霞, 靳宗洋, 等.氮钾配施对卷丹百合生长发育的影响[J].安徽农学通报, 2021, 27(24):27-29.WANG H, WANG Y X, JIN Z Y, et al.Effects of combined application of nitrogen and potassium on growth and development of Lilium lancifolium[J].Anhui Agricultural Science Bulletin, 2021, 27(24):27-29.
[3] 赵康宏, 周峰, 严思恩, 等.新鲜龙牙百合各萃取部位抗氧化、抗炎活性评价及化学成分分析[J].现代食品科技, 2020, 36(11):87-97.ZHAO K H, ZHOU F, YAN S E, et al.Evaluation of antioxidant and anti-inflammatory activities and analysis of chemical components in different extraction parts of fresh longya Lilium[J].Modern Food Science and Technology, 2020, 36(11):87-97.
[4] 孙泽晨. 几种四川野生观赏百合鳞茎酚类物质与抗氧化活性研究[D].雅安:四川农业大学, 2018.SUN Z C.Study on the phenolic compounds and antioxidant activity of several wild ornamental lily bulbs from Sichuan province[D].Ya’an:Sichuan Agricultural University, 2018.
[5] 杜静, 张海龙, 李丽, 等.龙牙百合花和甜茶提取物对食用油抗氧化作用的研究[J].中国油脂, 2017, 42(12):40-43;48.DU J, ZHANG H L, LI L, et al.Antioxidant effects of extracts of Longya Lily flower and Lithocarpus polystachyus on edible oil[J].China Oils and Fats, 2017, 42(12):40-43;48.
[6] LI W M, WANG Y J, WEI H L, et al.Structural characterization of Lanzhou lily (Lilium davidii var.unicolor) polysaccharides and determination of their associated antioxidant activity[J].Journal of the Science of Food and Agriculture, 2020, 100(15):5603-5616.
[7] SIM W S, CHOI S I, JUNG T D, et al.Antioxidant and anti-inflammatory effects of Lilium lancifolium bulbs extract[J].Journal of Food Biochemistry, 2020, 44(5):e13176.
[8] WANG X Y, YANG L Z, LIU J, et al.Comparison of the biochemical properties and thermal inactivation of polyphenol oxidase from three lily bulb cultivars[J].Journal of Food Biochemistry, 2020, 44(10):e13431.
[9] 符勇耀, 刘建玲, 朱艺勇, 等.卷丹转基因体系构建及岷江百合LrCCoAOMT的导入[J].园艺学报, 2020, 47(7):1345-1358.FU Y Y, LIU J L, ZHU Y Y, et al.Construction of transformation system and integration of LrCCoAOMT gene into Lilium lancifolium[J].Acta Horticulturae Sinica, 2020, 47(7):1345-1358.[10] 何纯莲, 雷丽红, 凌晓.百合提取物对羟自由基的清除作用[J].光谱实验室, 2003, 20(1):102-104.HE C L, LEI L H, LING X.Scavenging effect of Lilium extraction on hydroxyl radical (·OH)[J].Chinese Journal of Spectroscopy Laboratory, 2003, 20(1):102-104.
[11] 雷卢恒, 张延龙, 牛立新, 等.15个卷丹居群鳞茎活性成分及其抗氧化能力[J].食品科学, 2015, 36(14):122-129.LEI L H, ZHANG Y L, NIU L X, et al.Antioxidant capacity and active components of Lilium lancifolium Thunb.bulbs from 15 populations[J].Food Science, 2015, 36(14):122-129.
[12] 张希平. 10种百合鳞茎多酚提取物抗氧化活性及其与氮磷钾的相关性[D].银川:宁夏大学, 2022.ZHANG X P.Antioxidant activity of polyphenol extracts from ten lily bulbs and its correlation with nitrogen, phosphorus and potassium[D].Yinchuan:Ningxia University, 2022.
[13] 王润丰. 四种百合黄酮类化合物分离纯化与抗氧化作用的研究[D].杨凌:西北农林科技大学, 2011.WANG R F.Study on the purification and antioxidant effects of flavonoids from four species of lilies[D].Yangling:Northwest Agriculture &Forestry University, 2011.
[14] 王梅霖. 玫瑰类黄酮的生物活性及其应用研究[D].济南:齐鲁工业大学, 2021.WANG M L.Study on the biological activity and application of rose flavonoids[D].Jinan:Qilu University of Technology, 2021.
[15] 李莲芳, 杨丽莉, 龙艳昆, 等.紫外分光光度法测定大枣中总黄酮的研究[J].云南中医中药杂志, 2019, 40(8):75-77.LI L F, YANG L L, LONG Y K, et al.Study on determination of total flavonoids in jujube by ultraviolet spectrophotometry[J].Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 2019, 40(8):75-77.
[16] 李红娟. 卷丹百合营养成分、活性物质及栽培特性的研究[D].杨凌:西北农林科技大学, 2007.LI H J.Study on the nutrients,bioactive materials and cultivation characteristics of Lilium lancifolium Thunb[D].Yangling:Northwest Agriculture &Forestry University, 2007.
[17] 付玉梅, 尧梅香, 周明.西兰花中萝卜硫苷提取及抗氧化性研究[J].化学工程师, 2023, 37(4):104-109;46.FU Y M, YAO M X, ZHOU M.Study on extraction and antioxidant activity of glucoraphanin from broccoli[J].Chemical Engineer, 2023, 37(4):104-109;46.
[18] 王析瑞, 刘永建, 刘岑, 等.邻甲氧基肉桂酸抗衰老活性及机制研究[J].中国现代中药, 2022, 24(8):1481-1486.WANG X R, LIU Y J, LIU C, et al.Anti-aging activity and mechanism of O-methoxycinnamic acid[J].Modern Chinese Medicine, 2022, 24(8):1481-1486.
[19] 李伟, 叶嘉宜, 陈运娇, 等.桉叶多酚提取物体内外抗氧化活性评价[J].食品科学, 2021, 42(5):160-168.LI W, YE J Y, CHEN Y J, et al.Antioxidant activity of Eucalyptus leaf polyphenol extract in vitro and in vivo[J].Food Science, 2021, 42(5):160-168.
[20] 夏星, 钟振国, 冯丹霞.三七总皂苷保护PC12细胞对抗过氧化氢损伤的作用[J].中国实验方剂学杂志, 2013, 19(4):216-219.XIA X, ZHONG Z G, FENG D X.Effect of Panax notoginseng saponins protect PC12 cell against hydrogen peroxide induced damage[J].Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(4):216-219.
[21] PIZZINO G, IRRERA N, CUCINOTTA M, et al.Oxidative stress:Harms and benefits for human health[J].Oxidative Medicine and Cellular Longevity, 2017, 2017:8416763.
[22] 李慕. 白茶对秀丽隐杆线虫抗氧化损伤和抗衰老作用研究[J].广东蚕业, 2022, 56(7):20-22.LI M.Effects of white tea on antioxidative damage and anti-aging of Caenorhabditis elegans[J].Guangdong Sericulture, 2022, 56(7):20-22.
[23] 王润丰, 牛立新, 张延龙, 等.野生卷丹百合黄酮类化合物抗氧化能力的研究[J].西北农业学报, 2011, 20(11):152-155;187.WANG R F, NIU L X, ZHANG Y L, et al.Antioxidant ability of flavonoids from wild Lilium lancifolium[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2011, 20(11):152-155;187.