近年来,化妆品市场增长迅速,根据国家统计局(National Bureau of Statistics,NBS)数据统计,中国化妆品营业额在2021年达到288.8亿元且仍保持高增长率[1]。美白产品是化妆品的重要组成产业,而一些源自植物的活性成分是天然的美白剂,进入人体后可通过抑制络氨酸酶表达、黑色素合成转运等途径实现美白效果[2],相较合成替代品更加温和、健康、安全[3-4],是美白原料研发的重要方向之一。
管花肉苁蓉为列当科管花肉苁蓉Cistanche tubulosa (Schenk) Wight的干燥带鳞叶的肉质茎,是列当科肉苁蓉属多年生寄生草本植物。管花肉苁蓉是一种调节机体免疫功能的名贵中药,具有壮阳、抗衰老、抗疲劳、抗肿瘤、增强免疫力以及治疗糖尿病、心血管疾病、眼部疾病等功效[5-9],其性温、味甘咸,为补肾壮阳、润肠通便之要药,有“沙漠人参”的美誉。研究发现管花肉苁蓉中含有的苯乙醇苷类成分具有广泛的药理活性,包括抗氧化、抗疲劳、保肝以及抗肿瘤[10-11]等,通过降低黑素细胞内黑色素含量、抑制酪氨酸酶活性[12]发挥美白效果;其关键质量标准成分为松果菊苷和毛蕊花糖苷,该成分对中波紫外线(ultraviolet radiation B,UVB)照射引发的氧化应激损伤、DNA损伤和细胞凋亡具有显著保护作用[13-14],作为天然美白剂有着较高的开发利用价值。因此高效提取苯乙醇苷类化合物、验证管花肉苁蓉美白效果对管花肉苁蓉等天然产物资源开发具有重要意义。本研究旨在通过超声微波法结合Box-Behnken响应面法探索出最佳提取工艺条件,并通过生化指标和细胞水平评价管花肉苁蓉提取物的抗氧化、美白效果。
1 材料与方法
1.1 材料与试剂
实验用管花肉苁蓉购自新疆和田,经辽宁中医大学李学涛教授鉴定为列当科管花肉苁蓉Cistanche tubulosa(Schenk)Wight的干燥片茎,植物标本避光密封保存于北京石油化工学院制药工程系。对照品松果菊苷(批号D1105AS)购自大连美仑生物技术有限公司,质量分数≥98%;甲醇(色谱纯),国药集团化学试剂有限公司;无水乙醇(分析纯),福晨(天津)化学试剂有限公司;蒸馏水,娃哈哈公司;DPPH(分析纯),美国Sigma公司;铁氰化钾、FeCl3、三氯乙酸、抗坏血酸(维生素C),福晨(天津)化学试剂有限公司;CCK-8试剂盒,北京索莱宝科技有限公司;胎牛血清、0.25 %胰酶、PBS磷酸盐缓冲液(pH 7.4)、双抗、高糖培养基(Dulbecco’s modified eagle medium,DMEM)和RPMI-1640(Roswell Park Memorial Institute)培养基、小鼠黑色素瘤(B16)细胞、PAM212细胞,北京中生奥邦生物科技有限公司。
1.2 仪器与设备
UV2600紫外分光光度计,上海舜宇恒平科学仪器有限公司;RE52-86A旋转蒸发器,上海亚荣生化仪器厂;99-IIDN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;BSM200分析天平,上海卓精电子科技有限公司;SL-200高速多功能粉碎机,浙江省永康市松青五金厂;DT5-4B型低速台式离心机,北京时代北利离心机有限公司;XDS-2倒置生物显微镜,深圳市深视光谷光学仪器公司。
1.3 实验方法
1.3.1 管花肉苁蓉提取物制备及工艺优化
1.3.1.1 含量测定方法
管花肉苁蓉中苯乙醇苷类化合物主要成分为松果菊苷和毛蕊花苷;因此选择松果菊苷做为含量检测指标成分,参照宫晓庆[15]方法测量松果菊苷含量,制备质量浓度为0.5 mg/mL的松果菊苷标准溶液,再准确移取1 mL标准液并用甲醇定容到10 mL容量瓶中,摇匀后分别取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL的0.4 mg/mL的松果菊苷标准溶液至10 mL容量瓶中,甲醇定容,摇匀,以甲醇作为空白对照,测量其在波长为335 nm的紫外吸收值,绘制松果菊苷标准曲线。
1.3.1.2 提取工艺及优化
将管花肉苁蓉切片进行粉碎、过40目筛,分别考察料液比(1∶4、1∶8、1∶16、1∶24)、乙醇体积分数(50%、70%、90%)、超声功率(140、160、180 W)、超声时间(4、6、8 min)各因素对管花肉苁蓉中松果菊苷提取率的影响;根据单因素结果设计响应面实验,并以乙醇浓度(A)、超声功率(B)、超声时间(C)为自变量进行3因素3水平试验设计[16-17],以松果菊苷含量作为提取物得率(Y)因变量,优化提取工艺。
1.3.2 抗氧化活性检测
1.3.2.1 DPPH自由基清除能力测定
参考姚辛敏等[18]、BALIYAN等[19]的方法测定DPPH自由基清除能力;以维生素C为阳性对照,配制质量浓度为0.062 5、0.125、0.25、0.5、1、2 mg/mL的供试管花肉苁蓉提取物和维生素C标准液,再配制100 mL质量分数为0.004% DPPH的甲醇溶液,取200 mL甲醇溶液与600 mL DPPH混合均匀,吸光值记录为A空白;取200 mL管花肉苁蓉提取液、维生素C标准液与600 mL甲醇溶液混合均匀,吸光度记录为A对照;将甲醇溶液替换为DPPH溶液,其余同对照组,吸光度记录为A样品,以上样品混匀并避光反应30 min后在517 nm处测量吸光度值,测量时每组设3个平行,取均值。依据公式(1)计算DPPH清除率:
自由基清除率![]()
(1)
1.3.2.2 ABTS阳离子自由基清除能力测定
配制ABTS工作液:准确称取6 mg ABTS溶解于1.6 mL纯化水中,准确称取2 mg过硫酸钾溶解于3 mL纯化水中,两者避光备用。各移取300 mL的ABTS和过硫酸钾溶液,混合均匀,避光反应6 h后,稀释35倍即为ABTS工作液。待测样品浓度同“1.3.2.1节 DPPH自由基清除能力测定”,以维生素C为阳性对照,取200 mL ABTS工作液与10 mL PBS混合均匀,吸光值记录为A空白;取200 mL纯化水、与10 mL管花肉苁蓉提取液、维生素C标准液混合均匀,吸光度记录为A对照;用ABTS工作液替换纯化水,其余同对照组,吸光度记录为A样品,以上样品混匀并避光反应30 min后在540 nm测量吸光度值,测量时每组设3个平行,取均值,ABTS清除率计算如公式(1)所示。
1.3.2.3 总还原能力的测定
参考SCHNEIDER-TEIXEIRA等[20]方法并做一定修改,用标准的PBS缓冲液(干粉)配制pH 7.2~7.4的磷酸缓冲溶液,配制质量分数为1%的铁氰化钾、质量分数为10%的三氯乙酸溶液,维生素C做阳性对照,甲醇为参比;取不同浓度的样液各40 mL(提取物、维生素C浓度同1.3.2.1节)加入磷酸缓冲溶液100 mL、1%铁氰化钾100 mL,混合均匀后50 ℃恒温反应20 min,反应结束后尽快冰水浴冷却,加入10%三氯乙酸100 mL混合均匀,2 500 r/min 离心10 min,取100 mL上清液,依次加入无水乙醇100 mL、质量分数为0.1%的FeCl3溶液20 mL,混匀,取反应液在700 nm处测量吸光值,每组设置3个平行,取均值[20]。
1.3.3 管花肉苁蓉提取物对B16细胞活力的影响
参考庄文越等[21]的方法测定B16细胞活力,以每个孔加入6×103个细胞,将B16细胞接种于96孔板中,培养24 h使细胞完全贴壁,样品组加入含待测样品的RPMI-1640培养液,空白组加入不含待测样品的培养液,对照组加入相同培养液且无细胞。培养24 h后,每孔加入10 mL CCK-8溶液,继续孵育150 min后,于450 nm波长下测定每孔光密度值,每组设置6个平行。细胞存活率/%=(给药组OD450nm-对照组OD450nm)/(对照空白孔OD540nm-空白组OD540nm)×100。
1.3.4 对B16细胞内黑色素含量的影响
参考张娅妮等[22]的方法,将对数生长期的B16细胞以8×104个/孔接种于6孔细胞培养板,培养24 h使细胞完全贴壁;样品组加入含管花肉苁蓉提取物(质量浓度分别为10、25、50 mg/mL)的RPMI-1640培养液,空白组加入不含待测样品的培养液。待测样品作用72 h后,通过弃去上清液、PBS洗涤、胰酶消化、终止重悬对细胞进行计数;将细胞混悬液进行离心,弃去上清液,并往沉淀中加入1 mL NaOH溶液,于80 ℃加热30 min,置酶标仪中于490 nm波长下测定每孔光密度值,每组设置3个平行。黑色素含量/%=[(样品组OD值/细胞个数)/(空白组OD值/细胞个数)]×100
1.3.5 对B16细胞酪氨酸酶活性的影响
参考窦晨等[23]的方法检测酪氨酸酶(tyrosinase,TYR)活性,将B16细胞接种于96孔板中,以每孔加入2×103个细胞,培养24 h使细胞完全贴壁,样品组加入含待测样品的培养液,空白组加入不含待测样品的培养液。待测药样品作用72 h后,弃去上清液,用PBS洗涤2次,并加入含Triton X-100体积分数为1%的PBS溶液,振荡5 min溶解细胞,每孔加入10 mL 10 mmol/L的左旋多巴,37 ℃继续孵育40 min。置酶标仪中于490 nm波长下测定每孔光密度值,每组设置6个平行[23]。TYR活性/%=(空白组OD/样品组OD)×100。
1.3.6 对黑素小体转运量的影响
消化B16细胞,接种2.5×105个细胞于6 cm培养皿中。孵育2 h后加入2.5×105个 PAM212细胞(提前荧光标记),加入含质量分数15%胎牛血清的DMEM培养液,两种细胞置于培养箱中孵育12 h。弃旧培养基,模型组加入新鲜DMEM(0.5 mmol/L),样品组加入DMEM配制的10、50、100 mg/mL样品溶液,孵育48 h。模型组、样品组加入1 mL PBS,6 mJ/cm2 UVB照射4 h进行下一步实验处理。移除培养液,加入PBS洗涤、胰酶消化、收集细胞并充分吹打细胞;1 000 r/min,离心8 min后移除上清液,加入3 mL固定液并再次充分吹打细胞,固定1 h。混匀细胞样本,吸入5 mL流式管中,离心去上清液。加入2 mL PBS重悬细胞并重复离心,弃上清液。向细胞样本中加入2 mL细胞强力通透液,吹打混匀,通透30 min后离心去上清液并用PBS重悬,再次离心并弃上清液。向细胞样本中加入2 mL质量分数5%牛血清白蛋白V,吹打混匀细胞,封闭1 h。加入200 mL PBS重悬,加抗体(稀释浓度1∶500),37 ℃避光孵育30 min,将样品4 ℃避光孵育过夜;取出样品,混匀后迅速上机检测。
2 结果与分析
2.1 管花肉苁蓉提取工艺与含量检测
2.1.1 含量测定
通过紫外分光光度仪测量不同浓度下松果菊苷吸光度值并将数据拟合,方程为:Y=0.029 37X+0.002 53,相关系数R2=0.999 3,表示线性关系较好,标准曲线如图1所示,可用于实验操作。
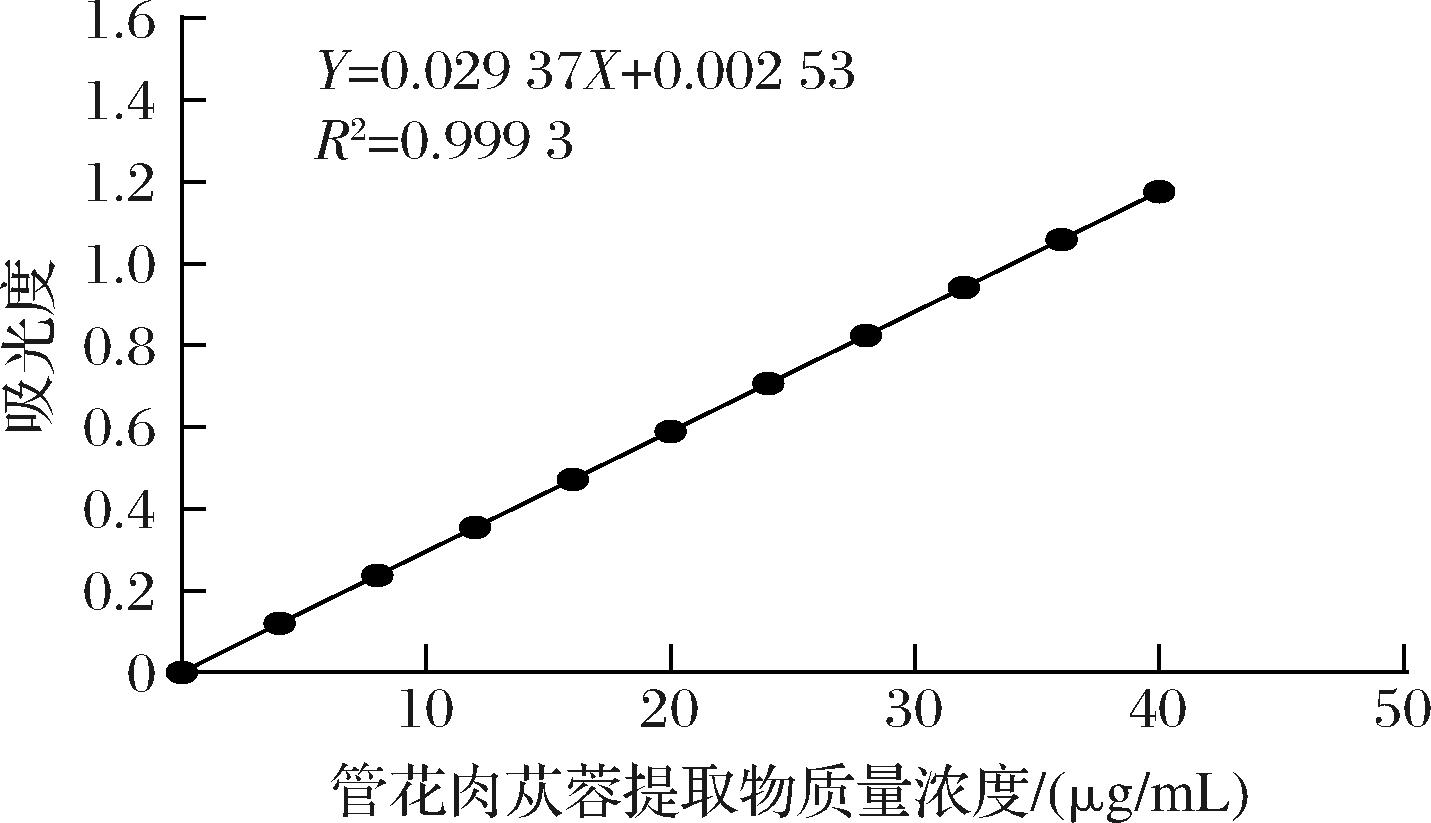
图1 松果菊苷浓度与吸光度标准曲线
Fig.1 Standard curve of concentration and absorbance of echinacoside
2.1.2 管花肉苁蓉提取工艺优化
实验自变量因素变化水平设计见表1。
表1 因素值和水平
Table 1 Factor values and levels

水平A乙醇体积分数/%B超声功率/WC超声时间/min-150140407016061901808
采用Box-Behnken方法设计试验,按照细胞粉碎超声提取、离心、减压浓缩流程进行提取,浓缩液经甲醇定容后测定得率,测得松果菊苷提取率见表2,在料液比为1∶16,乙醇体积分数70%,超声波功率160 W,超声波处理时间6 min条件下松果菊苷提取率最高,为8.089%。
表2 提取物得率的响应面实验数据
Table 2 Response surface experimental data for extract yield
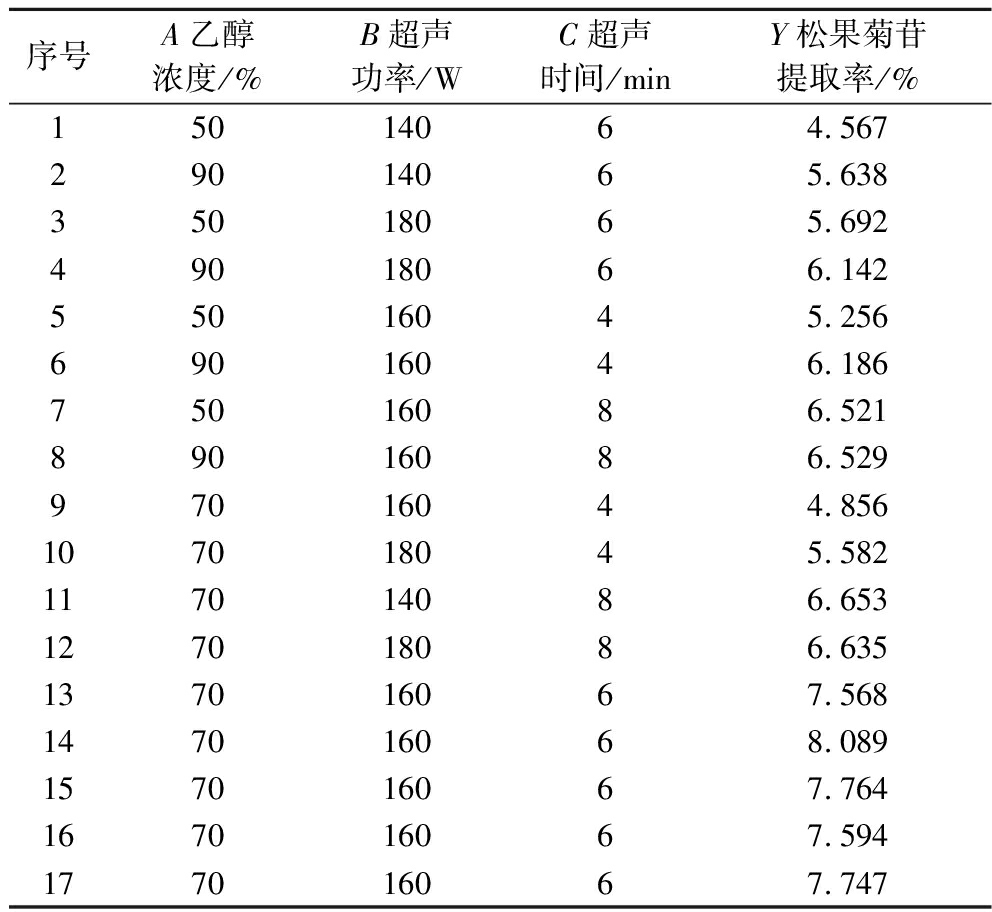
序号A乙醇浓度/%B超声功率/WC超声时间/minY松果菊苷提取率/%15014064.56729014065.63835018065.69249018066.14255016045.25669016046.18675016086.52189016086.52997016044.856107018045.582117014086.653127018086.635137016067.568147016068.089157016067.764167016067.594177016067.747
通过Design Expert V11软件分析得到松果菊苷得率与三因素间模型,回归方程为Y=7.75+0.33A+0.24B+0.53C-0.19AB-0.21AC-0.26BC-0.96A2-1.25B2-0.65C2,P值<0.000 1,模型显著性高;松果菊苷得率与三因素交互作用如图2所示,3D图存在开口向下的上凸曲面,且松果菊苷提取最大值在响应面图最高点、等高线图中心点,与上表提取率数据吻合,证明该模型可靠。结合等高线和响应面曲线发现,超声功率对管花肉苁蓉中松果菊苷含量影响更为显著。
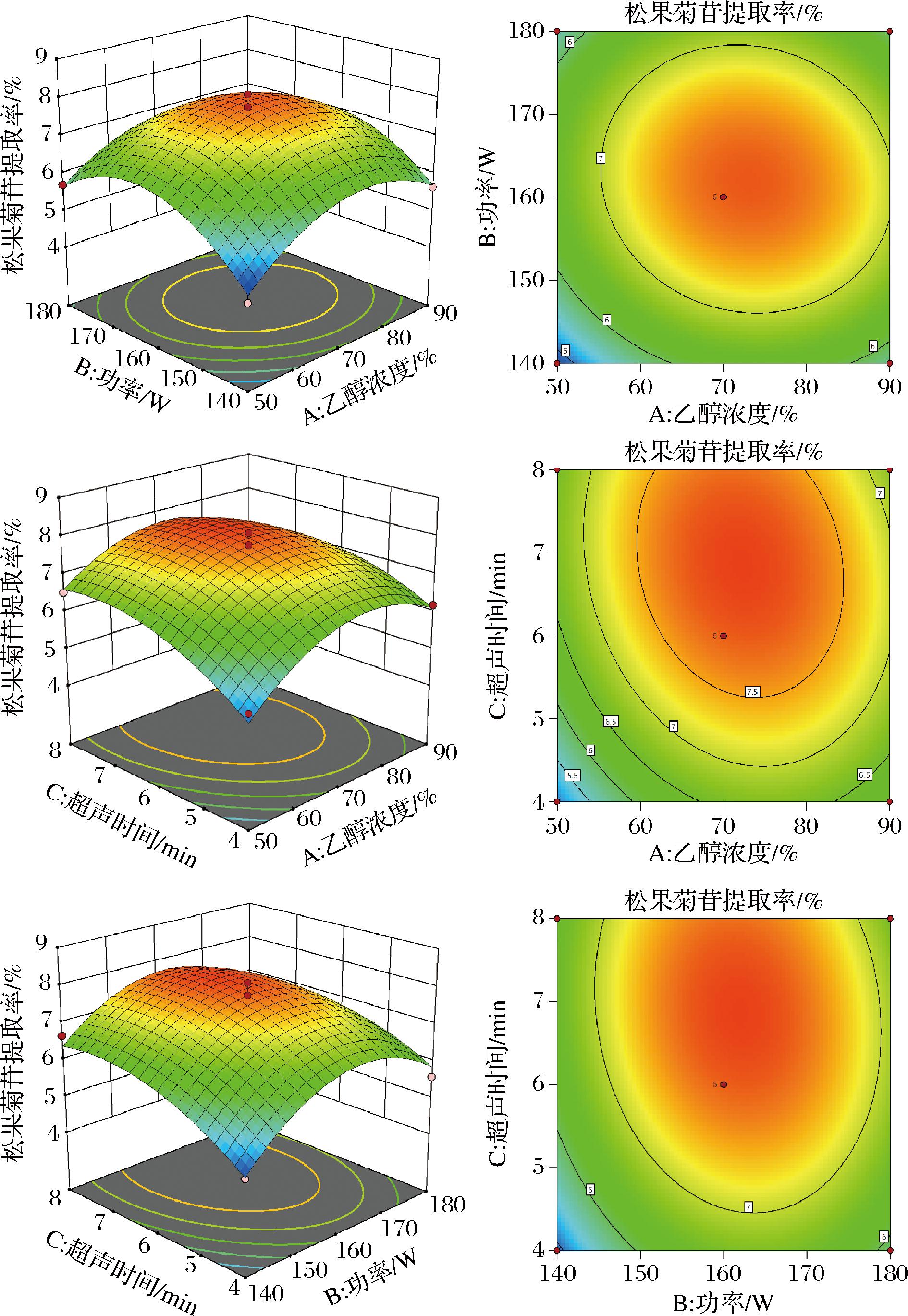
图2 各因素相互作用对管花肉苁蓉提取率影响的响应面与等高线图
Fig.2 Response surface and contour line diagram of the interaction of various factors on the extraction rate ofC. tubulosa
2.2 管花肉苁蓉提取物的体外抗氧化活性评价
2.2.1 自由基清除能力检测结果
通过不同浓度管花肉苁蓉提取物溶液、维生素C测定的DPPH自由基、ABTS阳离子自由基清除能力曲线如图3所示,在0.062 5~2.0 mg/mL内,随着浓度的增大,自由基清除率和还原能力逐渐升高,其中管花肉苁蓉提取物的ABTS阳离子自由基清除能力在1~2 mg/mL时高于维生素C对照,管花肉苁蓉提取物的DPPH自由基在2 mg/mL时清除能力接近维生素C对照,表现出良好的抗氧化活性,且与浓度呈现一定的线性关系。
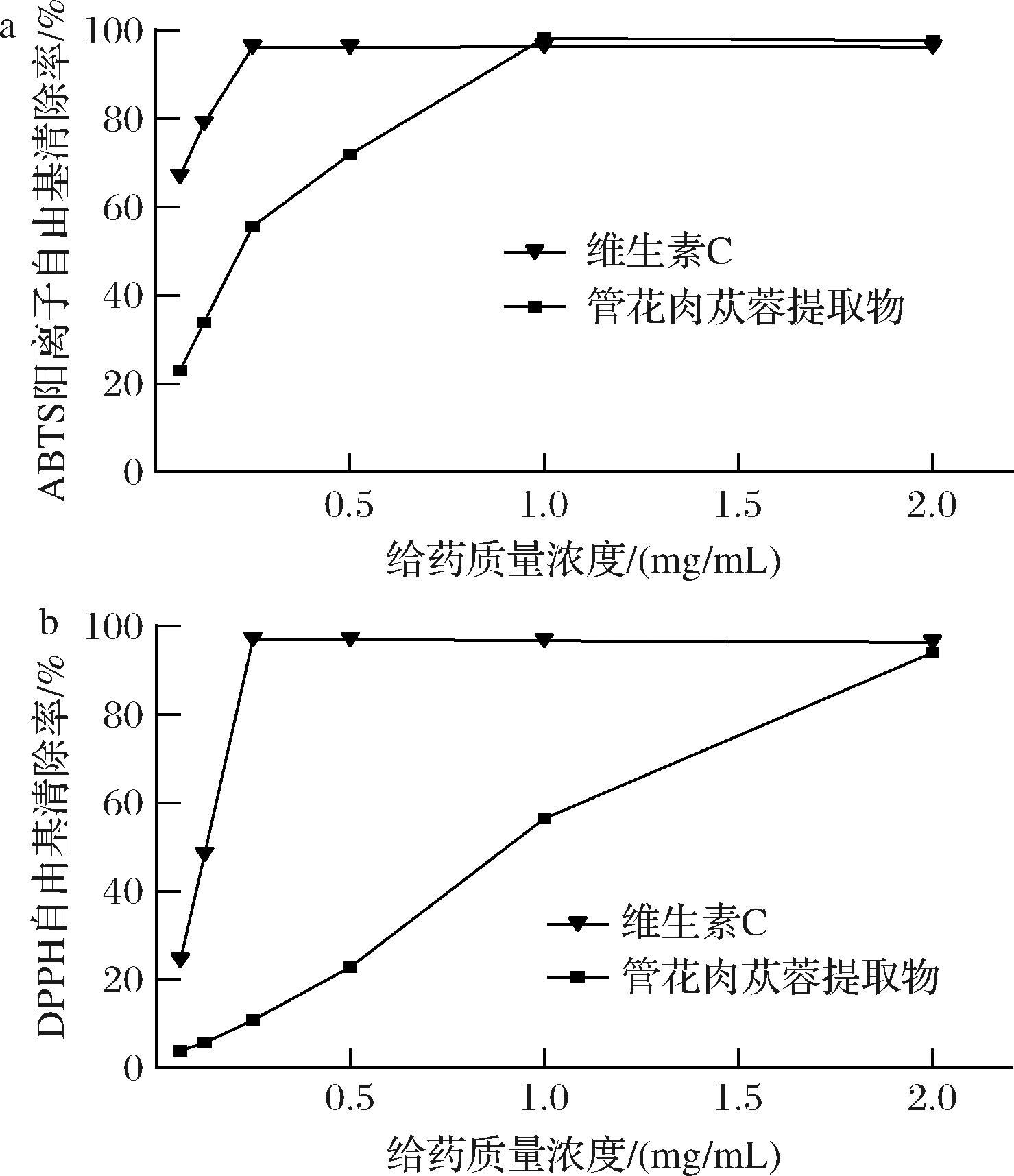
a-ABTS阳离子自由基清除曲线;b-DPPH自由基清除曲线
图3 管花肉苁蓉提取物各浓度下对ABTS阳离子自由基和DPPH自由基清除能力
Fig.3 ABTS free radical and DPPH free radical scavenging capacity of C. tubulosa extract at different concentrations
2.2.2 总还原力检测结果
抗氧化剂可将K3[Fe(CN)6]中Fe3+ 还原成Fe2+,生成K4[Fe(CN)6],K4[Fe(CN)6]与Fe3+生成的普鲁士蓝在700 nm处具有特征吸收;吸光度值越高说明抗氧化剂总还原能力越强。
如图4所示,随着样品浓度的增高,吸光值逐渐增大,样品的总还原能力越强,表明管花肉苁蓉提取物有一定的还原能力,且与浓度呈现一定的量效关系。
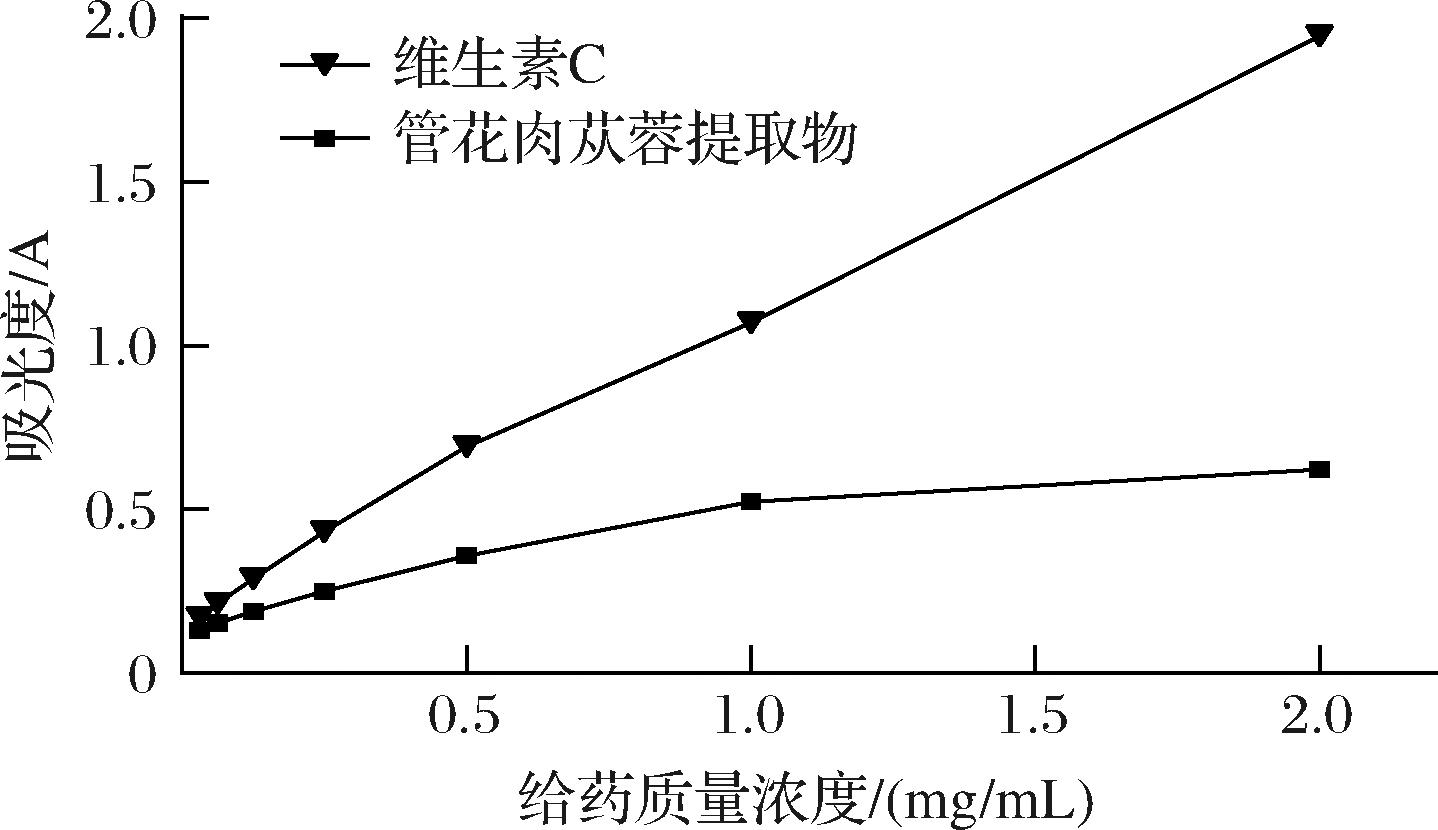
图4 管花肉苁蓉提取物各浓度还原能力的测定
Fig.4 Determination of reducing ability of extracts fromC. tubulosa at different concentrations
2.3 管花肉苁蓉提取物的体外美白活性评价
2.3.1 管花肉苁蓉提取物对B16细胞活力的影响
如图5所示,不同浓度管花肉苁蓉提取物对B16细胞的增殖无影响,各浓度细胞存活率均高于95%,与空白组相比无显著性差异(P>0.05)。说明管花肉苁蓉提取物在上述浓度区间下对B16细胞的活性无明显毒性作用。

a-提取物对b16细胞存活率影响;b-提取物对b16细胞组织影响
图5 管花肉苁蓉提取物对B16细胞活力影响及细胞组织学观察
Fig.5 Effect of C. tubulosa extract on B16 cell viability and cell histology observation
2.3.2 对B16细胞黑色素含量的影响
如图6所示,样品组的B16细胞黑色素含量明显低于空白组,差异具有统计学意义(P<0.000 1);当提取物质量浓度为50 mg/mL时,黑色素含量降低58.12%,差异具有统计学意义。管花肉苁蓉提取物能够高度抑制B16细胞中黑色素的生成,且明显呈剂量依赖。
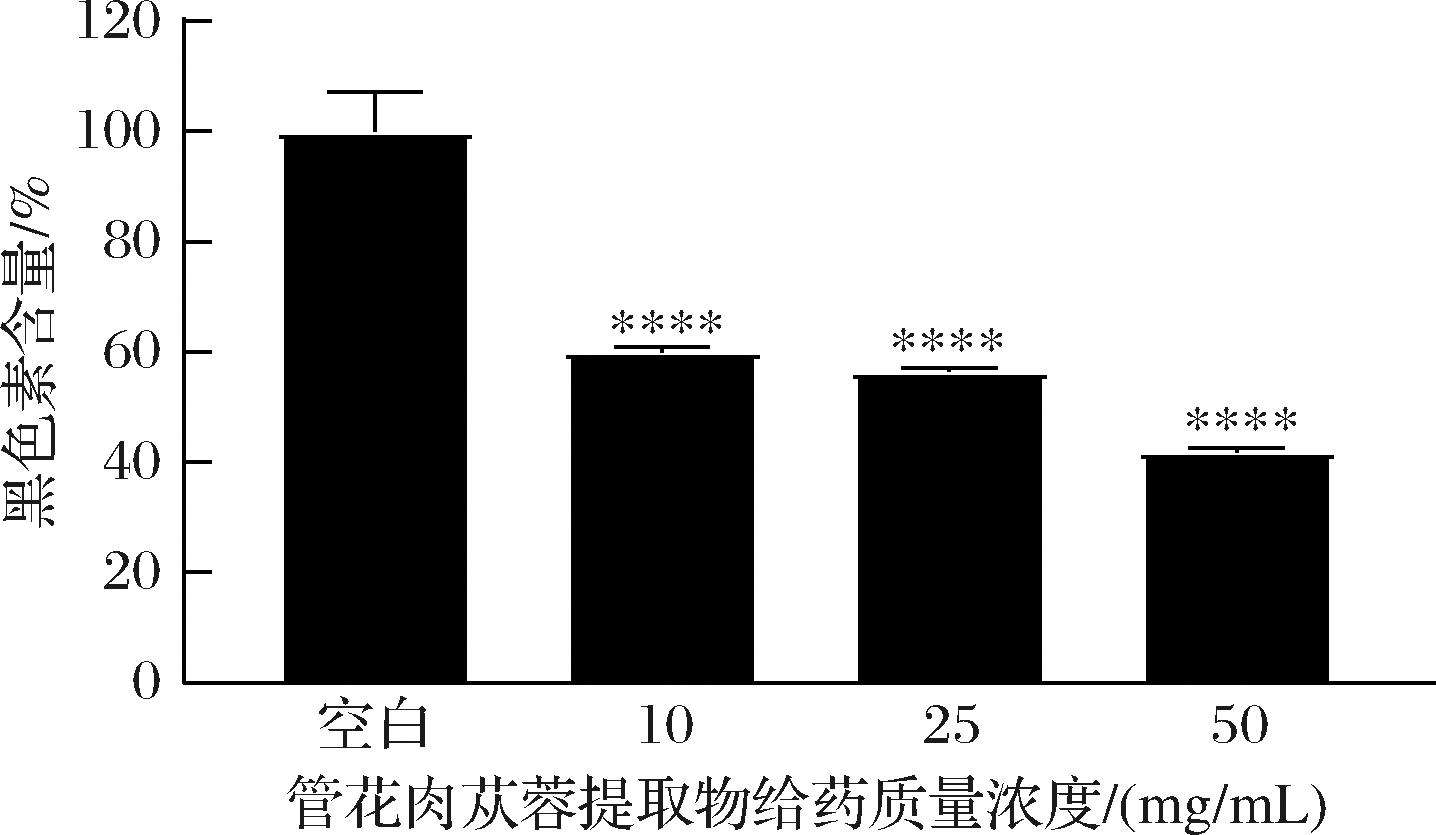
图6 管花肉苁蓉提取物对B16细胞黑色素含量的作用
Fig.6 Effect of C. tubulosa extract on the melanin content of B16 cells
注:****,与空白组差异极显著,P<0.001;误差棒为标准偏差,n=6(下同)。
2.3.3 对B16细胞TYR活性的影响
如图7所示,样品组的B16细胞TYR活性明显低于空白组,说明管花肉苁蓉提取物能够高度抑制B16细胞中TYR的活性,且明显呈剂量依赖。当提取物质量浓度为50 mg/mL时,对酪氨酸活性的抑制率达到32.10%,差异具有统计学意义(P<0.000 1),目前已知减少B16细胞黑色素生成的途径有很多,实验结果说明,管花肉苁蓉提取物对B16细胞黑色素合成的抑制作用可能是通过抑制TYR活性来实现的。
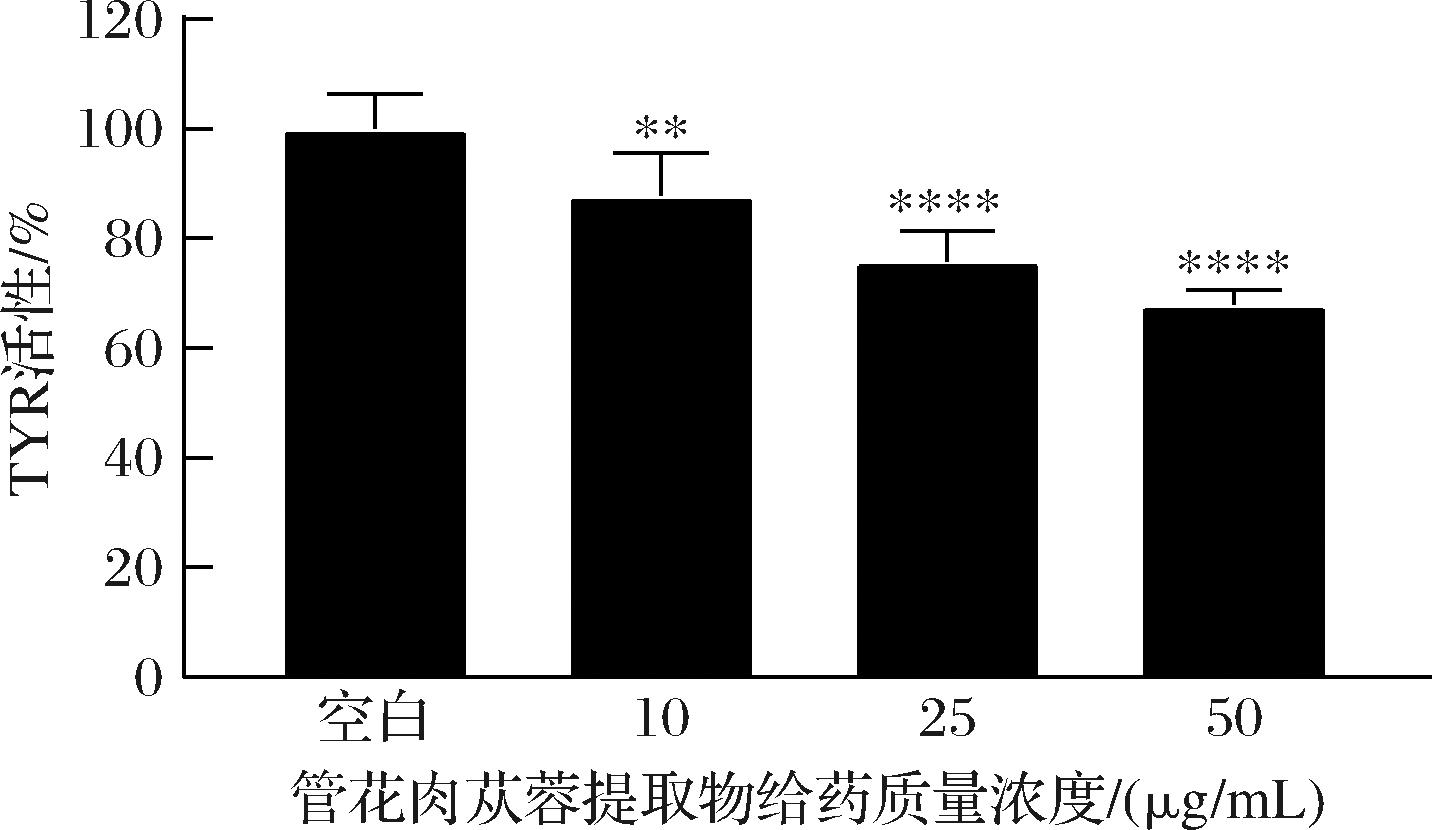
图7 管花肉苁蓉提取物对B16细胞TYR活性的比较
Fig.7 Comparison of the effects of extracts from C. tubulosaon the activity of tyrosinase in B16 cells
注:**,差异显著,P<0.01(下同)。
2.3.4 对黑素小体转运影响
按前述实验步骤上机检测,通过散点图FSC,SSC确定细胞所在位置,即不包括左下角的一团细胞,并设门(E2)分析E2中的细胞,通过散点图选择通道FL1、FL3,通过十字门确定细胞阳性占比,所得结果如图8所示。流式结果显示,空白对照组转移率为(11.6±1.06)%,经过UVB照射后,模型组转移率为(28.23±4.91)%,样品组中高浓度组转移率最低,为(12.77±1.08)%,中、低浓度转移率分别是(18.17±2.08)%、(22.67±2.27)%,均低于模型组。说明管花肉苁蓉提取物能够有效抑制黑素小体的转运,且呈明显的剂量依赖。
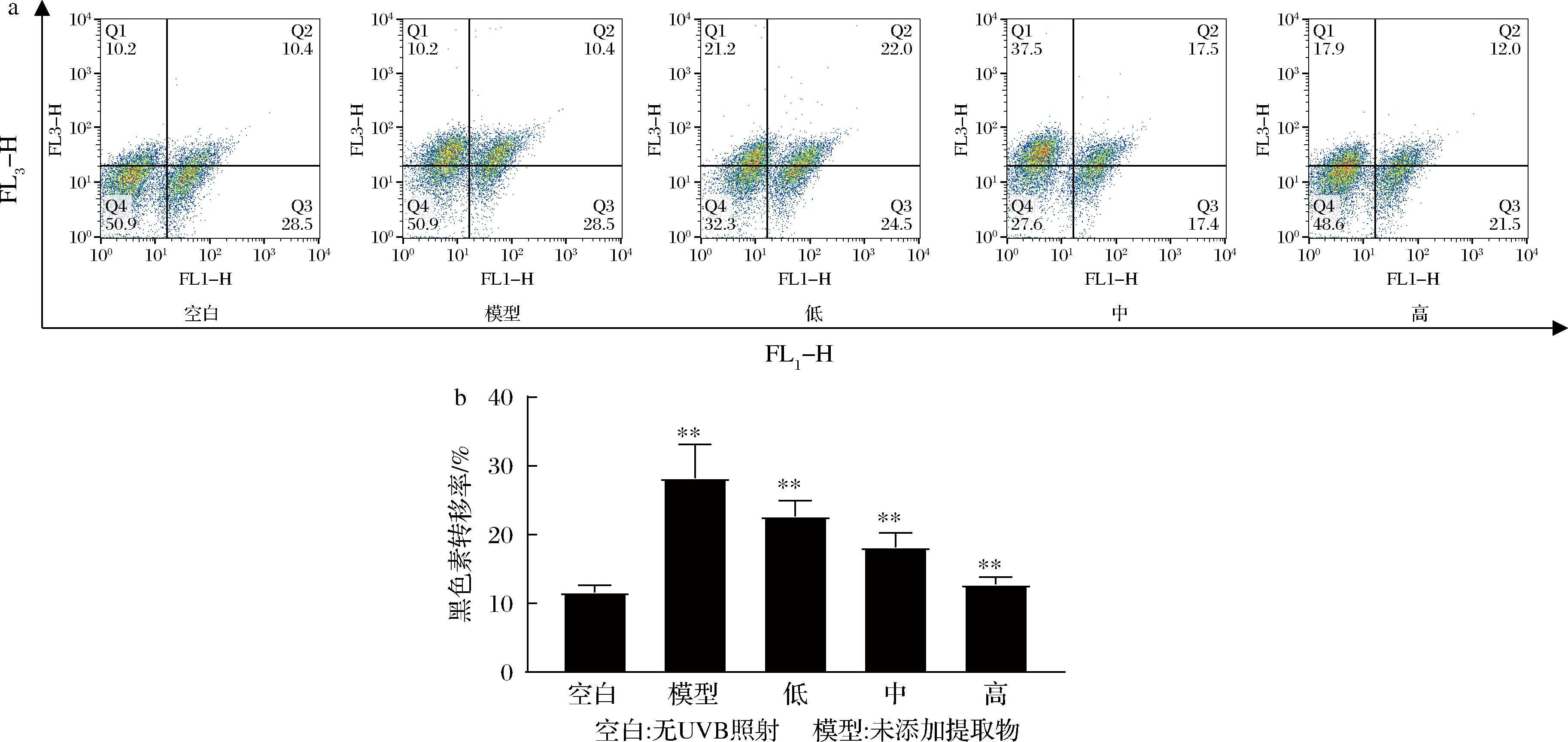
a-黑素小体转运量流式细胞术检测图;b-不同浓度提取物对黑素小体转运量影响
图8 管花肉苁蓉提取物对黑素小体转运量比较
Fig.8 Comparison of melanosome transport capacity of C. Tubulosa extract
注:管花肉苁蓉给药质量浓度低、中、高分别为10、50、100 mg/mL。
3 结论与讨论
本实验采用超声-微波法提取管花肉苁蓉中的活性物质,相较传统醇提法而言,苯乙醇苷类活性物质提取效率得到提升,提取物中松果菊苷等活性成分含量高,同时采用Box-Behnken响应面对此工艺进行优化,得出最优工艺条件为料液比1∶16,乙醇体积分数70%,超声功率160 W,超声时间6 min,以松果菊苷为检测指标提取物得率为8.09%。
在实验浓度范围内,管花肉苁蓉提取物表现出良好的DPPH自由基、ABTS阳离子自由基清除能力,在2 mg/mL下清除率与维生素C对照接近;管花肉苁蓉的提取物还原能力随浓度增强而增强,且呈现浓度依赖关系,表明管花肉苁蓉提取物具有良好的抗氧化能力。
本研究中管花肉苁蓉提取物显著降低B16细胞中黑色素含量、降低络氨酸酶活性,且有效抑制黑素小体的转运,并呈现剂量依赖,是潜在的天然黑色素抑制剂。后续可对其进行分离纯化,鉴定其活性结构,为管花肉苁蓉在医药、化妆品领域的应用提供理论依据。
[1] China, National Bureau of Statistics.(2021) Total turnover of Cosmetics[EB/OL].https://data.stats.gov.cn/.
[2] WANG B, AN X H, QU L P, et al.Review on oral plant extracts in skin whitening[J].Food Science and Technology.2022, 42:e83922.
[3] HU Y B, ZENG H L, HUANG J H, et al.Traditional Asian herbs in skin whitening:The current development and limitations[J].Frontiers in Pharmacology, 2020, 11:982.
[4] KANLAYAVATTANAKUL M, LOURITH N.Plants and natural products for the treatment of skin hyperpigmentation: A review[J].Planta Medica, 2018, 84(14):988-1006.
[5] MORIKAWA T, XIE H H, PAN Y N, et al.A review of biologically active natural products from a desert plant Cistanche tubulosa[J].Chemical &Pharmaceutical Bulletin, 2019, 67(7):675-689.
[6] WU C J, CHIEN M Y, LIN N H, et al.Echinacoside isolated from Cistanche tubulosa putatively stimulates growth hormone secretion via activation of the ghrelin receptor[J].Molecules, 2019, 24(4):720.
[7] LEI H B, XIN J Y, LV YANHUI, Effects of processing on the efficacy and metabolites of Cistanche tubulosa based on UPLC-Q/TOF-MS[J].Biomedical chromatography, 2023, 6(37):353-367.
[8] YUAN P F, FU C S, YANG Y, et al.Cistanche tubulosa phenylethanoid glycosides induce apoptosis of hepatocellular carcinoma cells by mitochondria-dependent and MAPK pathways and enhance antitumor effect through combination with cisplatin[J].Integrative Cancer Therapies, 2021, 20:15347354211013085.
[9] SONG Y L, ZENG K W, JIANG Y, et al.Cistanches Herba, from an endangered species to a big brand of Chinese medicine[J].Medicinal Research Reviews, 2021, 41(3):1539-1577.[10] WU L P, GEORGIEV M I, CAO H, et al.Therapeutic potential of phenylethanoid glycosides:A systematic review[J].Medicinal Research Reviews, 2020, 40(6):2605-2649.
[11] 杨峰, 李先芝, 胡杨, 等.管花肉苁蓉药材苯乙醇苷类成分研究[J].亚太传统医药, 2022, 18(10):91-95.YANG F, LI X Z, HU Y, et al.Study on phenylethanol glycosides in Cistanche tubulosa[J].Asia-Pacific Traditional Medicine, 2022, 18(10):91-95.
[12] YANG J H, WU S S, XU H H, et al.Inhibitory effects of phenylethanoid glycosides on melanin synthesis in cultured human epidermal melanocytes[J].International Journal of Clinical Experimental Medicine, 2016, 9(9):18019-18025.
[13] FACINO R M, CARINI M, ALDINI G, et al.Echinacoside and caffeoyl conjugates protect collagen from free radical-induced degradation:A potential use of Echinacea extracts in the prevention of skin photodamage[J].Planta Medica, 1995, 61(6):510-514.
[14] 张迪, 张娟利, 马忠英.毛蕊花糖苷对中波紫外线所致小鼠皮肤损伤的保护作用研究[J].中药新药与临床药理, 2023, 34(1):57-63.ZHANG D, ZHANG J L, MA Z Y.Study on the protective effect of verbascoside on the skin damage induced by UVB in mice[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2023, 34(1):57-63.
[15] 宫晓庆. 管花肉苁蓉苯乙醇总苷提纯工艺及其应用研究[D].北京:北京石油化工学院, 2020.GONG X Q.Study on purification technology and application of phenylethanol glycosides from Cistanche tubulosa[D].Beijing:Beijing Institute of Petrochemical Technology, 2020.
[16] 鲜诗敏, 赵德刚, 杨红.辣椒籽不溶性膳食纤维碱法提取工艺研究及其理化性质分析[J].食品与发酵工业, 2023,49(10):206-212;229.XIAN S M, ZHAO D G, YANG H.Study on extraction process of insoluble dietary fiber base method of pepper seed and analysis of its physicochemical properties[J].Food and Fermentation Industries, 2023, 49(10):206-212;229.
[17] 魏玉萍, 赵岩, 张丽, 等.超声波辅助提取管花肉苁蓉苯乙醇苷工艺优化及其抗氧化活性研究[J].食品工业科技, 2022, 43(13):148-155.WEI Y P, ZHAO Y, ZHANG L, et al.Optimization of ultrasonic-assisted extraction of phenylethanoside from Cistanche tubulosa and its antioxidant activities[J].Science and Technology of Food Industry, 2022, 43(13):148-155.
[18] 姚辛敏, 周晓洁, 周妍妍.肉苁蓉化学成分及药理作用研究进展[J].中医药学报, 2021, 7(2):93-97.YAO X M, ZHOU X J, ZHOU Y Y.Research progress in chemical components and pharmacological effect of herba Cistanche[J].Acta Chinese Medicine and Pharmacology, 2021, 7(2):93-97.
[19] BALIYAN S, MUKHERJEE R, PRIYADARSHINI A, et al.Determination of antioxidants by DPPH radical scavenging activity and quantitative phytochemical analysis of Ficus religiosa[J].Molecules, 2022, 27(4):1326.
[20] SCHNEIDER-TEIXEIRA A, MOLINA-GARC A A D, ALVAREZ I, et al.Application of betacyanins pigments from Alternanthera brasiliana as yogurt colorant[J].LWT, 2022, 159:113237.
A A D, ALVAREZ I, et al.Application of betacyanins pigments from Alternanthera brasiliana as yogurt colorant[J].LWT, 2022, 159:113237.
[21] 庄文越, 苏小明, 赵鸣瑶, 等.安五脂素对α-黑色素细胞刺激素诱导的小鼠黑色素瘤B16F10细胞中黑色素生成的影响及机制[J].中国药理学与毒理学杂志, 2022, 36(5):364-369.ZHUANG W Y, SU X M, ZHAO M Y, et al.Effect and mechanism of anwulignan on melanocyte-stimulating hormone-induced melanin production in B16F10 melanoma cells[J].Chinese Journal of Pharmacology and Toxicology, 2022, 36(5):364-369.
[22] 张娅妮, 王国良, 韩齐齐, 等.猕猴桃皮多酚提取及其对B16细胞黑色素的影响[J].农业工程学报, 2022, 38(7):317-325.ZHANG Y N, WANG G L, HAN Q Q, et al.Extraction of the polyphenols from kiwifruit peel and its effect on melanin in B16 cells[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(7):317-325.
[23] 窦晨, 丁雄, 潘蕊, 等.葡萄籽原花青素及其柔性纳米脂质体的抗氧化及对酪氨酸酶活性的抑制作用[J].中国药业, 2022, 31(19):44-50.DOU C, DING X, PAN R, et al.Antioxidation and inhibition of tyrosinase activity of grape seed proanthocyanidins and their flexible nano-liposomes[J].China Pharmaceuticals, 2022, 31(19):44-50.