2017—2021年是中国奶酪行业发展的黄金时期,政策上不断出台相关文件规范其行业标准,在此背景下,中国奶酪零售渠道销售额从52亿元增长到131亿元。其中,以奶酪条、奶酪片为代表的重组奶酪年复合增长率达到34.9%。2018年,中国市场上出现了一种名为“奶酪棒”的产品,近几年发展十分迅猛。2021年,奶酪棒的市场份额已达百亿。
奶酪棒是以天然奶酪作为主要原料,加入油脂(黄油、植物油)、糖(蔗糖、葡萄糖、玉米糖浆、水解乳糖)以及一些营养强化组分(浓缩乳蛋白、乳粉、果酱、维生素、钙盐等)[1],配合乳化盐(柠檬酸钠、焦磷酸钠、六偏磷酸钠、混合磷酸盐)、酸度调节剂(乳酸、磷酸盐)[1]、防腐剂(山梨酸钾)、亲水胶体(刺槐豆胶、卡拉胶、黄原胶、瓜尔胶、魔芋胶、明胶)[2]、香精、色素、甜味剂制成的高营养密度的儿童食品[3]。国标规定再制干酪中原制干酪含量必须在一半以上,添加或不添加食品添加剂和营养强化剂,经加热、搅拌、乳化(干燥)、冷却定型等工艺制成的产品。干酪制品中原制干酪含量在15%~50%,添加其他原料,添加或不添加食品添加剂和营养强化剂,经加热、搅拌、乳化(干燥)等工艺制成的产品[4]。
奶酪棒中含有丰富的蛋白质、维生素及微量元素、多样的风味口感、丰富可调节的形态外观、丰富的包装深受青少年儿童的喜爱以及家长的认可。基于奶酪棒的原制干酪含量,市场上的奶酪棒品类涵盖再制干酪和干酪制品。作为一种针对儿童设计的高营养密度食品,奶酪棒不仅富含牛奶蛋白、乳脂肪和多种维生素等营养成分,而且在外观、风味和质地口感上具有多样性和可调性,深受儿童群体的青睐。为了实现其多样化的质地和形态,奶酪棒的生产过程中往往依赖于亲水胶体的添加。其中,刺槐豆胶(locust bean gum, LBG)作为一种广泛应用于奶酪产品中的亲水胶体,几乎出现在所有市售奶酪棒中。然而,与LBG同属半乳甘露聚糖(galactomannan, GM)的其他多糖在奶酪棒中的应用却相对匮乏。奶酪棒的生产高度依赖于LBG,但该多糖存在依赖进口和成本高昂的问题。在当前的研究中,使用总含量为35%(质量分数)的新鲜马苏里拉奶酪以及蔗糖、黄油、乳化盐、水、亲水胶体和酸度调节剂构建了一个替代/模拟奶酪产品模型。通过分析样品的流变学、质构、水分分布和微观结构,比较了样品中LBG、瓜尔豆胶(guar gum GG)和皂荚糖胶(Gleditsia sinensis Lam gum, GLG)应用效果的差异,以阐明模拟奶酪如此依赖LBG的原因,为不同GM在奶酪棒中的应用提供参考。
1 材料与方法
1.1 原料与仪器
1.1.1 原料
LBG、GG、乳酸,浙江一诺生物科技有限公司;卡拉胶,济南东轩生物工程有限公司;GLG,中国优研生物技术有限公司;焦磷酸钠、柠檬酸钠,河南万邦化工科技有限公司;蔗糖,成都太古糖业有限公司;新西兰黄油,新西兰恒天然集团;马苏里拉奶酪,青岛百岁来食品有限公司。
1.1.2 仪器
TA-XT plus质构分析仪、DISCOVERY HR-3流变仪,美国 TA 仪器公司;TM6多功能料理机,德国福维克家电公司;MesoMR23-060V-I低场核磁共振分析仪,苏州纽迈分析仪器股份有限公司;Thermo-Lynx 4000冷冻离心机,美国赛默飞世尔科技公司;TCS SP8激光共聚焦显微镜,德国徕卡显微系统公司;Brookfield DV2T黏度计,美国博勒飞仪器公司。
1.2 试验方法
1.2.1 样品制备方法
GM溶液制备:倒入适量水于烧杯加热至90 ℃;将烧杯包裹一层锡纸,在磁力搅拌器上90 ℃搅拌;在转速为1 000 r/min时加入多糖,分散均匀后将转速调至600 r/min;在溶液表面铺上一层保鲜膜,搅拌2 h。
奶酪制品(奶酪棒)制备流程:将奶酪和黄油切碎,加入乳化盐和水,加热并以500 r/min搅拌至95 ℃(约2.5 min);加入蔗糖、胶体和乳酸的混合物,以1 000 r/min、90 ℃搅拌5.5 min;将转速调至500 r/min,搅拌1 min;注入模具并在4 ℃下冷藏24 h。
1.2.2 温度扫描
将流变仪样品台升温至80 ℃,倒入样品。在板间间隙值为1 050 μm处修边,并使用硅油封闭边缘裸露部分。随后将板间间隙值调至1 000 μm静置60 s后进行测试。测试条件:Oscillation Temperation Ramp进行测试。频率1 Hz、应变1%(通过应变扫描测试获得)的小振幅振荡进行温度扫描。测试期间,温度以每分钟2 ℃的速度从80 ℃降至4 ℃[5]。
1.2.3 频率扫描
样品在80 ℃保温。将流变仪样品台升温至80 ℃,倒入样品。将gap值调整为1 050 μm进行修边,随后将板间间隙值调整为1 000 μm。将样品台温度调整为4 ℃,温度到达后静置120 s开始测试[6]。测试条件:Oscillation Frequency进行测试,设置应变1%、温度4 ℃,在频率0.01~100 Hz的范围内进行频率扫描。
1.2.4 流动性与黏度分析
参照武晗等[7]的方法。取3 g奶酪制品放置于直径2 cm的玻璃管中。在70 ℃的水浴锅中将奶酪制品预热5 min。平放等待内部样品的自然流动,待冷却凝固后测量流动长度。将奶酪置于70 ℃水浴锅中直至完全融化。使用黏度计进行黏度测试。测试条件:转子LV-04(64),转子转速28 r/min,温度70 ℃,测试时间1 min,每10 s取平均值。
1.2.5 低场核磁分析
取4 g样品,使用保鲜膜包裹。25 ℃使用低场核磁共振分析仪。测试参数:Prg:3,Tw:2 000 ms,TE:0.500 ms,NECH:6 000,NS:4[8]。
1.2.6 持水能力分析
样品制备好后,4 ℃冷藏24 h取出。取30 g样品于50 mL离心管中,在室温(25 ℃)下静置30 min以备测试。使用冷冻离心机25 ℃、9 000 r/min将样品离心45 min。分离上层固体,称量总质量(ma)及渗出水的质量(mw)[9]。样品的持水能力按公式(1)计算:
持水能力![]()
(1)
1.2.7 质构分析
将凝固后的奶酪棒样品切为块状(3 cm×3 cm×2 cm)准备测试。选择P25探头使用质构分析仪对样品进行全质构测试。测试条件:测试前速度2.5 mm/s,测试速度2.5 mm/s,测试后速度2.5 mm/s。触发力5 g,测试距离5 mm。测试环境温度25 ℃[10]。
1.2.8 激光共聚焦显微结构
使用在样品成型后,取少量样品冷冻。使用冷冻切片机对样品进行切片,切片厚度30 μm。分别取5 μL溶于酒精的尼罗红(1 mg/mL)和尼罗兰(1 mg/mL)滴于样品表面,分别对蛋白和油脂进行染色,染色时间30 s。染色完毕使用酒精冲洗多余染料。使用激光共聚焦显微镜对样品进行观察。使用488 nm激发波长的荧光模式观察染色的脂肪球[11]。使用633 nm激发波长的荧光模式观察染色的蛋白[12]。
2 结果与分析
2.1 GM溶液的凝胶行为
如图1所示,在同为1%(质量分数)GM溶液当中,随着温度的降低,储能模量(G′)和损耗模量(G″)都在逐步增加。这是因为温度降低,多糖与水之间形成的氢键增多所导致的[6, 13]。其中GLG水溶液的G′和G″最大,LBG次之。G′和G″最低的是GG溶液,并且数值远远小于LBG和GLG。随着温度的降低,LBG和GLG的G′和G″有着明显的增加,而GG的变化却不明显。这可能是由于GG较高的半乳糖含量带来的空间位阻使其在较低温度下依然保持着舒展的分子链。而GLG和LBG因为分子链内和链间的空间位阻较小,因此在冷却过程中分子链容易卷曲缠结,链内和链间容易形成氢键,强化了体系的强度[14]。在测试的浓度和温度变化范围内只有GLG出现凝胶行为。LBG和GG溶液并未出现凝胶行为,溶液状态处于弱黏性或纠缠溶液[6]。这些不同的凝胶性能由于GM分子质量、半乳糖和甘聚糖的比例不同而造成较大的性质差异[15]。
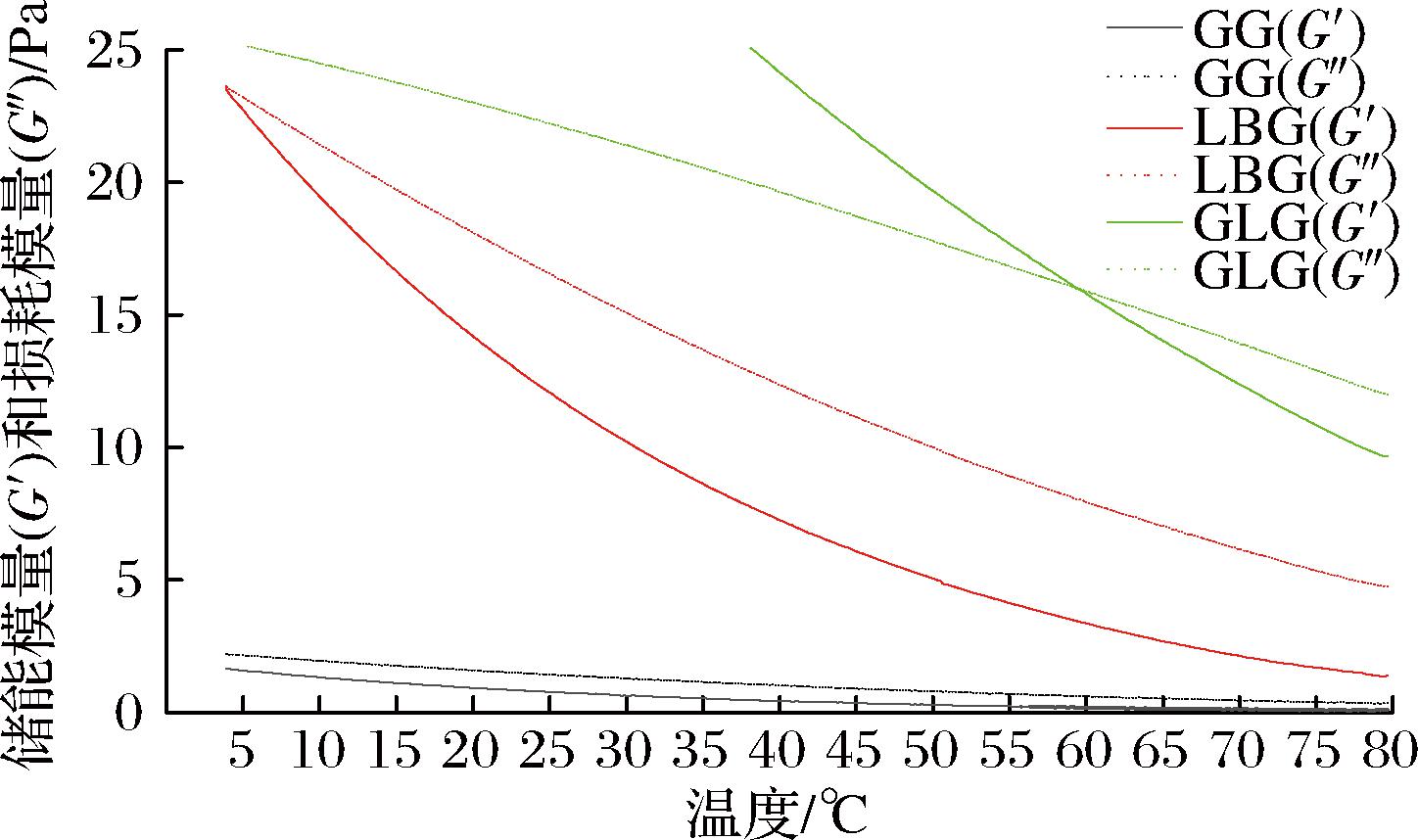
图1 水凝胶模量随温度的变化
Fig.1 Variation of hydrogel modulus with temperature
2.2 GM对奶酪棒浆料凝胶行为的影响
 ERN
ERN KOV
KOV 等[16]利用冷却振荡研究了奶酪类似物复合剪切模量的变化,重点是通过研究冷却振荡过程中能量储存模量和损失模量的相对变化来分析奶酪类似物的凝胶行为。本研究中也将凝胶点位作为重要的参考指标。G′和G″的交叉点作为凝胶点可以反映样品凝胶和流动状态的转变[17],以此来探究胶体的添加与奶酪制品凝胶行为变化的影响。如图2所示,所有样品随着多糖添加量的增加,其凝胶温度逐渐升高,这可能是由于更多的胶体代表着它将抢占体系当中更多的水分与其生成氢键,导致体系内的流动水减少,G′和G″升高[13],体系流动性下降,促进了体系的凝胶行为。添加了LBG和GG的样品在80 ℃时,奶酪浆料的G″>G′,样品属于流体(图2-a、图2-c)。在添加GLG的样品当中,当GLG的添加量达到0.36%(质量分数,下同)及更高浓度时,样品在80 ℃已呈凝胶态(图2-b)。有研究报道了LBG不凝胶的特性,可能是由于这个原因导致了添加LBG的样品在较高浓度下依然处于流动态[18]。这也与前文中LBG溶液频率扫描中难以出现G′、G″交叉点的现象相吻合,而添加GG的样品在较高浓度下能处于流动态的原因可能是较低的分子质量,较短的链长带来的低交联能力,因此对体系结构强度的增加并不明显。至于GLG溶液随温度的降低能够体现出溶胶与凝胶状态的转变。因为一定浓度的GLG在本体系中可以形成凝胶,即GLG在本体系中除了水和之外,依靠自身的凝胶能力使体系呈现凝胶状态。
等[16]利用冷却振荡研究了奶酪类似物复合剪切模量的变化,重点是通过研究冷却振荡过程中能量储存模量和损失模量的相对变化来分析奶酪类似物的凝胶行为。本研究中也将凝胶点位作为重要的参考指标。G′和G″的交叉点作为凝胶点可以反映样品凝胶和流动状态的转变[17],以此来探究胶体的添加与奶酪制品凝胶行为变化的影响。如图2所示,所有样品随着多糖添加量的增加,其凝胶温度逐渐升高,这可能是由于更多的胶体代表着它将抢占体系当中更多的水分与其生成氢键,导致体系内的流动水减少,G′和G″升高[13],体系流动性下降,促进了体系的凝胶行为。添加了LBG和GG的样品在80 ℃时,奶酪浆料的G″>G′,样品属于流体(图2-a、图2-c)。在添加GLG的样品当中,当GLG的添加量达到0.36%(质量分数,下同)及更高浓度时,样品在80 ℃已呈凝胶态(图2-b)。有研究报道了LBG不凝胶的特性,可能是由于这个原因导致了添加LBG的样品在较高浓度下依然处于流动态[18]。这也与前文中LBG溶液频率扫描中难以出现G′、G″交叉点的现象相吻合,而添加GG的样品在较高浓度下能处于流动态的原因可能是较低的分子质量,较短的链长带来的低交联能力,因此对体系结构强度的增加并不明显。至于GLG溶液随温度的降低能够体现出溶胶与凝胶状态的转变。因为一定浓度的GLG在本体系中可以形成凝胶,即GLG在本体系中除了水和之外,依靠自身的凝胶能力使体系呈现凝胶状态。

a-LBG;b-GLG;c-GG
图2 添加不同GM的奶酪棒凝胶转化点
Fig.2 Gel transformation point of cheese stick with different GMs
2.3 GM对奶酪棒模量的影响
如图3所示,添加GLG的样品当中,较低的添加量反而会导致G′和G″的降低。当胶体浓度进一步升高的时候,才会出现胶体添加对体系凝胶强度的增益效果(图3-b)。添加LBG的样品,在添加量为0.12%时其G′和G″高于对照组。添加0.36%和0.60% LBG时G′和G″降低,当LBG含量进一步升高时(0.80%)G′和G″升高。而GG的少量添加对体系的凝胶强度有一定的提升。但随着添加量的增加,样品的G′和G″进一步下降(图3-c)。
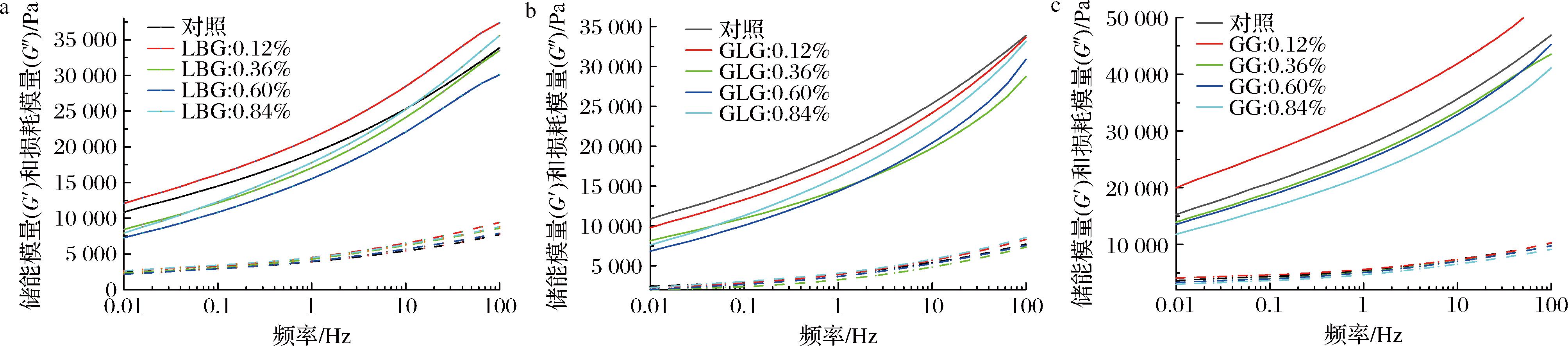
a-LBG;b-GLG;c-GG
图3 添加不同GM的奶酪棒模量随频率的变化
Fig.3 Variation of modulus with frequency in cheese stick with different GMs
不同于添加GLG的样品,LBG少量添加(0.12%)促使G′和G″的上升。可能因为LBG与卡拉胶的协同作用[19]。进一步添加时,才会出现和含GLG样品一致的G′和G″下降的现象。出现这种情况的原因可能是胶体的添加可能破坏了体系中原本存在的卡拉胶、蛋白凝胶结构[13]。GG的分子质量比较小,而且还有大量半乳糖导致其分子链的长度进一步减小。从这个角度来说,GG是半乳糖含量高,分子质量比较小导致了链长更短的GM。LBG和GLG则是分子质量更大,链长更长的GM。因此后两者在乳液凝胶体系中所占据的空间更大。与体系中的其他体系更容易产生空间上的相互作用,即与其他大分子的冲突(耗尽絮凝)更容易体现出来[20]。
添加LBG和GLG的样品,在添加浓度进一步提高后,G′和G″进一步提高。此时两者对体系的影响逐渐占据主导地位(体现为G′和G″的提高)。此时由于2种胶体与体系其他组分的冲突作为次要因素被掩盖。而在添加GG的样品当中,随着GG的添加量进一步提高,其所占的空间更大。GG与其他组分的冲突逐渐体现出来,所以表现出G′和G″降低的现象[21]。
2.4 GM对奶酪棒流动性与黏度的影响
奶酪的流动性是评价奶酪性质的常见指标,其与流变学属性的相关性极大。具体到本体系中,在较高的温度下奶酪中的乳脂转变为液态作为奶酪流动的驱动力[22],而最终的流动情况则是取决于包裹乳脂的连续相的性质。如图4所示,奶酪棒浆料的流动性与相应的黏度呈负相关,即随着黏度的升高奶酪的流动性降低。其中含有LBG的样品表现出最高的黏度,其次是GLG,GG的样品黏度最低。虽然同等含量下,添加LBG样品的黏度要高于添加GLG的样品,但是其流动性略微优于添加GLG的样品。这可能是由于LBG不凝胶的特性导致样品更加偏向于流动态,BANVILLE等[23]的结论也印证了凝胶状态与流动性的关系。流变温度扫描分析中GLG与LBG模量变化情况也印证了这一结论。添加了GG的奶酪棒浆料黏度最低,其流动性明显比其他两组流动性好。这说明黏度对流动性的影响占主导地位。
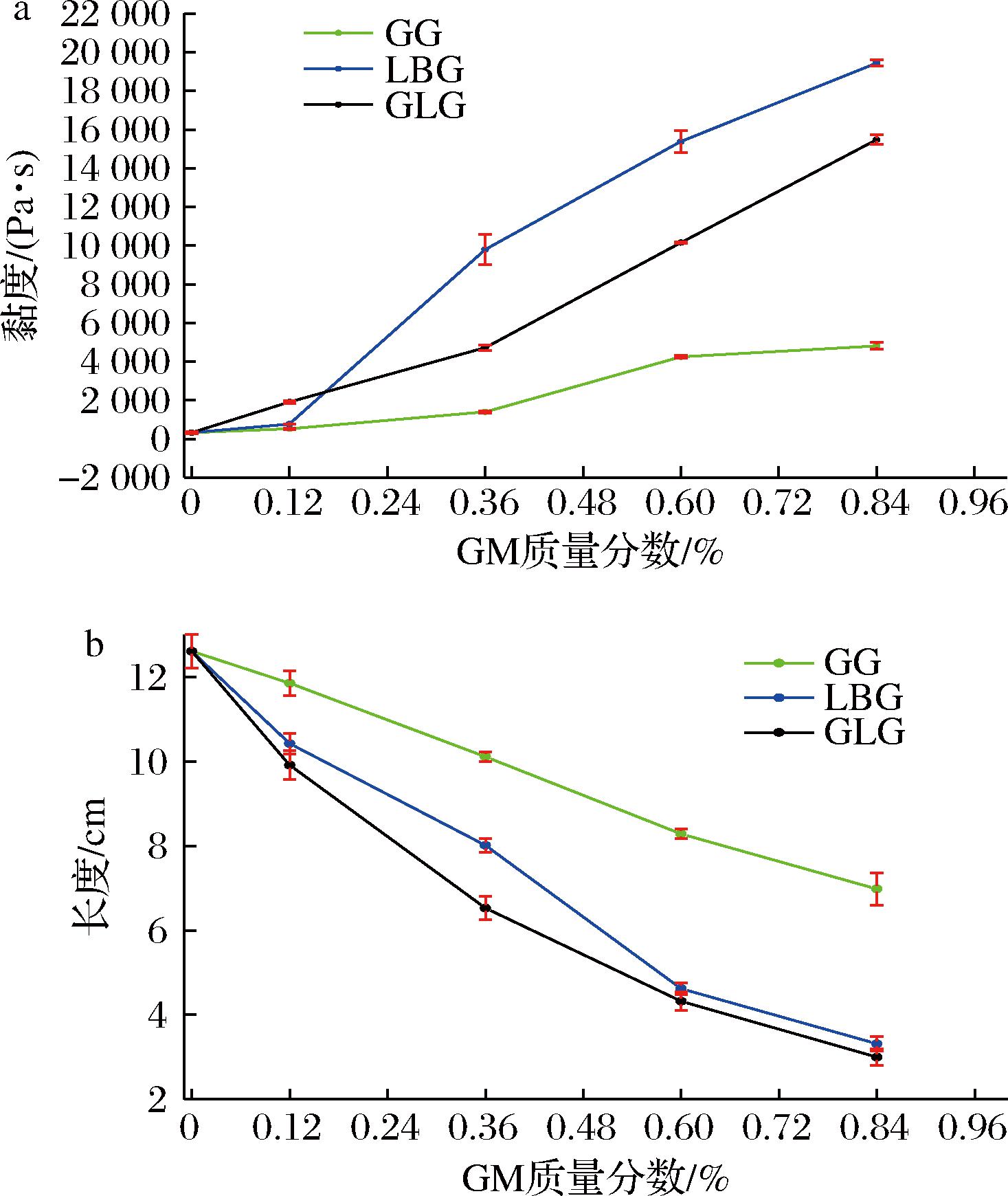
a-黏度;b-流动性
图4 不同GM添加量样品70 ℃下的黏度与流动性
Fig.4 Viscosity and fluidity of samples with different GM content at 70 ℃
综上,较低的黏度以及偏向于流体的样品流动性更好,其中黏度的影响更大。
2.5 GM对奶酪棒水分分布的影响
食物系统中的水主要有3种状态:结合水、半结合水和自由水。如图5所示,将1~10 ms的峰值定义为T21,10~50 ms的峰值定义为T22,50~200 ms的峰值被定义为T23。低场核磁共振中弛豫时间的增加表明水分子的自由度逐渐增加[24]。T21区域可归因于与极性基团紧密结合的水分子层中氢质子的弛豫。这是结合水的信号[25]。T22代表半结合水。这些水分子与亲水大分子结合较弱,流动性较强,位于亲水基团附近[26]。T23区域代表自由度较高的水,即凝胶网络中捕获的水分子以及血清水[27]。对照组只有2个峰值。4~10 ms处的弛豫代表与酪蛋白极性基团紧密结合的水(T21),20~300 ms处的弛豫代表半结合水、蛋白质/多糖凝胶网络中捕获的水质子和血清水(T23)。
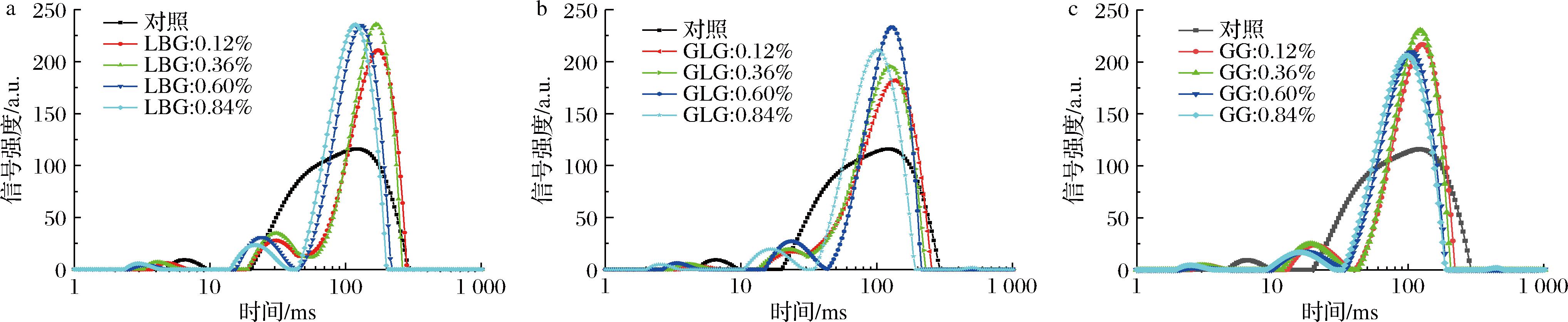
a-LBG;b-GLG;c-GG
图5 添加不同GM的奶酪棒水分分布
Fig.5 Water distribution of cheese stick with different GMs
在添加了GG/LBG/GLG 的样品中,10~50 ms处出现了一个新的弛豫峰。这表明添加LBG后,体系中部分水分子的自由度降低。这部分水处于半结合状态,聚集在水胶体分子周围。
添加0.12%的LBG和GLG的样品中T23的弛豫时间延长,表明这部分水的自由度更高。这可能是由于LBG、GLG的加入破坏了原有的酪蛋白/多糖凝胶系统,导致被原有凝胶系统截留的水自由度更高。而添加GG的样品并未出现这种情况,说明GG与本体系的相容性更高。
在表1中,随着胶体添加量的增加(0.12%、0.36%、0.60%和0.84%),T22和T23峰的弛豫时间逐渐减小。这表明水的自由度随着GM添加量的增加而降低。T22松弛时间缩短的原因是水胶体具有很强的水合能力,可以与水分子形成氢键,从而降低水分子的自由度。T23弛豫时间减小的潜在原因是多糖含量增加,形成更致密的网络结构,从而使保水能力更强[24]。
表1 不同GM添加量下样品的弛豫时间 单位:ms Table 1 Relaxation time of samples with different GM addition
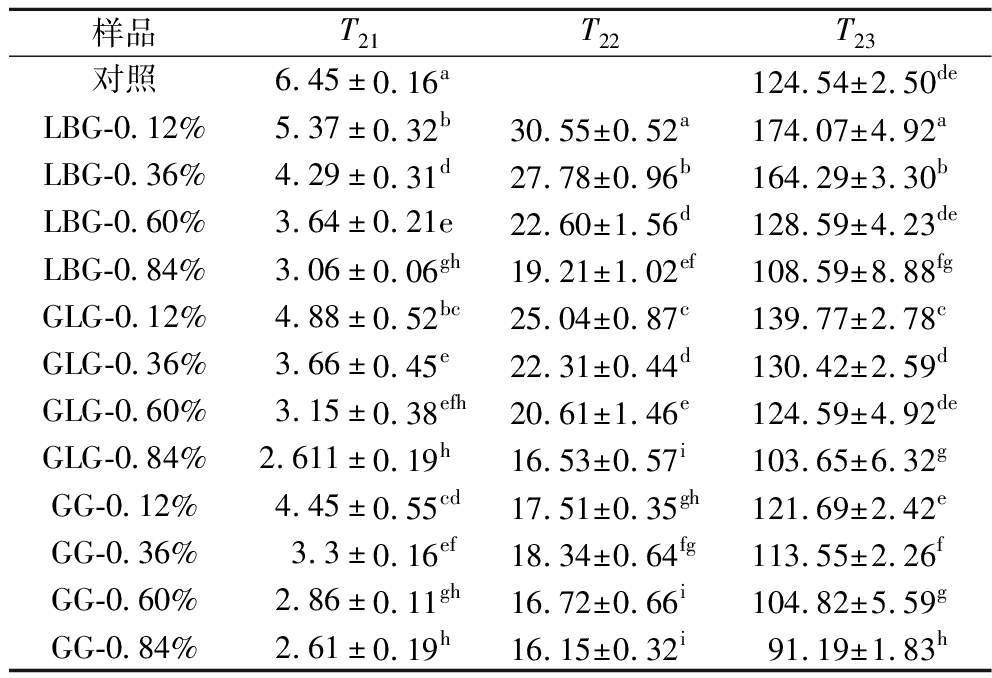
样品T21T22T23对照6.45±0.16a124.54±2.50deLBG-0.12%5.37±0.32b30.55±0.52a174.07±4.92aLBG-0.36%4.29±0.31d27.78±0.96b164.29±3.30bLBG-0.60%3.64±0.21e22.60±1.56d128.59±4.23deLBG-0.84%3.06±0.06gh19.21±1.02ef108.59±8.88fgGLG-0.12%4.88±0.52bc25.04±0.87c139.77±2.78cGLG-0.36%3.66±0.45e22.31±0.44d130.42±2.59dGLG-0.60%3.15±0.38efh20.61±1.46e124.59±4.92deGLG-0.84%2.611±0.19h16.53±0.57i103.65±6.32gGG-0.12%4.45±0.55cd17.51±0.35gh121.69±2.42eGG-0.36%3.3±0.16ef18.34±0.64fg113.55±2.26fGG-0.60%2.86±0.11gh16.72±0.66i104.82±5.59gGG-0.84%2.61±0.19h16.15±0.32i91.19±1.83h
注:同列数据上标的不同字母表示数据间有显著性差异(P<0.05)(下同)。
随着水胶体含量的增加,水分子的自由度降低。这与质构分析和持水能力的结果一致。在凝胶含量相同的情况下,添加GLG的样品的弛豫峰早于添加LBG的样品,其结合水的能力更强。这归因于GLG形成凝胶结构的能力。在流变温度扫描中,含0.36% GLG的浆料在80 ℃时已处于凝胶状态,与上述发现相吻合。添加GG的样品弛豫峰早于添加LBG的样品可能归因于GG的添加并不影响原有的凝胶结构,这与它的分子质量大小、分子链长度以及结构有关。
2.6 GM对奶酪棒持水性的影响
多糖的存在除了可以改善奶酪的质构属性之外,还可以维持好体系水相的稳定,防止水分渗出。如图6所示,添加0.12% GLG或LBG的样品的水分渗出量反而高于对照组不添加多糖的样品。随着胶体添加量的增加(0.12%至0.84%),样品水分的渗出量逐渐减少,持水能力增强。对照组的水分渗出量为24.97%,添加0.12% LBG/GLG的凝胶的水分渗出量为34.7%和30.63%,高于对照组。这是因为多糖分子的添加破坏了原有酪蛋白/多糖凝胶的结构,导致持水能力下降[28-29]。在添加了GM的样品中,体系的持水能力随着胶体含量的增加而增强。当胶体添加量为0.12%时,添加了GLG的样品的保水能力强于添加了LBG的样品。当胶体添加量≥0.24%时,添加LBG的样品保水能力优于添加相同量GLG的样品。随着GLG含量的增加,体系的保水能力也逐渐提高。当GLG的添加量为0.72%时,样品的产水量降至0。添加GG的样品,则显著区别于其他两组。在添加0.12%的样品当中,其离心出水量低于对照组,为16%。并没有因为GG的添加而出现持水力下降的问题。随着GG添加量的进一步升高,其持水能力持续增强,在添加量为0.60%时离心出水量为0。3种GM在添加量达到0.24%及以上浓度时,其持水性已经差距不大了。在此范围内LBG的持水性最好,GG次之。最后是GLG。持水能力的结果与低场核磁共振的结果高度一致。
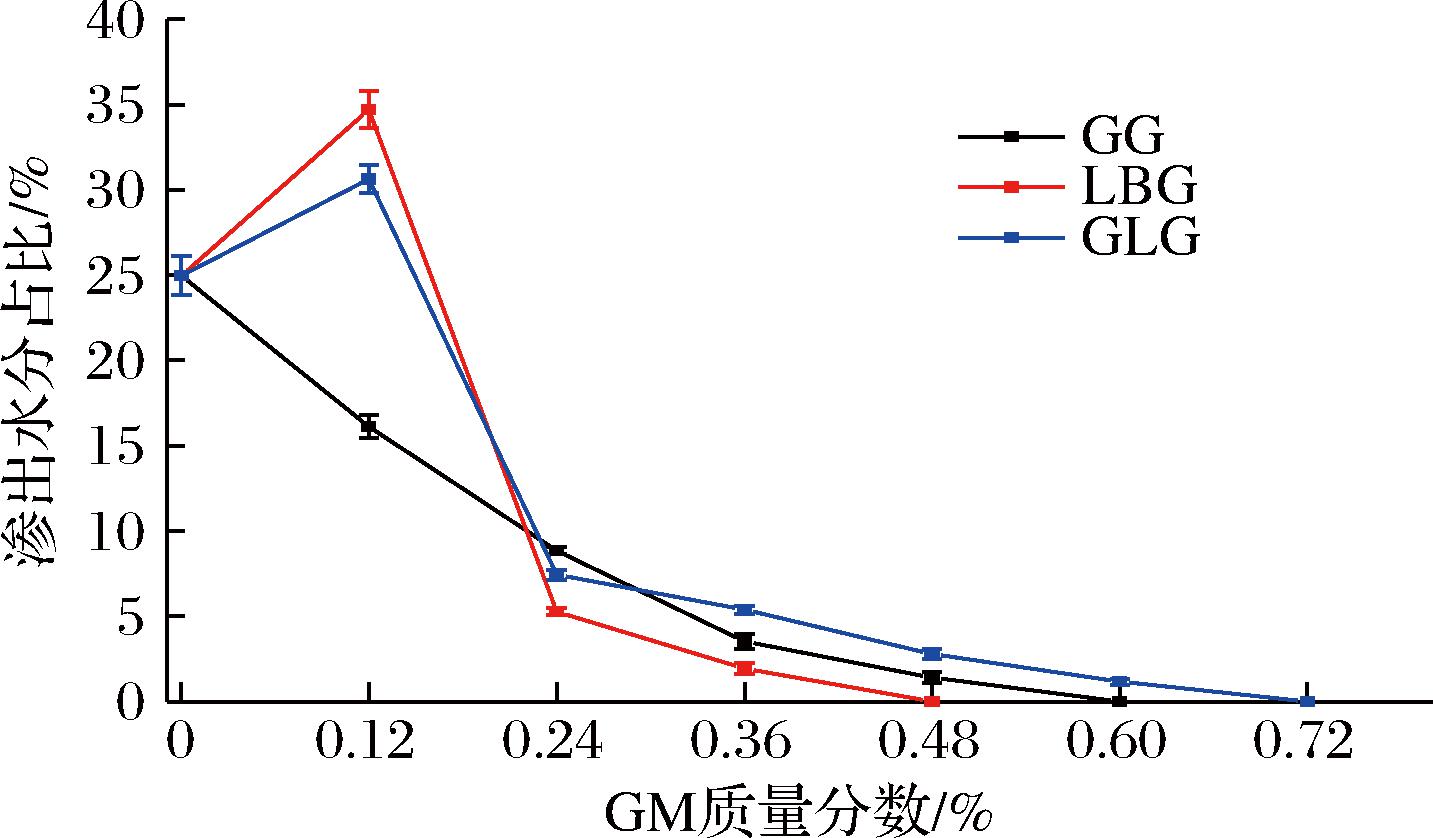
图6 渗出水分占比随GM含量的变化
Fig.6 Variation of exudate water percentage with GM content
2.7 GM对奶酪棒质构属性的影响
由表2的结果得知,与对照组相比,随着胶体添加量的增加,样品的硬度逐步升高。同等添加量下,加GG的样品硬度以及与硬度有极高关联性的胶凝性和咀嚼性要高于添加GLG的样品。添加LBG的样品这三类属性的数值最低,具备更加柔软的属性特征。添加LBG的样品具备良好的弹性,且与LBG的添加量呈正相关。可能是由于LBG和卡拉胶存在的协同作用有关[30]。而GLG的添加会使样品的弹性下降。在含有GG的样品弹性普遍较高,这可能是较低的分子质量以及较低的甘露糖与半乳糖比例导致更短的分子链,在水相当中起到填充作用且不会破坏体系原有的凝胶结构。但是随着GG的添加量升高,样品弹性逐渐降低。并且胶体的添加会提高样品的内聚性。样品的回复性也与胶体添加量呈正相关。其中含有GLG的样品具备更强的内聚性和回复性,这可能是由于GLG在体系中形成的凝胶结构。同等添加量下含有GG的样品硬度最高,结合简化体系蛋白粒径的结果可以推测较大的酪蛋白颗粒度会增加体系的硬度。
表2 质构分析数据
Table 2 Texture analysis data
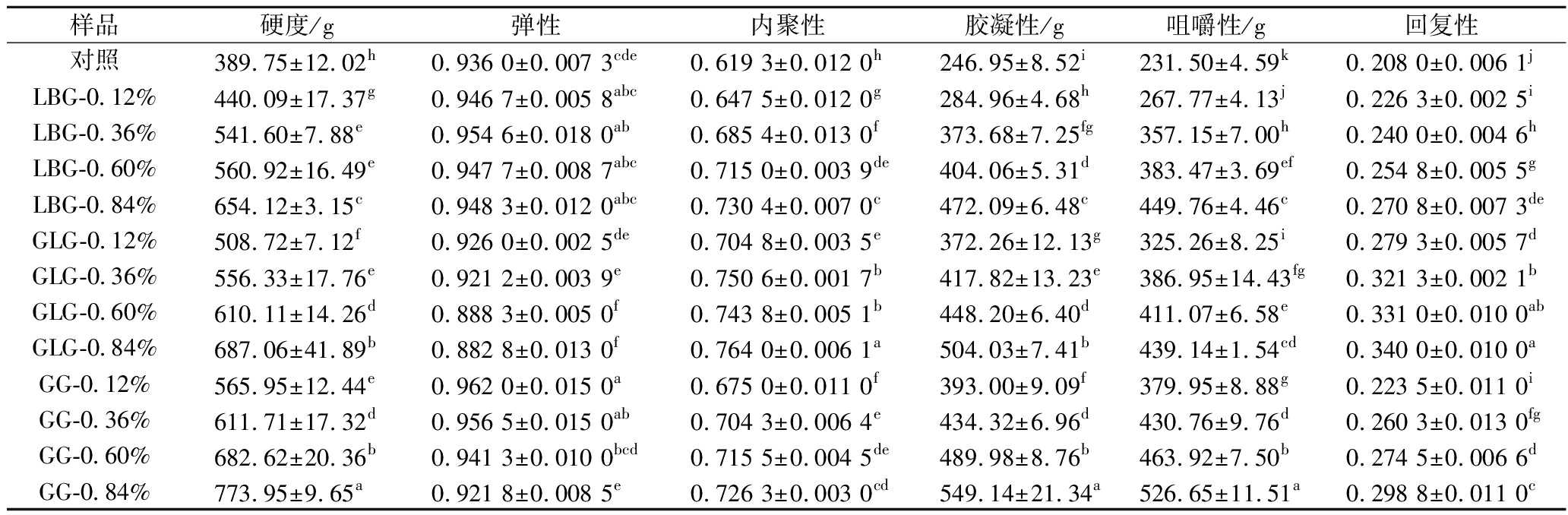
样品硬度/g弹性内聚性胶凝性/g咀嚼性/g回复性对照389.75±12.02h0.936 0±0.007 3cde0.619 3±0.012 0h246.95±8.52i231.50±4.59k0.208 0±0.006 1jLBG-0.12%440.09±17.37g0.946 7±0.005 8abc0.647 5±0.012 0g284.96±4.68h267.77±4.13j0.226 3±0.002 5iLBG-0.36%541.60±7.88e0.954 6±0.018 0ab0.685 4±0.013 0f373.68±7.25fg357.15±7.00h0.240 0±0.004 6hLBG-0.60%560.92±16.49e0.947 7±0.008 7abc0.715 0±0.003 9de404.06±5.31d383.47±3.69ef0.254 8±0.005 5gLBG-0.84%654.12±3.15c0.948 3±0.012 0abc0.730 4±0.007 0c472.09±6.48c449.76±4.46c0.270 8±0.007 3deGLG-0.12%508.72±7.12f0.926 0±0.002 5de0.704 8±0.003 5e372.26±12.13g325.26±8.25i0.279 3±0.005 7dGLG-0.36%556.33±17.76e0.921 2±0.003 9e0.750 6±0.001 7b417.82±13.23e386.95±14.43fg0.321 3±0.002 1bGLG-0.60%610.11±14.26d0.888 3±0.005 0f0.743 8±0.005 1b448.20±6.40d411.07±6.58e0.331 0±0.010 0abGLG-0.84%687.06±41.89b0.882 8±0.013 0f0.764 0±0.006 1a504.03±7.41b439.14±1.54cd0.340 0±0.010 0aGG-0.12%565.95±12.44e0.962 0±0.015 0a0.675 0±0.011 0f393.00±9.09f379.95±8.88g0.223 5±0.011 0iGG-0.36%611.71±17.32d0.956 5±0.015 0ab0.704 3±0.006 4e434.32±6.96d430.76±9.76d0.260 3±0.013 0fgGG-0.60%682.62±20.36b0.941 3±0.010 0bcd0.715 5±0.004 5de489.98±8.76b463.92±7.50b0.274 5±0.006 6dGG-0.84%773.95±9.65a0.921 8±0.008 5e0.726 3±0.003 0cd549.14±21.34a526.65±11.51a0.298 8±0.011 0c
2.8 GM对奶酪棒微观结构的影响
在对照组中(图7),可以看到油滴的大小并不均匀。油滴还存在破乳现象,即由多个油滴聚合形成更大的油滴。
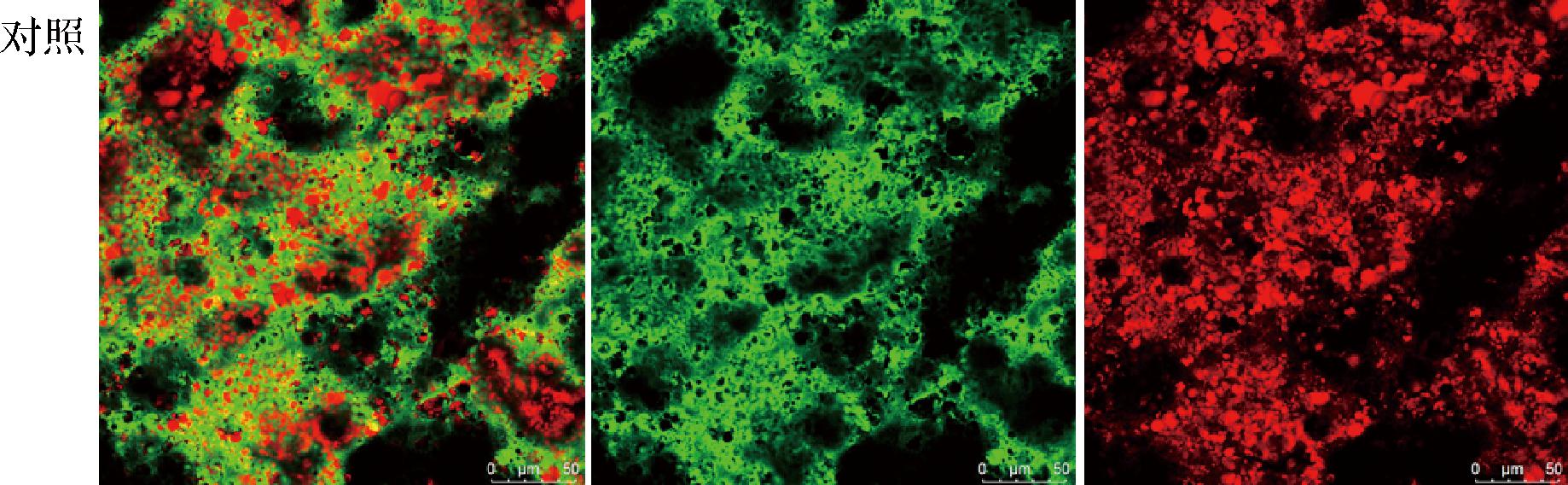
图7 对照组的微观分布
Fig.7 Microdistribution of the control group
由图8~图10可知,添加GM的样品以及对照组的微观分布都是非常均一的结构。其中绿色部分是连续相,代表水相当中的蛋白,红色部分为油滴被蛋白包裹。总体来看,随着多糖添加量的升高油滴的尺寸逐渐减小。
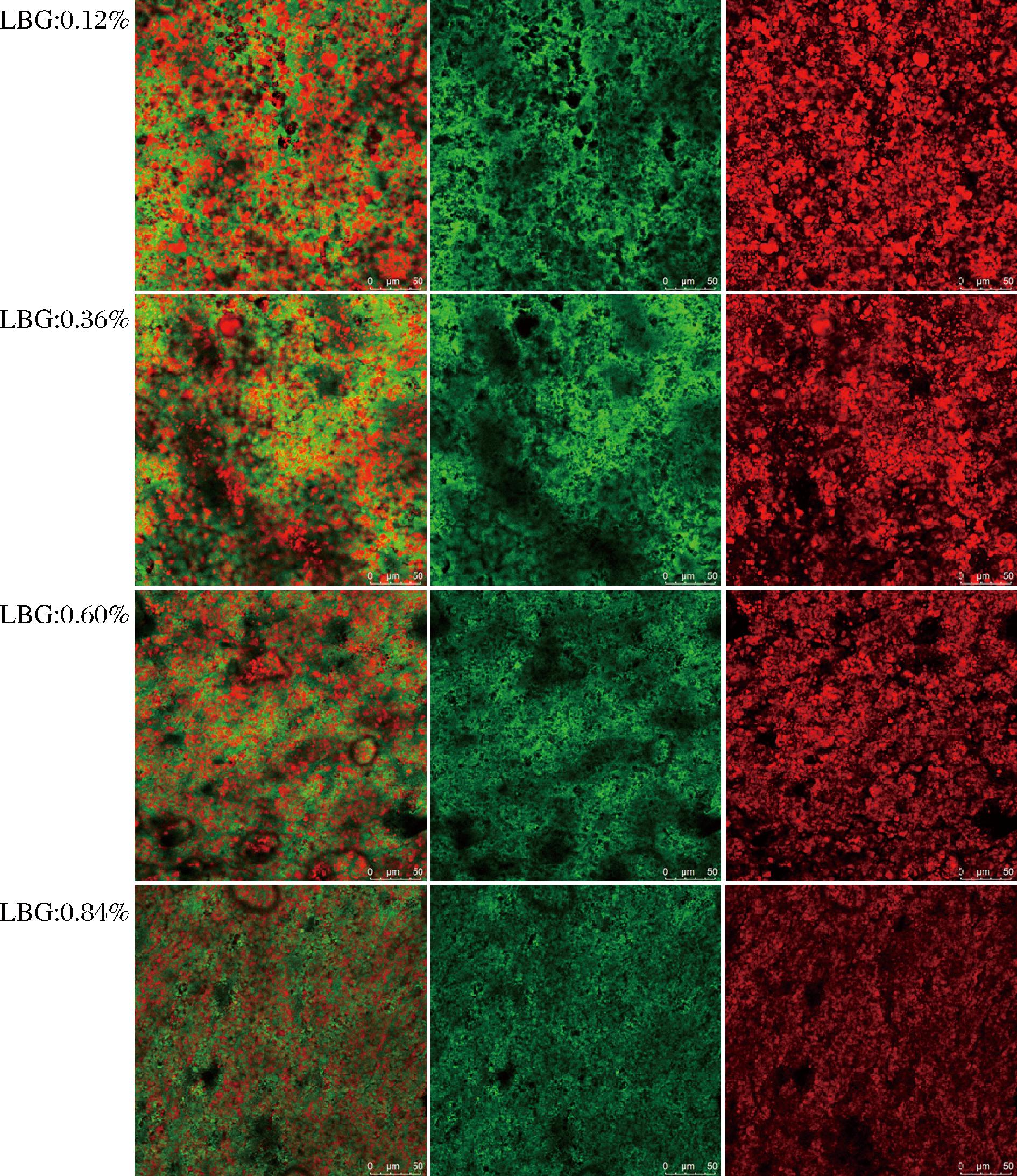
图8 含LBG的微观分布
Fig.8 Microdistribution of LBG-containing samples
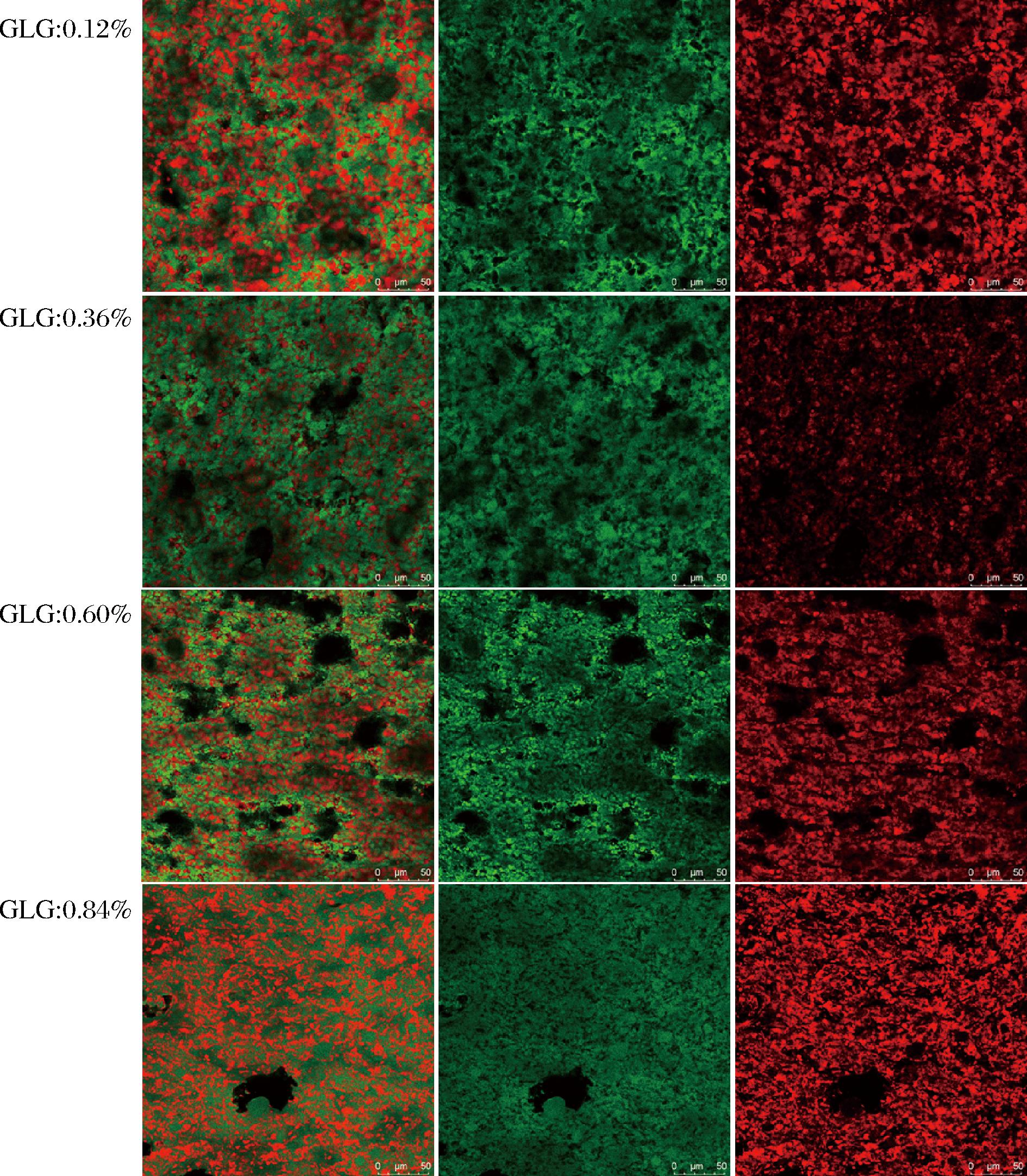
图9 含GLG样品的微观分布
Fig.9 Microdistribution of GLG-containing samples
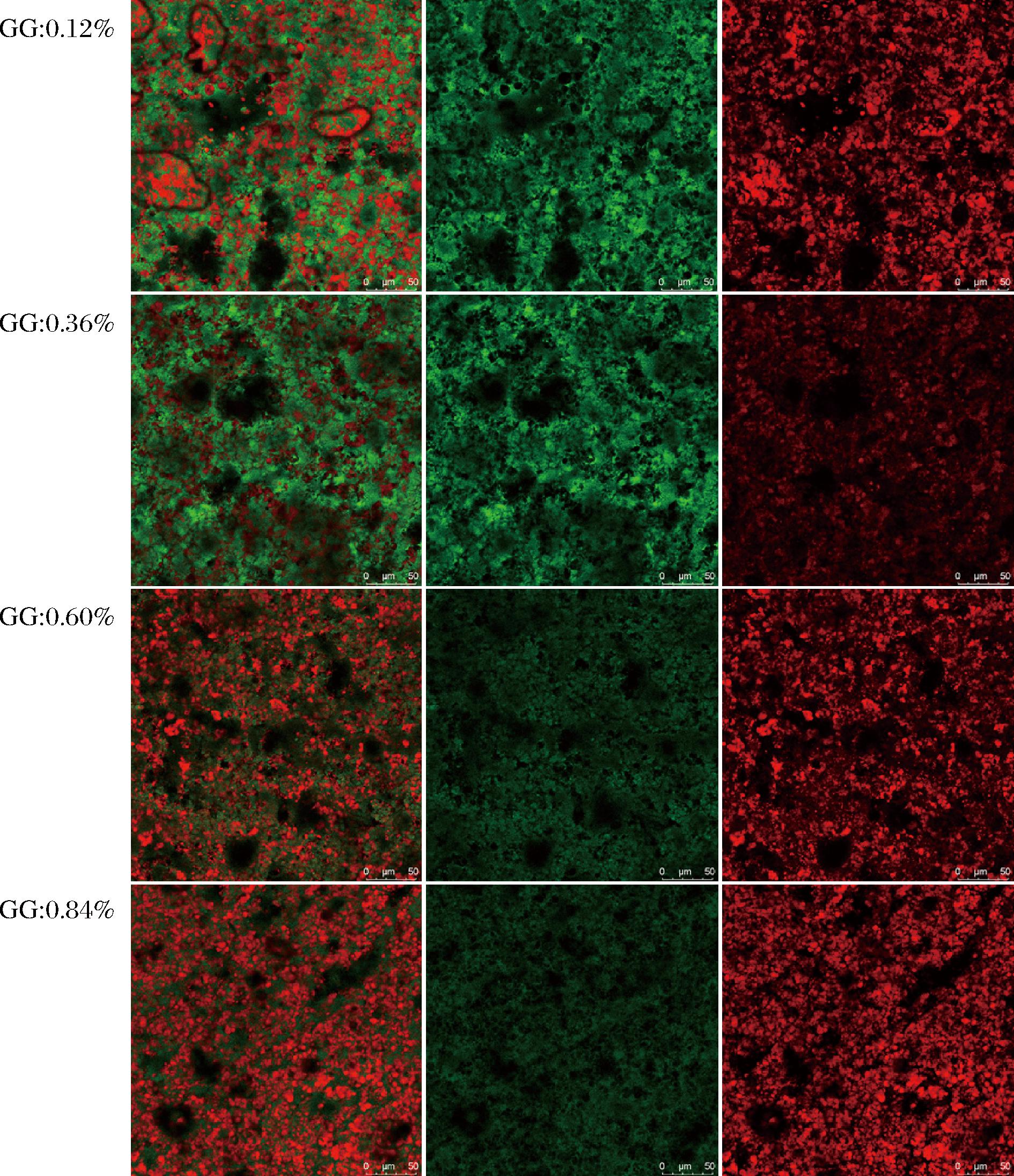
图10 含GG样品的微观分布
Fig.10 Microdistribution of GG-containing samples
多糖添加量达到0.12%时,这种情况依然明显存在。其中GG添加量达到0.60%时,依然能够观察到油滴聚集的现象。在含量达到0.84%才有明显改善(图10)。这可归因于其在水相当中表现出极低的黏度,在样品未冷却形成凝胶的高温阶段流动性更强,更容易聚集。由图8可知,样品中的LBG含量达到0.60%时,油滴聚集的情况已经明显改善。当LBG含量达到0.84%时,样品的油滴尺寸明显变小,在体系当中的分布也更加均匀。
由图9可知,当GLG添加量≥0.60%时,油滴的分布情况更加均匀,但油滴的形态并不是滴状,而是不规则的镶嵌在蛋白当中,这一点当GLG含量在0.84%的时候最为明显。结合流变学的分析得知,在80 ℃时GLG的样品在流变学的定义上已经是凝胶态即固体,不具备较好的流动性。那么体系当中的油滴在经过搅拌后,没有办法形成滴状的形态,只能以搅拌后的形态存在于体系当中。
3 结论
本奶酪棒体系是由黄油作为刚性支撑,卡拉胶作为水相凝胶骨架的乳液凝胶体系。添加LBG和GG的样品在高温下为偏向于流体的溶胶态,流动性更好,添加GLG的样品为偏向于固体的凝胶态,流动性较差。一定浓度GM的添加对体系内部原有的凝胶结构有影响,会造成凝胶强度和持水能力的下降。胶体的添加会促使体系的微观结构分布的更加均匀,浓度越高破乳现象越少,其中GG这方面性能较弱。凝胶网络也随着胶体的添加孔隙变小且更加致密。含有GLG的样品流动性较差、稳定性较好、质地柔软、弹性较差。含有GG的流动性很好,稳定性较差、硬度高、弹性好。含LBG的样品兼具两者的优点。
[1] 孙旗. 胡萝卜-芒果果蔬泥复合再制干酪的研制[D].哈尔滨:东北农业大学, 2019.SUN Q.Development of carrot-mango fruit and vegetable mud processed cheese[D].Harbin:Northeast Agricultural University, 2019.
[2] 朱盼盼. 常温奶酪加工技术研究及产品货架期稳定性评价[D].银川:宁夏大学, 2022.ZHU P P.Processing technology and shelf life stability prediction of room temperature cheese[D].Yinchuan:Ningxia University, 2022.
[3] 胡惠敏. 淀粉代替乳化盐在再制干酪中的应用[D].呼和浩特:内蒙古农业大学, 2013.HU H M.Starch as the substitute of emulsifying salts on the application of processed cheese[D].Hohhot:Inner Mongolia Agricultural University, 2013.
[4] 边燕飞, 闫清泉, 李志国, 等.乳清蛋白与酪蛋白比例对UHT再制干酪品质的影响[J].食品工业, 2019, 40(7):119-121.BIAN Y F, YAN Q Q, LI Z G, et al.Effect of ratio of casein and whey on quality of UHT processed cheese[J].The Food Industry, 2019, 40(7):119-121.
[5] WANG X C, CUI X F, DU Y N, et al.Gel formation of scallop (Patinopecten yessoensis) male gonad hydrolysates combined with κ-carrageenan and locust bean gum[J].Journal of Food Processing and Preservation, 2022, 46(12).
[6] BRIGHENTI M, GOVINDASAMY-LUCEY S, JAEGGI J J, et al.Behavior of stabilizers in acidified solutions and their effect on the textural, rheological, and sensory properties of cream cheese[J].Journal of Dairy Science, 2020, 103(3):2065-2076.
[7] 武晗, 刘怀伟, 李晓东.干酪融化性测量方法及其研究进展[J].中国乳品工业, 2007, 35(3):40-42.WU H, LIU H W, LI X D.Measurement method and progress on meltability of cheese[J].China Dairy Industry, 2007, 35(3):40-42.
[8] HINRICHS R, GÖTZ J, NOLL M, et al.Characterisation of the water-holding capacity of fresh cheese samples by means of low resolution nuclear magnetic resonance[J].Food Research International, 2004, 37(7):667-676.
[9] PANDEY P K, RAMASWAMY H S, ST-GELAIS D.Water-holding capacity and gel strength of rennet curd as affected by high-pressure treatment of milk[J].Food Research International, 2000, 33(8):655-663.[10] MIOCINOVIC J, MILORADOVIC Z, RADOVANOVIC M, et al.Sodium reduction by partial and total replacement of NaCl with KCl in Serbian white brined cheese[J].Foods, 2022, 11(3):374.
[11] HASSAN A N, FRANK J F, CORREDIG M.Microstructure of feta cheese made using different cultures as determined by confocal scanning laser microscopy[J].Journal of Food Science, 2002, 67(7):2750-2753.
[12] XU W, LI Z F, LI H, et al.Stabilization and microstructural network of Pickering emulsion using different xanthan gum/lysozyme nanoparticle concentrations[J].LWT, 2022, 160:113298.
[13] ZHAO M, HUANG X, ZHANG H, et al.Probiotic encapsulation in water-in-water emulsion via heteroprotein complex coacervation of type-a gelatin/sodium caseinate[J].Food Hydrocolloids, 2020, 105:105790.
[14] PRAJAPATI V D, JANI G K, MORADIYA N G, et al.Galactomannan:A versatile biodegradable seed polysaccharide[J].International Journal of Biological Macromolecules, 2013, 60:83-92.
[15] WU Y, LI W, CUI W, et al.A molecular modeling approach to understand conformation-functionality relationships of galactomannans with different mannose/galactose ratios[J].Food Hydrocolloids, 2012, 26(2):359-364.
[16]  ERN
ERN KOV
KOV M, BU
M, BU KA F, POSPIECH M, et al.Replacement of traditional emulsifying salts by selected hydrocolloids in processed cheese production[J].International Dairy Journal, 2010, 20(5):336-343.
KA F, POSPIECH M, et al.Replacement of traditional emulsifying salts by selected hydrocolloids in processed cheese production[J].International Dairy Journal, 2010, 20(5):336-343.
[17] DIMITRELI G, THOMAREIS A S.Effect of chemical composition on the linear viscoelastic properties of spreadable-type processed cheese[J].Journal of Food Engineering, 2008, 84(3):368-374.
[18] BARAK S, MUDGIL D.Locust bean gum:Processing, properties and food applications:A review[J].International Journal of Biological Macromolecules, 2014, 66:74-80.
[19] ARDA E, KARA S, PEKCAN Ö.Synergistic effect of the locust bean gum on the thermal phase transitions of κ-carrageenan gels[J].Food Hydrocolloids, 2009, 23(2):451-459.
[20] BIRCH G.Carbohydrate chemistry for food scientists[J].Food Chemistry, 1997, 60(4):690.
[21] JENKINS P, SNOWDEN M.Depletion flocculation in colloidal dispersions[J].Advances in Colloid and Interface Science, 1996, 68:57-96.
[22] LEFEVERE I, DEWETTINCK K, HUYGHEBAERT A.Cheese fat as driving force in cheese flow upon melting[J].Milchwissenschaft-milk Science International, 2000, 55:563-566.
[23] BANVILLE V, POWER N, POULIOT Y, et al.Relationship between baked-cheese sensory properties and melted-cheese physical characteristics[J].Journal of Texture Studies, 2015, 46(5):321-334.
[24] LIU Z B, ZHANG M, BHANDARI B, et al.Impact of rheological properties of mashed potatoes on 3D printing[J].Journal of Food Engineering, 2018, 220:76-82.
[25] XIAO R, LIU M, TIAN Q, et al.Physical and chemical properties, structural characterization and nutritional analysis of kefir yoghurt[J].Frontiers in Microbiology, 2023, 13:1107092.
[26] XU X Y, CUI H T, YUAN Z H, et al.Effects of different combinations of probiotics on rheology, microstructure, and moisture distribution of soy materials-based yogurt[J].Journal of Food Science, 2022, 87(7):2820-2830.
[27] TIDONA F, ALINOVI M, FRANCOLINO S, et al.Partial substitution of 40 g/100 g fresh milk with reconstituted low heat skim milk powder in high-moisture mozzarella cheese production:Rheological and water-related properties[J].LWT, 2021, 137:110391.
[28] L PEZ D N, GALANTE M, ALVAREZ E M, et al.Effect of the espina corona gum on caseinate acid-induced gels[J].LWT-Food Science and Technology, 2017, 85:121-128.
PEZ D N, GALANTE M, ALVAREZ E M, et al.Effect of the espina corona gum on caseinate acid-induced gels[J].LWT-Food Science and Technology, 2017, 85:121-128.
[29] PANG Z H, DEETH H, BANSAL N.Effect of polysaccharides with different ionic charge on the rheological, microstructural and textural properties of acid milk gels[J].Food Research International, 2015, 72:62-73.
[30] CHEN Y, LIAO M L, BOGER D V, et al.Rheological characterisation of κ-carrageenan/locust bean gum mixtures[J].Carbohydrate Polymers, 2001, 46(2):117-124.