随着生活方式的改变,高血压已成为严重威胁国民健康的重要慢性疾病之一,2021年我国约有2.45亿人患有高血压[1],长期高血压也会增加中风、心脏病、血管瘤、肾衰竭等心血管疾病和过早死亡的风险。血管紧张素转换酶(angiotensin converting enzyme,ACE)是引起血压升高的重要物质,它一方面通过催化无活性的血管紧张素-I转化为有活性的血管收缩剂血管紧张素-Ⅱ,从而调节血管收缩升高血压;另一方面通过使血管扩张剂缓激肽失活促使血压升高[2]。此外,国内外研究发现高血压与细胞氧化应激反应有着密切关系,活性氧可将血管扩张剂NO氧化为过氧亚硝酸盐,最后以亚硝酸盐和硝酸盐排出体外,使血管扩张剂一氧化氮舒张血管的功能丧失而升高血压[3]。因此,寻找兼具抗氧化和ACE抑制能力的活性物质成为了研究热点。
研究发现,蛋白质降解后生成的生物活性肽兼具有抗氧化、抗菌、降血压、免疫调节等多种生物学功能[4]。鱼肉中含有丰富的蛋白质,是人体补充氨基酸和活性多肽的重要来源,也是制备抗氧化肽和ACE抑制肽的优质来源[5]。日常生活中,通常采用不同烹饪方式改善鱼肉的口感、风味和食用安全性,但在烹饪加工过程中,鱼肉蛋白的结构和物理化学状态会发生变化,持续的热处理或更高温度的烹饪可导致蛋白质发生氧化反应,形成自由基,导致蛋白质羰基和二硫键的形成,进而加速蛋白质的断裂和聚集[6]。热处理导致的一些蛋白质和脂质修饰已被证明可影响蛋白质的消化、吸收及生物价值和功能[7-8],而不同的烹饪方式由于其温度、传热介质和加热时间等的不同,对蛋白质理化性质的影响也会不尽相同,从而使食品的消化特性和营养价值产生不同的差异。
草鱼(Ctenopharyngodon idella)是我国重要的淡水经济养殖鱼类,含有丰富的蛋白质,2020年的养殖量达557万t,位居所有淡水鱼之首,也是日常烹饪和加工的主要鱼类[9]。因此,本研究以草鱼肉为原料,分析5种常用烹饪方式对草鱼蛋白体外消化特性的影响,测定消化产物的体外抗氧化活性和ACE抑制活性,通过质谱鉴定和多肽合成技术对产物中的活性多肽进行鉴定、筛选、合成和活性验证。本研究可为人们日常生活中草鱼烹饪方式的合理选择和工业化加工提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
鲜活草鱼,约2.0 kg/条,南昌市长胜农贸大市场;胃蛋白酶(≥250 U/mg)、胰蛋白酶(≥250 U/mg)、糜蛋白酶(≥1 200 U/mg),北京Solarbio公司;ACE,美国Sigma公司;考马斯亮蓝超快染色液,上海碧云天生物技术有限公司;乙腈(色谱纯),上海泰坦科技股份有限公司;其他试剂均为国产分析纯。
L-8900 型氨基酸分析仪、U-2910紫外分光光度计、D-2000HSM型高效液相色谱仪,日本Hitachi公司;Mini-Protean电泳仪,美国Bio-Rad公司;WD-9413B凝胶成像分析仪,北京六一生物科技有限公司;Synergy H1酶标仪,美国Bio Tek公司。
1.2 实验方法
1.2.1 样品制备
生肉(raw,RW):鲜活草鱼→去鱼鳞、内脏和鱼头→切成长×宽×高为3.0 cm×2.0 cm×1.5 cm的鱼块→用滤纸除去鱼块表面水分。
汽蒸(steam,SM):将鱼块放置于蒸锅中汽蒸10 min,取出后冷却,然后用滤纸除去鱼块表面的水分。
水煮(boil,BO):将鱼块放置于沸水中煮10 min,取出后冷却,然后用滤纸除去鱼块表面的水分。
油炸(fry,FY):将鱼块放置于160 ℃左右的油中油炸10 min,取出后冷却,然后用滤纸除去鱼块表面的油脂。
烘烤(roast,RO):将鱼块放置烤箱中,温度设置为200 ℃,正反面各烤制10 min后取出,冷却,然后用滤纸除去鱼块表面的油脂和水分。
真空低温烹饪(sous-vide,SV):将真空包装好的鱼块置于60 ℃的水浴锅中加热1.0 h,取出后用冷水冷却,然后用滤纸除去鱼块表面的水分。
1.2.2 体外模拟消化
参照SANDOVAL-SICAIROS等[10]的方法稍加修改,称取含2.0 g蛋白质的鱼肉,加入100 mL去离子水,匀浆,调节pH值为2.0±0.02,加入60 mg胃蛋白酶,在37 ℃水浴条件下消化1.0 h,每隔10 min摇匀1次。胃消化结束后将pH值调至7.5±0.02,加入80 mg胰酶和20 mg糜蛋白酶,于37 ℃水浴条件下酶解2.0 h,每隔10 min 摇匀1次。消化结束后于95 ℃水浴10 min以终止酶消化,冷却至室温,使用蒸馏水定容至200 mL。分别在胃消化0、5、20、60 min和肠消化5、20、60、120 min时取消化液200 μL,离心后取上清液用于电泳分析。将最终消化液进行抽滤除得滤液,再将滤液以7 000 r/min离心15 min,取上清液,将上清液保存在-20 ℃冰箱中至分析。参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定样品中的蛋白质含量,体外消化率的计算如公式(1)所示:
(1)
式中:P,消化率,%;mS,消化液中的蛋白质含量,g;m0,消化前样品中的蛋白含量g。
1.2.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
取10 μL消化液上清液,加入30 μL蛋白上样缓冲液,沸水浴10 min后进行电泳分析,消化0 min的样品为1.2.2节中匀浆后消化前的上清液。电泳条件参照卢亚东等[11]的方法稍加修改,上样量10 μL,分离胶12.5%,浓缩胶5%,浓缩胶和分离胶分别在80 V和120 V下进行电泳,脱色后采用凝胶成像系统拍照。
1.2.4 相对分子质量分布测定
使用高效液相色谱法[12]测定消化产物中多肽的相对分子质量分布。
1.2.4 氨基酸组成测定
按照GB/T 5009.124—2016《食品安全国家标准食品中氨基酸的测定》中的方法,使用氨基酸分析仪测定消化后样品的氨基酸组成。
1.2.5 体外抗氧化活性测定
参照马梦娇[13]的方法测定样品稀释2倍后的Fe2+螯合能力;参照张露等[14]的方法测定样品稀释10倍后的ABTS阳离子自由基清除能力;参照郭洪辉等[15]的方法测定样品的羟自由基(·OH)清除能力和DPPH自由基清除率;参照朱敏方[16]的方法评价样品的超氧阴离子(·O2-)清除能力;参照李小锋等[12]的方法测定样品稀释2倍后的还原力。
1.2.6 ACE抑制率的测定
参照TU等[17]的方法测定样品的ACE抑制能力,取10 μL稀释20倍后的消化液和20 μL 100 mU/mL ACE于37 ℃恒温反应5 min,然后加入30 μL 2.5 mmol/L的马尿酰-组氨酸-亮氨酸水合物于37 ℃下反应1.0 h,最后加入60 μL 1.0 mol/L的HCl溶液终止反应,以10 μL 0.2 mol/L的硼酸缓冲液(含0.3 mol/L NaCl,pH 8.3)代替消化液作为空白。采用高效液相色谱法测定产物马尿酸的含量,色谱柱为Agilent ZORBAX SB-C18柱(5 μm,250 mm×4.6 mm)。采用等度洗脱,流动相A:82%体积分数0.1%的甲酸水溶液,流动相B:18%乙腈,流速0.8 mL/min,洗脱时间14 min,进样量20 μL,检测波长228 nm。记录产物马尿酸的峰面积As,空白组为A0。由公式(2)计算ACE抑制率:
ACE抑制率![]()
(2)
1.2.7 多肽序列鉴定
样品使用3 000 Da的超滤膜过滤,收集分子质量<3 000 Da的组分,委托上海厚基生物科技有限公司鉴定其结构。色谱条件:色谱柱:0.15 mm×150 mm,RP-C18;流动相A:0.1% 甲酸水溶液;流动相B:0.1%甲酸-84%乙腈水溶液;流速300 nL/min;洗脱梯度:0~50 min,4%~50% B;50~54 min,50%~100% B;54~60 min,100% B;多肽通过毛细管高效液相色谱分离后用Q Exactive质谱仪进行分析,分析时长60 min。检测方式为正离子模式;每次全扫描后采集10个碎片图谱。
质谱测试源文件用MaxQuant 1.5.5.1软件检索相应的数据库,得到蛋白质鉴定及定量分析结果,筛选相对离子强度>107的多肽进行统计分析。查库参数设置如下:一级离子质量容差为±20 ppm,二级离子质量容差为0.1 Da,允许的最大漏切位点数量为2,假阳性率≤0.01。以肽段的信号强度作为肽段的相对定量结果[18]。使用基于网络的多肽数据可视化工具Peptigram(http://bioware.ucd.ie/peptigram)来可视化不同样品中部分蛋白的多肽分布;鉴定出的多肽使用BIOPEP-UWM数据库(https://biochemia.uwm.edu.pl/)配对,得到部分多肽的生物活性。
1.2.8 多肽合成及活性验证
使用PeptideRanke(http://distilldeep.ucd.ie/PeptideRan ker)对多肽的生物活性进行评分,得分越高,具有生物活性的可能性越大。在本研究中,得分≥0.95的多肽被认为是潜在的生物活性多肽,并进一步筛选含量前5的多肽委托江西爱思博生物技术服务有限公司进行合成,然后测定其体外抗氧化活性和ACE抑制活性。
1.3 数据处理
结果以平均值±标准偏差表示,使用SPSS 20.0软件进行显著性分析,P<0.05表示差异显著,采用Origin 8.6软件绘图。
2 结果与分析
2.1 烹饪方式对草鱼蛋白消化过程中分子质量分布的影响
通过测定不同消化时间点消化液的SDS-PAGE图谱来研究烹饪方式对草鱼肉蛋白消化特性的影响。如图1所示,胃消化前,RW中条带较其他样品模糊且颜色更深,表明RW样品中的蛋白质种类最多且含量最高,这可能是因为鱼肉中的内源性酶在鱼肉高速均质后的水解作用[19],使得蛋白质条带增多,而实验组由于受到不同程度的热处理致使内源性的蛋白酶失活,同时蛋白质发生热变性导致蛋白质溶解度下降。

图1 不同烹饪方式制备的草鱼蛋白体外模拟消化过程的SDS-PAGE图
Fig.1 SDS-PAGE diagram of in vitro simulated digestion of grass carp proteins prepared by different cooking methods
胃消化5 min时,RW消化液中>135 kDa的蛋白质大部分被降解,熟肉中的蛋白大部分被胃蛋白酶酶解于消化液中,除BO外,其他样品中45 kDa处的蛋白均发生了明显的水解;胃消化20~60 min时,所有样品中37 kDa处的蛋白发生了有限的水解,其条带略微变宽,表明所有烹饪方式对其在胃消化过程的消化速率无影响;在此阶段,FY样品中更多的蛋白质被水解到消化液中,而其他样品中的条带则发生减少,这表明FY样品中蛋白质的胃消化速率慢于其他样品。肠消化20~120 min时,所有样品中的蛋白条带逐渐消失,这表明草鱼肉蛋白的消化过程主要发生在肠消化阶段。
如表1所示,BO鱼肉经胃消化后,消化液中分子质量>3 000 Da的多肽占比仅为34.35%,远小于其他处理组,表明水煮加快了草鱼蛋白在胃阶段的消化速度。FY鱼肉胃消化后,消化液中分子质量<500 Da的多肽占比为9.50%,略高于RW、SM、RO和SV,这可能是油炸鱼块时产生了一些小分子化合物导致的,如丙烯酰胺和杂环胺等物质[20]。肠消化后,FY中分子质量>2 000 Da的多肽占比最高,表明油炸降低了鱼肉蛋白在肠阶段的消化效率。
表1 不同烹饪方式处理对草鱼蛋白消化产物分子质量分布的影响
Table 1 Effects of different cooking methods on molecular weight distribution of digested products of grass carp protein
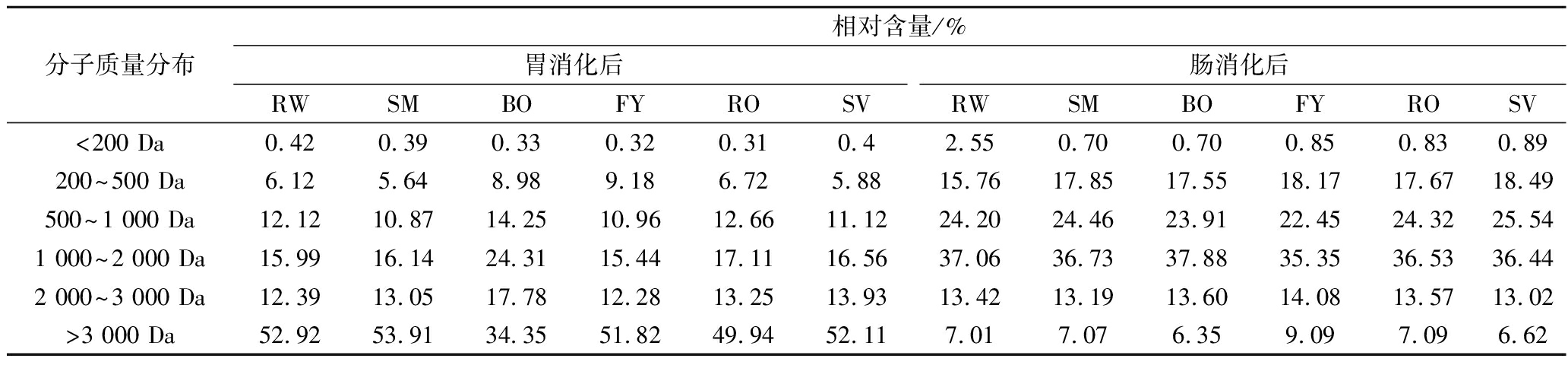
分子质量分布相对含量/%胃消化后肠消化后RWSMBOFYROSVRWSMBOFYROSV<200 Da0.420.390.330.320.310.42.550.700.700.850.830.89200~500 Da6.125.648.989.186.725.8815.7617.8517.5518.1717.6718.49500~1 000 Da12.1210.8714.2510.9612.6611.1224.2024.4623.9122.4524.3225.541 000~2 000 Da15.9916.1424.3115.4417.1116.5637.0636.7337.8835.3536.5336.442 000~3 000 Da12.3913.0517.7812.2813.2513.9313.4213.1913.6014.0813.5713.02>3 000 Da52.9253.9134.3551.8249.9452.117.017.076.359.097.096.62
2.2 烹饪方式对草鱼蛋白消化率的影响
如图2所示,除SM样品外,烹饪后鱼肉的消化率均发生了明显的下降(P<0.05),油炸鱼肉的消化率最低(44.42%),与ZHANG等[21]的研究结果一致,即油炸显著降低了兔肉蛋白的消化率,且随着油炸时间的延长,消化率越低。鱼块经油炸后,蛋白质的高度交联和聚集以及吸收大量脂肪形成的疏水层同样可能降低消化过程中水分的吸收,使蛋白酶进入鱼肉内部的速率降低,最终导致消化率的降低。OZVURAL等[22]研究了油炸对法兰克福香肠体外模拟消化特性的影响,发现油炸处理降低了香肠在消化过程中水分的吸收和消化率。除了蛋白质氧化与交联外,烹饪导致消化率降低的另一个原因可能是热处理过程中荧光碳点(fluorescent carbon dots,FCDs)的形成,而FCDs可与消化酶结合抑制其酶活性,从而降低蛋白质的消化率[23-24]。
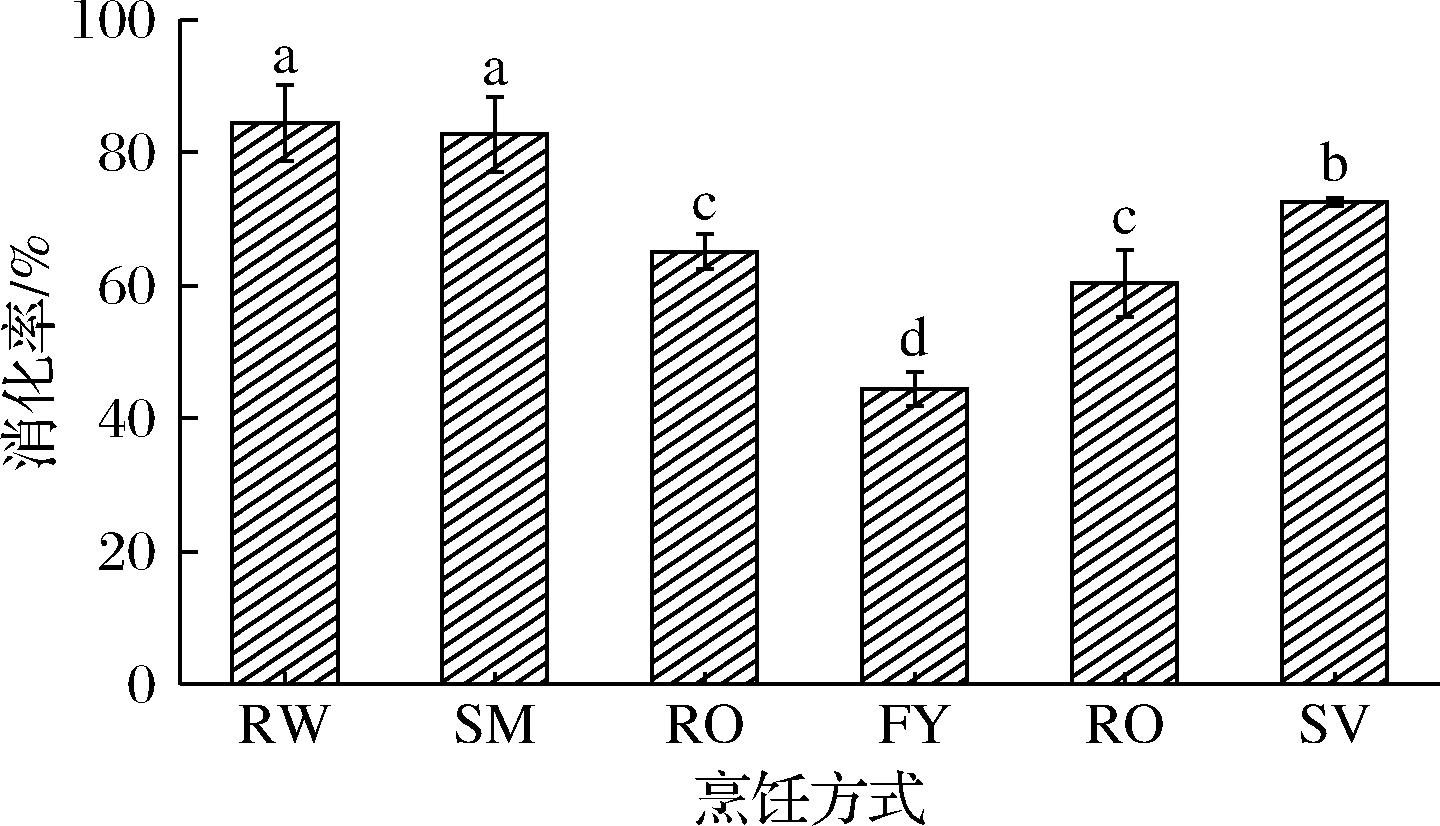
图2 不同烹饪方式对草鱼蛋白体外消化率的影响
Fig.2 Effects of different cooking methods on in vitrodigestibility of grass carp protein
注:不同小写字母表示同一测定指标中样品间差异显著(P<0.05)(下同)。
2.3 烹饪方式对草鱼蛋白消化产物中氨基酸组成的影响
如表2所示,Tyr、Phe、Pro、Ala、Leu和His在各样品中的占比均在28%以上,这些氨基酸与多肽的抗氧化活性密切相关[25],表明草鱼肉可能是抗氧化肽的优质来源。烹饪改变了鱼肉消化后的氨基酸组成,如Lys的相对含量在SM、BO、FY、RO中升高,而在SV中无明显变化;FY和RO的Cys相对含量最低,可能是加热过程中样品中更多的Cys的巯基形成二硫键,导致其含量降低[26]。不同烹饪方式处理对草鱼肉蛋白消化产物中的必需氨基酸总量无显著影响(P>0.05),但FY显著降低了疏水性氨基酸的相对含量(P<0.05)。
表2 不同烹饪方式处理对草鱼蛋白消化产物氨基酸组成的影响
Table 2 Effects of different cooking methods on amino acid composition of protein digested products of grass carp
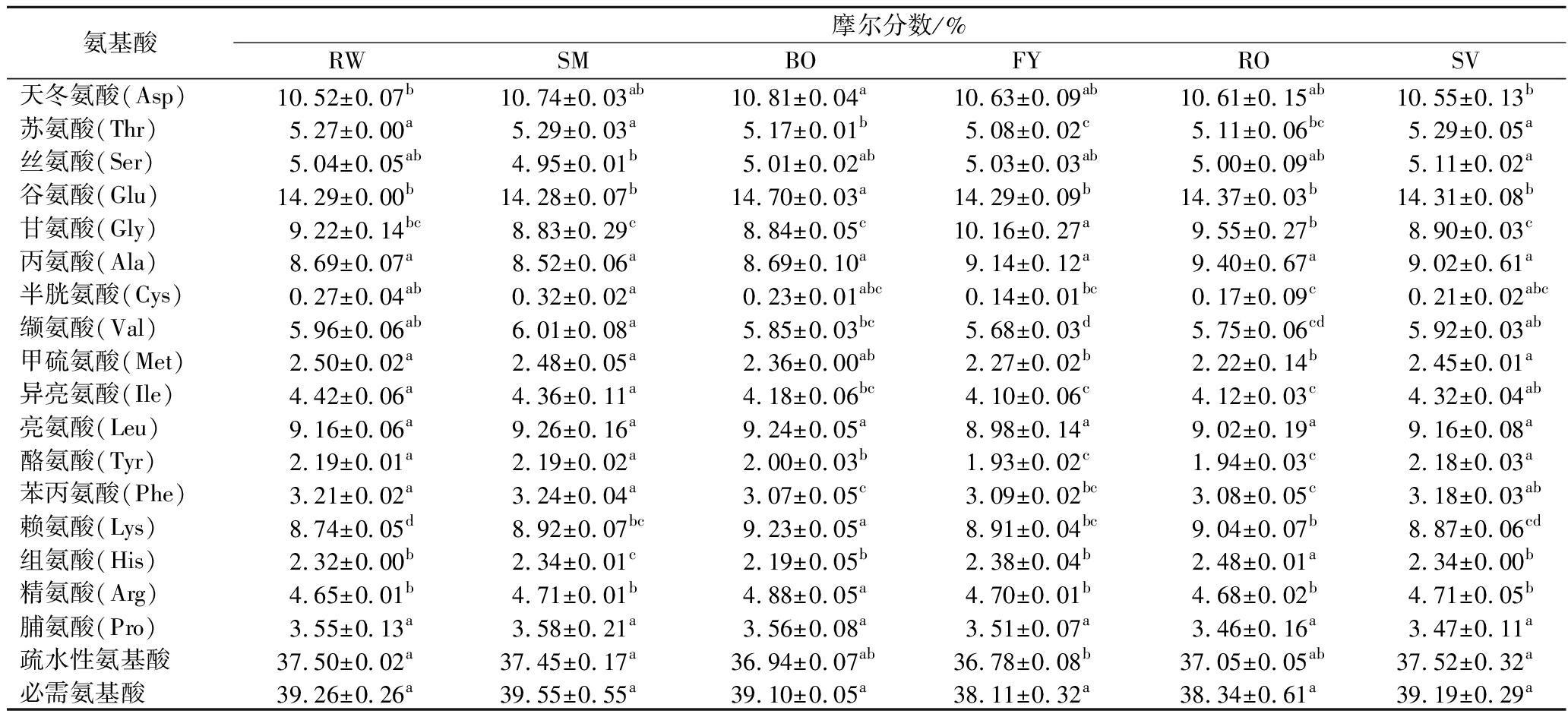
氨基酸摩尔分数/%RWSMBOFYROSV天冬氨酸(Asp)10.52±0.07b10.74±0.03ab10.81±0.04a10.63±0.09ab10.61±0.15ab10.55±0.13b苏氨酸(Thr)5.27±0.00a5.29±0.03a5.17±0.01b5.08±0.02c5.11±0.06bc5.29±0.05a丝氨酸(Ser)5.04±0.05ab4.95±0.01b5.01±0.02ab5.03±0.03ab5.00±0.09ab5.11±0.02a谷氨酸(Glu)14.29±0.00b14.28±0.07b14.70±0.03a14.29±0.09b14.37±0.03b14.31±0.08b甘氨酸(Gly)9.22±0.14bc8.83±0.29c8.84±0.05c10.16±0.27a9.55±0.27b8.90±0.03c丙氨酸(Ala)8.69±0.07a8.52±0.06a8.69±0.10a9.14±0.12a9.40±0.67a9.02±0.61a半胱氨酸(Cys)0.27±0.04ab0.32±0.02a0.23±0.01abc0.14±0.01bc0.17±0.09c0.21±0.02abc缬氨酸(Val)5.96±0.06ab6.01±0.08a5.85±0.03bc5.68±0.03d5.75±0.06cd5.92±0.03ab甲硫氨酸(Met)2.50±0.02a2.48±0.05a2.36±0.00ab2.27±0.02b2.22±0.14b2.45±0.01a异亮氨酸(Ile)4.42±0.06a4.36±0.11a4.18±0.06bc4.10±0.06c4.12±0.03c4.32±0.04ab亮氨酸(Leu)9.16±0.06a9.26±0.16a9.24±0.05a8.98±0.14a9.02±0.19a9.16±0.08a酪氨酸(Tyr)2.19±0.01a2.19±0.02a2.00±0.03b1.93±0.02c1.94±0.03c2.18±0.03a苯丙氨酸(Phe)3.21±0.02a3.24±0.04a3.07±0.05c3.09±0.02bc3.08±0.05c3.18±0.03ab赖氨酸(Lys)8.74±0.05d8.92±0.07bc9.23±0.05a8.91±0.04bc9.04±0.07b8.87±0.06cd组氨酸(His)2.32±0.00b2.34±0.01c2.19±0.05b2.38±0.04b2.48±0.01a2.34±0.00b精氨酸(Arg)4.65±0.01b4.71±0.01b4.88±0.05a4.70±0.01b4.68±0.02b4.71±0.05b脯氨酸(Pro)3.55±0.13a3.58±0.21a3.56±0.08a3.51±0.07a3.46±0.16a3.47±0.11a疏水性氨基酸37.50±0.02a37.45±0.17a36.94±0.07ab36.78±0.08b37.05±0.05ab37.52±0.32a必需氨基酸39.26±0.26a39.55±0.55a39.10±0.05a38.11±0.32a38.34±0.61a39.19±0.29a
2.4 烹饪方式对草鱼肉蛋白消化产物抗氧化活性的影响
由图3可知,FY样品的Fe2+螯合率、·OH清除率和ABTS阳离子自由基清除率均为最低(P<0.05),分别为67.06%、32.38%和67.31%。
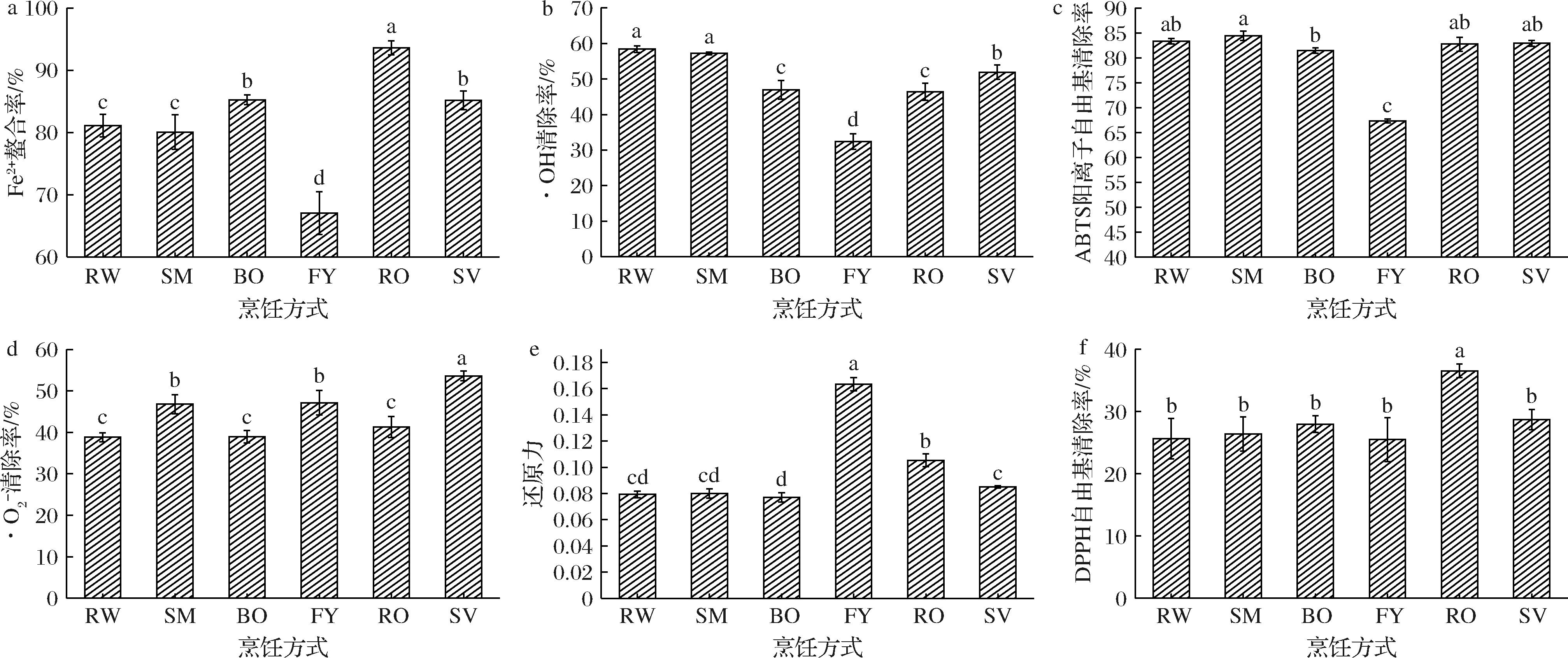
a-Fe2+螯合能力;b-·OH清除能力;c-ABTS阳离子自由基清除能力;d-·O2-清除能力;e-还原力;f-DPPH自由基清除率
图3 不同烹饪方式处理对草鱼蛋白消化产物体外抗氧化活性的影响
Fig.3 Effects of different cooking methods on antioxidant activity of protein digested products of grass carp in vitro
研究发现烹饪过程中产生的FCDs具有一定的抗氧化活性[27],但持续的高温加热可能导致FCDs表面的活性基团被破坏,从而降低其抗氧化活性。WANG等[28]研究发现,长时间高温烹饪的牛肉中FCDs与Fe2+的结合率显著下降,这可能也是FY 的Fe2+螯合率较低的原因。与RW相比,BO、RO和SV样品的Fe2+螯合率均上升,而·OH清除率均降低。与RW相比,SM样品的Fe2+螯合率、·OH清除率和ABTS阳离子自由基清除率无明显差异(P>0.05),但·O2-的清除速率升高,BO和对照组的ABTS阳离子自由基清除和·O2-清除速率无明显差异。FY样品的低抗氧化活性可能是其低消化率导致的,较低的消化率使得其样品中多肽浓度要远低于其他样品。另一方面,FY和RO分别具有最高的还原力和DPPH自由基清除率,为0.163、36.54%(P<0.05),因此,烹饪方式对草鱼蛋白消化后的抗氧化活性影响较大,但在不同的抗氧化活性评价模型中,消化产物的抗氧化活性变化趋势不同。
2.5 烹饪方式对草鱼肉蛋白消化产物ACE抑制活性的影响
如图4所示,RW、SM、BO、RO和SV鱼肉消化产物的ACE抑制率均在50%以上,FY样品的ACE抑制率也达到了48.28%,表明草鱼肉蛋白是ACE抑制肽的良好来源。RW、SM、BO、RO和SV之间的ACE抑制率无显著差异(P>0.05),说明SM、BO、RO和SV处理对草鱼肉水解物的ACE抑制活性无影响。FY的抑制率最低,这可能是因为油炸降低了草鱼蛋白的消化率,导致消化液中的多肽含量低于其他样品组,从而降低了其ACE抑制率。
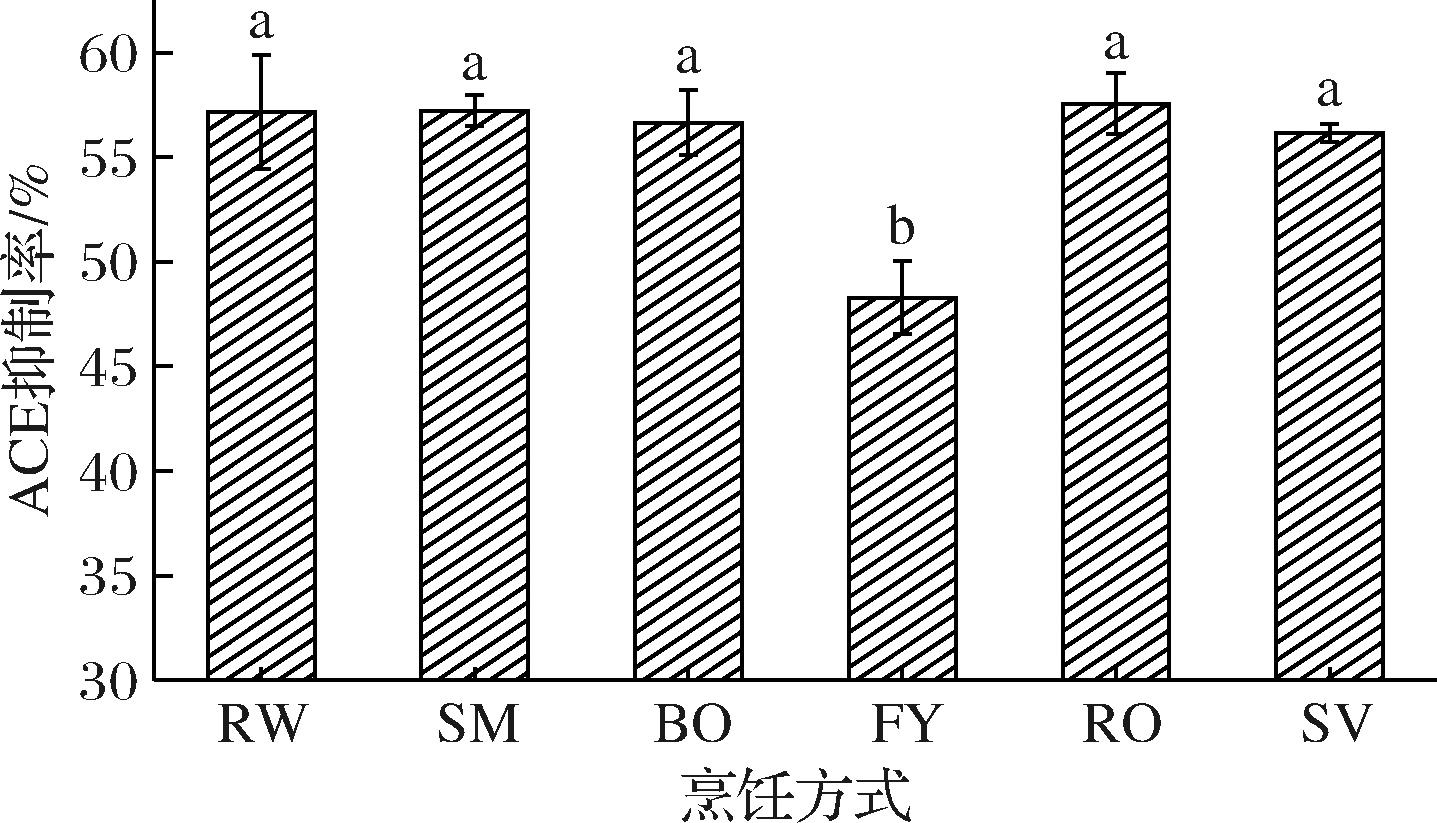
图4 不同烹饪方式处理对草鱼蛋白消化产物ACE抑制活性的影响
Fig.4 Effects of different cooking methods on ACE inhibitory activity of protein digestible products of grass carp
2.6 消化产物中潜在生物活性肽的筛选鉴定
将胃肠消化产物中鉴定的多肽序列与BIOPEP-UWM数据库中的生物活性多肽的序列进行比较,得到如表3所示的生物活性肽,数值越大,表示在样品中的含量越高。SM和RO产生了特有的降血压肽FHL,对于生物活性肽LLY,除SV外,其余烹饪方式处理鱼肉的消化产物中的含量均发生下降,而活性肽LFR、LEQQVDDLEGSLEQEKK、LHW、LWF和LWM在烹饪后鱼肉消化产物中的含量均发生不同程度下降。各活性肽的含量在不同烹饪方式之间也表现出较大差异,表明烹饪方式对鱼肉蛋白肽的含量和活性有较大的影响,因而烹饪方式的不同可能影响鱼肉蛋白消化后的生物活性和功能。
表3 不同消化液中从BIOPEP-UWM数据库配到的生物活性肽
Table 3 Bioactive peptides from BIOPEP-UWM database in different digestive juices
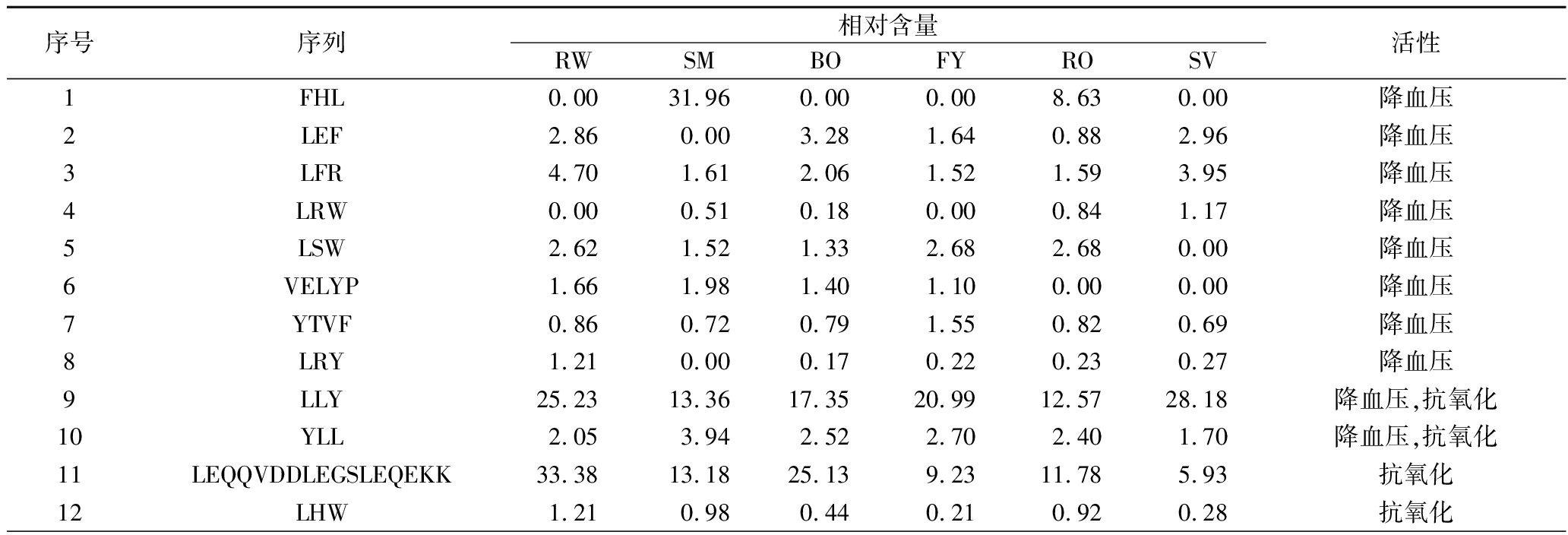
序号序列相对含量RWSMBOFYROSV活性1FHL0.0031.960.000.008.630.00降血压2LEF2.860.003.281.640.882.96降血压3LFR4.701.612.061.521.593.95降血压4LRW0.000.510.180.000.841.17降血压5LSW2.621.521.332.682.680.00降血压6VELYP1.661.981.401.100.000.00降血压7YTVF0.860.720.791.550.820.69降血压8LRY1.210.000.170.220.230.27降血压9LLY25.2313.3617.3520.9912.5728.18降血压,抗氧化10YLL2.053.942.522.702.401.70降血压,抗氧化11LEQQVDDLEGSLEQEKK33.3813.1825.139.2311.785.93抗氧化12LHW1.210.980.440.210.920.28抗氧化
续表3
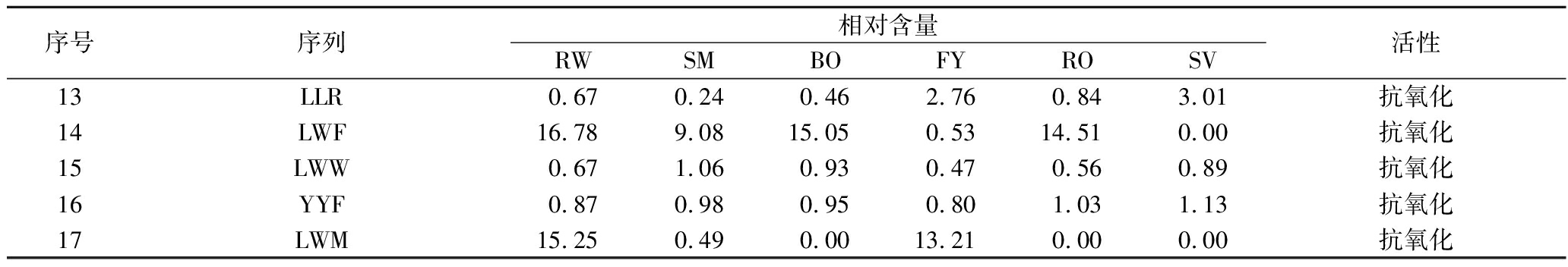
序号序列相对含量RWSMBOFYROSV活性13LLR0.670.240.462.760.843.01抗氧化14LWF16.789.0815.050.5314.510.00抗氧化15LWW0.671.060.930.470.560.89抗氧化16YYF0.870.980.950.801.031.13抗氧化17LWM15.250.490.0013.210.000.00抗氧化
2.7 烹饪方式对草鱼肉蛋白消化产物中多肽组成的影响
肌球蛋白和肌动蛋白是肌肉中蛋白的重要组成部分,根据质谱鉴定到的多肽,选取了源自肌球蛋白重链a(myosin heavy chain a)和α骨骼肌2肌动蛋白(actin,α skeletal muscle 2)的多肽进行消化图谱分析。如图5-a所示,在肌球蛋白重链a的多肽图谱中,各样品的多肽条带之间显示出不同程度的差异。
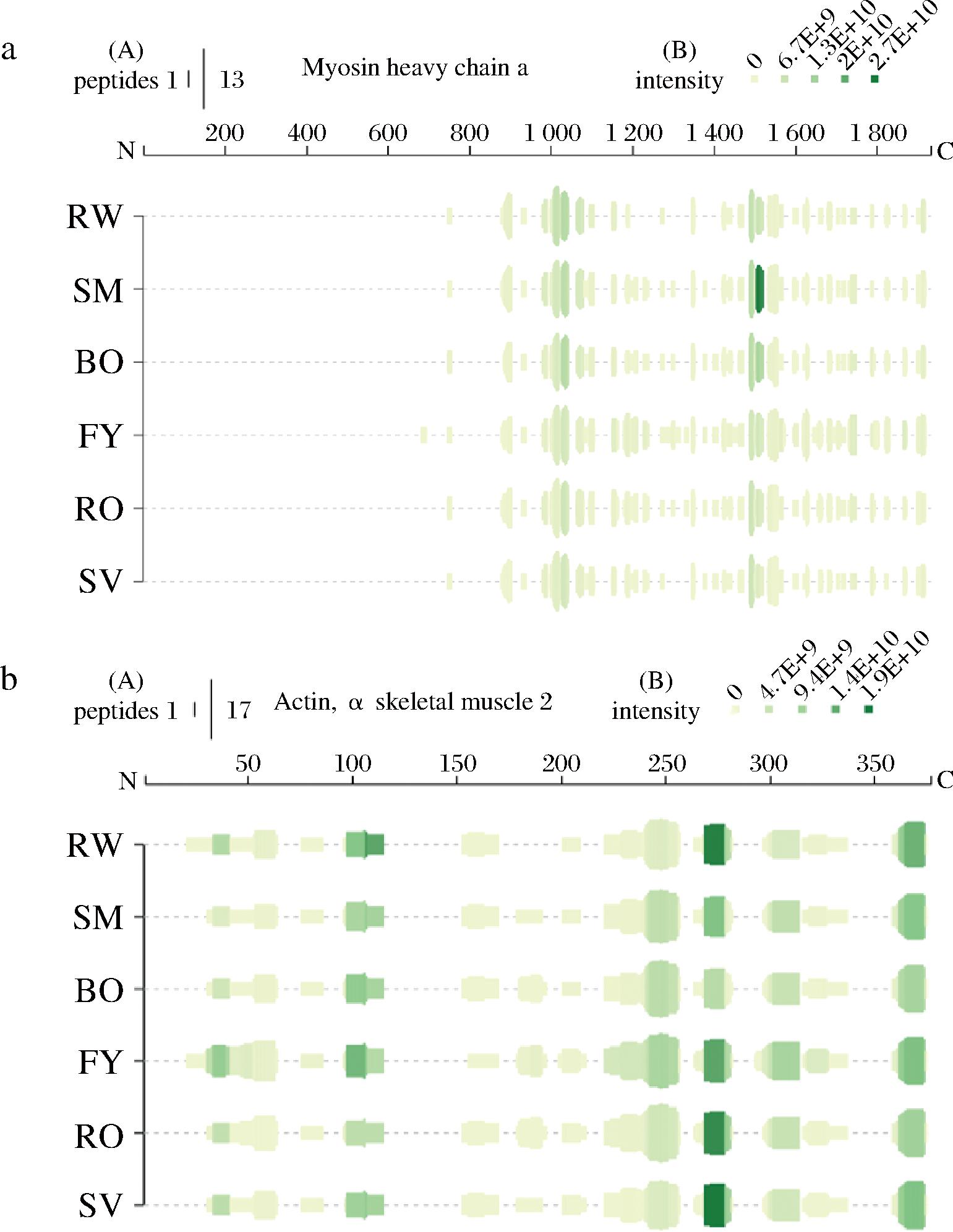
a-源自肌球蛋白重链a的多肽图谱;b-源自α骨骼肌2肌动蛋白的多肽图谱
图5 草鱼蛋白消化后的多肽图谱
Fig.5 Polypeptide map of digested grass carp protein
注:绿色条带该条的高度与该位置重叠的肽数量成比例,条带颜色强度与该位置重叠的肽总离子强度成正比。
在976~1 105和1 484~1 568处,所有样品均出现了较密集的多肽条带;在1 181~1 342位置处,RW中的条带最少,其次为SV、SM和BO,RO和FY在该区域有最多的条带,且FY要多于RO,这表明该区域多肽的释放可能与烹饪温度相关,温度越高该区域的氨基酸序列在消化时更容易被水解。在α骨骼肌2肌动蛋白的多肽图谱中(图5-b),各样品之间的条带也显示出一定的差异,如在21~31区间处,与RW相比,除FY外实验组其他样品中相应条带均缺失,但FY与其他样品相比,在153~170区域的条带丰度明显更低。在179~193区段,除RW外实验组样品中均出现了多肽条带,且BO、FY及RO的丰度更高,因此,此区域蛋白质片段的水解也可能依赖于热处理。2种蛋白质多肽图谱的结果表明,烹饪方式可改变蛋白质的水解位点,导致部分多肽片段的缺失和新片段的产生。
各样品中鉴定出的含量前10的多肽如表4所示,每行中数字的排序表明从左到右对应多肽的含量依次下降。在含量前10的多肽中,烹饪后鱼肉消化产物中共鉴定出了7条新的多肽,且所有烹饪后鱼肉中均鉴定出了新的多肽,其中BO、FY、RO和SV样品中各鉴定出了一种独特的多肽,分别为多肽14(VFF)、多肽15(KELFDPIISDR)、多肽16(VIISAPSADAPMF)和多肽17(DEIFPMNPPKF)。所有样品组中都鉴定出肽多肽1(LTEAPLNPK)、多肽2(IGMESAGIHE)和多肽4 (LLGSLDIDHTQY)。此外,前十个肽的含量明显不同,例如,多肽1(LTEAPLNPK)在生肉样品中排名第1,而在SM、BO、FY、RO和SV样品中的排名分别为第5、第3、第3、第8和第3。这表明烹饪方法会改变草鱼肉蛋白在胃肠消化后的肽组成。
表4 不同烹饪方式处理对草鱼蛋白消化产物中含量前10的多肽的影响
Table 4 Effects of different cooking methods on the content of top ten peptides in protein digested products of grass carp
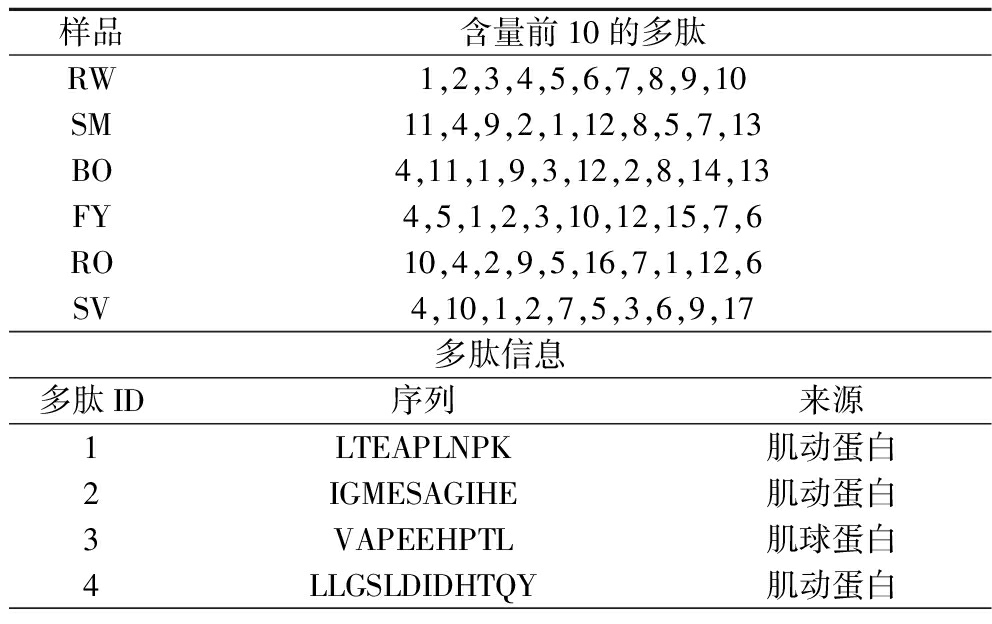
样品含量前10的多肽RW1,2,3,4,5,6,7,8,9,10SM11,4,9,2,1,12,8,5,7,13BO4,11,1,9,3,12,2,8,14,13FY4,5,1,2,3,10,12,15,7,6RO10,4,2,9,5,16,7,1,12,6SV4,10,1,2,7,5,3,6,9,17多肽信息多肽ID序列来源1LTEAPLNPK肌动蛋白2IGMESAGIHE肌动蛋白3VAPEEHPTL肌球蛋白4LLGSLDIDHTQY肌动蛋白
续表4
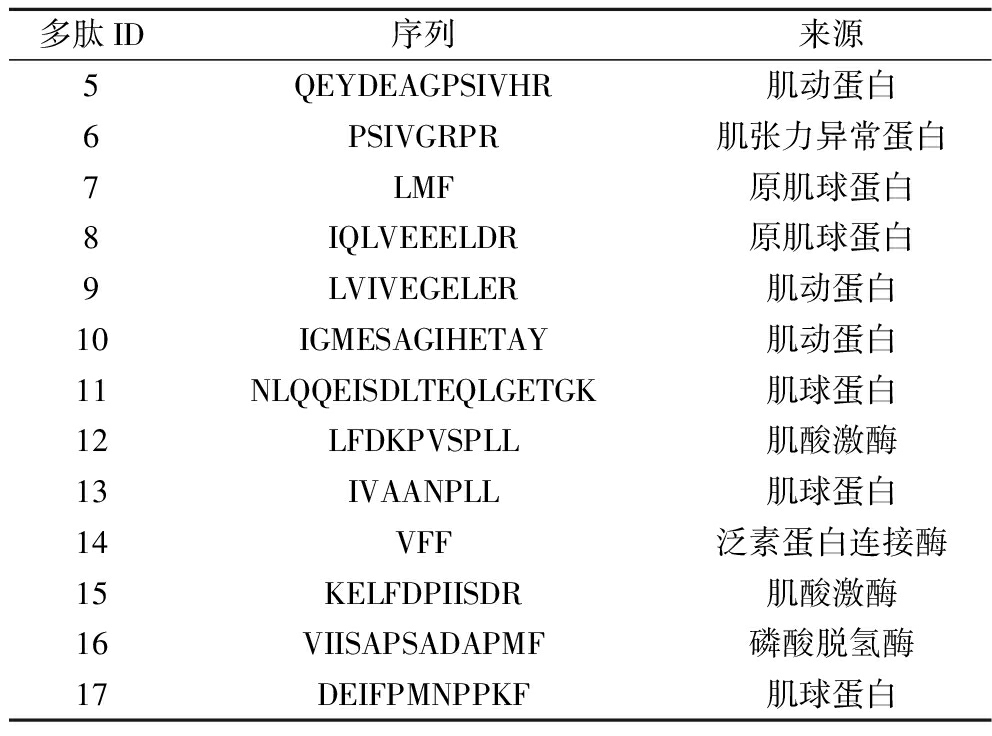
多肽ID序列来源5QEYDEAGPSIVHR肌动蛋白6PSIVGRPR肌张力异常蛋白7LMF原肌球蛋白8IQLVEEELDR原肌球蛋白9LVIVEGELER肌动蛋白10IGMESAGIHETAY肌动蛋白11NLQQEISDLTEQLGETGK肌球蛋白12LFDKPVSPLL肌酸激酶13IVAANPLL肌球蛋白14VFF泛素蛋白连接酶15KELFDPIISDR肌酸激酶16VIISAPSADAPMF磷酸脱氢酶17DEIFPMNPPKF肌球蛋白
Upset图(图6)显示了各样品消化产物的多肽组成,显示阈值设置为30。RW、SM、BO、FY、RO和SV样品中分别鉴定出2 257、2 090、2 028、2 270、2 027和2 159条多肽序列,其中共有多肽为958种,各样品中特有多肽分别为211、95、71、256、71、167条,FY中的独特多肽最多,可能是受其加热温度和传热介质影响,相比于其他烹饪方式,高温热油使鱼块快速脱水,蛋白质发生更强烈的氧化和变性,使鱼肉蛋白理化性质的变化大于其他烹饪方式处理的鱼肉,这与图1中油炸鱼肉蛋白消化过程与其他样品差异较大的结果一致。这些结果进一步表明烹饪方式对鱼肉蛋白消化后多肽的组成具有较大的影响。

图6 不同烹饪方式处理对草鱼蛋白消化产物中多肽组成的影响
Fig.6 Effects of different cooking methods on the composition of peptides in the digested products of grass carp protein
2.8 合成多肽的抗氧化活性验证
将合成的10条多肽配制成2 mg/mL的溶液,并评价其抗氧化活性(图7)。所有多肽都没有检测出ABTS阳离子自由基清除能力、DPPH自由基清除率和还原力,说明单一的肽段序列并不能对所有的自由基都有较好的清除能力,但在图3中消化产物具有一定的自由基清除能力和还原力,这可能是因为多肽之间的抗氧化活性存在协同作用,如JIA等[29]研究发现多肽VAGW、APPAMW和LLLYK对ABTS阳离子自由基的清除具有显著的协同作用,而多肽LLPDDGDH和WEPPK对·O2-的清除具有明显的拮抗作用。不同的多肽之间可能存在协同或拮抗作用,各消化产物中的多肽组成不同,因而在不同的抗氧化评价模型出表现出了不同的变化趋势;LFDF具有最高的·O2-清除率,其余多肽的·OH清除率和·O2-清除率没有较大差异,但LFDF几乎没有·OH清除能力和Fe+螯合能力;LWM的Fe2+螯合率最高(P<0.05);这些多肽在不同抗氧化活性评价模型中表现出不同强度的活性,可能是由于不同自由基的清除机理不同导致的。

a-·OH清除活性;b-·O2-清除率;c-Fe2+螯合率
图7 十条合成多肽的抗氧化活性
Fig.7 Antioxidant capacity of 10 synthetic peptides
2.9 合成多肽的ACE抑制活性
如表5所示,LMF、LMW、LWM和FLW的半抑制浓度(half inhibitory concentration,IC50)均低于100 μg/mL,具有很好的ACE抑制活性,其中LMW的抑制活性最强,其IC50为2.9 μg/mL,这可能是多肽中的氨基酸均为疏水性氨基酸,而疏水性氨基酸的含量通常决定着ACE抑制活性的高低[30]。此外,LMF、LMW和LWM这3条多肽的N端均为亮氨酸,LMF、LMW和FLW的C端均为芳香族氨基酸,这是这些多肽具有较强ACE抑制活性的另一原因[31]。在合成的10条多肽中有许多多肽的氨基酸序列非常相似,但是ACE抑制活性却显示出较大的差异,如VFF、QFF、FLF和LFF,N端为亮氨酸的多肽ACE抑制活性最好,这也印证了亮氨酸在N端可使ACE抑制活性更强的结论。经BIOPEP-UWM数据库检索后发现LMF、LMW、LWM和FLW这4条肽段为新型ACE抑制肽,其中LWM兼具较强的抗氧化能力和ACE抑制活性。
表5 十条合成多肽的ACE抑制活性
Table 5 ACE inhibitory activity of 10 synthetic peptides
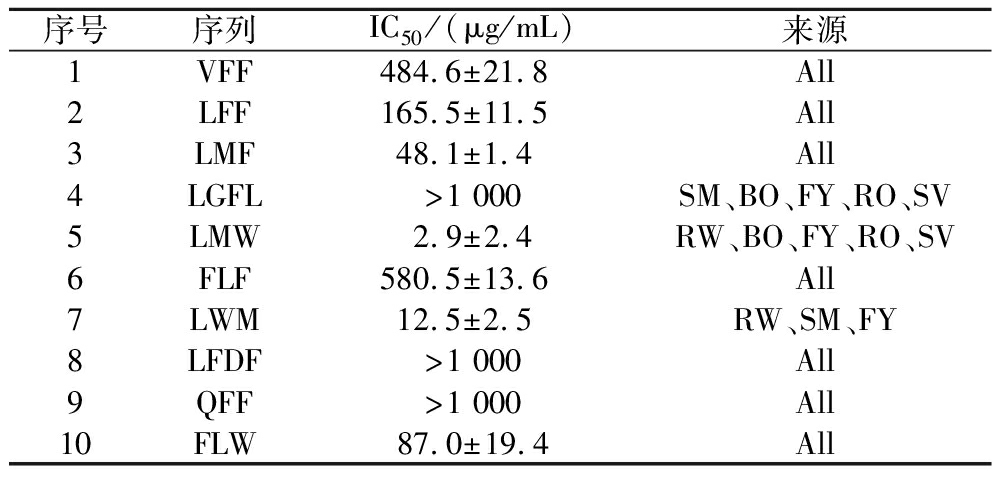
序号序列IC50/(μg/mL)来源1VFF484.6±21.8 All2LFF165.5±11.5 All3LMF48.1±1.4 All4LGFL>1 000SM、BO、FY、RO、SV5LMW2.9±2.4RW、BO、FY、RO、SV6FLF580.5±13.6 All7LWM12.5±2.5 RW、SM、FY8LFDF>1 000All9QFF>1 000All10FLW87.0±19.4All
3 结论
烹饪方式的选择显著影响草鱼肉蛋白的消化过程、消化率,以及消化产物的氨基酸组成、多肽组成及潜在生物活性。BO、FY、RO和SV均降低了草鱼肉蛋白的消化率,BO则加快了胃消化过程。RW、SM、BO、FY、RO和SV样品中分别鉴定出2 257、2 090、2 028、2 270、2 027和2 159种多肽序列,其中共有多肽为958种。抗氧化和ACE抑制活性测定结果表明,FY降低了鱼肉蛋白消化产物的ACE抑制率,其他烹饪方式则对ACE抑制活性没有显著影响(P>0.05),在不同抗氧化活性评价模型中,不同消化产物的抗氧化活性变化趋势不同,RO具有最高的Fe2+螯合能力和DPPH自由基清除活性,SM具有较强的·OH清除活性,SV的·O2-清除率最高,FY则具有最高的还原力。通过活性肽的筛选、合成和活性验证,共发现了4条新型ACE抑制肽LMF、LMW、LWM和FLW,IC50分别为48.1、2.9、12.5、87.0 μg/mL,且LWM同时兼具较强的抗氧化能力。本研究的发现有助于揭示烹饪方法与肉类蛋白营养价值之间的关系,为人们日常生活中草鱼烹饪方式的合理选择和工业化加工提供一定的理论依据。
[1] 秦萍, 廖玉华, 邱志华.生物靶向治疗高血压的研究进展[J].临床心血管病杂志, 2023, 39(1):6-10.QIN P, LIAO Y H, QIU Z H.Progress of bio-targeted treatment for hypertension[J].Journal of Clinical Cardiology, 2023,
[2] 李谋, 杨小琳, 赵金礼.食源性血管紧张素转换酶抑制肽的研究进展[J].医学综述, 2019, 25(8):1 490-1494;1500.LI M, YANG X L, ZHAO J L.Research progress in angiotensin-converting enzyme inhibitory peptides from foods[J].Medical Recapitulate, 2019, 25(8):1490-1494;1500.
[3] GRIENDLING K K, CAMARGO L L, RIOS F J, et al.Oxidative stress and hypertension[J].Circulation Research, 2021, 128(7):993-1020.
[4] 李晓杰, 李富强, 朱丽萍, 等.生物活性肽的制备与鉴定进展[J].齐鲁工业大学学报, 2021, 35(1):23-28.LI X J, LI F Q, ZHU L P, et al.Progress of preparation and identification of bioactive peptides[J].Journal of Qilu University of Technology, 2021, 35(1):23-28.
[5] 蔡燕萍, 余晓婉, 张庆春, 等.水产品生物活性肽的研究进展[J].食品与发酵工业, 2020, 46(16):249-256.CAI Y P, YU X W, ZHANG Q C, et al.Research progress of bioactive peptides in aquatic products[J].Food and Fermentation Industries, 2020, 46(16):249-256.
[6] YIN Y T, ZHOU L, PEREIRA J, et al.Insights into digestibility and peptide profiling of beef muscle proteins with different cooking methods[J].Journal of Agricultural and Food Chemistry, 2020,68(48):14243-14251.
[7] MITRA B, KRISTENSEN L, LAMETSCH R, et al.Cooking affects pork proteins in vitro rate of digestion due to different structural and chemical modifications[J].Meat Science, 2022, 192:108924.
[8] BHAT Z F, MORTON J D, BEKHIT A E D A, et al.Thermal processing implications on the digestibility of meat, fish and seafood proteins[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(5):4511-4548.
[9] 农业部渔业局. 中国渔业统计年鉴[Z].北京:中国农业出版社, 2021:31-40.Fisheries Bureau.China fishery statistics yearbook[Z].Beijing:China Agriculture Press, 2021:31-40.[10] SANDOVAL-SICAIROS E S, MIL N-NORIS A K, LUNA-VITAL D A, et al.Anti-inflammatory and antioxidant effects of peptides released from germinated amaranth during in vitro simulated gastrointestinal digestion[J].Food Chemistry, 2021, 343:128394.
N-NORIS A K, LUNA-VITAL D A, et al.Anti-inflammatory and antioxidant effects of peptides released from germinated amaranth during in vitro simulated gastrointestinal digestion[J].Food Chemistry, 2021, 343:128394.
[11] 卢亚东, 张成楠, 李秀婷, 等.不同干燥方式燕麦蛋白的性质及对肌原纤维蛋白凝胶特性的影响[J].食品科学技术学报, 2021, 39(6):53-63.LU Y D, ZHANG C N, LI X T, et al.Properties of oat proteins treated with different drying methods and effects on gel properties of myofibrillar protein[J].Journal of Food Science and Technology, 2021, 39(6):53-63.
[12] 李小锋, 张露, 马天新, 等.多宝鱼不同水解物肽段组成及体外抗氧化活性比较[J].食品工业科技, 2023, 44(3):95-101.LI X F, ZHANG L, MA T X, et al.Comparison of peptide composition and in vitro antioxidant activity of different hydrolysates of turbot meat[J].Science and Technology of Food Industry, 2023, 44(3):95-101.
[13] 马梦娇. 中华鳖肉抗氧化肽的制备及其抗衰老功能研究[D].无锡:江南大学, 2020.MA M J.Preparation of antioxidant peptides from Chinese soft-shelled turtle and its anti-aging activity[D].Wuxi:Jiangnan University, 2020.
[14] 张露, 刘鹏飞, 涂宗财, 等.香榧不同部位提取物的抗氧化和酶抑制活性比较分析[J].食品科学, 2018, 39(10):78-83.ZHANG L, LIU P F, TU Z C, et al.Comparison of antioxidant activity and enzyme inhibitory activity of different plant parts of Torreya grandis cv.merrillii[J].Food Science, 2018, 39(10):78-83.
[15] 郭洪辉, 张怡评, 洪专, 等.河豚鱼皮胶原寡肽螯合锌的体内体外抗氧化活性研究[J].食品工业科技, 2021, 42(5):66-71.GUO H H, ZHANG Y P, HONG Z, et al.Study on in vivo and in vitro antioxidant activity of collagen oligopeptide chelated zinc from puffer skin[J].Science and Technology of Food Industry, 2021, 42(5):66-71.
[16] 朱敏方. 草鱼鱼肉抗氧化肽的制备、分离鉴定及其活性研究[D].南昌:江西师范大学, 2020.ZHU M F.Preparation, isolation, identification and activity of antioxidant peptides from grass carp(Ctenopharyngodon idella) muscle[D].Nanchang:Jiangxi Normal University, 2020.
[17] TU M L, WANG C, CHEN C, et al.Identification of a novel ACE-inhibitory peptide from casein and evaluation of the inhibitory mechanisms[J].Food Chemistry, 2018, 256:98-104.
[18] LI X, GU Y X, HE S D, et al.Influence of pasteurization and storage on dynamic in vitro gastric digestion of milk proteins:Quantitative insights based on peptidomics[J].Foods, 2020, 9(8):998.
[19] 王慧平, 张欢, 陈倩, 等.鱼肉内源性蛋白酶对其贮藏期品质影响的研究进展[J].食品工业科技, 2021, 42(19):429-435.WANG H P, ZHANG H, CHEN Q, et al.Research progress on effects of endogenous protease on quality of fish during storage[J].Science and Technology of Food Industry, 2021, 42(19):429-435.
[20] 戚岱莎, 张清.食物油炸过程中丙烯酰胺和杂环胺的形成及控制方法研究进展[J].食品科学, 2021, 42(21):338-346.QI D S, ZHANG Q.Progress in research on formation mechanism and control methods for acrylamide and heterocyclic amines during food frying[J].Food Science, 2021, 42(21):338-346.
[21] ZHANG Y, WANG X H, WANG W, et al.Effect of boiling and frying on nutritional value and in vitro digestibility of rabbit meat[J].African Journal of Food Science, 2014, 8(2):92-103.
[22] OZVURAL E B, BORNHORST G M.Chemical and structural characteristics of Frankfurters during in vitro gastric digestion as influenced by cooking method and severity[J].Journal of Food Engineering, 2018, 229:102-108.
[23] 乔凤至, 侯率, 谭明乾.加工诱导形成的食源性荧光碳点研究进展[J].食品科学, 2022, 43(11):222-233.QIAO F Z, HOU S, TAN M Q.Recent progress in research on food-borne fluorescent carbon dots induced by food processing[J].Food Science, 2022, 43(11):222-233.
[24] SONG Y K, CAO L, LI J Q, et al.Interactions of carbon quantum dots from roasted fish with digestive protease and dopamine[J].Food &Function, 2019, 10(6):3706-3716.
[25] AHN C B, JE J Y, CHO Y S.Antioxidant and anti-inflammatory peptide fraction from salmon byproduct protein hydrolysates by peptic hydrolysis[J].Food Research International, 2012, 49(1):92-98.
[26] ZHAO D, HE J, ZOU X Y, et al.Influence of hydrothermal treatment on the structural and digestive changes of actomyosin[J].Journal of the Science of Food and Agriculture, 2019, 99(14):6209-6218.
[27] LI J Q, CAO L, LI D M, et al.Carbon dots from roasted mackerel (Scomberomorus niphonius) for free radical scavenging[J].LWT, 2019, 111:588-593.
[28] WANG N Y, WU Y Y, ZHAO X, et al.Food-borne nanocarriers from roast beef patties for iron delivery[J].Food &Function, 2019, 10(10):6711-6719.
[29] JIA X Y, ZHU M F, ZHANG L, et al.Extraction optimization and screening of antioxidant peptides from grass carp meat and synergistic-antagonistic effect[J].Food Science &Nutrition, 2022, 10(5):1481-1493.
[30] 林凯, 韩雪, 张兰威, 等.ACE抑制肽构效关系及其酶法制备的研究进展[J].食品科学, 2017, 38(3):261-270.LIN K, HAN X, ZHANG L W, et al.Progress in structure-activity relationship and enzymatic preparation of ACE inhibitory peptides[J].Food Science, 2017, 38(3):261-270.
[31] 胡田媛, 杨晨, 陈哲, 等.南瓜籽ACE抑制肽的Plastein反应修饰及分离鉴定[J].中国油脂, 2023, 48(2):29-35.HU T Y, YANG C, CHEN Z, et al.Plastein reaction modification of pumpkin seed ACE inhibitory peptide and its isolation and identification[J].China Oils and Fats, 2023, 48(2):29-35.