毛竹(Phyllostachys pubescens)属禾本科竹亚科刚竹属植物,主要分布于中国、日本、加拿大、韩国等地[1]。毛竹笋营养丰富,肉质脆嫩,富含蛋白质、氨基酸、膳食纤维、维生素等营养成分,具有抗炎、抗氧化、抗衰老、降血脂等功效,有“素食第一品”之称[2-3]。毛竹的出笋期季节性较强,且鲜笋易褐变和木质化,采摘后不能长期保存,故60%以上的鲜笋均用于加工[4]。干燥制粉是一种比较常见的果蔬加工方式,其通过脱水防止微生物腐败,延长果蔬货架期,减少果蔬体积,降低贮藏和运输成本。同时果蔬粉不仅可以作为固体冲调饮料供应市场,也可作为营养强化剂和风味增强剂广泛应用于食品加工中,提升附加值[5]。
不同干燥方式对果蔬粉品质影响差异显著。胡强等[6]研究发现真空冷冻干燥处理的苦竹笋粉总氨基酸及各呈味氨基酸含量均高于热风干燥。马尧[5]通过对比自然干燥、热风干燥、真空冷冻干燥、喷雾干燥4种干燥方式与超微粉碎结合制作的黄花菜粉品质,发现真空冷冻干燥和自然干燥制得的黄花菜粉综合得分较高。TIAN等[7]发现与新鲜香菇相比,热风干燥、真空干燥、微波干燥和微波真空干燥处理后的干香菇总游离氨基酸含量显著提高,微波真空干燥有助于保留更多的呈味氨基酸。目前对竹笋干燥领域的研究主要集中于干燥工艺及其对竹笋品质的影响方面[8-9],而不同干燥方式对竹笋氨基酸含量及蛋白质结构的影响的研究鲜有报道。因此,本实验以喷雾干燥(spray drying,SD)、热风干燥(hot air drying,HAD)、微波干燥(microwave drying,MD)、低温真空干燥(low-temperature vacuum drying,LVD)4种干燥方式制备得到毛竹笋全粉(Phyllostachys pubescens shoot powder,PPSP),通过单因素方差分析、主成分分析及综合评价、热图聚类分析等方式比较4组样品的氨基酸组成及含量,并基于拉曼光谱酰胺Ⅰ带分析其蛋白质二级结构变化,以期为高品质PPSP的制备提供理论参考。
1 材料与方法
1.1 材料与试剂
毛竹笋,福建省建瓯市美森竹业有限公司。盐酸、苯酚、柠檬酸(分析纯),成都市科隆化学品有限公司;柠檬酸钠pH缓冲溶液、17种氨基酸标准品、茚三酮(色谱纯),日本日立公司。
1.2 仪器与设备
FW135型中草药粉碎机,天津市泰斯特仪器有限公司;JMP-80胶体磨,广州市祥明机械设备有限公司;NT-H6均质机,南京市纳通机电制造有限公司;ADL311喷雾干燥机,日本雅马拓科学株式会社;DHG-9140电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;CEM SAM-255微波干燥仪,美国培安有限公司;DZF-6090Z电热真空干燥箱,上海跃进器械有限公司;L-8900011001全自动氨基酸分析仪,日本日立公司;DXR2010410激光共聚焦显微拉曼光谱仪,美国Thermo Fisher Scientific公司。
1.3 样品制备
将挑选的新鲜毛竹笋剥壳后切成厚度为0.3 cm的薄片,然后放入质量分数为0.2%的柠檬酸护色液中,料液比1∶5(g∶mL),浸泡20 min后用蒸馏水将笋片清洗3~4次,并沥干表面水分。采用SD、HAD、MD和LVD 4种不同的干燥方式在其较优干燥参数下对笋片进行干燥。具体如下:
SD样品:将一定质量笋片置于胶体磨中打浆,然后置于均质机中于30 MPa下均质2次,均质得到的乳液用喷雾干燥机进行喷雾干燥,进风温度200 ℃,出风温度80 ℃,入料流量50 mL/min,干燥结束后收集样品,过200目筛,得到金黄色的PPSP,含水量为8.03%。
HAD样品:将盛有一定质量笋片的托盘放入电热恒温鼓风干燥箱中,于70 ℃干燥10 h,将干燥后的样品粉碎后过200目筛,得到棕黄色的PPSP,含水量为8.13%。
MD样品:将一定质量的笋片放入微波干燥仪中,先于200 W功率下干燥22 min,间歇1 min,再干燥1 min,间歇1 min(5次),最后干燥0.5 min、间歇1 min(3次),干燥结束后粉碎,过200目筛,得到米黄色的PPSP,含水量为7.84%。
LVD样品:将一定质量的笋片放入电热真空干燥箱中,在真空度600 Pa,55 ℃干燥10 h,干燥结束后粉碎,过200目筛,得到淡黄色的PPSP,含水量为6.95%。
1.4 PPSP中氨基酸含量的测定
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》的方法,分别称取不同干燥方式的PPSP 50 mg于水解管中,先加入10 mL 6 mol/L盐酸,摇匀,加入3~4滴苯酚,待样品溶解后抽真空,密封水解管。将封口的水解管置于干燥箱内(110±1) ℃水解22 h后取出,冷却至室温。将冷却后的水解液过滤并转移到25 mL容量瓶中,用去离子水定容,摇匀待用。吸取2 mL定容后的溶液于旋转蒸发仪中,45 ℃蒸干,用2 mL去离子水溶解残留物再蒸干,反复操作2次后,加入0.02 mol/L盐酸定容至2 mL,用0.22 μm微孔滤膜过滤至1.5 mL进样瓶中,作为上机溶液。
分析条件:色谱柱(4.6 mm×60 mm),磺酸型阳离子交换树脂;检测波长440 nm和570 nm;洗脱液流速0.4 mL/min,柱温70 ℃;反应柱茚三酮流速0.35 mL/min,反应柱温135 ℃;采集时间55 min,进样量20 μL。结果以峰面积计算,采用外标法定量。
1.5 PPSP中蛋白质二级结构的测定
通过4种样品的拉曼光谱图酰胺Ⅰ带对蛋白质的二级结构进行定量分析,将不同干燥方式的PPSP置于载玻片上,用激光共聚焦显微拉曼光谱仪在785 nm激发波长下进行测试,激光功率120 mW,曝光时间60 s,3次扫描进行累加,扫描范围为400~3 500 cm-1。通过OMNIC 8.2软件对光谱图进行基线校正和平滑处理,使用PeakFit 4.12软件在1 600~1 700 cm-1波段进行去卷积和二阶导数拟合,计算各子峰面积得到蛋白质二级结构相对含量。
1.6 数据统计及分析
每组实验重复3次,采用Excel 2019进行数据整理和计算,采用SPSS 26.0软件进行单因素方差分析、相关性分析和主成分分析,采用Origin 2022软件进行实验绘图。
2 结果与分析
2.1 不同干燥方式对PPSP氨基酸组成及含量的影响
2.1.1 不同干燥方式PPSP中总氨基酸及必需氨基酸组成及含量分析
由表1可知,不同干燥方式的PPSP中均检出17种氨基酸。总氨基酸含量LVD样品与SD样品未见显著差异,HAD样品与MD样品未见显著差异,前两者明显较高(P<0.05)。其中LVD制备的PPSP总氨基酸含量最高,为29.19 g/100 g,其次为SD,HAD样品最低,为19.33 g/100 g,可能是由于LVD过程中温度较低,美拉德反应和蛋白质氧化反应程度较低,使氨基酸损失较少[10]。酪氨酸在4种干燥方式的PPSP中含量均最高,其中SD样品酪氨酸含量为5.48 g/100 g,显著高于其他3种干燥方式(P<0.05)。除酪氨酸和半胱氨酸外,其余15种氨基酸在LVD样品的含量均高于其他3种干燥方式。
表1 不同干燥方式PPSP氨基酸含量及组成 单位:g/100 g Table 1 Amino acid content and composition of PPSP dried using different drying methods
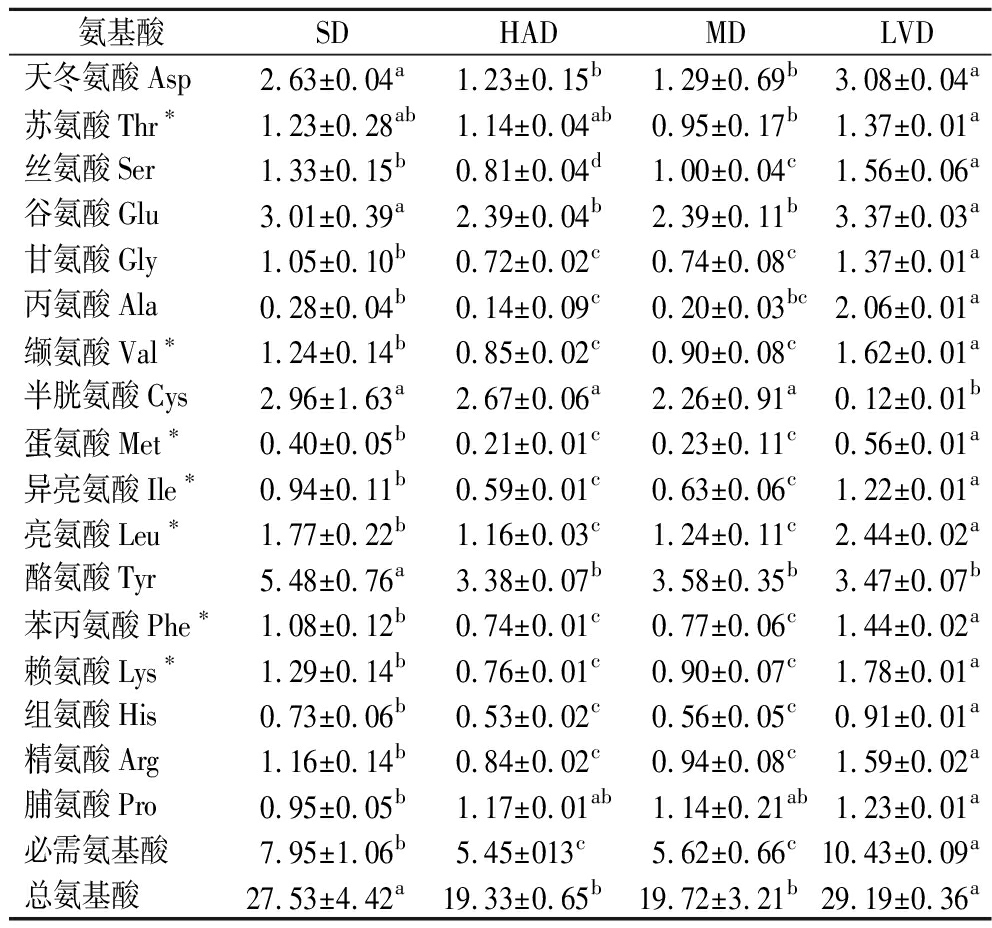
氨基酸SDHADMDLVD天冬氨酸Asp2.63±0.04a1.23±0.15b1.29±0.69b3.08±0.04a苏氨酸Thr∗1.23±0.28ab1.14±0.04ab0.95±0.17b1.37±0.01a丝氨酸Ser1.33±0.15b0.81±0.04d1.00±0.04c1.56±0.06a谷氨酸Glu3.01±0.39a2.39±0.04b2.39±0.11b3.37±0.03a甘氨酸Gly1.05±0.10b0.72±0.02c0.74±0.08c1.37±0.01a丙氨酸Ala0.28±0.04b0.14±0.09c0.20±0.03bc2.06±0.01a缬氨酸Val∗1.24±0.14b0.85±0.02c0.90±0.08c1.62±0.01a半胱氨酸Cys2.96±1.63a2.67±0.06a2.26±0.91a0.12±0.01b蛋氨酸Met∗0.40±0.05b0.21±0.01c0.23±0.11c0.56±0.01a异亮氨酸Ile∗0.94±0.11b0.59±0.01c0.63±0.06c1.22±0.01a亮氨酸Leu∗1.77±0.22b1.16±0.03c1.24±0.11c2.44±0.02a酪氨酸Tyr5.48±0.76a3.38±0.07b3.58±0.35b3.47±0.07b苯丙氨酸Phe∗1.08±0.12b0.74±0.01c0.77±0.06c1.44±0.02a赖氨酸Lys∗1.29±0.14b0.76±0.01c0.90±0.07c1.78±0.01a组氨酸His0.73±0.06b0.53±0.02c0.56±0.05c0.91±0.01a精氨酸Arg1.16±0.14b0.84±0.02c0.94±0.08c1.59±0.02a脯氨酸Pro0.95±0.05b1.17±0.01ab1.14±0.21ab1.23±0.01a必需氨基酸7.95±1.06b5.45±013c5.62±0.66c10.43±0.09a总氨基酸27.53±4.42a19.33±0.65b19.72±3.21b29.19±0.36a
注:*表示必需氨基酸。
4组样品中均检测出7种人体必需氨基酸,相对含量由高到低依次为:亮氨酸、赖氨酸、苏氨酸、缬氨酸、异亮氨酸、苯丙氨酸、蛋氨酸。LVD样品中必需氨基酸的含量最高,为10.43 g/100 g,占总氨基酸含量的35.75%,必需氨基酸成分保留较好,这与崔春等[11]的研究结果一致。HAD制备的PPSP总氨基酸含量和必需氨基酸含量均最低,可能是由于HAD的温度较高、时间较长,氨基酸发生Strecker降解反应转化为有机酸和其他风味物质,或者氨基酸和还原糖发生美拉德反应的速度大于氨基酸的生成速度[12],导致氨基酸损失。
2.1.2 不同干燥方式下PPSP中呈味氨基酸组成分析
食品风味的产生与食品中的呈味氨基酸有关。根据氨基酸呈味特性不同,将其分为鲜味、甜味、芳香族氨基酸等。谷氨酸与天冬氨酸呈现很强的鲜味,甘氨酸、丙氨酸、丝氨酸和脯氨酸表现出纯厚的甜味,芳香族氨基酸为包括苯丙氨酸和酪氨酸[13]。由表2可知,LVD和SD制备的PPSP中呈味氨基酸含量分别为17.58 g/100 g、15.81 g/100 g,无明显差异(P>0.05),显著高于HAD和MD样品的呈味氨基酸含量(P<0.05)。SD、HAD和MD样品呈味氨基酸的含量由高到低依次为:芳香族氨基酸、鲜味氨基酸、甜味氨基酸,而LVD制备的PPSP中鲜味氨基酸含量最高,为6.45 g/100 g,其次为甜味氨基酸。鲜味氨基酸含量LVD和SD样品未见差异,HAD和MD样品未见差异,前两者明显较高(P<0.05)。甜味氨基酸含量LVD制备的PPSP中最高,为6.22 g/100 g,SD样品次之,HAD、MD样品最低且未见显著差异(P>0.05)。芳香族氨基酸含量SD样品显著高于其他3种样品(P<0.05)。鲜味氨基酸和甜味氨基酸能缓和食物中的苦涩味,改善食物风味[14],丰富的呈味氨基酸对PPSP作为食品风味改良剂有重要作用。
表2 不同干燥方式PPSP中呈味氨基酸组成
Table 2 Composition of flavor amino acids in PPSP dried using different drying methods.

干燥方式鲜味氨基酸甜味氨基酸芳香族氨基酸呈味氨基酸合计含量/(g/100 g)相对含量/%含量/(g/100 g)相对含量/%含量/(g/100 g)相对含量/%含量/(g/100 g)相对含量/%SD5.64±0.43a20.493.61±0.34b13.116.56±0.88a23.8315.81±1.65a57.43HAD3.62±0.19b18.732.84±0.16c14.704.12±0.08b21.3110.58±0.43b54.74MD3.68±0.80b18.663.08±0.36c15.624.35±0.41b22.0611.11±1.57b56.34LVD6.45±0.07a22.106.22±0.09a21.314.91±0.09b16.8217.58±0.25a60.23
2.1.3 不同干燥方式PPSP必需氨基酸组成评价
食物蛋白质营养价值的优劣主要取决于其所含必需氨基酸的种类、数量和组成比例,其组成比例越接近人体需要氨基酸的比例,则质量越优,营养价值越高[15],如表3所示。在4组样品中,占总氨基酸含量最高的均为苯丙氨酸+酪氨酸,分别占比23.83%(SD)、21.31%(HAD)、22.06%(MD)、16.82%(LVD),与WHO/FAO氨基酸模式[16-17]相比表现出过剩;单一氨基酸含量最高的是亮氨酸,LVD和SD样品均超过WHO/FAO标准,且LVD样品中含量最高,达8.36%;组氨酸含量均高于WHO/FAO标准中的1.50,说明PPSP具备应用于婴儿或特殊人群食品中的潜力。4种干燥方式制备的PPSP的必需氨基酸/总氨基酸分别为28.88%(SD)、28.19%(HAD)、28.50%(MD)、35.73%(LVD),与标准有一定差距,表明干燥处理在一定程度上降低了PPSP的营养成分,导致其营养不够均衡。通过对比发现,LVD制备的PPSP中,除蛋氨酸+半胱氨酸含量未达到标准外,其余必需氨基酸含量均达到标准,且该干燥方式下的样品必需氨基酸/总氨基酸的比值比其他3组样品更为接近40%,氨基酸组成相对合理,营养价值较高。
表3 不同干燥方式PPSP中必需氨基酸占总氨基酸的质量分数与WHO/FAO标准模式谱比较
Table 3 Ratios of essential amino acids to total amino acids in PPSP dried using different drying methods in comparison with WHO/FAO recommended pattern
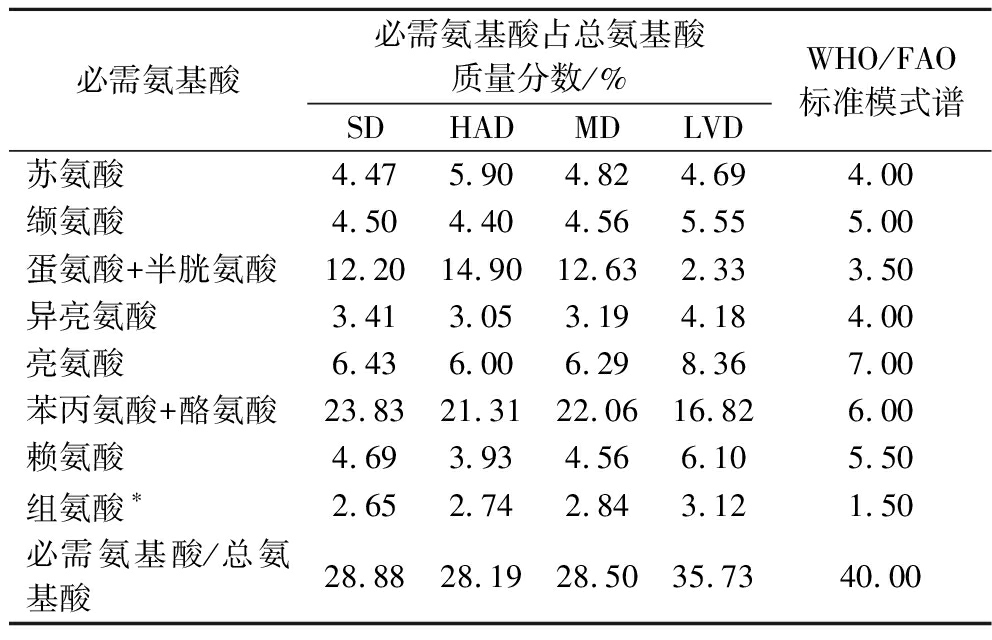
必需氨基酸必需氨基酸占总氨基酸质量分数/%SDHADMDLVDWHO/FAO标准模式谱苏氨酸4.475.904.824.694.00缬氨酸4.504.404.565.555.00蛋氨酸+半胱氨酸12.2014.9012.632.333.50异亮氨酸3.413.053.194.184.00亮氨酸6.436.006.298.367.00苯丙氨酸+酪氨酸23.8321.3122.0616.826.00赖氨酸4.693.934.566.105.50组氨酸∗2.652.742.843.121.50必需氨基酸/总氨基酸28.8828.1928.5035.7340.00
注:*表示婴儿或特定人群的必需氨基酸。
2.2 不同干燥方式PPSP氨基酸组成及含量的主成分分析
2.2.1 相关性分析
在进行主成分分析前需对相关指标进行适应性检验,相关性分析,结果如图1所示,图中红色代表成分呈正相关,蓝色代表呈负相关,颜色越深、圆圈越大代表成分之间的相关性越强[17],白色代表成分之间不存在显著相关性(P>0.05)。相关系数矩阵表明,半胱氨酸与其他16种氨基酸表现为负相关或无显著相关性,其余氨基酸之间表现为正相关(P<0.05)。酪氨酸、脯氨酸与其他16种氨基酸无显著相关性,其余氨基酸总体表现出显著相关性(P<0.05)和极显著相关性(P<0.01),且绝大部分氨基酸含量间Pearson系数r的绝对值均大于0.5,表明可以进一步对这4种样品的氨基酸进行主成分分析[18]。

图1 不同干燥方式PPSP中17种氨基酸的相关矩阵
Fig.1 Correlation matrices of 17 amino acids in PPSP dried using different drying methods
2.2.2 主成分分析
主成分分析是利用数据降维,通过线性变换将多个变量转化为几个互不相关的综合指标,用较少的变量反映原始数据的多元统计方法。如表4所示,主成分1和主成分2的初始特征值分别为13.280和1.927,均大于1,其中主成分1的方差贡献率达78.115%,表明样品品质受主成分1影响较大;2个主成分的累计方差贡献率达89.451%,说明其能够反映PPSP中氨基酸的大部分信息。
表4 主成分特征值及累计方差贡献率
Table 4 Eigenvalues and cumulative variance contribution rate of principal components
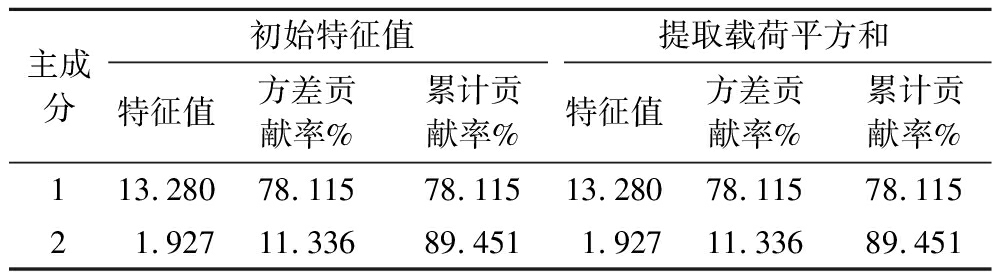
主成分初始特征值提取载荷平方和特征值方差贡献率%累计贡献率%特征值方差贡献率%累计贡献率%113.28078.11578.11513.28078.11578.11521.92711.33689.4511.92711.33689.451
主成分载荷矩阵能够反映出原始变量对主成分影响的大小,数值代表影响的大小,正负代表影响的方向[19]。由表5可知,除半胱氨酸外其余16种氨基酸在主成分1中均为正向影响,且除酪氨酸和脯氨酸载荷值较低之外,其余14种氨基酸在主成分1中的载荷值为0.718~1,表明主成分1能够反映这些氨基酸指标的信息,主成分1特征值大小与这些氨基酸含量成正比;主成分2中酪氨酸的载荷值最高,半胱氨酸次之,分别为0.928和0.742,表明主成分2能够反映这2种氨基酸的基本信息。上述结果表明,主成分1和主成分2可以用于代替氨基酸指标对4种不同干燥方式制备的PPSP进行综合评价。
表5 主成分载荷矩阵
Table 5 Principal component loading matrix
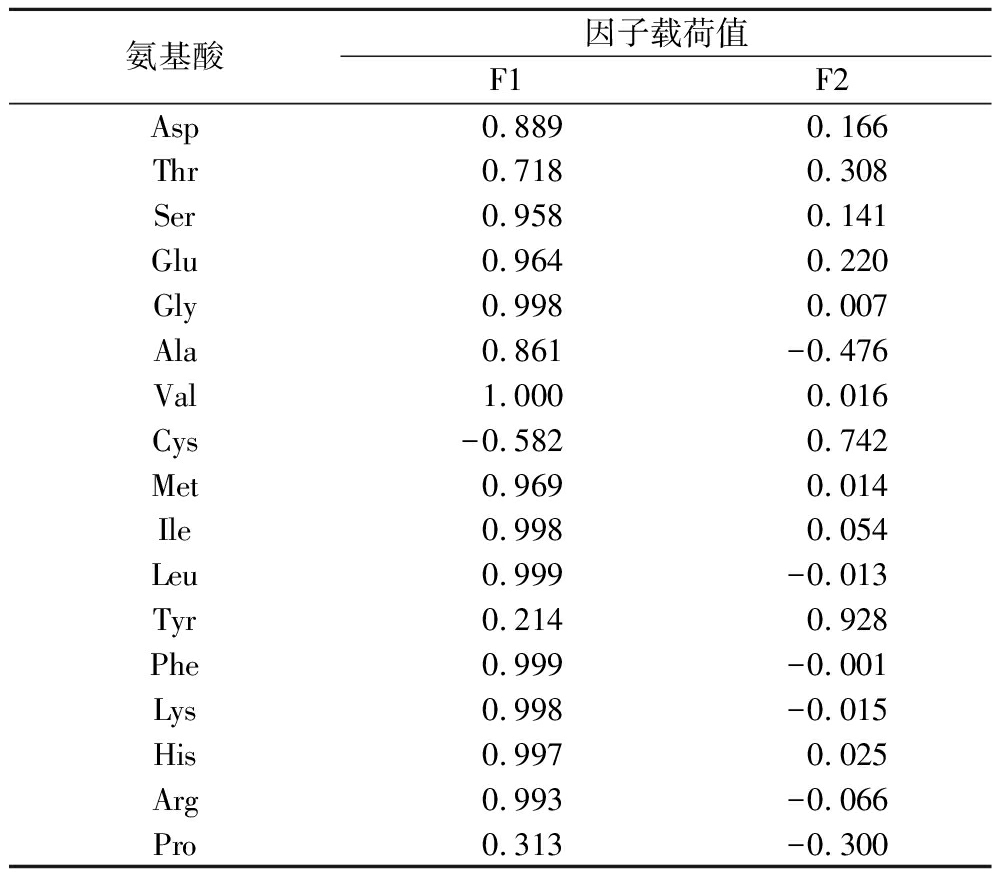
氨基酸因子载荷值F1F2Asp 0.889 0.166Thr0.7180.308Ser0.9580.141Glu0.9640.220Gly0.9980.007Ala0.861-0.476Val1.0000.016Cys-0.5820.742Met0.9690.014Ile0.9980.054Leu0.999-0.013Tyr0.2140.928Phe0.999-0.001Lys0.998-0.015His0.9970.025Arg0.993-0.066Pro0.313-0.300
2.2.3 综合评价
如表6所示,4种干燥方式样品得分根据主成分1由高到低为:LVD、SD、MD、HAD;根据主成分2由高到低为:SD、LVD、HAD、MD。由于2个主成分的贡献率有差异,将每个主成分的特征值与所提取主成分总的特征值之和的比例作为权重[20],得出主成分综合得分模型:F=0.781 15F1+0.113 36F2。由表6可知,不同干燥方式制备的PPSP综合得分之间差异显著(P<0.05),与单因素分析结果一致。LVD制备的PPSP综合得分最高,达3.44,综合排序为1,说明在该干燥方式下制备的PPSP中氨基酸含量较高,综合品质较其他3种干燥方式高。其他3组样品综合得分由高到低依次为:SD、MD、HAD。
表6 不同干燥方式PPSP的主成分得分和综合得分
Table 6 Principal component scores and comprehensive scores of PPSP dried using different drying methods
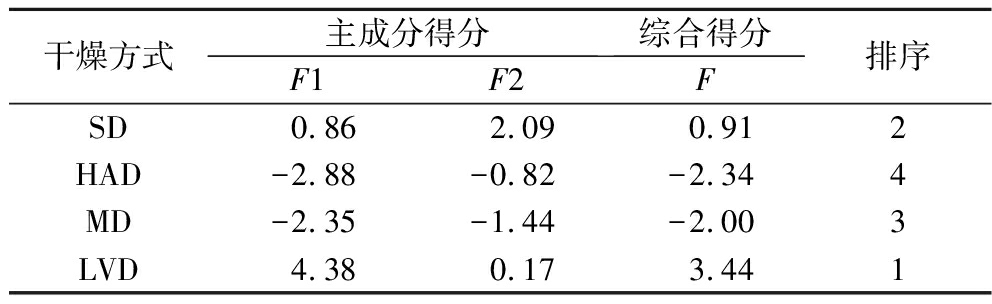
干燥方式主成分得分综合得分F1F2F排序SD 0.86 2.09 0.912HAD-2.88-0.82-2.344MD-2.35-1.44-2.003LVD4.380.173.441
2.3 不同干燥方式PPSP氨基酸组成及含量的热图聚类分析
聚类分析法可将受试样本划分为不同类群进行评价分析,其结果具有综合性、客观性和科学性[18]。由图2可知,4种干燥方式的PPSP可分为3类,第1类是LVD的样品,除酪氨酸与半胱氨酸含量较低之外,其余氨基酸含量均为最高,该干燥方式下的PPSP氨基酸营养品质较高;第2类是SD样品,氨基酸品质中等;HAD和MD的样品为第3类,各氨基酸含量均偏低,品质一般。聚类分析结果与单因素方差分析、主成分分析及综合评价得到的结果相互印证,能较好地反映出不同干燥方式的PPSP氨基酸含量及组成之间的差异性,可为制备高品质PPSP提供一定依据。
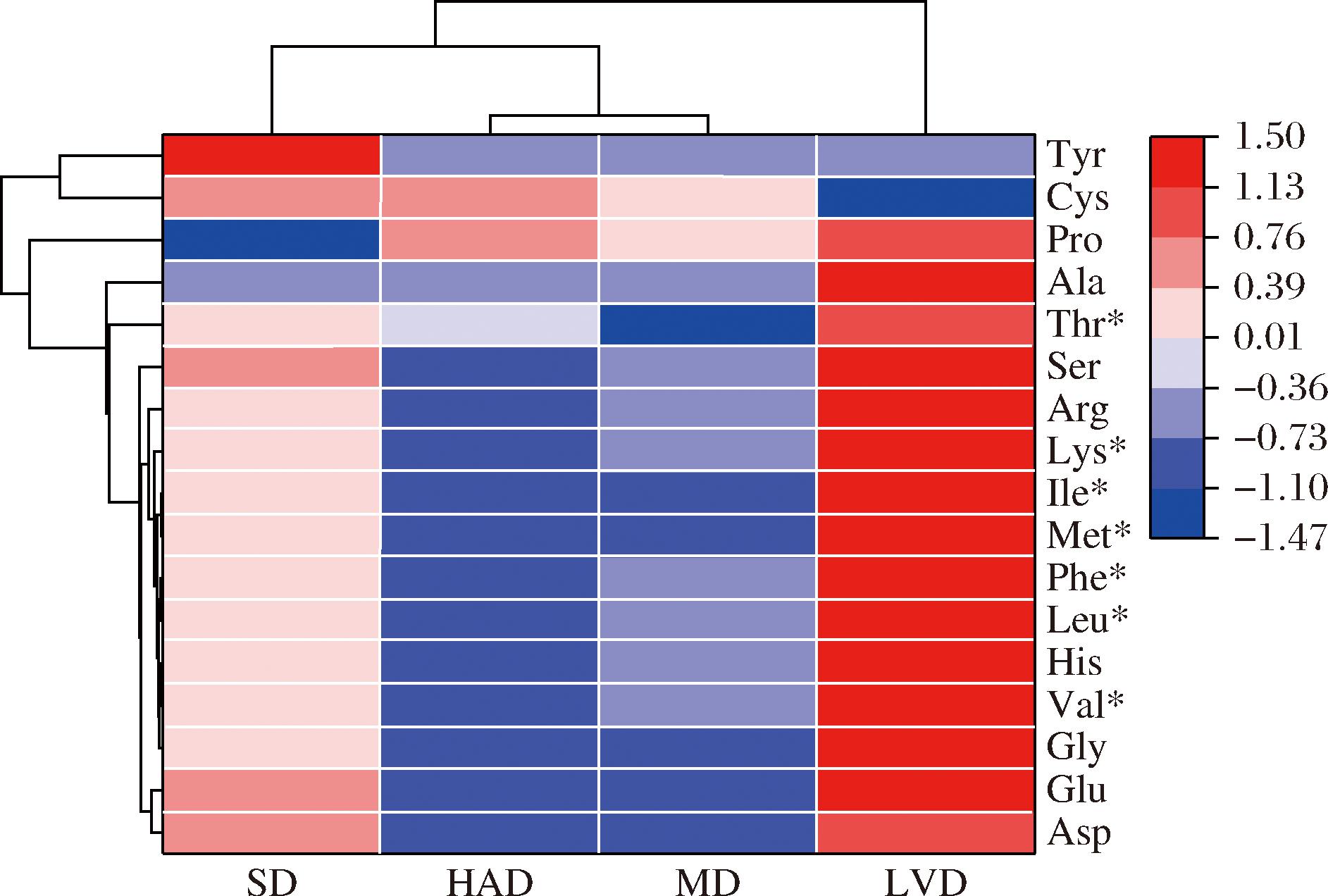
图2 不同干燥方式PPSP氨基酸含量聚类热图
Fig.2 Cluster heatmap of amino acid content in PPSP dried using different drying methods
注:*表示必需氨基酸。
2.4 不同干燥方式PPSP中蛋白质二级结构分析
2.4.1 拉曼光谱分析
酰胺I带(1 600~1 700 cm-1)是蛋白质拉曼光谱中最容易识别的区域[21],主要涉及肽基团的C![]() O拉伸,提供蛋白质二级结构的信息。蛋白质中二级结构含量的不同,会影响其在酰胺I区的峰形:α-螺旋结构含量高的蛋白在该谱段的峰会集中在1 645~1 657 cm-1之间,β-折叠结构含量高的会集中在1 665~1 680 cm-1之间,而1 660 cm-1之间附近的拉曼峰则预示蛋白质无规卷曲结构含量高[22-24]。图3为4种干燥方式的PPSP在酰胺 Ⅰ 带(1 600~1 700 cm-1)的拉曼光谱图。由图3可知,4种干燥方式的PPSP拉曼光谱图变化趋势基本相同。通过分析4种样品在酰胺Ⅰ带拉曼谱图的拉曼位移、特征峰、峰面积等参数,可以得到不同干燥方式对PPSP中蛋白质二级结构的影响。
O拉伸,提供蛋白质二级结构的信息。蛋白质中二级结构含量的不同,会影响其在酰胺I区的峰形:α-螺旋结构含量高的蛋白在该谱段的峰会集中在1 645~1 657 cm-1之间,β-折叠结构含量高的会集中在1 665~1 680 cm-1之间,而1 660 cm-1之间附近的拉曼峰则预示蛋白质无规卷曲结构含量高[22-24]。图3为4种干燥方式的PPSP在酰胺 Ⅰ 带(1 600~1 700 cm-1)的拉曼光谱图。由图3可知,4种干燥方式的PPSP拉曼光谱图变化趋势基本相同。通过分析4种样品在酰胺Ⅰ带拉曼谱图的拉曼位移、特征峰、峰面积等参数,可以得到不同干燥方式对PPSP中蛋白质二级结构的影响。
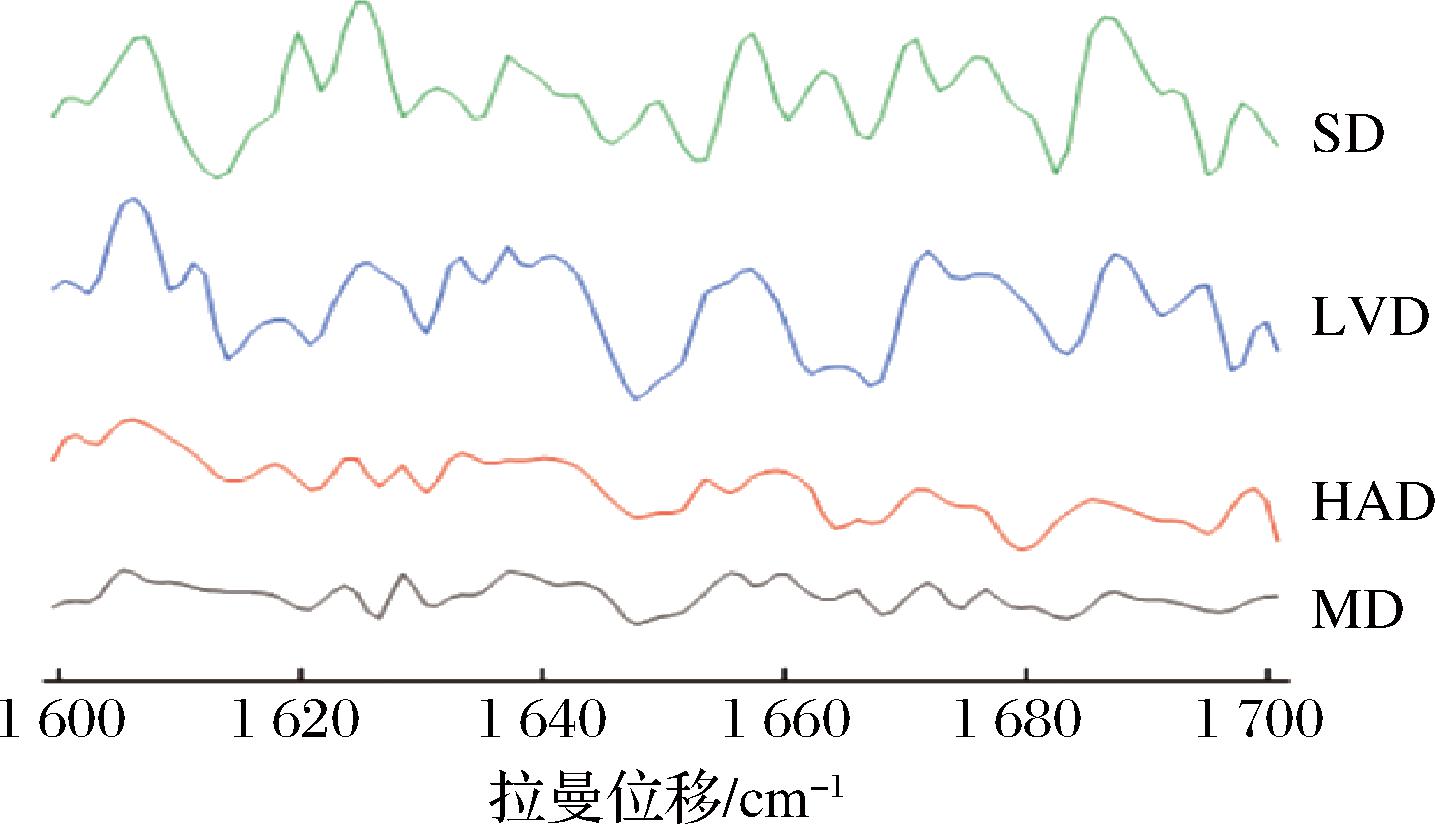
图3 不同干燥方式PPSP酰胺Ⅰ区拉曼光谱
Fig.3 Raman spectrogram on amide 1 region of PPSP dried using different drying methods.
2.4.2 不同干燥方式PPSP蛋白质二级结构变化
通过将4种样品在酰胺Ⅰ带的迭代拟合曲线与酰胺I带中蛋白质二级结构的特征条带进行对比,得到了不同干燥方式PPSP的蛋白质二级结构质量分数,如图4所示,4种干燥方式的样品蛋白质二级结构中,β-折叠占比最高,4组样品中均达42%以上,其次是β-转角,说明PPSP中主要的蛋白质二级结构为β-折叠和β-转角,这与席宇航[25]分析竹笋蛋白质二级结构的结果一致。在4组样品中,HAD的样品β-转角含量最低,α-螺旋、β折叠、无规则卷曲含量均为最高,其原因可能是干燥过程中β-转角伸展,打破了蛋白质静电斥力和疏水相互作用平衡,促进蛋白质热聚集体形成。研究表明,反向平行的折叠结构在聚集的蛋白质分子中形成[26],β-折叠结构的增多从侧面反映蛋白发生了聚集。相较于SD和MD的样品,LVD样品中β-折叠含量较低,无规则卷曲含量较高,可能是因为干燥过程中肽链的氢键等分子间相互作用力被破坏,促使其结构从β-折叠向无规则卷曲转变[27]。
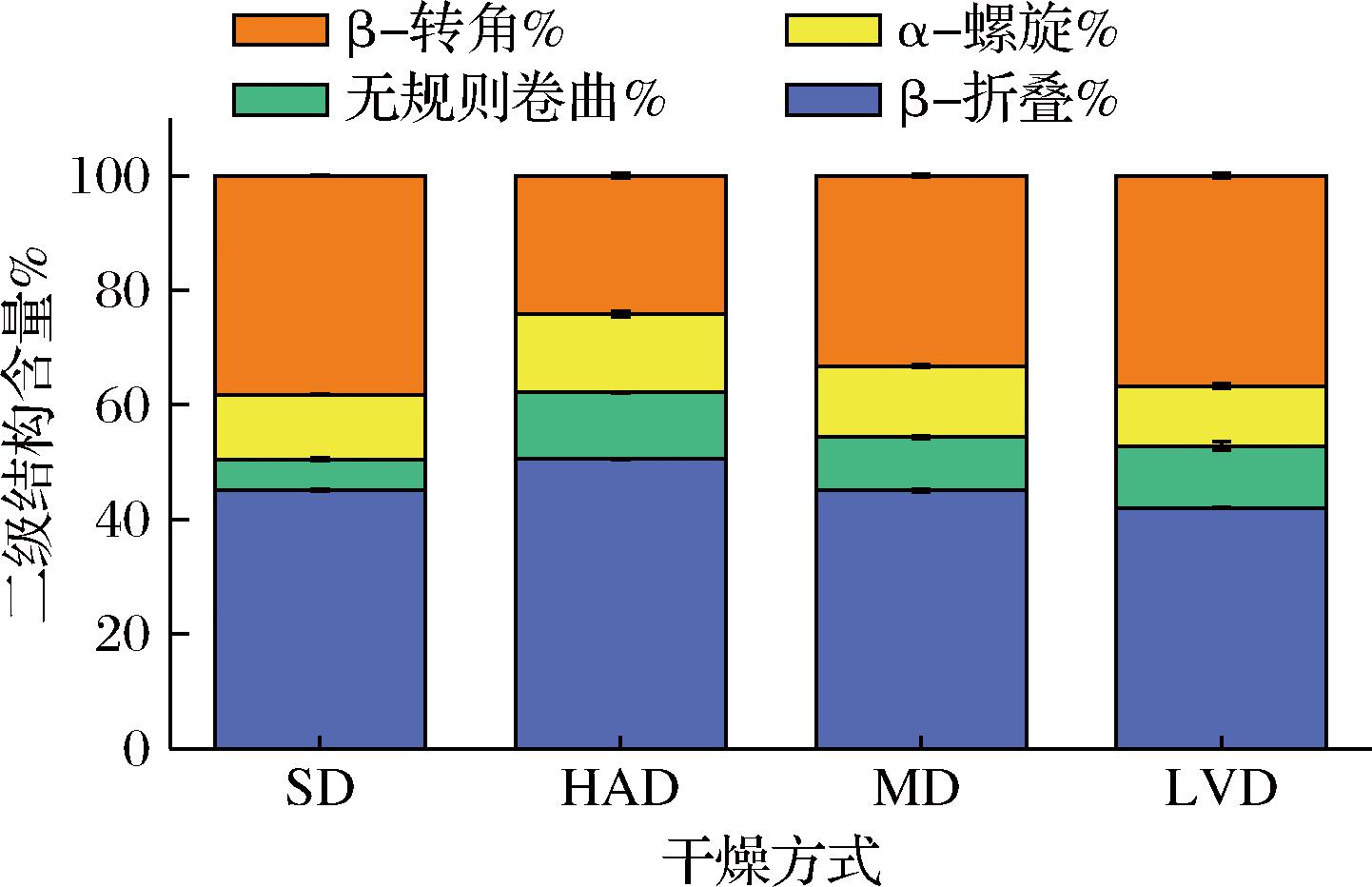
图4 不同干燥方式PPSP中蛋白质二级结构的相对含量
Fig.4 The relative content of protein secondary structures in PPSP dried using different drying methods.
3 结论
PPSP中共含有17种氨基酸及7种必需氨基酸,酪氨酸含量最为丰富。对比不同干燥方式PPSP中总氨基酸含量、总必需氨基酸含量、呈味氨基酸含量由高到低依次均为:LVD>SD>MD>HAD,LVD能够最大程度保留氨基酸成分。LVD样品的氨基酸组成最接近WHO/FAO标准模式,氨基酸组成相对合理,营养价值较高。利用主成分法构建PPSP氨基酸成分综合评价模型计算得出,LVD样品综合得分最高,氨基酸品质最好,其次为SD样品。4种干燥方式的样品蛋白质二级结构中,β-折叠占比最高,其次是β-转角。干燥方式对PPSP蛋白质各类二级结构相对含量影响差异显著,HAD的样品β-转角含量最低,α-螺旋、β折叠、无规则卷曲含量均为最高。综上,LVD能最大程度地保留PPSP的氨基酸成分,且制备的样品氨基酸营养品质较高。以上实验结果可为毛竹笋干燥及其全粉的加工提供理论依据。
[1] CHAUHAN O P, UNNI L E, KALLEPALLI C, et al.Bamboo shoots:Composition, nutritional value, therapeutic role and product development for value addition[J].International Journal of Food and Fermentation Technology, 2016, 6(1):1.
[2] SATYA S, BAL L M, SINGHAL P, et al.Bamboo shoot processing:Food quality and safety aspect (a review)[J].Trends in Food Science &Technology, 2010, 21(4):181-189.
[3] WANG N, WU L R, ZHANG F S, et al.Modifying the rheological properties, in vitro digestion, and structure of rice starch by extrusion assisted addition with bamboo shoot dietary fiber[J].Food Chemistry, 2022, 375:131900.
[4] 蒋小雅, 郑炯.竹笋干燥技术及其对竹笋品质的影响[J].食品与发酵工业, 2016, 42(6):260-264.JIANG X Y, ZHENG J.Research advances in drying technology and its impact on the quality of bamboo shoots[J].Food and Fermentation Industries, 2016, 42(6):260-264.
[5] 马尧. 不同干燥方式对黄花菜粉品质影响及喷雾干燥工艺优化[D].银川:宁夏大学, 2022.MA Y.Influence of different drying methods on the quality of daylily powder and optimization of spray drying process[D].Yinchuan:Ningxia University, 2022.
[6] 胡强, 王延云, 王燕, 等.两种干燥方式对苦竹笋粉营养成分的影响[J].乐山师范学院学报, 2023,38(8):21-26.HU Q, WANG Y Y, WANG Y, et al.Effects of two drying methods on nutrient composition of powder of bitter bamboo shoot[J].Journal of Leshan Normal University, 2023,38(8):21-26.
[7] TIAN Y T, ZHAO Y T, HUANG J J, et al.Effects of different drying methods on the product quality and volatile compounds of whole shiitake mushrooms[J].Food Chemistry, 2016, 197(Pt A):714-722.
[8] 耿想, 姚曦, 尤俊昊, 等.不同干燥方式对竹笋品质的影响[J].食品与发酵工业, 2022, 48(16):144-149.GENG X, YAO X, YOU J H, et al.Effect of different drying methods on the quality of bamboo shoots[J].Food and Fermentation Industries, 2022, 48(16):144-149.
[9] 苏煌杰, 刘明鑫, 刘斌雄, 等.响应面法优化竹笋过热蒸汽与真空联合干燥工艺[J].食品工业科技, 2020, 41(5):182-187.SU H J, LIU M X, LIU B X, et al.Optimization of superheated steam combined vacuum drying technology of bamboo shoots by response surface method[J].Science and Technology of Food Industry, 2020, 41(5):182-187.[10] 孙鹤, 史梦佳, 谢洪轩, 等.不同干燥方式对牡蛎非挥发性呈味物质的影响[J].食品科技, 2022, 47(5):173-181.SUN H, SHI M J, XIE H X, et al.Effects of different drying methods on nonvolatile flavor components in oyster[J].Food Science and Technology, 2022, 47(5):173-181.
[11] 崔春, 梁佳欣, 袁梦, 等.不同干燥方式对甘薯固体香料挥发性/半挥发性成分和表面结构的影响[J].食品工业科技, 2023, 44(10):27-35.CUI C, LIANG J X, YUAN M, et al.Effects of different drying methods on volatile/semi-volatile components and surface structure of sweet potato solid spice[J].Science and Technology of Food Industry, 2023, 44(10):27-35.
[12] YANG R L, LI Q, HU Q P.Physicochemical properties, microstructures, nutritional components, and free amino acids of Pleurotus eryngii as affected by different drying methods[J].Scientific Reports, 2020, 10(1):121.
[13] 杨苞梅, 姚丽贤, 国彬, 等.不同品种荔枝果实游离氨基酸分析[J].食品科学, 2011, 32(16):249-252.YANG B M, YAO L X, GUO B, et al.Analysis of free amino acids in litchi fruits from different cultivars[J].Food Science, 2011, 32(16):249-252.
[14] 安朝丽门, 钱磊, 姜迎迎, 等.不同干燥方式对滑子蘑滋味物质的影响[J].保鲜与加工, 2022, 22(10):69-75.AN C, QIAN L, JIANG Y Y, et al.Effects of different drying methods on the taste substances of Pholiota microspora[J].Storage and Process, 2022, 22(10):69-75.
[15] 侯娜, 赵莉莉, 魏安智, 等.不同种质花椒氨基酸组成及营养价值评价[J].食品科学, 2017, 38(18):113-118.HOU N, ZHAO L L, WEI A Z, et al.Amino acid composition and nutritional quality evaluation of different germplasms of Chinese prickly ash(Zanthoxylum bungeanum Maxim)[J].Food Science, 2017, 38(18):113-118.
[16] ARENTSON-LANTZ E, CLAIRMONT S, PADDON-JONES D, et al.Protein:A nutrient in focus[J].Applied Physiology, Nutrition, and Metabolism = Physiologie Appliquee, Nutrition et Metabolisme, 2015, 40(8):755-761.
[17] MILLWARD D J.Amino acid scoring patterns for protein quality assessment[J].The British Journal of Nutrition, 2012, 108(Suppl 2):S31-S43.
[18] 葛帅, 王蓉蓉, 王颖瑞, 等.湖南常见辣椒品种游离氨基酸主成分分析及综合评价[J].食品科学技术学报, 2021, 39(2):91-102.GE S, WANG R R, WANG Y R, et al.Principal component analysis and comprehensive evaluation of free amino acids of different peppers in Hunan[J].Journal of Food Science and Technology, 2021, 39(2):91-102.
[19] 唐史杰, 尹明雨, 松冈亮辅, 等.市售沙拉酱游离氨基酸组成的主成分分析与层次聚类分析[J].食品与发酵工业, 2021, 47(10):222-228.TANG S J, YIN M Y, MATSUOKA R, et al.The composition analysis of free amino acids in market salad dressings using principal component analysis and cluster analysis[J].Food and Fermentation Industries, 2021, 47(10):222-228.
[20] 李强, 何彩, 史星雲, 等.不同种源黑果枸杞果实游离氨基酸的品质评价[J].经济林研究, 2023, 41(1):26-35.LI Q, HE C, SHI X Y, et al.Quality evaluation of free amino acids in fruits for different provenances of Lycium ruthenicum[J].Non-wood Forest Research, 2023, 41(1):26-35.
[21] ZHOU X X, JIANG S, ZHAO D D, et al.Changes in physicochemical properties and protein structure of surimi enhanced with camellia tea oil[J].LWT, 2017, 84:562-571.
[22] LI-CHAN E C Y.The applications of Raman spectroscopy in food science[J].Trends in Food Science &Technology, 1996, 7(11):361-370.
[23] LI-CHAN E, NAKAI S, HIROTSUKA M.Raman Spectroscopy as a Probe of Protein Structure in Food Systems[M]//YADA RY, JACKMAN RL, SMITH JL.Protein Structure-Function Relationships in Foods.Boston, MA:Springer, 1994:163-197.
[24] NGARIZE S, HERMAN H, ADAMS A, et al.Comparison of changes in the secondary structure of unheated, heated, and high-pressure-treated beta-lactoglobulin and ovalbumin proteins using Fourier transform Raman spectroscopy and self-deconvolution[J].Journal of Agricultural and Food Chemistry, 2004, 52(21):6470-6477.
[25] 席宇航. 竹笋蛋白基食品胶体体系的构建与应用[D].杭州:浙江大学, 2022.XI Y H.Construction and application of bamboo shoot protein-based food colloid system[D].Hangzhou:Zhejiang University, 2022.
[26] ELLEPOLA S W, CHOI S M, MA C Y.Conformational study of globulin from rice (Oryza sativa) seeds by Fourier-transform infrared spectroscopy[J].International Journal of Biological Macromolecules, 2005, 37(1-2):12-20.
[27] MA C Y, ROUT M K, PHILLIPS D L.Study of thermal aggregation and gelation of oat globulin by Raman spectroscopy[J].Spectroscopy, 2003, 17(2-3):417-428.