在小麦粉加工过程中,小麦胚乳被碾磨分级为不同的粉流,根据粉流精度的不同,组合成前路粉、中路粉与后路粉3种基本粉。前路粉主要来自于小麦胚乳芯部的物料,后路粉主要来自糊粉层和麦麸等胚乳外部的物料。与前路粉相比,后路粉虽然蛋白含量高,但存在着加工精度低、色泽差、灰分高等缺点[1-2],由于其食品制作性能较差,后路粉目前被广泛用于生产谷朊粉(面筋蛋白粉)和淀粉的原料。由后路粉分离出的面筋蛋白也存在着面筋质量差、黏弹性不强[3]等问题,因此在谷朊粉生产加工中,对后路粉进行处理以提高其分离谷朊粉的品质,是提升后路粉加工适应性的一种有效手段。
活性大豆粉(active soybean powder,ASF)是一种天然食品配料,它是指脂肪氧合酶活性保存完好的大豆粉,其组成成分包括大豆蛋白、脂质与脂肪氧合酶(lipoxygenase,LOX)等。据相关报道,早在1934年活性大豆粉就已经作为漂白剂被添加到小麦粉当中[4],其漂白原理是活性大豆粉中含有的高活性脂肪氧合酶通过耦合反应破坏了小麦粉中的胡萝卜素的双键结构,同时氧化过程中产生的氧化自由基也会破坏小麦粉中的类胡萝卜素进而达到漂白作用。除了对小麦粉色度的影响外,还有研究报道了添加一定量的活性大豆粉可以利用大豆淀粉与小麦淀粉的吸水竞争进而对馒头的体积进行改善[5];LEBESI等[6]报道了小麦添加大豆粉后会延长面团的稳定时间并且增加了面团的抗拉伸力;石晶红等[7]通过实验发现添加了大豆粉后小麦粉的糊化特性发生了显著改变,大豆粉的添加使混合粉中的蛋白质与纤维素含量上升,淀粉相对含量减少从而降低了小麦粉的峰值黏度、低谷黏度、崩解值与最终黏度。目前行业内对活性大豆粉影响小麦面筋蛋白流变特性的研究较少,本文通过研究添加不同比例活性大豆粉的后路粉面筋蛋白的流变学特性的变化,明确活性大豆粉对后路粉面筋蛋白黏弹性与拉伸特性的影响,并观察其空间结构变化,为行业改善后路粉面筋蛋白品质提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
某面粉厂生产线后路粉;新鲜黄豆,当年新收获的籽粒;三羟甲基氨基甲烷(Tris)、甘氨酸、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴酚蓝、NaCl、尿素、牛血清蛋白,上海阿拉丁试剂有限公司,纯度除特殊说明均为分析级。
1.2 仪器与设备
万能粉碎机,北京兴时利和科技瓮;JHMZ型针式和面机,郑州中谷机械设备有限公司;真空冷冻干燥机,北京四环科学仪器厂有限公司;箱式电阻炉,上海跃进医疗器械厂;FossKjeltec8-400全自动凯氏定氮仪,福斯分析仪器公司;恒温水浴振荡器,金坛市华峰仪器有限公司;Avanti J-E高速冷冻离心机,上海贝克曼库尔特生命科学有限公司;紫外分光光度计,上海精密科学仪器有限公司;哈克RS6000流变仪,德国Haake公司;TA.XT plus质构仪,德国Stable Micro Systems公司;Nicolet iS50傅里叶红外变换光谱仪,美国赛默飞世尔科技;荧光分光光度计,美国VARIAN公司。
1.3 实验方法
1.3.1 活性大豆粉的制备
活性大豆粉的制备参考阮有志等[8]的方法并稍加修改,使用万能粉碎机粉碎适量新鲜黄豆,每20 s停止1次并且等待粉碎机温度下降后再次进行粉碎,防止粉碎过程中产生的热量破坏黄豆中的脂肪氧合酶活性。将粉碎完毕的大豆粉过100目筛后真空保存于低温保鲜柜中备用。
1.3.2 面筋蛋白的制备
将活性大豆粉按照0、0.2%、0.4%、0.6%、0.8%、1.0%的添加比例(质量分数)添加至后路粉中并且充分混匀。面筋蛋白制备方法参考徐小青等[9]的方法并稍加改进,取50 g混合粉与25 mL蒸馏水于针式和面机中和面3 min,和面结束后将面团放置于25 ℃醒发箱醒发30 min,醒发结束后用流动的水对面团进行冲洗直至冲洗水不浑浊。使用真空冷冻干燥机冻干洗净的湿面筋后用万能粉碎机研磨面筋蛋白成粉过100目筛即得样品A0、A1、A2、A3、A4、A5。
1.3.3 基本理化指标
湿面筋的测定参考GB/T 5506.1—2008《小麦和小麦粉 面筋含量 第1部分:手洗法测定湿面筋》方法;灰分的测定参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》方法;蛋白质的测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》方法;吸水率的测定参考GB/T 21924—2008《谷朊粉》方法;面筋指数的测定参考LS/T 6102—1995《小麦粉湿面筋质量测定法面筋指数法》方法。
1.3.4 面筋蛋白流变学特性的影响
参考了PERESSINI等[10]、DU等[11]的方法测定了面筋蛋白的流变学特性,将按照1.3.2节方法制备的2~3 g湿面筋放置在直径为35 mm的2块平行板中并且将其间隙设置为1 mm,当平行板压至设定位置后小心切去多余的样品并用硅油封住四周,等待3 min后开始测量,测量具体参数如下:频率扫描参数设置为固定应力15 Pa;频率范围0.1~10 Hz,蠕变回复参数设置为固定应力15 Pa;蠕变时间300 s;恢复时间600 s。以上步骤均要保持温度为25 ℃,且在样品黏弹性区间进行。
1.3.5 面筋蛋白拉伸特性的测定
参考了SCHERF等[12]的方法并稍作修改。将质构仪设置为拉伸模式后把按照方法1.3.2节制备好的湿面筋放置于SMS/Kieffer模具上并压紧,于(25±1) ℃温度下保持10 min后将模具切好的细条状湿面筋放在质构仪上进行测试。测试结果为面筋断裂力与断裂距离,分别表征面筋蛋白的面筋强度与延展性。
1.3.6 面筋蛋白游离巯基的测定
参考了LUO等[13]的方法测定,取40 mg不同冻干面筋蛋白样品溶于5 mL SDS-Tris-Gly缓冲液(1.042 g Tris,0.676 g甘氨酸,0.149 g EDTA,2.5 g SDS,定容至100 mL)反应1 h(每10 min涡旋30 s)后进行低温离心(4 ℃,5 000×g,10 min)。取1 mL离心完成后的上清液加40 μL DTNB溶液(4 g/L)充分混合反应30 min后使用紫外分光光度计于412 nm处测定其吸光度。游离巯基数量,按公式(1)计算:
—SH/(μmol/g)=73.53×A412/ρ
(1)
式中:A412,样品在412 nm处所测吸光度;ρ,蛋白质量浓度,即8 mg/mL。
1.3.7 面筋蛋白表面疏水性的测定
参考CHELH等[14]的方法稍作改动。取10 mg不同冻干面筋蛋白样品溶解在1 mL磷酸盐缓冲液(pH 7.0,0.02 mmol/L)中,加入200 μL溴酚蓝指示剂(1 mg/mL)并混合均匀10 min后离心(5 000×g,10 min),取0.5 mL上清液用水稀释至原体积的10倍,用酶标仪在595 nm处测量吸光度。溴酚蓝结合量的计算如公式(2)所示:
溴酚蓝结合量/μg=200×(A空-A样)/A空
(2)
式中:A空,空白组(不加样品)在595 nm处测得的吸光度;A样,样品在595 nm处测得的吸光度。
1.3.8 面筋蛋白麦谷蛋白大聚体(glutenin macropolymer,GMP)的测定
面筋蛋白GMP的测定参考FENG等[15]的方法,精准称取0.05 g的不同冻干面筋蛋白样品溶于10 mL SDS提取液(15 g/L),充分混匀后低温离心(10 000×g,10 min,4 ℃),离心完成后将上清液倒出后再加入10 mL上述SDS提取液,重复离心。将2次离心完成后的沉淀物使用自动凯式定氮仪进行测定,得到的蛋白质含量约等于该面筋蛋白GMP含量。
1.3.9 面筋蛋白分子间作用力的测定
参考LI等[16]的方法并进行适当修改,通过面筋蛋白在不同试剂中的溶解度来评估非共价键相互作用。以磷酸盐缓冲液(0.05 mol/L,pH 7)为底液,分别加入0.05 mol/L NaCl、0.6 mol/L NaCl、0.6 mol/L NaCl+1.5 mol/L尿素、0.6 mol/L尿素+8 mol/L尿素制成溶液S1、S2、S3、S4。称取0.2 g不同冻干面筋蛋白样品溶于上述4种5 mL溶液,充分涡旋混匀后将其放入恒温水浴振荡器中摇匀1 h(25 ℃,200 r/min)。摇匀结束后进行低温离心(10 000×g,15 min,4 ℃),取离心后上清液用考马斯亮蓝法测定蛋白质含量,以牛血清蛋白制作标准曲线,用mg/g表示可溶性蛋白含量。S1与S2的可溶性蛋白之差表示离子键强度,S3与S2的可溶性蛋白之差表示氢键强度,S4与S3的可溶性蛋白之差表示疏水相互作用强度。
1.3.10 傅里叶变换红外光谱
参考LIU等[17]的方法并稍加修改,使用傅立叶变换红外光谱对不同冻干面筋蛋白样品进行二级结构测定。面筋蛋白粉先与烘干后的KBr按1∶100的比例混合,再研磨成膜。在400~4 000 cm-1 的范围内进行了64次扫描,分辨率为4 cm-1。使用Peakfit软件分析了光谱的1 600~1 700 cm-1酰胺I带区域,并进行了两点基线校正。采用高斯去卷积后拟合方法对光谱进行拟合,并通过多重拟合最小化残差(r2=7),以完全区分不同的波段,然后根据不同波段的总峰面积之比计算面筋蛋白二级结构各构象占比。
1.3.11 内源荧光光谱
根据GULATI等[18]与周若昕[19]的方法并进行适当修改,利用荧光分光光度计扫描不同冻干面筋蛋白样品的内源荧光特征峰。取50 mg不同冻干面筋蛋白样品溶于25 mL磷酸盐缓冲液(0.01 mol/L,pH 7),涡旋1 min后进行低温离心(8 000 r/min,10 min,4 ℃),取离心后上清液置于荧光分光光度计内进行测定。测定参数:激发波长280 nm,发射波长250~480 nm,狭缝宽度5 nm,PMT电压700 V。
2 结果与分析
2.1 添加不同比例ASF后路粉面筋蛋白基本组分与理化指标分析
由表1可知,随着ASF的不断增加,后路粉面筋蛋白的湿面筋含量、灰分、蛋白含量、吸水率与面筋指数均显著上升。湿面筋含量的上升可能是因为ASF的添加促进了游离的蛋白质相互结合,灰分与蛋白含量的上升是因为ASF中本身含有的灰分与蛋白在后路粉面团醒发的过程中被包裹在面筋网络中且在后续洗面筋过程中并未洗出。吸水率是指面筋蛋白充分吸水水合的能力,是评判面筋蛋白活性的重要指标之一,在添加了ASF后面筋蛋白吸水率逐渐上升的主要原因可能是ASF中脂肪氧合酶对蛋白质的氧化作用,ZHANG等[20]发现添加了重组脂肪氧合酶的小麦粉制成的面条会因为脂肪氧合酶的氧化作用而具有更加紧密有序的网络结构,有序的网络结构往往代表蛋白活性优秀。除此之外,李俊华[21]认为豆类蛋白的吸水率高于面筋蛋白,这也可能是导致面筋蛋白吸水率上升的原因之一。面筋指数是指小麦粉湿面筋在离心力作用下通过一定孔径筛网后筛下物与原湿面筋质量之比,它可以在一定程度上表征面筋蛋白的强度。添加了ASF后面筋蛋白面筋指数上升可能是因为ASF中的脂肪氧合酶氧化了面筋蛋白中的游离巯基,增强了其面筋强度。
表1 添加ASF后路粉面筋蛋白基本组分
Table 1 The basic components of posterior routes gluten protein after adding ASF
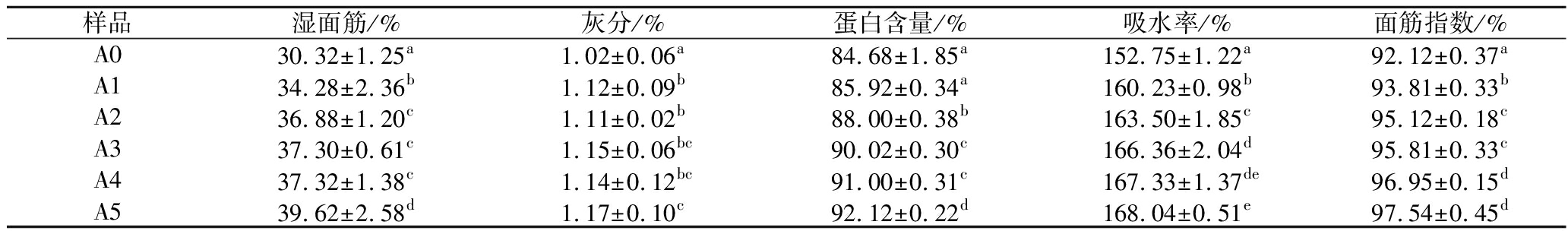
样品湿面筋/%灰分/%蛋白含量/%吸水率/%面筋指数/%A030.32±1.25a1.02±0.06a84.68±1.85a152.75±1.22a92.12±0.37aA134.28±2.36b1.12±0.09b85.92±0.34a160.23±0.98b93.81±0.33bA236.88±1.20c1.11±0.02b88.00±0.38b163.50±1.85c95.12±0.18cA337.30±0.61c1.15±0.06bc90.02±0.30c166.36±2.04d95.81±0.33cA437.32±1.38c1.14±0.12bc91.00±0.31c167.33±1.37de96.95±0.15dA539.62±2.58d1.17±0.10c92.12±0.22d168.04±0.51e97.54±0.45d
注:不同小写字母表示同列数据之间存在显著性差异(P≤0.05)(下同)。
2.2 添加不同比例ASF后路粉面筋蛋白流变学特性分析
2.2.1 频率扫描分析
A0~A5的频率扫描曲线如图1所示,A、B、C分别表示面筋蛋白储能模量、损耗模量与损耗正切角的变化曲线。在0~10 Hz,6种面筋蛋白的储能模量(G′)和损耗模量(G″)均随着频率的增加而增大且G′一直大于G″(tanδ<1),这说明在这个频率区间内面筋蛋白的黏弹性一直呈上升趋势。在整个测试过程中,对于分别添加不同ASF的后路粉面筋蛋白来说,它们的G′与G″均随着ASF添加量的增大而增加,这表明ASF的增加可以显著提升面筋蛋白的整体强度。
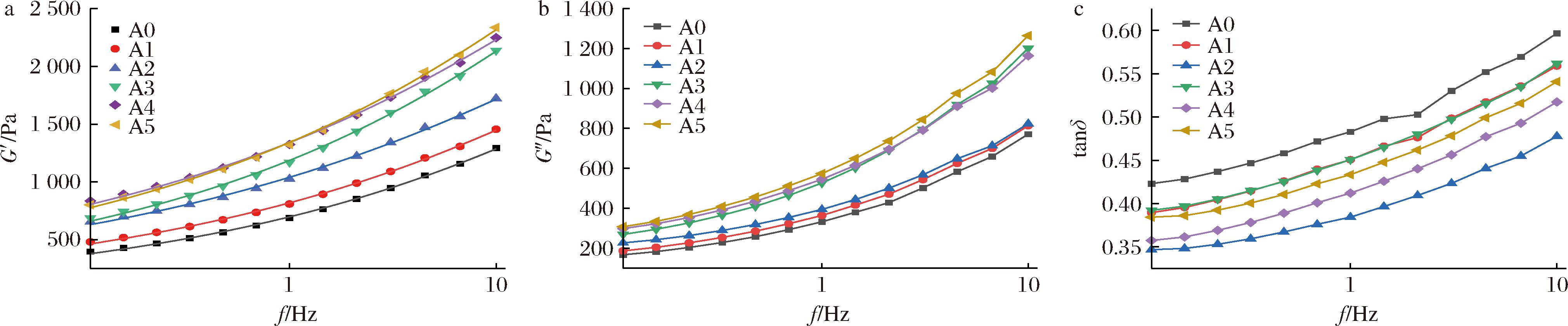
a-储能模量;b-损耗模量;c-损耗正切角
图1 添加不同比例ASF后路粉面筋蛋白储能模量、损耗模量与损耗正切角随频率变化曲线图
Fig.1 The energy storage modulus, loss modulus and loss tangent angle of posterior routes gluten protein after adding ASF as a function of frequency
对6种面筋蛋白的G′曲线进行幂律函数(G′=k′(f)z′)拟合[22],z′代表着G′对频率的关联程度,z′越接近0则代表着该面筋蛋白拥有更稳定的共价键;k′则代表了面筋蛋白的强度,其值越大说明蛋白强度越高[23]。由表2可知随着ASF的逐渐添加,得益于游离巯基被氧化[24],面筋蛋白网络结构逐渐变得稳定,其强度也越来越大。
表2 幂律函数与蠕变恢复阶段参数
Table 2 Power law function and creep recovery stage parameters

样品G′蠕变阶段恢复阶段z′K′×103R2Jmax×10-1(1/Pa)η0×105(Pas)Je/Jma/%Jv/Jmax/%A00.266±0.0020.697±0.0030.999±0.0011.2140.64259.97440.026A10.248±0.0020.818±0.0030.999±0.0030.820.98462.00038.000A20.218±0.0031.040±0.0040.998±0.0050.671.22761.30038.700A30.255±0.0031.186±0.0050.998±0.0000.631.42564.48935.511A40.221±0.0021.340±0.0050.998±0.0020.561.70065.30334.697A50.217±0.0021.342±0.0050.998±0.0040.501.15665.55834.442
2.2.2 蠕变恢复分析
为了进一步分析面筋蛋白的稳定性,对不同ASF添加量的后路粉面筋蛋白进行蠕变恢复处理。如图2所示,添加ASF前后的后路粉面筋蛋白之间差异显著,未添加ASF的后路粉面筋蛋白展现出最大的蠕变应变量,随着ASF的逐渐添加,其后路粉面筋蛋白的最大蠕变应变量也随之减小,这说明面筋蛋白的抗变形能力逐渐增强。最大蠕变量Jmax被用来描述蛋白的硬度,值越小代表面筋抗变形能力越强且η0越大表示面筋网络更加紧密,Je/Jmax能够表征面筋蛋白的弹性[25]。由表2可知,随着ASF的增加,Je/Jmax也逐渐增大,这代表了面筋蛋白弹性也逐渐增大。
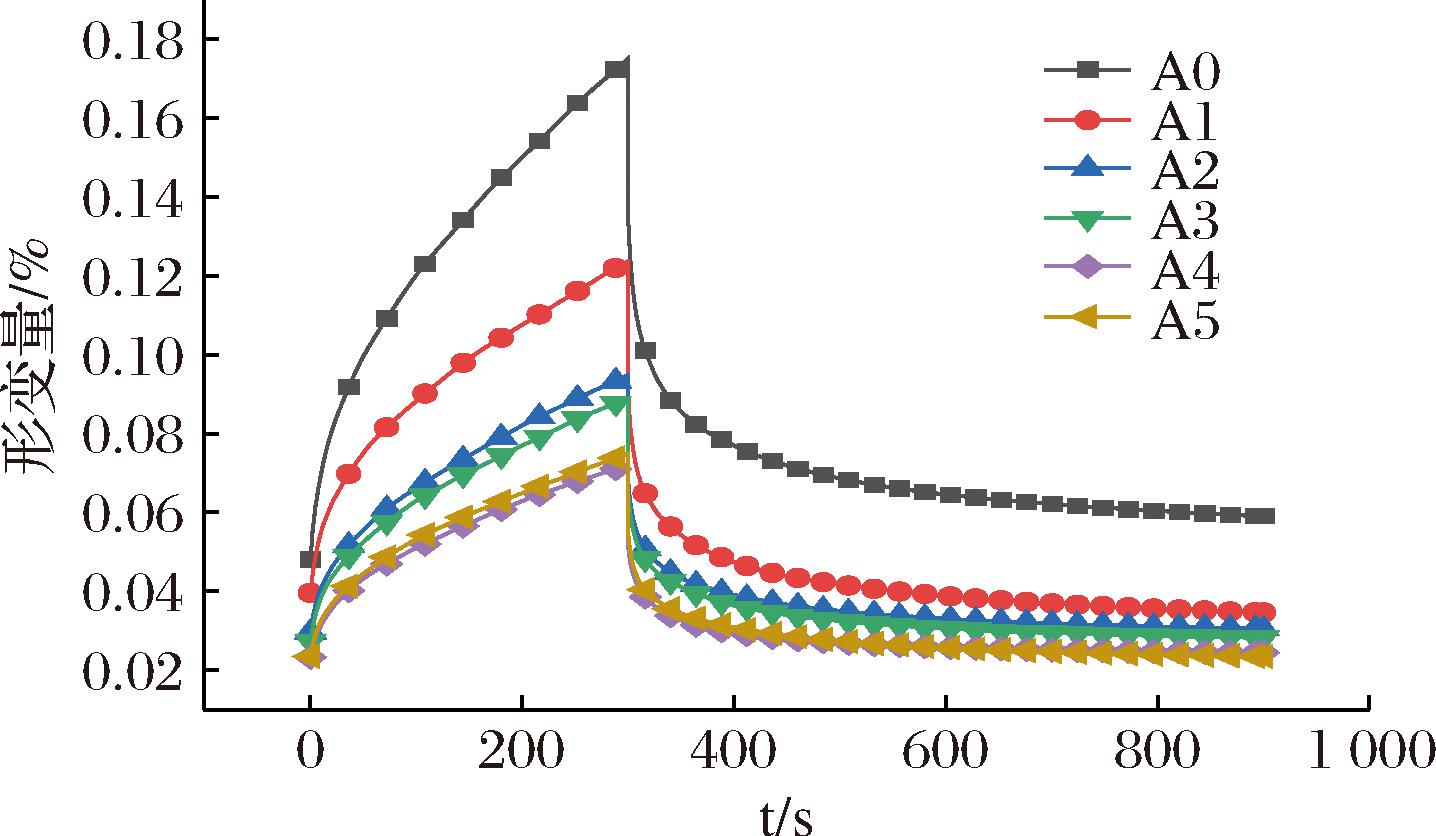
图2 添加不同比例ASF后路粉面筋蛋白蠕变恢复曲线
Fig.2 Creep recovery curve of posterior routes gluten protein after adding ASF
2.3 添加不同比例ASF后路粉面筋蛋白拉伸性质变化分析
面筋蛋白中麦谷蛋白与醇溶蛋白的相互作用很大程度影响了其拉伸特性,麦谷蛋白与醇溶蛋白的比值也会影响到其拉伸特性[26]。如图3所示,6种面筋蛋白的断裂力随着ASF含量的上升而上升,最大拉伸距离则呈现出相反的趋势,当ASF添加量逐渐上升时,面筋蛋白需要更大的力来将其拉断,这表明随着ASF的添加,面筋蛋白获得了更加强大的面筋强度;而最大拉伸距离的减小说明高浓度ASF面筋蛋白相比于未处理的面筋蛋白具有较差的延展性,这也与流变学实验里“较高浓度ASF增加了面筋蛋白抗变形能力”的结论一致。面筋蛋白拉伸特性的变化可能与麦谷蛋白的聚合有关,因为大分子质量的麦谷蛋白大聚合体中含有大量的半胱氨酸残基[27],有助于提升面筋蛋白的抗拉伸强度。
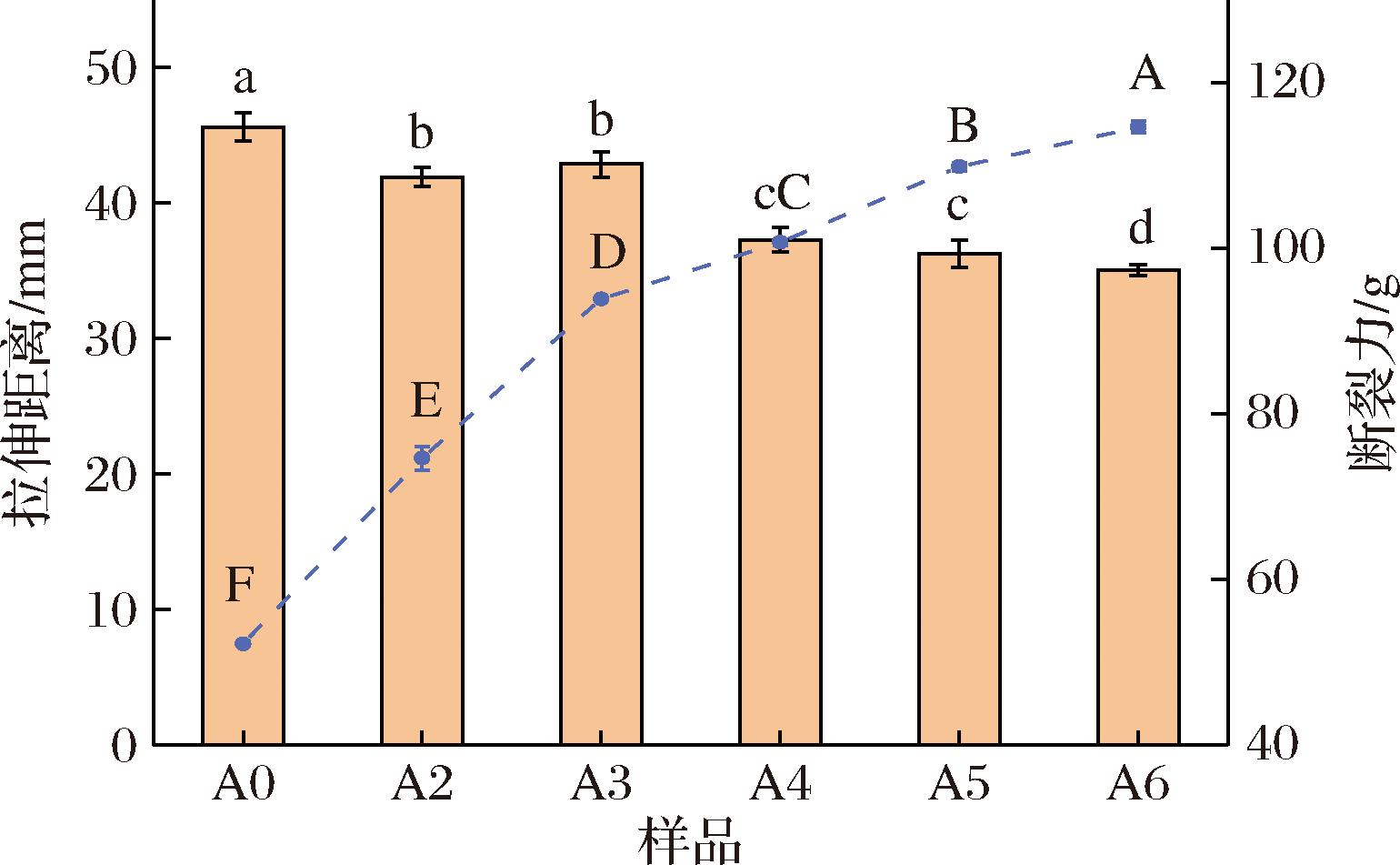
图3 添加不同比例ASF对后路粉面筋蛋白拉伸特性影响
Fig.3 Changes of tensile properties of posterior routes gluten protein after adding ASF
注:不同字母表示数据之间存在显著性差异(P≤0.05)(下同)。
2.4 添加不同比例ASF后路粉面筋蛋白游离巯基含量变化分析
面筋蛋白主要是由麦谷蛋白与醇溶蛋白组成,其中麦谷蛋白通过二硫键形成聚集体,形成网络结构[28],而二硫键是通过两个游离巯基结合形成,故面筋蛋白中的游离巯基含量可以反映其结构强度。如图4所示,添加ASF后,后路粉面筋蛋白的游离巯基数量显著下降,这表明添加ASF后的后路粉面筋蛋白结构更加紧密,而且其结构改善程度在一定范围内随着ASF的增加而加大。
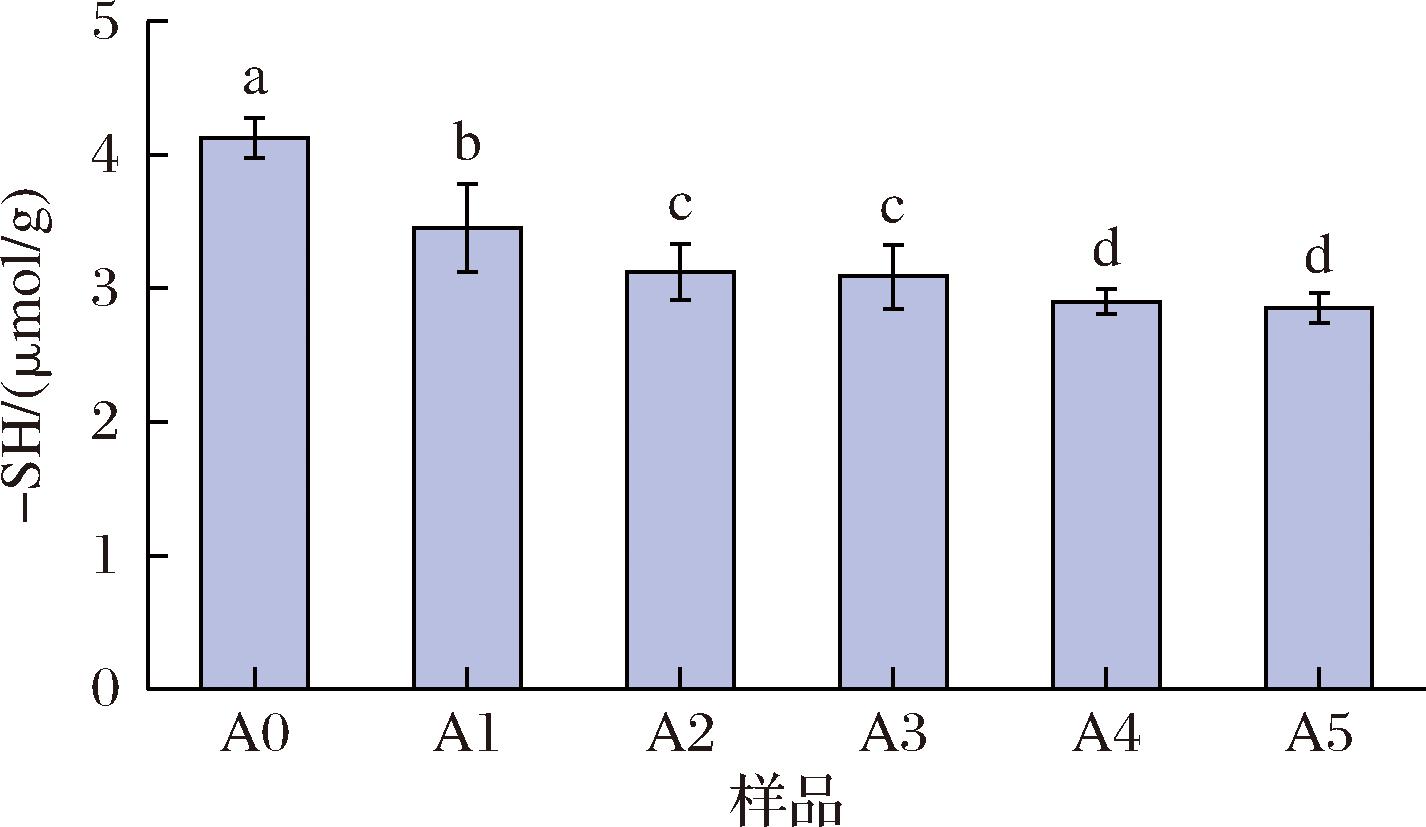
图4 添加不同比例ASF对后路粉面筋蛋白游离巯基数量影响
Fig.4 Effect of ASF on the number of free sulfhydryl groups of posterior routes gluten protein
面筋蛋白游离巯基含量的变化可能是因为ASF中的脂肪氧合酶催化的氧化反应有关,有不少文献显示,脂肪氧合酶所加剧的氧化反应可以将面筋蛋白中的游离巯基氧化形成二硫键[29],这是因为脂肪氧合酶在氧化反应中可以催化不饱和脂肪酸产生H2O2,进而在面筋蛋白中将游离巯基氧化链接形成二硫键。
2.5 添加不同比例ASF后路粉面筋蛋白表面疏水性变化分析
表面疏水性与蛋白质表面性质的变化密切相关,因为它直接反映了蛋白质表面疏水残基的实际分布,因此,由分子结构变化引起的表面疏水性的变化可以作为预测和评价蛋白质表面性质变化的理想的关键指标[30],一般来说表面疏水性越强的蛋白质其内部空间稳定性越差[31]。本实验采用溴酚蓝法测定面筋蛋白的表面疏水性,溴酚蓝可以与面筋蛋白表面的疏水基团结合,因此溴酚蓝的结合量越大,该蛋白的表面疏水性越强。
如图5所示,添加ASF后,后路粉面筋蛋白的表面疏水性逐渐变差且与ASF的添加量呈负相关关系,即ASF占比越大,面筋蛋白表面疏水性越弱。这是因为ASF所含有的脂肪氧合酶催化的氧化反应能够促使面筋蛋白形成更加紧密的空间结构,使得蛋白质分子内部无法自然展开,疏水性基团无法到达蛋白质表面,故其表面疏水性变差,也有报道称二硫键的增加也会削弱面筋蛋白表面疏水性,这也与上述游离巯基实验结果相吻合。此外,ASF中含有的大豆蛋白可能会与面筋蛋白交联形成聚合物,增大了面筋蛋白的分子质量,而大分子质量的蛋白质往往表面疏水性比小分子质量蛋白质差[32]。
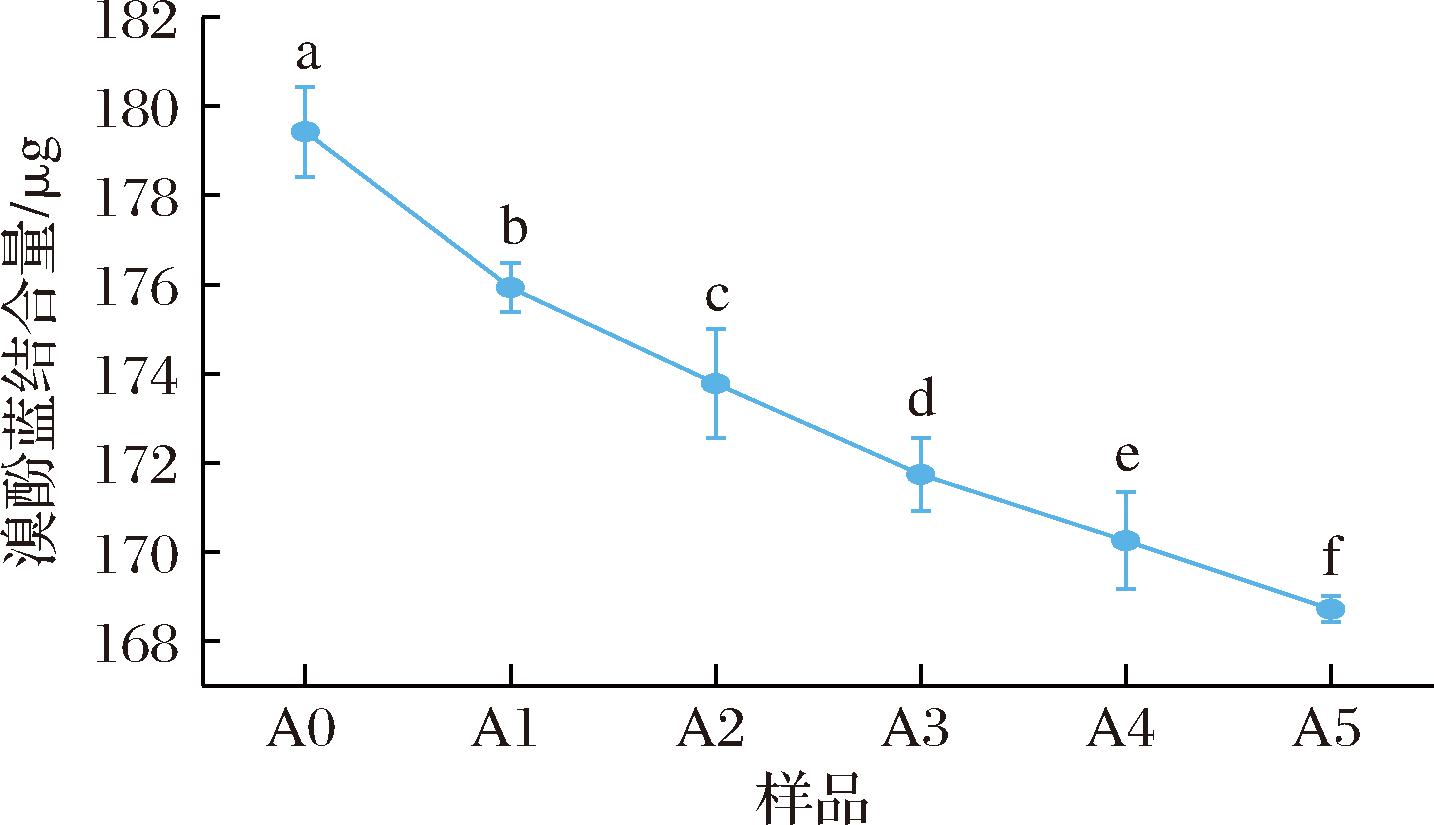
图5 添加不同比例ASF对后路粉面筋蛋白表面疏水性影响
Fig.5 Effect of ASF in different proportions on surface hydrophobicity of posterior routes gluten protein
2.6 添加不同比例ASF后路粉面筋蛋白GMP含量分析
GMP是指通过二硫键相互作用将若干个麦谷蛋白亚基链接聚合而形成的大聚合物,GMP可以表征该面筋蛋白的聚集程度,也能反映出该面筋蛋白的流变学特性[33]。如图6所示,随着ASF添加量的逐步上升,后路粉面筋蛋白的GMP含量也随之上升。这表明再加入ASF后,后路粉面筋蛋白的聚集程度上升,空间结构变得稳定,这是因添加的ASF促进了面筋蛋白内部游离巯基的氧化,二硫键含量上升,麦谷蛋白更加聚合在一起形成稳定的大聚合体。此外,WANG等[34]在面粉中添加脂肪氧合酶后,面团中的谷蛋白含量增加,而醇溶蛋白、清蛋白与球蛋白含量降低,脂肪氧合酶可使清蛋白、球蛋白与醇溶蛋白交联于低分子质量麦谷蛋白,形成麦谷蛋白大聚合物,这也可能是本实验中GMP含量上升的原因之一。
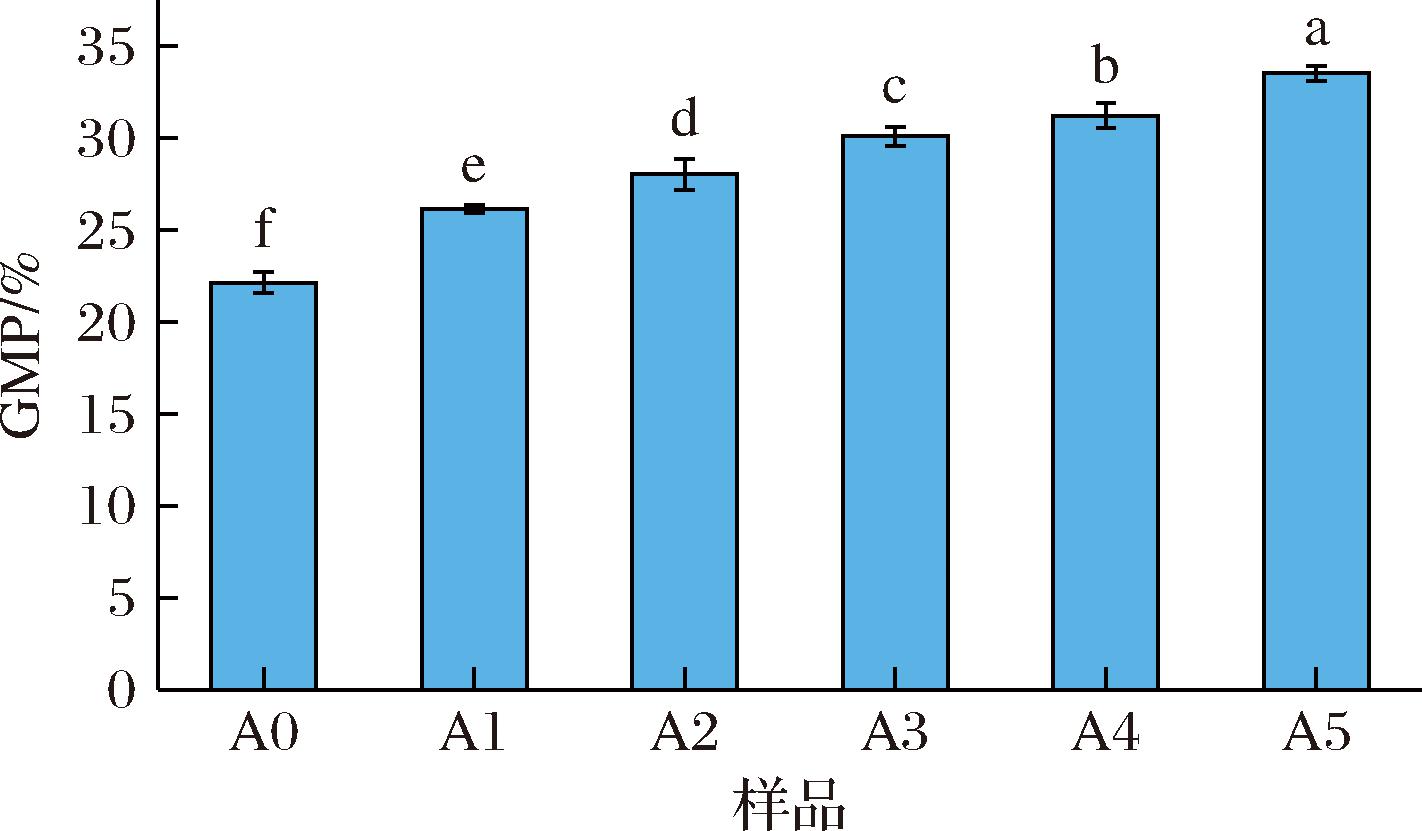
图6 添加不同比例ASF对后路粉面筋蛋白GMP含量影响
Fig.6 Effect of different proportions of ASF on GMP content of posterior routes gluten protein
2.7 添加不同比例ASF后路粉面筋蛋白分子间作用力变化分析
醇溶蛋白和麦谷蛋白的聚集度在一定程度上取决于面筋蛋白分子间的离子键、氢键、疏水相互作用等非共价键,因此这些非共价键的强弱可以影响面筋蛋白的结构与理化性质[35]。如图7所示,3种非共价键中氢键对蛋白的结构稳定性贡献最大,其次是疏水相互作用,最后是离子键。在ASF添加量逐步上升的同时,氢键被削弱而疏水相互作用与离子键作用得到加强,氢键作用的减弱可以归咎于二硫键的增加,具体来说,氢键和二硫键的解聚都是一个动态过程[36],半胱氨酸残基中的巯基会与邻近的氨基酸残基和羧基残基之间产生氢键作用,这些氢键在二硫键形成时会被打破,且对于维持面筋蛋白结构,二硫键的贡献要大于氢键,故在面筋蛋白逐渐稳定的同时,氢键作用被削弱;疏水相互作用的加强是因为蛋白质结构稳定时其内部折叠加剧,疏水基团无法游离至蛋白表面而堆积在蛋白质内部,故蛋白质疏水相互作用得到增强[31],这也与之前的表面疏水性实验结果吻合;在ASF的作用下,面筋蛋白内部GMP发生集聚,带有相反电荷的氨基酸集团互相吸引,进而离子键作用得以增强。
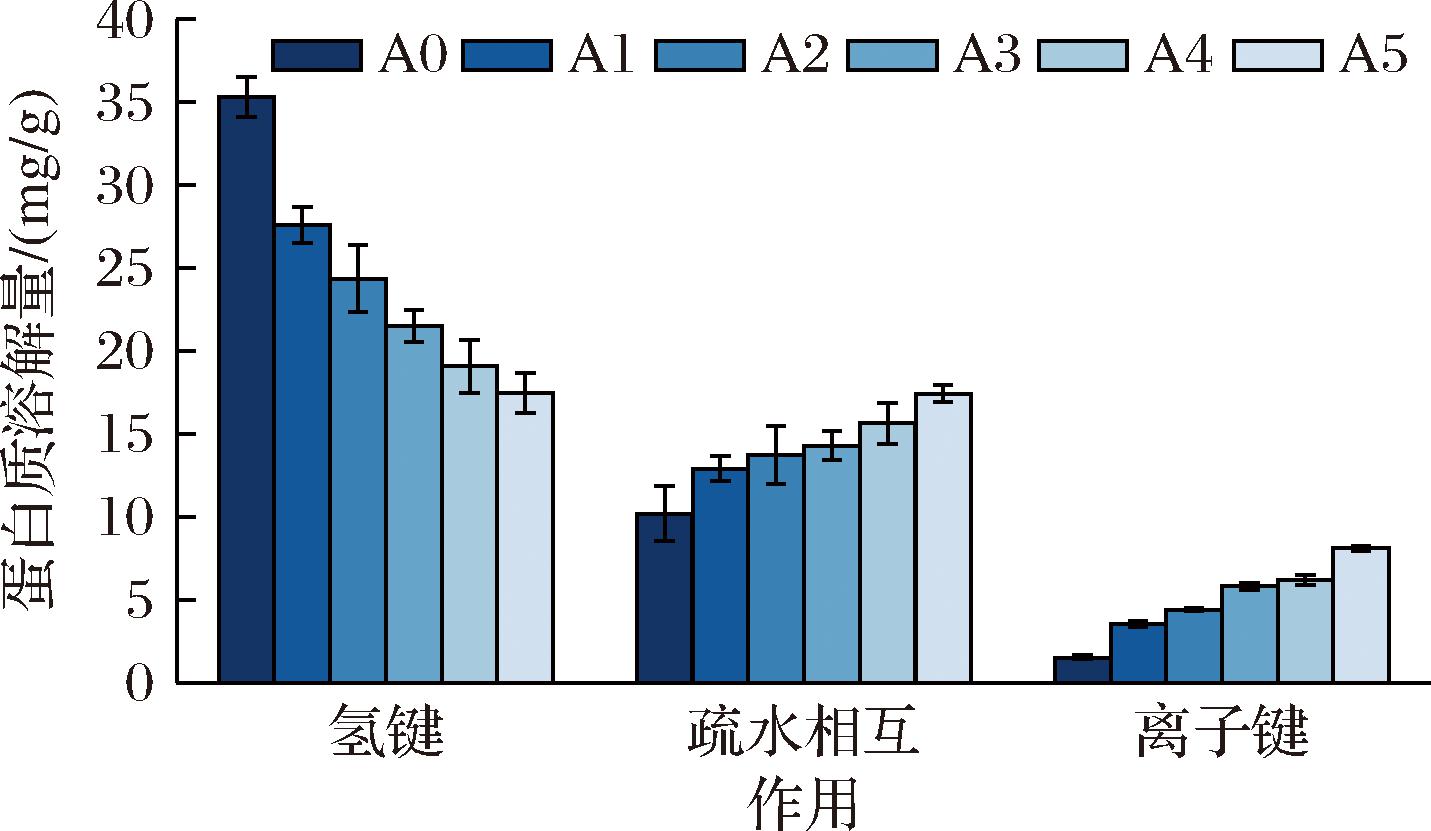
图7 添加不同比例ASF对后路粉面筋蛋白分子相互作用力的影响
Fig.7 Effect of adding ASF in different proportions on the interaction force of posterior routes gluten protein molecules
2.8 添加不同比例ASF后路粉面筋蛋白二级结构变化分析
在傅里叶红外变化光谱中,1 600~1 700 cm-1的酰胺I带区域被认为是研究蛋白质二级结构的最佳波段。如图8所示,随着ASF的添加,面筋蛋白的β转角与无规则卷曲逐渐减少,相应的α螺旋与β折叠比例上升。在蛋白质二级结构中,α螺旋是最稳定的结构,β折叠则为主要的稳定结构[37],β折叠可以与分子间的二硫键与氢键相互协同作用[38],促进蛋白质集聚进而改善面筋蛋白的流变学特性,这一实验结果进一步证实了ASF对后路粉面筋蛋白的改善作用。
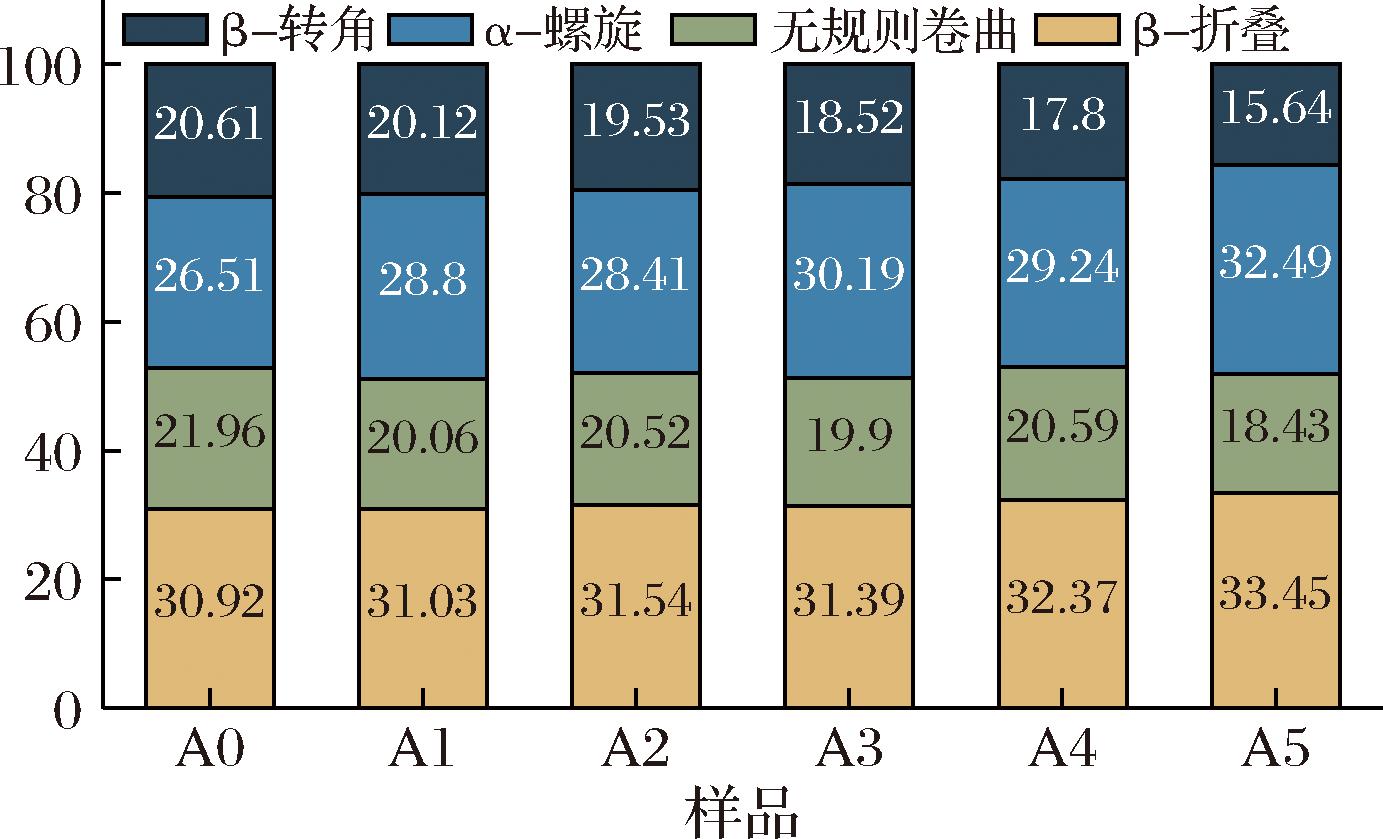
图8 添加不同比例ASF对后路粉面筋蛋白二级结构的影响
Fig.8 Effects of adding ASF in different proportions on secondary structure of posterior routes gluten protein
2.9 添加不同比例ASF后路粉面筋蛋白内源荧光光谱分析
蛋白质内部含有一些诸如色氨酸赖氨酸等能发射荧光的氨基酸,通过荧光分光光度计可以记录这些发光氨基酸的荧光变化,氨基酸的荧光变化可以在一定程度上表征该蛋白的三级结构变化[39]。荧光光谱中的λmax(峰值荧光出现的波长位置)的迁移情况可以体现出该蛋白氨基酸所处环境的变化,峰值荧光强度可以表征该蛋白氨基酸的暴露程度。
如表3所示,随着ASF的不断添加,后路粉面筋蛋白的λmax发生蓝移(向短波迁移),这说明面筋蛋氨基酸所处环境极性发生了变化,其空间构象产生了一定的改变,蛋白质结构由松散无序向整齐有序转变[40];而荧光峰值强度的降低也恰好说明了部分氨基酸及氨基酸残基因为蛋白质形成了紧密整齐的结构而被包裹在内部[39],这进一步证实了上述结果的可靠性。
表3 添加ASF后路粉面筋蛋白内源荧光变化
Table 3 The changes of endogenous fluorescence of posterior routes gluten protein after adding ASF
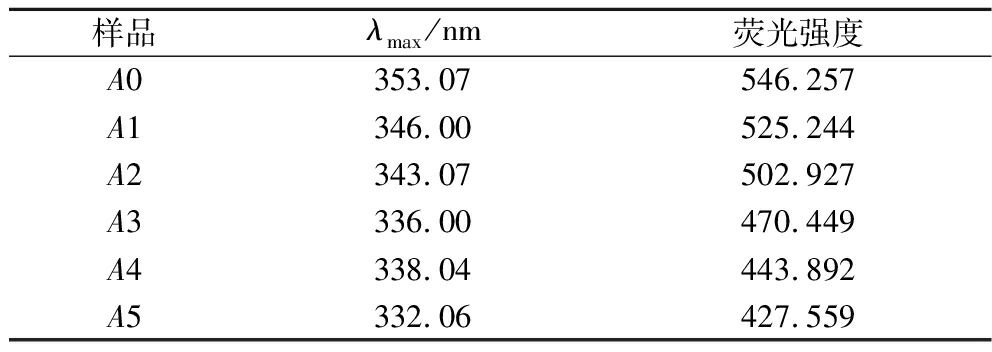
样品λmax/nm荧光强度A0353.07546.257A1346.00525.244A2343.07502.927A3336.00470.449A4338.04443.892A5332.06427.559
3 结论与讨论
本研究将不同梯度的ASF添加至后路粉中然后洗出湿面筋研磨成粉,探讨ASF不同添加量对后路粉面筋蛋白的宏观特性、结构性质与理化指标的影响。实验研究发现,在ASF添加量为1%以内时,不同梯度的ASF均可将后路粉面筋蛋白中的游离巯基氧化形成二硫键,显著降低了蛋白中的游离巯基含量;表面疏水性、GMP以及蛋白质分子间作用力测定结果显示蛋白质内部结构发生了一定程度的集聚与折叠;傅里叶红外变换光谱和内源荧光光谱结果也证实了添加ASF后面筋蛋白的二级结构与三级结构发生了改变,面筋蛋白的结构由松散无序向紧密有序转变且这些变化皆与活性大豆粉添加量呈现正相关关系。流变学实验与拉伸试验表明添加了ASF的后路粉面筋蛋白拥有更优秀的黏弹性与抗拉伸能力。这些实验结果表明了添加ASF后,面筋蛋白的结构层面发生了变化从而引起其宏观特性的改变,整齐有序的面筋蛋白网络会使它的流变学特性得到一定程度的改善。
[1] LIAO H J, CHEN Y L.Characteristics and protein subunit composition of flour mill streams from different commercial wheat classes and their relationship to white salted noodle quality[J].Cereal Chemistry, 2015, 92(3):302-311.
[2] 石玉飞, 郭蕾, 朱江涛.蛋糕用小麦粉生产中不同系统面粉品质的研究[J].现代面粉工业, 2019, 33(3):29-31.SHI Y F, GUO L, ZHU J T.Study on flour quality from different systems in the production of wheat flour for cake[J].Modern Flour Milling Industry, 2019, 33(3):29-31.
[3] 蒋家睿, 樊祥埼, 郑学玲.小麦加工前中后路粉面筋蛋白特性差异性分析[J].食品与发酵工业, 2024, 50(4):240-245.JIANG J R, FAN X Q, ZHENG X L.Analysis of differences in gluten protein characteristics of anterior, middle, and posterior wheat flour[J].Food and Fermentation Industries, 2024, 50(4):240-245.
[4] 王显伦, 蒋清民.活性大豆粉对小麦粉品质影响研究[J].河南工业大学学报(自然科学版), 2006, 27(3):26-28.WANG X L, JIANG Q M.Study on the effect of the bioactive soybean powder on the wheat flour quality[J].Journal of Henan University of Technology (Natural Science Edition), 2006, 27(3):26-28.
[5] 田晓会, 韩小贤, 郑学玲.活性大豆粉对馒头感官品质的影响[J].食品研究与开发, 2016, 37(15):49-52.TIAN X H, HAN X X, ZHENG X L.The effect of bioactive soybean powder on quality of steamed bread[J].Food Research and Development, 2016, 37(15):49-52.
[6] LEBESI D M, TZIA C.Effect of the addition of different dietary fiber and edible cereal bran sources on the baking and sensory characteristics of cupcakes[J].Food and Bioprocess Technology, 2011, 4(5):710-722.
[7] 石晶红, 郭淑文, 李云玲, 等.豆粉对小麦粉粉质特性和糊化特性的影响[J].食品与机械, 2020, 36(9):50-54.SHI J H, GUO S W, LI Y L, et al.Effects of different soybean powder on farinograph and gelatinization characteristics of wheat flour[J].Food &Machinery, 2020, 36(9):50-54.
[8] 阮有志, 宋小楠, 吴隆坤, 等.发芽大豆粉营养成分分析及其在蛋糕中的应用[J].现代食品, 2019(8):71-74;84.RUAN Y Z, SONG X N, WU L K, et al.Quality changes of germinated soybean flour and its application in cake[J].Modern Food, 2019(8):71-74;84.
[9] 徐小青, 郭祯祥, 郭嘉.麦醇溶蛋白与麦谷蛋白比值对面团特性的影响[J].河南工业大学学报(自然科学版), 2020, 41(2):27-33.XU X Q, GUO Z X, GUO J.Effect of the ratio of gliadin to glutenin on dough characteristics[J].Journal of Henan University of Technology (Natural Science Edition), 2020, 41(2):27-33.[10] PERESSINI D, SENSIDONI. A.Effect of soluble dietary fibre addition on rheological and breadmaking properties of wheat doughs[J].Journal of Cereal Science,2009, 49 (2): 190-201.
[11] DU J, DANG M Z, KHALIFA I, et al.Persimmon tannin changes the properties and the morphology of wheat gluten by altering the cross-linking, and the secondary structure in a dose-dependent manner[J].Food Research International, 2020, 137:109536.
[12] SCHERF K A, UMSEHER L, KIEFFER R, et al.Optimization of a micro-scale extension test for rehydrated vital wheat gluten[J].Journal of Cereal Science, 2016, 68:140-147.
[13] LUO Y, LI M, ZHU K X, et al.Heat-induced interaction between egg white protein and wheat gluten[J].Food Chemistry, 2016, 197:699-708.
[14] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[15] FENG Y L, ZHANG H J, WANG J, et al.Dynamic changes in glutenin macropolymer during different dough mixing and resting processes[J].Molecules, 2021, 26(3):541.
[16] LI M F, LIU C, ZHENG X L, et al.Interaction between A-type/B-type starch granules and gluten in dough during mixing[J].Food Chemistry, 2021, 358:129870.
[17] LIU Z P, CHEN J, ZHENG B, et al.Effects of matcha and its active components on the structure and rheological properties of gluten[J].LWT, 2020, 124:109197
[18] GULATI P, LI A X, HOLDING D, et al.Heating reduces proso millet protein digestibility via formation of hydrophobic aggregates[J].Journal of Agricultural and Food Chemistry, 2017, 65(9):1952-1959.
[19] 周若昕. 油炸对全麦油条面筋蛋白结构的影响[D].无锡:江南大学, 2020.ZHOU R X.Effect of frying on structure of gluten in whole wheat you-tiao[D].Wuxi:Jiangnan University, 2020.
[20] ZHANG C, ZHANG S, BIE X M, et al.Effects of recombinant lipoxygenase on the rheological properties of dough and the quality of noodles[J].Journal of the Science of Food and Agriculture, 2016, 96(9):3249-3255.
[21] 李俊华. 大豆粉对面粉特性及挂面品质的影响研究[D].无锡:江南大学, 2009.LI J H.Study on flour properties and noodle qualities by adding soybean powder[D].Wuxi:Jiangnan University, 2009.
[22] MOHAMED A A, HUSSAIN S, ALAMRI M S, et al.Dynamic rheological properties of corn starch-date syrup gels[J].Journal of Food Science and Technology, 2019, 56(2):927-936.
[23] ZHANG D Q, MU T H, SUN H N.Comparative study of the effect of starches from five different sources on the rheological properties of gluten-free model doughs[J].Carbohydrate Polymers, 2017, 176:345-355.
[24] PERMIAKOVA M D, TRUFANOV V A.Effect of soybean lipoxygenae on baking properties of wheat flour[J].Prikladnaia Biokhimiia i Mikrobiologiia, 2011, 47(3):348-354.
[25] SHANG J Y, ZHAO B, LIU C, et al.Impact of wheat starch granule size on viscoelastic behaviors of noodle dough sheet and the underlying mechanism[J].Food Hydrocolloids, 2023, 134:108111.
[26] GIRARD A L, AWIKA J M.Effects of edible plant polyphenols on gluten protein functionality and potential applications of polyphenol-gluten interactions[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):2164-2199.
[27] SHEWRY P R, HALFORD N G, LAFIANDRA D.Genetics of wheat gluten proteins[J].Advances in Genetics, 2003, 49:111-184.
[28] JOHANSSON E, MALIK A H, HUSSAIN A, et al.Wheat gluten polymer structures:The impact of genotype, environment, and processing on their functionality in various applications[J].Cereal Chemistry, 2013, 90(4):367-376.
[29] BAHAL G, SUDHA M L, RAMASARMA P R.Wheat germ lipoxygenase:Its effect on dough rheology, microstructure, and bread making quality[J].International Journal of Food Properties, 2013, 16(8):1730-1739.
[30] TANG S, LI J S, HUANG G X, et al.Predicting protein surface property with its surface hydrophobicity[J].Protein and Peptide Letters, 2021, 28(8):938-944.
[31] BRASELMANN E, CHANEY J L, CLARK P L.Folding the proteome[J].Trends in Biochemical Sciences, 2013, 38(7):337-344.
[32] WAGNER J R, GUÉGUEN J.Surface functional properties of native, acid-treated, and reduced soy glycinin.2.Emulsifying properties[J].Journal of Agricultural and Food Chemistry, 1999, 47(6):2181-2187.
[33] WANG X Y, GUO X N, ZHU K X.Polymerization of wheat gluten and the changes of glutenin macropolymer (GMP) during the production of Chinese steamed bread[J].Food Chemistry, 2016, 201:275-283.
[34] WANG X M, LU F X, ZHANG C, et al.Effects of recombinated Anabaena sp.lipoxygenase on the protein component and dough property of wheat flour[J].Journal of Agricultural and Food Chemistry, 2014, 62(40):9885-9892.
[35] ZHOU T T, ZHANG L, LIU Q N, et al.Rheological behaviors and physicochemical changes of doughs reconstituted from potato starch with different sizes and gluten[J].Food Research International, 2021, 145:110397.
[36] BREAKSPEAR S, NOECKER B, POPESCU C.Relevance and evaluation of hydrogen and disulfide bond contribution to the mechanics of hard α-keratin fibers[J].The Journal of Physical Chemistry.B, 2019, 123(21):4505-4511.
[37] ZHANG M L, MA M X, YANG T B, et al.Dynamic distribution and transition of gluten proteins during noodle processing[J].Food Hydrocolloids, 2022, 123:107114.
[38] GAO X, TONG J Y, GUO L, et al.Influence of gluten and starch granules interactions on dough mixing properties in wheat (Triticum aestivum L.)[J].Food Hydrocolloids, 2020, 106:105885.
[39] 罗帷, 张宇娟, 侯江霞, 等.不同抗氧化剂对面筋蛋白结构功能特性的影响[J].食品科技, 2022, 47(12):135-140.LUO W, ZHANG Y J, HOU J X, et al.Effects of different antioxidants on structural and functional properties of gluten[J].Food Science and Technology, 2022, 47(12):135-140.
[40] 尹燕霞, 向本琼, 佟丽.荧光光谱法在蛋白质研究中的应用[J].实验技术与管理, 2010, 27(2):33-36;40.YIN Y X, XIANG B Q, TONG L.The application of studying fluorescence spectroscopy on protein[J].Experimental Technology and Management, 2010, 27(2):33-36;40.