肌肽是由一分子β-丙氨酸和一分子L-组氨酸组成的二肽,广泛分布于脊椎动物的肌肉中。王春月等[1]通过检测鱼类、甲壳类和软体动物等40个物种肌肉组织中的组氨酸二肽,发现大多数硬骨鱼类的肌肉组织中的肌肽含量较高,其中鲣鱼肉、秋刀鱼肉、三文鱼肉的肌肽含量最高。肌肽作为一种食品营养剂,具有多种生物活性功能,分子质量较小,可通过细胞膜直接渗入细胞内并发挥作用[2]。肌肽通过其结构上的咪唑环提供活化氢,可结合并清除自由基,咪唑环上的氨基、羧基也能螯合Cu2+和Fe2+等金属离子从而抑制氧化反应。研究表明,老人每日补充肌肽可以改善记忆力、认知功能和身体活动机能,还能够延缓与衰老相关的一些疾病的发生[3]。肌肽还能调节免疫系统,维持糖尿病患者的血糖水平,并预防神经退行性病变[4]。此外,肌肽具有抗炎作用,对于脑部、肾脏和视网膜的损伤有较好的治疗效果[5]。肌肽作为一种新型食品添加剂,已广泛应用于保健品、功能饮料、美容等领域,但肌肽在肝损伤修复方面的研究与应用鲜有报道。
肝损伤是指肝脏在外界因素干扰下,导致肝细胞受损,从而影响肝脏正常生理功能的病理现象,是多种肝脏疾病共有的病理基础。研究表明,药物使用不当、细菌与病毒感染、寄生虫入侵、酒精过量等因素均会导致肝脏损伤,并进一步引发肝纤维化、肝硬化、肝炎、脂肪肝以及肝癌等多种肝脏疾病[6]。目前,世界卫生组织公布数据表明,全球约有7亿人患有肝脏疾病,因此,预防和控制肝损伤成为保障人民健康的重要任务之一。
肝损伤的致病因素与机制较为复杂,其中以氧化应激诱导损伤为主[7]。氧化应激是指体内防御系统在氧化和抗氧化作用之间的不平衡状态,其产生过量的活性氧会引起脂肪、蛋白质和DNA等物质的氧化与破坏,从而导致细胞和组织的功能障碍和病变[8]。核红细胞2相关因子2(nuclear factor-erythroid 2-related factor-2, Nrf2)是抗氧化应激的主要核转录因子,正常情况下其与Kelch样ECH关联蛋白1(Kelch like ECH associated protein 1, Keap1)的Kelch端结合,被锚定于细胞质中,在氧化应激条件下,Nrf2与Keap1解离并转移至细胞核,进一步调控醌氧化还原酶1(quinone oxidoreductase 1, NQO1)与血红素氧合酶1(heme oxygenase-1, HO-1)的表达[9]。因此,调控Keap1-Nrf2信号通路在对抗氧化应激诱导的各种病理状况中发挥关键作用。此外,磷酸化的氨基末端激酶(amino-terminal kinases phosphorylation, p-JNK),使胱天蛋白酶3(caspase-3,Cas-3)过度表达,引起细胞的非正常凋亡,导致肝细胞损伤[10]。目前,并没有治疗氧化应激引起肝损伤的特效药,且临床药物普遍具有毒副作用,因此,具有护肝作用的低毒性的天然活性物质对预防和治疗肝脏疾病具有重要的意义。
本文基于肌肽的抗氧化特性,旨在验证肌肽对叔丁基过氧化氢(tert butyl hydrogen peroxide, TBHP)诱导肝细胞损伤的修复作用,并阐明肌肽通过调控Keap1-Nrf2与JNK-Cas-3信号通路相关蛋白抵抗氧化应激与细胞凋亡的作用机制。
1 材料与方法
1.1 试剂
L-肌肽(98%),上海麦克林生化科技有限公司;正常人肝细胞(L-02),武汉尚恩生物技术有限公司;叔丁基过氧化氢、抗坏血酸(维生素C),Sigma-Aldrich公司;杜尔贝科鹰击改良培养基(Dulbecco’s modified eagle medium,DMEM)、胎牛血清(fetal bovine serum,FBS)、pH 7.4磷酸缓冲盐溶液(phosphate buffered saline,PBS)、消化活性胰酶,Gibco公司;ALT、AST、ROS和GSH检测试剂盒,南京建成生物工程研究所;Annexin V- FITC/PI凋亡检测试剂盒,北京索莱宝科技有限公司;Keap1、Nrf2、NQO1、HO-1、p-JNK、Bcl-2、Cas-3、β-actin等抗体,Santa公司;细胞计数试剂盒-8(CCK-8)、快速封闭液、一抗稀释液、二抗稀释液、0.22 μm聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、10×清洗液、10% SDS-PAGE预制胶、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白检测试剂盒、放射免疫沉淀(radio immunoprecipitation assay,RIPA)裂解液、极超敏ECL化学发光试剂盒,上海碧云天生物技术研究所。
1.2 仪器与设备
Varioskan全自动酶标仪、F3移液枪、Attune流式细胞仪,赛默飞世尔科技公司;HH-8数显恒温水浴锅,常州国华电器有限公司;超低温保存箱,青岛海尔生物医疗股份有限公司;CKX41-A32PH倒置显微镜,奥林巴斯工业有限公司;MCO-175二氧化碳培养箱,三洋化成工业株式会社;JIDI-5D高速自动离心机,广州吉迪仪器有限公司;SW-CJ-2FD超净工作台,苏州净化设备有限公司;tanon G2500凝胶成像仪,上海天能科技有限公司。
1.3 方法
1.3.1 细胞培养
L-02细胞使用含有100 mL/L FBS、10 mL/L青霉素和10 mL/L链霉素的DMEM培养液在37 ℃、5% CO2的培养箱中孵育,传代比为4∶1。
1.3.2 细胞损伤模型的建立
取处于对数生长的L-02细胞,以每孔2×104个细胞的密度接种于96孔板,接种体积100 μL/孔,放入培养箱中,在37 ℃、5% CO2的条件下孵育24 h。使用细胞培养液将9 mmol/mL TBHP分别稀释成200、400、600、800、1 000 mmol/mL的工作液。设立空白组和200、400、600、800、1 000 mmol/mL的TBHP处理组,每组均设有3个复孔,TBHP作用4 h后,每个孔中加入10 μL的CCK-8,放置在37 ℃、5% CO2条件下培养箱中孵育1 h,使用酶标仪于450 nm测量吸光度,计算细胞存活率。
1.3.3 细胞毒性
处于对数生长的L-02细胞,以每个孔2×104个细胞的密度接种于96孔板,接种体积为100 μL/孔,放入培养箱中,在37 ℃、5% CO2的条件下孵育12 h。使用细胞培养液配制5、10、20、40、80 mmol/L的肌肽溶液。设立空白组和5、10、20、40、80 mmol/L肌肽处理组,每组均设有3个复孔,肌肽作用12 h后,每个孔中加入10 μL的CCK-8,放置在37 ℃、5% CO2条件下培养箱中孵育1 h,使用酶标仪于450 nm测量吸光度,计算细胞存活率。
1.3.4 肌肽对TBHP损伤L-02细胞的影响
处于对数生长的L-02细胞,以每个孔2×104个细胞的密度接种于96孔板,接种体积为100 μL/孔,放入培养箱中,在37 ℃、5% CO2的条件下孵育12 h。设立空白组、TBHP模型组和5、10、20、40、80 mmol/L肌肽处理组,每组均设有3个复孔,肌肽处理12 h后,除空白组外每孔各加入400 mmol/mL的TBHP继续作用4 h后,每个孔中加入10 μL的CCK-8,放置在37 ℃、5% CO2条件下培养箱中孵育1 h,使用酶标仪于450 nm测量吸光度,计算细胞存活率。
1.3.5 谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)活性测定
取生长对数期的L-02细胞,按每孔4×105个细胞密度接种于6孔板中,接种体积为1.5 mL/孔,在37 ℃、5% CO2条件下培养12 h。使用细胞培养液配制10、20、40 mmol/L的肌肽溶液和50 μg/mL的抗坏血酸溶液。设置空白组、TBHP模型组、肌肽低剂量(10 mmol/L)、肌肽中剂量(20 mmol/L)、肌肽高剂量(40 mmol/L)预处理组和抗坏血酸(50 μg/mL)阳性对照组,肌肽和抗坏血酸预处理12 h,除空白组外每孔各加入400 mmol/mL的TBHP继续作用4 h后,取细胞培养液,按试剂盒说明书测定ALT与AST活性。
1.3.6 细胞内活性氧(reactive oxygen species, ROS)含量测定
取生长对数期的L-02细胞,按每孔4×105个细胞密度接种于6孔板中,接种体积为1.5 mL/孔,在37 ℃、5% CO2条件下培养12 h。设置空白组、TBHP模型组、肌肽低剂量(10 mmol/L)、肌肽中剂量(20 mmol/L)、肌肽高剂量(40 mmol/L)预处理组和抗坏血酸(50 μg/mL)阳性对照组,肌肽和抗坏血酸预处理12 h,除空白组外每孔各加入400 mmol/mL的TBHP继续作用4 h后,吸出培养液,每孔加300 mL 2,7-二氯荧光素二乙酸酯稀释液(10 mmol/L),培养箱继续孵育20 min,每5 min振荡1次,孵育结束后用PBS清洗3次,将细胞悬液加到96孔板中,密度为每孔2×104个细胞,用酶标仪测定荧光强度。
1.3.7 细胞内谷胱甘肽(glutathione, GSH)含量测定
取生长对数期的L-02细胞,按每孔4×105个细胞密度接种于6孔板中,接种体积为1.5 mL/孔,在37 ℃、5% CO2条件下培养12 h。使用细胞培养液配制10、20、40 mmol/L的肌肽溶液和50 μg/mL的抗坏血酸溶液。设置空白组、TBHP模型组、肌肽低剂量(10 mmol/L)、肌肽中剂量(20 mmol/L)、肌肽高剂量(40 mmol/L)预处理组和抗坏血酸(50 μg/mL)阳性对照组,肌肽和抗坏血酸预处理12 h,除空白组外每孔各加入400 mmol/mL的TBHP继续作用4 h后,收集细胞,按试剂盒说明书测定GSH含量。
1.3.8 细胞凋亡的测定
取生长对数期的L-02细胞,按每孔4×105个细胞密度接种于6孔板中,加入不同浓度肌肽预处理12 h后,加入400 mmol/mL TBHP造模损伤4 h,按照说明书处理并采集细胞样本,流式细胞仪检测细胞凋亡。
1.3.9 蛋白印记
生长对数期的L-02细胞,按每孔4×105个细胞密度接种于6孔板中,接种体积为1.5 mL,在37 ℃、5% CO2条件下培养12 h,设置空白组、TBHP模型组、肌肽低剂量(Car-L,10 mmol/L)、肌肽中剂量(Car-M,20 mmol/L)、肌肽高剂量(Car-H,40 mmol/L)预处理组和抗坏血酸(50 μg/mL)阳性对照组,预处理12 h,除空白组外每孔各加入400 mmol/mL的TBHP继续作用4 h,RIPA裂解液提取细胞蛋白,并用BCA蛋白检测试剂盒进行定量。将相同蛋白浓度的L-02细胞样品与5×上样缓冲液混合,用沸水浴处理5 min,用SDS-PAGE蛋白电泳分离,然后转移到0.22 μm PVDF膜上,在快速封闭溶液中封闭10~15 min后,将膜与一抗(1∶1 000)在4 ℃下孵育10 h,二抗(1∶2 000)孵育2 h。最后,用化学发光法观察免疫反应条带,用image J 1.8进行定量。
1.3.10 统计学分析
使用JMP14.0软件进行统计分析,使用Origin 9.0软件进行图形绘制,数据显示为平均值±标准差,所有实验至少重复3次。多组间比较采用单因素方差分析(One-Way ANOVA),P<0.05表示具有统计学意义。
2 结果与分析
2.1 TBHP处理时间与TBHP浓度对L-02细胞的影响
TBHP是一种具有强氧化能力的化合物,常被用作体外氧化应激模型的诱导剂[11]。与其他氧化剂相比,TBHP具有更高的稳定性。TBHP可被代谢为自由基中间体,从而破坏抗氧化防御体系,导致细胞氧化损伤与凋亡。因此,本次实验采用TBHP诱导L-02细胞建立L-02细胞氧化损伤模型,结果如图1所示,随着TBHP浓度的增加与处理时间的延长,L-02细胞存活率逐渐降低,且呈浓度依赖性。根据不同TBHP处理时间与不同TBHP浓度对细胞存活率的影响,细胞存活率在50%~60%时,TBHP诱导的L-02细胞损伤模型更加稳定,并且更有利于下一步实验,因此选择400 mmol/mL TBHP、处理时间4 h建立L-02细胞损伤模型。
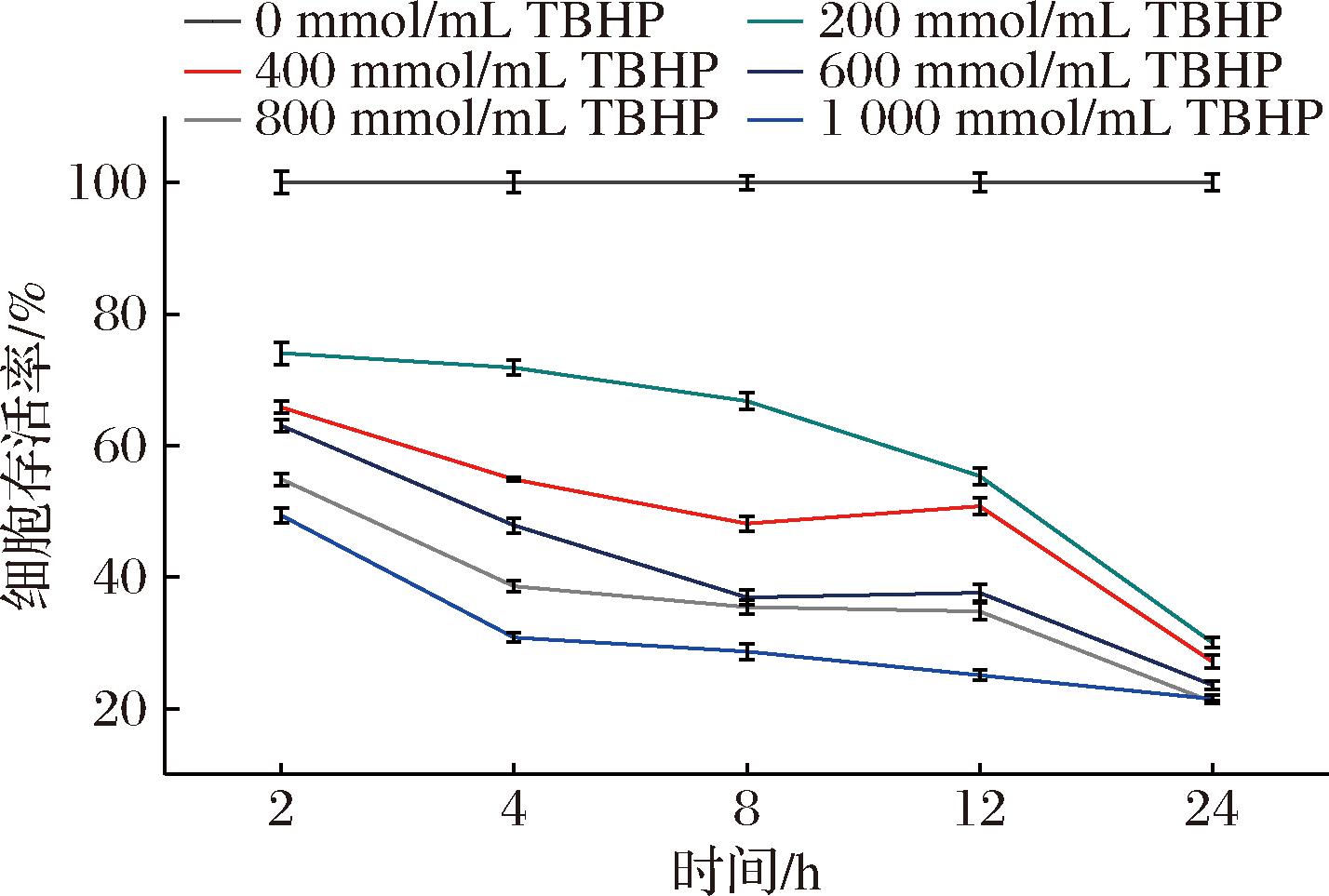
图1 叔丁基过氧化氢浓度与造模时间对L-02细胞存活率的影响(n=3)
Fig.1 Effects of tert-butyl hydrogen peroxide concentration and molding time on the survival rate of L-02 cells (n=3)
2.2 肌肽对L-02的毒副作用及其对TBPH诱导L-02细胞损伤的修复作用
在考察药物或活性物质基于其某种功能特性对细胞生长的影响时,该物质对细胞的毒副作用与增殖作用是影响实验结果的重要因素。本实验通过检测细胞存活率考察肌肽对L-02细胞的毒副作用与增殖作用,结果如图2-a所示,在5~80 mmol/L,肌肽预处理12 h对L-02细胞的存活率没有显著影响。此外,研究了肌肽浓度对TBPH诱导L-02细胞损伤的影响,结果如图2-b所示,与TBHP模型组比较,5~80 mmol/L肌肽预处理L-02细胞,细胞存活率都显著提高,在5~40 mmol/L呈浓度依赖性,但在浓度为80 mmol/L时,细胞存活率有所下降。
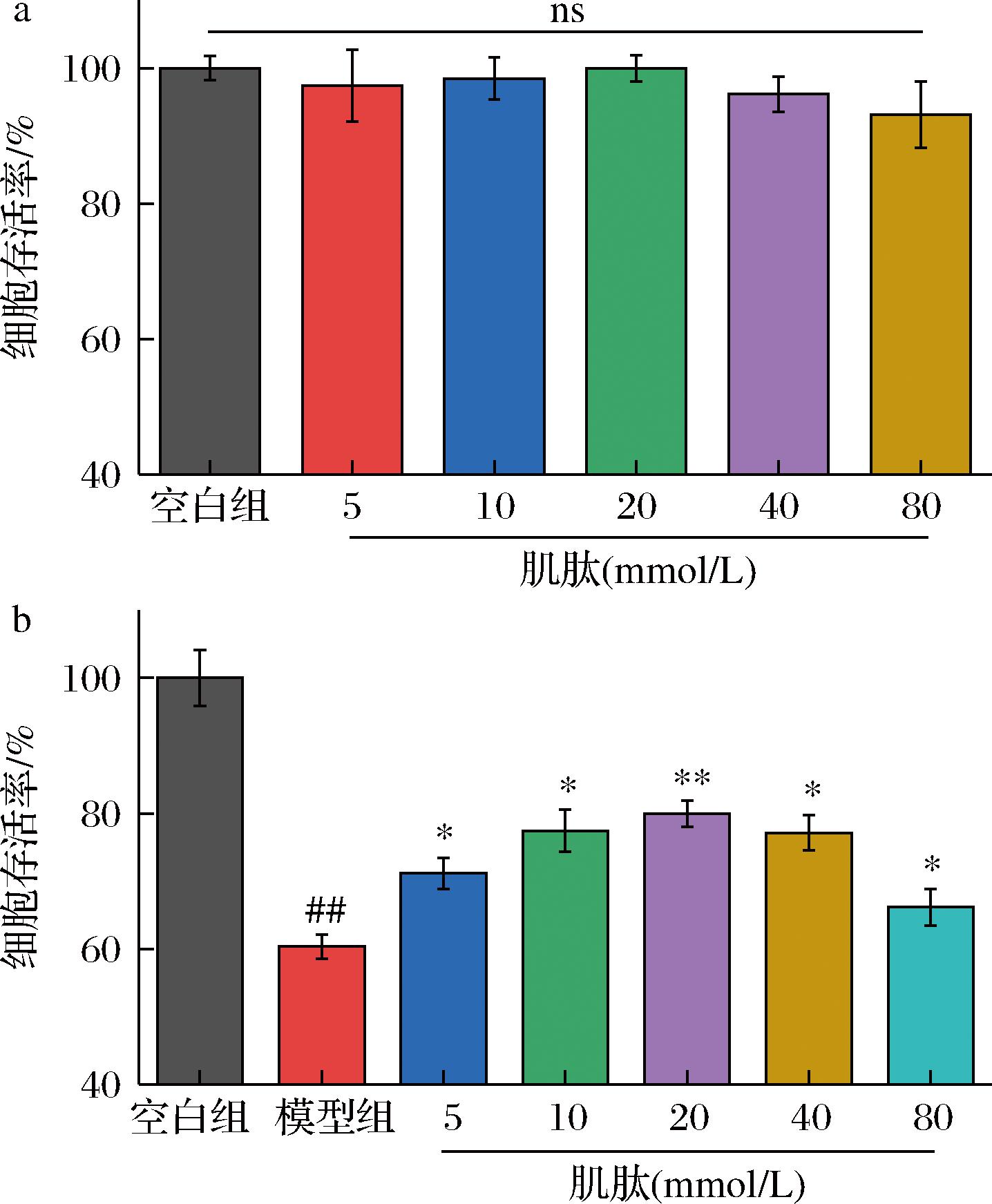
a-肌肽对L-02细胞存活率影响;b-肌肽对TBPH诱导L-02细胞损伤影响
图2 肌肽对L-02细胞存活率及其对TBPH诱导L-02细胞损伤的影响
Fig.2 Effect of carnosine on the survival rate of L-02 cells and on TBPH induced damage to L-02 cells
注:数据以平均值±标准差的形式表示(n=3),与空白组比较,#表示P<0.05,##表示P<0.01;与模型组相比,*表示P<0.05,**表示P<0.01(下同)。
2.3 肌肽对ALT、AST活性的抑制作用
TBHP诱导的肝细胞损伤可增加细胞膜的通透性,导致ALT和AST释放到细胞外。因此,细胞培养液中ALT和AST的含量是判断肝损伤的关键指标。洪玥等[12]研究表明,ALT和AST活力与CCl4诱导的大鼠肝细胞损伤密切相关。张淑霞等[13]研究发现,柚皮苷通过调节ALT和AST水平,可以减少肝细胞凋亡,改善酒精引起的肝损伤。本研究结果如图3所示,TBHP处理后显著升高了L-02细胞的ALT和AST活性,采用肌肽预处理显著抑制了TBHP诱导的L-02细胞的升高,与模型组相比,不同剂量肌肽处理组细胞的ALT活性分别下降了12.98%、33.76%、32.46%,AST活性分别降低了17.39%、30.43%、28.26%。本研究结果表明,肌肽预处理有效缓解TBHP诱导的L-02细胞损伤,相对于低剂量肌肽,中、高剂量肌肽的肝损伤修复作用更显著。
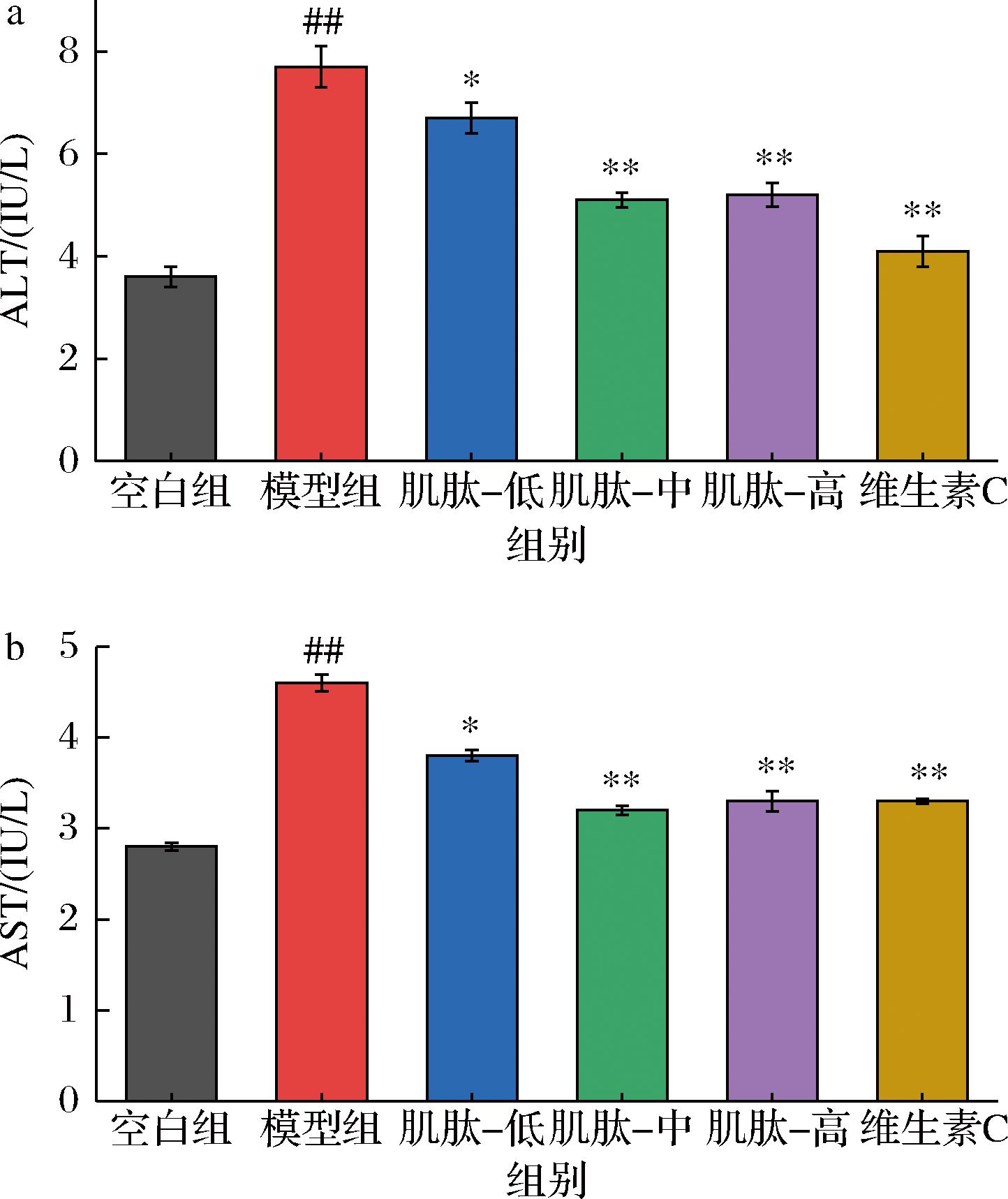
a-ALT活性;b-AST活性
图3 肌肽对ALT、AST活性的影响
Fig.3 Effect of carnosine on ALT and AST activity
2.4 肌肽对ROS、GSH含量的影响
ROS是一类高度活跃的含氧化合物。研究表明,氧化应激产生的过量ROS会导致细胞膜、蛋白质、核酸等生命物质的损伤[14]。因此,稳定的ROS水平是维持正常生理功能的重要保障。本研究通过检测ROS含量检验肌肽对TBHP诱导L-02细胞氧化应激的缓解作用,结果如图4-a所示,TBHP处理使L-02细胞的ROS含量急剧升高,与空白组相比,模型组的ROS含量升高了1.5倍;与模型组相比,低、中、高剂量肌肽预处理组的ROS含量分别下降了35.61%、13.62%、29.37%。越来越多的研究表明,ROS诱导的氧化应激可引起多种人类疾病,肝脏是ROS攻击的主要目标,控制ROS产生是预防或治疗肝损伤的有效途径。郑碧丹等[15]研究发现雷公藤内酯三醇通过抑制ROS生产减轻雷公藤甲素诱导的肝损伤。吕莹等[16]通过H2O2诱导L02损伤模型证明槲皮素修复ROS引起的肝细胞凋亡和损伤。本研究结果表明,肌肽有效抑制了TBHP诱导L-02细胞的氧化应激,减少ROS的生产,从而减轻肝细胞损伤。
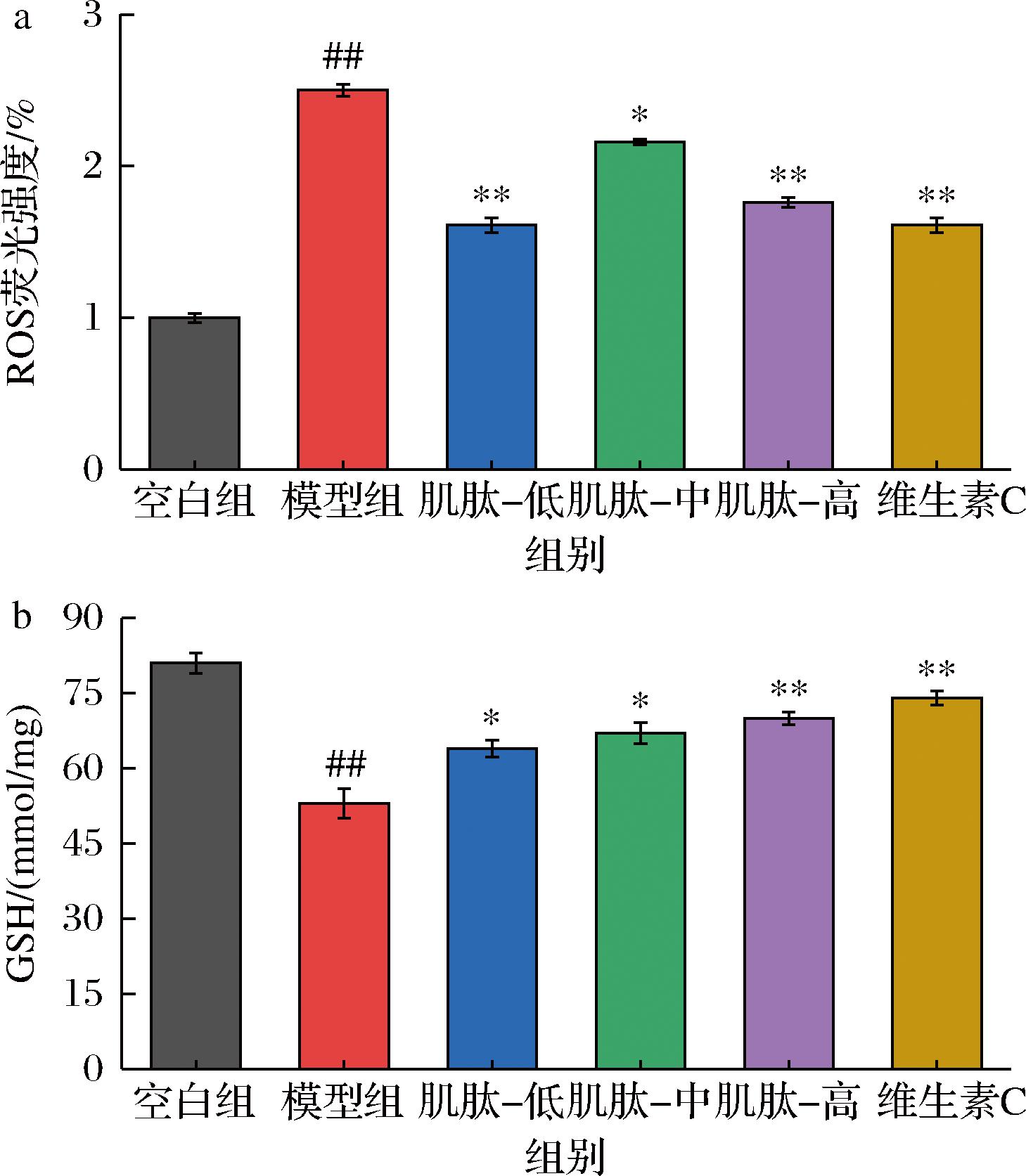
a-ROS含量;b-GSH含量
图4 肌肽ROS、GSH含量的影响
Fig.4 Influence of carnosine on ROS and GSH content
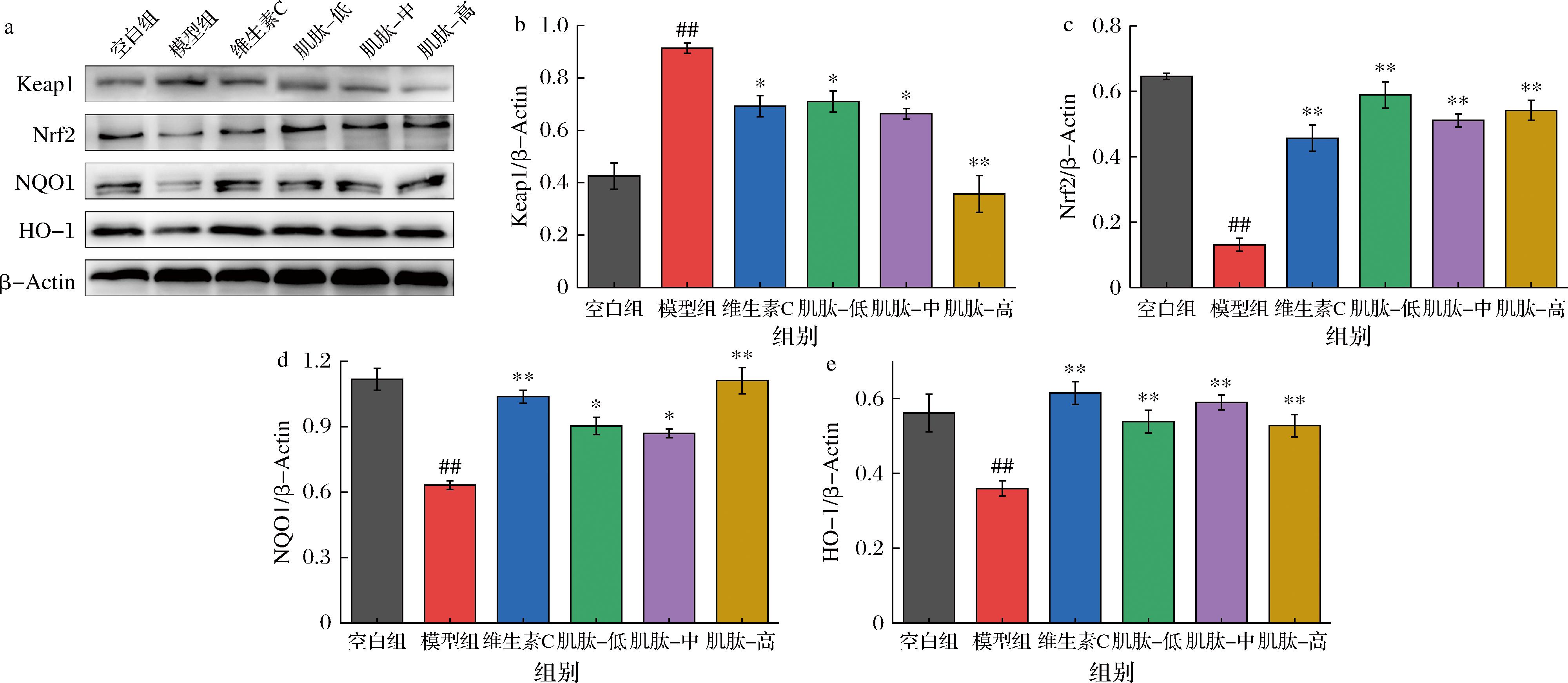
a-蛋白印迹;b-Keap1相对定量;c-Nrf2相对定量;d-NQO1相对定量;e-HO-1相对定量
图5 Keap1、Nrf2、NQO1与HO-1的蛋白印迹与相对定量
Fig.5 Western blotting and relative quantification of Keap1, Nrf2, NQO1, and HO-1 proteins in L-02 cells
GSH是抗氧化系统内源性分子中的重要成员,具有维持细胞内环境的氧化还原平衡与代谢毒素的功能[17]。GSH作为细胞中最丰富的硫醇,能直接与ROS反应,消减ROS对细胞的氧化损伤。因此,GSH含量是反映细胞氧化损伤的关键指标之一。如图4-b所示,TBHP诱导显著降低了L-02细胞的GSH含量,采用肌肽与抗坏血酸预处理显著抑制了TBHP引起的GSH含量的异常下降。与模型组相比,低、中、高剂量肌肽组细胞的GSH含量分别增加了4.68%、9.37%、15.62%,说明肌肽缓解了TBHP诱导的氧化应激,减轻肝细胞损伤。
2.5 肌肽对Keap1-Nrf2信号通路的调控作用
Keap1-Nrf2信号通路在抗氧化、肝细胞保护中发挥重要作用。Nrf2是抗氧化应激的主要核转录因子,在正常生理条件下,Nrf2与Keap1结合形成二聚体,在细胞质中被泛素蛋白酶快速降解从而保持低活性[18]。在氧化应激条件下,Nrf2从Nrf2-Keap1二聚体中解离并转移到细胞核中,调节NQO1和HO-1的基因表达,进而预防机体的氧化损伤。为进一步探索肌肽缓解TBHP诱导L-02细胞氧化应激的作用机制,本研究通过蛋白印记实验分析了肌肽对L-02细胞中Keap1、Nrf2、NQO1和HO-1蛋白表达的影响,结果如图5所示。
与空白组相比,模型组Keap1的蛋白表达量显著升高,Nrf2、NQO1和HO-1的蛋白表达量显著降低。与模型组相比,各剂量肌肽预处理均显著减弱了相关蛋白的变化趋势,中、高剂量肌肽对TBHP诱导的L-02细胞氧化应激的调控效果更好。XU等[19]研究发现花青素A2通过激活Nrf2蛋白表达抵抗TBHP诱导的L-02细胞氧化损伤。NI等[20]研究表明,异甘草素通过Nrf2途径减轻大黄素诱导的体内和体外肝毒性。WANG等[21]研究发现橘皮素通过减少Nrf2泛素化来维持抗氧化活性。相似地,本研究结果表明,肌肽上调了L-02细胞Nrf2的蛋白表达,细胞质中积累的Nrf2转移到细胞核中,上调下游因子NQO1和HO-1的表达,从而减轻肝细胞损伤,这可能与肌肽抑制Nrf2的泛素化与分解有关。
2.6 肌肽延缓L-02细胞凋亡
细胞凋亡是一种细胞程序性死亡,是多细胞生物发育、生长和维持体内稳态不可或缺的正常生理过程。研究表明,在氧化应激、非极性热应激、紫外线或离子辐射、重金属应激等因素的刺激下会引起细胞的非正常凋亡[22]。此外,GSH含量的降低是一种潜在的凋亡早期激活信号,本研究对GSH的检测结果表明,肌肽有效抑制TBHP诱导L-02细胞GSH含量的异常减少,因此采用流式细胞术进一步研究肌肽对L-02细胞在凋亡过程中的影响,结果如图6所示,与空白组相比,TBHP处理显著提高了L-02细胞的细胞凋亡率;与模型组相比,不同浓度肌肽预处理组的细胞凋亡显著降低,肌肽浓度越高,L-02细胞的凋亡率越低,结果表明肌肽有效延缓TBHP诱导的L-02细胞凋亡。
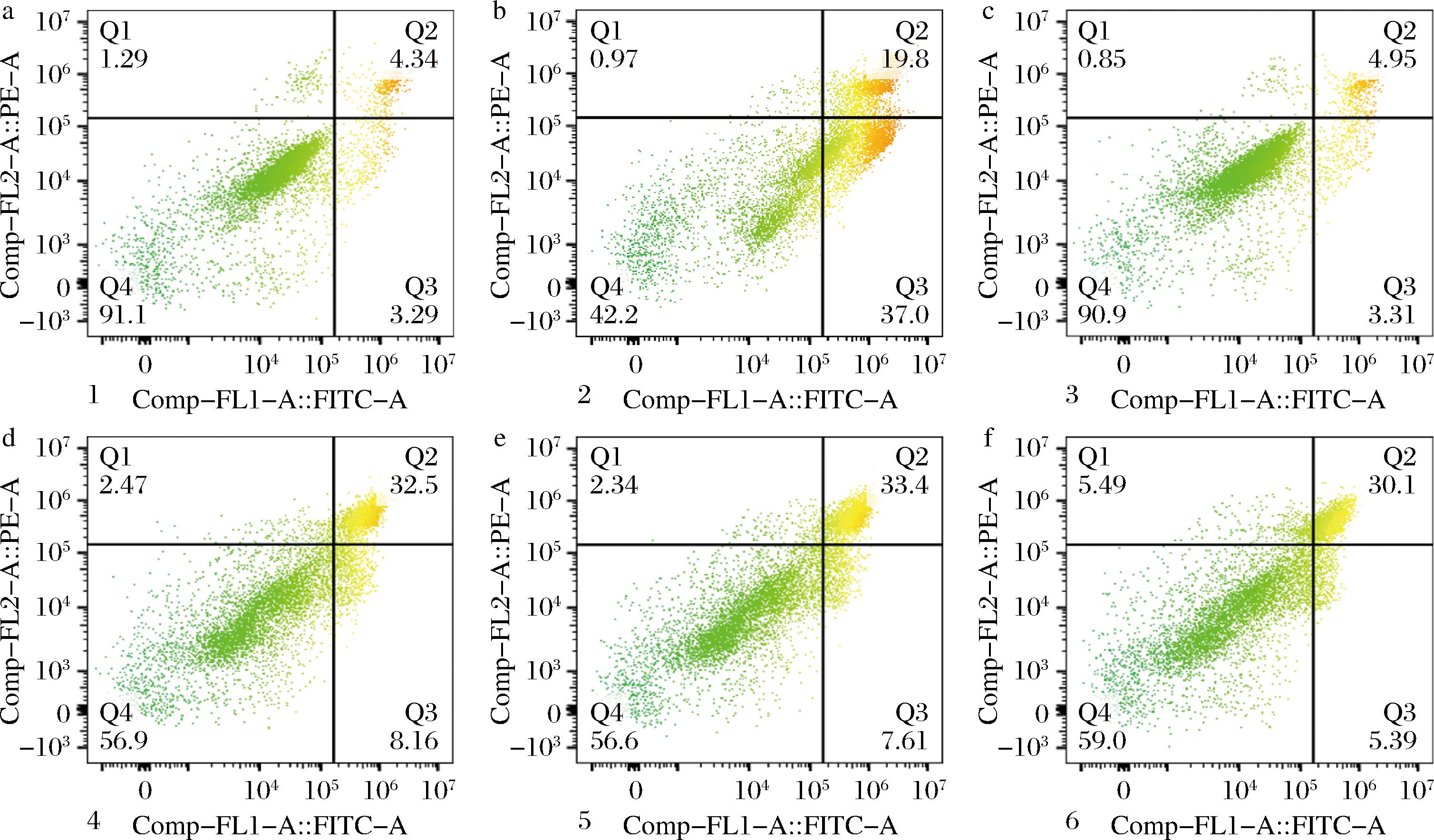
a-空白组;b-模型组;c-抗坏血酸对照组;d-肌肽低剂量组;e-肌肽中剂量组;f-肌肽高剂量组
图6 肌肽延缓L-02细胞凋亡
Fig.6 Carnosine delayed apoptosis of L-02 cells
注:Q1:死亡细胞;Q2:晚期凋亡细胞;Q3:早期凋亡细胞;Q4:正常细胞。
2.7 肌肽对JNK-Cas-3信号通路的调控作用
JNK信号通路是MAPK通路的一个重要分支,在细胞凋亡过程中起着重要的调控作用。在氧化应激条件下,JNK被磷酸化并介导下游因子Bcl-2的表达,然后通过Cas-3发挥促凋亡作用[23]。因此,减少细胞JNK蛋白的表达或JNK磷酸化可以有效抑制细胞的凋亡。YANG等[24]研究发现JNK参与调节乙醇诱导的L-02细胞凋亡。SHI等[25]研究发现橄榄苦苷以剂量依赖性方式抑制P38和JNK磷酸化降低H2O2处理引起的L-02细胞凋亡。为进一步探索在TBHP诱导环境下肌肽对L-02细胞凋亡的延缓机制,本研究通过蛋白印记实验定量分析了L-02细胞p-JNK、Bcl-2、Cas-3的蛋白表达量,结果如图7所示。与空白组相比,TBHP诱导显著增加了L-02细胞p-JNK和Cas-3的蛋白表达量,显著减少了Bcl-2的蛋白表达量。与模型组相比,抗坏血酸预处理降低了L-02细胞的p-JNK和Cas-3表达量,增加了Bcl-2的蛋白表达量;各剂量肌肽预处理显著降低L-02细胞的p-JNK表达量,中、高剂量肌肽显著升高了Bcl-2的蛋白表达量,低、中、高剂量肌肽显著抑制Cas-3的蛋白表达。研究结果明晰了肌肽通过调节p-JNK、Bcl-2、Cas-3的蛋白表达延缓TBHP诱导L-02细胞凋亡的作用机制。
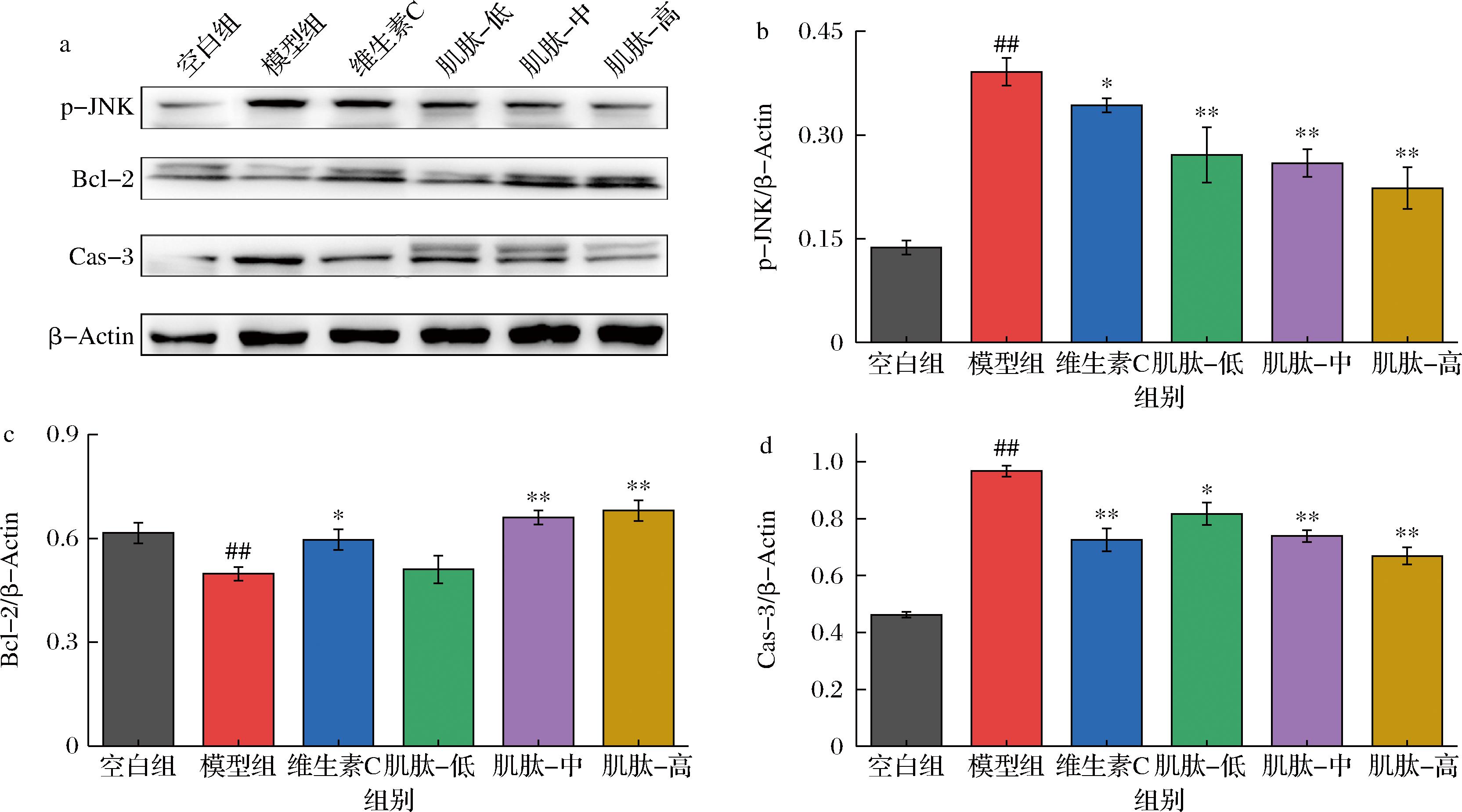
a-蛋白印迹;b-p-JNK相对定量;c-Bcl-2相对定量;d-Cas-3相对定量
图7 p-JNK、Bcl-2与Cas-3的蛋白印迹与相对定量
Fig.7 Western blotting and relative quantification of Nrf2, HO-1, and NQO1 proteins in L-02 cells
3 结论
肌肽是一种新型的食品营养补充剂,主要通过动物骨骼肌提取获得,基于较强的抗氧化特性,肌肽在抗衰老、抗炎、免疫调节和组织损伤修复等方面展现巨大潜力。本研究通过TBHP诱导L-02细胞构建肝细胞损伤模型,从抗氧化和抗凋亡2个方面对肌肽进行了评价,并探究其作用机制。结果显示,肌肽预处理显著降低L-02细胞ALT、AST活性,抑制了ROS的生成,增加GSH含量,延缓了细胞的非正常凋亡,验证了肌肽对肝细胞损伤与凋亡的修复作用;上调了Nrf2、NQO1、HO-1和Bcl-2的蛋白表达,下调Keap1、p-JNK和Cas-3的蛋白表达,明晰了肌肽通过调控Keap1-Nrf2与JNK-Cas-3信号通路相关蛋白抵抗L-02细胞氧化应激与细胞凋亡的作用机制。本研究结果表明肌肽具有预防或治疗肝损伤的潜力,为开发护肝保健食品提供了研究基础。
[1] 王春月, 李艳荣, 潘晨, 等.舟山海域常见经济物种组氨酸二肽的提取和鉴定[J].浙江海洋大学学报(自然科学版), 2020, 39(3):200-208.WANG C Y, LI Y R, PAN C, et al.Extraction and quantification of histidine-containing dipeptides from economic species in Zhoushan[J].Journal of Zhejiang Ocean University (Natural Science), 2020, 39(3):200-208.
[2] BOLDYREV A A, ALDINI G, DERAVE W.Physiology and pathophysiology of carnosine[J].Physiological Reviews, 2013, 93(4):1803-1845.
[3] 钱雯, 骆丹, 周炳荣.肌肽抗衰老机制的研究进展[J].实用皮肤病学杂志, 2018, 11(6):360-363.QIAN W, LUO D, ZHOU B R.Research progress of the anti-ageing mechanism of carnosine[J].Journal of Practical Dermatology, 2018, 11(6):360-363.
[4] SOLANA-MANRIQUE C, SANZ F J, MART NEZ-CARRI
NEZ-CARRI N G, et al.Antioxidant and neuroprotective effects of carnosine:Therapeutic implications in neurodegenerative diseases[J].Antioxidants, 2022, 11(5):848.
N G, et al.Antioxidant and neuroprotective effects of carnosine:Therapeutic implications in neurodegenerative diseases[J].Antioxidants, 2022, 11(5):848.
[5] ALDINI G, DE COURTEN B, REGAZZONI L, et al.Understanding the antioxidant and carbonyl sequestering activity of carnosine:Direct and indirect mechanisms[J].Free Radical Research, 2021, 55(4):321-330.
[6] HORVATITS T, DROLZ A, TRAUNER M, et al.Liver injury and failure in critical illness[J].Hepatology, 2019, 70(6):2204-2215.
[7] BARDALLO R G, PANISELLO-ROSELL A, SANCHEZ-NUNO S, et al.Nrf2 and oxidative stress in liver ischemia/reperfusion injury[J].The FEBS Journal, 2022, 289(18):5463-5479.
A, SANCHEZ-NUNO S, et al.Nrf2 and oxidative stress in liver ischemia/reperfusion injury[J].The FEBS Journal, 2022, 289(18):5463-5479.
[8] SIES H, BERNDT C, JONES D P.Oxidative stress[J].Annual Review of Biochemistry, 2017, 86:715-748.
[9] CUADRADO A, ROJO A I, WELLS G, et al.Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases[J].Nature Reviews.Drug Discovery, 2019, 18(4):295-317.[10] EL-KASHEF D H, SEWILAM H M.Empagliflozin mitigates methotrexate-induced hepatotoxicity:Targeting ASK-1/JNK/Caspase-3 pathway[J].International Immunopharmacology, 2023, 114:109494.
[11] WEDEL S, MARTIC I, HRAPOVIC N, et al.tBHP treatment as a model for cellular senescence and pollution-induced skin aging[J].Mechanisms of Ageing and Development, 2020, 190:111318.
[12] 洪玥, 陈友霞, 刘珍珍, 等.咖啡酸对CCl4诱导BRL大鼠肝细胞损伤的保护作用[J].食品工业科技, 2021, 42(23):356-361.HONG Y, CHEN Y X, LIU Z Z, et al.Protective effect of caffeic acid on CCl4-induced injury of BRL hepatocyte[J].Science and Technology of Food Industry, 2021, 42(23):356-361.
[13] 张淑霞, 张雪涟, 卢珊, 等.柚皮苷对酒精诱导急性肝损伤的保护作用[J].中国实验方剂学杂志, 2023, 9(1):61-66.ZHANG S X, ZHANG X L, LU S, et al.Protective effect of naringin on alcohol-induced acute liver injury[J].Chinese Journal of Experimental Traditional Medical Formulae, 2023, 9(1):61-66.
[14] SIES H, BELOUSOV V V, CHANDEL N S, et al.Defining roles of specific reactive oxygen species (ROS) in cell biology and physiology[J].Nature Reviews.Molecular Cell Biology, 2022, 23(7):499-515.
[15] 郑碧丹, 王晓婉, 王思玉, 等.雷公藤内酯三醇通过Nrf2/Keap1信号通路抑制氧化应激和炎症减轻雷公藤甲素诱导的肝损伤[J].中药新药与临床药理, 2023, 34(4):509-519.ZHENG B D, WANG X W, WANG S Y, et al.Triptriolide alleviates triptolide-induced liver injury through reducing oxidative stress and inflammation via Nrf2/Keap1 signaling pathway[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2023, 34(4):509-519.
[16] 吕莹, 郝尧坤, 张照兰.槲皮苷通过Nrf2/HO-1通路抑制H2O2诱导人肝细胞L-02凋亡和损伤[J].中南药学, 2021, 19(1):44-50.LYU Y, HAO Y K, ZHANG Z L.Quercetin inhibits H2O2-induced apoptosis and injury of human hepatocytes L-02 via the Nrf2/HO-1 pathway[J].Central South Pharmacy, 2021, 19(1):44-50.
[17] LIU T, SUN L, ZHANG Y B, et al.Imbalanced GSH/ROS and sequential cell death[J].Journal of Biochemical and Molecular Toxicology, 2022, 36(1):e22942.
[18] WANG X, ZHOU T J, YANG X, et al.DDRGK1 enhances osteosarcoma chemoresistance via inhibiting KEAP1-mediated NRF2 ubiquitination[J].Advanced Science, 2023, 10(14):e2204438.
[19] XU H Y, FENG X H, ZHAO P F, et al.Procyanidin A2 penetrates L-02 cells and protects against tert-butyl hydroperoxide-induced oxidative stress by activating Nrf2 through JNK and p38 phosphorylation[J].Journal of Functional Foods, 2019, 62:103562.
[20] NI B R, LIU Y, GAO X, et al.Isoliquiritigenin attenuates emodin-induced hepatotoxicity in vivo and in vitro through Nrf2 pathway[J].Comparative Biochemistry and Physiology.Toxicology &Pharmacology:CBP, 2022, 261:109430.
[21] WANG Y, JIN R, CHEN J B, et al.Tangeretin maintains antioxidant activity by reducing CUL3 mediated NRF2 ubiquitination[J].Food Chemistry, 2021, 365:130470.
[22] NAGATA S.Apoptosis and clearance of apoptotic cells[J].Annual Review of Immunology, 2018, 36:489-517.
[23] LAI M C, LIU W Y, LIOU S S, et al.P-hydroxybenzyl alcohol antagonized the ROS-dependent JNK/Jun/caspase-3 pathway to produce neuroprotection in a cellular model of Parkinson’s disease[J].Nutrients, 2022, 14(23):5002.
[24] YANG C F, ZHONG Y J, MA Z H, et al.NOX4/ROS mediate ethanol-induced apoptosis via MAPK signal pathway in L-02 cells[J].International Journal of Molecular Medicine, 2018, 41(4):2306-2316.
[25] SHI C, CHEN X R, LIU Z J, et al.Oleuropein protects L-02 cells against H2O2-induced oxidative stress by increasing SOD1, GPx1 and CAT expression[J].Biomedicine &Pharmacotherapy=Biomedecine &Pharmacotherapie, 2017, 85:740-748.