小麦籽粒经过研磨制粉得到小麦粉,小麦粉除可用于面制品加工,也是谷朊粉(面筋蛋白)及小麦淀粉的生产原料。小麦粉中淀粉的比例约为70%,面筋蛋白的含量约为8%~14%[1],此外还含有少量的非淀粉多糖及脂质。其中小麦淀粉由20%~25%的直链淀粉及75%~80%支链淀粉构成。根据淀粉的颗粒大小一般分为A型小麦淀粉(A淀粉)、B型小麦淀粉(B淀粉),A淀粉颗粒粒径、密度较大约占总淀粉含量的70%~80%,B淀粉颗粒相对较小,约占总淀粉含量的20%~30%[2]。小麦淀粉因其黏度较强等特性,常用于食品改良剂,此外小麦淀粉也是凉皮等粉类食品生产的主要原料,工业中一般以优质淀粉(A淀粉)的特性来探究产品的特性。面筋蛋白是麦胶蛋白及麦谷蛋白结合而成的高分子聚合体,其蛋白含量在80%以上[3],且氨基酸组成较为齐全,麦谷蛋白及麦胶蛋白形成的三维网络结构,赋予了面筋蛋白独特的性质,使其表现出良好的黏弹性、延伸性、乳化性等性质而被广泛应用于食品及饲料等行业[4]。淀粉、谷朊粉市场需求量逐年增长,但是目前小麦深加工的转化率较低,通过优化分离工艺提高淀粉以及面筋蛋白组分的得率及纯度,同时降低水资源及其他能源的消耗一直是该领域的研究热点。
淀粉-面筋蛋白分离工艺一般分为水洗工艺及离心分离工艺[5],马丁法是一种典型的水洗工艺,其通过水洗醒发后的面团得到湿面筋及淀粉浆,淀粉浆离心后得到淀粉。马丁法分离淀粉与面筋蛋白时存在污水处理困难、环境污染等问题。现阶段大型生产企业多采用离心分离工艺,其原理是将面粉与水以一定比例混合形成面浆,面浆均质化处理后通过离心将物料分离。采用离心分离工艺节省了水资源但是产品的得率及纯度相对较低,DIK等[6]通过研究水温及粉水比的综合因素发现,在最佳粉水比的条件下采用40 ℃的水可以得到最佳的面筋蛋白。VAN DEN BULCK等[7]通过研究转速、温度及含水量对分离效果的影响,发现高温、低转速有利于面筋的团聚,而高转速有助于面筋的迁移。上述研究均是通过调整现有工艺中某一单元操作的参数来改善分离效果。工艺中采用辅助手段的研究还不够深入,目前超声作为一种辅助手段已广泛应用于玉米淀粉、豌豆淀粉等产品的改性,从而赋予淀粉产品更好的加工特性及感官品质[8-9]。因超声具有空化、均质等作用[10-11],可以改变面筋的起泡性、持水能力、面筋结构等产品特性,但是现阶段还缺乏超声处理对小麦淀粉及谷朊粉分离效果的探究,因此本文通过超声辅助处理分离小麦粉中淀粉与面筋蛋白,探究超声处理对分离效果及产品理化特性的影响,旨在为小麦淀粉及谷朊粉的工业化生产提供理论指导。
1 材料与实验方法
1.1 实验材料
小麦粉,五得利集团有限公司 ;KBr,上海麦克林生化科技股份有限公司;盐酸,天津市富宇精细化工有限公司;试剂均为分析纯。
1.2 仪器与设备
SCQ-8201E超声仪,上海声彦超声波仪器有限公司;XDF-D内切式匀浆机,宁波新芝生物科技股份有限公司;FOSS全自动凯式定氮仪,丹麦FOSS福斯仪器有限公司;LXJ-ⅡB型低速大容量离心机,上海安亭科学仪器厂;LGJ-10C普通型冷冻干燥机,北京四环科学仪器厂有限公司;WZZ-2B自动旋光仪,上海精密仪器科学有限公司;RVA-4黏度分析仪,美国Newport公司;数字型黏度计,上海魅宇仪器设备有限公司;傅里叶红外光谱仪、HAKKE RS6000流变仪,美国赛默飞世尔科技;Quanta 250FEG扫描电镜:美国FEI公司;ADVANCE型X射线衍射仪,德国Bruker公司。
1.3 实验方法
1.3.1 样品制备
面浆制备:取100 g小麦粉于烧杯中,加入120 mL蒸馏水搅拌形成面糊,30 ℃醒发30 min,再加入180 mL蒸馏水均匀搅拌形成面浆。
超声波处理:将装有面浆的烧杯放入超声装置中,以恒定功率300 W采用不同的超声波处理时间,0、5、10、20、30 min对面浆进行处理。
均质处理:将超声处理后的面浆置于均质机的载物台上,并对面浆进行均质(10 000 r/min,2 min),之后对其进行离心分离。
淀粉及面筋蛋白分离:将均质后的面浆进行离心(4 000 r/min,15 min),离心样品倒出上清液,所得上层沉淀为面筋蛋白与B淀粉混合物,下层为优质淀粉(A淀粉),洗涤上层混合物并对所收集洗涤液进行离心(4 000 r/min,15 min),分离得到面筋蛋白。将A淀粉、面筋蛋白冷冻干燥,磨粉后过100目筛网,收集样品并置于干燥器中室温保存。
1.3.2 基本指标测定
水分含量测定采用GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;蛋白含量测定采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;损伤淀粉含量测定采用GB/T 31577—2015《粮油检验 小麦粉损伤淀粉测定 安培计法》;面筋吸水率测定采用GB/T 5506.4—2008《小麦和小麦粉 面筋含量 第4部分:快速干燥法测定干面筋》;面筋指数测定采用LS/T 6102—1995《小麦粉湿面筋质量测定法面筋指数法》;降落数值测定采用GB/T 10361—2008《小麦、黑麦及其面粉,杜伦麦及其粗粒粉 降落数值的测定 Hagberg-Perten法》;粗淀粉含量测定参照1%(质量分数)盐酸旋光法;淀粉得率按公式(1)计算;面筋蛋白得率按公式(2)计算。
淀粉得率![]()
(1)
面筋蛋白得率![]()
(2)
式中:m0,面粉质量,g;m1,淀粉质量(干基),g;m2,面筋蛋白粉质量(干基),g。
1.3.3 面浆黏度测定
将旋转黏度计放入均质后的面浆中对其黏度进行测定,根据待测样品的黏度范围对转子及转速进行选择。在黏度计张角示数为25%~75%时测量黏度,并记录稳定后的示数。
1.3.4 淀粉糊化特性
使用快速黏度仪测定淀粉的糊化特性,称量实验所需的淀粉和水将样品配制成含水量为12%的悬浊液,参照缪铭等[12]的方法进行测定。
1.3.5 淀粉结晶度
根据BLAZEK等[13]的方法并稍作修改。采用X射线衍射对淀粉样品的晶体结构进行测定,扫描范围5°~40°,扫描速度4°/min,步长0.02°。
1.3.6 淀粉短程有序结构
参考YIN等[14]的方法稍作改动。将烘干的KBr颗粒与淀粉样品以1∶100(质量比)进行混合,在研钵中研磨均匀,研磨过程在干燥室内进行,将研磨后的样品压片后于红外光谱仪装置内进行扫描,得到扫描波段为400~4 000 cm-1的红外光谱。利用OMNIC 9.0软件对800~1 200 cm-1波段进行分析。
1.3.7 面筋蛋白二级结构
将烘干的KBr颗粒与面筋蛋白样品以1∶100(质量比)的比例进行混合,在研钵中研磨均匀,研磨过程在干燥室内进行,将研磨样品压片后于红外光谱仪内进行扫描,得到扫描波段为400~4 000 cm-1的红外光谱。利用peak fit 4.12软件对1 600~1 700 cm-1波段进行分析。
1.3.8 面筋蛋白流变特性
参考李翠翠等[15]的方法并有所修改,将分离后的湿面筋样品,放置于配有直径为35 mm的平行转子的载物平板上。当样品被压至所设定的1.000 mm时,刮去周边多余的湿面筋并使用甲基硅油进行密封,根据测试程序对样品在0.1~10 Hz进行频率扫描,恒定应力15 Pa下进行应力扫描。
1.3.9 面筋蛋白微观结构
将冻干的面筋样品制成1 cm3的面筋块,保证观察的表面为自然断裂面并尽可能平整,用扫描电镜对喷金处理后的断裂面进行扫描,扫面电压3.0 kV,放大倍数500倍,观察其微观结构。
1.4 数据处理
使用SPSS软件对结果进行显著性分析及单因素方差分析并计算其平均值、标准差,每项数据需3个以上平行,使用OMNIC、peak fit软件处理傅里叶红外图谱,Origin 2023b绘制图像并进行分析。
2 结果与分析
2.1 小麦粉基本理化指标
原料小麦粉的主要基本理化指标如表1所示。
表1 小麦粉基本理化指标
Table 1 Basic physical and chemical indexes of wheat flour
指标水分 /%灰分 /%降落数值/s面筋含量/%面筋指数损伤淀粉 /UCD粗蛋白/%含量12.70±0.110.42±0.02487.00±5.0032.10±0.5072.86±2.9225.05±0.1511.6±0.03
注:实验测定3次,结果为平均值±标准差(下同)。
2.2 超声时间对淀粉-面筋分离效果的影响
如表2所示,超声处理后的A淀粉得率、面筋蛋白纯度要显著高于未超声处理(P<0.05),这可能是由于未超声处理样品中的部分A淀粉被面筋蛋白包裹没有释放出来,而超声处理改变了面筋结构的稳定性,限制淀粉流动的能力减弱,表现为淀粉颗粒更好地释放,超声10 min时A淀粉得率达到最高(51.50%)后有所下降,这可能是由于长时间的超声作用降低了部分A淀粉的粒径大小,在离心过程中由于颗粒小、密度低而被分离至B淀粉中。经过超声处理的A淀粉纯度与未超声处理无显著性差异。超声处理后的面筋蛋白得率均低于未超声处理(9.72%),这可能是由于超声作用增加了面筋蛋白的溶解度[16],导致面筋蛋白得率有所下降。
表2 超声时间对分离效果的影响
Table 2 Effect of ultrasonic time on separation of wheat flour
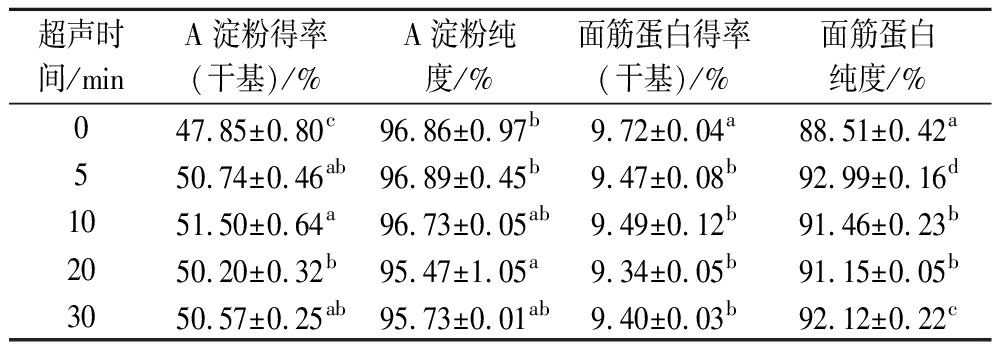
超声时间/minA淀粉得率(干基)/%A淀粉纯度/%面筋蛋白得率(干基)/%面筋蛋白纯度/%047.85±0.80c96.86±0.97b9.72±0.04a88.51±0.42a550.74±0.46ab96.89±0.45b9.47±0.08b92.99±0.16d1051.50±0.64a96.73±0.05ab9.49±0.12b91.46±0.23b2050.20±0.32b95.47±1.05a9.34±0.05b91.15±0.05b3050.57±0.25ab95.73±0.01ab9.40±0.03b92.12±0.22c
注:表中不同字母表示样品间具有显著性差异(P<0.05)(下同)。
2.3 面浆黏度的变化
超声的空化作用使得面浆悬浮液中产生大量气穴,气穴内部的大气压强产生的剪切作用导致面筋蛋白分子不断发生断裂、重排[17]。在淀粉与面筋分离的过程中,随着面筋蛋白的聚集及淀粉颗粒的释放,面浆的黏度逐渐降低,从图1可以看出,随着超声时间的增加,面浆的黏度呈现出先下降后上升的趋势,在超声处理时间为10 min时面浆的黏度达到最低,此时面筋蛋白与淀粉之间分离效果较好,超声10 min后随着时间的增加,黏度逐渐增加可能是因为超声能量的累积导致面筋蛋白结合的二硫键等受到强剪切作用断裂,产生了细碎的面筋造成的。
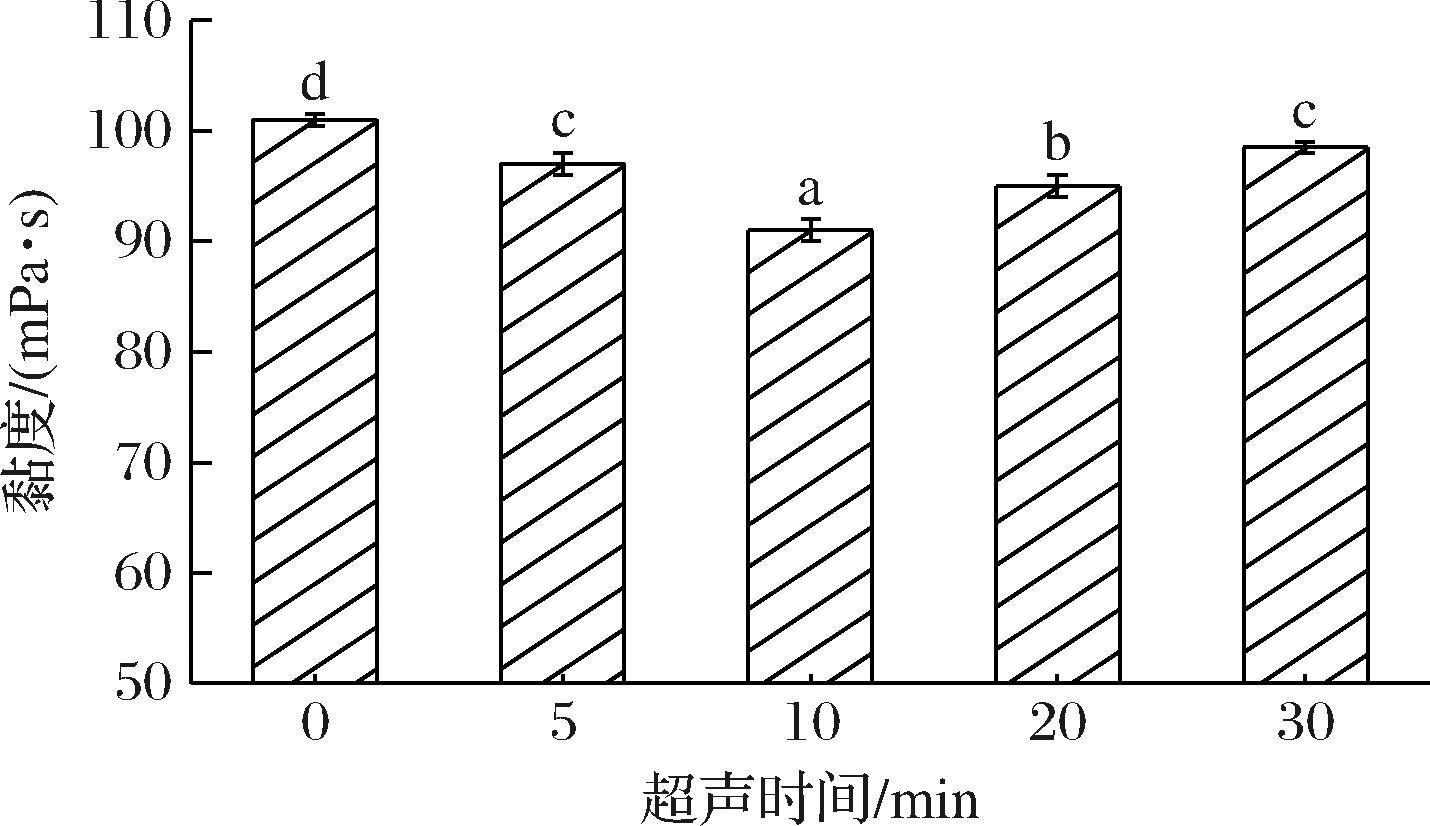
图1 超声时间对面浆黏度的影响
Fig.1 Effect of ultrasonic time on batter viscosity
注:图中不同字母表示样品间具有显著性差异(P<0.05)(下同)。
2.4 淀粉短程有序结构的变化
淀粉分子的双螺旋有序结构在红外光谱的1 200~800 cm-1波段很敏感[18],其中波长为1 047 cm-1处的吸收带与晶态淀粉有关,波长在1 022 cm-1范围处的吸收带与非晶态的淀粉有关,2处吸收峰强度的比值可用来表征淀粉颗粒短程有序结构[19]。图2-a为淀粉的傅里叶去卷积红外图谱(1 200~800 cm-1),图2-b为两波长(1 047、1 022 cm-1)处波峰强度的比值。可以看出超声处理后的比值显著低于未超声处理(P<0.05),这可能是因为超声处理打开了淀粉分子链,导致了双螺旋结构的解聚。破坏了淀粉的短程有序结构,随着超声时间的增加R1047/1022值整体呈现下降的趋势,这与淀粉结晶度的趋势基本一致。在超声10、30 min时有所波动,可能是由于超声作用于长支链淀粉侧链使其断裂,导致游离的短链淀粉含量上升,而较高含量的短链淀粉在分子间作用力下发生重排促使了有序结构的形成[8]。
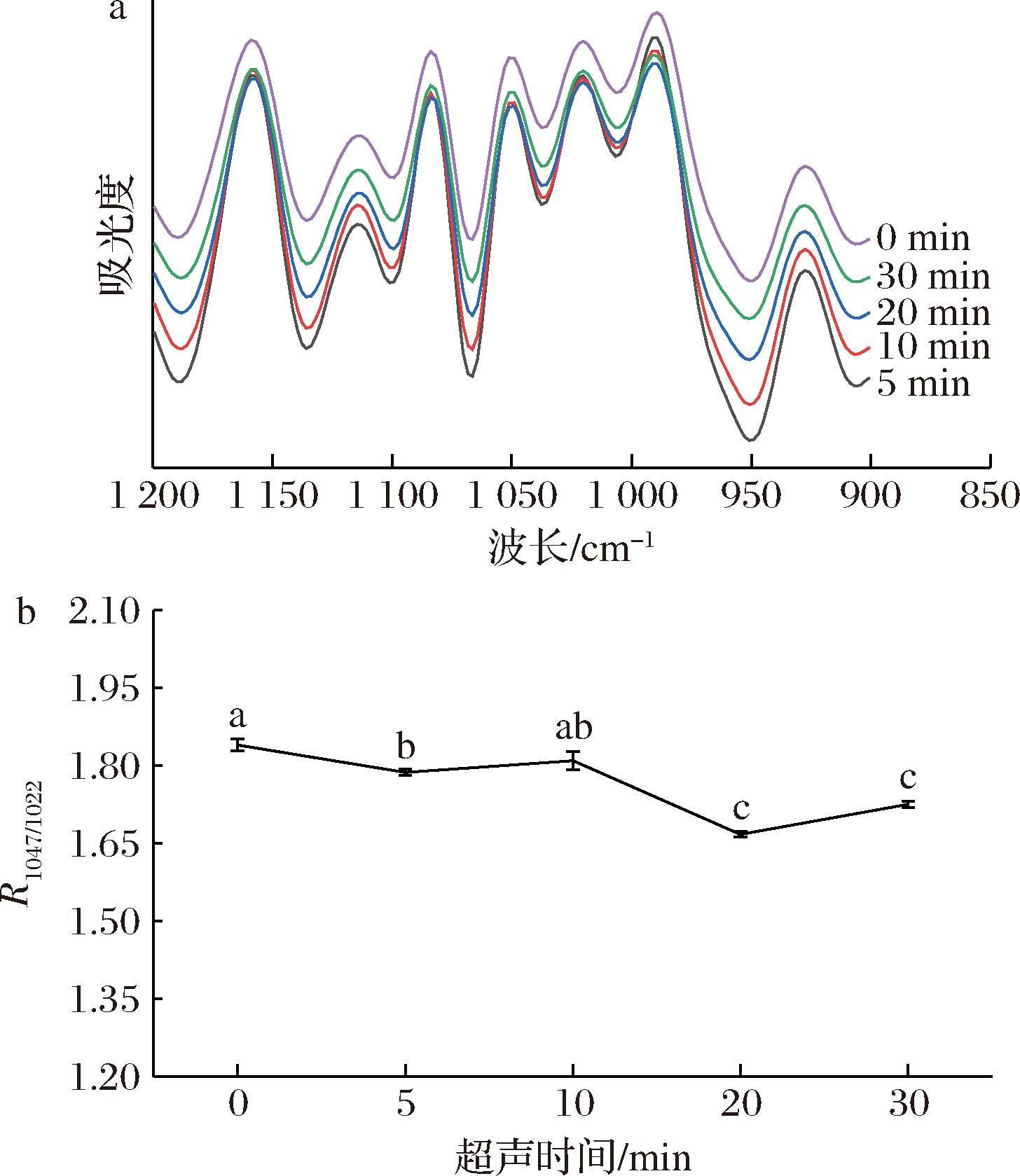
a-FT-IR光谱;b-R1047/1022值
图2 不同超声时间时淀粉的FT-IR光谱及R1047/1022值的变化
Fig.2 Effect of ultrasonic time on FT-IR spectrum andR1047/1022 value of starch
2.5 淀粉相对结晶度的变化
淀粉分子结构是由重复的无定形层和半结晶层构成,无定形层包含具有无序构象的支链淀粉及大分子直链淀粉[20]。结晶度可以表征淀粉分子的稳定状态,由图3可知,经过不同超声时间处理的小麦淀粉在15°、17°、18°、23°时出现明显的衍射峰,为典型的A型晶体结构,这表明超声处理未使小麦淀粉颗粒的晶型发生改变。随着超声时间的增加,淀粉的相对结晶度整体呈现下降的趋势,在超声处理30 min时作用更加明显,结晶度降到最低(25.89%),可能是因为超声的空化作用产生了一系列如振荡、气核膨胀、爆破等动力学行为[16],破坏了淀粉分子间或分子内氢键,降低了淀粉分子双螺旋结构的紧密程度及内部的有序性,从而使淀粉分子结晶度降低,这与张晓磊等[8]的研究一致。
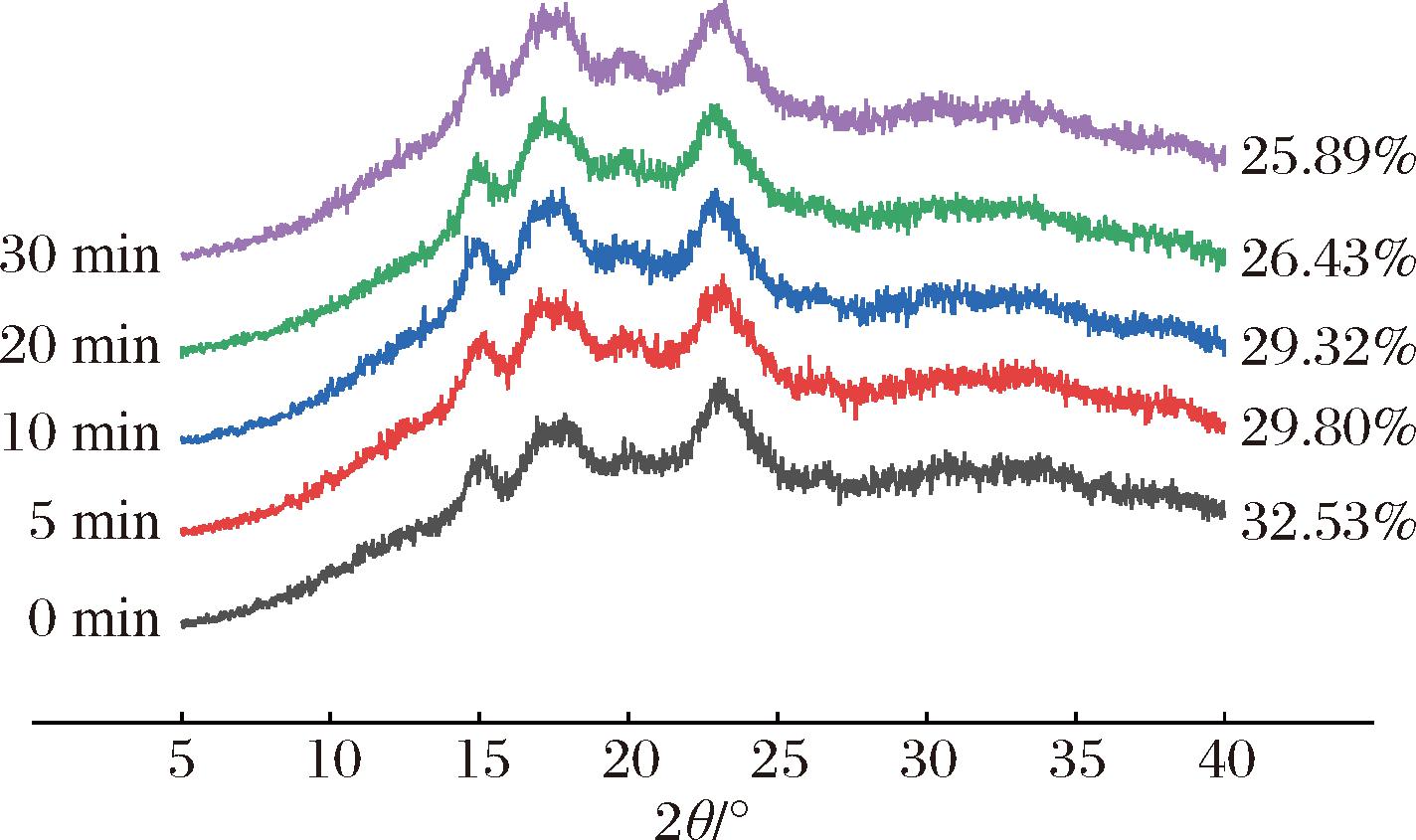
图3 超声时间对淀粉相对结晶度的影响
Fig.3 Effect of ultrasonic time on the relative crystallinity of starch
2.6 淀粉的糊化特性
如表3所示,淀粉峰值黏度在超声20 min之后显著降低(P<0.05),可能是由于超声能量随时间的累积,对分子结合键的作用增强使其断开,导致分子间的作用力减弱,进而表现为黏度的降低,而超声前10 min峰值黏度变化不大可能是由于形成的短链发生重排导致的。崩解值可以表征热糊的稳定性,而热糊稳定性跟淀粉中的支链淀粉有关,支链淀粉比例越大形成的糊就越稳定[12]。表3中崩解值的大小随着超声时间的增加呈现先上升后下降的趋势,这可能由于在短时间超声时(5、10 min),超声作用于淀粉结晶区的短支链淀粉,使其断裂并重排形成较长的支链淀粉,使热糊稳定性有所降低,而随着超声时间的增加(20、30 min),超声对结晶区的破坏程度逐渐增大,短支链淀粉比例增加,支链淀粉分子在热糊形成的时候交联的接触点增多[8],表现出热糊稳定性的增强。淀粉回生值的大小与直链淀粉聚合度以及支链淀粉外链长有关[12],随着超声时间的增加,淀粉的回生值呈现先升高后降低的趋势,超声10 min时回生值达到最高,这可能是因为超声的空化作用破坏了淀粉的结晶区,形成的短链直支链淀粉分子重排形成较长淀粉分子链,冷却时直链淀粉重新排列成有序的结构导致的,而超声的持续作用(20、30 min)使得结晶区破坏较大,直链淀粉聚合度减小而表现为回生值的降低。
表3 超声时间对A淀粉糊化特性的影响
Table 3 Effect of ultrasonic time on gelatinization properties of A-starch
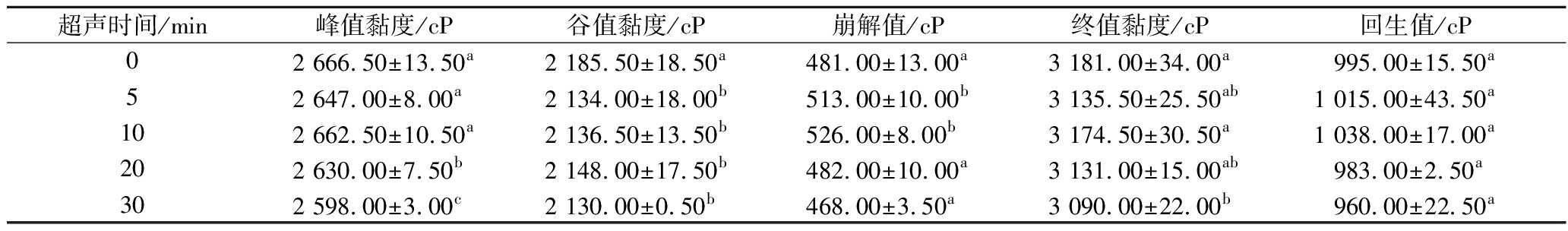
超声时间/min峰值黏度/cP谷值黏度/cP崩解值/cP终值黏度/cP回生值/cP02 666.50±13.50a2 185.50±18.50a481.00±13.00a3 181.00±34.00a995.00±15.50a52 647.00±8.00a2 134.00±18.00b513.00±10.00b3 135.50±25.50ab1 015.00±43.50a102 662.50±10.50a2 136.50±13.50b526.00±8.00b3 174.50±30.50a1 038.00±17.00a202 630.00±7.50b2 148.00±17.50b482.00±10.00a3 131.00±15.00ab983.00±2.50a302 598.00±3.00c2 130.00±0.50b468.00±3.50a3 090.00±22.00b960.00±22.50a
2.7 面筋吸水率的变化
由图4可知,面筋的吸水率随着超声时间的增加呈现先上升后降低的趋势,未经超声处理的面筋吸水率为181.86%,在超声10 min时面筋吸水率达到最高(187.98%),之后有所下降,在超声30 min时面筋吸水率降至最低(178.5%),这可能是由于超声的强机械剪切作用,使面筋蛋白的二硫键断裂而暴露出内部的亲水性氨基酸,使得面筋的吸水率呈现短暂升高的趋势,而随着超声时间的增加,对面筋网络结构的破坏增强,面筋保持水的能力减弱,使得面筋的吸水率逐渐下降。
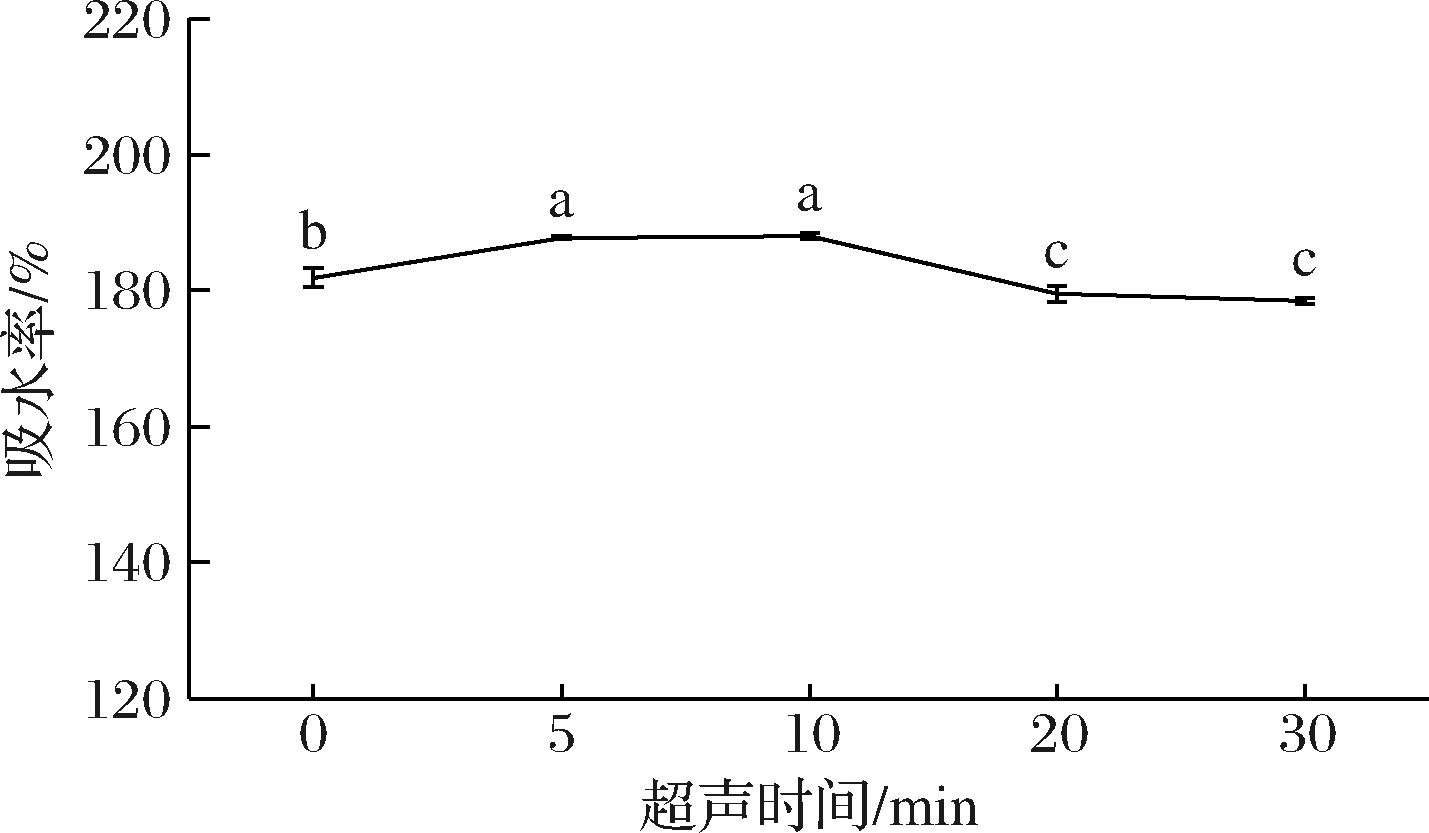
图4 超声时间对面筋吸水率的影响
Fig.4 Effect of ultrasound time on water absorption of gluten
2.8 面筋蛋白二级结构变化
研究表明,蛋白质红外光谱由9个酰胺特征带组成,其中酰胺Ⅰ (1 600~1 700 cm-1)带对蛋白质二级结构的研究最有意义[21]。通过对傅里叶红外(波长范围1 600~1 700 cm-1)图谱进行傅里叶去卷积以及二阶导数的拟合,求出不同波峰的面积,根据蛋白二级结构归属(1 600~1 640 cm-1为β-折叠,1 637~1 645 cm-1为无规则卷曲,1 646~1 664 cm-1为α-螺旋,1 665~1 700 cm-1为β-转角)计算各个结构的比例[22],其中β-折叠、α-螺旋是蛋白质构象中较为稳定、有序的结构。如图5所示,经过超声处理后面筋蛋白的β-折叠呈现逐渐减少的趋势,无规则卷曲显著增加(P<0.05),α-螺旋与β-转角无显著变化,这可能是因为超声空化、机械剪切作用使面筋蛋白分子间的氢键作用减少,导致β-折叠减少而无规则卷曲增加,形成无序、开放的网络结构,面筋结构逐渐变得疏松,促使了淀粉颗粒的溶出。
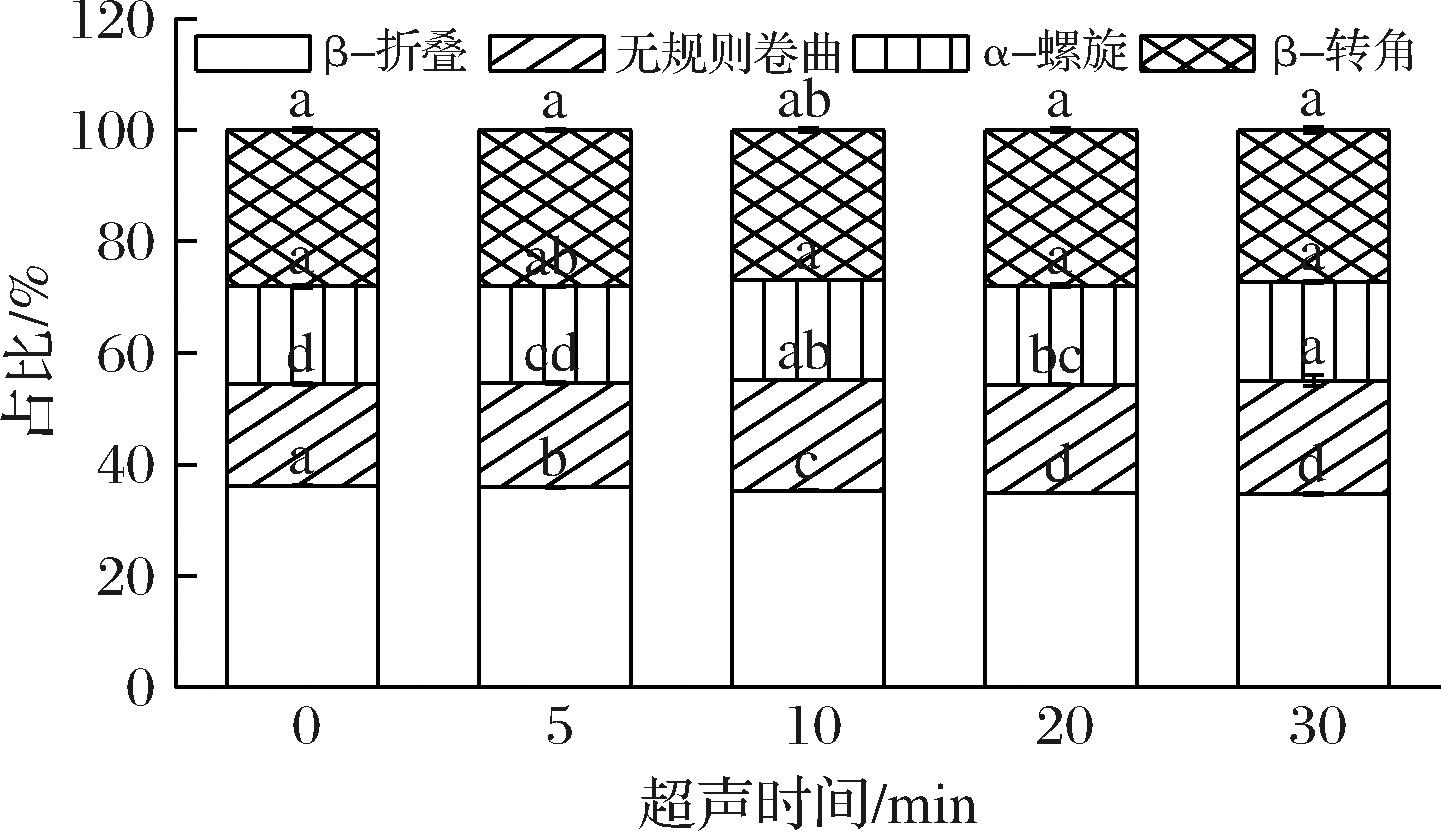
图5 超声时间对面筋蛋白二级结构的影响
Fig.5 Effect of ultrasonic time on gluten protein secondary structure
2.9 面筋流变特性分析
在动态流变学中,弹性模量(G′)是指发生弹性形变时所储存的能量大小,黏性模量(G″)是指发生黏性形变而损耗的能量大小,两者分别反映材料的弹、黏性,而tanδ反映的是材料黏弹性的比例,面筋蛋白的tanδ<1,是典型的固体黏弹性材料。研究表明,麦胶蛋白缺少弹性,具有流动性,决定着面筋蛋白的黏性和延展性;麦谷蛋白分子间通过二硫键交联且结合能力强,决定着面筋的弹性[23]。从图6-a、图6-b中可以看出,随着超声时间的增加,面筋的弹性模量和黏性模量整体呈现减小的趋势,且G′明显大于G″,表明面筋体系中的弹性大于黏性。随着超声时间的增加面筋的弹性模量以及黏性模量降低表明超声改变了面筋的网络结构,可能是由于超声的机械剪切作用降低了麦谷蛋白分子间二硫键的交联程度,同一超声时间随着频率的增加,面筋的弹性模量以及黏性模量整体呈现上升的趋势。
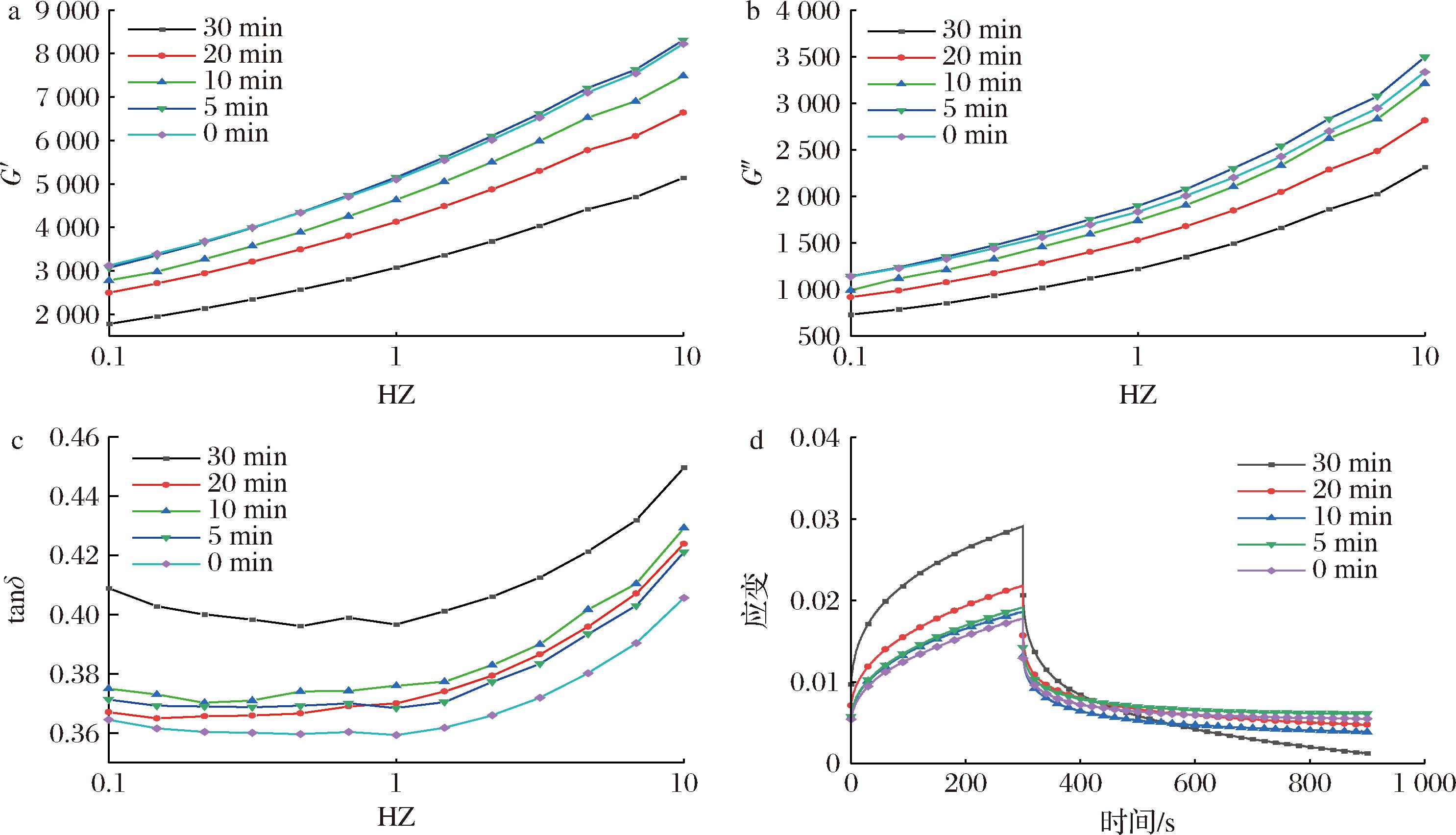
a-储能模量;b-损耗模量;c-损耗因子δ;d-蠕变恢复
图6 超声时间对面筋的储能模量、损耗模量、损耗因子δ、蠕变恢复的影响
Fig.6 Effect of ultrasonic time on storage modulus, loss modulus, loss factor δ, and creep recovery of gluten
一般情况下,材料的弹性越好,其抗形变的能力就越强,且恢复时就越容易恢复到最小形变状态。面筋的蠕变恢复能力如图6-d所示,随着超声时间的增加,面筋的形变越来越大,短时间超声处理(5、10 min)对比未超声变化较小,在超声时间为30 min时面筋的形变量达到最大值,这表明超声作用降低了面筋抗形变能力且越来越明显,与面筋蛋白的黏弹性模量表征一致。
2.10 面筋微观结构
为了探究超声作用对面筋蛋白网络微观结构的影响,对面筋蛋白样品进行了扫描电镜观察,如图7所示,被观察的样品结构均呈现出具有细小孔洞的海绵状网络结构,这是由麦谷蛋白及麦胶蛋白分子通过二硫键、氢键、范德华力等相互作用而交联在一起,形成的具有黏弹性的三维网状结构[24]。通过对比不同超声处理时间面筋蛋白的微观结构,可以看出相同的放大倍数下,未经超声处理的样品结构较为致密,随着超声时间的增加,面筋网络的孔洞逐渐增大,在超声20、30 min时面筋网络明显变得疏松,且出现断裂的现象,这有可能是超声的空化作用产生气核,而气核内部产生巨大的压强并作用于维持面筋蛋白网状结构稳定的次级键,由于蛋白分子间作用力被破坏而导致面筋蛋白网络结构遭到破坏,且随着超声时间的增加破坏程度逐渐增大。
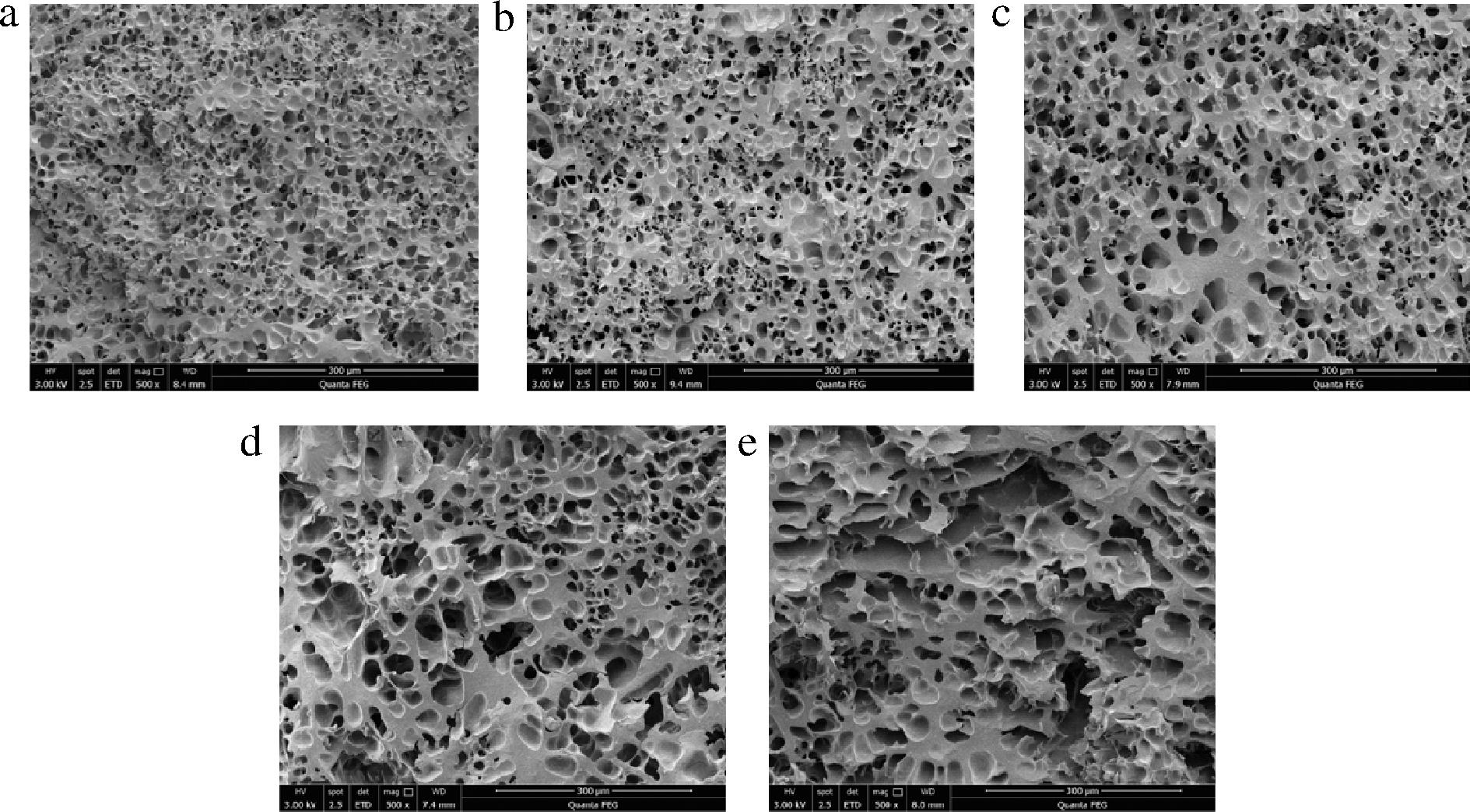
a-0 min;b-5 min;c-10 min;d-20 min;e-30 min
图7 超声时间对面筋微观结构的影响(×500)
Fig.7 Effect of ultrasound time on gluten microstructure(×500)
3 结论
本研究发现,超声处理改变了面筋结构,蛋白二级结构中的β-折叠减少,无规则卷曲增加,面筋的弹性模量、黏性模量逐渐下降。因此限制淀粉分子流动的因素减弱,A淀粉得率及面筋蛋白的纯度显著增加(P<0.05)。较短时间(≤10 min)的超声处理使得面筋网络结构发生改变有助于淀粉的溶出从而提高其得率,然而随着超声时间的增加,超声能量的累积对面筋质量的负面影响进一步加深,导致分离的效果有所降低。同时对面筋蛋白、淀粉的作用增强,使得淀粉的结晶度及淀粉分子链的有序程度发生改变,淀粉糊的崩解值、回生值均呈现显著增加后减小的趋势。对面筋蛋白作用使得面筋网络变得疏松,稳定性变差。因此,工业中分离小麦淀粉及面筋蛋白时可以采用较短的超声处理时间,在保证产品质量及经济效益的前提下实现产量的提升。
[1] 乔永钦, 王彦波.小麦淀粉生产工艺及设备的改进[J].粮食与饲料工业, 2006(10):25-26.QIAO Y Q, WANG Y B.Improvement of production technology and equipment of wheat starch[J].Cereal &Feed Industry, 2006(10):25-26.
[2] AO Z H, JANE J L.Characterization and modeling of the A- and B-granule starches of wheat, triticale, and barley[J].Carbohydrate Polymers, 2007, 67(1):46-55.
[3] 王彦波, 李爱花, 乔永钦.小麦淀粉、谷朊粉的生产与应用[J].粮食与饲料工业, 1995(4):13-14.WANG Y B, LI A H, QIAO Y Q.Production and application of wheat starch and gluten[J].Cereal &Feed Industry, 1995(4):13-14.
[4] 王岸娜, 陈丛丛, 吴立根.小麦面筋蛋白研究进展[J].粮油食品科技, 2017, 25(5):19-23.WANG A N, CHEN C C, WU L G.Research progress of wheat gluten protein[J].Science and Technology of Cereals, Oils and Foods, 2017, 25(5):19-23.
[5] 李明菲, 郑学玲, 卞科, 等.面团状态对小麦淀粉与谷朊粉分离效果的影响[J].粮食与油脂, 2015, 28(10):21-24.LI M F, ZHENG X L, BIAN K, et al.Influence of dough state on the separation effect of wheat starch and gluten flour[J].Cereals &Oils, 2015, 28(10):21-24.
[6] DIK T, YÖNDEM-MAKASCIO LU F, AYTAÇ C H, et al.Wet separation of wheat flours into starch and gluten fractions:The combined effects of water to flour ratio-dough maturation time and the effects of flour aging and ascorbic acid addition[J].Journal of the Science of Food and Agriculture, 2002, 82(4):405-413.
LU F, AYTAÇ C H, et al.Wet separation of wheat flours into starch and gluten fractions:The combined effects of water to flour ratio-dough maturation time and the effects of flour aging and ascorbic acid addition[J].Journal of the Science of Food and Agriculture, 2002, 82(4):405-413.
[7] VAN DEN BULCK K, LOOSVELD A M A, COURTIN C M, et al.Amino acid sequence of wheat flour Arabinogalactan-peptide, identical to part of grain softness protein GSP-1, leads to improved structural model[J].Cereal Chemistry, 2002, 79(3):329-331.
[8] 张晓磊, 刘鹏飞, 代养勇, 等.超声处理对豌豆淀粉结构及热力学性质的影响[J].粮食与油脂, 2023, 36(6):30-34.ZHANG X L, LIU P F, DAI Y Y, et al.Effect of ultrasonic treatment on the structure and thermodynamic properties of pea starch[J].Cereals &Oils, 2023, 36(6):30-34.
[9] 郁映涛, 肖刘洋, 杨晓凡, 等.超声波结合酶解对玉米淀粉多层级结构及其吸附性能的影响[J].食品科学,2024,45(5):174-183.YU Y T, XIAO L Y, YANG X F, et al.Effects of ultrasonic combined with enzymatic hydrolysis on the multilevel structure and adsorption properties of maize starch[J].Food Science, ,2024,45(5):174-183.[10] SORIA A C, VILLAMIEL M.Effect of ultrasound on the technological properties and bioactivity of food:A review [J].Trends in Food Science &Technology, 2010, 21(7):323-331.
[11] PONGSAWATMANIT R, HARNSILAWAT T, MCCLEMENTS D J.Influence of alginate, pH and ultrasound treatment on palm oil-in-water emulsions stabilized by β-lactoglobulin [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2006, 287(1-3):59-67.
[12] 缪铭, 江波, 张涛.淀粉的消化性能与RVA曲线特征值的相关性研究[J].食品科学, 2009, 30(5):16-19.MIAO M, JIANG B, ZHANG T.Correlation analysis between starch digestibility and rapid viscosity analyzer profile characteristics[J].Food Science, 2009, 30(5):16-19.
[13] BLAZEK J, COPELAND L.Pasting and swelling properties of wheat flour and starch in relation to amylose content[J].Carbohydrate Polymers, 2008, 71(3):380-387.
[14] YIN Y F, BERGLUND L, SALMÉN L.Effect of steam treatment on the properties of wood cell walls[J].Biomacromolecules, 2011, 12(1):194-202.
[15] 李翠翠, 陆啟玉, 马宇翔, 等.巯基、二硫键变化对小麦面筋蛋白性质的影响[J].中国食品学报, 2019, 19(7):93-98.LI C C, LU Q Y, MA Y X, et al.Effects of sulfydryl groups and disulfide bonds on the characteristics of wheat gluten protein[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):93-98.
[16] 黄达伟, 马宁, 杜喜坤.超声对小麦面筋蛋白功能性质的影响[J].食品与发酵科技, 2014, 50(3):42-45;49.HUANG D W, MA N, DU X K.Effect of ultrasonic on the functionality of wheat gluten protein[J].Food and Fermentation Technology, 2014, 50(3):42-45;49.
[17] 张海华, 朱科学, 周惠明.超声波对小麦面筋蛋白结构的影响[J].中国农业科学, 2010, 43(22):4687-4693.ZHANG H H, ZHU K X, ZHOU H M.Effect of ultrasonic on the structure of wheat gluten protein[J].Scientia Agricultura Sinica, 2010, 43(22):4687-4693.
[18] 冯琳琳, 闫溢哲, 张明月, 等.等离子体活化水湿热处理对小麦淀粉结构和性能的影响研究[J].河南农业大学学报, 2019, 53(4):601-607.FENG L L, YAN Y Z, ZHANG M Y, et al.Effects of plasma activated water combined with heat-moisture treatment on the structure and physicochemical properties of wheat starch[J].Journal of Henan Agricultural University, 2019, 53(4):601-607.
[19] MAN J M, YANG Y, ZHANG C Q, et al.Structural changes of high-amylose rice starch residues following in vitro and in vivo digestion[J].Journal of Agricultural and Food Chemistry, 2012, 60(36):9332-9341.
[20] WATERSCHOOT J, GOMAND S V, FIERENS E, et al.Production, structure, physicochemical and functional properties of maize, cassava, wheat, potato and rice starches[J].Starch-Stärke, 2015, 67(1-2):14-29.
[21] 刘锞琳, 何悦珊, 王钊, 等.傅里叶红外光谱法与拉曼光谱法测定蛋白质二级结构研究进展[J].食品与发酵工业, 2023, 49(10):293-298.LIU K L, HE Y S, WANG Z, et al.Progress in determination of protein secondary structure by Fourier infrared spectroscopy and Raman spectroscopy[J].Food and Fermentation Industries, 2023, 49(10):293-298.
[22] 何建川, 邵阳, 张波.蛋白质和变性蛋白质二级结构的FTIR分析进展[J].化学研究与应用, 2012, 24(8):1 176-1 180.HE J C, SHAO Y, ZHANG B.Progress in study of protein secondary structure and denaturized protein by FTIR[J].Chemical Research and Application, 2012, 24(8):1176-1180.
[23] 王亚平, 安艳霞.小麦面筋蛋白组成、结构和功能特性[J].粮食与油脂, 2011, 24(1):1-4.WANG Y P, AN Y X.The composition, structure and functional properties of wheat gluten protein[J].Cereals &Oils, 2011, 24(1):1-4.
[24] HUANG Q, LI L, FU X.Ultrasound effects on the structure and chemical reactivity of cornstarch granules[J].Starch-Stärke, 2007, 59(8):371-378.