酚类物质是一类具有高生物活性的植物次生代谢产物,不仅参与调节植物的生长发育、应对环境应激,而且对人体具有抗氧化[1]、抗癌抑菌[2]等生理活性,已被广泛应用于食品、药品及化妆品等多个领域。酚类物质主要由苯丙烷代谢途径合成,其中苯丙氨酸解氨酶(phenylalanine aminolyase,PAL)、肉桂酸-4-羟化酶(cinnamic acid-4-hydroxylase,C4H)和4-香豆酸辅酶A连接酶(4-coumarate coenzyme A ligase,4CL)在酚类物质合成代谢过程中起重要的调控作用[3]。γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种非蛋白质氨基酸,广泛分布于动植物和微生物中。在植物中,其作为一种内源信号分子,参与调控酚类物质的合成代谢[4]。GABA在禾谷类单子叶植物中主要由谷氨酸脱氢酶(glutamic acid decarboxylase,GAD)催化谷氨酸合成[5]。人体中,GABA是一种重要的神经递质,同时具有降低血压、镇静、改善肾脏和肝脏功能以及促进酒精代谢等生理功能[6]。
谷物发芽不仅促进了籽粒中还原糖、矿物质、游离氨基酸、膳食纤维等营养成分的合成,而且使酚酸、黄酮和GABA等生物活性成分大量累积[7]。同时,植酸、黄曲霉毒素和其他抗营养因子等会在籽粒萌发过程中显著减少[8]。研究表明,发芽可促进不同品种大豆籽粒中总酚和总黄酮含量的提升,并且可以提高其抗炎活性和营养价值[9]。大豆在发芽过程中通过提高GAD活力及其基因表达水平,促进了内源GABA的累积,且其含量在发芽第6天时达到峰值[10]。此外,发芽6 d的大麦芽苗中不仅GAD活力显著提高,而且促进了GABA的累积[11],PAL、C4H和4CL等关键酶基因表达水平也得到提高,使得酚酸含量显著增加,尤其是对香豆酸和阿魏酸的累积量[12]。因此,萌发处理是提高植物内源GABA和酚酸等生物活性成分的有效方式。
糙米是一种极具潜力的功能性食品原料,由于其保留了胚和皮层,因此富含维生素、矿物质以及GABA、酚类物质等多种活性成分,有促进新陈代谢、预防老年痴呆、保肝护肾、调节激素分泌等生理功效[13]。糙米发芽后,多种内源酶被激活,促使大分子营养物质转化为更易吸收的小分子,尤其酚酸、黄酮和GABA等次生代谢产物大量累积,营养和功能品质显著提升。研究发现,催芽24 h的稻谷中GABA含量增加了23.60 mg/100 g[3]。WANG等[4]研究发现,糙米中GABA含量在发芽过程中显著提高,且当发芽20 h时其含量较糙米籽粒增加2倍。MOONGNGARM等[14]亦报道,与未发芽糙米相比,发芽糙米中总酚含量提高了14 mg/100 g。因此,发芽促进了糙米中多种活性物质的累积,在提高糙米营养品质方面具有重要作用。
研究显示,谷物籽粒中生物活性物质含量与其品种密切相关。EUM等[9]发现相同萌发时间下大豆中酚类物质含量及其组分变化与其品种之间存在较大差异。以往相关研究更多关注对不同处理条件下萌发糙米的GABA和酚类物质含量变化差异的分析。然而,发芽处理对不同品种糙米GABA、酚类组分含量的影响程度是否存有差异尚不清楚,仍需进一步深入研究。因此,本研究选取粤秀优197、万象优197、泰丰优197、万象优111、上两优798、莲玉香2号、莲粳9号、甬优1538、广泰优197、广和优197、浙两优798和Rondo共12个糙米品种为研究对象,分析发芽对不同品种糙米中GABA、酚类物质含量及其合成关键酶活力的影响,优选高GABA和酚类物质水平的品种。本研究对促进消费者的健康、提升糙米的深加工水平、显著延长糙米产业链条有积极作用,为开发富含GABA和酚类物质等功能成分的芽类食品提供理论依据和技术支持。
1 材料与方法
1.1 试验材料与处理
参试稻谷品种‘粤秀优197、万象优197、泰丰优197、万象优111、上两优798、莲玉香2号、莲粳9号、甬优1538、广泰优197、广和优197、浙两优798和Rondo’,由江西省农业科学院水稻研究所提供,种植于江苏省淮安市施河镇江苏百斯特鲜食有限公司试验基地,稻谷收获后于-20 ℃保存待用。
挑选砻谷后籽粒饱满、无损伤的糙米,置于1% NaClO(体积分数)溶液中浸泡消毒15 min,经去离子水冲洗至pH中性。消毒后的糙米籽粒于25 ℃下浸泡6 h解除休眠,再于25 ℃避光条件下培养36 h,期间每4 h喷水1次,以未发芽为对照。12个品种发芽糙米形态如图1所示。

图1 十二个品种发芽糙米的表观形态
Fig.1 Apparent morphology of brown rice after germination
1.2 指标测定
GABA含量:参照TSUSHIDA等[15]方法进行测定。称取1 g发芽糙米粉,与去离子水按料液比1∶8(g∶mL)混合振荡提取,离心后上清液为GABA粗提液。GABA含量以mg/g DW计。
GAD活力:参考TSUSHIDA等[15]的方法进行测定。以每分钟每克发芽糙米(鲜重)酶促反应体系吸光度值增加0.01为1个GAD活性单位(U),表示为0.01 OD630/(min·g),即U/g FW。
谷氨酸提取与测定:采用LI等[16]的方法进行测定,以mg/g DW计。称取1 g发芽糙米粉,按料液比1∶8加入pH=6.0的0.2 mol/L醋酸-醋酸钠溶液,于60 ℃下振荡(140 r/min)提取2 h。然后4 000 r/min、4 ℃下离心5 min,上清液即谷氨酸提取液。
总酚提取与测定:采用MA等[12]的方法提取并测定。准确称取1 g糙米粉,经9 mL体积分数80%甲醇振荡浸提3次,离心后合并滤液,于45 ℃下旋蒸至干,并用体积分数50%甲醇定容,即游离酚提取液。提取游离酚后的残余物经2 mol/L NaOH碱解4 h,水解液用6 mol/L的浓盐酸调节pH至1.5~2.0终止反应,用25 mL乙酸乙酯萃取3次,用体积分数50%甲醇定容,即结合酚提取液。以没食子酸为当量,计算发芽糙米中酚类物质含量,单位以mg GAE/100 g DW计。
酚酸含量测定:采用CHEN等[17]的方法进行测定。提取酚类物质过程与条件同上述总酚提取步骤,利用液相色谱法测定提取的游离态酚酸和结合态酚酸,含量以mg/g DW计。
PAL活力、C4H活力、4CL活力:取2 g新鲜发芽糙米,加入适量缓冲液研磨成匀浆,离心取上清液作为提取液。PAL、C4H和4CL活力测定参照HAN等[18]的方法。以每小时每克发芽糙米(鲜重)酶促反应体系吸光度值增加0.01为1个PAL活力单位(U),以每分钟每克发芽糙米(鲜重)酶促反应体系吸光度值增加0.01为1个C4H和4CL活力单位(U),分别表示为0.01△OD290/(h·g)、0.01△OD340/(min·g)和0.01 OD333/(min·g),即U/g FW。
1.3 数据统计与分析
采用SPSS 25.0软件对数据进行方差分析,显著性水平为P <0.05。试验设3次生物学重复,数据以平均值±标准差表示。
2 结果与分析
2.1 不同品种发芽糙米GABA合成代谢
由图2-a可知,供试12个品种的发芽糙米中有10种GABA含量差异显著,且品种间对萌发刺激的响应程度不同。其中,经发芽的万象优197、泰丰优197、广和优197、甬优1538、浙两优798和广泰优197糙米中GABA含量较未发芽显著增加16.69%~503.79%(P<0.05),其中甬优1538和泰丰优197的提升幅度更大。然而,万象优111、莲粳9号、Rondo和莲玉香2号4个品种发芽糙米中GABA含量显著下降22.31%~77.11%(P<0.05),其中Rondo下降幅度最大,而粤秀优197和广泰优197无显著变化(P>0.05)。
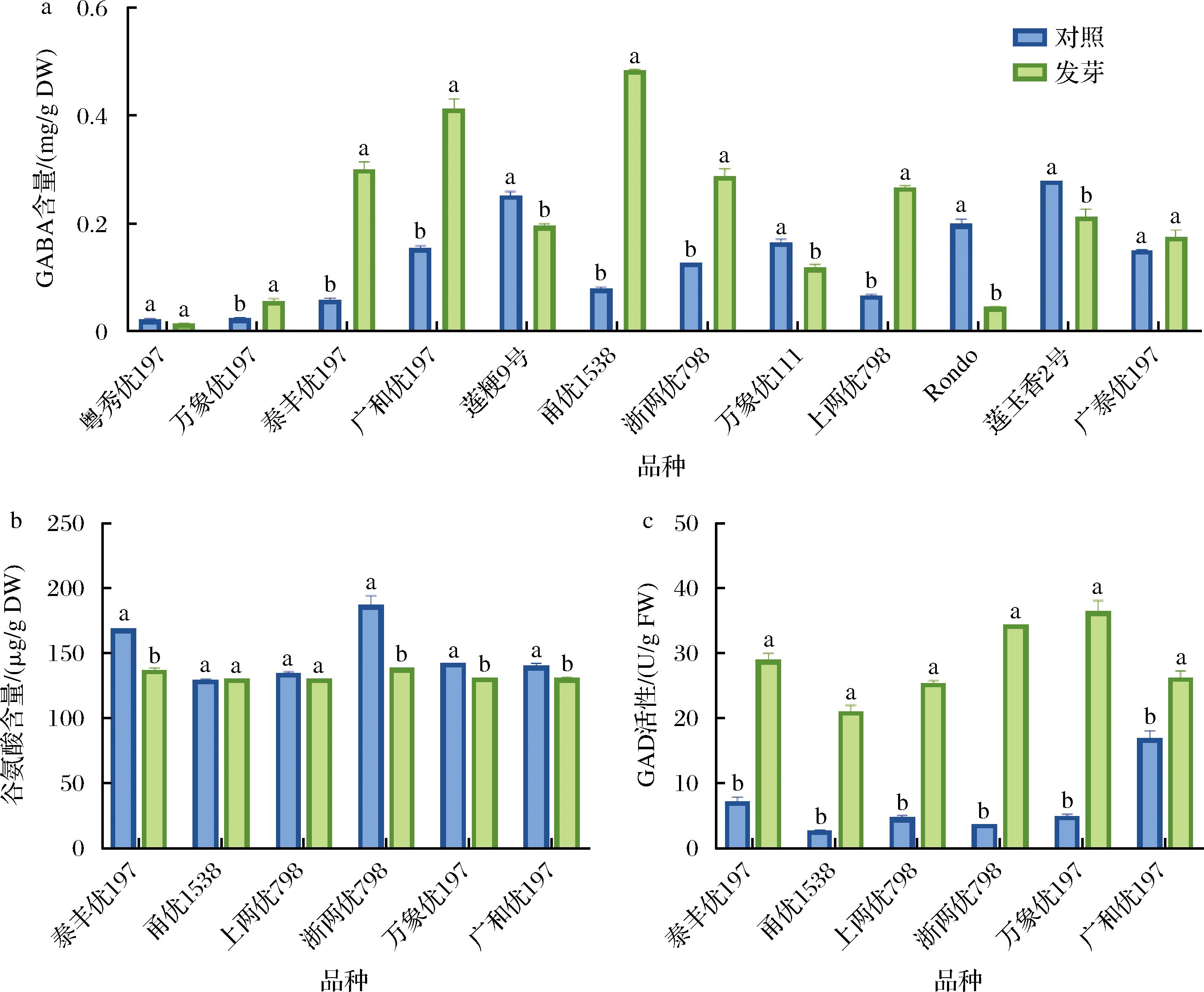
a-GABA含量;b-谷氨酸含量;c-GAD活性
图2 不同品种发芽糙米的GABA含量、谷氨酸含量和GAD活性
Fig.2 GABA content, glutamic acid content and GAD activity of germinated brown rice in different varieties
注:以未发芽为对照,不同小写字母表示同一品种对照和发芽处理间差异显著(P<0.05)(下同)。
本研究对发芽后GABA显著累积的6种糙米中谷氨酸含量和GAD活性进行研究,结果发现泰丰优197、浙两优798、万象优197和广和优197等4个品种糙米经发芽后谷氨酸含量显著降低7%~26%(P<0.05),其中浙两优798下降幅度最大,甬优和上两优798中谷氨酸含量在发芽前后无显著差异(P>0.05)(图2-b)。此外,6种糙米发芽后GAD活性较未发芽显著提高55.92%~898.04%(P<0.05)(图2-c),其中浙两优798和甬优1538的上升幅度最大。
2.2 发芽对不同糙米中酚类物质合成的影响
糙米发芽后酚类物质大量累积,但其对萌发刺激的响应程度不尽相同。由图3-a可知,供试12个品种的发芽糙米中,泰丰优197的游离酚含量较未发芽组显著增加22.33%,而万象优197、甬优1538和万象优111三个品种糙米的游离酚含量分别较未发芽组显著下降52.17%、33.97%和37.49%(P<0.05),除泰丰优197外其余8个品种糙米的游离酚含量在发芽前后无显著差异(P>0.05)。
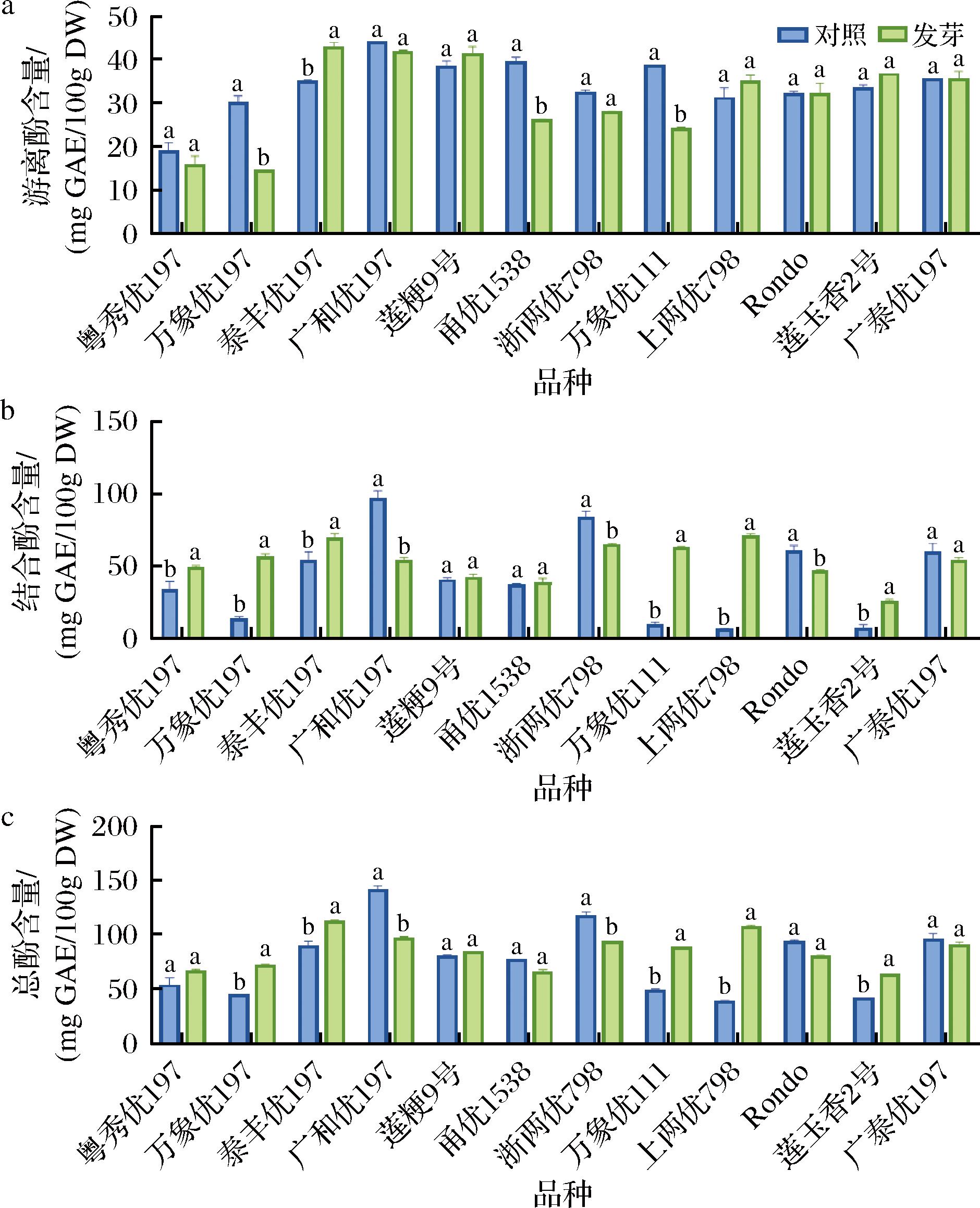
a-游离酚;b-结合酚;c-总酚
图3 不同品种发芽糙米的游离酚、结合酚和总酚含量
Fig.3 Contents of free phenol, bound phenol, and total phenol in different germinated brown rice varieties
供试12个品种中有6种发芽糙米的结合酚含量显著增加。其中,上两优798经发芽后其结合酚含量较未发芽组显著增加916.13%(P<0.05)。莲粳9号、甬优1538、广泰优197糙米在发芽前后其结合酚含量无显著差异(P>0.05)。然而,广和优197、浙两优798和Rondo糙米发芽后结合酚含量分别显著减少43.94%、22.81%和22.26%(P<0.05)(图3-b)。
由图3-c表明,发芽糙米中总酚含量显著增加,其中万象优197、泰丰优197、万象优111、上两优798和莲玉香2号5个品种糙米的总酚含量较对照显著增加25.97%~178.53%(P<0.05),尤其上两优798增幅最大。莲粳9号、甬优1538和广泰优197的总酚含量在发芽前后并无显著差异(P>0.05)。然而,广和优197和浙两优798的总酚含量在发芽后分别较对照组显著减少31.84%和20.32%。
综上,本研究选取泰丰优197、莲玉香2号、上两优798、万象优111和万象优197五个品种糙米,进一步探究萌发刺激对5种糙米中酚酸合成代谢的调控作用。
2.3 发芽糙米品种酚酸含量
本研究共鉴定了供试发芽糙米中没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、丁香酸、对香豆酸、阿魏酸和芥子酸9种酚酸。其中,对香豆酸和丁香酸是糙米中主要的酚酸组分,对香豆酸大多以结合态形式存在,而丁香酸大多以游离态形式存在。此外,没食子酸和原儿茶酸主要以游离态形式存在,咖啡酸则以结合态存在于糙米中。结果发现,供试品种中上两优798的总酚酸含量最高。
糙米发芽后,内源酚酸组分和含量变化各不相同,总体呈游离酚酸含量减少,结合酚酸含量增加的趋势。5个品种糙米中,结合态咖啡酸、丁香酸和对香豆酸占比高,且对萌发刺激的敏感度高,在体内大量累积。其中,发芽后的莲玉香2号中丁香酸由游离态向结合态转变,而其对羟基苯甲酸含量显著减少。经发芽后,上两优798中游离态和结合态丁香酸均大量合成,而万象优197的游离态丁香酸含量显著降低(P<0.05)。此外,万象优111在发芽后,内源丁香酸由结合态向游离态发生转化。具体见表1~表3。
表1 游离酚酸含量 单位:mg/g DW Table 1 Content of free phenolic acids

品种处理没食子酸原儿茶酸对羟基苯甲酸香草酸咖啡酸丁香酸对香豆酸阿魏酸芥子酸泰丰优197对照8.03±0.11a8.34±0.32aND1.57±0.01aNDND0.89±0.07a3.95±0.09a1.47±0.10a发芽3.99±0.13b9.26±0.88aND1.51±0.01aNDND1.31±0.02a3.04±0.20b0.95±0.06b
续表1
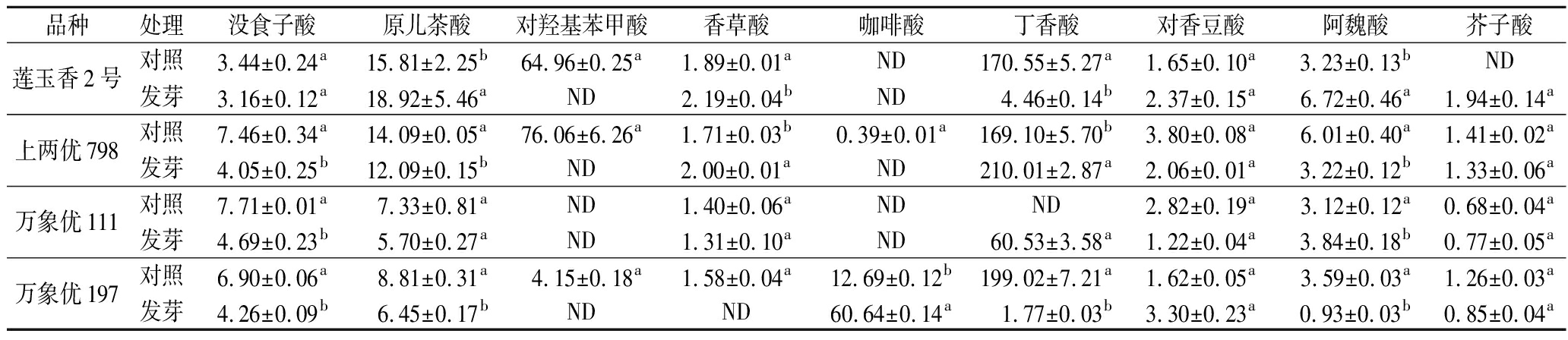
品种处理没食子酸原儿茶酸对羟基苯甲酸香草酸咖啡酸丁香酸对香豆酸阿魏酸芥子酸莲玉香2号对照3.44±0.24a15.81±2.25b64.96±0.25a1.89±0.01aND170.55±5.27a1.65±0.10a3.23±0.13bND发芽3.16±0.12a18.92±5.46aND2.19±0.04bND 4.46±0.14b2.37±0.15a6.72±0.46a1.94±0.14a上两优798对照7.46±0.34a14.09±0.05a76.06±6.26a1.71±0.03b0.39±0.01a169.10±5.70b3.80±0.08a6.01±0.40a1.41±0.02a发芽4.05±0.25b12.09±0.15bND2.00±0.01aND210.01±2.87a2.06±0.01a3.22±0.12b1.33±0.06a万象优111对照7.71±0.01a7.33±0.81aND1.40±0.06aNDND2.82±0.19a3.12±0.12a0.68±0.04a发芽4.69±0.23b5.70±0.27aND1.31±0.10aND60.53±3.58a1.22±0.04a3.84±0.18b0.77±0.05a万象优197对照6.90±0.06a8.81±0.31a4.15±0.18a1.58±0.04a12.69±0.12b199.02±7.21a1.62±0.05a3.59±0.03a1.26±0.03a发芽4.26±0.09b6.45±0.17bNDND60.64±0.14a 1.77±0.03b3.30±0.23a0.93±0.03b0.85±0.04a
注:以未发芽为对照,ND表示未检出。不同字母表示对照和发芽处理间差异显著(P<0.05)(下同)。
表2 结合酚酸含量 单位:mg/g DW Table 2 Content of combined phenolic acids
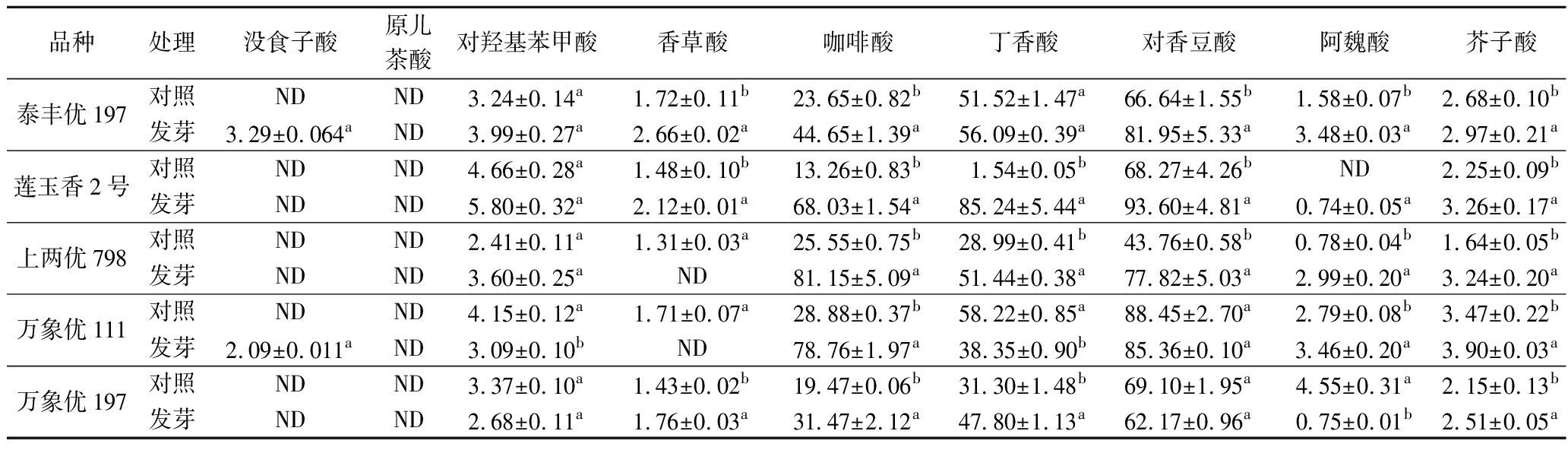
品种处理没食子酸原儿茶酸对羟基苯甲酸香草酸咖啡酸丁香酸对香豆酸阿魏酸芥子酸泰丰优197对照NDND3.24±0.14a1.72±0.11b23.65±0.82b51.52±1.47a66.64±1.55b1.58±0.07b2.68±0.10b发芽3.29±0.064aND3.99±0.27a2.66±0.02a44.65±1.39a56.09±0.39a81.95±5.33a3.48±0.03a2.97±0.21a莲玉香2号对照NDND4.66±0.28a1.48±0.10b13.26±0.83b1.54±0.05b68.27±4.26bND2.25±0.09b发芽NDND5.80±0.32a2.12±0.01a68.03±1.54a85.24±5.44a93.60±4.81a0.74±0.05a3.26±0.17a上两优798对照NDND2.41±0.11a1.31±0.03a25.55±0.75b28.99±0.41b43.76±0.58b0.78±0.04b1.64±0.05b发芽NDND3.60±0.25aND81.15±5.09a51.44±0.38a77.82±5.03a2.99±0.20a3.24±0.20a万象优111对照NDND4.15±0.12a1.71±0.07a28.88±0.37b58.22±0.85a88.45±2.70a2.79±0.08b3.47±0.22b发芽2.09±0.011aND3.09±0.10bND78.76±1.97a38.35±0.90b85.36±0.10a3.46±0.20a3.90±0.03a万象优197对照NDND3.37±0.10a1.43±0.02b19.47±0.06b31.30±1.48b69.10±1.95a4.55±0.31a2.15±0.13b发芽NDND2.68±0.11a1.76±0.03a31.47±2.12a47.80±1.13a62.17±0.96a0.75±0.01b2.51±0.05a
表3 总酚酸含量 单位:mg/g DW Table 3 Content of total phenolic acids
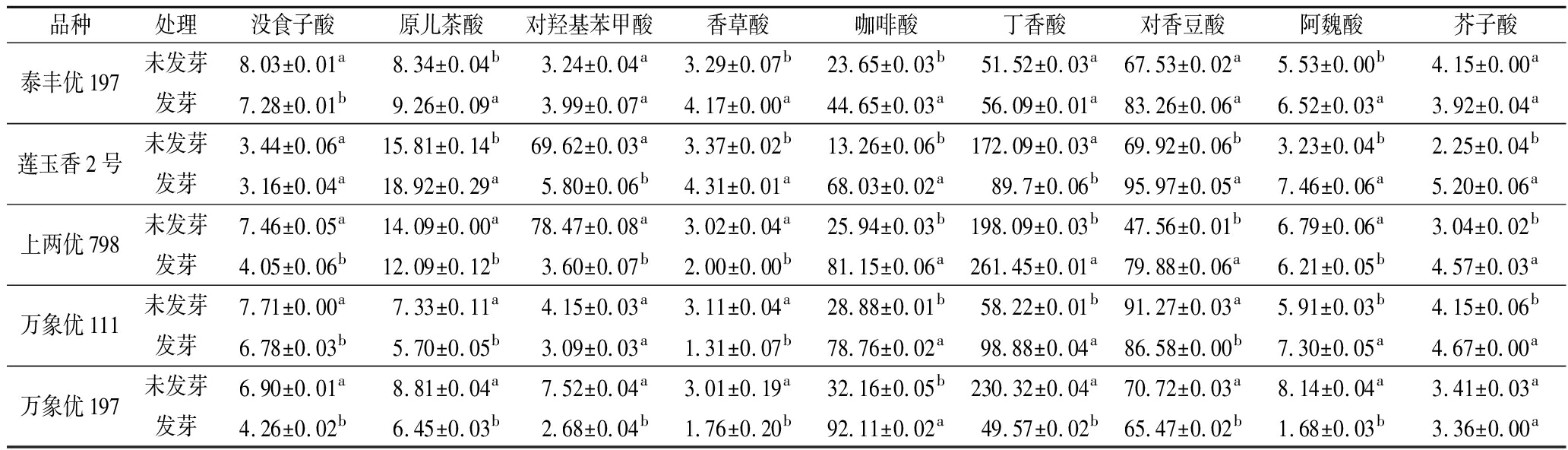
品种处理没食子酸原儿茶酸对羟基苯甲酸香草酸咖啡酸丁香酸对香豆酸阿魏酸芥子酸泰丰优197未发芽8.03±0.01a8.34±0.04b3.24±0.04a3.29±0.07b23.65±0.03b51.52±0.03a67.53±0.02a5.53±0.00b4.15±0.00a发芽7.28±0.01b9.26±0.09a3.99±0.07a4.17±0.00a44.65±0.03a56.09±0.01a83.26±0.06a6.52±0.03a3.92±0.04a莲玉香2号未发芽3.44±0.06a15.81±0.14b69.62±0.03a3.37±0.02b13.26±0.06b172.09±0.03a69.92±0.06b3.23±0.04b2.25±0.04b发芽3.16±0.04a18.92±0.29a5.80±0.06b4.31±0.01a68.03±0.02a89.7±0.06b95.97±0.05a7.46±0.06a5.20±0.06a上两优798未发芽7.46±0.05a14.09±0.00a78.47±0.08a3.02±0.04a25.94±0.03b198.09±0.03b47.56±0.01b6.79±0.06a3.04±0.02b发芽4.05±0.06b12.09±0.12b3.60±0.07b2.00±0.00b81.15±0.06a261.45±0.01a79.88±0.06a6.21±0.05b4.57±0.03a万象优111未发芽7.71±0.00a7.33±0.11a4.15±0.03a3.11±0.04a28.88±0.01b58.22±0.01b91.27±0.03a5.91±0.03b4.15±0.06b发芽6.78±0.03b5.70±0.05b3.09±0.03a1.31±0.07b78.76±0.02a98.88±0.04a86.58±0.00b7.30±0.05a4.67±0.00a万象优197未发芽6.90±0.01a8.81±0.04a7.52±0.04a3.01±0.19a32.16±0.05b230.32±0.04a70.72±0.03a8.14±0.04a3.41±0.03a发芽4.26±0.02b6.45±0.03b2.68±0.04b1.76±0.20b92.11±0.02a49.57±0.02b65.47±0.02b1.68±0.03b3.36±0.00a
2.4 发芽对糙米中酚类物质合成关键酶活力的调控
发芽糙米中酚类物质大量累积,与苯丙烷代谢通路中关键调控酶的活力有关。本研究对酚类物质合成途径中3个关键起始酶PAL、C4H和4CL的活力进行分析,发现3种酶中C4H活力变化最为显著,均较未发芽组显著提高(P<0.05)(图4-b),而5个品种糙米中PAL和4CL活力变化存在差异。其中,万象优197的PAL活力较未发芽组显著增加497.73%(图4-a)。而万象优111经发芽后PAL活力虽较未发芽组显著下降43.83%(P<0.05),而其4CL活力显著提高(P<0.05)(图4-b、图4-c)。
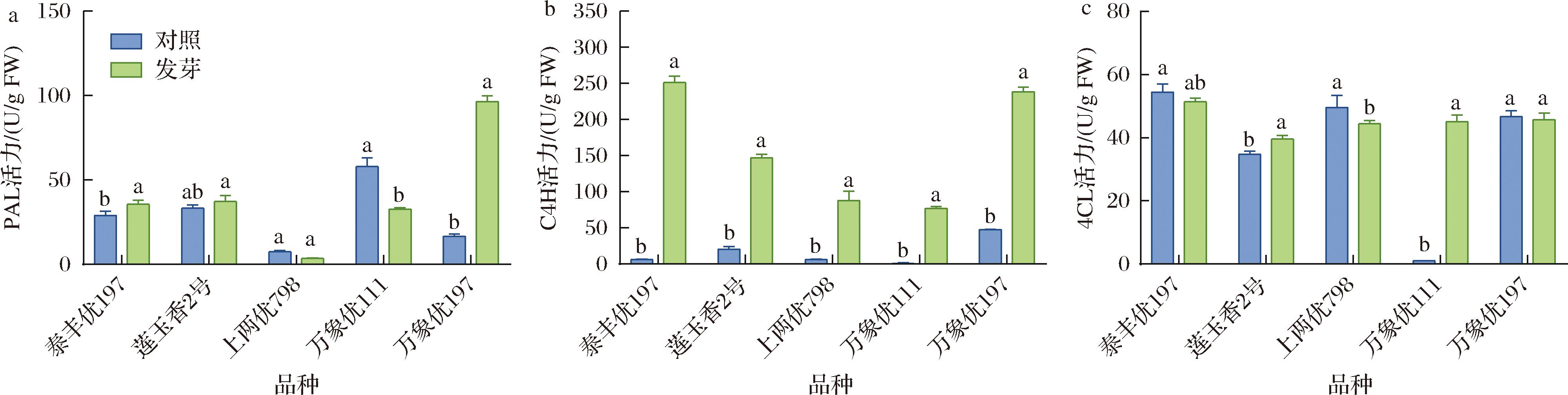
a-PAL活力;b-C4H活力;c-4CL活力
图4 不同品种发芽糙米的PAL活力、C4H活力和4CL活力
Fig.4 PAL activity, C4H activity and 4CL activity of germinated brown rice of different varieties
3 讨论
不同品种糙米发芽后,GABA和酚类物质含量变化有差异(图2-a和图3-c)。万象优197、泰丰优197、万象优111、上两优798和莲玉香2号5个品种糙米的总酚含量较对照显著增加,以万象优111和上两优798两个品种上升最为显著。万象优197、泰丰优197、广和优197、甬优1538、浙两优798和广泰优197糙米中GABA含量较未发芽显著增加,其中甬优1538和泰丰优的提升幅度较大。发芽后的万象优111中酚类物质大量累积,而GABA含量显著下降。
广和优197和浙两优798糙米经发芽后,GABA含量显著增加,而结合酚含量显著下降。研究表明,萌发刺激有助于提高糙米中多种内源酶活性,从而促进酚酸、黄酮、GABA等生物活性成分的合成。TIAN等[19]发现发芽糙米中游离酚类,如阿魏酸、香豆酸和芥子酸均明显高于未发芽糙米,并且不溶性酚类含量亦显著增加,BANCHUEN等[20]也得到类似结论。同样地,糙米(Keunun和Samkwang)发芽24 h后,内源GABA含量增加了3~50倍[21]。KATO等[22]则发现仅催芽5 h的糙米中GABA水平显著提高,其营养价值远大于普通精白米。然而,部分发芽糙米中未见酚类化合物和GABA同时富集的现象,主要与糙米的品种基因型密切相关[23]。相同萌发时间下不同品种糙米中内源酶激活效率不一,初级代谢产物的组成和含量存在差异,导致部分发芽糙米中功能成分累积量不同[24]。其次,糙米在发芽过程中存在游离酚和结合酚之间的动态转换[25]。另外,GABA作为植物信号分子,参与介导了NO、Ca2+等下游信号分子对酚类物质合成代谢的调控,因而二者合成过程中可能存在时间差[4]。因此,萌发刺激有助于糙米中GABA、酚类物质的累积,但其含量因品种基因型的不同而存在差异。值得注意的是,并非全部品种的糙米经发芽后总酚大幅增加,广和优197的总酚含量显著下降(图3-c)。研究表明,酚类物质极容易在多酚氧化酶的作用下发生褐变,在种子萌发阶段,液泡膜可能遭到破坏,从而导致液泡内的氧化酶与酚类作用发生不可逆的反应,导致出现总酚含量下降的结果[26]。同样,部分品种的GABA含量在发芽后也呈下降趋势,其中Rondo的GABA含量下降尤其明显,达到77.11%(图2)。TIANSAWANG等[27]研究发现,大豆经36 h萌发处理后GABA含量低于未发芽籽粒且含量随发芽时间继续下降;WANG等[28]试验表明,黑豆的GABA含量随发芽时间呈先增加后减少再增加的趋势。这可能是由于萌发时合成的GABA也会在GABA转氨酶的作用下分解代谢为琥珀酸半醛,并经脱氢合成琥珀酸进入三羧酸循环[29]。因此,GABA含量下降可能是这些糙米品种中,其分解速率大于合成速率,最终导致GABA含量下降。
糙米经催芽36 h后,其酚酸的组成、含量和存在形式均发生改变,以结合态酚酸居多(表1和表2)。对香豆酸和丁香酸是糙米中主要的酚酸类型,分别占糙米总酚酸的12.37%~43.31%和21.80%~62.08%,且对香豆酸多以结合态形式存在,丁香酸多以游离态形式存在。由于酚酸是一类含有活性酚羟基的化合物,因而具有高抗氧化和抗炎活性,在植物生长发育、抵御环境应激和病虫害等方面发挥关键作用[13]。不同酚酸的结构和功能作用不同,植物品种、发育阶段、环境胁迫等诸多因素均影响植物细胞中酚酸的组成和含量[26]。研究发现,丁香酸是构成茶树等植物中香气的主要成分之一,通过影响茶树体内丁香酸的合成代谢途径和催化丁香酸的糖基化,可有效提高茶树的香气[30]。对香豆酸因具有高抗氧化活性,在植物内可发挥抗病菌和抵御病虫害的作用[31]。SARKER等[32]还发现,盐胁迫下VA14和VA3两个品种拟南芥中对香豆酸等酚酸化合物含量大量累积,有助于植株抗逆性的提高。此外,纳塔尔李子中花青素3-O-吡喃糖苷、花青素3-O-糖苷和槲皮素3-O-鼠李糖基糖苷等花青素衍生物则被用于提高果实的耐冷性[25]。部分糙米经发芽后,其游离态酚酸含量显著下降,而结合态酚酸含量显著增加(表1和表2)。这是由于酚酸在植物机体内被用于细胞骨架的构建,发挥交联植物细胞壁多糖的作用,对于增强植物细胞壁的结构稳定性及其生长发育,防止病原体入侵等方面具有重要意义[33]。在糙米发芽过程中,芽苗伸长,细胞快速生长分裂,因而酚酸以糖苷形式大量存在于植物细胞壁中,并且部分酚酸由游离态向结合态转变[29]。BENTO-SILVA等[34]研究发现,在玉米中阿魏酸是含量最高的酚酸,常与玉米细胞壁中的阿拉伯木聚糖相连,并促进其他细胞壁成分间的交联,增强细胞壁结构,对玉米的生长具有重要作用。ESUA等[35]则发现番茄果实贮在藏期间经UV-C(2.15 kJ/m2)辐照后累积的酚类物质,有利于果实细胞壁结构和防御能力的增强。因此,萌发刺激影响了不同品种糙米中酚酸的组成及其含量,对植物细胞生长和营养价值提升等方面具有重要作用。
发芽糙米中功能物质的累积与其合成关键酶活力密切相关。如图2-c和图4所示,苯丙烷代谢通路中PAL、C4H和4CL三个关键起始酶在糙米发芽后均有不同程度的提高,并且GABA支路中GAD活力亦显著提高,并伴随L-谷氨酸含量的下降。在苯丙烷代谢通路中,PAL是连接植物初级代谢和该通路的关键桥梁,在细胞分化、木质化、酚类化合物合成等过程中都有重要作用[36]。C4H作为该通路中的第二步反应酶,参与细胞膜上的电子传递反应,影响该通路中多条下游代谢支路[7]。4CL则可催化4-香豆酸转化为4-香豆酰-CoA,同时形成阿魏酸以及其他羟基琥珀酸盐的CoA酯[37]。糙米在发芽过程中,上调了PAL、C4H和4CL等基因的表达水平,使得相应酶活力显著增强,从而加速酚类物质的合成[38]。CHO等[39]发现,糙米中PAL活性和可溶性酚酸含量在发芽第1天时达到峰值,此后开始下降。大麦发芽后也有类似结论,即发芽6 d期间,大麦苗中PAL、C4H和4CL的基因表达水平和活力基本呈先增高后降低的趋势,且在第4天达到峰值,其酚类物质累积量在发芽期间持续增加[12],说明萌发刺激可有效提高PAL等合成关键酶活力,促使酚类化合物大量合成。此外,GABA亦可通过调控编码类黄酮代谢的相关基因(PAL、C4H、4CL、CHS、CHI等),激活关键酶活力(PAL、C4H和4CL),从而提高酚类物质的生物合成量[1]。发芽糙米中GABA的合成和累积也与GAD活力的提高有着密切关系。研究表明,糙米在浸泡和发芽过程中主要通过谷氨酸经GAD脱羧来积累GABA[40]。当在培养基中添加PLP(1.48 mg/100 g)和2.25%谷氨酸,米糠中GAD被激活,使GABA含量从10.7 mg/100 g增加到171.5 mg/100 g[41]。此外,通过基因组编辑技术对水稻GAD3进行基因修饰,发现改良的水稻中GABA含量是野生型糙米的7倍[42]。因此,萌发刺激通过影响特定合成途径中相应酶活力水平,实现了酚类化合物和GABA的合成和累积。
4 结论
糙米发芽后,万象优197、泰丰优197、广和优197、甬优1538、浙两优798和广泰优197 GABA含量较未发芽显著增加,与GAD活力的显著增加有关;糙米发芽后其中PAL、C4H和4CL等酶活力存在品种间差异,万象优197、泰丰优197、万象优111、上两优798和莲玉香2号5个品种中的总酚含量较对照显著增加,与PAL、C4H和4CL活力呈正相关。表明,萌发激活GAD、PAL、C4H和4CL等酶是促进GABA和酚类物质累积的关键。本研究结果可为糙米在我国的市场营销开拓思路,为开发国内富含GABA和酚类等生物活性成分的全谷物食品奠定基础,对促进国民健康饮食和社会发展进步有重要意义。
[1] REN T Y, ZHENG P C, ZHANG K X, et al.Effects of GABA on the polyphenol accumulation and antioxidant activities in tea plants (Camellia sinensis L.) under heat-stress conditions[J].Plant Physiology and Biochemistry:PPB, 2021, 159:363-371.
[2] YU C L, PAN S W, ZHANG J, et al.Ferulic acid exerts Nrf2-dependent protection against prenatal lead exposure-induced cognitive impairment in offspring mice[J].The Journal of Nutritional Biochemistry, 2021, 91:108603.
[3] VOGT T.Phenylpropanoid biosynthesis[J].Molecular Plant, 2010, 3(1):2-20.
[4] WANG M, ZHU Y H, WANG P, et al.Effect of γ-aminobutyric acid on phenolics metabolism in barley seedlings under low NaCl treatment[J].Antioxidants, 2021, 10(9):1421.
[5] JI J, SHI Z, XIE T T, et al.Responses of GABA shunt coupled with carbon and nitrogen metabolism in poplar under NaCl and CdCl2 stresses[J].Ecotoxicology and Environmental Safety, 2020, 193:110322.
[6] SHELP B J, BOWN A W, ZAREI A.γ-Aminobutyrate (GABA):A metabolite and signal with practical significance[J].Botany, 2017, 95(11):1015-1032.
[7] WANG M, DING Y X, WANG Q E, et al.NaCl treatment on physio-biochemical metabolism and phenolics accumulation in barley seedlings[J].Food Chemistry, 2020, 331:127282.
[8] PAKFETRAT S, AMIRI S, RADI M, et al.Reduction of phytic acid, aflatoxins and other mycotoxins in wheat during germination[J].Journal of the Science of Food and Agriculture, 2019, 99(10):4695-4701.
[9] EUM H L, PARK Y, YI T G, et al.Effect of germination environment on the biochemical compounds and anti-inflammatory properties of soybean cultivars[J].PLoS One, 2020, 15(4):e0232159.[10] JIAO C F, DUAN Y Q, LIN Q.MAPK mediates NO/cGMP-induced GABA accumulation in soybean sprouts[J].LWT, 2019, 100:253-262.
[11] MA Y, WANG P, CHEN Z J, et al.GABA enhances physio-biochemical metabolism and antioxidant capacity of germinated hulless barley under NaCl stress[J].Journal of Plant Physiology, 2018, 231:192-201.
[12] MA Y, WANG P, CHEN Z J, et al.NaCl stress on physio-biochemical metabolism and antioxidant capacity in germinated hulless barley (Hordeum vulgare L.)[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1755-1764.
[13] TYAGI A, SHABBIR U, CHEN X Q, et al.Phytochemical profiling and cellular antioxidant efficacy of different rice varieties in colorectal adenocarcinoma cells exposed to oxidative stress[J].PLoS One, 2022, 17(6):e0269403.
[14] MOONGNGARM A, SAETUNG N.Comparison of chemical compositions and bioactive compounds of germinated rough rice and brown rice[J].Food Chemistry, 2010, 122(3):782-788.
[15] TSUSHIDA T, MURAI T.Conversion of glutamic acid to γ-aminobutyric acid in tea leaves under anaerobic conditions[J].Agricultural and Biological Chemistry, 1987, 51(11):2865-2871.
[16] LI H X, WANG L Q, NIE L J, et al.Sensitivity intensified ninhydrin-based chromogenic system by ethanol-ethyl acetate:Application to relative quantitation of GABA[J].Metabolites, 2023, 13(2):283.
[17] CHEN Z J, YU L L, WANG X K, et al.Changes of phenolic profiles and antioxidant activity in canaryseed (Phalaris canariensis L.) during germination[J].Food Chemistry, 2016, 194:608-618.
[18] HAN C, LI J, JIN P, et al.The effect of temperature on phenolic content in wounded carrots[J].Food Chemistry, 2017, 215:116-123.
[19] TIAN S, NAKAMURA K, KAYAHARA H.Analysis of phenolic compounds in white rice, brown rice, and germinated brown rice[J].Journal of Agricultural and Food Chemistry, 2004, 52(15):4808-4813.
[20] BANCHUEN J, THAMMARUTWASIK P, OORAIKUL B, et al.Increasing the bio-active compounds contents by optimizing the germination conditions of Southern Thai Brown Rice[J].Songklanakarin Journal of Science and Technology, 2010, 32(3):219.
[21] OH S K, LEE J H, WON Y J, et al.Changes of physicochemical properties according to the shoot length in germinated brown rice[J].Korean Journal of Crop Science, 2014, 59(3):223-229.
[22] KATO T, HORIBATA A.Distribution of γ-oryzanol in the outer layers of brown rice and its variation among cultivars[J].Plant Production Science, 2021, 24(2):256-265.
[23] MUNARKO H, SITANGGANG A B, KUSNANDAR F, et al.Germination of five Indonesian brown rice:Evaluation of antioxidant, bioactive compounds, fatty acids and pasting properties[J].Food Science and Technology, 2022, 42:e19721.
[24] HAN Z G, AHSAN M, ADIL M F, et al.Identification of the gene network modules highly associated with the synthesis of phenolics compounds in barley by transcriptome and metabolome analysis[J].Food Chemistry, 2020, 323:126862.
[25] MPHAPHULI T, SLABBERT R M, SIVAKUMAR D.Storage temperature and time changes of phenolic compounds and antioxidant properties of Natal plum (Carissa macrocarpa)[J].Food Bioscience, 2020, 38:100772.
[26] GAN R Y, LUI W Y, WU K, et al.Bioactive compounds and bioactivities of germinated edible seeds and sprouts:An updated review[J].Trends in Food Science &Technology, 2017, 59:1-14.
[27] TIANSAWANG K, LUANGPITUKSA P, VARANYANOND W, et al.GABA (γ-aminobutyric acid) production, antioxidant activity in some germinated dietary seeds and the effect of cooking on their GABA content[J].Food Science and Technology, 2016, 36(2):313-321.
[28] WANG Y, LI M, XU F F, et al.Variation in polyphenols, tocols, γ-aminobutyric acid, and antioxidant properties in whole grain rice (Oryza sativa L.) as affected by different germination time[J].Cereal Chemistry, 2016, 93(3):268-274.
[29] LI L, DOU N, ZHANG H, et al.The versatile GABA in plants[J].Plant Signaling &Behavior, 2021, 16(3):1862565.
[30] ZHAO M Y, CAI B B, JIN J Y, et al.Cold stress-induced glucosyltransferase CsUGT78A15 is involved in the formation of eugenol glucoside in Camellia sinensis[J].Horticultural Plant Journal, 2020, 6(6):439-449.
[31] SHANMUGAM M, SUBRAMANIAN S, RAMACHANDRAN S.Method development and validation for quantification of six bioactive compounds (andrographolide, columbin, piperine, gallic, paracoumaric and oleanolic acids) by HPTLC[J].Journal of Complementary &Integrative Medicine, 2022, 20(1):137-145.
[32] SARKER U, OBA S.The response of salinity stress-induced A.tricolor to growth, anatomy, physiology, non-enzymatic and enzymatic antioxidants[J].Frontiers in Plant Science, 2020, 11:559876.
[33] LIVINGSTON D, TUONG T, TISDALE R, et al.Visualising the effect of freezing on the vascular system of wheat in three dimensions by in-block imaging of dye-infiltrated plants[J].Journal of Microscopy, 2022, 286(3):252-262.
[34] BENTO-SILVA A, VAZ PATTO M C, DO ROS RIO BRONZE M.Relevance, structure and analysis of ferulic acid in maize cell walls[J].Food Chemistry, 2018, 246:360-378.
RIO BRONZE M.Relevance, structure and analysis of ferulic acid in maize cell walls[J].Food Chemistry, 2018, 246:360-378.
[35] ESUA O J, CHIN N L, YUSOF Y A, et al.Effects of simultaneous UV-C radiation and ultrasonic energy postharvest treatment on bioactive compounds and antioxidant activity of tomatoes during storage[J].Food Chemistry, 2019, 270:113-122.
[36] SURJADINATA B B, JACOBO-VEL ZQUEZ D A, CISNEROS-ZEVALLOS L.Physiological role of reactive oxygen species, ethylene, and jasmonic acid on UV light induced phenolic biosynthesis in wounded carrot tissue[J].Postharvest Biology and Technology, 2021, 172:111388.
ZQUEZ D A, CISNEROS-ZEVALLOS L.Physiological role of reactive oxygen species, ethylene, and jasmonic acid on UV light induced phenolic biosynthesis in wounded carrot tissue[J].Postharvest Biology and Technology, 2021, 172:111388.
[37] ZHANG H P, CHEN J J, PENG Z X, et al.Integrated transcriptomic and metabolomic analysis reveals a transcriptional regulation network for the biosynthesis of carotenoids and flavonoids in ‘Cara cara’ navel orange[J].BMC Plant Biology, 2021, 21(1):29.
[38] ZHANG G C, XU J X, WANG Y Q, et al.Combined transcriptome and metabolome analyses reveal the mechanisms of ultrasonication improvement of brown rice germination[J].Ultrasonics Sonochemistry, 2022, 91:106239.
[39] CHO D H, LIM S T.Changes in phenolic acid composition and associated enzyme activity in shoot and kernel fractions of brown rice during germination[J].Food Chemistry, 2018, 256:163-170.
[40] ZARGARCHI S, SAREMNEZHAD S.Gamma-aminobutyric acid, phenolics and antioxidant capacity of germinated indica paddy rice as affected by low-pressure plasma treatment[J].LWT, 2019, 102:291-294.
[41] OH S J, KIM H S, LIM S T, et al.Enhanced accumulation of gamma-aminobutyric acid in rice bran using anaerobic incubation with various additives[J].Food Chemistry, 2019, 271:187-192.
[42] AKAMA K, AKTER N, ENDO H, et al.An in vivo targeted deletion of the calmodulin-binding domain from rice glutamate decarboxylase 3 (OsGAD3) increases γ-aminobutyric acid content in grains[J].Rice, 2020, 13(1):20.