牡蛎是世界上养殖规模最大的海洋贝类,根据《中国渔业统计年鉴》[1],2021年中国牡蛎养殖产量达581.91×104 t,约占世界牡蛎养殖产量的86%[2-3]。牡蛎营养丰富、味道鲜美,深受全球消费者的青睐[4-5]。但是牡蛎的高水分含量和丰富的营养成分导致其在生产、运输、销售过程中极易因微生物、温度等外部环境的影响而变质,从而失去食用价值。因此,在中国和亚洲其他国家,人们通过干制加工来延长牡蛎的保质期。干制加工不但可以延长保质期,减少运输成本和因销售不合时宜造成的损失,还生产出具有特殊风味的牡蛎干制产品。在中国市场,牡蛎干以其独特的口感和风味普遍受到消费者的认可,是广东人逢年过节餐桌上不可或缺的菜肴。
传统的牡蛎干制工艺主要以自然晒干(solar drying,SD)为主,但该方法存在产品质量低、干制效率慢、条件不受控制等缺点,近年来为了提高干制效率和产品质量,研发出热风干制(hot air drying,HAD)、真空冷冻干制(vacuum freeze drying,VFD)、真空干制(vacuum drying,VD)[6-8]等工艺方法。但不同干制工艺因干制条件(温度、O2、干制时间)的不同,对脂肪氧化、蛋白质降解、氨基酸代谢等生理生化反应有不同程度的影响,从而产生不同的气味物质[6-7, 9-10]。香气在决定干制产品的质量和消费者接受度方面起着重要作用[11]。
脂质作为挥发性物质的重要前体物,其在干制过程中的氧化降解是水产干制品特征香气形成的主要途径,不饱和脂肪酸是发生热降解的主要脂肪酸[11-12],在干制过程中从脂质中释放出来的不饱和脂肪酸进一步氧化成醛、酮、醇等挥发性物质,该类物质通常阈值较低,对产品的气味品质有显著影响[13]。ZHENG等[11]研究发现,磷脂能促进虾干中吡嗪类、醛类等芳香族化合物的形成。WANG等[14]在金鲳鱼中鉴定出95种挥发性化合物,其中54.74%的化合物与脂质氧化相关,特征香气成分戊醛、己醛、1-辛烯-3-醇等与油酸、亚油酸、棕榈酸、硬脂酸的水平呈正相关。KE等[15]研究发现,干腌鱼的特征挥发性风味物质1-辛烯-3-醇、正己醛、庚醛、辛醛、2,4-癸二烯醛、1-辛烯-3-酮等主要由脂肪酸氧化产生。综上所述,脂质在干制过程中的氧化降解对水产干制品特征气味的形成有重要作用。
基于此,本文以香港牡蛎(Crassostrea hongkongensis)为对象,研究 SD、VFD、VD、HAD四种干制工艺对牡蛎干气味和脂肪酸组成的影响,并结合多元化分析明确脂肪酸与特征气味变化的相互关系,为牡蛎干制产品的标准化生产提供技术支撑和水产干制品的风味调控提供理论依据。
1 材料与方法
1.1 仪器与试剂
VOS-210C型真空干燥器,上海爱朗仪器有限公司;LGJ-12型真空冷冻干燥机,北京松源华兴科技发展有限公司;GZX-9140MBE型电热鼓风干燥箱,上海博迅医疗生物仪器有限公司;PEN3型电子鼻,德国AIRSENSE公司;Inert Cap®Pure-WAX石英毛细柱(30 m×0.25 mm,0.25 μm)、TQ8050 NX型气相色谱-质谱联用仪,日本岛津公司。
37种脂肪酸混合标准品,美国Sigma公司;三氯甲烷、NaCl、NaOH、Na2SO4(均为分析纯)、甲醇(色谱纯)、正己烷(色谱纯),国药集团化学试剂有限公司;十九烷酸标准品,上海源叶生物科技有限公司;体积分数为14%BF3-CH3OH溶液,美国Supelco公司。
1.2 样品处理
牡蛎购自湛江霞山海鲜批发市场,将新鲜牡蛎储存在装有冰块的泡沫盒中,并在1 h内运往实验室。去壳(用蚝刀撬开上壳,切断闭壳肌,取出牡蛎肉),选择大小均匀、质量为(25±2) g的牡蛎肉,清洁,在5%NaCl溶液(1∶5,g∶mL)中漂烫1 min(水分含量=76%±0.5%),漂烫的牡蛎经下述4种工艺进行干制,直至水分含量为(20±2)%。HAD:样品平铺于(70±2) ℃的鼓风干燥箱中,风速为1 m/s,干制660 min。VD:样品平铺于(70±2) ℃的真空干燥箱中,真空度为0.08 MPa,干制720 min。VFD:样品在-80 ℃预冷冻6 h后,置于真空冷冻干燥室,冷阱温度-50 ℃,真空度10 Pa,干制960 min。SD:样品平铺于竹编中,置于阳光下,温度(33±3) ℃,晒制28 h。
1.3 实验方法
1.3.1 电子鼻分析
参考周莹等[16]的方法并稍作修改,称取2.00 g样品于20 mL顶空进样瓶中,立即用顶空瓶盖密封,于室温下平衡30 min后,使用电子鼻对样品进行检测。测定条件为:进样流速300 mL/min,传感器自清洗时间120 s,采集时间120 s,选取信号稳定的55~59 s为信号采集时间,每组样品做3次平行重复测定。
1.3.2 脂肪酸分析
称取5 g干样或10 g鲜样,加入100 mL V(氯仿)∶V(甲醇)=2∶1的溶液,于4 ℃冰箱中避光静置提取24 h,过滤,向滤液中加30 mL MgCl2溶液(0.03 mol/L),混匀后静置4 h,收集下层氯仿层于30 ℃旋转蒸发仪中浓缩,待溶剂完全蒸发后,加入5 mL NaOH-甲醇溶液(0.5 mol/L),再加入100 μL 10 mg/mL十九烷酸作为内标,于100 ℃油浴中冷凝回流10 min,加入3 mL 14%BF3-CH3OH溶液反应3 min,再加入2 mL正己烷溶液,回流萃取2 min,冷却至室温后,加入10 mL饱和NaCl溶液,混匀后静置,待分层后,收集上层并加入少量的无水硫酸钠脱去残余水分,用0.22 μm有机相滤膜过滤后进行GC-MS分析。
GC-MS条件:GC条件:色谱柱Pure-WAX石英毛细柱(30 m×0.25 mm,0.25 μm),载气流速1.0 mL/min,分流比50∶1,进样口温度250 ℃,进样量1 μL。升温程序:起始柱温80 ℃,保持3 min,以10 ℃/min的速率升至160 ℃,保持5 min,然后以5 ℃/min的速率升至250 ℃,保持5 min。MS条件:EI离子源,电子能量70 eV,接口温度250 ℃,离子源温度230 ℃,m/z扫描范围33~550。
1.3.3 GC-IMS分析
称取2 g(干基计)样品于20 mL顶空瓶中,60 ℃、500 r/min孵育10 min,通过1 mL气密加热注射器将500 μL顶空样品以不分流模式注入自动进样器中,进样温度80 ℃。色谱柱:MTX-5(15 m×0.53 mm,美国RESTEK公司),柱温60 ℃,载气/漂移气为N2(纯度≥ 99.999%)。载气流速程序:0~2 min为2 mL/min,2~25 min线性增加至100 mL/min,并保持至30 min。IMS在温度45 ℃和流速150 mL/min条件下运行。在相同条件下以C4-C9正酮类化合物为外标,计算各挥发性化合物的保留指数(retention index,RI),将RI和漂移时间与IMS数据库的信息进行对比,结合参考文献对挥发性化合物定性。
1.4 数据分析
使用SPSS 26软件进行显著性分析(P<0.05),使用Excel 2019软件计算平均值和标准偏差,数值以平均值±标准差形式表示,SIMCA 14.1用于偏最小二乘法判别分析(partial least squares-discriminant analysis,PLS-DA),Origin 2021用于绘图。
2 结果与分析
2.1 脂肪酸分析
由表1可知,牡蛎中不饱和脂肪酸含量显著高于饱和脂肪酸含量(P<0.05),其中,棕榈酸(C16∶0)、油酸(C18∶1)、DHA(C22∶6)分别是含量最高的饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸,该结果与WANG等[5]在太平洋牡蛎中的研究结果一致。牡蛎经干制加工后脂肪酸含量显著减少(P<0.05),VFD、VD、SD、HAD组总脂肪酸含量较CK组分别减少19.45%、49.27%、27.69%、46.63%,其中饱和脂肪酸减少21.39%~45.17%,不饱和脂肪酸减少20.66%~52.21%。脂肪酸作为气味物质的重要前体物,在干制加工过程中被氧化降解成醛、酮、醇等小分子挥发性物质[14,17],LI等[18]研究发现,己醛、癸醛、苯甲醛、(Z)-2-庚烯醛、(E)-2-辛烯醛、2-戊基呋喃、(E,E)-2,4-癸二烯醛等挥发性化合物是C18∶1、C18∶2、C18∶3的降解产物。此外,干制工艺对牡蛎干的脂肪酸组成有显著影响,VFD组脂肪酸含量显著高于高温干制组(HAD、VD),表明高温促进了脂质的氧化降解,该结果与FU等[19]的研究结果一致。
表1 不同干制工艺下牡蛎干的脂肪酸组成分析 单位:mg/100 g,干基计
Table 1 Fatty acid composition of dried oysters under different drying technologies

脂肪酸CKVFDVDSDHADC12∶02.30±0.13aND1.50±0.01c2.00±0.02b1.50±0.05cC13∶02.60±0.16a0.40±0.07d1.40±0.12c1.90±0.05b1.70±0.06bC14∶00.50±0.05c32.10±0.16a0.60±0.19c0.80±0.06bc0.90±0.03bC14∶13.20±0.83a0.80±0.28c1.60±0.47b2.80±0.46a0.90±0.43bcC15∶085.80±5.25a73.30±2.64b51.20±4.20c76.00±2.77b57.00±3.06cC16∶01 366.60±65.01a1 155.70±31.56b748.20±16.14d979.00±31.65c687.90±20.54eC16∶1446.20±19.39a250.30±15.83b92.80±8.85d238.00±3.08b162.30±2.01cC17∶133.60±1.95a8.00±0.68b5.50±0.25c29.70±1.27a7.80±0.64bC18∶0506.60±34.74a445.60±19.87b313.00±14.70cd286.60±17.27d325.50±18.86cC18∶11 078.00±60.82a976.70±10.05a524.80±15.48d885.50±31.24b680.30±16.97cC18∶3255.50±6.38a235.00±4.59b79.70±4.68d210.60±1.14c27.40±1.15eC18∶4274.40±9.44a156.60±21.73b86.20±1.34d168.70±1.87b114.40±5.84cC20∶0171.20±6.98a14.40±4.48d123.00±4.06c189.40±6.41a146.30±3.14bC20∶1605.60±15.18a556.80±7.25b459.40±12.00c414.50±28.27d429.30±1.20dC20∶367.20±4.51a44.41±12.92c22.80±0.74d56.22±3.01b40.62±3.18cC20∶4n-69.70±2.90a5.73±0.98b2.80±0.42dND4.10±0.16cC20∶4n-31.20±0.13b53.13±19.72aNDND1.30±0.13bC20∶5(EPA)238.52±3.86a175.90±0.18d88.21±6.33c103.20±10.40b95.30±2.56cC22∶0132.20±3.00a60.80±3.99b25.61±3.16cd31.70±5.87c22.50±3.32dC22∶274.91±7.95a45.80±1.47b42.30±9.23b78.20±6.86a77.70±1.99aC22∶6(DHA)769.60±28.58a642.30±6.49b437.00±19.22d574.20±17.96c402.70±13.28d单不饱和脂肪酸2 166.60±98.17a1 792.60±34.09b1 084.10±37.05e1 570.50±64.32c1 280.60±21.25d多不饱和脂肪酸1 691.03±63.75a1 358.87±68.08c759.01±41.96d1 291.12±41.18b763.52±28.29d饱和脂肪酸2 267.80±115.32a1 782.30±62.77b1 264.51±42.58d1 567.40±64.10c1 243.30±49.06d总脂肪酸6 125.43±277.24a4 933.77±164.94b3 107.62±121.59c4 429.02±169.60b3 287.42±98.60c
注:ND表示未检出;同行数据不同小写字母表示样品间具有显著性差异(P<0.05)。
2.2 电子鼻分析
如图1-a所示,不同干制工艺下牡蛎干的雷达指纹轮廓相似,所有样品在W5S传感器的响应值最高,其次是W1W传感器,其余传感器的检测值较小,表明焯水牡蛎和牡蛎干的特征气味物质主要为氮氧化合物和含硫化合物,该结果与前人研究结果一致[5, 20]。据报道太平洋牡蛎中醛类物质含量很高,且该类物质阈值较低,因此对牡蛎的气味特征影响较大。此外,不同样品的电子鼻响应值存在显著差异(P<0.05),干制组(HAD、VD、SD、VFD)的信号值显著高于CK组,其中HAD组与CK组差异最大,VFD组与CK组差异最小。信号值的高低与样品中挥发性物质的浓度相关,牡蛎中不饱和脂肪酸含量丰富[5,21],在干制过程中脂肪酸被氧化降解成醛、酮、醇、酸等化合物,但不同干制工艺因干制条件不同,对脂质的氧化降解有不同程度的影响,导致不同干制工艺下牡蛎干的挥发性物质存在差异[6]。ZHU等[22]研究了不同干制方式对河豚鱼片风味的影响,结果表明HAD比其他干制方式产生更多的挥发性物质,提升了鱼片产品的香气属性。
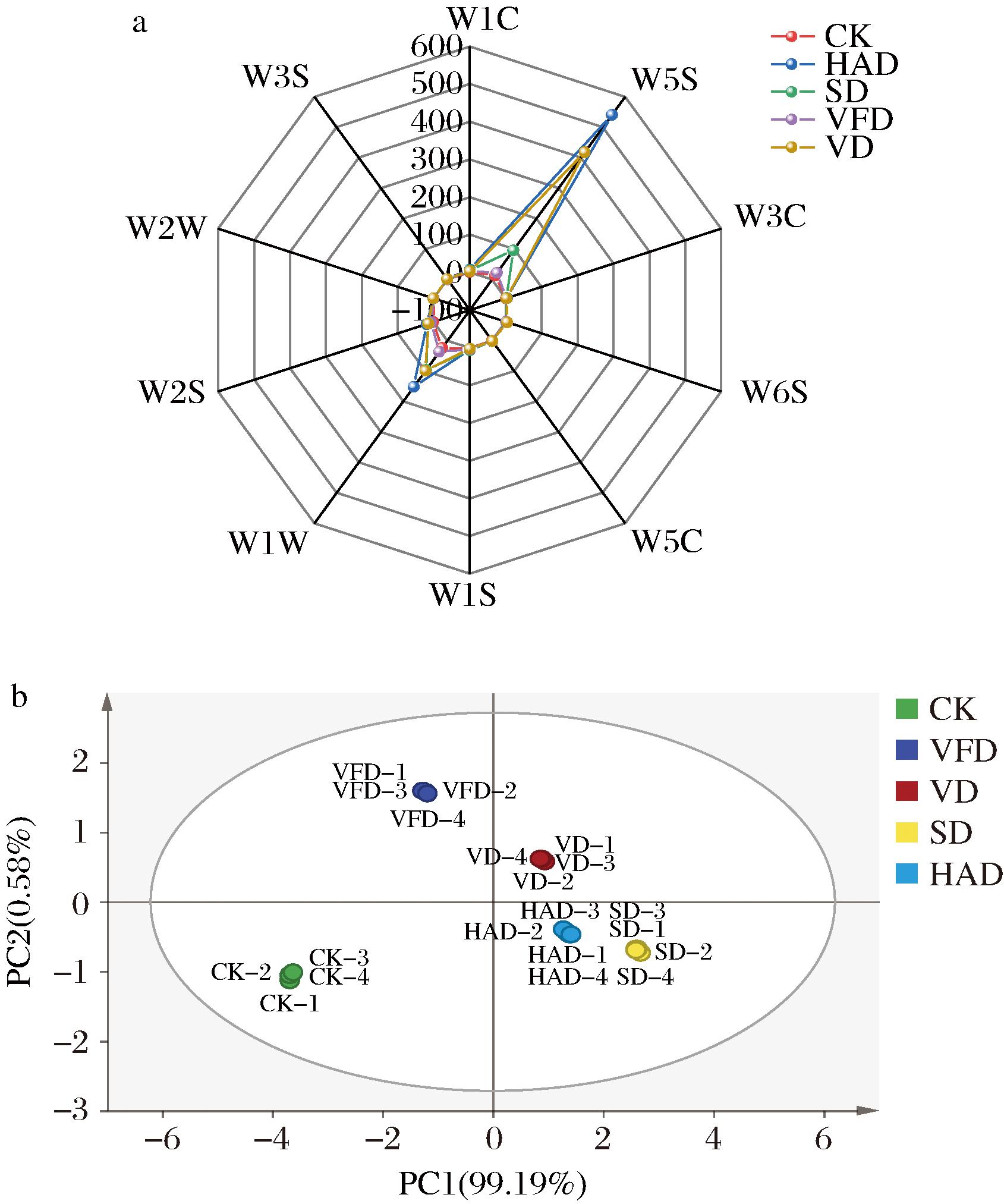
a-电子鼻响应值;b-主成分分析
图1 不同干制工艺下牡蛎干的电子鼻响应值和主成分分析
Fig.1 E-nose response values and principal component analysis of dried oysters under different drying technologies
为了进一步区分不同牡蛎干香气特征的差异,对电子鼻数据进行PCA分析。结果如图1-b所示,PC1贡献率为99.19%,PC2贡献率为0.58%,累积贡献率为99.77%,基本涵盖样本的所有信息,该结果能够准确反映原始样本的特征。5组样品分布于4个不同象限内且样品之间距离较远,表明不同干制工艺对牡蛎干的挥发性成分有显著影响。
2.3 挥发性物质分析
2.3.1 GC-IMS谱图分析
采用GC-IMS对样品中的挥发性物质进行了分析,为了方便比较不同样品的异同,采用了差异对比模式得到了不同干制工艺下牡蛎干挥发性物质的GC-IMS二维差异对比图谱(图2),即选取CK组的谱图作为参照,其他样品的谱图扣减参照,如果二者挥发性物质一致,则扣减后的背景为白色,而红色点代表该物质的含量高于参照样品,蓝色点表示低于参照样品[23]。由图2可知,不同样品的挥发性成分的特征谱图存在显著差异,谱图变化较大的是在保留时间100~300 s(绿色圈内),与CK相比,干制组(VFD、VD、SD、HAD)气味物质特征峰的数量和特征峰信号强度均显著增加。此外,干制工艺对牡蛎干的挥发性成分有显著影响,热干制组(VD、SD、HAD)谱图中红色点显著高于冷干制组(VFD),且VD、SD、HAD组的谱图也存在差异(绿色圈内),表明干制加工的温度是影响产品气味的关键因素[7]。高温干制促进了脂质的氧化降解,增加了干制品中挥发性物质的浓度,从而提升了感官属性的丰富度,对干制产品风味品质的提升有积极作用,该结果与电子鼻、脂肪酸的测定结果一致。
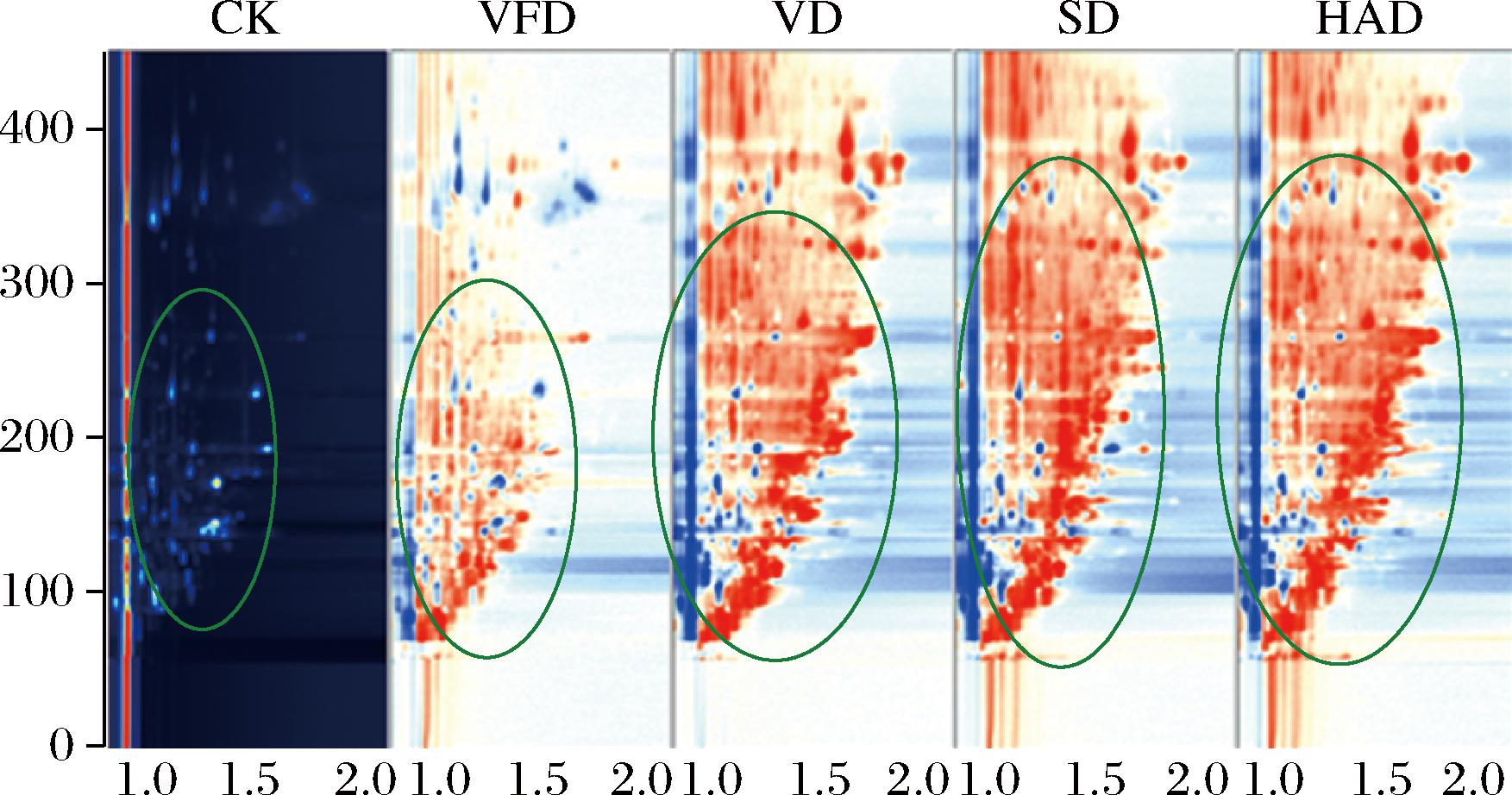
图2 不同干制工艺下牡蛎干挥发性物质的GC-IMS(二维)谱图
Fig.2 GC-IMS (two-dimensional) spectra of dried oyster volatiles under different drying technologies
2.3.2 挥发性物质的定性定量分析
GC-IMS主要是以正酮C4-C9为外标,通过计算各挥发性物质的RI并与仪器的IMS数据库和NIST数据库匹配,再结合保留时间和迁移时间实现对挥发性物质的定性分析[23]。由表2可知,在5组样品中共鉴别出71种单体或二聚体挥发性物质,其中醇类16种、呋喃类7种、醚类2种、醛类24种、酸类3种、酮类10种、酯类5种、其他化合物4种。
表2 不同干制工艺下牡蛎干挥发性物质的相对含量和光谱参数
Table 2 Relative content and spectral parameters of dried oyster volatiles under different drying technologies
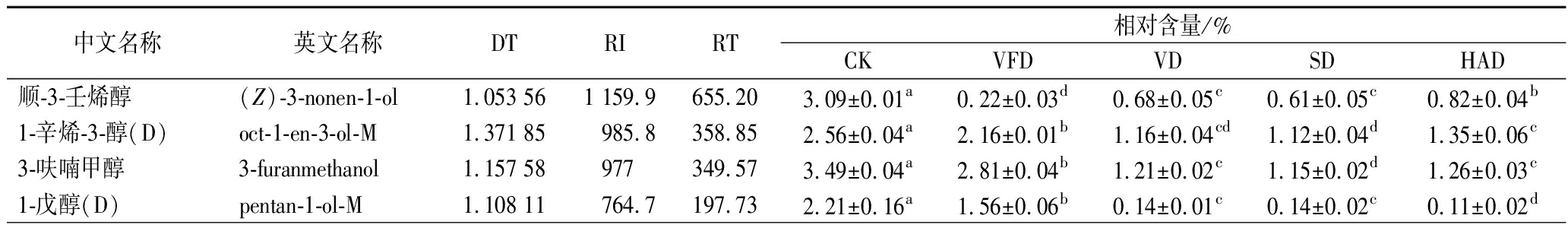
中文名称英文名称DTRIRT相对含量/%CKVFDVDSDHAD顺-3-壬烯醇(Z)-3-nonen-1-ol1.053 561 159.9655.203.09±0.01a0.22±0.03d0.68±0.05c0.61±0.05c0.82±0.04b1-辛烯-3-醇(D)oct-1-en-3-ol-M1.371 85985.8358.852.56±0.04a2.16±0.01b1.16±0.04cd1.12±0.04d1.35±0.06c3-呋喃甲醇3-furanmethanol1.157 58977349.573.49±0.04a2.81±0.04b1.21±0.02c1.15±0.02d1.26±0.03c1-戊醇(D)pentan-1-ol-M1.108 11764.7197.732.21±0.16a1.56±0.06b0.14±0.01c0.14±0.02c0.11±0.02d
续表2

中文名称英文名称DTRIRT相对含量/%CKVFDVDSDHAD丙醇1-propanol1.253 83 549.2125.480.74±0.06b0.63±0.02c0.96±0.02a0.40±0.02d0.66±0.02c3-辛醇3-octanol1.263 791 007.5384.910.90±0.07d2.17±0.09a1.44±0.05c1.51±0.05c1.89±0.08b正丁醇1-butanol1.406 4663.7155.830.13±0.02d0.72±0.03c0.95±0.07b0.99±0.01b1.18±0.02a糠醇(M)2-furanmethanol-M1.378 06837.9237.240.08±0.01d0.17±0.03c0.30±0.02b1.95±0.02a0.30±0.02b糠醇(D)2-furanmethanol-D1.361 97866.4254.630.05±0.01c0.06±0.01b0.05±0.01c0.84±0.01a0.05±0.01c1-辛烯-3-醇(M)oct-1-en-3-ol-M1.364 17984.5357.450.84±0.03a0.44±0.01d0.49±0.02c0.50±0.01c0.62±0.04b5-甲基-2-呋喃甲醇5-methyl-2-furanmeth-anol1.593 74961.1333.380.04±0.01c0.04±0.02c0.50±0.02b0.51±0.01b0.56±0.01a1-戊醇(M)pentan-1-ol-M1.560 47762.5196.640.66±0.09a0.62±0.01a0.14±0.01d0.18±0.01b0.15±0.01c芳樟醇linalool1.515 571 099529.850.17±0.01d1.17±0.02a0.69±0.01c1.04±0.01b1.00±0.03b二氢月桂烯醇dihydromyrcenol1.224 311 074.6486.570.25±0.02e1.44±0.04b1.06±0.02d1.62±0.04a1.24±0.02c正己醇n-hexanol1.231 02871.5257.880.26±0.02c0.48±0.02b0.49±0.02b0.23±0.01c0.65±0.04a3-甲基-3-丁烯-1-醇3-methyl-3-buten-1-ol1.326 37727179.870.03±0.01d0.02±0.01d0.19±0.01c0.29±0.01b0.65±0.02a2,5-二甲基呋喃(D)2,5-dimethylfuran-D1.505 56704.7170.079.35±0.16a5.61±0.01b3.97±0.10c3.46±0.02d3.35±0.05d四氢呋喃(M)tetrahydrofurane-M1.352 72628.4145.762.44±0.11a1.28±0.02b0.24±0.02cd0.23±0.01d0.32±0.03c四氢呋喃(D)tetrahydrofurane-D1.063 35631.9146.711.24±0.06e6.50±0.08a2.75±0.07d3.40±0.21b2.94±0.16c2-乙酰基呋喃(M)2-acetylfuran-M1.224 58915.2290.700.13±0.01d0.11±0.01d1.89±0.14b1.19±0.08c2.56±0.05a2,5-二甲基呋喃(M)2,5-dimethylfuran-M1.120 01695.9166.340.11±0.01d0.28±0.01b0.19±0.01c0.26±0.01b0.46±0.02a2-乙酰基呋喃(D)2-acetylfuran-D1.039 36911.8291.700.52±0.02c0.49±0.02cd1.00±0.02b0.47±0.01d1.22±0.04a2-正戊基呋喃2-pentyl furan1.447 74994.3368.040.09±0.00c0.08±0.01c0.27±0.01b0.44±0.01a0.46±0.01a乙二醇二甲醚1,2-dimethoxyethane1.247 74654.5153.110.75±0.05d1.57±0.03c1.82±0.02b1.84±0.04b2.07±0.01a二丙基二硫醚dipropyl disulfide1.299 441 109548.700.29±0.01d0.64±0.03c0.75±0.02b0.61±0.05c1.45±0.05a4-甲基噻唑4-methylthiazole1.477 74816.4224.910.05±0.01d0.15±0.03c0.25±0.02b2.52±0.01a0.20±0.05b二甲胺dimethylamine1.361 97423.898.981.20±0.05d8.59±0.10a3.92±0.06b3.92±0.15b2.95±0.11c2-乙烷基-3,5-二甲基吡嗪2-ethyl-3,5-dimeth-ylpyrazine1.736 211 074.6486.570.10±0.00d0.22±0.02c0.52±0.06b1.33±0.07a0.77±0.07b(E,E)-2,4-庚二烯醛(M)(E, E)-2,4-heptadie-nal-M1.198 331 013.8393.471.86±0.03a0.73±0.08c1.54±0.07b1.58±0.06ab1.72±0.08a庚醛(D)heptanal-M1.334 18901.9279.412.07±0.10b2.73±0.06a0.50±0.03d0.69±0.03c0.48±0.04d2-己烯醛(D)2-hexenal-D1.517 05853.2246.413.38±0.05a2.00±0.03b0.62±0.04c0.40±0.01d0.62±0.05c2-己烯醛(M)2-hexenal-M1.507 05849.7244.334.51±0.04b2.36±0.10c5.08±0.32a5.37±0.11a5.18±0.10a己醛hexanal1.263 76792.8212.172.56±0.06a1.41±0.02b0.09±0.01c0.08±0.01c0.13±0.01c反式-2-戊烯醛(D)(E)-2-pentenal-D1.355 37752191.558.83±0.15a3.54±0.18d7.87±0.07c7.81±0.05c8.24±0.08b异戊醛3-methylbutanal1.196 71647.7151.163.13±0.07a1.99±0.04d2.67±0.10b2.31±0.17c2.56±0.10bc反式-2-戊烯醛(M)(E)-2-pentenal-M1.104 88751.1191.082.61±0.09a2.04±0.05b0.19±0.01c0.19±0.01c0.14±0.01d反-2-辛烯醛(D)(E)-2-octenal-D1.332 791 062.3466.070.21±0.01d0.16±0.04d1.92±0.14b0.98±0.13c3.16±0.19a反-2-辛烯醛(M)(E)-2-octenal-M1.232 171 061.6463.641.39±0.01d0.60±0.01e2.37±0.05b1.72±0.06c2.99±0.01a(E,E)-2,4-庚二烯醛(D)(E, E)-2,4-heptadie-nal-D1.617 731 016.8397.650.51±0.06b0.18±0.03c5.09±0.21a4.95±0.22a5.31±0.16a正辛醛octanal1.824 001 007384.320.12±0.01e0.46±0.03d1.93±0.08b1.29±0.04c2.91±0.09a2,4-庚二烯醛2,4-heptadienal1.626 111 000.7375.930.15±0.01b0.08±0.01c2.01±0.13a1.92±0.15a2.07±0.14a(E)-2-庚烯醛(M)(E)-hept-2-enal-M1.253 08957.6329.870.12±0.01d0.09±0.01e1.87±0.11b1.22±0.13c2.38±0.08a庚醛(M)heptanal-D1.695 86901.8279.300.63±0.07e1.95±0.10c4.03±0.05a1.83±0.02d2.84±0.08b3-甲基-2-丁烯醛(D)3-methyl-2-butenal-D1.356 12786.5208.870.11±0.01d0.50±0.07c0.96±0.01b1.93±0.08a0.59±0.04c3-甲基-2-丁烯醛(M)3-methyl-2-butenal-M1.357 89779204.990.21±0.01c0.32±0.03b0.30±0.02b0.77±0.12a0.83±0.11a丁醛(D)butanal-D1.291 48596.8137.300.20±0.01e2.09±0.02c3.17±0.09b3.40±0.11a0.90±0.01d5-甲基呋喃醛5-methylfurfural1.466 06962.6334.890.04±0.00c0.05±0.01c0.32±0.02b0.50±0.01a0.34±0.01b苯甲醛benzaldehyde1.148 85962.6334.890.35±0.01d0.44±0.01c0.56±0.01b0.66±0.01a0.62±0.03a(E)-2-庚烯醛(D)(E)-hept-2-enal-D1.669 76957.8330.100.46±0.02ab0.24±0.01d0.50±0.02a0.35±0.01c0.45±0.02b(Z)-4-庚烯醛(Z)-4-heptenal1.147 92900.3278.080.44±0.01b0.73±0.03a0.18±0.01d0.28±0.01c0.17±0.01d2-甲基-2-戊烯醛2-methyl-2-pentenal1.158 71834.2235.070.08±0.00e0.13±0.01c0.16±0.01b0.10±0.00d0.25±0.02a丁醛(M)butanal-M1.289 76596.8135.300.12±0.01d0.15±0.01c0.71±0.11b0.87±0.03b1.87±0.30a异戊酸3-methylbutyric acid1.494 57827.5231.180.20±0.01e0.47±0.02d5.14±0.31b4.65±0.15c7.40±0.08a2-甲基戊酸2-methylpentanoic acid1.262 391 031.6418.740.21±0.01d0.22±0.01d0.38±0.01b0.29±0.02c0.50±0.02a丙酸propanoic acid1.111 43702.8169.250.58±0.05a0.36±0.03b0.04±0.01d0.07±0.01c0.05±0.00d
续表2
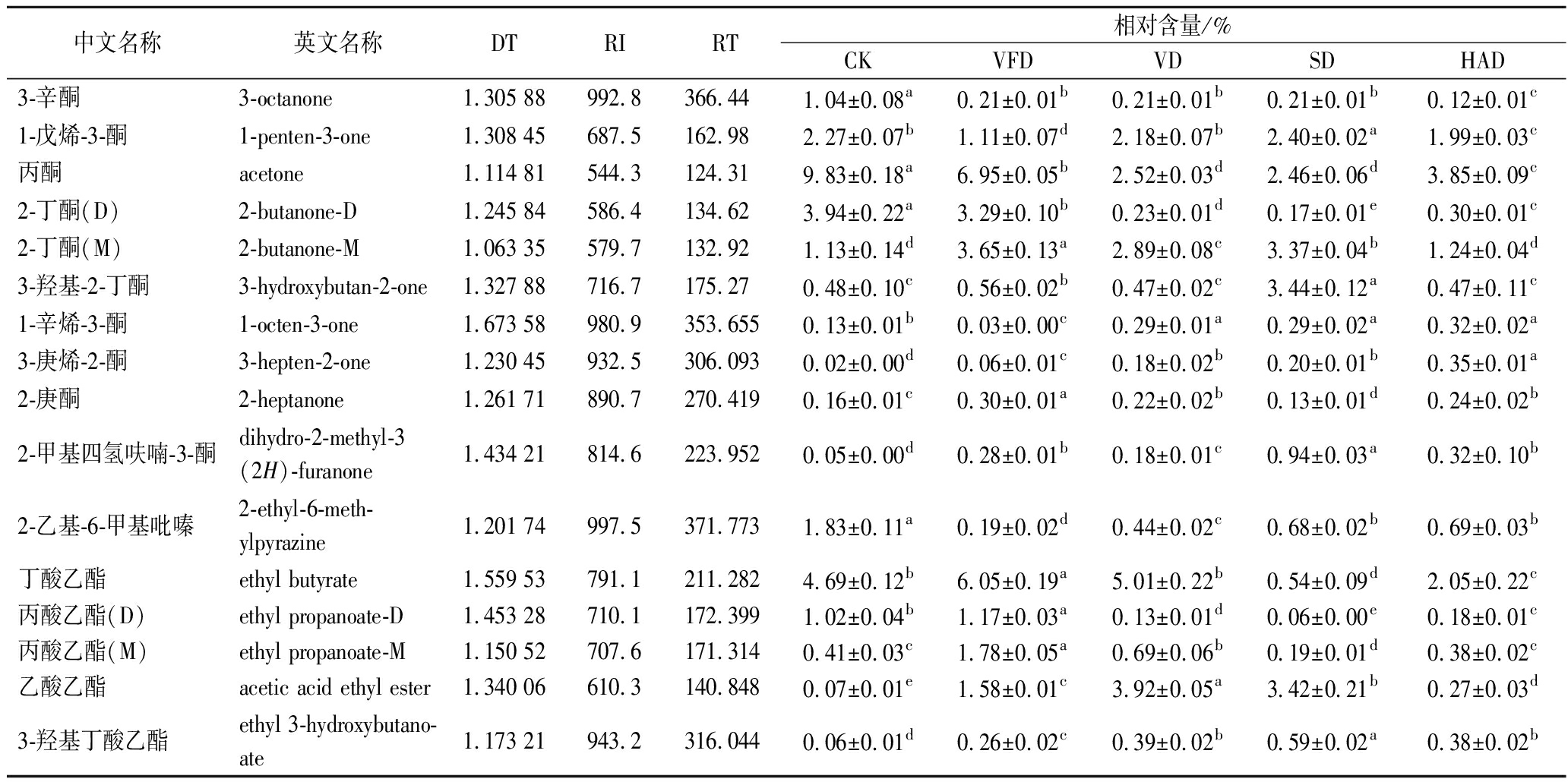
中文名称英文名称DTRIRT相对含量/%CKVFDVDSDHAD3-辛酮3-octanone1.305 88992.8366.44 1.04±0.08a0.21±0.01b0.21±0.01b0.21±0.01b0.12±0.01c1-戊烯-3-酮1-penten-3-one1.308 45687.5162.982.27±0.07b1.11±0.07d2.18±0.07b2.40±0.02a1.99±0.03c丙酮acetone1.114 81544.3124.319.83±0.18a6.95±0.05b2.52±0.03d2.46±0.06d3.85±0.09c2-丁酮(D)2-butanone-D1.245 84586.4134.623.94±0.22a3.29±0.10b0.23±0.01d0.17±0.01e0.30±0.01c2-丁酮(M)2-butanone-M1.063 35579.7132.921.13±0.14d3.65±0.13a2.89±0.08c3.37±0.04b1.24±0.04d3-羟基-2-丁酮3-hydroxybutan-2-one1.327 88716.7175.270.48±0.10c0.56±0.02b0.47±0.02c3.44±0.12a0.47±0.11c1-辛烯-3-酮1-octen-3-one1.673 58980.9353.6550.13±0.01b0.03±0.00c0.29±0.01a0.29±0.02a0.32±0.02a3-庚烯-2-酮3-hepten-2-one1.230 45932.5306.0930.02±0.00d0.06±0.01c0.18±0.02b0.20±0.01b0.35±0.01a2-庚酮2-heptanone1.261 71890.7270.4190.16±0.01c0.30±0.01a0.22±0.02b0.13±0.01d0.24±0.02b2-甲基四氢呋喃-3-酮dihydro-2-methyl-3(2H)-furanone1.434 21814.6223.9520.05±0.00d0.28±0.01b0.18±0.01c0.94±0.03a0.32±0.10b2-乙基-6-甲基吡嗪2-ethyl-6-meth-ylpyrazine1.201 74997.5371.7731.83±0.11a0.19±0.02d0.44±0.02c0.68±0.02b0.69±0.03b丁酸乙酯ethyl butyrate1.559 53791.1211.2824.69±0.12b6.05±0.19a5.01±0.22b0.54±0.09d2.05±0.22c丙酸乙酯(D)ethyl propanoate-D1.453 28710.1172.3991.02±0.04b1.17±0.03a0.13±0.01d0.06±0.00e0.18±0.01c丙酸乙酯(M)ethyl propanoate-M1.150 52707.6171.3140.41±0.03c1.78±0.05a0.69±0.06b0.19±0.01d0.38±0.02c乙酸乙酯acetic acid ethyl ester1.340 06610.3140.8480.07±0.01e1.58±0.01c3.92±0.05a3.42±0.21b0.27±0.03d3-羟基丁酸乙酯ethyl 3-hydroxybutano-ate1.173 21943.2316.0440.06±0.01d0.26±0.02c0.39±0.02b0.59±0.02a0.38±0.02b
注:D为二聚体;M为单体;RI为保留指数;RT保留时间(s);DT为迁移时间(ms);同行数据不同小写字母表示样品间具有显著性差异(P<0.05)。
为进一步分析不同干制工艺对牡蛎干挥发性物质的影响,采用归一化法对图谱中各种有机化合物进行了半定量分析,得到了样品中各挥发性化合物的相对含量(表2、图3)。由图3可知,5组样品中鉴别出的挥发性物质的总相对含量在93.72%~99.07%,能够代表原始样本的大部分信息,其中醛、醇、酮、呋喃类化合物含量较高,与电子鼻的测定结果一致。醛类是牡蛎干中的主要挥发性物质,相对含量为24.97%~46.72%,与CK组相比,VFD组醛类含量显著减少,HAD、SD、VD组醛类含量均显著增加,醛类主要来源于脂质的氧化降解反应,且该类物质通常阈值较低,呈现强烈的脂香、青香、果香[7, 24]。因此,醛类物质的浓度是导致不同干制工艺下牡蛎干香气特征存在差异的重要因素。醇类物质的相对含量为10.44%~15.50%,醇类物质一般来源于脂质的氧化以及醛、酮类物质的还原[25-26],其阈值通常较高,对产品的气味影响不大,但一些不饱和醇(例如,1-辛烯-3-醇)的阈值较低,且被认为是水产品腥味的来源[27],与CK相比,干制加工减少了牡蛎干中1-辛烯-3-醇的含量,对牡蛎干风味品质的提升有积极作用。酮类物质主要由不饱和脂肪酸的热氧化以及氨基酸的降解产生,属于不稳定的中间体,会被进一步氧化或还原成相应的醇[12],该物质通常赋予产品独特的香气和果味,是干制产品特征气味的重要组成部分。呋喃类化合物主要来源于美拉德反应[11],5组样品中的相对含量在9.45%~14.35%,其中2-乙酰基呋喃阈值较低且具有强烈肉香味,被认为是干制产品中的关键气味化合物[28],HAD组2-乙酰基呋喃的含量显著高于其他组。
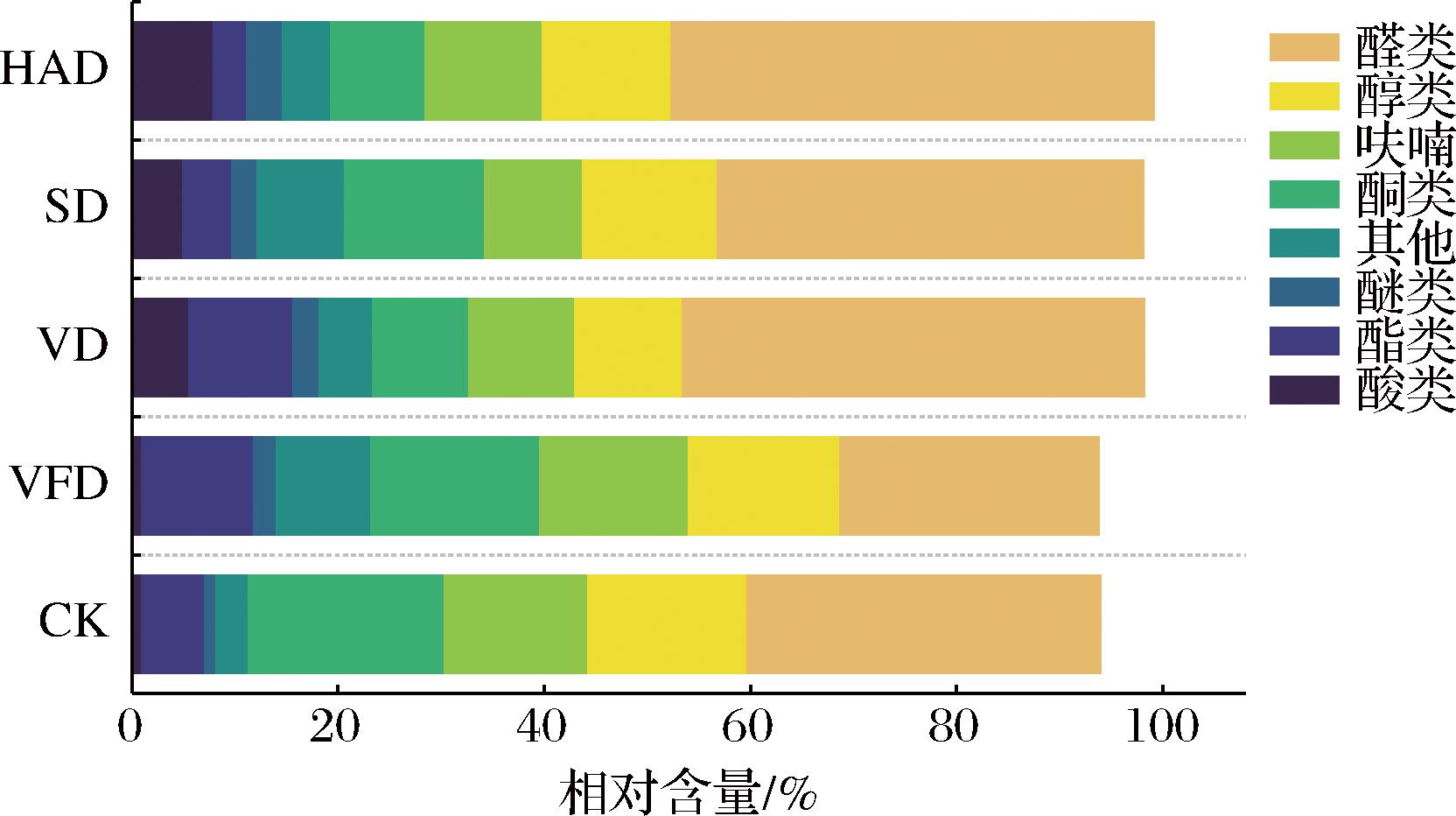
图3 不同干制方式下牡蛎干中各类挥发性物质的相对含量
Fig.3 Total relative contents of various classes of volatile substances in dried oysters under different drying technologies
2.3.3 指纹图谱分析
如图4所示,图中每一行为一个样品,每个样品重复3次,每一列为一种挥发性物质,图中颜色越深代表该物质含量越高,指纹图谱可分为A、B、C、D四个区域,A区域为焯水牡蛎的特征香气物质,包括1-辛烯-3-醇、3-呋喃甲醇、1-戊醇、反式-2-戊烯醛、1-戊醇、2-丁酮、丙酸乙酯、丙酸、3-辛酮等,具有蘑菇、泥土、青草、柑橘等类别的风味[5]。B区域为牡蛎经热干制(VD、SD、HAD)加工后显著增加的挥发性化合物,以阈值较低的醛、酮类物质为主,包括反式-2-戊烯醛、(E,E)-2,4-庚二烯醛、2-己烯醛、异戊醛、苯甲醛、(E)-2-庚烯醛、2-甲基-2-戊烯醛、庚醛、1-辛烯-3-酮、2-庚酮、1-戊烯-3-酮、2-丁酮等,赋予牡蛎干花香、脂香、果香、青香等风味特征,C区域为热干制组(VD、SD、HAD)牡蛎干共有的挥发性化合物,包括2,4-庚二烯醛、2-正戊基呋喃、2-乙酰基呋喃、正辛醛、芳樟醇、3-庚烯-2-酮、正丁醇、2,5-二甲基呋喃、5-甲基-2-呋喃甲醇等,其中呋喃化合物为牡蛎干贡献了强烈的烤肉香属性,该类化合物尤其在HAD组表现出更高的浓度。D区域是SD组显著高于其他组的物质,包括糠醇、4-甲基噻唑、3-羟基-2-丁酮、乙酸乙酯、3-羟基丁酸乙酯、3-庚烯-2-酮、二氢月桂烯醇、2-乙烷基-3,5-二甲基吡嗪、2-甲基四氢呋喃-3-酮等。

图4 不同干制工艺下牡蛎干的指纹图谱
Fig.4 Fingerprint profiles of dried oysters under different drying technologies
2.4 多元化分析
2.4.1 聚类分析
如图5所示,5组样品可聚为4类,CK、VFD、SD各聚为一类,VD和HAD聚为一类,表明VD组和HAD组的挥发性物质具有一定的相似性,可能原因是HAD组和VD组相同的干制温度所致。
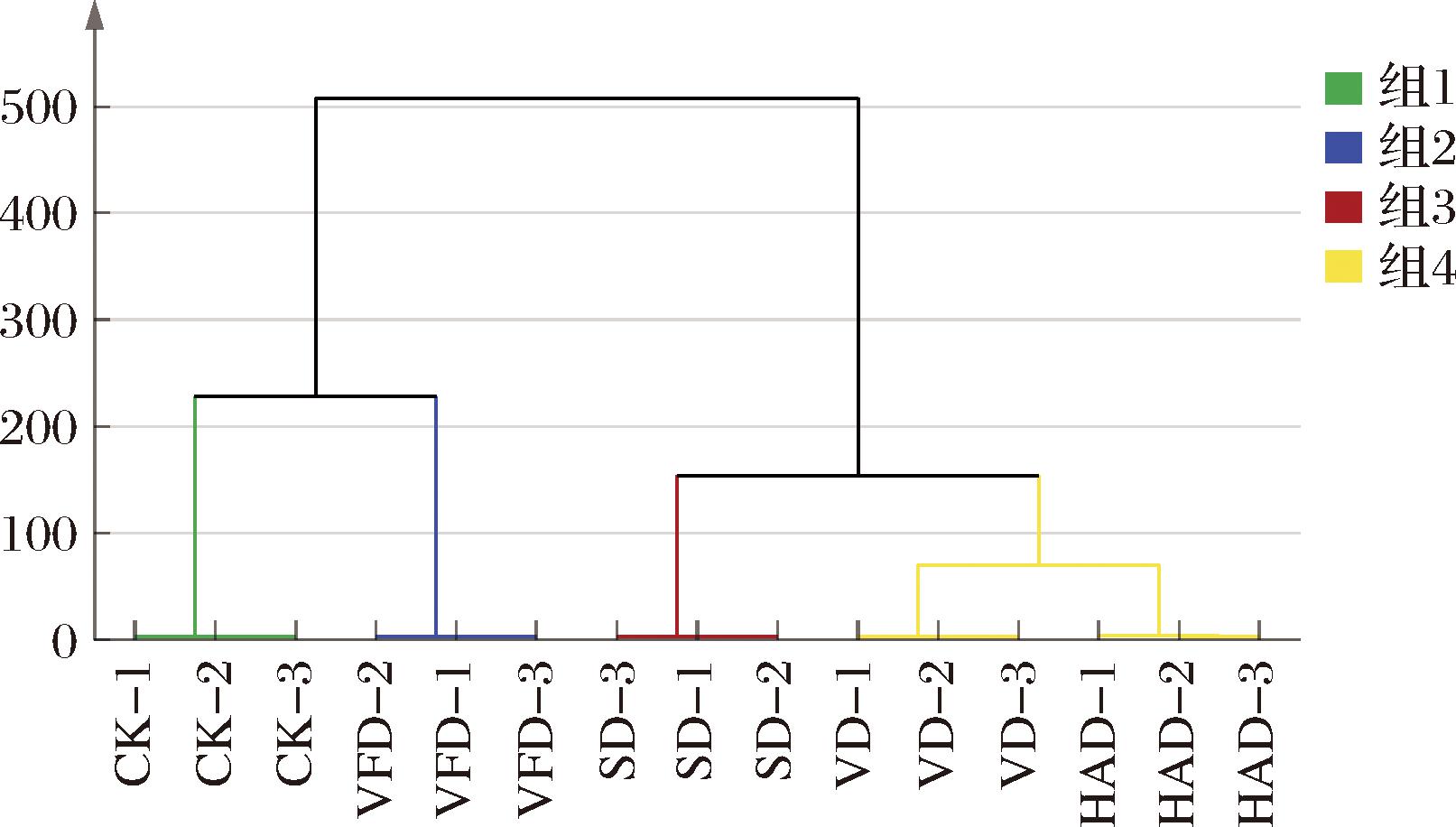
图5 不同干制工艺下牡蛎干挥发性物质的聚类分析
Fig.5 Cluster analysis of dried oyster volatiles under different drying technologies
2.4.2 PLS-DA
PLS-DA是一种不同于PCA的监督判别的统计方法,可以有效地解释观测值并实现相应变量的预测,模型的可靠性和预测能力可以通过R2和Q2进行评估,R2和Q2高于0.5表示模型拟合度可接受,值越接近1表示预测能力越强[29]。进一步采用PLS-DA对不同干制工艺下牡蛎干的气味物质进行分析,结果如图6-a所示,PC1为54.8%,PC2为22.8%,累积贡献率为77.6%,能够反应样品的大部分信息,且各样品得到了明显区分,表明5组样品的挥发性物质差异显著。此外,经过200次排列测试后(图6-c),Q2回归线与纵轴的交点小于零,且R2与Q2的交点(0.994 8,0.979 6)大于0.5,模型没有过度拟合,表明该模型预测能力可靠。在PLS-DA模型中,变量投影重要度(variable importance for the projection,VIP)是评价变量贡献度的指标,一般认为VIP>1的变量能反映统计模型中的差异特征[29],在5组样品中共筛选出31种VIP>1的挥发性物质,结果如图6-b所示,这些物质可以作为区分不同样品的标志物。

a-PLS-DA;b-VIP;c-检验模型
图6 不同干制工艺下牡蛎干挥发性物质的PLS-DA、VIP、检验模型
Fig.6 PLS-DA, VIP, and test model of dried oyster volatiles under different drying technologies
2.4.3 相关性分析
为了研究脂肪酸与挥发性风味物质之间的关系,对游离脂肪酸与VIP>1的挥发性化合物进行了Pearson相关性分析,如图7所示。红色方块代表呈正相关,蓝色方块代表呈负相关,颜色越深代表相关系数的绝对值越大,星号代表呈极相关性(P<0.05)。由图7可知,游离脂肪酸中的C15∶0、C16∶1、C16∶0、C18∶3、C18∶4、C20∶0、C20∶1、C20∶2与牡蛎干中的特征挥发性物质庚醛、丁醛、2-甲基-2-戊烯醛、2-庚酮、1-戊烯-3-酮、2-丁酮、1-辛烯-3-醇、(E,E)-2,4-庚二烯醛等呈显著负相关性(P<0.05),该结果与前人的研究结果类似。WANG等[14]研究表明,脂肪酸中的C17∶0、C16∶0、C18∶0、C18∶1、C18∶3、C20∶0与金鲳发酵过程中挥发性化合物的形成呈显著相关性,ZHENG等[11]研究发现,不饱和度较高的脂肪酸对虾干整体香气的影响较大,C16∶0、C18∶0、C18∶1、C18∶2可促进虾干香气物质的形成。由此进一步说明牡蛎干制过程中的脂质降解与挥发性气味的形成密切相关,可为牡蛎干挥发性气味形成机制研究提供理论依据。
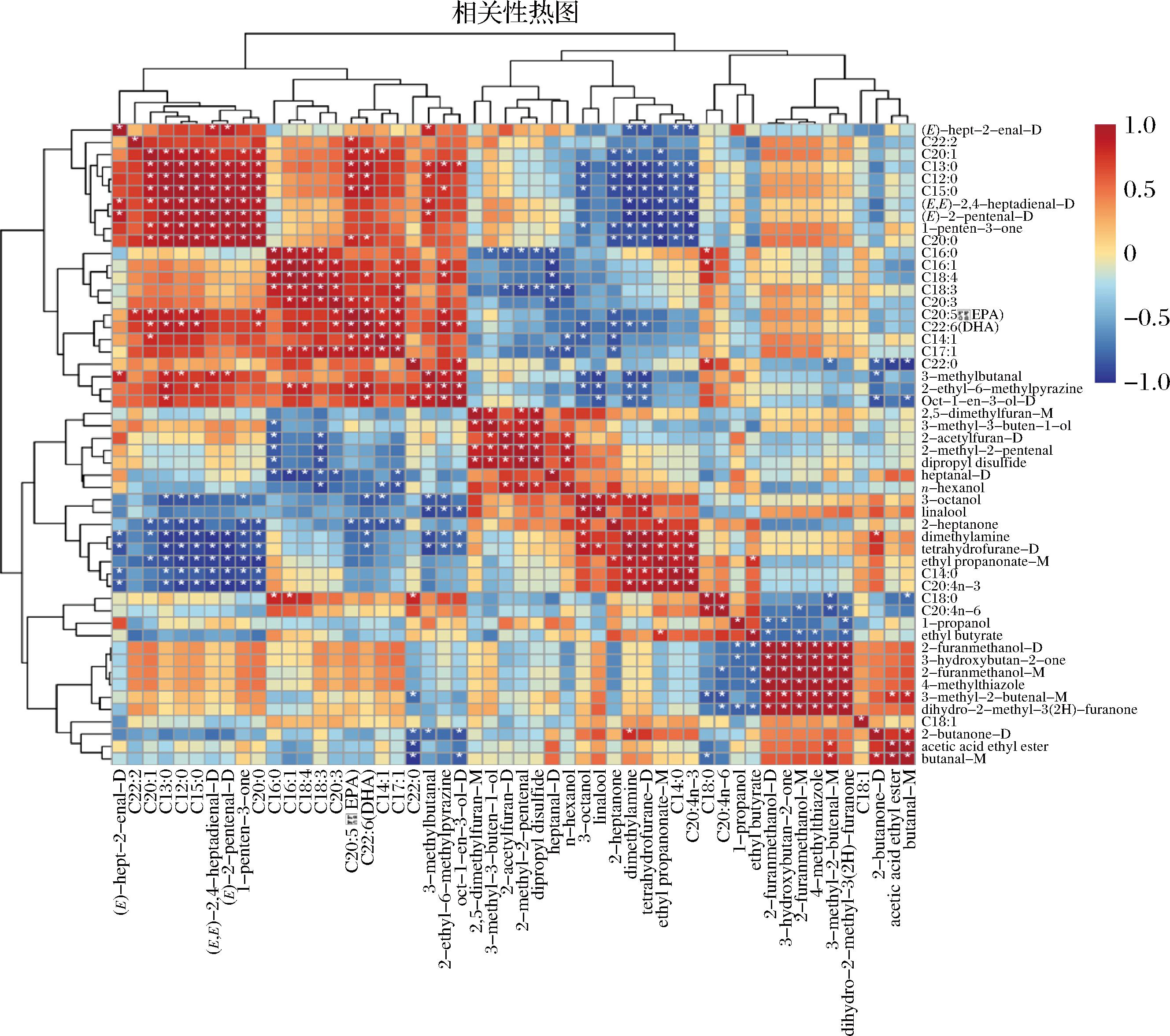
图7 相关性分析
Fig.7 Correlation analysis
3 结论
不同干制工艺对牡蛎干的气味和脂肪酸组成有显著影响,牡蛎经干制加工后脂肪酸含量显著降低,其中VD组脂肪酸损失最严重,其次是HAD,而VFD更有利于保留脂肪酸。通过GC-IMS鉴别了71种挥发性化合物,醛、醇、酮、呋喃类化合物是牡蛎干的主要挥发性物质,多元化分析结果表明,不同干制工艺对牡蛎干气味有显著影响,热干制(VD、SD、HAD)显著增加了挥发性物质的浓度,电子鼻能有效区分不同样品的气味。此外,筛选了31种差异性挥发性化合物,包括庚醛、丁醛、2-甲基-2-戊烯醛、2-庚酮、1-戊烯-3-酮、2-丁酮、1-辛烯-3-醇、(E,E)-2,4-庚二烯醛等,牡蛎干特征气味的形成与游离脂肪酸中C15∶0、C16∶1、C16∶0、C18∶3、C18∶4、C20∶0、C20∶1、C20∶2等的氧化降解密切相关。
[1] 农业农村部. 2022中国渔业统计年鉴[M].北京:中国农业出版社, 2022.Ministry of Agriculture and Rural Affairs.China Fishery Statistical Yearbook 2022 [M].Beijing:China Agriculture Press, 2022.
[2] GAO J X, ZHANG Y Y, HUANG X H, et al.Comparison of amino acid, 5′-nucleotide and lipid metabolism of oysters (Crassostrea gigas Thunberg) captured in different seasons[J].Food Research International, 2021, 147:110560.
[3] PENG D M, ZHANG S C, ZHANG H Z, et al.The oyster fishery in China:Trend, concerns and solutions[J].Marine Policy, 2021, 129:104524.
[4] LIU C S, GU Z F, LIN X X, et al.Effects of high hydrostatic pressure (HHP) and storage temperature on bacterial counts, color change, fatty acids and non-volatile taste active compounds of oysters (Crassostrea ariakensis)[J].Food Chemistry, 2022, 372:131247.
[5] WANG Q, SUN C, CHEN L P, et al.Evaluation of microalgae diets on flavor characteristics of Pacific oysters (Crassostrea gigas) during fattening[J].Food Chemistry, 2022, 391:133191.
[6] LI Y Y, JIANG S, ZHU Y W, et al.Effect of different drying methods on the taste and volatile compounds, sensory characteristics of Takifugu obscurus[J].Food Science and Human Wellness, 2023, 12(1):223-232.
[7] QIU D, DUAN R B, WANG Y Q, et al.Effects of different drying temperatures on the profile and sources of flavor in semi-dried golden pompano (Trachinotus ovatus)[J].Food Chemistry, 2023, 401:134112.
[8] YIN M Y, MATSUOKA R, YANAGISAWA T, et al.Effect of different drying methods on free amino acid and flavor nucleotides of scallop (Patinopecten yessoensis) adductor muscle[J].Food Chemistry, 2022, 396:133620.
[9] YU M G, LI T, SONG H L.Characterization of key aroma-active compounds in four commercial oyster sauce by SGC/GC × GC-O-MS, AEDA, and OAV[J].Journal of Food Composition and Analysis, 2022, 107:104368.[10] ZHANG N L, WANG W L, LI B, et al.Non-volatile taste active compounds and umami evaluation in two aquacultured pufferfish (Takifugu obscurus and Takifugu rubripes)[J].Food Bioscience, 2019, 32:100468.
[11] ZHENG X S, JI H W, ZHANG D, et al.The identification of three phospholipid species roles on the aroma formation of hot-air-dried shrimp (Litopenaeus vannamei) by gas chromatography-ion mobility spectrometry and gas chromatography-mass spectrometry[J].Food Research International, 2022, 162(Pt B):112191.
[12] CHEN C, FAN X K, HU Y Y, et al.Effect of different salt substitutions on the decomposition of lipids and volatile flavor compounds in restructured duck ham[J].LWT, 2023, 176:114541.
[13] CHEN Z Q, ZHU Y H, CAO W H, et al.Novel insight into the role of processing stages in nutritional components changes and characteristic flavors formation of noble scallop Chlamys nobilis adductors[J].Food Chemistry, 2022, 378:132049.
[14] WANG Y Q, WANG H F, WU Y Y, et al.Insights into lipid oxidation and free fatty acid profiles to the development of volatile organic compounds in traditional fermented golden pomfret based on multivariate analysis[J].LWT, 2022, 171:114112.
[15] KE Z G, BAI Y, BAI Y W, et al.Cold plasma treated air improves the characteristic flavor of dry-cured black carp through facilitating lipid oxidation[J].Food Chemistry, 2022, 377:131932.
[16] 周莹, 吉宏武, 张泽伟, 等.虾青素对热风干制凡纳滨对虾香气特性的影响[J].广东海洋大学学报, 2023, 43(1):95-102.ZHOU Y, JI H W, ZHANG Z W, et al.Effect of astaxanthin on aroma characteristics of hot-air-dried litopenaeus vannamei[J].Journal of Guangdong Ocean University, 2023, 43(1):95-102.
[17] 刘琳琳, 秦小明, 刘亚, 等.香港牡蛎挥发性成分及其加热处理变化[J].广东海洋大学学报, 2018,38(5):41-49.LIU L L, QIN X M, LIU Y, et al.Volatile components of HongKong oyster and their changes by heat treatment[J].Journal of Guangdong Ocean University,2018,38(5):41-49.
[18] LI P L, ZHAO W, LIU Y Y, et al.Precursors of volatile organics in foxtail millet (Setaria italica) porridge:The relationship between volatile compounds and five fatty acids upon cooking [J].Journal of Cereal Science, 2021, 100:103253.
[19] FU X J, LIN Q L, XU S Y, et al.Effect of drying methods and antioxidants on the flavor and lipid oxidation of silver carp slices[J].LWT - Food Science and Technology, 2015, 61(1):251-257.
[20] CHEN L P, ZHANG H W, SHI H H, et al.The flavor profile changes of Pacific oysters (Crassostrea gigas) in response to salinity during depuration[J].Food Chemistry:X, 2022, 16:100485.
[21] LIU C S, JI W Z, JIANG H Z, et al.Comparison of biochemical composition and non-volatile taste active compounds in raw, high hydrostatic pressure-treated and steamed oysters Crassostrea hongkongensis[J].Food Chemistry, 2021, 344:128632.
[22] ZHU Y, CHEN X T, PAN N, et al.The effects of five different drying methods on the quality of semi-dried Takifugu obscurus fillets[J].LWT, 2022, 161:113340.
[23] 徐永霞, 白旭婷, 冯媛, 等.基于GC-IMS和化学计量学分析海鲈鱼肉蒸制过程中风味物质的变化[J].食品科学, 2021, 42(22):270-275.XU Y X, BAI X T, FENG Y, et al.Changes of flavor compounds in sea bass during steaming process as analyzed by gas chromatography-ion mobility spectroscopy and chemometrics[J].Food Science, 2021, 42(22):270-275.
[24] JIANG H, ZHANG M T, YE J J, et al.HS-SPME-GC-MS and OAV analyses of characteristic volatile flavour compounds in salt-baked drumstick[J].LWT, 2022, 170:114041.
[25] 刘常园, 方东路, 汤静, 等.基于电子鼻和GC-IMS分析复热对香菇汤 挥发性风味物质的影响[J].食品科学技术学报, 2020, 38(4):46-53.LIU C Y, FANG D L, TANG J, et al.Based on electronic nose and GC-IMS to study effect of reheating on volatile flavor substances of Lentinus edodes soups[J].Journal of Food Science and Technology, 2020, 38(4):46-53.
[26] 姚文生, 蔡莹暄, 刘登勇, 等.不同材料熏制鸡腿肉挥发性物质GC- IMS指纹图谱分析[J].食品科学技术学报, 2019, 37(6):37-45.YAO W S, CAI Y X, LIU D Y, et al.Volatile compounds analysis in chicken thigh smoked with different materials by GC- IMS fingerprint[J].Journal of Food Science and Technology, 2019, 37(6):37-45.
[27] WANG Z J, LI H Q, CAO W H, et al.Effect of drying process on the formation of the characteristic flavor of oyster (Crassostrea hongkongensis)[J].Foods, 2023, 12(11):2136.
[28] ZHANG D, JI H W, LIU S C, et al.Similarity of aroma attributes in hot-air-dried shrimp (Penaeus vannamei) and its different parts using sensory analysis and GC-MS[J].Food Research International, 2020, 137:109517.
[29] SUN W Z, JI H W, ZHANG D, et al.Evaluation of aroma characteristics of dried shrimp (Litopenaeus vannamei) prepared by five different procedures[J].Foods, 2022, 11(21):3532.