单细胞油脂(single cell oil,SCO),是单细胞产油微生物在一定条件下,利用糖类、碳氢化合物、普通油脂等为碳源,在菌体内大量积累的油脂。利用微生物生产油脂具有很多优势[1-3]:a)生长周期短,培养条件简单,操作方便且微生物适应性强,可进行连续化规模化生产;b)生产不受场地、季节限制;c)可利用工农业副产品、食品加工废弃物等廉价原料进行油脂生产,保护环境,节约资源;d)可对微生物进行定向改造,强化遗传性能,提高油脂产量;e)微生物油脂不易被氧化,生物安全性较高。
通常将能积累油脂超过其细胞干重20%的微生物称为产油微生物[4]。其中,产油酵母是单细胞真菌,其所产油脂为SCO,主要以甘油三酯的形式积累,相比于其它产油微生物,其优势为:与微藻相比,其受气候影响较小,且可利用更多种类的糖和简单化合物作为碳源;相比于真菌,对金属离子和低氧有更高的耐受性;与细菌不同,细胞体积更大,更易收获[5]。某些产油酵母在适宜条件下培养后,可积累超过其细胞干重50%~70%的脂质[6-7]。主要的产油酵母有:Trichosporon sp.(丝孢酵母属)、Anodotorula sp.(红酵母属)、Yarrowia sp.(耶氏酵母属)、Candida sp.(念珠菌属)、Cryptococcus sp.(隐球菌属)等[8]。丝孢酵母作为主要的产油酵母,因其产油能力强、可利用原料多而具有较高的研究价值和应用前景。目前,国内外学者对丝孢酵母SCO已进行了大量的研究,主要集中在发酵条件的优化以及对廉价原料的利用上,但目前针对丝孢酵母SCO的详尽综述还很匮乏,本文希望能填补这一空白。
1 丝孢酵母单细胞油脂简介
产油酵母合成SCO可分为4个阶段:乙酰-CoA的形成、脂肪酸的合成、脂肪酸碳链的延长和去饱和、甘油三酯的合成[9]。如图1所示[9-10]:在合成油脂的初始阶段,葡萄糖在线粒体内生成乙酰-CoA,再经过柠檬酸循环合成柠檬酸;之后经线粒体膜上的柠檬酸-苹果酸转移酶(citrate-malate translocase,CMT)将柠檬酸转移至细胞质中,在ATP-柠檬酸裂解酶(ATP citrate lyase,ACL)的作用下,将其分解成乙酰-CoA和草酰乙酸,再经乙酰-CoA羧化酶(acetyl-CoA carboxylase,ACC)的催化作用,将乙酰-CoA催化成丙二酰-CoA,作为脂肪酸合成的起始;最后,在脂肪酸合酶复合体的催化下,经过合成、还原、脱水、再还原反应,实现碳链的延长,达到微生物普遍具有的脂肪酸长度(一般在C16-C18)。甘油三酯的合成通常经过磷脂酸途径:二羟基丙酮被还原为甘油醛-3-磷酸,经过甘油酰酰基磷酸转移酶(glycerol 3-phosphate acyltransferase,GPAT)酰化作用生成溶血磷脂酸,之后经单酰基甘油酰基转移酶(lysophosphatidate transferase,LPAT)生成磷酸酯,再由磷酸酯转移酶(phosphatidate phosphatase,PAP)转化生成甘油二酯,最终经二酰基甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)催化生成甘油三酯,储存在细胞内。
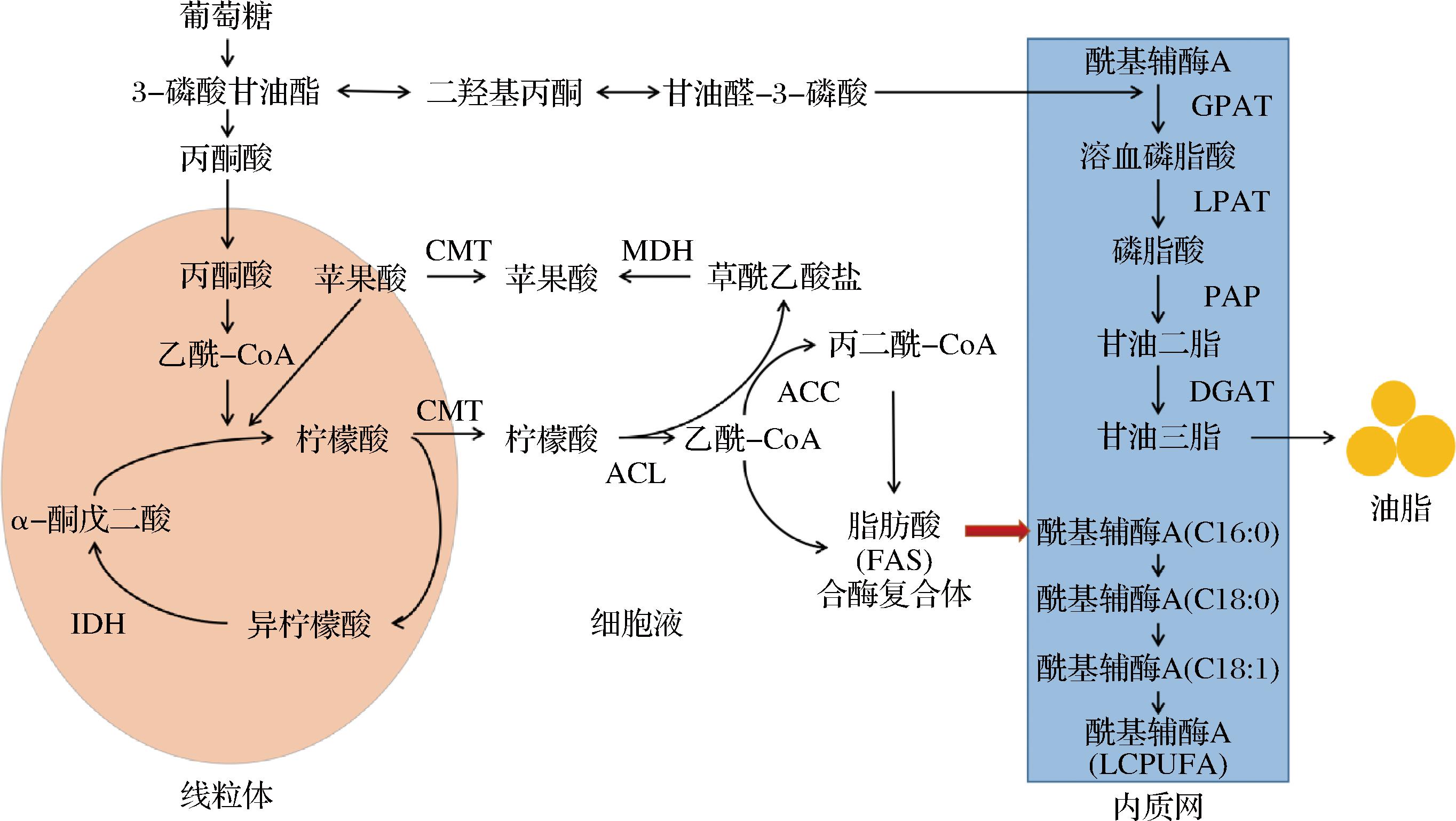
图1 产油酵母转化葡萄糖合成油脂路径
Fig.1 The pathway of glucose conversion to oil synthesis by oleaginous yeasts
注:IDH,异柠檬酸脱氢酶(isocitrate dehydrogenase);CMT,柠檬酸-苹果酸转移酶;ACL,ATP-柠檬酸裂解酶;ACC,乙酰-CoA羧化酶;MDH,苹果酸脱氢酶(malate dehydrogenase);GPAT,甘油酰酰基磷酸转移酶;LPAT,单酰基甘油酰基转移酶;PAP,磷酸酯转移酶;DGAT,二酰基甘油酰基转移酶。
丝孢酵母属是一种高产油脂的酵母菌属,有显著产油能力的有:Trichosporon fermentans(发酵性丝孢酵母)、T.cutaneum(皮状丝孢酵母)、T.oleaginosus(油性丝孢酵母)、T.mucoides(黏性丝孢酵母)、T.dermatis(真皮丝孢酵母)、T.coremiiform(芯状丝孢酵母)、T.mycotoxinivorans(解毒丝孢酵母)、T.porosum(产孢丝孢酵母)等。
丝孢酵母属各产油菌种所产SCO的脂肪酸组成如表1所示。可见,丝孢酵母属各菌种所产脂质主要成分是含有16和18个碳原子的长链脂肪酸,如棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2),与植物油相似。不同菌种的SCO脂肪酸组成含量也不同。其中,T.cutaneum的SCO中棕榈酸含量最高,为50.5%,其次为油酸和硬脂酸,分别为45.4%和26.7%。而T.fermentans、T.oleaginosus、T.mucoides、T.dermatis、T.coremiiform和T.mycotoxinivorans的SCO中,含量最高的都是油酸,其次为棕榈酸,T.fermentans的SCO中油酸含量最高,可达65.1%。
表1 丝孢酵母单细胞油脂含量及脂肪酸组成
Table 1 Single cell oil content and fatty acid composition of Trichosporon sp.
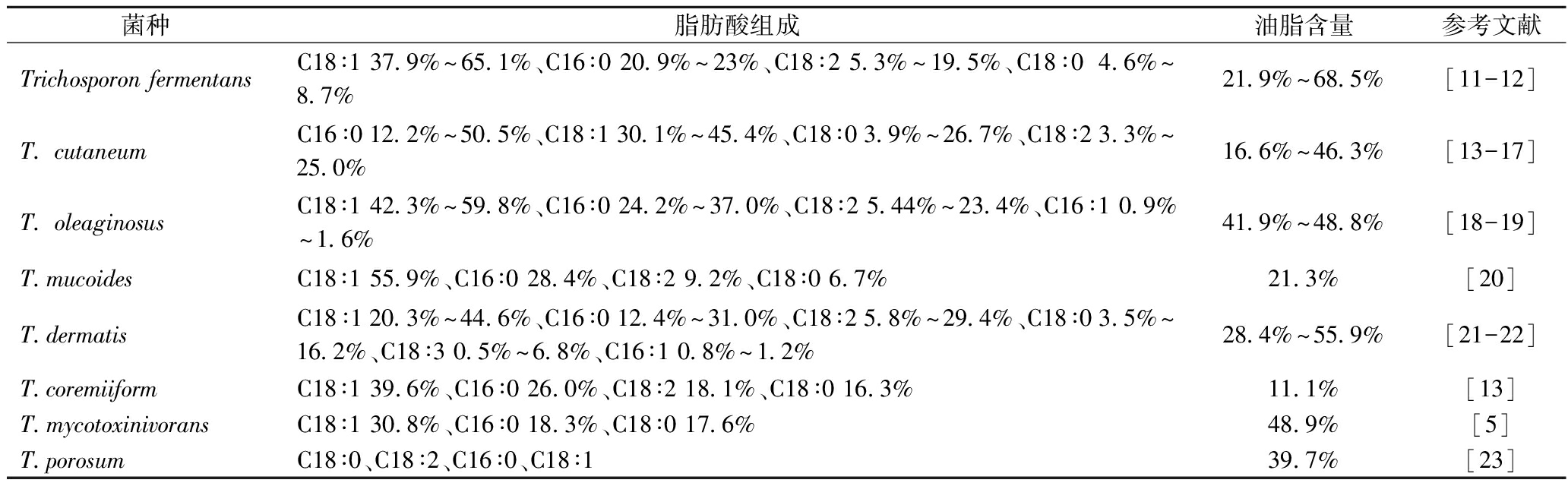
菌种脂肪酸组成油脂含量参考文献Trichosporon fermentansC18∶1 37.9%~65.1%、C16∶0 20.9%~23%、C18∶2 5.3%~19.5%、C18∶0 4.6%~8.7%21.9%~68.5%[11-12]T. cutaneumC16∶0 12.2%~50.5%、C18∶1 30.1%~45.4%、C18∶0 3.9%~26.7%、C18∶2 3.3%~25.0%16.6%~46.3%[13-17]T. oleaginosusC18∶1 42.3%~59.8%、C16∶0 24.2%~37.0%、C18∶2 5.44%~23.4%、C16∶1 0.9%~1.6%41.9%~48.8%[18-19]T.mucoidesC18∶1 55.9%、C16∶0 28.4%、C18∶2 9.2%、C18∶0 6.7%21.3%[20]T.dermatisC18∶1 20.3%~44.6%、C16∶0 12.4%~31.0%、C18∶2 5.8%~29.4%、C18∶0 3.5%~16.2%、C18∶3 0.5%~6.8%、C16∶1 0.8%~1.2%28.4%~55.9%[21-22]T.coremiiformC18∶1 39.6%、C16∶0 26.0%、C18∶2 18.1%、C18∶0 16.3%11.1%[13]T.mycotoxinivoransC18∶1 30.8%、C16∶0 18.3%、C18∶0 17.6%48.9%[5]T.porosumC18∶0、C18∶2、C16∶0、C18∶139.7%[23]
不同菌种所需的最适生长环境不同或发酵底物的不同,导致其油脂含量有所差异,其中T.fermentans油脂含量最高,可达68.5%。同一菌种油脂含量也有差异,如T.cutaneum的最低油脂含量只有16.6%,最高可达46.3%,可能原因为:处于不同的发酵条件、培养基中添加额外的营养物质或采用不同的发酵底物等。
2 丝孢酵母生产单细胞油脂的影响因素
2.1 培养基成分
2.1.1 碳源
碳源会影响丝孢酵母的生长和油脂生成,常见碳源有糖类、有机酸、甘油等。T.fermentans以葡萄糖为碳源,菌体的脂质产量和脂质含量均为最高,分别可达到1.98 g/L和11.36%,在木糖、蔗糖、乳糖及可溶性淀粉中的脂质产量均不及葡萄糖[11]。T.dermatis在含葡萄糖和木糖的混合培养基中表现出良好的木糖利用能力,96 h内消耗了85.9%的木糖,脂质产量达到11.48 g/L[22]。T.cutaneum培养基中葡萄糖和木糖的质量浓度比例越大,菌体的生物量和油脂含量越高,说明葡萄糖更有利于其生长和油脂合成[24]。此外,T.cutaneum可利用乙酸发酵,在优化条件下,以50 g/L乙酸为唯一碳源,生物量、脂质产量分别为8.9 g/L、4.4 g/L[25]。T.oleaginosus以纯化甘油为碳源,可获得10.75 g/L的生物量和47%的脂质含量[26]。葡萄糖和木糖是大部分丝孢酵母的良好碳源,只是对木糖利用能力有差异,如T.dermatis比其他菌种能更好的利用木糖产油。除糖类外,有些菌种还能利用有机酸发酵产油,如T.porosum和T.cutaneum能在以乙酸作为唯一碳源的培养基上生长。
2.1.2 氮源
氮源也会对微生物生长和脂质积累产生影响。氮通过辅助氨基酸合成等方式作用于生物量的积累过程(生长的第一阶段);当氮耗尽,细胞开始利用剩余的碳积累脂肪酸(生长的第二阶段)。氮源分为有机氮源(蛋白胨、酵母提取物、玉米浆、尿素等)和无机氮源(硝酸盐、铵盐、氨水等)。
对于Trichosporon sp.F1-2,以蛋白胨、酵母浸出物和胰蛋白胨作为氮源时的生物量均高于以硫酸铵、氯化铵作为氮源时的生物量,有机氮源在生物量积累方面优于无机氮源,但生物量高并不意味着油脂产量一定高,例如Trichosporon sp.F1-2以胰蛋白胨为氮源时,其生物量虽然优于以硫酸铵为氮源时的生物量,但由于前者的油脂含量显著低于后者的油脂含量,导致最终前者的油脂产量并不如后者的油脂产量[27]。对于T.fermentans,蛋白胨比酵母提取物、尿素和硫酸铵更有利于其油脂合成,脂质含量最高可达31.5%[11,28]。对于T.cutaneum,酵母提取物、蛋白胨等有机氮源比无机氮源更有利于其油脂积累,添加酵母提取物时细胞生物量和脂质产量均最高,分别为10.61 g/L和4.87 g/L[29]。以蛋白胨和酵母提取物作为混合氮源,T.fermentans和T.cutaneum也可获得较好的生物量,分别为13.9 g/L和11.5 g/L[28]。总体而言,有机氮源更利于丝孢酵母的生长和油脂积累,其中,蛋白胨和酵母提取物相比于其他有机氮源在油脂积累方面又更胜一筹。
2.1.3 C/N比
在产油酵母中诱导脂质积累需要氮缺乏机制,培养基中碳源充足、氮源缺乏时,更有利于菌体脂质的积累。
对于T.dermatis,30~130范围内的C/N比对细胞生长的影响并不明显,但脂质浓度随着C/N比从30增加到110而增加,随着C/N比进一步增加而降低,当C/N比为110时,T.dermatis的脂质产量最高,为16.33 g/L[22]。T.fermentans发酵甘蔗渣水解液,随着C/N比的增加,生物量和油脂含量均逐渐增大,在C/N比168时达到最大值,分别为31.7 g/L和41.4%[30]。T.cutaneum利用粗甘油作为碳源,C/N比60时,生物量达到最大值15.07 g/L[31]。一般情况下,高C/N比有利于脂质的积累,但C/N比过高会导致生物量下降。对于丝孢酵母,不同菌种有其最适C/N比,大多在60~110的范围内,而T.dermatis产SCO的最优C/N比相较于同属其它菌种则更高。
2.1.4 无机盐
无机盐是一种矿物质营养素,能调节培养基的pH值和渗透压的大小,有利于油脂积累的稳定性,其中金属离子可参与细胞膜的构成,影响脂肪酶活性,进而影响油脂积累[8]。
培养基中添加适量的K+、Mg2+、Cu2+、Mn2+,有利于T.fermentans CICC1368油脂的积累[12]。Fe3+和Fe2+在保持含油率不变的同时能促进T.cutaneum的生长,从而提高油脂产量[32]。适宜的KH2PO4浓度有利于T.cutaneum的生长和油脂积累,培养基中KH2PO4浓度从0 g/L增加到1.0 g/L时,菌体的生物量和脂质产量均在增加,在1.0 g/L时达到最大值,分别为9.76和3.07 g/L,继续加大浓度,生物量和脂质产量反而降低,说明过多的KH2PO4会抑制其生长和油脂积累[24]。
2.2 接种量
培养基中菌种接种量少,细胞生长量和油脂积累量也低;接种量越大,越有利于细胞生长和油脂积累。不同菌种的最适接种量可能存在差异。
T.mucoides EAM-AC16在5%、10%、15%、20%四个接种量下,生物量随接种量的增加而增大,但油脂产量逐渐降低,当接种量为10%时,其生物量相对低于接种量为20%的生物量,但脂质产量远高于接种量为20%的脂质产量,因此10%为其最佳接种量[33]。T.fermentans HWZ004利用水稻秸秆水解液发酵产油时,最佳接种量为5.0%[12]。T.dermatis以玉米芯酸水解物与大豆油为混合培养基,5.0%的接种量最有利于其细胞生长和脂质积累[21]。T.cutaneum发酵玉米芯酸水解液产油,当接种量为15%时,生物量最高,为23.2 g/L;当接种量为5%时,脂质含量和脂质产量最高,分别为45.0%和9.3 g/L[34]。
2.3 pH值
pH值能影响细胞内多种酶的活性,且可改变细胞膜的通透性,从而对油脂积累产生影响。微生物的生长过程中由于营养物质的分解、代谢产物的积累,培养基的pH也会发生改变,因此在培养基的配制及微生物培养过程中需调节pH值。
T.fermentans基于甘蔗渣水解液发酵产油脂,在pH值5.5~9.0的范围内,能获得较高的生物量和油脂含量,在pH值7.5时达到最大值,分别为33.6 g/L和44.2%[30]。T.cutaneum以玉米芯酸水解物和大豆油为混合培养基,初始pH值在6.0~8.0范围内,产脂量大致相同,说明该菌在这个pH范围内有较高的适应性,初始pH值为6.0时,脂质产量最高[21]。T.cutaneum B3在近乎中性pH(6.0~7.0)条件下,生物量和油脂含量均较高,分别为20 g/L和54%[29]。接近中性的pH值更利于丝孢酵母的生长和油脂积累,过酸或过碱条件下细胞生长会受到一定抑制。
2.4 温度
微生物都有其最适生长温度,温度过高或过低都会影响其正常的生命活动,温度过高可能导致菌体的死亡,温度过低则菌体受到抑制。当温度30 ℃以上时,大多数微生物不饱和脂肪酸的生物合成较低[35]。
T.fermentans在25 ℃时生物量最高(14.3 g/L),28 ℃时脂质产量和脂质含量最高(4.2 g/L和17.2%)[28,31]。T.cutaneum细胞生长和脂质积累的最佳温度为30 ℃,生物量、脂质产量和脂质含量分别为15.0 g/L、4.1 g/L和27.4%[28,31]。T.cutaneum发酵玉米芯酸水解液,从25 ℃到32 ℃,生物量随着温度的升高而缓慢增加,脂质含量在28 ℃时达到最大值35.9%[34]。丝孢酵母大多数菌种生长和油脂积累的温度在25 ℃~30 ℃范围内,具体温度要根据菌种及发酵底物等条件进行确定。
2.5 培养时间
培养时间也会影响菌体生长和油脂积累。培养时间不足,菌体主要处于生长对数期,生长旺盛,但油脂合成较少;培养时间过长,培养基中营养物质基本被消耗殆尽,菌体会消耗油脂来进行自身生长代谢,导致油脂损失,菌体处于衰亡期,最终导致菌体死亡。
Trichosporon sp.JM-B,在48~168 h范围内,各项数值均随时间延长先增加后降低,在144 h时,生物量、油脂产量、油脂含量均达到最大,分别为15.06 g/L、4.85 g/L、32.22%[36]。T.mucoides EAM-AC16培养时间从96 h延长到192 h,生物量和油脂含量均呈先上升后下降的趋势,在144 h达到最大值,分别为15和5 g/L[33]。在最适培养条件下,120 h是Trichosporon sp.F1-2生产油脂的最佳培养时间[27]。
2.6 溶氧量
对于T.oleaginosus,50%~60%的溶解氧水平能促进细胞生长,在脂质生成阶段保持较低的溶解氧浓度(20%~30%),脂质含量最高,达到51%[37]。在摇床发酵培养中,培养基中的溶氧量主要靠摇床速度来控制,摇床速度越快,发酵液中的溶氧量越大,反之则越小[8]。T.cutaneum B3在搭载微孔膜空气分布器后,可在搅拌转速降低为150 r/min时,油脂产率达0.191 g/(L·h)[29]。在适当范围内,溶氧量越高越有利于丝孢酵母细胞生长,而相对较低的溶氧量更有利于油脂积累。应根据不同条件、不同菌种去确定最适溶氧量。
3 丝孢酵母对廉价原料的利用
木质纤维素水解物、工农业废弃物及一些淀粉类原料等廉价原料,含有葡萄糖、木糖等可被丝孢酵母利用的碳源。利用其生产SCO,能降低生产成本,实现大规模生产,保护环境,实现资源的有效利用。
3.1 木质纤维素水解物
木质纤维素属于可再生资源,主要由纤维素、半纤维素和木质素组成,完全水解后可得到大量可溶性单糖(如葡萄糖、木糖)。在木质纤维素原料预处理过程中,通常会产生糠醛、五羟甲基糠醛和乙酸等可能抑制微生物生长的副产物,需对其进行脱毒处理后,再作为碳源用于微生物的发酵产油[12]。
高粱秸秆的组成为:蔗糖34.4%、葡萄糖8.2%、果糖8.1%、纤维素19.6%、半纤维素15.2%,液化处理会使得蔗糖水解,增加水解液中葡萄糖的浓度。利用T.fermentans发酵高粱秸秆,可获得1.97 g/L的脂质产量,产脂率为0.493 g/(L·d),与T.fermentans在糖混合物中产生的脂质相当[11]。T.cutaneum发酵高粱秸秆水解液,补加4%蔗糖,以酵母膏和硫酸铵作为氮源,在28 ℃、150 r/min的最佳发酵条件下,生物量、油脂含量及油脂产量分别为3.256 g/L、37.1%、1.208 g/L[15]。
水稻秸秆水解液中葡萄糖含量较高。T.fermentans发酵水稻秸秆完全水解液,只需添加少量氮源及微量CuSO4·5H2O,在最佳培养条件下,其生物量、油脂含量和油脂产量分别为:26.4 g/L、52.2%和 13.8 g/L[38]。T.mycotoxinivorans发酵未解毒的稻秆水解液(用纤维素酶糖化),添加0.05%的酵母提取物,0.18%的蛋白胨和0.04%的MgSO4,得到5.17 g/L脂质,产脂率为0.06 g/(L·h)[5]。
玉米秸秆水解液中可利用糖为葡萄糖、木糖、阿拉伯糖和纤维二糖。T.dermatis分别利用经稀酸和稀碱预处理的玉米秸秆进行发酵,油脂产量分别为7.46、6.81 g/L[22]。T.cutaneum以经动态脱毒(物料置于15 L生物反应器中,以10%接种量接入脱毒菌种,37 ℃培养至抑制物完全脱除)和静态脱毒(脱毒菌种以10%接种量加入预处理物料中,充分混匀后每隔12 h向盒中喷水,室温放置至抑制物完全脱除)的小麦秸秆发酵时,油脂产量分别达到43.8和55.4 g/L;而以静态脱毒和动态脱毒的玉米秸秆发酵时,油脂产量分别达到45.3和58.4 g/L[39]。
以玉米芯、桉木和松木为原料,经辐照预处理和两步水解法所得的水解液中含有葡萄糖、木糖和阿拉伯糖等糖类,利用T.cutaneum发酵产油,生物量分别为29 g/L、24.6 g/L和23.6 g/L,油脂含量分别为42.52%、37.12%和37.20%[14]。T.oleaginosus利用经碱预处理后的玉米芯水解液发酵产油,该水解液中葡萄糖浓度为81.64 g/L,最终脂质产量为18.97 g/L[19]。
甘蔗渣水解物中主要含有葡萄糖和木糖。T.fermentans发酵甘蔗渣稀酸水解液,最优条件下其生物量和油脂含量分别达到33.7 g/L和44.9%[38]。甘蔗渣分别经高温液态水和碱预处理,再使用纤维素酶进行酶解后进行T.cutaneum的培养,生物量、油脂含量分别可达8.08 g/L、52.00%和13.67 g/L、43.20%[40]。
因来源的不同及水解工艺条件的差异,不同木质纤维素水解液中各单糖含量也不同,导致丝孢酵母在利用其发酵产油时,所得油脂产量也不同。如T.fermentans在水稻秸秆水解液中的产油量优于在高粱秸秆水解液和甘蔗渣水解液中的产油量,主要原因是水稻秸秆水解液中的可发酵性糖(葡萄糖)含量在三者中最高。此外,木质纤维素水解物中都含有一定量的抑制剂,利用不同种的丝孢酵母发酵同种木质纤维素水解物,油脂产量也可能不同。如利用水稻秸秆水解液发酵时,T.fermentans的油脂产量优于T.mycotoxinivorans,利用高粱秸秆水解液和甘蔗渣水解液发酵时,T.fermentans的油脂产量均优于T.cutaneum,可见,T.fermentans对于木质纤维素中的抑制剂耐受性可能更高。丝孢酵母能利用各种木质纤维素水解物生产油脂,但若想提高油脂产量,需解决水解物中抑制剂带来的问题,因此,寻找廉价简便的脱毒技术以及筛选出能更高效抵抗抑制剂的菌种可能会是该领域未来的研究重点。
3.2 工农业废弃物
利用工农业废弃物作为发酵原料,可以缓解其所带来的严重环境威胁。
以木质纤维素为原料生产乙醇的过程中会产生大量的废水,T.cutaneum发酵该废水时生物量和脂质产量分别可达到20.945 g/L和1.56 g/L[13]。纤维素乙醇发酵废水是利用纤维素生产乙醇时,发酵液蒸馏塔中的静液流,含有葡萄糖、木糖、乙酸、乙醇和部分酚类化合物,利用T.cutaneum ACCC 20271对其进行生物转化,在3 L的生物反应器中培养5 d,可积累2.16 g/L的脂质[41]。
我国白酒年产量高,生产过程中会产生大量丢糟,造成资源浪费且污染环境,加大对其综合利用具有重大意义。利用硫酸水解丢槽后,再用T.cutaneum对其进行发酵,油脂含量可达24.86%[42]。而T.cutaneum发酵酶解后的丢槽水解液,可获得0.354 9 g/100 mL的生物量和23.89%的油脂含量[43]。
在添加NH4Cl的生活废水污泥和粗甘油培养基中培养T.oleaginosus,生物量、脂质产量和脂质含量分别达到55.33 g/L、26.98 g/L和48.77%[18]。T.cutaneum能耐受高达13.0%的NaCl,具有高耐盐性能,能在不添加任何碳源、氮源的榨菜废水中生长,并积累2.2 g/L的油脂[44]。利用T.fermentans发酵大豆油废水,废水中的磷脂有助于提高生物量和脂质产量,培养后可获得7.9 g/L的生物量和43%的油脂含量[45]。
工农业废弃物中含大量利于丝孢酵母发酵产油的物质,如纤维素乙醇发酵废水中的糖、有机酸和氮氨等营养物质,大豆油废水中的磷脂等。但废弃物往往成分复杂,其中苯酚是各工业废水中最常见的有机污染物之一,稳定性高且难降解,通常采用的吸附、氧化等去除方法,均不能实现苯酚的降解,而T.cutaneum在发酵榨菜废水时,能在3.5%的盐度条件下耐受1 000 mg/L的苯酚浓度,其生长和油脂产量均不受影响。可见,筛选出能耐受工农业废弃物中抑制剂的菌种具有重大意义。
3.3 淀粉类原料
木薯、菊芋等高淀粉植物,也是生产SCO的优质原料。T.fermentans利用木薯淀粉水解液发酵产油,油脂产量可达到15.01 g/L[46]。利用T.cutaneum发酵菊糖产油脂,在最佳培养条件下,在5 L发酵罐中分批扩大培养,其生物量、油脂含量和油脂产量分别为3.93 g/L、34.73%和4.89 g/L[17]。T.cutaneum利用菊粉为碳源进行发酵产油,在最佳发酵条件下,生物量和油脂产量分别达到13.56 g/L和5.34 g/L,当利用菊芋粉抽提液发酵时,生物量和油脂产量分别为14.25 g/L和5.59 g/L,均高于以菊粉为原料的发酵培养基[47]。
4 丝孢酵母单细胞油脂的应用
油脂合成后进行应用之前,还需对其进行提取。微生物细胞壁结构复杂,是溶剂渗透的屏障,合理的预处理是油脂提取前的关键步骤。常见的预处理方法有:酸热法(利用酸、沸水浴和快速冷冻的交叉作用破坏细胞壁,释放油脂)、研磨法(利用研磨工具破碎细胞,释放油脂)、酶解法(用酶破坏细胞壁,加速油脂释放)、反复冻融法(通过反复冷冻与解冻,利用细胞内的冰晶使细胞壁破裂)、超声波破碎法(利用超声波在液体介质中产生冲击波和局部高温,使细胞破裂)等[48]。总体来说,化学法(酸热法、酶解法)比物理法(研磨法、反复冻融法、超声波破碎法)更加简便快捷,对设备的要求也更低,短时间内可处理大量样品。
油脂提取方法有:有机溶剂萃取法(利用油脂溶于某些溶剂的特性,通过渗透、分子扩散等将油脂提取出来,常用的有机溶剂有乙醚、石油醚、氯仿、正己烷、苯等)、超临界CO2萃取法(采用特定设备产生超临界CO2,以之为载体溶解菌体中的油脂,再分离油脂和超临界CO2,收集油脂)、索氏抽提法(利用溶剂在索氏抽提器中的回流和虹吸来提取油脂)等[48]。相较来说,有机溶剂萃取法应用更广,更适用于油脂的提取,其处理量大、提取率高,生产工艺及设备成熟,是工业化生产中最常用的方法。
目前,丝孢酵母SCO的应用研究主要集中在能源和食品两个领域:
生物柴油属于“绿色能源”,以食用植物油为原料生产生物柴油,属于第一代原料,但因其可能导致食品价格上涨、食用油短缺等,而开发了第二代原料,即废油、动物油、不可食用油等。目前,正在开发基于第三代原料(产油酵母、微藻和细菌)的生物柴油生产技术,此类生物柴油无毒、可生物降解,且能有效缓解食物和能源的竞争关系,具有很好的发展前景[49-50]。T.porosum以乙酸钠为碳源生产脂质,所得脂类中棕榈酸、硬脂酸、油酸、亚油酸占总脂肪酸的90%以上,可作为原料生产生物柴油[23]。T.oleaginosus以纯化甘油为碳源生产SCO,脂肪酸谱表明其可作为生产生物柴油的的原料[26]。T.fermentans发酵精制大豆油废水,所得SCO具有与植物油相似的特性,也可作为生产生物柴油的潜在原料[45]。
丝孢酵母SCO最初是作为生物柴油合成中食用油的替代品来开展研究的,以缓解食物和能源的竞争危机,但近年有研究发现,其可以作为食品功能性脂质的合成原料,并且可通过调节碳源为不同合成目标提供原料[27]:Trichosporon sp.F1-2以木糖为碳源合成的SCO所含的脂肪酸主要为油酸、棕榈酸和亚油酸,其中油酸含量最高,sn-2位含量达到了(70.15±0.26)%,非常适合作为1,3-二硬脂酸-2-油酸甘油三酯(一种可可脂改良剂)的合成原料;而以可溶性淀粉为碳源时,合成的SCO中亚油酸和α-亚麻酸的含量显著增加,sn-2位含量分别达到了44.72%±1.99%和5.22%±0.48%,能作为MLM型结构脂(一种低热量膳食甘油三酯)的合成原料,满足该功能性结构脂sn-2位含较多长链多不饱和脂肪酸为宜的需求。可可脂主要由3种甘油三酯组成,POP(C16∶0-C18∶1-C16∶0)、POS(C16∶0-C18∶1-C18∶0)和SOS(C18∶0-C18∶1-C18∶0),含量分别为14%~16.4%、34.6%~38.3%和23.7%~28.4%,丝孢酵母SCO也含有较高的C16和C18脂肪酸,研究发现,T.oleaginosus在378 mg三酸甘油酯/g干细胞重的水平下可产生14.4%的1,3-二棕榈酰基-2-油酰基甘油、13.4%的1-棕榈酰基-2-油酰基-3-硬脂酰基-甘油和2.0%的1,3-二硬脂酰基-2-油酰基甘油,这表明其在未来经过进一步代谢工程后有潜力成为类可可脂生产原料[51]。
5 展望
目前,培养基的高昂价格仍是限制丝孢酵母SCO实现工业化生产的一大阻碍。利用廉价原料进行发酵产油,是降低生产成本最直接的方法,但这些原料通常成分复杂,一般都含有抑制菌株生长代谢、不利于油脂积累的物质,需对其进行脱毒处理。现阶段的脱毒处理技术仍存在一些不足之处,如:脱毒不完全,水解液中仍会存在抑制物;步骤复杂耗时长,不利于其规模化应用等。因此,需要更高效的原料处理技术,来避免抑制物对丝孢酵母油脂生产效率的负面影响。此外,筛选出能耐受或利用抑制物的菌株,也是一个解决途径。在未来的发展中,开发丝孢酵母发酵产脂的新技术、新设备,筛选更高效的菌株,对于降低生产成本、提高油脂产率及进行工业化生产,具有重要意义。
[1] ABDEL-WAHAB M A, ELGORBAN A M, BAHKALI A H.Single cell oil of oleaginous marine microbes from Saudi Arabian mangroves as a potential feedstock for biodiesel production[J].Journal of King Saud University-Science, 2023, 35(4):102615.
[2] KAMOUN O, AYADI I, GUERFALI M, et al.Fusarium verticillioides as a single-cell oil source for biodiesel production and dietary supplements[J].Process Safety and Environmental Protection, 2018, 118:68-78.
[3] ROBLES-IGLESIAS R, NAVEIRA-PAZOS C, FERN NDEZ-BLANCO C, et al.Factors affecting the optimisation and scale-up of lipid accumulation in oleaginous yeasts for sustainable biofuels production[J].Renewable and Sustainable Energy Reviews, 2023, 171:113043.
NDEZ-BLANCO C, et al.Factors affecting the optimisation and scale-up of lipid accumulation in oleaginous yeasts for sustainable biofuels production[J].Renewable and Sustainable Energy Reviews, 2023, 171:113043.
[4] CHO H U, PARK J M.Biodiesel production by various oleaginous microorganisms from organic wastes[J].Bioresource Technology, 2018, 256:502-508.
[5] SAGIA S, SHARMA A, SINGH S, et al.Single cell oil production by a novel yeast Trichosporon mycotoxinivorans for complete and ecofriendly valorization of paddy straw[J].Electronic Journal of Biotechnology, 2020, 44:60-68.
[6] QIN L, LIU L, ZENG A P, et al.From low-cost substrates to Single Cell Oils synthesized by oleaginous yeasts[J].Bioresource Technology, 2017, 245(Pt B):1507-1519.
[7] 陈玉炜, 聂小安.微生物油脂制取生物燃料研究进展[J].当代化工研究, 2022(5):147-149.CHEN Y W, NIE X A.Research progress of biofuel from microbial oils[J].Modern Chemical Research, 2022(5):147-149.
[8] 陈韵, 钟先锋, 陆丽珠, 等.影响产油酵母菌合成油脂的因素研究现状[J].农产品加工, 2019(21):87-90.CHEN Y, ZHONG X F, LU L Z, et al.Research status of factors affecting the synthesis of oils by oleaginous yeasts[J].Farm Products Processing, 2019(21):87-90.
[9] 陈琳, 钱秀娟, 章晓宇, 等.产油酵母合成微生物油脂的研究现状及展望[J].生物加工过程, 2020, 18(6):732-740.CHEN L, QIAN X J, ZHANG X Y, et al.Microbial lipid production by oleaginous yeasts:A review[J].Chinese Journal of Bioprocess Engineering, 2020, 18(6):732-740.[10] JIN M J, SLININGER P J, DIEN B S, et al.Microbial lipid-based lignocellulosic biorefinery:Feasibility and challenges[J].Trends in Biotechnology, 2015, 33(1):43-54.
[11] ANTONOPOULOU I, SPANOPOULOS A, MATSAKAS L.Single cell oil and ethanol production by the oleaginous yeast Trichosporon fermentans utilizing dried sweet sorghum stalks[J].Renewable Energy, 2020, 146:1609-1617.
[12] 李园园, 吴虹, 黄超, 等.发酵性丝孢酵母HWZ004利用水稻秸秆水解液发酵产油脂[J].生物工程学报, 2011, 27(9):309-316.LI Y Y, WU H, HUANG C, et al.Using rice straw hydrolysate for microbial oil production by Trichosporon fermentans HWZ004[J].Chinese Journal of Biotechnology, 2011, 27(9):309-316.
[13] YAO S M, XIONG L, CHEN X F, et al.Comparative study of lipid production from cellulosic ethanol fermentation wastewaters by four oleaginous yeasts[J].Preparative Biochemistry &Biotechnology, 2021, 51(7):669-677.
[14] 郭莉军. 皮状丝孢酵母直接发酵木质纤维素水解液生产微生物油脂新技术[D].北京:北京化工大学, 2017.GUO L J.New technology of Trichosporon cutaneums’ direct fermentation by lignocellulose hydrolysate production of microbial oils[D].Beijing:Beijing University of Chemical Technology, 2017.
[15] 康静, 王燕, 张亚平.皮状丝孢酵母发酵高粱秸秆水解液产油脂条件研究[J].广州化工, 2015, 43(22):56-58.KANG J, WANG Y, ZHANG Y P.Optimization of fermentation conditions for bio-oil production from sorghum straw hydrolysate by Trichosporon cutaneum fermentation[J].Guangzhou Chemical Industry, 2015, 43(22):56-58.
[16] 沈珺珺, 李富超, 杨庆利, 等.皮状丝孢酵母利用大米草水解液发酵生产微生物油脂[J].海洋科学, 2007, 31(8):38-41.SHEN J J, LI F C, YANG Q L, et al.Fermentation of Spartina anglica acid hydrolysate by Trichosporon cutaneum for microbial lipid production[J].Marine Sciences, 2007, 31(8):38-41.
[17] 汪伦记, 纠敏, 吉艳青, 等.菊芋提取液的皮状丝孢酵母发酵产油脂试验研究[J].中国粮油学报, 2014, 29(9):52-56;64.WANG L J, JIU M, JI Y Q, et al.Lipid production from extract of Jerusalem artichoke tubers by Trichosporon cutaneum[J].Journal of the Chinese Cereals and Oils Association, 2014, 29(9):52-56;64.
[18] CHEN J X, ZHANG X L, TYAGI R D.Impact of nitrogen on the industrial feasibility of biodiesel production from lipid accumulated in oleaginous yeast with wastewater sludge and crude glycerol[J].Energy, 2021, 217:119343.
[19] GRUBI I
I M, GALI
M, GALI PERE
PERE INEC M, PEREMIN I, et al.Optimization of pretreatment conditions and enzymatic hydrolysis of corn cobs for production of microbial lipids by Trichosporon oleaginosus[J].Energies, 2022, 15(9):3208.
INEC M, PEREMIN I, et al.Optimization of pretreatment conditions and enzymatic hydrolysis of corn cobs for production of microbial lipids by Trichosporon oleaginosus[J].Energies, 2022, 15(9):3208.
[20] 谢莹, 吴辰宇, 刘爽, 等.粘性丝孢酵母的诱变及以玉米秸秆水解液为原料产油条件优化[J].基因组学与应用生物学, 2019, 38(2):677-680.XIE Y, WU C Y, LIU S, et al.Mutagenesis of Trichosporon mucoide and optimization of oil production conditions using straw hydrolysate as raw material[J].Genomics and Applied Biology, 2019, 38(2):677-680.
[21] HUANG C, LUO M T, CHEN X F, et al.Combined “de novo” and “ex novo” lipid fermentation in a mix-medium of corncob acid hydrolysate and soybean oil by Trichosporon dermatis[J].Biotechnology for Biofuels, 2017, 10(1):147.
[22] YU Y, XU Z X, CHEN S T, et al.Microbial lipid production from dilute acid and dilute alkali pretreated corn stover via Trichosporon dermatis[J].Bioresource Technology, 2020, 295:122253.
[23] QIAN X J, GORTE O, CHEN L, et al.Continuous self-provided fermentation for microbial lipids production from acetate by using oleaginous yeasts Cryptococcus podzolicus and Trichosporon porosum[J].Renewable Energy, 2020, 146:737-743.
[24] 汪洲, 肖玲玲, 龚大春.皮状丝孢酵母Trichosporon cutaneum产油脂发酵培养基优化[J].农产品加工, 2017(11):9-11.WANG Z, XIAO L L, GONG D C.Optimization of fermentation medium for lipid production from Trichosporon cutaneum[J].Farm Products Processing, 2017(11):9-11.
[25] 刘娟. 皮状丝孢酵母转化木质纤维素糖和醋酸产油脂的研究[D].武汉:武汉科技大学, 2021.LIU J.Study on lipid production from lignocellulosic-derived sugars and acetic acid by Trichosporon cutaneum[D].Wuhan:Wuhan University of Science and Technology, 2021.
[26] CHEN J X, YAN S, ZHANG X L, et al.Chemical and biological conversion of crude glycerol derived from waste cooking oil to biodiesel[J].Waste Management, 2018, 71:164-175.
[27] CAO X, PAN Y Y, WEI W, et al.Single cell oil production by Trichosporon sp.:Effects of fermentation conditions on fatty acid composition and applications in synthesis of structured triacylglycerols[J].LWT, 2021, 148:111691.
[28] LIU L P, HU Y, LOU W Y, et al.Use of crude glycerol as sole carbon source for microbial lipid production by oleaginous yeasts[J].Applied Biochemistry and Biotechnology, 2017, 182(2):495-510.
[29] 汪涯. 形态调控提高皮状丝孢酵母油脂发酵产量及过程机制[D].上海交通大学, 2020.WANG Y.Morphological regulation enhances the oil fermentation yield and process mechanism of Trichosporon cutaneum[D].Shanghai Jiao Tong University, 2020
[30] 李日锋. 基于甘蔗渣水解液的发酵性丝孢酵母发酵产油脂的研究[D].广州:华南理工大学, 2010.LI R F.Study on microbial oil production from bagasse hydrolysate by Trichosporon fermentans[D].Guangzhou:South China University of Technology, 2010.
[31] 胡洋. 油脂酵母利用粗甘油发酵产微生物油脂的研究[D].广州:华南理工大学, 2016.HU Y.Study on the use of crude glycerol for microbial oil fermentation by oleaginous yeasts[D].Guangzhou:South China University of Technology, 2016.
[32] 崔振阳. 金属离子对皮状丝孢酵母油脂发酵的影响及玉米芯残渣生产微生物油脂[D].上海:华东理工大学, 2013.CUI Z Y.Effect of metal ion on lipid fermentation by Trichosporon cautaneum and lipid fermentation using corncob residual[D].Shanghai:East China University of Science and Technology, 2013.
[33] 钟琦, 吴慧昊, 代军飞, 等.响应面法优化油脂酵母发酵产油的影响因子[J].西北民族大学学报(自然科学版), 2016, 37(2):57-64.ZHONG Q, WU H H, DAI J F, et al.Optimization of influencing factors of oil production by oil yeast fermentation by response surface methodology[J].Journal of Northwest University for Nationalities (Natural Science), 2016, 37(2):57-64.
[34] CHEN X F, HUANG C, YANG X Y, et al.Evaluating the effect of medium composition and fermentation condition on the microbial oil production by Trichosporon cutaneum on corncob acid hydrolysate[J].Bioresource Technology, 2013, 143:18-24.
[35] VALDÉS G, MENDONÇA R T, AGGELIS G.Lignocellulosic biomass as a substrate for oleaginous microorganisms:A review[J].Applied Sciences, 2020, 10(21):7698.
[36] 王莉, 宋兆齐, 李慧真, 等.一株丝孢酵母属菌株发酵产油脂的研究[J].中国油脂, 2015, 40(4):84-89.WANG L, SONG Z Q, LI H Z, et al.Lipid production of Trichosporon sp.strain[J].China Oils and Fats, 2015, 40(4):84-89.
[37] ZHANG X L, CHEN J X, WU D, et al.Economical lipid production from Trichosporon oleaginosus via dissolved oxygen adjustment and crude glycerol addition[J].Bioresource Technology, 2019, 273:288-296.
[38] 黄超. 基于木质纤维素水解液的发酵性丝孢酵母发酵产油脂的研究[D].广州:华南理工大学, 2011.HUANG C.Study on lipid fermentation on lignocellulosic hydrolysate by Trichosporon fermentans[D].Guangzhou:South China University of Technology, 2011.
[39] 李园园. 纤维素酶胁迫下超高速离心筛选皮状丝孢酵母及微生物油脂发酵研究[D].上海:华东理工大学, 2020.LI Y Y.Screening Trichosporon cutaneum under cellulase stress by ultra-high speed centrifugation and microbial lipid fermentation[D].Shanghai:East China University of Science and Technology, 2020.
[40] 尚常花, 王闻, 朱顺妮, 等.利用皮状丝孢酵母对甘蔗渣酶解液产油脂的研究[J].中国粮油学报, 2017, 32(7):74-78.SHANG C H, WANG W, ZHU S N, et al.Oil production from enzymatic hydrolysate of sugarcane bagasse by Trichosporon cutaneum[J].Journal of the Chinese Cereals and Oils Association, 2017, 32(7):74-78.
[41] WANG J, HU M S, ZHANG H Z, et al.Converting chemical oxygen demand (COD) of cellulosic ethanol fermentation wastewater into microbial lipid by oleaginous yeast Trichosporon cutaneum[J].Applied Biochemistry and Biotechnology, 2017, 182(3):1121-1130.
[42] 陆步诗, 李新社, 彭发喜.皮状丝孢酵母发酵丢糟水解液的应用研究[J].中国油脂, 2013, 38(8):81-83.LU B S, LI X S, PENG F X.Fermentation of grain distillate hydrolysate by Trichosporon cutaneum[J].China Oils and Fats, 2013, 38(8):81-83.
[43] 李新社, 陆步诗, 曾海波.皮状丝孢酵母在酶法水解丢糟生产微生物油脂中的应用[J].酿酒科技, 2009(12):87-90;92.LI X S, LU B S, ZENG H B.Application of Trichosporon cutaneum in the production of microbial oil by enzymatic hydrolysis of distiller’s grains[J].Liquor-Making Science &Technology, 2009(12):87-90;92.
[44] 孙鲁欢. 高盐胁迫下皮状丝孢酵母的微生物油脂发酵研究[D].上海:华东理工大学, 2021.SUN L H.Study on microbial lipid fermentation of Trichosporon cutaneum under high salt stress[D].Shanghai:East China University of Science and Technology, 2021.
[45] YU D Y, WANG X N, FAN X, et al.Refined soybean oil wastewater treatment and its utilization for lipid production by the oleaginous yeast Trichosporon fermentans[J].Biotechnology for Biofuels, 2018, 11:299.
[46] 艾佐佐. 发酵性丝孢酵母以木薯淀粉基质发酵单细胞油脂研究[D].南昌:江西师范大学, 2012.AI Z Z.Study on single cell oil production using cassava starch as feedstock by Trichosporon fermentans[D].Nanchang:Jiangxi Normal University, 2012.
[47] 贾闪闪. 皮状丝孢酵母发酵菊粉产油脂的研究[D].洛阳:河南科技大学, 2012.JIA S S.Single cell oil production from hydrolysates of inulin by Trichosporon cutaneum[D].Luoyang:Henan University of Science and Technology, 2012.
[48] 李小英, 聂小安, 陈洁, 等.微生物油脂制备生物柴油技术研究现状及发展趋势[J].生物质化学工程, 2015, 49(6):37-44.LI X Y, NIE X A, CHEN J, et al.Research status and development trendency of biodiesel preparation from microbial lipid[J].Biomass Chemical Engineering, 2015, 49(6):37-44.
[49] CAPORUSSO A, DE BARI I, LIUZZI F, et al.Optimized conversion of wheat straw into single cell oils by Yarrowia lipolytica and Lipomyces tetrasporus and synthesis of advanced biofuels[J].Renewable Energy, 2023, 202:184-195.
[50] DI FIDIO N, DRAGONI F, ANTONETTI C, et al.From paper mill waste to single cell oil:Enzymatic hydrolysis to sugars and their fermentation into microbial oil by the yeast Lipomyces starkeyi[J].Bioresource Technology, 2020, 315:123790.
[51] WEI Y J, SIEWERS V, NIELSEN J.Cocoa butter-like lipid production ability of non-oleaginous and oleaginous yeasts under nitrogen-limited culture conditions[J].Applied Microbiology and Biotechnology, 2017, 101(9):3577-3585.