溃疡性结肠炎(ulcerative colitis, UC)是一种慢性炎症性肠病(inflammatory bowel disease, IBD),常伴随有便血、持续性腹泻等症状,严重的UC会表现出结肠远端的大面积溃疡[1]。UC的发病率日益升高,已成为21世纪的全球性医疗问题[2]。临床上常用于UC的治疗药物包括5-氨基水杨酸、皮质类固醇、免疫抑制剂和抗生素等,但这些药物效果有限,且可能会引起高血压、糖尿病等不良反应[3]。因此,需要探索更安全有效的治疗或改善UC的方法。
肠道菌群包含超过300万个基因,被称为“人体第二基因组”[4],对维持体内平衡和免疫系统的发育、成熟等许多代谢过程有重要影响[5]。大量研究表明,UC的发生和进展与肠道菌群的变化密切相关。肠道菌群可以在黏膜上形成屏障,降低肠道通透性,增强黏膜上皮的防御机制[6],其产生的短链脂肪酸(short-chain fatty acids,SCFAs)也可以调节肠道炎症[7]。此外,肠道菌群的失调会导致肠道有害病原体的增加,从而导致肠道炎症的发生[8]。因此,维持肠道菌群平衡是预防和治疗UC的重要手段之一。
苹果为蔷薇科苹果属植物,富含多酚、维生素、类黄酮、膳食纤维等多种营养物质,具有抗氧化、抗癌、预防心脑血管疾病及其他慢性病等作用[9]。苹果发酵物是以苹果为原料,利用微生物的发酵作用经一系列代谢反应后得到的苹果加工产品,其营养丰富且具有良好的抗氧化活性[10]。本研究使用酵母菌、植物乳杆菌和醋酸菌对苹果进行发酵并探究发酵物的体外抗氧化能力,之后采用质量分数为2.5%葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导建立UC小鼠模型,通过测定SCFAs含量及16S rRNA高通量测序探究苹果发酵物对DSS诱导UC小鼠肠道菌群的影响,从而阐明苹果发酵物在预防和治疗UC方面的潜力。
1 材料与方法
1.1 材料
1.1.1 实验动物
24只SPF级雄性C57BL/6小鼠,7~9周龄,体质量18~22 g,购于成都达硕实验动物有限公司,许可证号:SCXK(川)2020-030。饲养环境:20~24 ℃、相对湿度50%~60%,12 h交替光照,自由摄食饮水。本研究中所有动物实验程序均经过成都达硕实验动物有限公司实验动物伦理委员会(CDDOSSY202 209-001)批准。
1.1.2 材料与试剂
苹果发酵物的制备:选用陕西省优质秦冠苹果为主要原料,将清洗并干燥后的苹果果实去核、破碎,放入不锈钢发酵器中。向其中加入0.3 kg/t果胶酶后在50 ℃下酶解3 h。取等量酶解得到的苹果果浆分别接种质量分数为0.1%的酵母菌(Saccharomyces cerevisiae)与0.01%的植物乳杆菌(Lactobacillus plantarum),于30 ℃发酵72 h,之后向酵母菌发酵液中加入质量分数为3%的醋酸菌(Acetobacter pasteurianus)并在30 ℃喷淋发酵10 min。将两种发酵物按质量比1∶1混合后进行三级过滤,得到苹果发酵物。
超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒、人尿粪隐血测试盒,南京建成生物工程研究所;ABTS阳离子自由基清除能力检测试剂盒、DPPH、DSS(36~50 kDa,≥98%)、苏木精-伊红(hematoxylin-eosin, HE),北京索莱宝公司;质量分数为0.9% NaCl溶液,山东科伦药业公司;乙醇、甲醇、乙醚、二甲基亚砜(dimethyl sulfoxide, DMSO)、多聚甲醛、硫酸(分析纯),SCFAs(乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸)为色谱纯,上海阿拉丁生化科技有限公司。
1.1.3 仪器与设备
VictorX3多功能酶标仪,美国PerkinElmer公司;Z216MK低温高速离心机,德国HERMLE公司;BDS3000倒置显微镜,重庆奥特光学仪器有限公司;MD200-1氮吹仪,杭州奥盛仪器有限公司;GC-2014C气相色谱仪,日本岛津公司;DB-FFAP气相色谱柱,美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 苹果果浆和苹果发酵物体外抗氧化能力的测定
SOD活性和ABTS阳离子自由基清除能力使用对应试剂盒进行检测,按照说明书进行操作。
DPPH自由基清除能力的测定方法参照文献[11]并有所修改。配制体积比为3∶2的甲醇与DMSO混合溶液,用其配制0.02 mmol/L DPPH溶液,并将样品用甲醇混合液分别稀释至0.1、0.02、0.01、0.005和0.002 g/mL。将150 μL DPPH溶液与150 μL各浓度样品混合(A1),室温下避光反应30 min,将DPPH溶液与相同体积的甲醇混合液混合(A0),以样品和甲醇混合液的混合物作为空白对照(A2)。测定各组在517 nm处的吸光度值。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
1.2.2 动物模型建立及给药
适应性饲养小鼠7 d后将其随机分为3组:空白组(CK组),模型组(DSS组),苹果发酵物组(AF组)。如图1所示,第1~14天,每日按照15 mL/kg剂量对CK组和DSS组小鼠灌胃生理盐水、对AF组灌胃苹果发酵物。连续灌胃两周后,给予DSS组和AF组小鼠含2.5% DSS(质量分数)的饮用水持续7 d,以诱导UC模型,同时AF组给予等体积的苹果发酵物,CK组给予等体积的生理盐水。
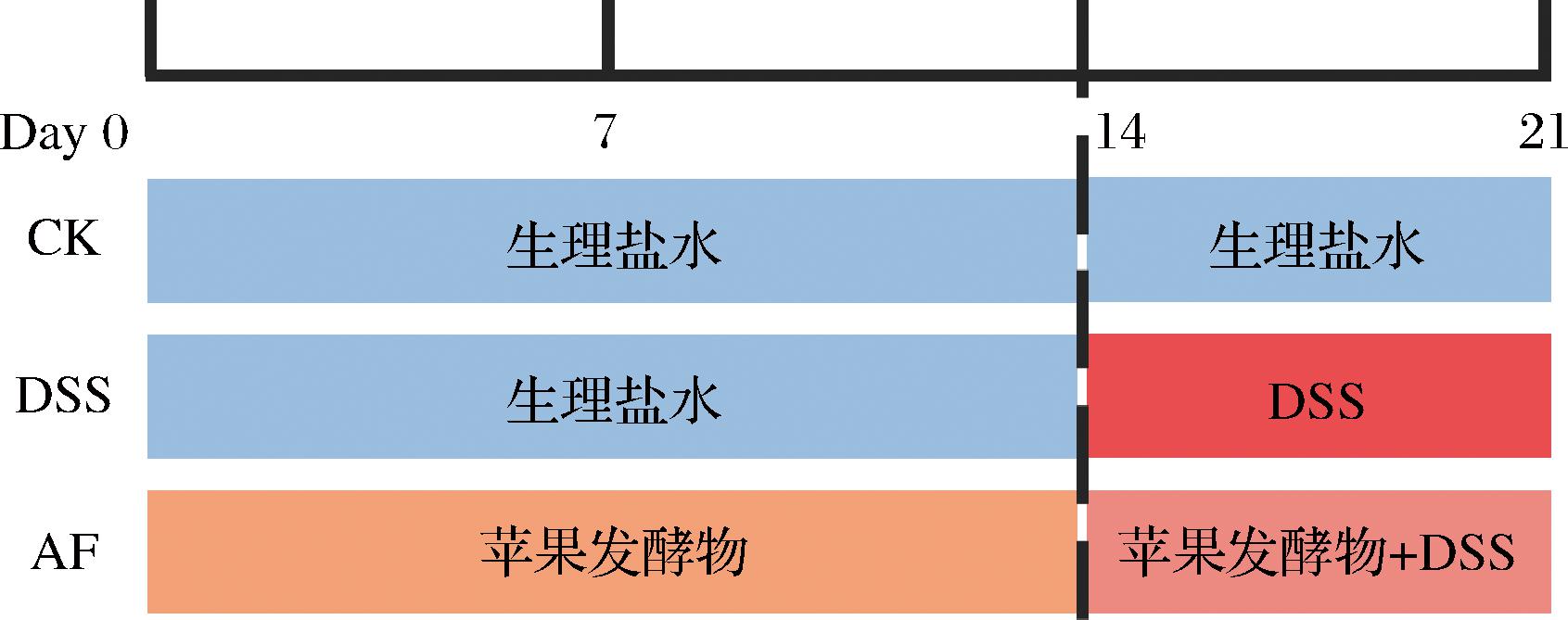
图1 动物分组及给药方案
Fig.1 Schematic diagram of animal grouping and administration
1.2.3 生理指标观察与样品采集
给药期间,每日观察小鼠的精神状况、活动能力和食欲等一般状况,记录小鼠、体质量变化、粪便黏稠度、便血情况等,参考李鹤年等[1]的方法对各组小鼠疾病活动指数(disease activity index,DAI)进行评分,DAI评分为体质量变化率、粪便性状和便血情况3个指标评分的平均值。末次给药后,小鼠禁食不禁水12 h,并在此时收集各组小鼠新鲜粪便存于-80 ℃冰箱备用。颈椎脱臼法处死小鼠后,剖取收集结肠组织,取约1 cm完好的结肠肠段,迅速放入质量分数4%多聚甲醛固定液中静置48 h,待做石蜡组织切片。剩余结肠组织标本使用液氮迅速冷冻并研磨后,于-80 ℃冰箱冻存。
1.2.4 结肠的组织病理学分析
取上述多聚甲醛固定的各组小鼠病灶部位的结肠组织进行常规石蜡包埋切片,对其进行HE染色后于显微镜下观察结肠组织病变情况。参照WIRTZ等[12]的方法对结肠损伤程度进行组织学定量评分。
1.2.5 粪便SCFA含量的测定
向200 mg各组小鼠粪便样品中加入1 mL超纯水后混匀。向其中加入0.15 mL体积分数为50% H2SO4溶液,混匀后加入1.6 mL乙醚,置于冰上并剧烈振荡20 min,之后在1 500 r/min下离心10 min。吸取1 mL上层醚液于洁净离心管中,置于冰上并用氮吹仪将溶液浓缩至0.2 mL后待测。取乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸(色谱纯)6种SCFA标准品,用乙醚(色谱纯)制备1.0、0.5、0.1、0.05、0.025、0.012 5 μL/mL系列标准溶液。
气相色谱分析条件如下:使用DB-FFAP色谱柱(30 m×0.32 mm, 0.5 μm),进样口温度250 ℃,进样体积2 μL,载气N2,吹扫流量2.0 mL/min,分流比10∶1;程序升温参数为初始温度50 ℃,保持1 min后以15 ℃/min的速率升温至120 ℃,再以5 ℃/min的速率升温至170 ℃,最后以15 ℃/min的速率升温至220 ℃,维持5 min;氢火焰离子化检测器的温度为270 ℃。
1.2.6 粪便肠道菌群的分析
样本DNA的提取和测试工作由深圳华大基因股份有限公司完成。使用MagPure Stool DNA KF kit B试剂盒提取每组粪便样品的总DNA,并使用Qubit荧光仪和Qubit dsDNA BR试剂盒对DNA进行荧光定量分析,通过1%琼脂糖凝胶电泳试验检测DNA质量。之后借助PCR引物341F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增样品16S rRNA的V3-V4可变区,使用AMpure XP磁珠纯化PCR产物。通过Agilent 2100生物分析仪对文库进行质量评估后,在Illumina MiSeq平台上进行2×300 bp的双端基因测序。采用UPARSE软件对原始测序数据在97%相似度下进行操作分类单元(operational taxonomic units, OTU)聚类分析,并基于OTU水平进行α多样性分析、β多样性分析和菌群的物种组成分析。
1.2.7 数据的统计分析
所有实验数据以平均值±标准差表示,使用SPSS 25和Microsoft Excel 2016进行数据分析与作图,用单因素方差分析(ANOVA)及邓肯多重检验进行组间差异性分析,P<0.05表示有统计学差异。
2 结果与分析
2.1 苹果发酵物的体外抗氧化能力
如图2-a所示,苹果发酵物的SOD活性达到198.45 U/mL,比苹果果浆提高了36.59%。图2-b和图2-c表明,在检测的稀释倍数范围内,苹果发酵物的DPPH和ABTS阳离子自由基清除率均随着样品浓度的增加而增大。当样品质量浓度超过0.01 g/mL时,苹果发酵物的DPPH自由基清除率显著高于苹果果浆,而苹果发酵物的ABTS阳离子自由基清除率始终高于苹果果浆。这些结果表明,一定浓度的苹果发酵物具有良好的体外抗氧化能力。

a-SOD活性;b-DPPH自由基清除率;c-ABTS阳离子自由基清除率
图2 苹果果浆和苹果发酵物的体外抗氧化能力
Fig.2 The in vitro antioxidant activity of apple pulp and apple fermentation
注:与苹果果浆组相比##P<0.01。
2.2 苹果发酵物对结肠炎小鼠一般状况和DAI评分的影响
给药期间对小鼠一般状况的观察显示,CK组小鼠精神、活动能力和饮食正常,DSS组小鼠从第3天起活动能力减弱、摄食量减少,AF组小鼠的上述症状有所缓解。小鼠体质量变化如图3-a所示,自第3天起DSS组小鼠体质量与对照组相比明显下降(P<0.05),AF组小鼠体质量与对照组相比较低,但比DSS组下降幅度小且从第5天起与DSS组有显著性差异(P<0.05)。如图3-b所示,除对照组外所有小鼠的DAI评分呈上升趋势。DSS组小鼠DAI评分明显高于CK组(P<0.05),并在第6天出现便血现象,而AF组小鼠DAI评分明显低于DSS组(P<0.05)。结果表明,DSS诱导的结肠炎模型构建成功,且苹果发酵物对UC小鼠的症状有一定的缓解作用。
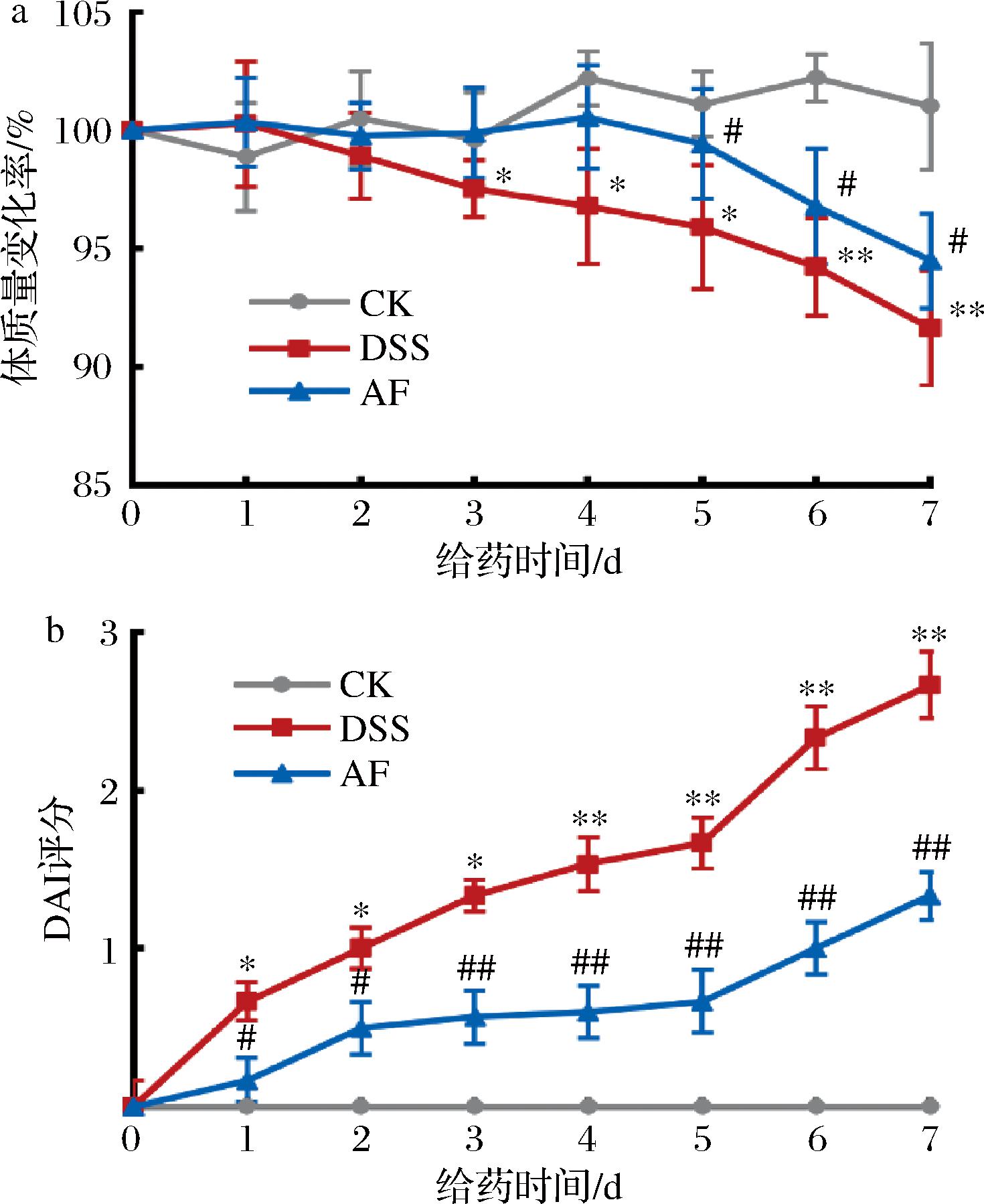
a-体质量变化率;b-DAI评分
图3 苹果发酵物对结肠炎小鼠体质量和DAI评分的影响
Fig.3 Effects of apple fermentation on body mass and disease activity index score of UC mice
注:与CK组相比,*-P<0.05,**-P<0.01;与DSS组相比,#-P<0.05,##-P<0.01(下同)。
2.3 苹果发酵物对结肠炎小鼠结肠组织病理损伤的影响
如图4-a所示,CK组小鼠结肠黏膜和隐窝结构完整,未见溃疡;DSS组小鼠结肠组织结构明显损伤,部分区域溃烂,隐窝结构缺失,黏膜层炎症细胞浸润明显;AF组小鼠结肠组织完整性较好,与DSS组相比仅有少量炎症细胞浸润。结合图4-b各小组结肠组织学评分可知,苹果发酵物对UC小鼠结肠结构有一定改善作用,可减轻小鼠结肠组织的损伤程度。
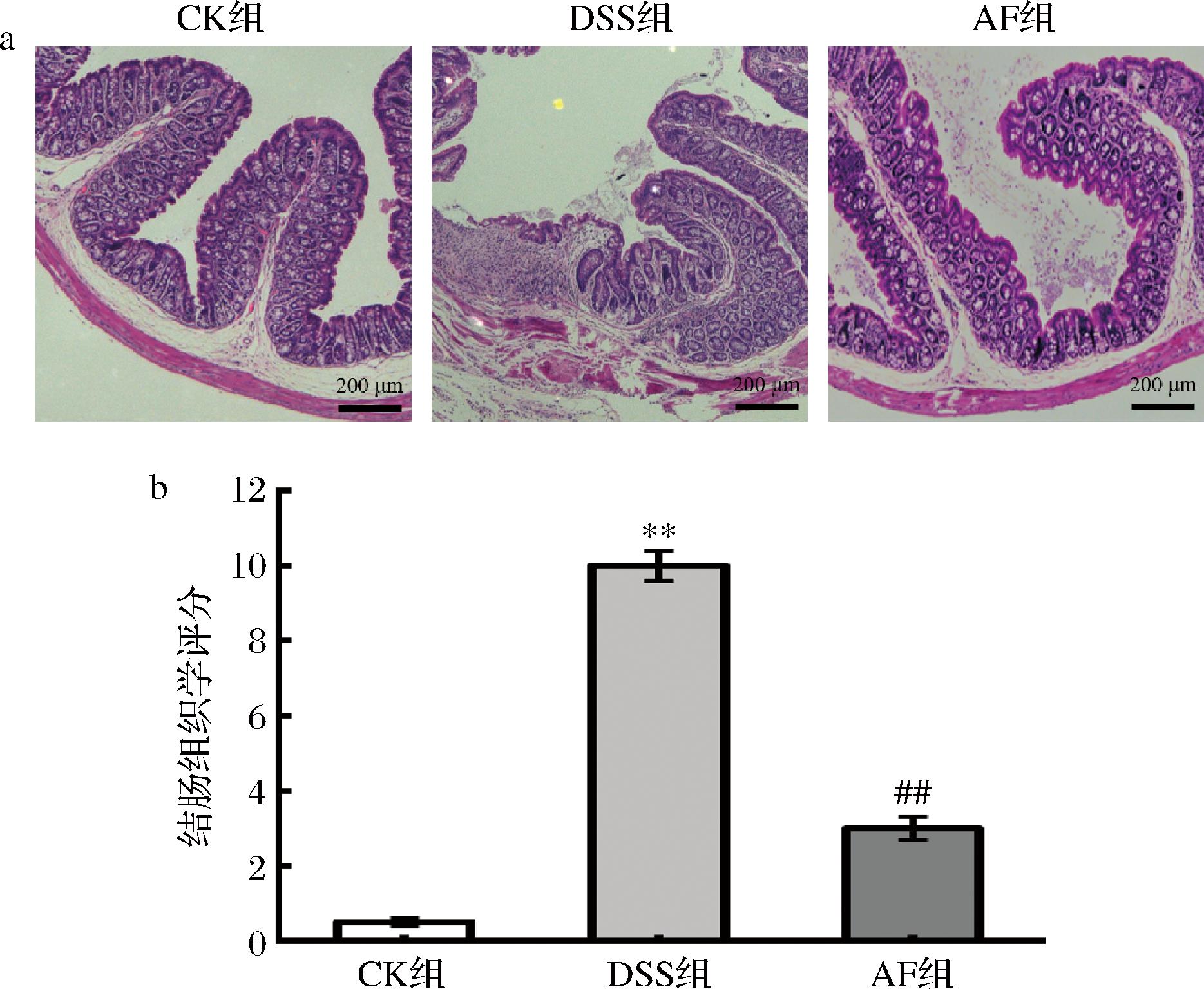
a-结肠组织HE染色;b-结肠组织学评分
图4 苹果发酵物对结肠炎小鼠结肠组织病理损伤的影响
Fig.4 Effects of apple fermentation on colon histopathological damage of UC mice
2.4 苹果发酵物对结肠炎小鼠粪便中SCFA的影响
SCFA是肠道微生物的重要代谢产物,其含量与肠道健康密切相关,表1反映了苹果发酵物对UC小鼠粪便中几种主要SCFA含量的影响。与CK组相比,DSS处理会降低小鼠粪便中SCFA的含量,其中乙酸、异丁酸、戊酸和总SCFA的含量下降明显(P<0.05)。AF组小鼠粪便中SCFA含量相较于DSS组均有所提升,其中乙酸、丙酸和总SCFA含量的变化极显著(P<0.01),异丁酸、丁酸、异戊酸和戊酸的含量也明显增加(P<0.05)。结果表明,苹果发酵物能减少UC小鼠粪便中SCFA含量的下降,从而对缓解小鼠肠道炎症有一定积极作用。
表1 小鼠粪便中的SCFA含量 单位:mg/g Table 1 Concentration of SCFAs in mice feces

组别乙酸丙酸异丁酸丁酸异戊酸戊酸总SCFACK1.089±0.0040.323±0.0430.063±0.0030.160±0.0140.056±0.0080.054±0.0161.745±0.062DSS0.677±0.018∗∗0.261±0.0290.049±0.006∗0.156±0.0160.052±0.0180.038±0.006∗1.232±0.094∗∗AF1.081±0.060##0.533±0.023##0.068±0.002#0.234±0.067#0.064±0.022#0.053±0.008#2.033±0.182##
注:与CK组相比*-P<0.05,**-P<0.01;与DSS组相比#-P<0.05,##-P<0.01(下同)。
2.5 苹果发酵物对结肠炎小鼠肠道菌群的影响
2.5.1 肠道菌群α、β多样性分析
单个样本的物种多样性可由α多样性表示,其中Chao1和Ace指数反映了微生物群落的丰富度,Shannon指数反映了微生物群落的多样性,Coverage指数反映了样本文库的覆盖率。如表2所示,所有样本的Coverage指数均>0.998,说明测序结果可以反映样本的真实情况。与CK组相比,DSS组的Chao1和Ace指数均显著性降低(P<0.05),AF组的Chao1和Ace指数较DSS组有所升高但无显著性差异(P>0.05)。各组的Shannon指数均无显著性差异(P>0.05)。结果表明,苹果发酵物可以在一定程度上改善UC小鼠肠道菌群的物种多样性。
表2 小鼠肠道菌群的α多样性
Table 2 α-Diversity of gut microbiota in mice

组别Chao1AceShannonCoverageCK389.30±38.20394.71±16.203.19±0.550.999 1DSS309.70±28.12∗308.99±34.10∗2.35±0.500.998 7AF351.64±46.18323.22±54.262.37±0.760.998 4
β多样性用于分析不同样本间菌群结构的相似性,基于unweighted UniFrac距离进行主坐标分析(principal coordinates analysis,PCoA),距离越近表示样本相似度越高。如图5所示,CK组与DSS组之间相距较远,表示二者的菌群结构明显不同;而AF组与DSS组完全分离,且向CK组接近。这表明苹果发酵物能改善UC小鼠肠道菌群的物种组成,使其与CK组更为相似。
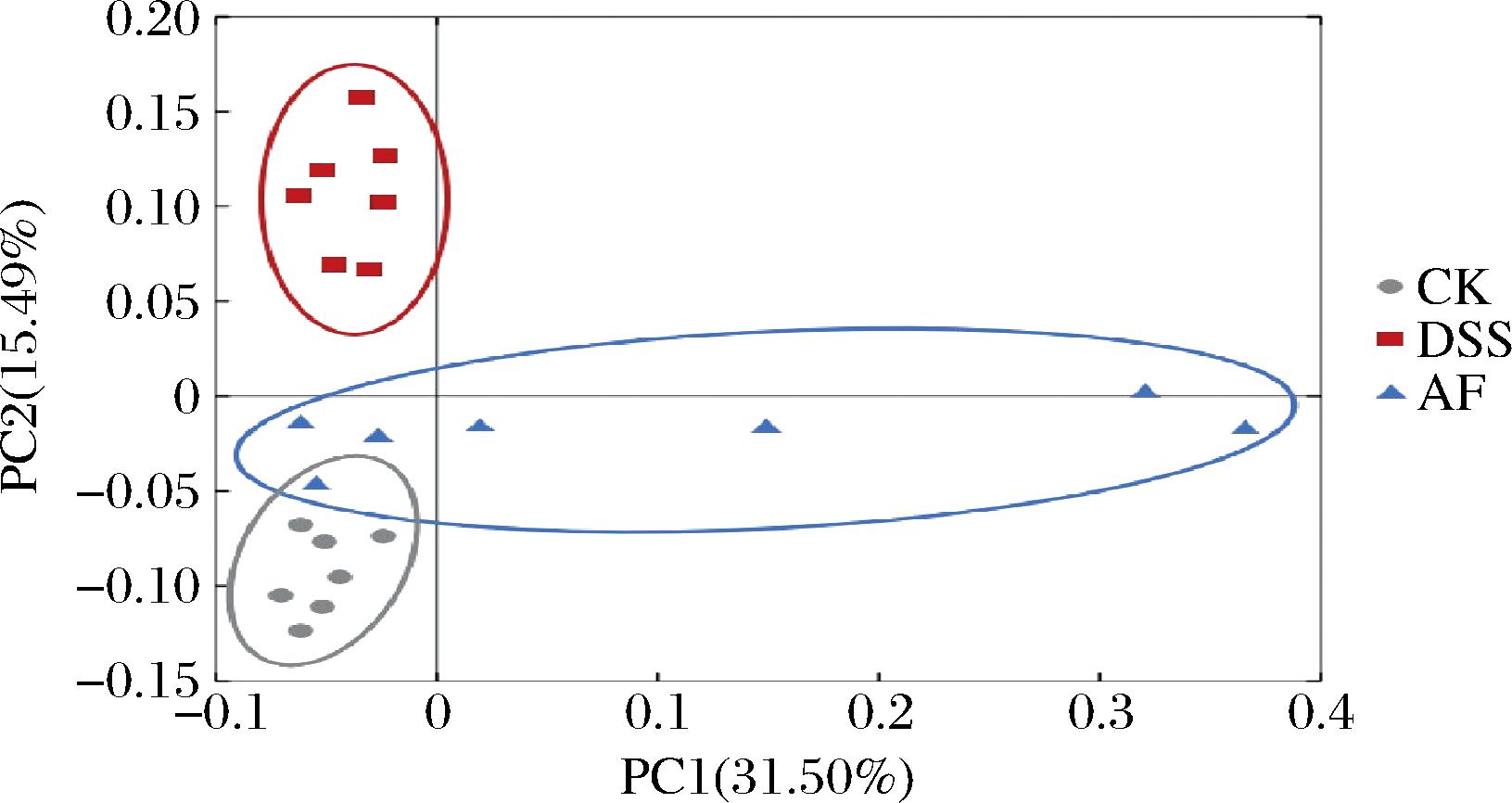
图5 小鼠肠道菌群的PCoA图
Fig.5 PCoA plot of gut microbiota in mice
2.5.2 肠道菌群的物种组成
如图6-a所示,在门水平上,各组厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的相对丰度总和均超过65%,为各组优势菌门。

a-门水平相对丰度;b-属水平相对丰度;c-属水平热图;d-标志菌群的LDA分数
图6 小鼠肠道菌群的物种组成
Fig.6 Species composition of gut microbiota in mice
与CK组相比,DSS组中厚壁菌门的相对丰度有所增加,而拟杆菌门的相对丰度显著下降(P<0.05)。与DSS组相比,AF组厚壁菌门的相对丰度显著降低,拟杆菌门的相对丰度显著增加(P<0.05)。如图6-b所示,在属水平上,与CK组相比,DSS组中乳杆菌属(Lactobacillus)的相对丰度显著下降,链球菌属(Streptococcus)的相对丰度显著增加(P<0.05)。与DSS组相比,AF组显著增加了乳杆菌属、韦荣氏球菌属(Veillonella)和拟杆菌属(Bacteroides)的相对丰度,显著降低了链球菌属的相对丰度(P<0.05)。
此外,在属水平上进行了群落组分相似度的物种组成热图统计分析,如图6-c所示。CK组、AF组与DSS组小鼠的肠道菌群结构之间存在明显差异,而AF组与CK组的优势菌群结构更相似,进一步证明苹果发酵物干预后UC小鼠的肠道菌群物种组成更接近CK组。
采用线性判别分析以进一步确定各组小鼠肠道中具有显著性差异的标志菌群(LDA>2, P<0.05),如图6-d所示。CK组中富集粪球菌属(Coprococcus)、理研菌科(Rikenellaceae)及理研菌属(Rikenella)。DSS处理后小鼠肠道的标志菌群发生改变,链球菌属、Desulfovibrio、Turicibacter等在DSS组中富集。AF组中的标志菌群为拟杆菌属和韦荣氏球菌属等。以上结果说明苹果发酵物干预可以改变UC小鼠肠道菌群的物种组成。
3 讨论
UC是IBD的一种常见类型,近年来UC的发病率在全球范围内急剧增加。多项研究表明,食物中的多酚、多糖和膳食纤维等活性物质,可以对免疫反应、肠道的屏障功能和肠道菌群产生积极作用,并进一步改善UC的损伤症状[13]。苹果富含多种营养物质,其发酵物也被证明富含SOD、纤维素酶、淀粉酶等功效酶,同时具有一定的清除DPPH、ABTS、超氧阴离子、羟基等自由基的能力[14]。因此,本研究采用质量分数为2.5% DSS诱导建立UC小鼠模型,研究苹果发酵物干预对UC小鼠的预防和治疗效果,并通过16S rRNA高通量测序分析苹果发酵物对UC小鼠肠道菌群的影响。
研究表明,氧化应激对肠道炎症的发生有重要影响[15]。本研究通过SOD活性、DPPH和ABTS阳离子自由基清除率评估苹果发酵物的体外抗氧化活性,结果表明发酵显著提高了苹果的抗氧化能力,可能会有助于缓解肠道炎症中的氧化应激反应。动物实验结果表明,DSS处理后UC小鼠的活动能力减弱、摄食量减少、体质量显著降低、DAI评分显著升高并出现便血症状,结肠组织结构明显损伤、大量炎症细胞浸润。经苹果发酵物干预后,UC小鼠的以上症状得到显著改善,说明苹果发酵物对于防治UC具有潜在的应用前景。
多项研究表明,肠道菌群在UC的产生和治疗中具有重要作用,其组成和代谢产物都会影响肠道健康,肠道菌群失调是引起UC的重要原因之一[6-7]。拟杆菌门的减少会导致肠道慢性炎症和代谢功能障碍,从而使肠道屏障受损[16]。厚壁菌门/拟杆菌门(Firmicutes/Bacteroidetes, F/B)的变化是肠道菌群紊乱的重要标志,有研究表明F/B值的下降会引起IBD患者的DAI评分增加[17]。在本研究中,与CK组相比,DSS组小鼠肠道菌群的α多样性降低、菌群结构发生变化,厚壁菌门的相对丰度无明显变化而拟杆菌门的相对丰度显著下降。经苹果发酵物干预后,肠道菌群的α多样性和菌群结构有所改善,且F/B值显著降低。这一发现与LUO等[18]用半夏泻心汤治疗UC小鼠的现象一致。这表明苹果发酵物可改善UC小鼠肠道中微生物群落的丰富度和多样性,缓解肠道菌群的紊乱,从而增强对不良环境的抵抗力。
在属水平上,DSS处理显著降低了乳杆菌属等益生菌的相对丰度,显著增加了链球菌属等机会致病菌的相对丰度。链球菌属、Desulfovibrio、Turicibacter等是DSS组的标志菌群,研究表明,链球菌属丰度的升高与代谢综合征和结肠癌的发生密切相关[19],Desulfovibrio可将硫酸盐转化成具有细胞毒性的硫化物,常在UC患者的肠道中被检出[20],Turicibacter与肥胖和糖尿病等的发展有关[21]。在苹果发酵物干预后,上述致病菌或机会致病菌的相对丰度显著下降,乳杆菌属、韦荣氏球菌属和拟杆菌属的相对丰度显著上升。乳杆菌属能通过加强肠道屏障和抑制促炎因子分泌缓解结肠炎症[22];拟杆菌属和韦荣氏球菌属是AF组的标志菌群,拟杆菌属与免疫失调相关,韦荣氏球菌属产丙酸和丁酸[23],均对肠道健康有积极影响。苹果发酵物富含多种益生菌,能抑制病原微生物增殖并保护肠道健康[24],其含有的活性肽、多糖、多酚等活性成分也能通过调节NF-κB、Wnt/β-Catenin等信号通路以维持肠道屏障的完整性、缓解肠道菌群失调[25-27],从而在预防和治疗UC方面发挥积极作用。
SCFAs是肠道微生物的代谢产物,可参与机体的免疫调节、保持肠道屏障完整、调节细胞因子的分泌等。肠道中含量最高的SCFA通常为乙酸、丙酸和丁酸,对肠道炎症有重要影响:乙酸可改善由上皮细胞介导的肠道屏障功能,从而防止宿主感染[28];丙酸可激活肠道糖异生从而维持体重平衡[29];丁酸已被证明是肠上皮细胞维持肠道屏障的必需能量来源,同时可改善菌群结构,并减少炎症因子的表达[30]。本实验结果表明,苹果发酵物处理显著增加了UC小鼠粪便中乙酸、丙酸、丁酸等SCFAs的含量,邓梅等[31]使用乌鸡肽灌胃UC小鼠后也发现了类似现象。结合前文对肠道菌群组成的分析,AF组中拟杆菌门、乳杆菌属和韦荣氏球菌属的相对丰度较DSS组显著上升。拟杆菌门为小鼠肠道菌群的优势菌门,主要产乙酸和丙酸,乳杆菌属以产乙酸为主[32],韦荣氏球菌属能将乳酸转化为丙酸和丁酸[23]。故苹果发酵物通过上调产酸菌的丰度显著增加了UC小鼠粪便中多种SCFAs的含量,从而缓解了肠道炎症。
4 结论
苹果发酵物可以缓解由DSS诱导引起的活动能力减弱、食欲降低、体质量减轻、便血、结肠组织损伤等UC相关症状,其作用机制可能与提高肠道菌群的多样性及丰度、调节肠道菌群及其代谢产物SCFAs的组成结构有关。本研究有助于苹果加工产品的开发与利用,同时为防治UC提供了新思路。今后需进一步探究苹果发酵物的特定成分在调节肠道菌群中的作用机制。
[1] 李鹤年, 胡雨嘉, 张弛, 等.鳗鱼皮胶原蛋白水解物对结肠炎的改善作用[J].中国食品学报, 2023, 23(4):96-105.LI H N, HU Y J, ZHANG C, et al.The effect of collagen hydrolysate of eel skin on the improvement of colitis[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(4):96-105.
[2] NG S C, SHI H Y, HAMIDI N, et al.Worldwide incidence and prevalence of inflammatory bowel disease in the 21 st century:A systematic review of population-based studies[J].The Lancet, 2018, 390(10114):2769-2778.
[3] LI L Y, QIU N, MENG Y Q, et al.Preserved egg white alleviates DSS-induced colitis in mice through the reduction of oxidative stress, modulation of inflammatory cytokines, NF-κB, MAPK and gut microbiota composition[J].Food Science and Human Wellness, 2023, 12(1):312-323.
[4] ZHANG L, WANG X Z, ZHANG X.Modulation of intestinal flora by dietary polysaccharides:A novel approach for the treatment and prevention of metabolic disorders[J].Foods, 2022, 11(19):2961.
[5] CAMMAROTA G, IANIRO G, CIANCI R, et al.The involvement of gut microbiota in inflammatory bowel disease pathogenesis:Potential for therapy[J].Pharmacology &Therapeutics, 2015, 149:191-212.
[6] GEVERS D, KUGATHASAN S, DENSON L A, et al.The treatment-naive microbiome in new-onset Crohn’s disease[J].Cell Host &Microbe, 2014, 15(3):382-392.
[7] TAN J, MCKENZIE C, POTAMITIS M, et al.The role of short-chain fatty acids in health and disease[J].Advances in Immunology, 2014, 121:91-119.
[8] WANG J J, ZHU G N, SUN C, et al.TAK-242 ameliorates DSS-induced colitis by regulating the gut microbiota and the JAK2/STAT3 signaling pathway[J].Microbial Cell Factories, 2020, 19(1):158.
[9] 王虎玄, 柯西娜, 王聪, 等.苹果酵素的制备及其抗氧化功能研究[J].陕西科技大学学报, 2023, 41(3):37-46.WANG H X, KE X N, WANG C, et al.Study on preparation and antioxidant function of apple enzyme[J].Journal of Shaanxi University of Science &Technology, 2023, 41(3):37-46.[10] 杨小幸, 周家春, 陈启明, 等.苹果酵素天然发酵过程中代谢产物的变化规律[J].食品科学, 2017, 38(24):15-19.YANG X X, ZHOU J C, CHEN Q M, et al.Changes in metabolites during natural fermentation of apple into enzyme drink[J].Food Science, 2017, 38(24):15-19.
[11] 许先猛, 董文宾, 张增帅, 等.苹果渣多酚大孔树脂分离及抗氧化性研究[J].中国食品添加剂, 2014(1):140-146.XU X M, DONG W B, ZHANG Z S, et al.Study on apple ponce polyphenols separation by macroporus resin and its antioxidation activities[J].China Food Additives, 2014(1):140-146.
[12] WIRTZ S, NEUFERT C, WEIGMANN B, et al.Chemically induced mouse models of intestinal inflammation[J].Nature Protocols, 2007, 2(3):541-546.
[13] GE H F, CAI Z Z, CHAI J L, et al.Egg white peptides ameliorate dextran sulfate sodium-induced acute colitis symptoms by inhibiting the production of pro-inflammatory cytokines and modulation of gut microbiota composition[J].Food Chemistry, 2021, 360:129981.
[14] 张海燕, 康三江, 张芳, 等.发酵条件对苹果酵素品质及生物活性的影响[J].食品工业, 2021, 42(6):163-168.ZHANG H Y, KANG S J, ZHANG F, et al.Effect of fermentation conditions on qualities and biological activities of apple enzyme[J].The Food Industry, 2021, 42(6):163-168.
[15] ZHU H, LI Y R.Oxidative stress and redox signaling mechanisms of inflammatory bowel disease:Updated experimental and clinical evidence[J].Experimental Biology and Medicine, 2012, 237(5):474-480.
[16] CHEN X Y, ZHAO H Y, LU Y J, et al.Surfactin mitigates dextran sodium sulfate-induced colitis and behavioral disorders in mice by mediating gut-brain-axis balance[J].Journal of Agricultural and Food Chemistry, 2023, 71(3):1577-1592.
[17] KIM D Y, LEE T S, JUNG D H, et al.Oral administration of Lactobacillus sakei CVL-001 improves recovery from dextran sulfate sodium-induced colitis in mice by microbiota modulation[J].Microorganisms, 2023, 11(5):1359.
[18] LUO Y T, FU S, LIU Y L, et al.Banxia Xiexin decoction modulates gut microbiota and gut microbiota metabolism to alleviate DSS-induced ulcerative colitis[J].Journal of Ethnopharmacology, 2024, 326:117990.
[19] ZENG H W, ISHAQ S L, ZHAO F Q, et al.Colonic inflammation accompanies an increase of β-catenin signaling and Lachnospiraceae/Streptococcaceae bacteria in the hind gut of high-fat diet-fed mice[J].The FASEB Journal, 2016, 30:1166.4.
[20] FITE A, MACFARLANE G T, CUMMINGS J H, et al.Identification and quantitation of mucosal and faecal desulfovibrios using real time polymerase chain reaction[J].Gut, 2004, 53(4):523-529.
[21] WANG Y L, SONG X, WANG Z J, et al.Effects of pine pollen polysaccharides and sulfated polysaccharides on ulcerative colitis and gut flora in mice[J].Polymers, 2023, 15(6):1414.
[22] WANG W, CHEN L P, ZHOU R, et al.Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J].Journal of Clinical Microbiology, 2014, 52(2):398-406.
[23] MIAO M, SHI Y Q, LI Y X, et al.Non-digestible galactomannan oligosaccharides from Cassia seed gum modulate microbiota composition and metabolites of human fecal inoculum[J].Journal of Functional Foods, 2021, 86:104705.
[24] COUSIN F J, LE GUELLEC R, SCHLUSSELHUBER M, et al.Microorganisms in fermented apple beverages:Current knowledge and future directions[J].Microorganisms, 2017, 5(3):39.
[25] HE D, ZENG W, WANG Y, et al.Isolation and characterization of novel peptides from fermented products of Lactobacillus for ulcerative colitis prevention and treatment[J].Food Science and Human Wellness, 2022, 11(6):1464-1474.
[26] LIU F, WANG X J, LI D M, et al.Apple polyphenols extract alleviated dextran sulfate sodium-induced ulcerative colitis in C57BL/6 male mice by restoring bile acid metabolism disorder and gut microbiota dysbiosis[J].Phytotherapy Research:PTR, 2021, 35(3):1468-1485.
[27] LI Y H, WANG S, SUN Y, et al.Apple polysaccharide protects ICR mice against colitis associated colorectal cancer through the regulation of microbial dysbiosis [J].Carbohydrate Polymers, 2020, 230:115726.
[28] FUKUDA S, TOH H, HASE K, et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate[J].Nature, 2011, 469(7331):543-547.
[29] DE VADDER F, KOVATCHEVA-DATCHARY P, GONCALVES D, et al.Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J].Cell, 2014, 156(1-2):84-96.
[30] SU L L, MAO C Q, WANG X C, et al.The Anti-colitis effect of Schisandra chinensis polysaccharide is associated with the regulation of the composition and metabolism of gut microbiota[J].Frontiers in Cellular and Infection Microbiology, 2020, 10:519479.
[31] 邓梅, 张露, 罗晶, 等.乌鸡肽对葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠的保护作用[J].食品科学, 2023, 44(19):148-156.DENG M, ZHANG L, LUO J, et al.Protective effect of Gallus gallus domesticlus brisson peptides on dextran sodium sulfate-induced ulcerative colitis in mice[J].Food Science, 2023, 44(19):148-156.
[32] 贾楠楠, 刘静, 王汉屏.低分子量酶解灵芝硒多糖对小鼠肠道菌群的影响[J].食品安全质量检测学报, 2024, 15(4):292-303.JIA N N, LIU J, WANG H P.Effects of low molecular weight enzymatic hydrolysis of Ganoderma lucidum selenium polysaccharides on intestinal microflora in mice[J].Journal of Food Safety &Quality, 2024, 15(4):292-303.