环糊精(cyclodextrin,CD)主要分为α-CD、β-CD和γ-CD,区别在于D-吡喃葡萄糖基个数的不同,CD的圆筒内腔有非极性的氢和通过醚键连接的氧因而呈疏水性,其圆筒外部分子结构呈亲水性,该特殊结构使得CD具有形成包合物的特性[1]。因此CD被广泛运用到食品、化妆品、医药、农业等多种行业中,例如稳定食品成分、去除食品中的异味与苦涩味、作为食品添加剂和包装材料;去除化妆品中不良气味、增大化妆品溶解度;降低药物毒副作用、提高药物稳定性;作为植物生长调节剂等[1-3]。环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGT酶)是一种淀粉降解酶,也是α-淀粉酶家族的重要糖基水解酶,主要催化4种不同反应:歧化、环化、偶合和水解反应(根据反应中受体分子的不同)[4]。目前酶法合成是大多数CD工业化生产采取的方法,此法主要是通过对α-1,4糖苷键进行断裂后作用于淀粉等底物,使其葡萄糖基团发生转移从而获得CD[1]。
获取CGT酶主要有以下途径[5]:从自然界中筛选性状优良野生菌株;通过诱变育种筛选高酶活力菌株;对菌株产酶基因异源表达并使用多种优化策略提高表达水平;结合酶空间结构,使用蛋白质工程技术对酶目的基因片段进行改造,从而改良酶的特性(例如提高酶活力、酶产物特异性、酶热稳定性等)。α-、β-、γ-CGT酶环化活力测定分别对应的主要方法有甲基橙法[1]、酚酞法[2]和溴甲酚绿法[3],一个酶活力单位(U)定义为在相应方法下每分钟生产1 μmol α-CD、β-CD、γ-CD所需要的酶量,通常根据主产物的生成比率将CGT酶主要分为上述3类。如无特殊说明,文中所述酶活力指的是CGT酶环化活力。
1 CGT酶生产菌株的筛选或构建
性状优良的产酶菌株通常指的是以下性质较高:产酶活力、热稳定性、pH稳定性等。目前产CGT酶菌株的选育主要有以下三方面:自然界中筛选、诱变育种筛选和菌株产酶基因在宿主菌中的异源表达。
1.1 自然界中筛选
筛选产酶菌株较早可以追溯到TILDEN等[6]于1942年对浸麻芽孢杆菌(Bacillus macerans)的研究,该菌可产生转化淀粉为α-CD、β-CD的独特淀粉酶,即CGT酶。目前能产CGT酶的菌种较多,它们的主要生长地点有碱性环境、高温地域、底物原料富集地等[5],通常对所筛选出菌株进行形态学鉴定、生理生化鉴定、16S rRNA鉴定及系统发育树构建(结合NCBI基因库和相应模式菌株),来确定菌株的属和种,例如产α-CGT酶的浸麻类芽孢杆菌(Paenibacillus macerans)、产β-CGT酶的环状芽孢杆菌(Bacillus circulans)、产γ-CGT酶的克氏芽孢杆菌(Bacillus clarkii)等,此外在工业上生产CD使用较多的也是来源于芽孢杆菌属的菌株[1-2, 4]。自然界中筛选出的菌株在酶活力、酶稳定性等方面不具备优势,往往需要结合其他方法进一步完成产酶菌株的选育工作。
1.2 诱变育种筛选
诱变育种是指通过物理或化学等因素作用于菌株,使其基因发生突变,且突变的频率远高于自发突变,以期筛选出目的性状(例如提高产酶活力、热稳定性)菌株,优点在于理论与技术层面有较为成熟的研究且操作与方法简便等。常用的诱变育种的方法可分为物理、化学两类,物理诱变剂主要有紫外线(ultraviolet,UV)、微波、γ射线、N+离子注入术、常压室温等离子体(atmospheric and room temperature plasma,ARTP)、He-Ne激光等。化学诱变剂主要有甲基磺酸乙酯(ethyl methyl sulfone,EMS)、亚硝基胍(nitrosoguanidine,NTG)、亚硝酸盐、LiCl、硫酸二乙酯(diethyl sulfate,DES)等物质。表1中列举了学者对产CGT酶菌株诱变育种情况,表中酶活力如无标注,通常指的是CGT酶水解淀粉的酶活力[7]。
表1 产CGT酶菌株诱变育种情况
Table 1 Mutation breeding of CGTase producing strains
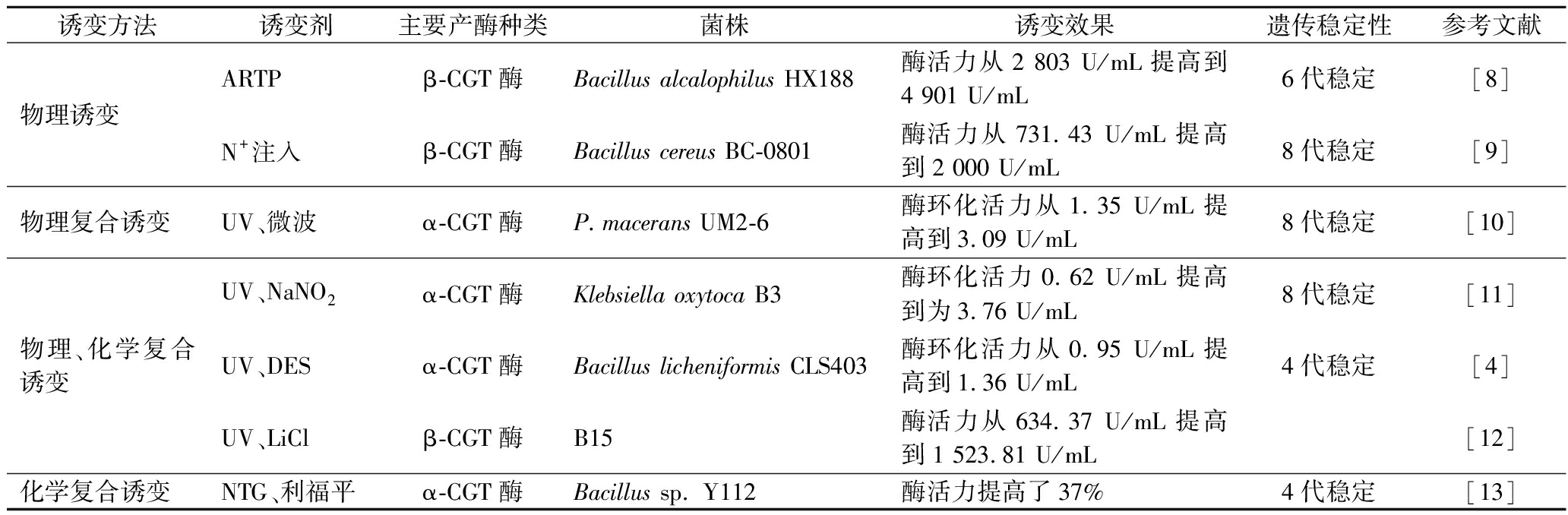
诱变方法诱变剂主要产酶种类菌株诱变效果遗传稳定性参考文献物理诱变ARTPβ-CGT酶Bacillus alcalophilus HX188酶活力从2 803 U/mL提高到4 901 U/mL6代稳定[8]N+注入β-CGT酶Bacillus cereus BC-0801酶活力从731.43 U/mL提高到2 000 U/mL8代稳定[9]物理复合诱变UV、微波α-CGT酶P.macerans UM2-6酶环化活力从1.35 U/mL提高到3.09 U/mL8代稳定[10]物理、化学复合诱变UV、NaNO2α-CGT酶Klebsiella oxytoca B3酶环化活力0.62 U/mL提高到为3.76 U/mL8代稳定[11]UV、DESα-CGT酶Bacillus licheniformis CLS403酶环化活力从0.95 U/mL提高到1.36 U/mL4代稳定[4]UV、LiClβ-CGT酶B15酶活力从634.37 U/mL提高到1 523.81 U/mL[12]化学复合诱变NTG、利福平α-CGT酶Bacillus sp. Y112酶活力提高了37%4代稳定[13]
学者们在菌株诱变育种中通常使用复合诱变,结合菌株的致死率及正突变率确定出最佳诱变条件,从而筛选出高酶活力、遗传稳定性良好的菌株。除了传统的诱变方法,还有一些新型的诱变方法,例如核糖体工程、ARTP、航天诱变育种等,在菌株诱变育种方面有较大潜力。但相比于传统诱变育种方法,菌株产酶基因异源表达在提高菌株产酶活力方面更有优势且高效便捷,也更能满足工业化生产需要。
1.3 异源表达
目前产CGT酶基因的异源表达宿主主要有以下3种常用菌:大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)以及巴斯德毕赤酵母(Komagataella phaffii)。此外有选择短短芽孢杆菌(Brevibacillus brevis)[14]、巨大芽孢杆菌(Bacillus megaterium)[15]等作为宿主的研究。3种常用宿主优缺点:E.coli遗传背景清晰、易于规模培养,但受表达时形成的不溶性包涵体所制约,因此较多学者研究减少包涵体的形成[16-17];B.subtilis是革兰氏阳性菌,其发酵工艺成熟、不产生内毒素;K.phaffii是真核宿主,稳定性高、产物易分离纯化,且基本没有E.coli那种不溶性包涵体,缺点是后两种宿主菌胞外表达量较低[18]。宿主B.brevis、B.megaterium的共同优点是不分泌内毒素、基本无包涵体、胞外酶活力高,但对这两种宿主菌研究较少,需进一步研究能高效异源表达的优化策略[14-15]。国内外学者通常构建质粒载体使CGT酶基因在宿主中表达,结合优化策略改良酶学性质,本文主要综述以下优化策略:产酶条件优化、信号肽选择、启动子优化、密码子优化等,如表2所示,其中产酶条件优化包括诱导条件优化和产酶培养基成分优化。
表2 菌株产CGT酶基因异源表达研究情况
Table 2 Research on heterologous expression of CGTase gene in strains
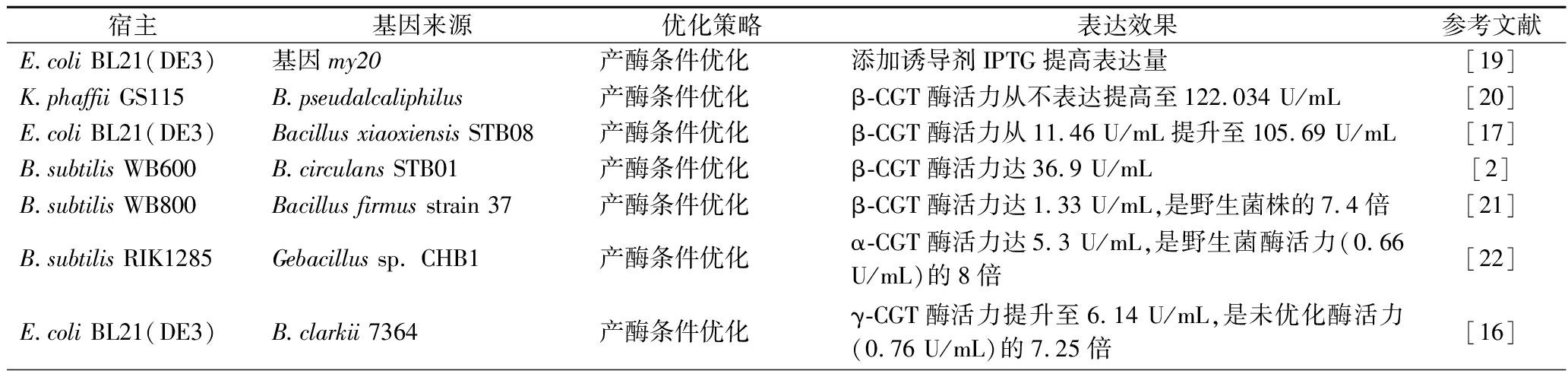
宿主基因来源优化策略表达效果参考文献E.coli BL21(DE3)基因my20产酶条件优化添加诱导剂IPTG提高表达量[19]K.phaffii GS115B.pseudalcaliphilus产酶条件优化β-CGT酶活力从不表达提高至122.034 U/mL[20]E.coli BL21(DE3)Bacillus xiaoxiensis STB08产酶条件优化β-CGT酶活力从11.46 U/mL提升至105.69 U/mL[17]B.subtilis WB600B.circulans STB01产酶条件优化β-CGT酶活力达36.9 U/mL[2]B.subtilis WB800Bacillus firmus strain 37产酶条件优化β-CGT酶活力达1.33 U/mL,是野生菌株的7.4倍[21]B.subtilis RIK1285Gebacillus sp. CHB1产酶条件优化α-CGT酶活力达5.3 U/mL,是野生菌酶活力(0.66 U/mL)的8倍[22]E.coli BL21(DE3)B.clarkii 7364产酶条件优化γ-CGT酶活力提升至6.14 U/mL,是未优化酶活力(0.76 U/mL)的7.25倍[16]
续表2

宿主基因来源优化策略表达效果参考文献E.coli BL21(DE3)P.macerans JFB05-011.信号肽选择2.产酶条件优化OmpA信号肽提高2.2倍酶环化活力。添加IPTG、Mg2+酶环化活力分别提升至17、25.7 U/mL[23]E.coli BL21(DE3)Paenibacillus campinasensis Hhj-11.信号肽选择2.产酶条件优化使用信号肽DacD,β-CGT酶活力提高11.48倍。产酶优化后酶活力提高至50.3 U/mL[24-25]E.coli BL21(DE3)Lactococcus lactis1.信号肽选择2.产酶条件优化使用信号肽G1,酶活力提高近4倍左右。产酶条件经响应面法优化后,酶活力提升至16.89 U/mL[26]E.coli BL21(DE3)Bacillus sp.G825-6信号肽选择使用信号肽DacD的总酶活力较pelB、原始信号序列提高3.9、3.0倍[27]B.subtilis RIK1285Geobacillus caldoxylosilyticus CHB11.信号肽选择2.信号肽N端氨基酸饱和突变筛选最优信号肽citH,其N端三点突变体G2R-N3K-T4L的α-CGT酶活力提升至14.2 U/mL[28]E.coli BL21(DE3)B.pseudalcaliphilus 8SB启动子优化T7启动子可有效产胞外异源蛋白[29]B.subtilis WSH11B.stearothermophilus启动子优化最优单、双启动子分别为PamyQ′、PhpaII-PamyQ′,对应α/β-CGT酶活力为6.52、11.15 U/mL[30]B.subtilis CCTCC M 2016536B.circulans 251启动子优化最优单、双启动子分别为PamyQ′、PHpaII-PamyQ′,对应β-CGT酶活力为24.1、30.5 U/mL[31]E.coli BL21(DE3)Geobacillus stearothermophilus NO2启动子优化最优单启动子为PtacI,优化启动子间隔序列后酶歧化活力提升至170.6 U/mL[32]B.brevisB.stearothermophilus1.启动子优化2.产酶条件优化替换为木糖启动子xyl变成可控的诱导型表达,产酶优化后酶活力提高到93.6 U/mL[14]K.phaffii GS115B.pseudalcaliphilus密码子优化密码子适应指数从0.71提高到0.86[33]E.coli BL21(DE3)P.macerans密码子优化交替使用最优、次优密码子,α-CGT酶活力提高到55.3 U/mL[34]K.phaffii GS115Gebacillus sp. CHB1密码子优化低频密码子优化成高频密码子,酶环化活力从0.37 U/mL提升到0.62 U/mL[35]B.megaterium MS941P.macerans JFB05-011.密码子优化2.产酶条件优化系统的密码子优化更适应宿主偏好;产酶优化后α-CGT酶活力提高到10.4 U/mL[15]E.coli BL21(DE3)Geobacillus sp. CHB1分子伴侣共表达5种分子伴侣共表达系统中,分子伴侣质粒pKJE8提高酶环化活力48.6%[36]
1.3.1 产酶条件优化
产酶条件优化通常是寻找最适的诱导条件和产酶培养基成分,其中诱导条件包括培养温度、初始pH、接种量、发酵时间、装液量等因素,产酶培养基成分包括碳源、氮源、金属离子、无机盐、表面活性剂、氨基酸、诱导剂等物质[37],本部分内容讨论的是在摇瓶水平上发酵所得而非发酵罐。SONG等[19]通过确定最佳诱导温度20 ℃、时间18 h、诱导剂异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)浓度0.4 mmol/L,提高在E.coli中的表达水平。WANG等[16]的最佳产酶条件为25 ℃、β-CD 7.5 mmol/L、乳糖2 g/L,在E.coli中表达的γ-CGT酶总酶活力为6.14 U/mL,是未优化酶活力(0.76 U/mL)的7.25倍,研究发现加入β-CD作小分子伴侣可抑制γ-CGT酶包涵体的形成,提高可溶表达。柴宝成[23]的单因素试验结果为0.01 mmol/L IPTG、5 mmol/L Mg2+可分别提高在E.coli中表达的CGT酶活力至17 U/mL、25.7 U/mL。郑金珠等[24]的最优培养基添加剂组合:表面活性剂吐温-80 2%和Triton X-100 0.5%、甘氨酸30 mmol/L、渗透调节剂L-脯氨酸80 mmol/L,在E.coli中表达的β-CGT酶活力为50.3 U/mL,是对照组的2.04倍。范博望[14]的最优产酶条件为30 ℃、工业蛋白胨、葡萄糖、1 mmol/L MgSO4,在B.brevis中表达的CGT酶活力提高到93.6 U/mL。MAHMUD等[26]使用响应面法优化显著影响产酶的3个条件(诱导后温度、诱导剂乳链菌肽浓度、诱导起始点OD600),使用响应面模型预测条件变量的最佳值分别为20.1 ℃、3.09 ng/mL、0.09,经验证后酶活力从5.01 U/mL提升至16.89 U/mL。学者们的研究表明温度是影响酶活力的重要因素,合理使用诱导剂、金属离子、培养基添加剂等物质可有效提高酶异源表达量。
GIMENEZ等[21]在标准、超富(super rich,SR)、2x酵母提取物胰蛋白胨(2xYT)培养基中选择最适产酶的2xYT培养基,在B.subtilis中表达的β-CGT酶活力为1.33 U/mL,是野生菌的7.4倍。陈龙军等[22]在LB(Luria-Bertani)、胰蛋白胨大豆肉汤(tryptone soya broth,TSB)、M9、TB(terrific broth)培养基中选择最适产酶的TB培养基,于pH 6.5、37 ℃发酵24 h,在B.subtilis中表达的α-CGT酶活力为5.3 U/mL,是野生型酶活力(0.66 U/mL)的8倍。李才明[2]改良TB培养基成分(玉米淀粉6 g/L、酵母提取物II 30 g/L、K2HPO4·3H2O 16.4 g/L、KH2PO4 2.3 g/L、天冬氨酸0.5 g/L、0.5 mmol/L Fe3+),于37 ℃、pH 7.0培养48 h,在B.subtilis中表达的β-CGT酶活力提高到36.9 U/mL。ZHANG等[20]以BSM(Basal salt medium)为基础,将其中的磷酸和氨水替换为PBS和硫酸铵,确定最佳产酶条件为100 mmol/L PBS、1%甘油、1%硫酸铵、30 ℃、pH 6.5、8%接种量、1.5%甲醇、10 mmol/L 吐温-80,在K.phaffii中表达的β-CGT酶活力从0 U/mL提高至122.034 U/mL,其中吐温-80作为非离子型表面活性剂对酶表达有显著促进作用,较对照组提高了46.16%。周媛媛[17]使用的培养基配方为:玉米浆膏24 g/L、大豆蛋白胨6 g/L、葡萄糖2 g/L、麦芽糖4 g/L,KH2PO4 2.32 g/L、K2HPO4·3H2O 16.43 g/L,于30 ℃、pH 7.0、装液量30 mL/250 mL、添加25 mmol/L Ca2+发酵96 h,在E.coli中表达的β-CGT酶活力为105.69 U/mL,比优化前(TB培养基酶活力11.46 U/mL)提高数倍,研究发现复合碳源、氮源相比于单一碳源、氮源,更有利于菌株产酶,且较低的溶氧和添加Ca2+能够减少重组大肠杆菌包涵体的形成。刘花[15]优化后的培养基成分:甘油12 g/L,酵母粉24 g/L,蛋白胨12 g/L,KH2PO4 17 mmol/L,K2HPO4 72 mmol/L,于32 ℃、菌体OD578=0.5时添加5 g/L木糖诱导剂,在B.megaterium中表达的α-CGT酶活力为10.4 U/mL。学者们的研究表明在已有培养基配方基础上进行适当改良,确定出最佳产酶培养基成分以及培养条件,是普遍使用的、有效提高酶活力的一种方法。在摇瓶水平上优化异源表达宿主菌的诱导条件和产酶培养基成分,可为CGT酶在发酵罐中的扩大生产奠定理论基础。
1.3.2 信号肽选择
3种异源表达常用宿主E.coli、B.subtilis、K.phaffii实现重组蛋白质的转运有多种途径,使用较多的途径为一般分泌信号(general secretory pathway,Sec)途径、信号识别颗粒(signal-recognition particle,Srp)途径、双精氨酸转运(twin-arginine translocation,Tat)途径等。信号肽由少量氨基酸残基(10~40个)构成,一般位于新生肽链N端,其功能是介导上述各种转移途径,实现蛋白质的跨膜运输。柴宝成[23]研究发现OmpA信号肽介导的CGT酶活力较PelB信号肽和无信号肽分别提高29.41%及2.2倍。SONNENDECKER等[27]从DacD、PelB、菌株CGT酶基因衍生这3种信号肽中选择使酶高水平表达的DacD信号肽,在E.coli中表达的酶总活力较PelB、CGTase基因衍生信号肽分别提高3.9倍、3.0倍。ZHENG等[25]从DacD、OmpA、OmpT、菌株CGT酶基因衍生这4种信号肽中,同样选择使酶表达最高效的DacD信号肽,于E.coli中表达的β-CGT酶活力较不含信号肽的提高11.48倍。MAHMUD等[26]从G1、M5、Usp45这3种信号肽中选择促进酶分泌表达的G1(异源天然信号肽),酶活力较其他2种分别提高1.8、4.1倍左右。陈龙军等[28]从173种信号肽文库筛选引导分泌效率最高的citH信号肽,并对citH信号肽N端氨基酸Gly2、Asn3、Thr4进行饱和突变后,得到信号肽三点突变体 G2R-N3K-T4L-CGT,在B.subtilis中表达的CGT酶活力为14.2 U/mL,比未突变信号肽提高47.9%,是野生菌酶活力(0.66 U/mL)的21.5倍,通过利用外源蛋白与特定信号肽之间的适配性可筛选匹配度高、提高外源蛋白分泌的信号肽,此外N端信号肽正电荷数变化可能会影响表达效率。学者们研究不同转运途径下相应信号肽对表达水平的影响,旨在提高宿主菌表达量,进一步对信号肽结构与功能的关系和分泌机制进行研究,在预测或设计适配信号肽和提高表达效率方面有较大潜力[28]。
1.3.3 启动子选择
启动子是一段可识别、结合RNA聚合酶并起始基因转录的DNA序列,是异源表达系统中的重要转录调控元件,通常按诱导方式主要分为组成型启动子(无需诱导剂即可持续表达)和诱导型启动子(可按需使用特定诱导剂)[38]。PETROVA等[29]在PJET载体使用T7启动子促进表达,证明在E.coli中T7启动子可有效进行胞外异源蛋白表达。范博望[14]木糖启动子xyl替换表达载体上原有的组成型P2启动子,使在B.brevis中由不可控的组成型表达转为可控的诱导型表达。DENG等[32]构建5个单启动子质粒PT7、Ptrp、PlacUV5、PtacI、PtacII,在E.coli中表达的最优单启动子为PtacI,此时酶歧化活力110.2 U/mL,进一步通过降低GC含量比例优化启动子间隔序列,酶歧化活力提升至170.6 U/mL,是原菌株(25.2 U/mL)的7倍左右。ZHANG等[31]构建9个单启动子质粒(PamyQ′,PHpaII,Psrf,Pxyl′,PgsiB,Pxyl,PaprE,PnprE,PamyQ),在B.subtilis中表达的最优单启动子为PamyQ′,β-CGT酶活力为24.1 U/mL;构建6个双启动子质粒,最优双启动子为PHpaII-PamyQ′,酶活力进一步提高至30.5 U/mL。李云菲等[30]也考察9个单启动子(PamyQ′,PhpaII,Psrf,Pxyl′,PgsiB,Pxyl,PaprE,PnprE,PamyQ)对酶活力影响,在B.subtilis表达的最优单启动子为PamyQ′,α/β-CGT酶活力为6.52 U/mL;最优双启动子为PhpaII-PamyQ′,酶活力进一步提升至11.15 U/mL。学者们通过研究启动子功能与调控机制,合理的选择单、双启动子,在调控表达形式、提高异源表达水平等方面有积极作用。
1.3.4 密码子优化
密码子共64种并编码20种氨基酸,编码同一种氨基酸的多个密码子被称为同义密码子,而稀有密码子则是限制异源表达的密码子。密码子优化主要是通过分析宿主的偏好密码子性,尽量满足宿主对密码子的需求,同时避免使用稀有密码子;或是基于密码子使用频率和蛋白结构来选择最优密码子,从而提高异源蛋白表达[15]。有研究分析E.coli、B.megaterium的各密码子使用频率并寻找密码子偏好性,使用最优密码子且避免使用稀有密码子,同时交替使用最优、次优的同义密码子以防止tRNAs过于繁忙导致表达降低的情况,经密码子优化后在E.coli、B.megaterium中表达的α-CGT酶活力分别提升至55.3、10.4 U/mL(基于产酶条件优化)[15,34]。ZHANG等[33]在不改变氨基酸序列的前提下优化密码子,对2 046 bp的编码序列和90 bp的信号肽序列分别修改456 bp、26 bp的非偏爱密码子,在K.phaffii中表达的密码子适应指数从0.71提高到0.86(理论上越接近1蛋白表达越高)。陈龙军等[35]根据K.phaffii密码子偏好性,将原始基因中低频密码子优化成酵母表达系统中的高频密码子,低频密码子使用频率由11%降至6%,在K.phaffii中表达的酶活力从0.37 U/mL提升到0.62 U/mL。宿主对编码氨基酸密码子的使用并非平均化,通过密码子优化的方法将密码子调整为表达宿主偏爱的、首选的高频密码子,可提高翻译效率并促进异源蛋白高效表达[15]。
2 CGT酶分子改造
目前CGT酶分子改造策略主要使用的为生物法(此外还有物理法、化学法等),本文主要综述生物法的三类设计:理性设计、半理性设计、非理性设计,及分别对应的常用方法:定点突变、定点饱和突变、易错PCR(error prone PCR,ep PCR)等。异源表达及相应优化策略可提高酶表达量、改良部分酶学性质,在此基础上结合上述蛋白质工程技术改造酶分子,可进一步对酶相关特性进行改良(例如产物抑制、产物特异性、反应特异性、热稳定性等),以期满足工业化生产的需求。已列举出近年来国内外学者对酶分子改造的研究情况,见表3。
表3 CGT酶分子改造研究情况
Table 3 Research on molecular modification of CGTase

宿主基因来源CGT酶类型分子改造方法突变位点改造结果参考文献B.subtilis WB600B.circulans STB01β-CGT酶定点突变MBS2区域A599、Y633A599N/Y633A降低线性混合型产物抑制,总环化活性、CD的产率分别提高22.4%、15.8%[39]E.coli BL21(DE3)B.stearothermophilus NO2定点突变+2亚位点附近L277L277M、L227F歧化水解比率分别是野生型的2.4、1.3倍[40]E.coli BL21(DE3)B.stearothermophilus NO2定点突变-7亚位点E142,+2亚位点附近L277E142P/L277M产物α-CD产量及占比率较野生型分别提高1.7 g/L、14.3%[41]E.coli BL21(DE3)B.stearothermophilus NO2定点突变-7亚位点E142,+2亚位点N353E142P、E142P/N353A产物α-CD占比分别提高9.65%、15.62%;N353A环化水解比值是野生型的3.25倍[42]E.coli BL21(DE3)P.macerans JFB05-01α-CGT酶定点突变-7亚位点R146、D147,-3亚位点N94,中心亚位点Y195R146A/D147P、R146P/D147A产物α-CD占比由野生型63.2%分别提高至75.1%、76.1%,N94W/Δ(145-151)D/Y195W产γ-CD比率由野生型12.9%提升至40.3%[3, 43]E.coli BL21(DE3)B.clarkii 7364γ-CGT酶定点突变-3亚位点F91,中心亚位点Y186F91N、F91L环化活性由9.72 U/mg分别提升至18.72、19.32 U/mg;Y186W产物γ-CD占比由野生型77.1%提升至94.6%[44]
续表3

宿主基因来源CGT酶类型分子改造方法突变位点改造结果参考文献E.coli BL21(DE3)Paenibacillus sp.β-CGT酶定点突变Y100、S145、Y167,钙结合位点A315Y100I、S145G、Y167H产β-CD比率较高;S145P、A315H/R/S提高产α-CD∶γ-CD比例;A315D在60 ℃下保温30 min,活性由野生型70%提升至90%[45]E.coli BL21(DE3)Bacillus sp. G-825-6γ-CGT酶定点突变-7亚位点Y211Y211L产γ-CD的质量分数提升至97%[46]B.subtilis WB600B.circulans STB01β-CGT酶定点突变MBS2区域N603N603D降低线性混合型产物抑制,单位质量酶CD产量较野生型提高23.9%[47]B.subtilis WB600B.circulans STB01β-CGT酶定点突变MBS2区域L600L600E、L600R降低线性混合型产物抑制,β-CD产量小幅提升[48]B.subtilis WB600B.circulans STB01β-CGT酶定点突变CaIII位点A315、D577A315D、D577K分别将原始酶60 ℃下半衰期提高约80%、130%,添加Ca2+可进一步提高稳定性[49]B.subtilis WB600B.circulans STB01β-CGT酶定点突变CaIII位点D577D577G、D577A的Km分别降低36.1%、18.0%,Kcat/Km分别升高43.9%、23.0%[50]E.coli MC1061B.circulans 251定点突变+2亚位点F183、F259F183S/F259N水解环化比由野生型1∶90提升至15∶1[51]E.coli BL21(DE3)Bacillus sp. Y112定点突变-3亚位点R81R81T产物α-CD、β-CD所占比例分别降低和提高8%、7%[52]E.coli BL21(DE3)Bacillus sp. FJAT-44876γ-CGT酶定点突变G20860 ℃下G208S酶热稳定性半衰期为0.5 h,提高1.85倍[53]E.coli ER2566Paenibacillus pabuli US132定点突变N65560 ℃下N655S酶的热稳定性半衰期为20 min,是野生型2倍[54]E.coli BL21(DE3)Paenibacillus sp. 602-1α-CGT酶定点饱和突变中心亚位点Y195Y195R主产物变成γ-CD,其占比提升至50%;Y195I产物β-CD、γ-CD占比分别提升至34%、38%[55]E.coli BL21(DE3)P.macerans JFB05-01定点饱和突变D182、S77、Y195D182C糖基化产物基本无LCGS;S77N/Y195S、S77N/Y195I糖基化产物LCGS比例分别提高15.27%、29.96%[23, 56]E.coli BL21(DE3)P.macerans JFB05-01定点饱和突变A156、A166、L174L174P、A156V/L174P、A156V/L174P/A166Y产物LCGS占比由野生型13.2%分别提升至32.0%、33.4%、34.9%[57]E.coli BL21(DE3)P.macerans JFB05-01迭代饱和突变-6亚位点Y167、G179、N193、G180Y167S/G179K/N193R/G180R生成AA-2G产量为2.12 g/L,较原始酶提高84%[58]E.coli BL21(DE3)Bacillus sp. Y112定点饱和突变-7亚位点P176P176G底物转化率提高10.4%,β-CD产量提高6%;P176L、P176I产物CD分别增加7.9 %、9.4%;P176K催化效率提高14%[59]E.coli BL21(DE3)B.cereusβ-CGT酶定点饱和突变A47A47Y产物β-、γ-CD由野生型11.71、3.19 mg/mL分别提升至14.88、4.92 mg/mL;突变体A47D的β-CD/γ-CD由野生型3.67提升至4.99[60]E.coli BL21(DE3)P.campinasensisβ-CGT酶ep PCRQ280Q280L的β-CGT酶活力、底物亲和力、β-CD转化率分别提高42.10%、46.13%、7.60%[61]E.coli BL21(DE3)Bacillus sp. 6021α-CGT酶ep PCR、定点饱和突变A536、-6亚位点Y167Y167H/A536V产物α-CD∶β-CD从3.4提升至7.8;对Y167H定点饱和突变发现Y167H仍为最优选[62]
续表3
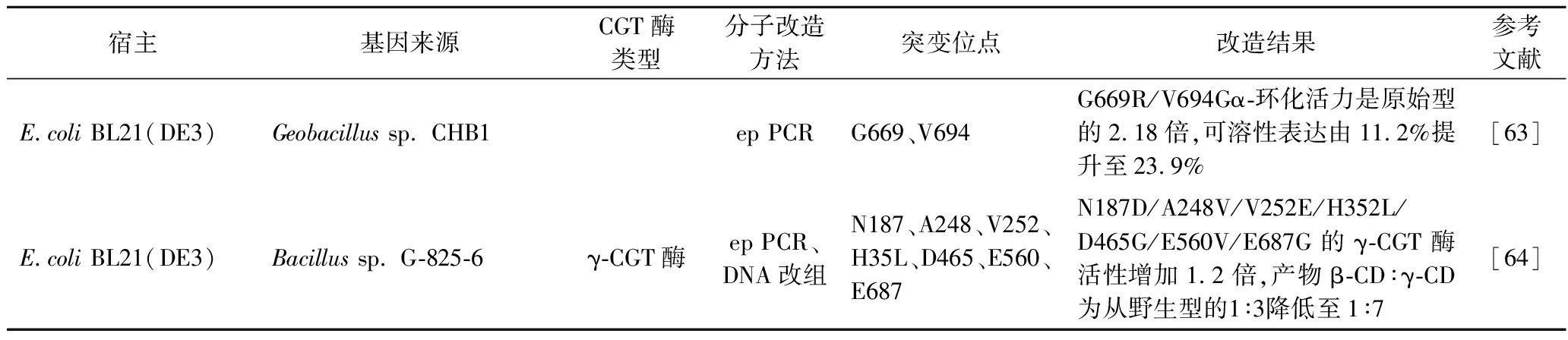
宿主基因来源CGT酶类型分子改造方法突变位点改造结果参考文献E.coli BL21(DE3)Geobacillus sp. CHB1ep PCRG669、V694G669R/V694Gα-环化活力是原始型的2.18倍,可溶性表达由11.2%提升至23.9%[63]E.coli BL21(DE3)Bacillus sp. G-825-6γ-CGT酶ep PCR、DNA改组N187、A248、V252、H35L、D465、E560、E687N187D/A248V/V252E/H352L/D465G/E560V/E687G的γ-CGT酶活性增加1.2倍,产物β-CD∶γ-CD为从野生型的1∶3降低至1∶7[64]
注:20种氨基酸名称及缩写:丙氨酸Ala(A)、精氨酸Arg(R)、天冬氨酸Asp(D)、半胱氨酸Cys(C)、谷氨酰胺Gln(Q)、谷氨酸Glu/Gln(E)、组氨酸His(H)、甘氨酸 Gly(G)、天冬酰胺 Asn(N)、酪氨酸Tyr(Y)、脯氨酸Pro(P)、丝氨酸Ser(S)、甲硫氨酸Met(M)、赖氨酸Lys(K)、缬氨酸Val(V)、异亮氨酸Ile(I)、苯丙氨酸Phe(F)、亮氨酸Leu(L)、色氨酸Trp(W)、苏氨酸Thr(T)。
2.1 理性设计
理性设计的方法需要结合已知CGT酶蛋白质结构,分析蛋白质氨基酸序列对结构和功能的影响,从而确定出突变的氨基酸位点和种类,方法通常有定点突变、盒式突变、片段删除突变、蛋白嵌合技术等。国内外多名学者已对多个菌株来源的CGT酶三维空间结构进行解析、报道,CGT酶是α-淀粉酶家族13的成员之一,其结构通常包含完整的5个结构域,分别命名为A、B、C、D、E,其中A域有催化活性,包含(β/α)8桶状结构,也被称为磷酸三糖磷酸异构酶 (triosephosphate isomerase ,TIM)桶结构;B域为底物结合域,包含一个使底物与酶蛋白能有效结合的凹槽(位于酶表面);C域可参与原淀粉结合,含有麦芽糖基结合位点(maltose binding site,MBS)MBS3;E域与淀粉颗粒的吸附有关,含有MBS1和MBS2;D域的功能可能是用来正确定位E域[1-3]。学者对酶结构的进一步研究表明,CGT酶底物结合凹槽包含至少9个结合亚位点,例如来源于B. circulans 251的β-CGT酶9个结合亚位点可标记为-7~-1、+1、+2[3]。正因为结构决定功能,各亚位点氨基酸序列和结构发生变化后,酶的性质也有相应变化,因此学者们基于已知的酶结构与功能解析情况,通常使用定点突变这种理性设计的方法,实现CGT酶分子改造从而改良酶特性。
2.1.1 定点突变降低CGT酶产物抑制,提高CD产量
产物CD与CGT酶结合抑制酶活性的现象称为产物抑制,主要分为竞争性抑制、非竞争性抑制和线性混合型抑制,是阻碍CD产量的因素之一,使用定点突变这种较低成本且环保的方法改造酶分子结构从而降低酶产物抑制,以期提高CD产量[65]。LI等[39]在MBS2区域的599、633位点进行定点单、双突变,其中双位点定点突变体A599N/Y633A的总环化活性和CD产率较野生型分别提高22.4%、15.8%,由于599位点由A(非极性)突变至N(极性),侧链因此发生变化导致该位点与CD氢键强度降低,阻碍产物CD与β-CGT酶结合,从而降低产物对A599N的线性混合型产物抑制。CHEN等[48]在MBS2区域出构建突变体L600E、L600R未改变β-CGT酶产物抑制类型,其β-CD产量较野生型均小幅提升,且抑制常数Ki、K′i均显著高于野生型,降低线性混合型产物抑制,突变导致疏水相互作用减弱,产物CD与β-CGT酶的结合亲和力降低从而降低产物抑制。此外,CHEN等[47]在MBS2区域构建的突变体N603E、N603D降低β-CGT酶线性混合型产物抑制,N603D单位质量酶的CD产量较野生型提高了23.9%,因603位点突变成带负电荷的E、D时破坏了氢键,突变体与MBS1、MBS2相互作用改变导致产物抑制降低。学者们的研究表明MBS区域的结构与β-CGT酶产物抑制作用有较大关系,在此区域构建的突变体可通过转变氨基酸极性和正负电荷等方法,实现减弱氢键作用、疏水相互作用等方式阻止产物与酶结合,从而降低CGT酶产物抑制,提高CD产量。
2.1.2 定点突变提高CGT酶产物特异性
由于CGT酶催化淀粉等底物的产物基本都是由α-CD、β-CD、γ-CD混合组成的,而应用时通常是使用某种单一类型的CD,因此通过酶分子改造的方式获得高产物特异性的CGT酶,可降低CD工业生产成本[3]。左方圆[42]在-7亚位点构建突变体E142P,使产物α-CD/β-CD比值从1.14(野生型)提升到1.98,α-CD产物占比从38.05%(野生型)提升到47.70%;构建双突变体E142P/N353A,α-CD产物占比较野生型提高15.62%,突变破坏了氢键相互作用从而提高酶α-CD产物特异性。孔德民等[41]构建双突变体E142P/L277M在24 h内最高催化生成10.15 g/L α-CD,与野生型相比其产量和占比分别提高1.7 g/L、14.3%,提高酶α-CD产物特异性。王金鹏等[46]在-7亚位点构建单突变体Y211L催化木薯淀粉所得γ-CD占总CD产物质量分数97%,提高酶γ-CD产物特异性。LI等[45]构建单突变体Y100I、S145G、Y167H产β-CD比率较高于野生型,突变体S145P、A315H/R/S提高产α-CD/γ-CD比值,淀粉转化活性的提高可能是氨基酸的改变加强疏水反应或是与底物形成新的疏水相互作用。有学者在-7亚位点构建双突变体R146A/D147P、R146P/D147A产α-CD比率由野生型63.2%分别提升至75.1%、76.1%,发现封闭-7亚位点可提高酶α-CD特异性;在中心、-7、-3亚位点构建组合突变体N94W/Δ(145-151)D/Y195W[对-7亚位点处Loop进行理性设计的片段删除突变Δ(145-151)D],产γ-CD占比由12.9%上升至40.3%[3,43]。此外WANG等[44]在中心亚位点构建突变体Y186W产物γ-CD特异性高,占比由野生型77.1%提升至94.6%。李晓涵等[52]在-3亚位点构建突变体R81T,其产物α-CD占比降低8%、β-CD占比提高7%,突变后氨基酸侧链变短且与周围氨基酸的氢键作用力改变,导致底物结合活性位点的空间增大以及氢键与底物的作用力消失,从而影响环化反应的产物特异性。学者们的研究表明因氨基酸突变导致氢键作用、疏水相互作用等发生变化,且氨基酸侧链长度的变化会影响结合位点空间大小(空间大有利于大环的CD生成),从而使产物比率向目标方向改变,以提高CGT酶产物特异性。
2.1.3 定点突变提高CGT酶反应特异性
环化反应是CGT酶主要催化的4种反应中的特征反应,环化、歧化反应原理是切断直链麦芽低聚糖链后通过转糖基反应,将切断糖链形成的共价复合物分别转移至同一个、另一个直链受体上;偶合反应是环化反应的逆反应,原理为打开CD的环并转移到直链麦芽低聚糖链上;水解反应原理是切断直链淀粉分子并转移到水分子上[1,3]。根据不同工业应用中对CGT酶4种反应的需求情况,改造酶分子以提高所需反应特异性。由于影响歧化和水解的残基通常在+2亚位点,KONG等[40]将+2亚位点、E253附近的L277位点定点突变为其他疏水氨基酸,突变体L277M、L227F歧化水解比率分别是野生型2.4、1.3倍,提升的原因是突变影响E253水分子分布或+2亚位点的疏水性。左方圆[42]在+2亚位点构建突变体N353A,其环化水解比值是野生型的3.25倍,因突变影响电荷平衡导致E253与D225(亲核残基)距离变大从而提高环化反应特异性。VAN DER VEEN等[51]在+2亚位点构建双突变体F183S/F259N,其水解环化比由野生型的1∶90提升到15∶1,提高酶水解反应特异性,由于F183、F259在环化反应中起重要作用,且将疏水残基F突变为亲水残基S、N,从而导致水解活性增加、环化活性降低。学者们的研究发现+2亚位点附近的结构对歧化、水解反应特异性有重要影响;氨基酸突变导致亲水疏水性、电荷平衡等发生变化,影响着CGT酶各反应的发生,因此通过调整酶结构的方式提高目的反应特异性以期满足工业化需求有很大潜力。
2.1.4 定点突变提高CGT酶热稳定性
热稳定性不足会缩短酶在较高温度下的反应时间,降低反应效率,对工业化应用有阻碍作用,因此针对CGT酶空间结构对氨基酸序列进行合理设计,以提高酶热稳定性[2]。LI等[45]构建位于钙结合位点的突变体A315D表现出较高的热稳定性,其在60 ℃保温30 min有90%左右活性(野生型为70%左右),80 ℃保温5 min仍有30%活性(野生型20%左右),热稳定性的提高是由于突变体A315D增加了与周围残基的盐桥或氢键,增强了静电相互作用。LI等[49]在CaIII位点上构建单突变体A315D和D577K,分别将原始酶60 ℃下的半衰期提高约80%和130%;向A315D、D577K分别添加1.5、0.5 mmol/L Ca2+,60 ℃保温120 min分别保留86.3%、56.3%。郑丹妮[53]构建突变体G208S的最适温度保持不变(50 ℃),60 ℃下的γ-CGT酶热稳定性半衰期为0.5 h,提高了1.85倍,结构解析发现208位点的丝氨酸可分别与203、204位点的丝氨酸形成间接、直接的氢键,从而提高酶热稳定性。SAHNOUN等[54]构建突变体N655S最适温度为65 ℃,较野生型提高5 ℃;60 ℃下酶的热稳定性半衰期为20 min,是野生型2倍。学者们的研究表明通过突变使位点氨基酸增强与附近残基的盐桥、氢键、静电相互作用等,可稳定酶空间结构从而提高酶热稳定性。
2.1.5 定点突变改良其他酶学性质
定点突变技术可对上述之外的酶学性质例如CGT酶活力、酶催化效率等进行改良。WANG等[44]在-3亚位点构建突变体F91N、F91L,环化总比活力由野生型的9.72 U/mg提升至18.72、19.32 U/mg。LI等[50]构建突变体D577G、D577A的环化活性提高,Km分别降低36.1%、18.0%,Kcat/Km分别升高43.9%、23.0%,提高了酶催化效率。
2.2 半理性设计
CGT酶分子改造的半理性设计的原理类似于理性设计,也是基于已知酶结构对酶某个点或某片区域进行饱和突变(一般突变为其他19种氨基酸),此设计兼顾序列空间多样性和筛选工作量,包括定点饱和突变、迭代饱和突变等方法。XIE等[55]对Y195定点饱和突变,突变体Y195R主产物由α-CD(35%)转变为γ-CD(50%);Y195I合成β-CD和γ-CD分别为34%、38%,产物特异性较野生型(α-CD占比83%)发生较大变化。LI等[59]对-7亚位点P176饱和突变,突变体P176G底物转化率提高10.4%,β-CD产量提高6%,发现甘氨酸的较简单结构有利于产生更大的CD分子从而提高β-CD产物特异性;P176L和P176I的CD产量分别增加7.9 %、9.4%;P176K催化效率提高14%。SONG等[62]对-6亚位点Y167饱和突变,突变体Y167H产物α-CD/β-CD由野生型的3.4提升至7.8,显著提高产物特异性。花敬涵[60]对A47定点饱和突变,突变体A47Y的β-CD、γ-CD产量由野生型11.71、3.19 mg/mL分别提升至最高值14.88、4.92 mg/mL;突变体A47D的β-CD/γ-CD由野生型3.67提升至最高值为4.99,研究表明47位点为疏水氨基酸时更利于β-、γ-CD大环CD的生成,从而提升产物特异性。
CGT酶不仅能催化生成CD,还可以催化生成其他产物以实现多种用途。柴宝成等[23, 56]对D182饱和突变,突变体D182C提高短链糖基化槐角苷产物特异性,且产物基本没有长链糖基化槐角苷生成,底物转化率从57.76%提高到71.18%(主要糖基化产物也因此提高);对S77、Y195饱和突变,突变体S77N/Y195S、S77N/Y195I的转化率较野生型分别提高13.86%、11.85%,糖基化产物LCGS比例也分别提高15.27%、29.96%,提高LCGS产物特异性,研究表明上述突变造成酶与底物的作用力增加,从而提升糖基化效率。HAN等[57]对174、156、166位点饱和突变,构建突变体L174P、A156V/L174P、A156V/L174P/A166Y的产物LCGS占比由野生型13.2%分别提升至32.0%、33.4%、34.9%,提高LCGS产物特异性,研究表明可能由于-5、-6、-7亚位点上氢键相互作用的变化,引起突变体对长链底物亲和力增强从而提高产物特异性,同时揭示pH调节产物特异性机制(低、高pH分别依赖相应的反应途径)。此外,韩瑞枝[58]对-6亚位点氨基酸(Y167、G179、G180、N193)进行迭代饱和突变,建立多位点突变体Y167S/G179K/N193R/G180R,其利用麦芽糊精生成2-氧-α-D-吡喃型葡萄糖基-L-抗坏血酸(2-O-α-D-glucopyranosyl-L-ascorbic acid,AA-2G)产量为2.12 g/L,较原始酶提高84%,研究表明此多位点突变型与底物间的氢键个数由2增加到4,从而提高与底物结合能力使转化效率升高;且迭代饱和突变较单点饱和突变相比,是一种高效的酶分子改造方法,可简化繁琐的筛选过程。学者们对影响CGT酶学性质的重要位点或区域进行半理性设计突变,从而对比分析所有氨基酸在该位点上对酶学性质的改变情况,进一步掌握氨基酸性质对酶结构及作用机制变化的影响,也为研究其他位点上氨基酸的突变选择奠定理论基础。
2.3 非理性设计
酶的非理性设计也被称为酶的定向进化,此法不需要深入了解酶分子结构及对应功能,通过构建随机突变结合定向筛选所需性状的突变体这2个步骤完成,主要方法有ep PCR、DNA改组等技术[66]。郑婉等[61]构建ep PCR突变文库并对产酶活力进行筛选,得到高酶活力突变体Q280L,其β-CGT酶活力较野生型提高42.10%、底物亲和力提高46.13%、β-CD的转化率提高7.60%,研究表明第839位的A突变为T导致氨基酸由Q变为L,使侧链变短、L280与Y269氢键作用消失,因此导致酶与底物作用力改变且更利于大环CD产物从而提高产物特异性。郭永华等[63]构建ep PCR突变文库并筛选胞外酶活力和可溶性表达提高的突变体ds-6、ep-9,α-环化活力分别是原始型的1.72、2.18倍且可溶性表达由11.2%分别提升至18.5%、23.9%,其中ep-9共发生突变的3个碱基分别是G2005A、A2037G、T2081G,对应的氨基酸突变为G669R、V694G,研究表明氨基酸残基亲水性增加可能促进蛋白可溶表达,并且G2005A是影响酶活力和可溶表达的关键位点。SONG等[62]构建ep PCR突变文库并筛选出产物α-CD∶β-CD比值提高的突变体No.95,序列对比发现突变为Y167H、A536V,其α-CD∶β-CD从3.4提升至7.8,提高产物特异性。MELZER等[64]通过ep PCR和DNA改组相结合的方法,突变体S54发生7个氨基酸突变(分别为N187D、A248V、V252E、H352L、D465G、E560V、E687G),γ-CGT酶活力增加1.2倍,产物β-CD∶γ-CD为从野生型1∶3降低至1∶7,显著提高γ-CD产物特异性,研究发现由于A248V靠近催化位点,该位点疏水性提高可能造成酶活力提高、改善活性部位与水的相互作用从而使CD产量提高。学者们的研究表明CGT酶的非理性设计往往通过构建基因文库并筛选出使酶实现定向进化的有效突变体,对发生的一个或多个氨基酸突变位点结合酶学性质分析这些突变协同造成酶结构的改变情况。在此基础上,可扩大随机突变范围并结合快速筛选的方法,实现CGT酶多性质的高效率定向进化,同时对分析多位点突变体的酶结构和功能之间的关系有一定帮助。
3 讨论
本文主要综述了产CGT酶的菌株选育和酶分子改造这两块内容,详细介绍了菌株诱变育种、异源表达及优化策略、酶分子改造的三类设计及对应方法等内容,希望能给学者们的研究带来帮助。
在产酶菌株选育方面,系统性阐述了产酶条件优化、信号肽选择、启动子优化、密码子优化这4种异源表达优化策略。在自然界筛选、诱变育种这两法中,优化菌株培养条件、产酶培养基成分也是一个提高酶活力的重要方法,通常使用单因素试验、正交试验、响应面中心组合设计试验等方法辅助研究各因素各水平的相互关系,从而确定最优产酶条件提高酶活力。此外,还有一些其他的异源表达优化策略例如表达载体优化、分子伴侣共表达的方法,也同样能使宿主菌高效异源表达,郭永华等[36]构建5种分子伴侣质粒(分别为pKJE8、pKJE7、pGro7、pTf16和pG-Tf2),分别与重组表达质粒pET-28a(+)-ompA-cgt共表达,其中pKJE8提高酶环化活力48.6%、提高目的蛋白可溶性表达56.9%,研究表明分子伴侣共表达法可减少在E.coli中表达的包涵体形成,提高酶活力和可溶性蛋白表达。今后仍需继续从自然界中筛选性状优良的野生菌株,结合新型高效的诱变育种方法和契合异源表达宿主菌的优化策略,从而完成产CGT酶菌株的选育。
在酶分子改造方面,阐述了生物法中理性、半理性、非理性这三类设计所对应的常用方法(定点突变、定点饱和突变、ep PCR)和酶分子经改造后相关性质的改变情况。由于本文以酶法制备CD为基础,而酶法制备工艺一般可分为控制过程与非控制过程,控制过程是指在生产时向反应体系中加入有机试剂,例如癸醇、甲苯等,目的使特定CD转化率提高;非控制过程是指在生产CD时不加入其他试剂,提高CD的安全性并降低生产成本,但使用范围较为局限[1-3]。因此,对CGT酶分子改造以改良酶相关特性可优化这两种酶法制备CD过程,例如WANG[44]构建γ-CGT酶突变体Y186W,使γ-CD比率提高到94.6%,具有不添加有机试剂即能单一生产γ-CD的工业运用潜力。今后仍需进一步研究单位点及多位点突变引起的相互作用力变化和CGT酶结构因此的改变情况,以及这些变化对酶学性质的影响,从而更全面的分析CGT酶结构与功能之间的关系,提高酶工业化运用范围。
[1] 李兆丰. 软化类芽孢杆菌α-环糊精葡萄糖基转移酶在大肠杆菌中的表达及其产物特异性分析[D].无锡:江南大学, 2009.LI Z F.Expression of α-cyclodextrin glycosyltransferase from Paenibacillus macerans in Escherichia coli and analysis of its product specificity[D].Wuxi:Jiangnan University, 2009.
[2] 李才明. β-环糊精葡萄糖基转移酶在枯草杆菌中的分泌表达及其热稳定性研究[D].无锡:江南大学, 2014.LI C M.Secretory expression in Bacillus subtilis and thermostability of β-cyclodextrin glycosyltransferase [D].Wuxi:Jiangnan University, 2014.
[3] 王蕾. 环糊精葡萄糖基转移酶的产物特异性分子改造及发酵制备研究[D].无锡:江南大学, 2018.WANG L.Product specificity engineering and fermentation of cyclodextrin glycosyltransferase [D].Wuxi:Jiangnan University, 2018.
[4] 陈龙然. 产α-环糊精葡萄糖基转移酶的菌株分离、产酶条件优化与酶学特性研究[D].杭州:浙江大学, 2005.CHEN L R.Breeding and optimized fermentation of an α-glucanotransferase producing strain and its enzymatic characteristics [D].Hangzhou:Zhejiang University, 2005.
[5] 金征宇, 柏玉香, 王金鹏.环糊精系列综述之一 环糊精葡萄糖基转移酶的筛选及其定向改造[J].食品与生物技术学报, 2012, 31(2):113-123.JIN Z Y, BAI Y X, WANG J P.Screen and modification of cyclodextrin glycosyltransferase[J].Journal of Food Science and Biotechnology, 2012, 31(2):113-123.
[6] TILDEN E B, HUDSON C S.Preparation and properties of the amylases produced by Bacillus macerans and Bacillus polymyxa[J].Journal of Bacteriology, 1942, 43(4):527-544.
[7] 朱国威, 李丽芬, 傅楠楠, 等.产环糊精葡萄糖基转移酶苦橙内生细菌的分离鉴定[J].食品研究与开发, 2023, 44(14):198-204.ZHU G W, LI L F, FU N N, et al.Isolation and identification of endophytic bacteria producing cyclodextrin glucosyltransferase from bitter orange[J].Food Research and Development, 2023, 44(14):198-204.
[8] 张新武. 常压室温等离子诱变选育β-环糊精葡萄糖基转移酶高产菌株及发酵工艺研究[J].食品安全质量检测学报, 2016, 7(12):4930-4938.ZHANG X W.Study on high-yield strains producing β-cyclodextrin glycosyltransferase by atmospheric room temperature plasma mutation breeding and optimization of their fermentation conditions[J].Journal of Food Safety &Quality, 2016, 7(12):4930-4938.
[9] 张洪斌, 凌国庆, 胡雪芹, 等.N~+注入诱变选育β-环状糊精葡萄糖基转移酶高产菌株及其发酵条件优化[J].食品科学, 2012, 33(15):239-245.ZHANG H B, LING G Q, HU X Q, et al.Screening of a high-yield β-cyclodextrin glycosyltransferase-producing Bacillus cereus strain and optimization of its fermentation conditions[J].Food Science, 2012, 33(15):239-245.[10] 陶大炜, 张小丹, 宁喜斌, 等.复合诱变选育高产α-环糊精葡萄糖基转移酶的菌株及产酶条件优化[J].食品与发酵工业, 2021, 47(19):63-70.TAO D W, ZHANG X D, NING X B, et al.Strain breeding for high-yielding α-cyclodextrin glucosyltransferase and optimization of the enzyme formation conditions[J].Food and Fermentation Industries, 2021, 47(19):63-70.
[11] 张智维, 雷新辉, 张海群.紫外线和亚硝酸诱变选育高产α-环糊精葡萄糖基转移酶菌株[J].粮油食品科技, 2013, 21(5):101-104.ZHANG Z W, LEI X H, ZHANG H Q.Breeding of high yield α-cyclodextrin glucosyltransferase strains by UV and nitrite mutagenesis[J].Science and Technology of Cereals, Oils and Foods, 2013, 21(5):101-104.
[12] 廖威, 华慧颖, 莫于旺.一株β-环状糊精葡萄糖基转移酶产生菌的筛选与发酵条件研究[J].轻工科技, 2011,27(002):1-3.LIAO W, HUA H Y, MO Y W.Screening and fermentation conditions of a β-cyclodextrin glucosyltransferase producing strain[J].Guang Xi Journal of Light Industry, 2011, 27(002):1-3.
[13] 张晓磊. 一株α-环糊精葡萄糖基转移酶产生菌的选育,鉴定,产酶条件优化和酶学性质的研究[D].上海:上海海洋大学, 2015.ZHANG X L.Breeding, identification and optimized fermentation of an alpha cyclomaltodextrin glucanotransferase producing strain and its enzymatic characterization[D].Shanghai:Shanghai Ocean University, 2015.
[14] 范博望. Bacillus stearothermophilus环糊精葡萄糖基转移酶在短小芽孢杆菌中的重组表达、发酵优化及应用研究[D].无锡:江南大学, 2016.FAN B W.Fermentation and application of CGTase from Bacillus stearothermophilus expressed in Bacillus brevis[D].Wuxi:Jiangnan University, 2016.
[15] 刘花. 基于密码子优化的α-环糊精糖基转移酶在大肠杆菌及巨大杆菌中的表达[D].无锡:江南大学, 2012.LIU H.Codon usage optimization aided α-cyclodextrin glycosyltransferase expression in E.coli and B.megaterium[D].Wuxi:Jiangnan University, 2012.
[16] WANG L, CHEN S, WU J.Cyclodextrin enhanced the soluble expression of Bacillus clarkii γ-CGTase in Escherichia coli[J].BMC Biotechnology, 2018, 18(1):72.
[17] 周媛媛. 来源于Bacillus xiaoxiensis STB08的β-CGT酶在大肠杆菌中的分泌表达及发酵优化[D].无锡:江南大学, 2022.ZHOU Y Y.Secretion expression in Escherichia coli and fermentation optimization of β-CGTase from Bacillus xiaoxiensis STB08[D].Wuxi:Jiangnan University, 2022.
[18] 李晓涵, 郝建华, 郭姣梅, 等.环糊精葡萄糖基转移酶高效异源表达研究进展[J].微生物学通报, 2020, 47(2):615-622.LI X H, HAO J H, GUO J M, et al.Advance in high-level heterologous expression of cyclodextrin glycosyltransferase[J].Microbiology China, 2020, 47(2):615-622.
[19] SONG K, SUN J J, WANG W, et al.Heterologous expression of cyclodextrin glycosyltransferase my20 in Escherichia coli and its application in 2-O-α-D-glucopyranosyl-L-ascorbic acid production[J].Frontiers in Microbiology, 2021, 12:664339.
[20] ZHANG J G, ZHAO Y X, LI M L, et al.Optimization of defined medium for recombinant Komagataella phaffii expressing cyclodextrin glycosyltransferase[J].Biotechnology Progress, 2019, 35(5):e2867.
[21] GIMENEZ G G, COSTA H, DE LIMA NETO Q A, et al.Sequencing, cloning, and heterologous expression of cyclomaltodextrin glucanotransferase of Bacillus firmus strain 37 in Bacillus subtilis WB800[J].Bioprocess and Biosystems Engineering, 2019, 42(4):621-629.
[22] 陈龙军, 林陈强, 张慧, 等.嗜热芽胞杆菌α-环糊精葡萄糖基转移酶在枯草芽胞杆菌中的表达[J].福建农业学报, 2019, 34(5):600-605.CHEN L J, LIN C Q, ZHANG H, et al.Expression of α-cyclodextrin glycosyltransferase gene of Gebacillius sp.CHB1 in Bacillus subtilis[J].Fujian Journal of Agricultural Sciences, 2019, 34(5):600-605.
[23] 柴宝成. 分子改造环糊精葡萄糖基转移酶合成糖基化染料木素[D].无锡:江南大学, 2021.CHAI B C.Engineering of cyclodextrin glucosyltransferase for the synthesis of glycosylated genistein[D].Wuxi:Jiangnan University, 2021.
[24] 郑金珠, 吴华伟, 李相前.培养基添加剂促进重组大肠杆菌胞外分泌β-环糊精葡萄糖基转移酶的工艺优化[J].食品科技, 2019, 44(11):16-22.ZHENG J Z, WU H W, LI X Q.Optimization of medium additives for promoting extracellular secretion of β-cyclodextrin glucosyltransferase from recombinant Escherichia coli[J].Food Science and Technology, 2019, 44(11):16-22.
[25] ZHENG J Z, LI X Q, WU H W.High-level extracellular secretion and characterization of the thermophilic β-cyclodextrin glucanotranferase from Paenibacillus campinasensis in Escherichia coli[J].3 Biotech, 2019, 9(10):372.
[26] MAHMUD H, ISMAIL A, ABDUL RAHIM R, et al.Enhanced secretion of cyclodextrin glucanotransferase (CGTase) by Lactococcus lactis using heterologous signal peptides and optimization of cultivation conditions[J].Journal of Biotechnology, 2019, 296:22-31.
[27] SONNENDECKER C, WEI R, KURZE E, et al.Efficient extracellular recombinant production and purification of a Bacillus cyclodextrin glucanotransferase in Escherichia coli[J].Microbial Cell Factories, 2017, 16(1):87.
[28] 陈龙军, 林陈强, 贾宪波, 等.信号肽筛选优化提高耐热α-环糊精酶在枯草芽胞杆菌中的表达[J].福建农业学报, 2022, 37(3):414-422.CHEN L J, LIN C Q, JIA X B, et al.Enhanced thermophilic α-cyclodextrin glycosyltransferase expression by optimizing target signal peptide in Bacillus subtilis[J].Fujian Journal of Agricultural Sciences, 2022, 37(3):414-422.
[29] PETROVA P, TONKOVA A, PETROV K.Sequence analysis, cloning and extracellular expression of cyclodextrin glucanotransferase gene from the alkaliphilic Bacillus pseudalcaliphilus 8SB in Escherichia coli[J].Process Biochemistry, 2012, 47(12):2139-2145.
[30] 李云菲, 宿玲恰, 吴敬.启动子对枯草芽孢杆菌表达环糊精葡萄糖基转移酶的影响[J].基因组学与应用生物学, 2019, 38(8):3540-3547.LI Y F, SU L Q, WU J.Effect of promoter on the expression of cyclodextrin glucosyltransferase by Bacillus subtilis[J].Genomics and Applied Biology, 2019, 38(8):3540-3547.
[31] ZHANG K, SU L Q, DUAN X G, et al.High-level extracellular protein production in Bacillus subtilis using an optimized dual-promoter expression system[J].Microbial Cell Factories, 2017, 16(1):32.
[32] DENG C, LI J H, SHIN H D, et al.Efficient expression of cyclodextrin glycosyltransferase from Geobacillus stearothermophilus in Escherichia coli by promoter engineering and downstream box evolution[J].Journal of Biotechnology, 2018, 266:77-83.
[33] ZHANG J G, ZHANG Y, LI M L.High-level secretion and characterization of cyclodextrin glycosyltransferase in recombinant Komagataella phaffii[J].Journal of Biotechnology, 2017, 259:126-134.
[34] LIU H, LI J H, DU G C, et al.Enhanced production of α-cyclodextrin glycosyltransferase in Escherichia coli by systematic codon usage optimization[J].Journal of Industrial Microbiology &Biotechnology, 2012, 39(12):1841-1849.
[35] 陈龙军, 陈济琛, 林晓栩, 等.嗜热芽孢杆菌CHB1环糊精酶基因优化及其在毕赤酵母中的表达[J].食品与生物技术学报, 2018, 37(9):994-999.CHEN L J, CHEN J C, LIN X X, et al.Codon optimization and expression of cyclodextrin glycosyltransferase from Gebacillius sp.CHB1 in Pichia pastoris[J].Journal of Food Science and Biotechnology, 2018, 37(9):994-999.
[36] 郭永华, 陈济琛, 贾宪波, 等.分子伴侣共表达对嗜热环糊精葡萄糖基转移酶异源可溶性表达的影响[J].微生物学通报, 2016, 43(3):518-526.GUO Y H, CHEN J C, JIA X B, et al.Effects of chaperone co-expression on heterologous solubility expression of thermophilic cyclodextrin glucosetransferase[J].Microbiology China, 2016, 43(3):518-526.
[37] 张艺凡, 周文喜, 王华.环糊精葡萄糖基转移酶的生产及其分离纯化研究进展[J].内蒙古民族大学学报(自然科学版), 2023, 38(3):231-236.ZHANG Y F, ZHOU W X, WANG H.Research progress in production and separation purification of cyclodextrin glucosyltransferase[J].Journal of Inner Mongolia Minzu University (Natural Sciences), 2023, 38(3):231-236.
[38] 熊海涛, 韦宇拓.枯草芽孢杆菌表达系统及其启动子的研究进展[J].广西科学, 2018, 25(3):233-241.XIONG H T, WEI Y T.Research progress of Bacillus subtilis expression system and its promoter regulatory elements[J].Guangxi Sciences, 2018, 25(3):233-241.
[39] LI C M, YOU Y X, ZHANG Y Z, et al.Maltose binding site 2 mutations affect product inhibition of Bacillus circulans STB01 cyclodextrin glycosyltransferase[J].International Journal of Biological Macromolecules, 2021, 175:254-261.
[40] KONG D M, WANG L, SU L Q, et al.Effect of Leu277 on disproportionation and hydrolysis activity in Bacillus stearothermophilus NO2 cyclodextrin glucosyltransferase[J].Applied and Environmental Microbiology, 2021, 87(12):e0315120.
[41] 孔德民, 左方圆, 吴敬, 等.Bacillus stearothermophilus NO2环糊精葡萄糖基转移酶Leu277突变提高α-环糊精产量[J].食品与发酵工业, 2023, 49(15):1-7.KONG D M, ZUO F Y, WU J, et al.Improvement of α-cyclodextrin yield by mutants of Leu277 about CGTase from Bacillus stearothermophilus NO2[J].Food and Fermentation Industries, 2023, 49(15):1-7.
[42] 左方圆. Bacillus stearothermophilus NO2环糊精葡萄糖基转移酶的分子改造及制备α-环糊精的研究[D].无锡:江南大学, 2022.ZUO F Y.Molecular modification of Bacillus stearothermophilus NO2 cyclodextrin glucosyltransferase and preparation[D].Wuxi:Jiangnan University, 2022.
[43] WANG L, DUAN X G, WU J.Enhancing the α-cyclodextrin specificity of cyclodextrin glycosyltransferase from Paenibacillus macerans by mutagenesis masking subsite-7[J].Applied and Environmental Microbiology, 2016, 82(8):2247-2255.
[44] WANG L, XIA Y M, SU L Q, et al.Modification of Bacillus clarkii γ-cyclodextrin glycosyltransferase and addition of complexing agents to increase γ-cyclodextrin production[J].Journal of Agricultural and Food Chemistry, 2020, 68(43):12079-12085.
[45] LI Y, WEI L K, ZHU Z L, et al.Rational design to change product specificities and thermostability of cyclodextrin glycosyltransferase from Paenibacillus sp[J].RSC Advances, 2017, 7(23):13726-13732.
[46] 王金鹏, 王萍, 苑征, 等.γ-CGTase突变体制备及其产γ-CD条件优化[J].食品与生物技术学报, 2018, 37(10):1015-1020.WANG J P, WANG P, YUAN Z, et al.Preparation of γ-CGTase mutant and optimization of the production of γ-CD[J].Journal of Food Science and Biotechnology, 2018, 37(10):1015-1020.
[47] CHEN S D, LI Z F, GU Z B, et al.Variants at position 603 of the CGTase from Bacillus circulans STB01 for reducing product inhibition[J].International Journal of Biological Macromolecules, 2019, 136:460-468.
[48] CHEN S D, LI Z F, GU Z B, et al.Leu600 mutations decrease product inhibition of the β-cyclodextrin glycosyltransferase from Bacillus circulans STB01[J].International Journal of Biological Macromolecules, 2018, 115:1194-1201.
[49] LI C M, BAN X F, GU Z B, et al.Calcium ion contribution to thermostability of cyclodextrin glycosyltransferase is closely related to calcium-binding site CaIII[J].Journal of Agricultural and Food Chemistry, 2013, 61(37):8836-8841.
[50] LI Z F, HUANG M, GU Z B, et al.Asp577 mutations enhance the catalytic efficiency of cyclodextrin glycosyltransferase from Bacillus circulans[J].International Journal of Biological Macromolecules, 2016, 83:111-116.
[51] VAN DER VEEN B A, LEEMHUIS H, KRALJ S, et al.Hydrophobic amino acid residues in the acceptor binding site are main determinants for reaction mechanism and specificity of cyclodextrin-glycosyltransferase[J].The Journal of Biological Chemistry, 2001, 276(48):44557-44562.
[52] 李晓涵, 郭姣梅, 宋凯, 等.Bacillus sp.Y112环糊精葡萄糖基转移酶位点R81定点突变提高产物特异性[J].食品科学, 2021, 42(10):133-138.LI X H, GUO J M, SONG K, et al.Improvement of the product specificity of Bacillus sp.Y112 cyclodextrin glucosyltransferase by site-directed mutagenesis of arginine 81[J].Food Science, 2021, 42(10):133-138.
[53] 郑丹妮. Bacillus sp.FJAT-44876γ-环糊精葡萄糖基转移酶的表征及热稳定性提升研究[D].无锡:江南大学, 2020.ZHENG D N.Characterization and thermostability improved of γ-CGTase from Bacillus sp. FJAT-44876[D].Wuxi:Jiangnan University, 2020.
[54] SAHNOUN M, JAOUA M, BEJAR S, et al.Highlight on mutations affecting the US132 cyclodextrin glucanotransferase binding specificity, thermal stability, and anti-staling activity[J].Colloids and Surfaces.B, Biointerfaces, 2022, 212:112375.
[55] XIE T, SONG B H, YUE Y, et al.Site-saturation mutagenesis of central tyrosine 195 leading to diverse product specificities of an α-cyclodextrin glycosyltransferase from Paenibacillus sp.602-1[J].Journal of Biotechnology, 2014, 170:10-16.
[56] 柴宝成, 姜钰琳, 倪晔, 等.环糊精葡萄糖基转移酶182位点定点改造催化合成糖基化染料木素[J].生物工程学报, 2022, 38(2):749-759.CHAI B C, JIANG Y L, NI Y, et al.Engineering the 182 site of cyclodextrin glucosyltransferase for glycosylated genistein synthesis[J].Chinese Journal of Biotechnology, 2022, 38(2):749-759.
[57] HAN R Z, NI J, ZHOU J Y, et al.Engineering of cyclodextrin glycosyltransferase reveals pH-regulated mechanism of enhanced long-chain glycosylated sophoricoside specificity[J].Applied and Environmental Microbiology, 2020, 86(7):e00004-e00020.
[58] 韩瑞枝. 环糊精葡萄糖基转移酶的分子改造及合成糖基化L-抗坏血酸[D].无锡:江南大学, 2013.HAN R Z.Molecular engineering of cyclodextrin glycosyltransferase for glycosyl L-ascorbic acid synthesis[D].Wuxi:Jiangnan University, 2013.
[59] LI X H, SUN J J, WANG W, et al.Site-saturation mutagenesis of proline 176 in cyclodextrin glucosyltransferase from Bacillus sp.Y112 effects product specificity and enzymatic properties[J].Process Biochemistry, 2020, 94:180-189.
[60] 花敬涵. β-环糊精糖基转移酶的催化机制及理性改造研究[D].合肥:合肥工业大学, 2019.HUA J H.Catalytic mechanism and rational transformation of β-cyclodextrin glycosyltransferase[D].Hefei:Hefei University of Technology, 2019.
[61] 郑婉, 刘振杨, 郑金珠, 等.易错PCR技术改造β-环糊精葡萄糖基转移酶的催化特性[J].现代食品科技, 2023, 39(5):25-31.ZHENG W, LIU Z Y, ZHENG J Z, et al.Modification of the catalytic properties of β-cyclodextrin glucosyltransferase through error-prone PCR[J].Modern Food Science and Technology, 2023, 39(5):25-31.
[62] SONG B H, YUE Y, XIE T, et al.Mutation of Tyrosine167 Histidine at remote substrate binding subsite -6 in α-cyclodextrin glycosyltransferase enhancing α-cyclodextrin specificity by directed evolution[J].Molecular Biotechnology, 2014, 56(3):232-239.
[63] 郭永华, 陈济琛, 贾宪波, 等.应用易错PCR技术提高环糊精葡萄糖基转移酶的可溶性表达[J].微生物学报, 2016, 56(10):1551-1560.GUO Y H, CHEN J C, JIA X B, et al.Improving soluble expression of Geobacillus sp.B1 CGTase by errorprone PCR[J].Acta Microbiologica Sinica, 2016, 56(10):1551-1560.
[64] MELZER S, SONNENDECKER C, FÖLLNER C, et al.Stepwise error-prone PCR and DNA shuffling changed the pH activity range and product specificity of the cyclodextrin glucanotransferase from an alkaliphilic Bacillus sp[J].FEBS Open Bio, 2015, 5(1):528-534.
[65] 陈双娣. 麦芽糖基结合位点2区域对环糊精葡萄糖基转移酶产物抑制的影响研究[D].无锡:江南大学, 2019.CHEN S D.Effects of maltose binding site 2 region on product inhibition of cyclodextrin glycosyltransferase[D].Wuxi:Jiangnan University, 2019.
[66] 郭永华. 嗜热环糊精葡萄糖基转移酶的分子改造[D].福州:福建农林大学, 2016.GUO Y H.Molecular modification of the thermophilic cyclodextrin glucosetransferase[D].Fuzhou:Fujian Agriculture and Forestry University, 2016.