2型糖尿病是一种以持续高血糖为主要症状的代谢性疾病,其发生率不断增长,严重威胁人类身心健康[1]。随着研究的不断深入,由肠道L细胞合成的胰高血糖素样肽-1(glucagon-like peptide1,GLP-1)已经在医药生物行业引起了研究人员的高度重视。GLP-1对葡萄糖具有一定的依赖性,通过抑制肠道L细胞凋亡和促进胰岛素分泌等多种方式使患者的血糖水平降低,成为当前临床治疗糖尿病等诸多疾病的重要靶点。由于GLP-1在人体内会迅速被二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)降解,导致其在人体血浆中的半衰期<2 min,这一定程度上使GLP-1的临床应用受到限制[2]。现阶段,医学领域已经成功合成GLP-1受体激动剂和DPP-4抑制剂两种药物,但它们在可接受性、药物成本和使用便利性方面仍存有局限性,迫切需要发现新的天然药物来源候选物[3]。
甜味植物是指具有甜味口感的植物,其主要成分是一类能够与甜味受体相结合并刺激味觉神经产生甜味的化合物,这些化合物常被应用于食品和饮料中作为低热量的替代糖使用。近年来的研究发现,部分甜味植物中的物质基础在提供天然滋味甜外,通常还具有一定的降糖功效性,但其发挥降糖作用的现代药理机制尚未完全阐明。已有多项研究证实甜味植物与GLP-1间存在潜在联系,这是其有效控制血糖的重要理论依据。本研究将对甜味植物中的甜味物质基础及其作用于GLP-1的可能机制进行综述,旨在为进一步阐明甜味植物的“滋味”与“功效”提供新的视角,并为甜味植物资源的开发利用提供新的思路。
1 甜味植物的物质基础
1.1 糖类
糖类是甜味植物中最为丰富的物质成分,可分为单糖、低聚糖、多糖。其中,单糖和低聚糖是滋味“甜”的主要来源,而多糖则更多的作为功效性成分体现。目前,已经从甜味植物中分离鉴定出多种不同的处于游离状态的单糖,主要有葡萄糖和果糖等。它们普遍具有甜味,同时也是进一步构成低聚糖和多糖的主要聚合组分[4]。甜味植物经过蒸煮等工艺加工后,甜味增加、苦味减少,可有效提升其“滋味”。研究发现,这一现象可能与甜味植物经加工后多糖的聚合度降低,游离出更多的呈味单糖有关[5]。
多糖具有多种生物活性,特别是其“味甜”而“降糖”的特点使之成为甜味植物活性成分研究的焦点。已有研究表明,调节GLP-1分泌水平,可有效增强机体对胰岛素的抵抗能力,同时也会使受到损伤的胰岛细胞得到一定程度的恢复,是多数甜味植物多糖发挥降糖作用的有效方式[6-7]。甜味植物多糖的降糖活性与其分子结构紧密联系,多糖的分子质量、单糖的种类及组成比例、糖苷键、取代基和高级结构均是决定其活性强弱的关键因素[8-13](表1)。通过硫酸酯化、羧甲基化和乙酰化等化学修饰法改变甜味植物多糖分子质量、分子形状和分子结构,均可有效增强其生物活性[14]。此外,有研究指出,多糖进入人体肠道后,在肠道菌群影响下,可生成短链脂肪酸(short-chain fatty acid,SCFAs)等多种代谢物[15],这些物质具有一定调控肠道微生物结构及功能的作用,有助于改善高糖高脂膳食结构引发的代谢异常情况。提示除化学修饰外,对肠道代谢产物的研究可能成为未来洞察甜味植物成分活性机理的重要研究方向。
表1 甜味植物中多糖的结构组成与特征
Table 1 Structural composition and characterization of polysaccharides from sweet-taste plants
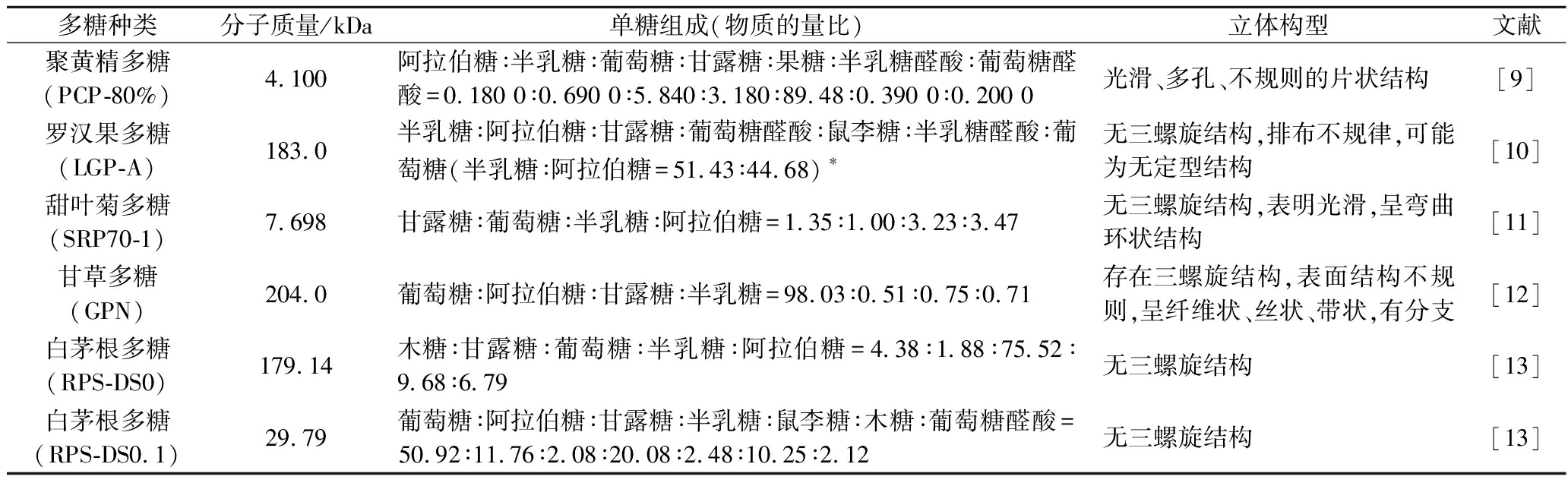
多糖种类分子质量/kDa单糖组成(物质的量比)立体构型文献聚黄精多糖(PCP-80%)4.100阿拉伯糖∶半乳糖∶葡萄糖∶甘露糖∶果糖∶半乳糖醛酸∶葡萄糖醛酸=0.180 0∶0.690 0∶5.840∶3.180∶89.48∶0.390 0∶0.200 0光滑、多孔、不规则的片状结构[9]罗汉果多糖(LGP-A)183.0半乳糖∶阿拉伯糖∶甘露糖∶葡萄糖醛酸∶鼠李糖∶半乳糖醛酸∶葡萄糖(半乳糖∶阿拉伯糖=51.43∶44.68)∗无三螺旋结构,排布不规律,可能为无定型结构[10]甜叶菊多糖(SRP70-1)7.698甘露糖∶葡萄糖∶半乳糖∶阿拉伯糖=1.35∶1.00∶3.23∶3.47无三螺旋结构,表明光滑,呈弯曲环状结构[11]甘草多糖(GPN)204.0葡萄糖∶阿拉伯糖∶甘露糖∶半乳糖=98.03∶0.51∶0.75∶0.71存在三螺旋结构,表面结构不规则,呈纤维状、丝状、带状,有分支[12]白茅根多糖(RPS-DS0)179.14木糖∶甘露糖∶葡萄糖∶半乳糖∶阿拉伯糖=4.38∶1.88∶75.52∶9.68∶6.79无三螺旋结构[13]白茅根多糖(RPS-DS0.1)29.79葡萄糖∶阿拉伯糖∶甘露糖∶半乳糖∶鼠李糖∶木糖∶葡萄糖醛酸=50.92∶11.76∶2.08∶20.08∶2.48∶10.25∶2.12无三螺旋结构[13]
注:*其他单糖含量较低,未列出比例。
1.2 皂苷类
皂苷类化合物是呈现甜味植物“滋味”的特征物质。目前,已经从不同的甜味植物中鉴定出多种皂苷类成分,如绞股蓝总皂苷[16]、甘草甜素[17]、罗汉果甜苷[18]、青钱柳甜苷[19]、甜叶菊糖苷[20]、甜茶素[21]等,这是甜味植物重要的风味来源。甜味植物皂苷类成分可按苷元结构分类,以四环三萜或四环二萜为主(表2)。进一步研究构效关系,发现其甜度可能与特定侧链基团糖基取代种类和数量有关。例如,绞股蓝总皂苷的甜味强度取决于其C-20上的侧链取代种类或C-3上的葡糖基数量[16];罗汉果皂苷的甜味强度取决于其C-11上的侧链取代种类[18];甜菊糖苷的甜味强度则取决于C-13上葡糖基取代数量[20]。
表2 甜味植物中苷类物质结构与甜度的构效关系
Table 2 Relations between structure and sweetness of glycosides from sweet-taste plants

皂苷种类来源苷元结构侧链结构甜味程度或甜味阈值文献绞股蓝皂苷YN1~4绞股蓝皂苷YN5~9绞股蓝皂苷YN10~16绞股蓝四环三萜C-20侧链为4-甲基-4-戊烯及其衍生物YN1~3甜度较低,甜味阈值较高;YN4甜度最高,甜味阈值最低C-20侧链为4-甲基-1,2-二戊烯及其衍生物YN5~9甜度较低,甜味阈值较高C-20侧链为4-甲基-1,3-二戊烯YN12~14,16甜度和阈值适中;YN15甜度较低,甜味阈值较高[16]11-O-罗汉果皂苷Ⅴ罗汉果皂苷Ⅴ罗汉果四环三萜C11位上所连接的基团类型为O基以蔗糖为基准,样品浓度为0.005 7%~0.034 2%时,相对甜度为76~94C11位上所连接的基团类型为—OH基以蔗糖为基准,样品浓度为0.005 7%~0.034 2%时,相对甜度为241~330[18]
续表2

皂苷种类来源苷元结构侧链结构甜味程度或甜味阈值文献甜茶苷甜菊苷瑞鲍迪苷A瑞鲍迪苷C杜克苷A瑞鲍迪苷F甜菊双糖苷瑞鲍迪苷B瑞鲍迪苷M瑞鲍迪苷D甜叶菊四环二萜C13位的葡萄糖基取代数为1;C19上葡萄糖基取代数为1以蔗糖为基准,相对甜度200C13位的葡萄糖基取代数为2;C19上葡萄糖基取代数为1以蔗糖为基准,相对甜度250C13位的葡萄糖基取代数为3;C19上葡萄糖基取代数为1以蔗糖为基准,相对甜度300C13位的鼠李糖基取代数量为1,且葡萄糖基取代数为1;C19上葡萄糖基取代数为1以蔗糖为基准,相对甜度50C13位的鼠李糖基取代数量为1,无葡萄糖基取代;C19上葡萄糖基取代数为1以蔗糖为基准,相对甜度50C13位的葡萄糖基取代数为2,且木糖取代数为1;C19上葡萄糖基取代数为1以蔗糖为基准,相对甜度250C13位的葡萄糖基取代数为2;C19上无取代基以蔗糖为基准,相对甜度100C13位的葡萄糖基取代数为3;C19上无取代基以蔗糖为基准,相对甜度300C13位的葡萄糖基取代数为3;C19上葡萄糖基取代数为3以蔗糖为基准,相对甜度200C13位的葡萄糖基取代数为3;C19上葡萄糖基取代数为2以蔗糖为基准,相对甜度250[20]
除贡献滋味“甜”外,皂苷类物质也常具有降糖活性。已有研究证实,甜味植物皂苷类物质,如罗汉果皂苷、人参皂苷等,可使人体肠道分泌GLP-1的效率显著提升、人体内的胰岛素浓度大幅增加,进而发挥降血糖作用[22-24]。有研究指出,皂苷类物质的生物活性也可能与其结构中糖链的数量、大小、组成和位置,以及与其他分子的相互作用等因素密切相关[25]。提示改变皂苷分子中的糖基数量和结构,对提高其生物活性具有重要意义。
1.3 黄酮类
黄酮类化合物是存在于各种植物内的一种次生代谢物,其生物活性与药理作用较为丰富,也可以赋予植物独特的感官风味。目前,已有研究证实从甜味植物中提取获得的部分黄酮类化合物具有一定调控血糖水平的作用。例如葛根素可以有效使GLP-1受体处于激活状态,保护胰岛β细胞状态,调节体内葡萄糖平衡[26]。值得注意的是,由于多数天然黄酮化合物结构特殊,导致它们在生物体内的可利用性不高,这一点严重制约了它们潜在的生物活性。通过生物催化或化学法对这些黄酮化合物的结构进行修饰改性,可以有效提升其在生物体内的可利用率[27]。这是未来甜味植物中黄酮类成分研究的重要方向。
此外,新近研究证实从甜味植物中提取获得的部分黄酮类物质具有甜味,如多穗柯中提取黄酮类物质根皮苷和三叶草苷等[28]。目前已发现的“甜味”黄酮类物质按苯环的不同组成分类均属于二氢查尔酮类黄酮,这可能与甜味受体能特异性识别二氢查尔酮类黄酮的分子结构有关[29]。二氢查尔酮类黄酮物质与甜味觉的构效关系研究,是未来甜味植物黄酮类成分研究的另一重要方向。
1.4 生物碱及其他成分
甜味植物中还含有丰富的生物碱、香豆素和蛋白质等多种有机成分,及Al、Si、V、Fe、Co、Ca、Sr等多种无机成分。在枸杞[30]、麻黄根[31]和北沙参[32]等甜味植物中,多种生物碱和香豆素类成分已被证实是呈甜味物质;而无机元素也已被证实其含量和种类是影响甜味植物风味的有效因素,如甜味植物中元素Li、Al、Si、V、Fe、Co的含量明显高于苦味植物,Ca、Sr的含量则明显较低[33]。但因该类物质含量有限,目前尚缺乏这些成分的活性研究。
综上所述,甜味植物中丰富的糖类、皂苷类、黄酮类及生物碱类等化合物是甜味植物呈“甜味”的主要物质基础,在发挥其“滋味”和“功效”中起着双重作用(表3)。
表3 常见甜味植物的滋味及功效物质成分
Table 3 Taste and efficacy substance composition of sweet-taste plants

物质基础化合物类型种类滋味/功效文献滋味物质单糖类葡萄糖、果糖、半乳糖、甘露糖低聚糖类低聚果糖、低聚木糖、低聚乳果糖皂苷类绞股蓝皂苷(YN1~9,YN11~15)、甘草甜素、罗汉果甜苷、青钱柳甜苷、甜叶菊苷、甜茶素黄酮类多穗柯黄酮(根皮苷、三叶苷)生物碱类甜菜碱、酪氨酸甜菜碱香豆素类补骨脂素、香柑内脂无机物类Li甜味物质来源[4][4][16-21][28][30-31][32][33]
续表3

物质基础化合物类型种类滋味/功效文献功效物质多糖类皂苷类黄酮类铁皮石斛多糖增加GLP-1的合成与分泌,影响糖代谢[16]枸杞多糖促进GLP-1的分泌,改善胰岛素抵抗[12]黄芪多糖恢复紊乱的肠道菌群,促进GLP-1分泌[15]罗汉果皂苷抑制肠道α-葡萄糖苷酶活性,促进GLP-1合成及胰岛素分泌[22]人参皂苷调节肠道肠菌微生物组成,诱导GLP-1合成与分泌[23]甘草酸激活体内胆汁酸受体,增强机体循环,促进GLP-1分泌,提高胰岛素浓度[24]葛根素高糖环境下可刺激GLP-1受体及靶细胞[26]
2 甜味植物调节GLP-1的分子机制
甜味植物可以通过多种分子机制有效调节GLP-1合成与分泌,主要分为两类(图1):一类,直接与人体肠道L细胞发生作用,对信号传导起到一定的调节控制作用,进而促进GLP-1的合成与分泌;包括味觉受体信号通路、胰高血糖素原多肽(glucagon peptide,PG)/前激素转化酶1/3(pre hormone converting enzyme 1/3,PC1/3)途径、Wnt/β-catenin信号通路和磷酯酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路等。另一类,间接的通过调整肠道菌群平衡或GLP-1水解,促进GLP-1的分泌或维持。如肠道菌群/SCFA途径、肠道菌群/胆汁盐水解酶(bile acid saline hydrolytic enzyme,BSH)/法尼醇X受体(farnesoid X receptor,FXR)途径、DPP-4途径等。
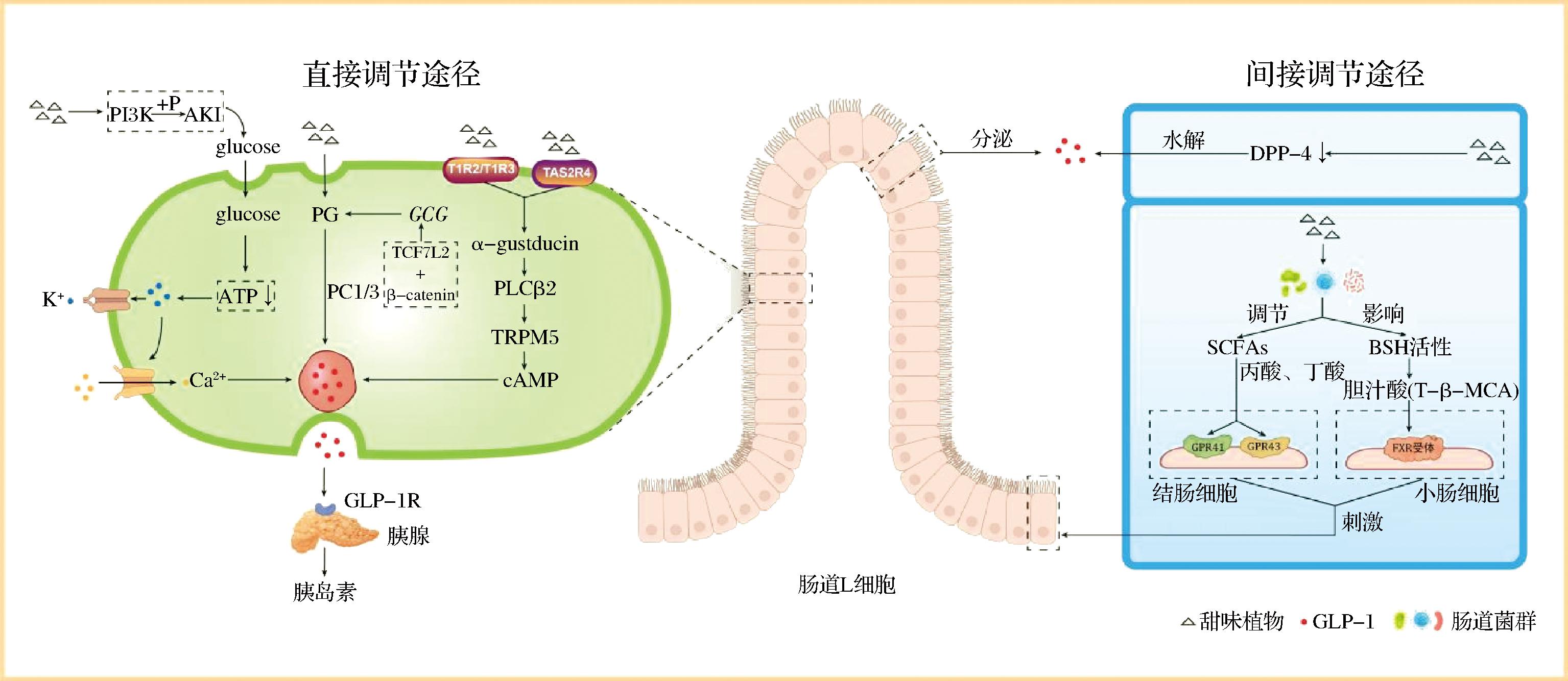
图1 甜味植物调节GLP-1的分子机制
Fig.1 Mechanism of GLP-1 regulation by sweet-taste plants
注:PI3K:磷酯酰肌醇3-激酶;Akt:蛋白激酶B;glucose:葡萄糖;ATP:腺嘌呤核苷三磷酸;PG:胰高血糖素原多肽;PC1/3:前激素转化酶1/3;GCG:胰高血糖素原基因;TCF7L2:转录因子7类似物2抗体;β-catenin:β-连环蛋白;T1R2/T1R3:甜味受体;α-gustducin:α味转导素;PLCβ2:磷脂酶;TRPM5:瞬时感受器电位阳离子通道;cAMP:环磷酸腺苷;SCFAs:短链脂肪酸;BSH:胆汁盐水解酶;GPR41/GPR43:短链脂肪酸受体;FXR:法尼醇X受体;T-β-MCA:牛磺酸结合型β鼠胆酸;DPP-4:二肽基肽酶-4(一种丝氨酸蛋白酶);GLP-1R:胰高糖素样肽-1受体。
2.1 味觉受体途径
甜味受体(taste receptor type 1 member 2/3, T1R2/T1R3),最早于味蕾中被发现。机体依赖甜味受体获得甜味觉,进而诱发摄食喜好行为。新近研究显示,甜味受体在脑、胃肠道等多处组织细胞中也均有表现。肠道L细胞上的甜味受体与甜味物质结合后,可依次通过激活下游信号通路关键因子α味转导素(α-gustducin)、磷脂酶(PLCβ2)和瞬时感受器电位阳离子通道(TRPM5),启动第二信使cAMP并诱导GLP-1的分泌,从而调节胰岛素功能和糖代谢[34-35]。甜味植物中的“甜味”物质是甜味受体天然的激动剂。XIE等[36]用黄芪多糖培养肠内分泌细胞NCI-H716后,细胞释放GLP-1水平明显提升,但其作用可以被T1R2/T1R3抑制剂或cAMP抑制剂影响,提示黄芪多糖可通过甜味受体介导cAMP通路促进GLP-1的合成。YANG等[37]在实验研究过程中构建2型糖尿病大鼠模型,研究结果显示黄芪多糖具有显著的降血糖活性和胰岛素促进作用,其机制可能与上调大鼠甜味受体(T1R2/T1R3)及其通路(α-gustducin、PLCβ2、TRPM5)基因或蛋白的表达存在着一定关系。这将会有效促进机体GLP-1的合成,并使GLP-1受体处于激活状态,进而上调葡萄糖转运蛋白与葡萄糖协同转运蛋白的表达。与此同时,玉竹皂苷与甜味受体结合会有效促进GLP-1的合成,实现降低血糖的作用,但其详细机制尚不明确[38]。
甜菊糖苷是甜叶菊中的一类高甜度皂苷物质,包括甜菊糖苷、莱鲍迪苷A和莱鲍迪苷D等,有较好的降糖生物活性[39]。作为一种商业化的甜味剂,甜菊糖苷里的甜苦味可能破坏食物的味觉体验,因而成为其提取工艺和风味改良的重点[20]。NOYA-LEAL等[40]研究发现,甜菊糖苷中的莱鲍迪苷A能独立于甜味受体,与肠道内分泌细胞中的苦味受体信号通路相互作用,以浓度依赖的方式通过作用于苦味受体4亚型,促进GLP-1的释放。苦味受体跟甜味受体共用下游通路,在细胞信号传递机制上存在交互作用[41]。因此,TRPM5等共有的关键信号分子可能是GLP-1能够被不同类型味觉分子调节的生物学基础。这一研究丰富了人们对甜味植物仅激活甜味受体的固有认识,提示除甜味受体外其他味觉受体也可能参与了甜味植物调节内源性GLP-1分泌过程,同时对部分甜味植物中“苦味”的来源提出了另一角度的科学解释和应用的新思路。
2.2 PG/PC1/3途径
PG是由胰高血糖素原基因(proglucagon,GCG)编码的多肽前体,可转化为多种生物活性肽;PC1/3广泛存在于肠道内分泌细胞中,可有效识别PG前体蛋白,并将其剪切成具有一定活性的GLP-1肽段[42]。GLP-1在“肠促胰岛素效应”的作用下,会使体内胰岛素的分泌处于动态平衡状态,进而使人体血糖水平相对稳定。基于此,调节肠道L细胞中GCG基因或PG、PC1/3蛋白的表达会使得GLP-1合成受到一定程度的影响,进而有效降低患者血糖水平。黄芪甲苷是甜味植物黄芪中非常重要的一种活性成分,属皂苷类物质。黄陈等[43]在实验研究过程中提出,黄芪甲苷可使2型糖尿病大鼠的血糖水平显著降低,并有效促进其血液和肠道细胞中GLP-1的合成,推测其降血糖的功效与促进GLP-1合成之间存在一定的关联。与此同时,他们在实验研究过程中还发现,受到其干预作用,2型糖尿病大鼠血液和肠道细胞中GCG和PC1/3 mRNA的表达明显上调,这表明其通过PG/PC1/3途径有效促进了GLP-1的合成,进而发挥了一定的降血糖功效。相关医学研究结果表明,黄精多糖具有降血糖作用[44]。杨光[5]通过体外实验发现,多花黄精多糖可以显著地上调与GLP-1分泌与表达相关基因GCG与酶PC1/3的表达、增强PC1/3的活性,提高NCI-H716细胞内GLP-1的浓度,刺激GLP-1的分泌。多花黄精多糖可以通过作用PG/PC1/3途径促进GLP-1的分泌,进一步提示多花黄精多糖具有降血糖功效可能与其能够促进GLP-1分泌有关。这些研究结果表明,调节GCG基因和PC1/3蛋白的表达,促进内源性GLP-1的分泌是甜味植物活性成分发挥降血糖作用的途径之一。
2.3 Wnt/β-catenin途径
Wnt/β-catenin通路参与细胞增生繁殖和衰老死亡等过程[45]。研究发现,转录因子7类似物2抗体(transcription factor 7-like 2,TCF7L2)与该信号通路的关键入核蛋白β-catenin结合,可上调GCG mRNA表达,进而促进肠道L细胞分泌GLP-1[46-47]。这可能是该通路的变化常与糖尿病等多种代谢性疾病的发生和进展紧密相连的重要原因。枸杞多糖是枸杞子中的主要活性成分,可通过刺激GLP-1的分泌,发挥改善胰岛素抵抗、调节糖代谢等多种降血糖生理功能,但其具体机制尚不清楚[48]。邓姝颖[7]采用不同浓度的枸杞多糖干预小鼠肠道内分泌细胞STC-1,结果显示STC-1细胞中核蛋白等3种蛋白中的β-catenin表达水平显著上调,同时伴随着枸杞多糖浓度的明显提高,核转位、TCF7L2与β-catenin的结合强度以及GCG mRNA的表达均随之增加。这说明枸杞多糖等甜味植物活性成分会使Wnt/β-catenin通路处于激活状态,并使得GCG mRNA的表达显著上调,一定程度上会促进GLP-1的合成,进而实现降血糖的作用。YANG等[26]另一项关于葛根素的研究印证了这一观点。葛根素是葛根中提取出的异黄酮类物质,可促进高糖条件下胰岛β细胞存活并恢复肥胖糖尿病小鼠的葡萄糖平衡,其机制涉及诱导TCF7L2表达上调,激活Wnt信号通路对GLP-1的调节。但这项研究中葛根素组小鼠循环中GLP-1水平与正常对照组并无差异。这可能与GLP-1受体信号传导激活后,GLP-1的降解增强或负反馈其表达合成等其他GLP-1生理调节机制的参与有关。这一研究提示GLP-1调控的复杂性,也从另一角度展示了天然甜味植物多靶点、多途径调节内源性GLP-1分泌并维持其循环稳态的优越性。
2.4 PI3K/AKT途径
PI3K及其下游的AKT组成的PI3K/AKT信号通路在调节内源性GLP-1分泌,维持糖代谢平衡方面扮演着非常重要角色。该通路会使得细胞对葡萄糖的吸收效率及多种营养物质的感应都显著提升,进而有效促进GLP-1的合成,这将使机体内胰岛素的含量明显增加[49]。相关医学研究发现,地黄多糖可有效刺激GLP-1和葡萄糖依赖性促胰岛素释放肽的释放,进而使肥胖型糖尿病大鼠的血糖、血脂等相关指标得到显著改善[50]。CHEN等[51]发现,地黄多糖干预可明显提高STC-1细胞中PI3K和AKT磷酸化水平,并促进了GLP-1激素的释放。提示地黄多糖促进GLP-1分泌的机制与激活PI3K/AKT通路密切相关。同样的,黄芪甲苷会干预PI3K/AKT通路,进而促进机体对GLP-1的合成。黄陈等[43]采用不同浓度的黄芪甲苷和PI3K/AKT特异性抑制剂分别对NCI-H716细胞进行处理,实验研究结果表明,在黄芪甲苷的作用下,NCI-H716细胞合成GLP-1的能力明显增强;但在PI3K/AKT的作用下,原本由黄芪甲苷引发的GLP-1分泌增强效果被明显抑制。提示除PG/PC1/3通路外,黄芪甲苷会通过PI3K/AKT促进GLP-1的合成来实现降低血糖的作用。
2.5 肠道菌群/SCFAs和肠道菌群/BSH/FXR途径
SCFAs是来源于植物纤维或多糖类物质的肠道菌群代谢产物,主要包括丁酸和丙酸等。它们会使结肠中GPR41和GPR43受体处于激活状态,或通过增强GPR41/43基因或蛋白的表达而触发GLP-1的分泌[52]。番泻叶苷是从番泻叶中提取出的二蒽酮类衍生物,是其中一种较为丰富的活性成分。LE等[53]研究发现,番泻叶苷对于肥胖小鼠血液和肠道细胞中GLP-1水平的改善有着极其重要的作用,可以有效增强小鼠对胰岛素的敏感性,进而使小鼠血糖显著降低。其机制可能与其修复肥胖小鼠结肠黏膜结构,改善肠道微生态环境和SCFAs组成,上调GPR41和GPR43的表达,增加GLP-1的合成之间有一定的关联。SONG等[15]研究发现,黄芪多糖会使糖尿病小鼠肠道菌群得以修复,进而促进SCFAs的合成,增强GPR41/43的表达,提示黄芪多糖会对肠道菌群/SCFAs产生一定的影响,进而对GLP-1的合成起到一定的调控作用,最终实现糖代谢过程的稳定。
FXR是维持体内胆汁酸分泌状态稳定和肝肠微生态的重要受体,其广泛存在于肝脏及小肠等多处组织细胞中[54]。BSH能通过调节控制部分胆汁酸的含量对肠道FXR起到一定的抑制作用,进而促进肠L细胞合成GLP-1[55-56]。这是BSH/FXR对肥胖引起的糖代谢紊乱和胰岛素抵抗等症状,均能起到一定的缓解作用的重要原因。BSH的活性受到肠道菌群的影响,因此可认为BSH/FXR是肠道菌群调节GLP-1分泌的另一途径[57]。绞股蓝皂苷是从绞股蓝中分离得到的一组达玛烷三萜皂苷,具有调节血糖平衡的作用[58]。XIE等[59]发现股蓝皂苷在体内生物活性代谢产物三铁皂苷元2α-OH-原人参二醇可调节高脂高糖饮食诱导下的小鼠肠道菌群中微生物的比例,抑制BSH活性并增加肠道中具有抑制FXR作用的牛磺酸结合型β鼠胆酸的累积,进而使得FXR的转录活性明显下降,引诱GLP-1的生成与释放。这些研究结果提示甜味植物除直接影响肠道L细胞分泌GLP-1外,也可能通过体内代谢物经肠道菌群间接影响GLP-1,发挥降糖活性。
2.6 DPP-4途径
DPP-4是一种普遍存在于机体内各个组织的丝氨酸蛋白酶,可作用于GLP-1、葡萄糖依赖性促胰岛素释放肽等肠促胰岛素,将其迅速降解失活进而干扰血糖代谢[60]。因此,抑制DPP-4蛋白的表达或破坏DPP-4,可以有效的减少体内GLP-1降解,延长它们的半衰期,从而增加体内胰岛素的分泌,并维持血糖稳态。目前已有西格列汀、维格列汀等DPP-4抑制剂应用于临床,为间接影响GLP-1的一类药物。历代传统医学典籍均有将肉桂用于糖尿病治疗的记载,然而其降糖调脂的机制尚未明确。顾嘉琪等[61]研究表明,肉桂水提液可以通过降低糖尿病小鼠DPP-4的表达及升高GLP-1的水平,恢复肠促胰效应,降低机体血糖水平。提示甜味植物也可能通过DPP-4间接影响GLP-1,但这一研究并未明确肉桂影响DPP-4的有效部位或成分。戚志强等[62]发现,芦笋水提液及各膜分离部位对DPP-4均有抑制,且各部位对DPP-4的抑制率均不同,这可能是因为不同膜分离部位中所含有的活性成分各不相同,因而在功效上呈现了差异性。具体来说,不同组分中多糖、多酚与含氮类物质含量越高则DPP-4抑制率越高,而黄酮含量越高则DPP-4抑制率越低。此研究结果为后续确定芦笋中抑制DPP-4作用的活性成分奠定基础,也为未来探究甜味植物中发挥DPP-4抑制作用的活性成分提示了方向。此外,另有苏木和番石榴等甜味植物也已被发现其降糖作用与抑制DPP-4活性密不可分[63]。
3 结语与展望
甜味植物在糖尿病防治方面具有独特的优势。一方面,中医理论认为五味之一的甘甜味具有益气生津、和中止渴的功效,而糖尿病暨“消渴病”的用药思路正与之相契合。许多甜味植物(如人参、枸杞、山药等)被视为“甘味中药”广泛运用于治疗糖尿病的方剂中,滋养脾胃、调和气血。从而发挥调节体内代谢,改善血糖水平,辅助治疗糖尿病的作用。这些甜味植物在传统中医实践中的宝贵经验,为现代医学对其研究提供了宝贵的启示。另一方面,甜味植物“味甜”却能“降糖”,将其作为功能性食品原料和甜味剂开发,潜力巨大。但目前尚缺乏对其应用于糖尿病治疗的机制解释,限制其了进一步开发利用。未来,运用现代生物技术探索甜物植的药理作用机制、发掘潜力化合物,开发利用好甜味植物资源将进一步助力于传统医学文化的继承与革新。
随着对GLP-1的深入研究,司美格鲁肽等GLP-1受体激动剂及西格列汀等DPP-4抑制剂已被开发并成功运用于临床治疗,降糖、减重疗效显著。近年来,已有多项研究证实甜味植物的降糖作用涉及内源性GLP-1调节。本研究归纳了数十种通过多种途径影响GLP-1,对血糖有一定调节控制作用的甜味植物活性成分及分子机制。从总结发现中不难发现,糖类、皂苷类、黄酮类及生物碱类等生物活性物质是甜味植物发挥“滋味”和“功效”共同作用的物质基础。未来研究工作可围绕这些甜味植物的活性成分展开,如运用分子生物技术、高通量筛选和复合药理学等前沿科学技术,对这些成分进行充分的提取、分离、判定和功能性验证等。现有作用于GLP-1的西药仍有一定局限性,深入研究甜味植物活性成分调节内源性GLP-1的合成与分泌,开发出口服或更便捷给药的GLP-1药物,可有效增加患者对治疗的依从性并降低经济压力。此外,借鉴消渴方等传统医学组方对于联用药材的优化配置经验也可为现代药物设计提供了灵感。可基于甜味植物活性成分开发既有GLP-1增敏作用又能通过其他机制辅助降糖的复方制剂,通过多组分、多途径的方式发挥其抗糖尿病的作用。此外,目前甜菊糖苷、罗汉果甜苷等多种苷类化合物已被率先被开发应用为商业代糖,具有类似传统甜味剂的的味道特性,又不会引起较大的血糖波动。此类甜味剂及基于此研发的健康食品符合当前“全民控糖”的理念,也有较好的开发基础及市场需求。
值得注意的是,虽已鉴定出多种甜味植物生物活性物质,但目前对这些成分与GLP-1确切作用的了解仍有限。现有研究往往停留在单一成分和单一机制的认知上,且大多数已知的活性成分在体内的药代动力学过程尚不清楚。此外,关于甜味植物复杂成分间相互协同或拮抗效应及其长期使用下可能产生不良反应的评估也相对不足。本研究对甜味植物调节GLP-1的现有研究成果进行了综述,有助于研究者开阔思路。未来,对于甜味植物的研究仍需加强对其复杂机制的深入剖析,并进一步验证其疗效及安全性,为甜味植物资源在糖尿病防治领域的应用提供更为可靠的科学支持。
[1] SUN H, SAEEDI P, KARURANGA S, et al.IDF Diabetes Atlas:Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J].Diabetes Research and Clinical Practice, 2022, 183:109119.
[2] JUNG H, TITTEL S R, SCHLOOT N C, et al.Clinical characteristics, treatment patterns, and persistence in individuals with type 2 diabetes initiating a glucagon-like peptide-1 receptor agonist:A retrospective analysis of the Diabetes Prospective Follow-Up Registry[J].Diabetes, Obesity &Metabolism, 2023, 25(7):1813-1822.
[3] XIE Y C, ZHOU Q, HE Q J, et al.Opportunities and challenges of incretin-based hypoglycemic agents treating type 2 diabetes mellitus from the perspective of physiological disposition[J].Acta Pharmaceutica Sinica B, 2023, 13(6):2383-2402.
[4] 邹越霄, 王庆仙, 齐冬梅, 等.中药糖类提取物的定性与定量方法研究进展[J].中华中医药杂志, 2023, 38(2):710-718.ZOU Y X, WANG Q X, QI D M, et al.Research progress on qualitative and quantitative methods of carbohydrate extracts from traditional Chinese medicine[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2023, 38(2):710-718.
[5] 杨光. 多花黄精多糖对GLP-1分泌与表达的调节及其分子机制研究[D].合肥:合肥工业大学, 2018.YANG G.The effect of Polygonatum cyrtonema Hua polysaccharides (PCP) on the expression and secretion of GLP-1 and its molecular mechanism[D].Hefei:Hefei University of Technology, 2018.
[6] KUANG M T, LI J Y, YANG X B, et al.Structural characterization and hypoglycemic effect via stimulating glucagon-like peptide-1 secretion of two polysaccharides from Dendrobium officinale[J].Carbohydrate Polymers, 2020, 241:116326.
[7] 邓姝颖. 基于GLP-1的“肠促胰素效应” 研究口服枸杞多糖的抗T2DM作用机制[D].银川:宁夏医科大学, 2021.DENG S Y.Study on the anti-T2DM mechanism of oral lycium barbarum polysaccharide based on the “incretin effect” of GLP-1[D].Yinchuan:Ningxia Medical University, 2021.
[8] DONG Y H, WANG Z X, CHEN C, et al.A review on the hypoglycemic effect, mechanism and application development of natural dietary polysaccharides[J].International Journal of Biological Macromolecules, 2023, 253:127267.
[9] CHENG Y N, TIAN S L, CHEN Y, et al.Structural characterization and in vitro fermentation properties of polysaccharides from Polygonatum cyrtonema[J].International Journal of Biological Macromolecules, 2024, 258:128877.[10] 张洁, 张巧铃, 卢凤来, 等.罗汉果根多糖的分离纯化及免疫活性研究[J].中草药, 2024, 55(4):1100-1109.ZHANG J, ZHANG Q L, LU F L, et al.Isolation, purification and immunomodulatory activity of polysaccharides from roots of Siraitia grosuenorii[J].Chinese Traditional and Herbal Drugs, 2024, 55(4):1100-1109.
[11] LI Z G, AN L J, ZHANG S J, et al.Structural elucidation and immunomodulatory evaluation of a polysaccharide from Stevia rebaudiana leaves[J].Food Chemistry, 2021, 364:130310.
[12] ROZI P, ABUDUWAILI A, MA S J, et al.Isolations, characterizations and bioactivities of polysaccharides from the seeds of three species Glycyrrhiza[J].International Journal of Biological Macromolecules, 2020, 145:364-371.
[13] 魏菱鸽, 李慧, 米圣成, 等.白茅根多糖理化性质及对HepG2细胞的降糖作用研究[J/OL].食品与发酵工业, 1-16[2024-04-08].http://doi.org.hnucm.opac.vip/10.13995/j.cnki.11-1802/ts.037115.WEI L G, LI H, MI S C, et al.Study on Physicochemical properties and hypoglycemic effects of polysaccharide from Rhizoma Alba L.on HepG2 cells[J/OL].Food and Fermentation Industry, 1-16 [2024-04-08].http://doi.org.hnucm.opac.vip/10.13995/j.cnki.11-1802/ts.037115.
[14] ZHAO T, YANG M, MA L N, et al.Structural modification and biological activity of polysaccharides[J].Molecules, 2023, 28(14):5416.
[15] SONG Q B, CHENG S W, LI D, et al.Gut microbiota mediated hypoglycemic effect of Astragalus membranaceus polysaccharides in db/db mice[J].Frontiers in Pharmacology, 2022, 13:1043527.
[16] ZHANG H X, WANG Z Z, DU Z Z.Sensory-guided isolation and identification of new sweet-tasting dammarane-type saponins from Jiaogulan (Gynostemma pentaphyllum) herbal tea[J].Food Chemistry, 2022, 388:132981.
[17] SCHMID C, MITTERMEIER-KLEßINGER V, TABEA PETERS V C, et al.Quantitative mapping of flavor and pharmacologically active compounds in European licorice roots (Glycyrrhiza glabra L.) in response to growth conditions and arbuscular mycorrhiza symbiosis[J].Journal of Agricultural and Food Chemistry, 2021, 69(44):13173-13189.
[18] 戴胜, 汪惠丽.天然甜味剂罗汉果甜苷的研究进展[J].中成药, 2023, 45(2):503-509.DAI S, WANG H L.Research progress of natural sweetener mogroside[J].Chinese Traditional Patent Medicine, 2023, 45(2):503-509.
[19] 陈絮蒙, 王雅靖, 陈靓, 等.青钱柳活性物质及其代谢调节作用的研究与应用进展[J].食品与发酵工业, 2023, 49(12):336-344.CHEN X M, WANG Y J, CHEN L, et al.Research and application progress of active substances and their metabolic regulatory effects of Cyclocarya paliurus[J].Food and Fermentation Industries, 2023, 49(12):336-344.
[20] 田欣雨. 甜菊糖苷单体结构与其甜苦味感官表现的相关性研究[D].无锡:江南大学, 2021.TIAN X Y.Correlation between steviol glycosides structure and their bitterness/sweetness sensory properties[D].Wuxi:Jiangnan University, 2021.
[21] LIU M Y, WANG P Y, ZHAO B L, et al.Chemical components and health benefits of Rubus suavissimus S.Lee (Chinese sweet tea) and the production method of rubusoside[J].Trends in Food Science &Technology, 2024, 143:104252.
[22] ZHANG Y L, ZHOU G S, PENG Y, et al.Anti-hyperglycemic and anti-hyperlipidemic effects of a special fraction of Luohanguo extract on obese T2DM rats[J].Journal of Ethnopharmacology, 2020, 247:112273.
[23] BAI L T, GAO J L, WEI F, et al.Therapeutic potential of ginsenosides as an adjuvant treatment for diabetes[J].Frontiers in Pharmacology, 2018, 9:423.
[24] WANG L Y, CHENG K C, LI Y X, et al.Glycyrrhizic acid increases glucagon like peptide-1 secretion via TGR5 activation in type 1-like diabetic rats[J].Biomedicine &Pharmacotherapy, 2017, 95:599-604.
[25] WEI X F, WANG Y K, LIU R T, et al.Review of natural plant-derived seco-triterpenoids and derived saponins from 2020 to 2023:New compounds, distributions, diverse activities and structure-activity relationships[J].Phytochemistry Reviews, 2024:DOI https://doi.org/10.1007/s11101-024-09917-z
[26] YANG L, YAO D D, YANG H Y, et al.Puerarin protects pancreatic β-cells in obese diabetic mice via activation of GLP-1R signaling[J].Molecular Endocrinology, 2016, 30(3):361-371.
[27] SHAKOUR Z T A, FAYEK N M, FARAG M A.How do biocatalysis and biotransformation affect citrus dietary flavonoids chemistry and bioactivity? A review[J].Critical Reviews in Biotechnology, 2020, 40(5):689-714.
[28] YANG J, HUANG Y Y, YANG Z, et al.Identification and quantitative evaluation of major sweet ingredients in sweet (Lithocarpus polystachyus Rehd.) based upon location, harvesting time, leaf age[J].Journal of the Chemical Society of Pakistan, 2018, 40(1):158.
[29] REN Z M, LIU Z H.Receptor, signal transduction and evolution of sweet, umami and bitter taste[J].Marine Life Science &Technology, 2020, 2(1):6-15.
[30] MA J, MA X L, JIANG Z B, et al.Molecular network technology for discovering new alkaloids glycosides from goji berry[J].Brazilian Journal of Botany, 2023, 46(3):573-582.
[31] ZHENG Q G, MU X Y, PAN S B, et al.Ephedrae herba:A comprehensive review of its traditional uses, phytochemistry, pharmacology, and toxicology[J].Journal of Ethnopharmacology, 2023, 307:116153.
[32] ZHANG S W, CHENG F, YANG L, et al.Chemical constituents from Glehnia littoralis and their chemotaxonomic significance[J].Natural Product Research, 2020, 34(19):2822-2827.
[33] 魏小成, 李成义, 周瑞娟, 等.无机元素与中药关系研究进展[J].中国中医药信息杂志, 2022, 29(7):140-144.WEI X C, LI C Y, ZHOU R J, et al.Research progress in relationship between inorganic elements and Chinese materia medica[J].Chinese Journal of Information on Traditional Chinese Medicine, 2022, 29(7):140-144.
[34] BEHRENS M, LANG T.Extra-oral taste receptors-function, disease, and perspectives[J].Frontiers in Nutrition, 2022, 9:881177.
[35] VON MOLITOR E, RIEDEL K, KROHN M, et al.Sweet taste is complex:Signaling cascades and circuits involved in sweet sensation[J].Frontiers in Human Neuroscience, 2021, 15:667709.
[36] XIE S Z, YANG G, JIANG X M, et al.Polygonatum cyrtonema Hua polysaccharide promotes GLP-1 secretion from enteroendocrine L-cells through sweet taste receptor-mediated cAMP signaling[J].Journal of Agricultural and Food Chemistry, 2020, 68(25):6864-6872.
[37] YANG Z M, WANG Y, CHEN S Y.Astragalus polysaccharide alleviates type 2 diabetic rats by reversing the glucose transporters and sweet taste receptors/GLP-1/GLP-1 receptor signaling pathways in the intestine-pancreatic axis[J].Journal of Functional Foods, 2021, 76:104310.
[38] 李婷, 邓碧莲, 欧阳征海, 等.基于甜味受体整合中药“效味” 和“滋味” 探索玉竹甘味药性物质基础[J].中草药, 2023, 54(3):849-858.LI T, DENG B L, OUYANG Z H, et al.Exploration on material basis of sweet medicinal properties of Polygonatum odoratum by integrating “effective taste” and “taste” of traditional Chinese medicine based on sweet receptors[J].Chinese Traditional and Herbal Drugs, 2023, 54(3):849-858.
[39] ORELLANA-PAUCAR A M.Steviol glycosides from Stevia rebaudiana:An updated overview of their sweetening activity, pharmacological properties, and safety aspects[J].Molecules, 2023, 28(3):1258.
[40] NOYA-LEAL F, VAN DER WIELEN N, BEHRENS M, et al.Rebaudioside A from Stevia rebaudiana stimulates GLP-1 release by enteroendocrine cells via bitter taste signalling pathways[J].Food &Function, 2023, 14(15):6914-6928.
[41] AHMAD R, DALZIEL J E.G protein-coupled receptors in taste physiology and pharmacology[J].Frontiers in Pharmacology, 2020, 11:587664.
[42] MCLEAN B A, WONG C K, CAMPBELL J E, et al.Revisiting the complexity of GLP-1 action from sites of synthesis to receptor activation[J].Endocrine Reviews, 2021, 42(2):101-132.
[43] 黄陈, 杨海峰.黄芪甲苷对2型糖尿病大鼠胰高血糖素样肽-1分泌的影响研究[J].中兽医医药杂志, 2022, 41(4):1-6.HUANG C, YANG H F.Effect of Astragaloside Ⅳ on GLP-1 secretion in type 2 diabetic rats[J].Journal of Traditional Chinese Veterinary Medicine, 2022, 41(4):1-6.
[44] LI R S, TAO A E, YANG R M, et al.Structural characterization, hypoglycemic effects and antidiabetic mechanism of a novel polysaccharides from Polygonatum kingianum Coll.et Hemsl[J].Biomedicine &Pharmacotherapy, 2020, 131:110687.
[45] HAYAT R, MANZOOR M, HUSSAIN A.Wnt signaling pathway:A comprehensive review[J].Cell Biology International, 2022, 46(6):863-877.
[46] DEL BOSQUE-PLATA L, MART NEZ-MART
NEZ-MART NEZ E, ESPINOZA-CAMACHO M
NEZ E, ESPINOZA-CAMACHO M  , et al.The role of TCF7L2 in type 2 diabetes[J].Diabetes, 2021, 70(6):1220-1228.
, et al.The role of TCF7L2 in type 2 diabetes[J].Diabetes, 2021, 70(6):1220-1228.
[47] NAGAHISA T, YAMAGUCHI S, KOSUGI S, et al.Intestinal epithelial NAD+ biosynthesis regulates GLP-1 production and postprandial glucose metabolism in mice[J].Endocrinology, 2022, 163(4):bqac023.
[48] 刘婷婷. 枸杞多糖经TLR4/MyD88/NF-κB信号通路对T2DM炎症因子的作用[D].银川:宁夏医科大学, 2019.LIU T T.Effect of Lycium barbarum polysaccharide on T2DM inflammatory cytokines via TLR4/MyD88/NF-κB signaling pathway[D].Yinchuan:Ningxia Medical University, 2019.
[49] HJØRNE A P, MODVIG I M, HOLST J J.The sensory mechanisms of nutrient-induced GLP-1 secretion[J].Metabolites, 2022, 12(5):420.
[50] QI L, SHUAI T, DA J, et al.In-vitro GLP-1 release assay using STC-1 cells[J].Bio-protocol, 2020, 10(16):e3717.
[51] CHEN H E, LIU X Y, XIE M X, et al.Two polysaccharides from Rehmannia glutinosa:Isolation, structural characterization, and hypoglycemic activities[J].RSC Advances, 2023, 13(43):30190-30201.
[52] AN Y C, DAI H Y, DUAN Y H, et al.The relationship between gut microbiota and susceptibility to type 2 diabetes mellitus in rats[J].Chinese Medicine, 2023, 18(1):49.
[53] LE J M, ZHANG X Y, JIA W P, et al.Regulation of microbiota-GLP1 axis by sennoside A in diet-induced obese mice[J].Acta Pharmaceutica Sinica B, 2019, 9(4):758-768.
[54] MEADOWS V, YANG Z N, BASALY V, et al.FXR friend-ChIPs in the enterohepatic system[J].Seminars in Liver Disease, 2023, 43(3):267-278.
[55] YANG Y N, WU C M.Targeting gut microbial bile salt hydrolase (BSH) by diet supplements:New insights into dietary modulation of human health[J].Food &Function, 2022, 13(14):7409-7422.
[56] NISS K, JAKOBSSON M E, WESTERGAARD D, et al.Effects of active farnesoid X receptor on GLUTag enteroendocrine L cells[J].Molecular and Cellular Endocrinology, 2020, 517:110923.
[57] WANG Q L, LIN H B, SHEN C R, et al.Gut microbiota regulates postprandial GLP-1 response via ileal bile acid-TGR5 signaling[J].Gut Microbes, 2023, 15(2):2274124.
[58] SONG M X, TAN D H, LI B, et al.Gypenoside ameliorates insulin resistance and hyperglycemia via the AMPK-mediated signaling pathways in the liver of type 2 diabetes mellitus mice[J].Food Science and Human Wellness, 2022, 11(5):1347-1354.
[59] XIE Z F, JIANG H W, LIU W, et al.The triterpenoid sapogenin (2α-OH-protopanoxadiol) ameliorates metabolic syndrome via the intestinal FXR/GLP-1 axis through gut microbiota remodelling[J].Cell Death &Disease, 2020, 11(9):770.
[60] MATHUR V, ALAM O, SIDDIQUI N, et al.Insight into structure activity relationship of DPP-4 inhibitors for development of antidiabetic agents[J].Molecules, 2023, 28(15):5860.
[61] 顾嘉琪, 覃骊兰, 苏榕, 等.肉桂对糖尿病大鼠肠促胰素效应的调节作用[J].中国实验方剂学杂志, 2023, 29(12):104-111.GU J Q, QIN L L, SU R, et al.Cinnamomi cortex regulates incretin effect in diabetic rats[J].Chinese Journal of Experimental Traditional Medical Formulae, 2023, 29(12):104-111.
[62] 戚志强, 田颖刚.芦笋水提物的不同膜分离部位对二肽基肽酶-Ⅳ活性的影响及其成分分析[J/OL].食品工业科技,1-11[2024-03-25].http://doi.org.hnucm.opac.vip/10.13386/j.issn1002-0306.2023090224.QI Z Q, TIAN Y G.Effects of different membrane separation sites on the activity of dipeptidyl peptidase-Ⅳ of water extract of asparagus and its composition analysis[J/OL].Science and Technology of Food Industry,1-11[2024-03-25].http://doi.org.hnucm.opac.vip/10.13386/j.issn1002-0306.2023090224.
[63] SETYANINGSIH E P, SAPUTRI F C, MUN’IM A.The antidiabetic effectivity of Indonesian plants extracts via DPP-IV inhibitory mechanism[J].Journal of Young Pharmacists, 2019, 11(2):161-164.