芝麻(Sesamum indicum L.)是一种极具特色油料作物,其油脂具有独特的清香,富含油酸、亚油酸等人体必需脂肪酸,此外还含有丰富的生理活性物质,如维生素E、木脂素、植物甾醇、叶酸和黄酮等[1]。木脂素是一类植物中广泛存在的多酚类天然产物,具有很强的抗氧化活性[2-3]。芝麻籽中木脂素含量约为0.5%~1%,因而芝麻油的不饱和脂肪酸含量虽高(81%~89%),却仍具有良好的储藏稳定性[4]。依据芝麻木脂素的溶解特性,可将其划分为脂溶性和水溶性两类,前者包括芝麻林素、芝麻林素酚、松脂醇、芝麻素和芝麻素酚等,后者则是以脂溶性芝麻木脂素为苷元,葡萄糖为糖基,缩合反应形成的糖苷[5]。
虽然芝麻籽和芝麻油中的芝麻素酚含量较低,但其具有抗氧化、抗肿瘤、抗炎、神经保护等多种生理活性功能,并且热稳定性极强[6],因而具有较高的应用价值和巨大的开发潜力[7]。但是,药理作用机制尚不完全明晰,并且分离纯化成本仍居高不下,限制了芝麻素酚的研究和应用。近年来,得益于现代仪器和分析检测方法的快速发展,芝麻素酚生理功能研究得以逐步深入;同时,随着现代分离纯化技术的迅速发展,分离纯化成本亦逐渐下降,使其生理活性功能研究及产品应用开发迎来了重要的发展契机。本文综述了近年来芝麻素酚生理活性功能的最新研究进展,从抗氧化、抗肿瘤、心血管保护等7个方面对其进行了梳理,并对研究的局限性及应对策略进行了探讨,同时对研究和产业发展前景进行了展望,以期为芝麻素酚生理活性功能研究及相关产品应用开发提供参考和借鉴。
1 芝麻素酚的化学结构
1985年,FUKUDA等[8]在芝麻籽的丙酮提取物中鉴定到一个抗氧化活性极强的新化合物,将其命名为芝麻素酚,其分子式为C20H18O7,化学结构如图1-a所示。在酸性白土脱色的芝麻油中,NAGATA等[9]通过核磁共振色谱和X射线单晶衍射发现,芝麻素酚具有4种立体异构体(图1-b),即芝麻素酚、差向芝麻素酚、2-表芝麻素酚和6-表芝麻素酚。基于比较分子场分析模型的立体构象和静电场效应分析发现,芝麻素酚苯环上C2′位的酚羟基是赋予其抗氧化活性的重要官能团[10]。
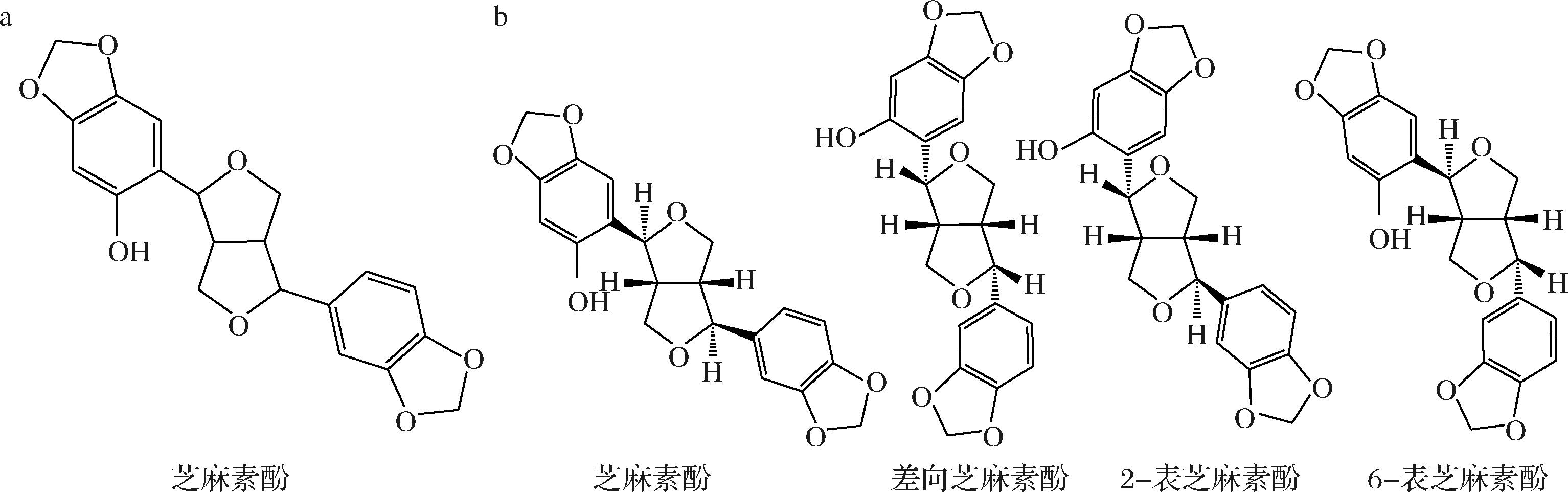
a-芝麻素酚的化学结构;b-芝麻素酚立体异构体的化学结构
图1 芝麻素酚及其立体异构体的化学结构
Fig.1 Chemical structure of sesaminol and its stereoisomers
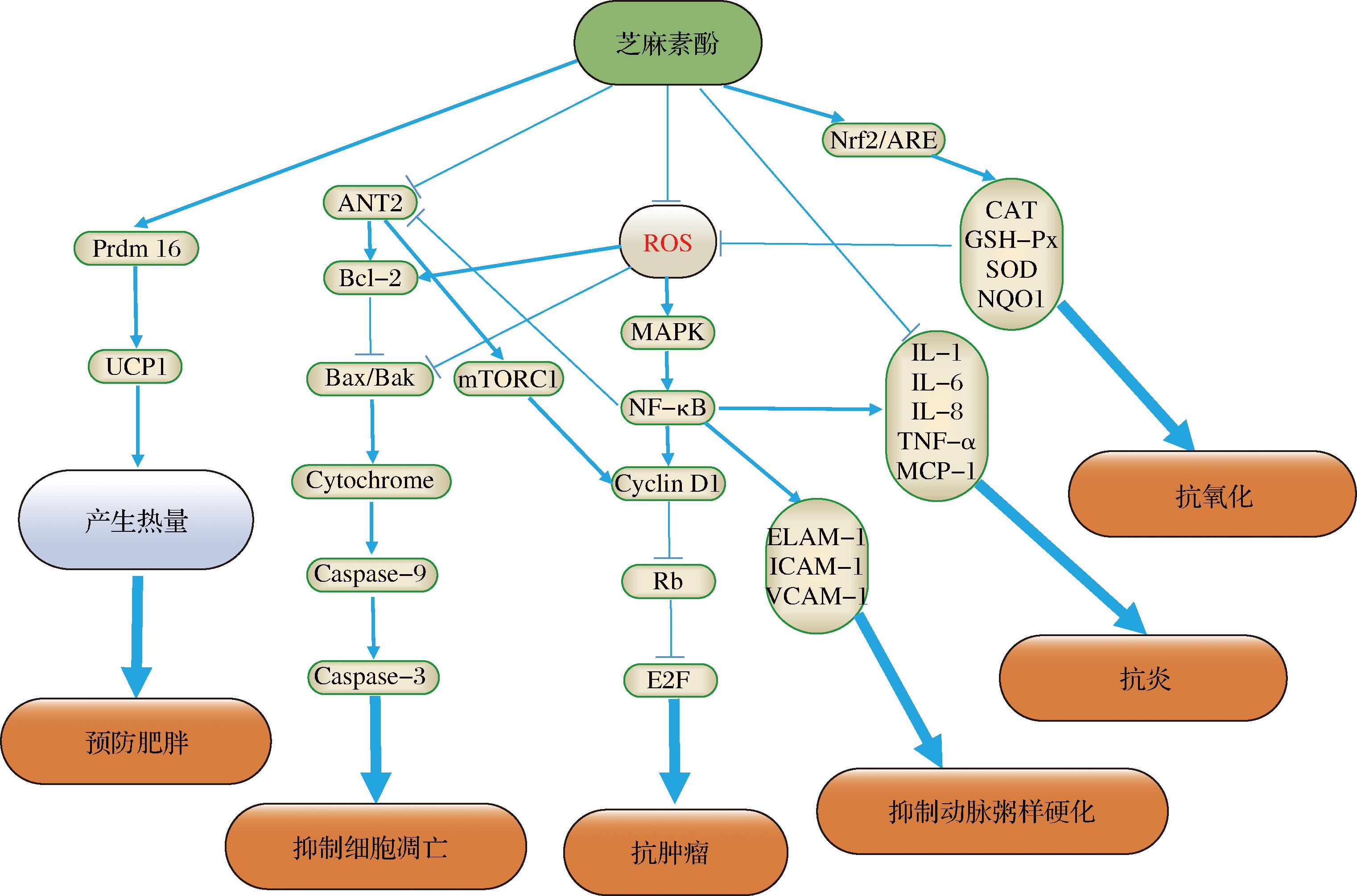
图2 芝麻素酚主要生理活性功能及分子作用机制(→, 激活;—|, 抑制)
Fig.2 Biological activities of sesaminol and its molecular mechanism
Bcl-2同源拮抗剂(Bcl-2 homologous antagonist/killer, Bak);含半胱氨酸的天冬氨酸蛋白水解酶9(Cysteinyl aspartate specific proteinase 9, caspase 9);含半胱氨酸的天冬氨酸蛋白水解酶3(Cysteinyl aspartate specific proteinase 3, Caspase-3);丝裂原活化蛋白激酶(Mitogen-activated protein kinases, MAPK);视网膜母细胞瘤基因(Retinoblastoma gene, Rb);转录因子E2F(Transcription factor E2F, E2F);核因子红细胞2相关因子2-抗氧化反应原件复合体(Nrf2-antioxidant response element, ARE)。
2 芝麻素酚的制备和分离纯化
目前,芝麻素酚的主要制备方式是酶水解芝麻素酚葡萄糖苷(sesaminol glucosides, SGs)、化学合成和芝麻林素分解。此外,通过微生物发酵芝麻粕和芝麻籽、高温烘焙芝麻籽、酸处理芝麻籽和芝麻油精炼时使用酸性白土脱色,可促使其他芝麻木脂素转化生成芝麻素酚,提高芝麻素酚的含量。
2.1 芝麻素酚的制备方式
2.1.1 SGs水解
SGs是芝麻素酚与不同数量(1~3)的葡萄糖配基通过糖苷键连接形成的糖苷。由于SGs主要存在于芝麻油提取后的副产物芝麻粕中,因此水解SGs是制备芝麻素酚的主要途径。GAO等[10]研究发现,β-半乳糖苷酶、β-葡萄糖苷酶、β-葡聚糖酶和纤维素酶均可水解芝麻素酚三葡萄糖苷(sesaminol triglucoside, STG)生成芝麻素酚,其中β-半乳糖苷酶催化效率最高,在反应温度50 ℃、反应时间4.0 h、pH 5.5、底物STG浓度1.0 mg/mL、酶用量20 mg/mL的最优条件下,芝麻素酚转化率高达98.88%。NAIR等[11]在类芽孢杆菌(Paenibacillus sp.)KB0549中鉴定到一个新的β-半乳糖苷酶PSTG,它同时具有β-1,2、β-1,4和β-1,6三种糖苷键水解功能,其β-1,2糖苷键水解效率甚至高于β-1,4和β-1,6糖苷键,可高效水解STG制备芝麻素酚。
此外,微生物在发酵过程中可产β-半乳糖苷酶,亦可催化STG水解制备芝麻素酚。因此,利用微生物发酵芝麻籽或芝麻粕,可促提高芝麻素酚含量。BAE等[12]利用3株乳酸菌——嗜酸乳杆菌(Lactobacillus acidophilus)、植物乳杆菌(Lactobacillus plantarum)P8和嗜热链球菌(Streptococcus thermophilus)S10发酵芝麻籽,以体积分数80%甲醇提取芝麻素酚,其含量分别达到30.6、35.1和32.9 mg/10 g芝麻籽。
2.1.2 化学合成
ISHIKAWA等[13]以4-氧丁酸甲酯和3,4-二硝基苯磺酰基苯甲醛为原料,以L-脯氨酸和双功能尿素为催化剂,催化二者的交叉羟醛缩合反应,并以喹甲烷为中间体构建呋喃骨架,最后合成芝麻素酚,产率为32%。HAMASHIMA等[14]先以1,1-二甲基烯丙醇为原料经过2步反应合成4-氧丁酸甲酯,随后采用与ISHIKAWA等[13]相似的路线合成了芝麻素酚,产率达到35%。
2.1.3 芝麻林素分解
芝麻林素的乙缩醛氧桥不稳定,酸性条件下易断裂,分解生成芝麻素酚[15-16]。盐酸和磷钨杂多酸均可催化芝麻林素分解生成芝麻素酚[17]。强酸性的磺酸阳离子交换树脂亦可催化芝麻林素分解生成芝麻素酚,在芝麻林素初始浓度6 mmol/L、溶剂甲苯体积5 mL、处理温度90 ℃、树脂用量16.66 g/mmol的最优条件下,芝麻素酚转化率达到75%[15]。FUKUDA等[16]使用酸性白土对冷榨芝麻油进行脱色,发现芝麻油中芝麻素酚含量大幅度提升,通过HPLC比较分析,发现芝麻素酚源自于芝麻林素的分解。
此外,高温处理亦可促使芝麻林素分解生成芝麻素酚。KUMAZAWA等[18]分别以218 ℃和230 ℃的高温烘焙芝麻籽,提取油脂检测,发现芝麻素酚浓度分别达到(1.68±0.28) μg/g芝麻籽和(3.99±0.46) μg/g芝麻籽,而未烘焙芝麻籽提取的油脂中则未检出,研究证实芝麻素酚源自于高温条件下芝麻林素的分解。
芝麻籽提取芝麻油后,水溶性SGs残留于副产物芝麻粕中。因此,通过酶水解或微生物发酵芝麻粕制备芝麻素酚,具有更高的经济效益和更好的发展前景。
2.2 芝麻素酚的分离纯化
甲醇、正己烷和乙酸乙酯是常用的芝麻素酚提取溶剂,柱层析、半制备和制备色谱是主要的芝麻素酚的纯化方法。KUMAZAWA等[18]联合Amberlite XAD-2大孔树脂层析柱和硅胶柱层析,以正己烷、正己烷-乙酸乙酯(8∶2)、甲醇和甲醇-蒸馏水进行洗脱,从烘焙型芝麻油中分离芝麻素酚,最后通过制备高效液相色谱纯化,但从300 mL芝麻油中仅获得3.0 mg芝麻素酚。MICHAILIDIS等[19]通过离心分配色谱从芝麻油中分离芝麻素酚,随后利用制备色谱纯化,纯度达85%。张丽霞等[20]以杂多酸催化芝麻林素分解,反应液经减压浓缩,硅胶柱层析和制备高效液相色谱纯化,纯度达到98.2%。高锦鸿等[21]以磁性介孔二氧化硅固定β-半乳糖苷酶,水解SGs制备芝麻素酚,反应产物经简单的超声提取、减压浓缩和冷冻干燥后即获得了纯度达99.2%的芝麻素酚。黄纪念等[22]以H型强酸性苯乙烯系阳离子交换树脂催化芝麻林素分解生成芝麻素酚,以硅胶柱层析纯化,相继以体积比为8∶1和4∶1的正己烷-乙酸乙酯洗脱,减压浓缩获得的芝麻素酚纯度高达97.63%,得率达到68.3%。
柱层析可有效地分离芝麻素酚,但其工艺复杂且耗时长,难以自动化,溶剂消耗量大难以回收,导致生产成本较高,因而难以工业化生产。半制备或制备色谱操作简单,自动化程度高,可快速高效地纯化芝麻素酚,但溶剂消耗量大,并且需购买昂贵的专业设备,因此目前多用于实验室科学研究,工业生产应用较为少见。β-半乳糖苷酶水解高纯度SGs和酸水解高纯度芝麻林素,芝麻素酚转化率高,反应产物仅需提取、减压浓缩及冷冻干燥等传统分离纯化工艺处理即可获得高纯度的芝麻素酚。随着现代分离技术的快速发展,芝麻林素和芝麻素酚分离纯化成本将逐步下降,酶水解SGs和酸水解芝麻林素将是未来制备芝麻素酚具有竞争力的选择。
3 芝麻素酚的生理活性功能
氧化应激是指机体由于自身病理原因、外界逆性胁迫或病原体等风险因子刺激条件下,活性氧(reactive oxygen species, ROS)大量积累,机体氧化应激失衡,从而造成机体氧化损伤[23]。ROS具有双重生物学功能,低水平时可清除入侵的病原微生物,介导机体细胞免疫,以及作为信号分子或第二信使参与细胞通讯等,对机体具有积极的意义;但ROS水平过高将影响信号传导,并可与核酸、酶、结构蛋白和脂类生物大分子发生非特异性氧化作用,导致结构损伤,如DNA碱基突变、DNA双链断裂、蛋白质氧化和膜脂过氧化等,从而引发机体衰老或疾病[23-24]。
ROS对机体生理功能具有重大的危害作用。高水平ROS可促进炎症发生[25];诱导细胞癌化形成肿瘤,促进肿瘤细胞活化、浸润和转移[26];引起或加剧动脉粥样硬化导致心血管疾病[24];诱导脑组织神经细胞凋亡,引发帕金森氏症和阿尔茨海默症等神经性疾病[27];抑制皮肤的透明质酸和胶原蛋白合成,并促进其降解,导致皮肤衰老[28]。芝麻素酚具有超强的抗氧化活性,可有效清除ROS,因此这也是其抗肿瘤、抗炎、延缓皮肤衰老、预防肥胖、心血管保护和神经保护等多种生理活性功能的基础。
3.1 抗氧化
芝麻素酚具有很强的自由基清除能力,主要通过提高胞内抗氧化酶活力、激活氧化应激转录因子和抑制膜脂过氧化等途径保护细胞免受氧化损伤[29]。
与芝麻素酚葡萄糖苷、芝麻素、芝麻林素以及泡桐素、麦冬高异黄酮A等其他芝麻木脂素及其衍生物相比,芝麻素酚具有更强的DPPH自由基和ABTS阳离子自由基清除能力[10]。在水相介质中,芝麻素酚对2,2′-偶氮二异丁基脒二盐酸盐[2,2′-Azobis-(2-amidinopropane)dihydrochloride, AAPH]的自由基清除能力甚至强于商业抗氧化剂α-生育酚和普罗布考(Probucol)[30]。
在双氧水和香烟烟雾提取物诱导构建的PC12鼠嗜铬细胞瘤细胞和BEAS-2B肺支气管上皮细胞氧化应激损伤细胞模型中,芝麻素酚处理可显著提高细胞存活率以及过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)活力,降低细胞凋亡率、高密度脂蛋白和ROS水平[31-32]。此外,芝麻素酚处理还可提高PC12鼠嗜铬细胞瘤细胞的谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活力[32]。
核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)可直接感应胞内ROS水平的变化,调控相应基因的表达维持细胞氧化还原平衡,并清除氧化受损的蛋白质,保护细胞免受氧化损伤[33-34]。以芝麻素酚处理6-羟基多巴胺诱导构建的神经母细胞瘤帕金森氏症模型细胞,可显著抑制ROS水平上升,上调Nrf2表达水平,增强NAD(P)H:醌氧化还原酶活力[35]。细胞受到氧化应激损伤时,氧化应激标志物,如8-羟基-2′-脱氧鸟苷(8-hydroxy-2′-deoxyguanosine, 8-OHDG)、丙二醛(malondialdehyde, MDA)和4-羟基烯醛(4-hydroxy-nonenal, 4-HNE)等,水平将升高。在乙醇诱导的氧化应激模型小鼠中,芝麻素酚处理可抑制小鼠8-OHDG、MDA和4-HNE水平的上升,说明芝麻素酚可有效缓解6-羟基多巴胺诱导的氧化应激损伤[36]。
低密度脂蛋白(low density lipoprotein, LDL)氧化将加速动脉粥样硬化进程,而芝麻素酚可抑制LDL的氧化,从而抑制和减缓动脉粥样硬化进程[30-32]。KANG等[30]以硫酸铜体外诱导人体LDL过氧化,发现芝麻素酚处理组的LDL过氧化产物4-HNE和MDA水平显著降低,说明芝麻素酚可保护LDL免受氧化作用。芝麻素酚抑制LDL氧化的机制主要有两种:一是与过氧化自由基反应阻断氧化链式反应;二是阻止多不饱和脂肪酸的自氧化作用[37]。
3.2 抗炎
炎症是机体的一种自我保护和防御机制,当机体受到感染、物理损伤或化学刺激时,免疫系统快速反应清除病原体和修复受损组织器官。但是,过度或长期持续的炎症反应将导致组织损伤加剧或引发疾病,如发烧、关节炎、自身免疫病、癌症和脏器衰竭等,甚至可能导致死亡[38]。因此,控制炎症对于维持机体稳态具有重要的意义。
芝麻素酚可抑制促炎因子表达,具有良好的抗炎活性。肿瘤坏死因子(tumor necrosis factor, TNF)和白细胞介素(interleukin, IL)是两类主要的促炎因子,而单核细胞趋化蛋白1(monocyte chemoattractant protein 1, MCP-1)可以激活炎症相关信号通路,因此TNF、IL和MCP-1水平的上升将促进细胞炎症发生。在乙醇诱导构建炎症小鼠模型中,喂服芝麻素酚可显著降低促炎因子TNF-α、IL-6和MCP-1水平,证实芝麻素酚具有良好的抗炎活性[36]。随后以香烟烟雾提取物处理BEAS-2B肺支气管上皮细胞,构建炎症细胞模型,并将其与芝麻素酚共培养,发现芝麻素酚可显著降低细胞的IL-6和IL-8转录水平,提高细胞存活率[31]。此外,KATAYAMA等[39]研究发现,以芝麻素酚喂饲SAMP8阿尔茨海默症模型小鼠,其脑组织的IL-6、IL-1和TNF-α转录水平显著降低,并可减轻其阿尔茨海默症症状。RUCKMANI等[40]以800 mg/kg剂量的黑芝麻乙醇提取物(芝麻素16.33%,芝麻林素13.06%,芝麻素酚1.92%)处理风湿性关节炎模型小鼠,发现其TNF-α和IL-6水平分别下降39.2%和42.2%;组织病理学检查结果显示,小鼠的膝关节滑膜炎症和软骨损伤明显改善。
3.3 抗肿瘤
肿瘤是一种严重威胁人类健康的疾病,其主要原因是细胞发生基因突变,从而导致细胞癌化,恶性增殖。肿瘤细胞具有10个基本特征,即增殖信号持续、逃避生长抑制信号、能够无限复制、诱导血管生成、组织浸润和远处转移、基因组不稳定和突变、促发肿瘤炎症、可进行代谢重编程和免疫逃逸[41]。
体外肿瘤细胞模型研究证实,芝麻素酚具有良好的抗肿瘤活性功能。芝麻素酚可有效抑制SK-MEL-28黑色素瘤细胞、乳腺癌MDA-MB-231细胞、乳腺癌MCF7细胞、肺癌A549细胞和结直肠癌RKO细胞生长[42]。此外,芝麻素酚还可诱导肿瘤细胞凋亡,抑制淋巴白血病Molt 4B细胞生长,其抑制效率与剂量和作用时间正相关[43]。
芝麻素酚还可作用于多个信号通路,抑制肿瘤细胞生长。Δ-5-去饱和酶是合成多不饱和脂肪酸的限速酶,也是一个重要的肿瘤治疗靶点[44],而芝麻素酚可特异地抑制Δ-5-去饱和酶活性[45]。腺嘌呤核苷酸转位酶2(adenine nucleotide translocase-2, ANT2)在多种肿瘤细胞中均呈现高表达,它可上调抗细胞凋亡蛋白B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)表达,抑制促细胞凋亡蛋白Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的表达,从而抑制细胞凋亡,促进肿瘤细胞增殖[46]。G1/S-特异性周期蛋白-D1(cyclin D1)是调控细胞周期的关键作用因子,在细胞分裂进入S期后即被泛素化降解。但是,如果cyclin D1持续高表达,将显著缩短细胞分裂的G1期,提前进入S期,导致细胞癌化,恶性增殖,形成肿瘤[47]。cyclin D1基因的转录核因子κB(nuclear factor kappa-B,NF-κB)信号通路正向调控,而翻译则受哺乳动物雷帕霉素受体蛋白复合体1(mammalian target of rapamycin complex 1, mTORC1)信号通路正向调控,与此同时,ANT2可特异性激活NF-κB和mTORC1信号通路[48]。因此,ANT2是肿瘤治疗的一个重要靶点。芝麻素酚可通过与ANT2特异性结合抑制NF-κB和mTORC1信号通路,影响cyclin D1的转录和翻译,从而抑制肿瘤细胞的增殖[42]。
3.4 预防肥胖
肥胖易诱发糖尿病、高血压、冠心病,甚至癌症等多种疾病[49]。因此,预防肥胖对于机体健康具有重要的意义。
白色脂肪组织(white adipose tissue, WAT)和棕色脂肪组织(brown adipose tissue, BAT)是哺乳动物中脂肪的基本存在形式。WAT主要是以脂滴形式存储的三脂酰甘油,而BAT细胞内富含线粒体,可通过解耦联蛋白1(uncoupling protein 1, UCP1)介导,将能量以非偶联呼吸作用形成热量释放[50]。BAT特异性转录因子PR结构域蛋白16(PR domain-containing 16, Prdm16)可与UCP1启动子直接结合,激活UCP1表达,诱导机体将多余的能量以热量形式释放[51-53]。体外实验结果显示,芝麻素酚体外可上调UCP1、Pgc1a、CytC表达,增强细胞氧消耗速率,诱导WAT向BAT转化;小鼠活体实验发现,芝麻素酚可通过上调Prdm16表达,抑制C2C12成肌细胞肌肉发育相关代谢途径和细胞分化,诱导机体产生热量,从而降低小鼠的肥胖水平和胆固醇水平[54]。因此,芝麻素酚可有效地预防肥胖。
3.5 心血管保护
心血管疾病是指涉及心脏和血管循环系统的疾病,主要有心肌炎、高血压、心率失常、冠心病、心力衰竭、心包炎、心脏骤停和心源性猝死等,动脉粥样硬化是心血管疾病发生的主要原因[55]。因此,抑制动脉粥样硬化对心血管保护和心血管疾病预防具有重要的意义。
LDL氧化是动脉粥样硬化的主要诱因,也是临床干预的重要目标。芝麻素酚可保护LDL免受氧化作用,减缓动脉粥样硬化进程[30-32]。细胞黏附分子(cell adhesion molecules,CAM)对动脉粥样硬化发展具有重要的作用[55]。NF-κB信号通路正向调控内皮细胞白细胞黏附分子1(endothelial leukocyte adhesion molecule 1, ELAM-1)、细胞内黏附分子1(intracellular adhesion molecule 1, ICAM-1)和血管细胞黏附分子1(vascular cell adhesion molecule 1, VCAM-1)基因表达,但芝麻素酚肝脏代谢产物芝麻素酚-6-儿茶酚可抑制NF-κB信号通路,下调ELAM-1、ICAM-1和VCAM-1基因的转录,抑制和减缓动脉粥样化进程[56-57]。
3.6 神经保护
帕金森氏症是一种典型的神经退行性疾病,其典型临床症状为运动迟缓、僵硬、静止性震颤和姿势不稳等[58]。神经毒素、氧化应激和线粒体功能异常可导致黑质多巴胺能神经元变性和缺失,使得脑部多巴胺合成减少,从而引发帕金森氏症[59-60]。KAJI等[35]通过6-羟基多巴胺诱导SH-SY5Y神经母细胞瘤细胞,构建帕金森氏症细胞模型,发现芝麻素酚可抑制ROS水平的提高,诱导Nrf2表达上调,增强NAD(P)H:醌氧化还原酶活力,维持细胞稳态;此外,他们还发现小鼠口服神经毒素鱼藤酮后,运动功能显著下降,但喂饲0.0008%的芝麻素酚即可使其恢复至正常水平。上述结果表明,芝麻素酚对帕金森氏症具有良好的预防和治疗作用。
阿尔茨海默症又名老年痴呆,是一种中枢神经系统退行性病变导致的疾病,其主要临床表现为记忆障碍、抽象思维损害、失语、失认和人格行为改变等。研究发现,患者大脑神经细胞周围沉积了大量的β-淀粉样蛋白,形成脑内老年斑,并诱导神经细胞凋亡,从而引发阿尔茨海默症[61]。相较于芝麻素、芝麻林素和STG,芝麻素酚体外抑制β-淀粉样蛋白聚集的效果更佳;此外,在阿尔茨海默症SAMP8小鼠模型中,喂饲含0.05%芝麻素酚的饲料,16周后发现脑内β-淀粉样蛋白沉积和氧化应激水平显著降低,并且参与非淀粉样蛋白前体物加工的蛋白酶ADAM10上调,从而有效地抑制致病性β-淀粉样蛋白聚集,缓解阿尔茨海默症[39]。
3.7 抗皮肤衰老
胶原蛋白和透明质酸是维持皮肤紧致和光泽的关键因子。胶原蛋白是皮肤中主要的结构蛋白,具有良好的延展性和弹性,可使皮肤保持弹性和紧致,减少皱纹产生[62]。透明质酸可通过氢键作用与水分子结合,防止水分流失,此外透明质酸还可帮助修复受损皮肤,从而维持皮肤湿润和光泽[63]。
ROS可破坏皮肤细胞外基质,抑制透明质酸和胶原蛋白的合成,并诱导合成透明质酸酶和胶原蛋白酶,降解皮肤中的透明质酸和胶原蛋白,从而导致皮肤衰老[64]。相较于芝麻素、芝麻林素、芝麻酚等其他芝麻木脂素,芝麻素酚的胶原蛋白酶抑制效率更高,100 μmol/L芝麻素酚即可抑制71.94%的胶原蛋白酶活性,500 μmol/L则高达91.99%[19]。因此,芝麻素酚可有效地延缓皮肤衰老,可进一步研究开发用于护肤品和化妆品。此外,芝麻素酚还可刺激皮肤合成胶原蛋白和弹性蛋白,促进伤口愈合,目前其在护肤品中的应用已申请专利保护[65]。
4 结语
芝麻素酚具有多种生理活性功能,在医药、营养保健品和化妆品行业有着重要的应用价值和巨大的发展潜力。本文综述了芝麻素酚生理活性功能的最新研究进展,并对生理活性功能及其作用机制进行了分门别类、分析归纳和总结。
目前,芝麻素酚生理功能研究仍处于动物模型,甚至体外细胞模型研究阶段,距临床应用和产业化仍有很长的距离。因此,亟需深化芝麻素酚生理活性功能研究,完善产品研究开发。首先,在小鼠和哺乳动物模型研究的基础上,完善临床药理机制研究,进一步明晰药理机制和安全评价,为相关医药产品的市场投放提供理论支持。其次,进一步推进芝麻素酚营养保健和疾病预防研究,为相关功能食品和营养保健品的开发提供理论依据。最后,积极探索研究芝麻素酚新的生理活性功能,拓宽其应用领域和范围。目前,芝麻素酚分离纯化成本仍然较高,这也是芝麻素酚产业发展缓慢的重要原因。因此,综合应用现代分离技术和分析方法,研发廉价、快速、高效的分离纯化方法,将是芝麻素酚产业发展的关键。
芝麻素酚具有多重生理功效,在疾病防治、营养保健和化妆品应用方面已展示出良好的发展潜力,是一种极具应用和开发前景的天然产物。积极推进芝麻素酚生理活性功能研究,完善药理机制研究和安全评价,对于提升芝麻经济附加值和人类健康具有积极的意义。
[1] WEI P P, ZHAO F L, WANG Z, et al.Sesame (Sesamum indicum L.):A comprehensive review of nutritional value, phytochemical composition, health benefits, development of food, and industrial applications[J].Nutrients, 2022, 14(19):4079.
[2] JANG W Y, KIM M Y, CHO J Y.Antioxidant, anti-inflammatory, anti-menopausal, and anti-cancer effects of lignans and their metabolites[J].International Journal of Molecular Sciences, 2022, 23(24):15482.
[3] OSMAKOV D I, KALINOVSKII A P, BELOZEROVA O A, et al.Lignans as pharmacological agents in disorders related to oxidative stress and inflammation:Chemical synthesis approaches and biological activities[J].International Journal of Molecular Sciences, 2022, 23(11):6031.
[4] WAN Y, LI H X, FU G M, et al.The relationship of antioxidant components and antioxidant activity of sesame seed oil[J].Journal of the Science of Food and Agriculture, 2015, 95(13):2571-2578.
[5] DOSSOU S S K, XU F T, DOSSA K, et al.Antioxidant lignans sesamin and sesamolin in sesame (Sesamum indicum L.):A comprehensive review and future prospects[J].Journal of Integrative Agriculture, 2023, 22(1):14-30.
[6] KONSOULA Z, LIAKOPOULOU-KYRIAKIDES M.Effect of endogenous antioxidants of sesame seeds and sesame oil to the thermal stability of edible vegetable oils[J].LWT - Food Science and Technology, 2010, 43(9):1379-1386.
[7] ANDARGIE M, VINAS M, RATHGEB A, et al.Lignans of sesame (Sesamum indicum L.):A comprehensive review[J].Molecules, 2021, 26(4):883.
[8] FUKUDA Y, OSAWA T, NAMIKI M, et al.Studies on antioxidative substances in sesame seed[J].Agricultural and Biological Chemistry, 1985, 49(2):301-306.
[9] NAGATA M, OSAWA T, NAMIKI M, et al.Stereochemical structures of antioxidative bisepoxylignans, sesaminol and its isomers, transformed from sesamolin[J].Agricultural and Biological Chemistry, 1987, 51(5):1285-1289.[10] GAO J H, WANG R D, LU X, et al.Enzymatic preparation and structure-activity relationship of sesaminol[J].Journal of Oleo Science, 2021, 70(9):1261-1274.
[11] NAIR A, KUWAHARA A, NAGASE A, et al.Purification, gene cloning, and biochemical characterization of a β-glucosidase capable of hydrolyzing sesaminol triglucoside from Paenibacillus sp.KB0549[J].PLoS One, 2013, 8(4):e60538.
[12] BAE J J, YEON S J, PARK W J, et al.Production of sesaminol and antioxidative activity of fermented sesame with Lactobacillus plantarum P8, Lactobacillus acidophilus ATCC 4356, Streptococcus thermophilus S10[J].Food Science and Biotechnology, 2016, 25(1):199-204.
[13] ISHIKAWA R, YOSHIDA N, AKAO Y, et al.Total syntheses of (+)-sesamin and (+)-sesaminol[J].Chemistry Letters, 2014, 43(10):1572-1574.
[14] HAMASHIMA Y, KAN T, INAI M, et al.Stereocontrolled total syntheses of optically active furofuran lignans[J].Synthesis, 2015, 47(22):3513-3521.
[15] HUANG J N, SONG G H, ZHANG L X, et al.A novel conversion of sesamolin to sesaminol by acidic cation exchange resin[J].European Journal of Lipid Science and Technology, 2012, 114(7):842-848.
[16] FUKUDA Y, NAGATA M, OSAWA T, et al.Contribution of lignan analogues to antioxidative activity of refined unroasted sesame seed oil[J].Journal of the American Oil Chemists’ Society, 1986, 63(8):1027-1031.
[17] 李晓栋, 汪学德, 王楠楠, 等.芝麻林素的酸催化反应与抗氧化性分析[J].食品科学, 2018, 39(10):59-64.LI X D, WANG X D, WANG N N, et al.Acidic catalysis and antioxidant activity of sesamolin[J].Food Science, 2018, 39(10):59-64.
[18] KUMAZAWA S, KOIKE M, USUI Y, et al.Isolation of sesaminols as antioxidative components from roasted sesame seed oil[J].Journal of Oleo Science, 2003, 52(6):303-307.
[19] MICHAILIDIS D, ANGELIS A, ALIGIANNIS N, et al.Recovery of sesamin, sesamolin, and minor lignans from sesame oil using solid support-free liquid-liquid extraction and chromatography techniques and evaluation of their enzymatic inhibition properties[J].Frontiers in Pharmacology, 2019, 10:723.
[20] 张丽霞, 孙强, 宋国辉, 等.一种催化芝麻林素制备芝麻素酚的方法:CN104059081B[P].2016-06-15.ZHANG L X, SUN Q, SONG G H, et al.Method for preparing sesamol by catalyzing sesamolin:CN104059081B[P].2016-06-15.
[21] 高锦鸿, 杜蘅, 苑立博, 等.一种利用固定化酶酶解芝麻素酚糖苷制备芝麻素酚的方法:CN116103350A[P].2023-05-12.GAO J H, DU H, YUAN L B, et al.Preparing sesaminol, by preparing magnetic nano-iron (II, III) oxide particles, mixing iron (II, III) oxide-silicon dioxide-ammonia-glutaraldehyde-immobilized beta-galactosidase with sesaminol glucoside, centrifuging, and freeze-drying product:CN116103350A[P].2023-05-12.
[22] 黄纪念, 宋国辉, 孙强, 等.一种芝麻素酚的制备方法:CN101648957A[P].2010-02-17.HUANG J N, SONG G H, SUN Q.Preparation method of sesamin phenol:CN101648957A[P].2010-02-17.
[23] BYRNE N J, RAJASEKARAN N S, ABEL E D, et al.Therapeutic potential of targeting oxidative stress in diabetic cardiomyopathy[J].Free Radical Biology and Medicine, 2021, 169:317-342.
[24] BATTY M, BENNETT M R, YU E.The role of oxidative stress in atherosclerosis[J].Cells, 2022, 11(23):3843.
[25] WU S J, LIAO X Y, ZHU Z J, et al.Antioxidant and anti-inflammation effects of dietary phytochemicals:The Nrf2/NF-κB signalling pathway and upstream factors of Nrf2[J].Phytochemistry, 2022, 204:113429.
[26] SARMIENTO-SALINAS F L, PEREZ-GONZALEZ A, ACOSTA-CASIQUE A, et al.Reactive oxygen species:Role in carcinogenesis, cancer cell signaling and tumor progression[J].Life Sciences, 2021, 284:119942.
[27] TCHEKALAROVA J, TZONEVA R.Oxidative stress and aging as risk factors for Alzheimer’s disease and Parkinson’s disease:The role of the antioxidant melatonin[J].International Journal of Molecular Sciences, 2023, 24(3):3022.
[28] NANTARAT N, MUELLER M, LIN W C, et al.Sesaminol diglucoside isolated from black sesame seed cake and its antioxidant, anti-collagenase and anti-hyaluronidase activities[J].Food Bioscience, 2020, 36:100628.
[29] AFROZ M, NEAMUL KABIR ZIHAD S M, UDDIN S J, et al.A systematic review on antioxidant and antiinflammatory activity of sesame (Sesamum indicum L.) oil and further confirmation of antiinflammatory activity by chemical profiling and molecular docking[J].Phytotherapy Research:PTR, 2019, 33(10):2585-2608.
[30] KANG M H, NAITO M, SAKAI K, et al.Mode of action of sesame lignans in protecting low-density lipoprotein against oxidative damage in vitro[J].Life Sciences, 2000, 66(2):161-171.
[31] CAO W M, DAI M J, WANG X, et al.Protective effect of sesaminol from Sesamum indicum Linn.against oxidative damage in PC12 cells[J].Cell Biochemistry and Function, 2013, 31(7):560-565.
[32] DONG P, FU X, WANG X, et al.Protective effects of sesaminol on BEAS-2B cells impaired by cigarette smoke extract[J].Cell Biochemistry and Biophysics, 2015, 71(2):1207-1213.
[33] SHI M, WANG J Q, BI F F, et al.Diosmetin alleviates cerebral ischemia-reperfusion injury through Keap1-mediated Nrf2/ARE signaling pathway activation and NLRP3 inflammasome inhibition[J].Environmental Toxicology, 2022, 37(6):1529-1542.
[34] LEE J, LIM J W, KIM H.Lycopene inhibits IL-6 expression by upregulating NQO1 and HO-1 via activation of Nrf2 in ethanol/lipopolysaccharide-stimulated pancreatic acinar cells[J].Antioxidants, 2022, 11(3):519.
[35] KAJI H, MATSUI-YUASA I, MATSUMOTO K, et al.Sesaminol prevents Parkinson’s disease by activating the Nrf2-ARE signaling pathway[J].Heliyon, 2020, 6(11):e05342.
[36] OHIRA H, OIKAWA D, KUROKAWA Y, et al.Suppression of colonic oxidative stress caused by chronic ethanol administration and attenuation of ethanol-induced colitis and gut leakiness by oral administration of sesaminol in mice[J].Food &Function, 2022, 13(18):9285-9298.
[37] KANG M H, KATSUZAKI H, OSAWA T.Inhibition of 2, 2′-azobis(2, 4-dimethylvaleronitrile)-induced lipid peroxidation by sesaminols[J].Lipids, 1998, 33(10):1031-1036.
[38] ROSSI J F, LU Z Y, MASSART C, et al.Dynamic immune/inflammation precision medicine:The good and the bad inflammation in infection and cancer[J].Frontiers in Immunology, 2021, 12:595722.
[39] KATAYAMA S, SUGIYAMA H, KUSHIMOTO S, et al.Effects of sesaminol feeding on brain aβ accumulation in a senescence-accelerated mouse-prone 8[J].Journal of Agricultural and Food Chemistry, 2016, 64(24):4908-4913.
[40] RUCKMANI A, METI V, VIJAYASHREE R, et al.Anti-rheumatoid activity of ethanolic extract of Sesamum indicum seed extract in Freund’s complete adjuvant induced arthritis in Wistar albino rats[J].Journal of Traditional and Complementary Medicine, 2018, 8(3):377-386.
[41] HANAHAN D.Hallmarks of cancer:New dimensions[J].Cancer Discovery, 2022, 12(1):31-46.
[42] WATANABE M, IIZUMI Y, SUKENO M, et al.The pleiotropic regulation of cyclin D1 by newly identified sesaminol-binding protein ANT2[J].Oncogenesis, 2017, 6(4):e311.
[43] MIYAHARA Y, HIBASAMI H, KATSUZAKI H, et al.Sesaminol from sesame seed induces apoptosis in human lymphoid leukemia Molt 4B cells[J].International Journal of Molecular Medicine, 2001, 7(5):485-488.
[44] PANG L Z, SHAH H, XU Y, et al.Delta-5-desaturase:A novel therapeutic target for cancer management[J].Translational Oncology, 2021, 14(11):101207.
[45] SHIMIZU S, AKIMOTO K, SHINMEN Y, et al.Sesamin is a potent and specific inhibitor of Δ5 desaturase in polyunsaturated fatty acid biosynthesis[J].Lipids, 1991, 26(7):512-516.
[46] ZHANG H Y, CHEN N H, DENG Z H, et al.Suppression of ANT2 by miR-137 inhibits prostate tumorigenesis[J].Frontiers in Genetics, 2021, 12:687236.
[47] KOLAPALLI S P, SAHU R, CHAUHAN N R, et al.RNA-binding RING E3-ligase DZIP3/hRUL138 stabilizes cyclin D1 to drive cell-cycle and cancer progression[J].Cancer Research, 2021, 81(2):315-331.
[48] AVEROUS J, FONSECA B D, PROUD C G.Regulation of cyclin D1 expression by mTORC1 signaling requires eukaryotic initiation factor 4E-binding protein 1[J].Oncogene, 2008, 27(8):1106-1113.
[49] CÉLIND J, BYGDELL M, MARTIKAINEN J, et al.Childhood overweight and risk of obesity-related adult cancer in men[J].Cancer Communications, 2022, 42(6):576-579.
[50] CYPESS A M, WEINER L S, ROBERTS-TOLER C, et al.Activation of human brown adipose tissue by a β3-adrenergic receptor agonist[J].Cell Metabolism, 2015, 21(1):33-38.
[51] FELDMANN H M, GOLOZOUBOVA V, CANNON B, et al.UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality[J].Cell Metabolism, 2009, 9(2):203-209.
[52] LEITNER B P, HUANG S, BRYCHTA R J, et al.Mapping of human brown adipose tissue in lean and obese young men[J].Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(32):8649-8654.
[53] HAN S P, YANG Y F, LU Y N, et al.Cyanidin-3-O-glucoside regulates the expression of Ucp1 in brown adipose tissue by activating Prdm16 gene[J].Antioxidants, 2021, 10(12):1986.
[54] DIVAKARAN S J, SRIVASTAVA S, JAHAGIRDAR A, et al.Sesaminol induces brown and beige adipocyte formation through suppression of myogenic program[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2020, 34(5):6854-6870.
[55] WANG J Q, CHEN X P.Junctional adhesion molecules:Potential proteins in atherosclerosis[J].Frontiers in Cardiovascular Medicine, 2022, 9:888818.
[56] MOCHIZUKI M, TSUCHIE Y, NAKAMURA Y, et al.Identification and characterization of sesaminol metabolites in the liver[J].Journal of Agricultural and Food Chemistry, 2009, 57(21):10429-10434.
[57] MOCHIZUKI M, TSUCHIE Y, YAMADA N, et al.Effect of sesame lignans on TNF-α-induced expression of adhesion molecules in endothelial cells[J].Bioscience, Biotechnology, and Biochemistry, 2010, 74(8):1539-1544.
[58] WANG Y T, LU J H.Targeting chaperone-mediated autophagy for Parkinson’s disease therapy[J].Neural Regeneration Research, 2023, 18(8):1723-1724.
[59] WATANABE H, DIJKSTRA J M, NAGATSU T.Parkinson’s disease:Cells succumbing to lifelong dopamine-related oxidative stress and other bioenergetic challenges[J].International Journal of Molecular Sciences, 2024, 25(4):2009.
[60] HENRICH M T, OERTEL W H, SURMEIER D J, et al.Mitochondrial dysfunction in Parkinson’s disease: A key disease hallmark with therapeutic potential[J].Molecular Neurodegeneration, 2023, 18(1):83.
[61] DREGNI A J, DUAN P, XU H, et al.Fluent molecular mixing of Tau isoforms in Alzheimer’s disease neurofibrillary tangles[J].Nature Communications, 2022, 13(1):2967.
[62] PU S Y, HUANG Y L, PU C M, et al.Effects of oral collagen for skin anti-aging:A systematic review and meta-analysis[J].Nutrients, 2023, 15(9):2080.
[63] CASTREJ N-COMAS V, ALEM
N-COMAS V, ALEM N C, PÉREZ-MADRIGAL M M.Multifunctional conductive hyaluronic acid hydrogels for wound care and skin regeneration[J].Biomaterials Science, 2023, 11(7):2266-2276.
N C, PÉREZ-MADRIGAL M M.Multifunctional conductive hyaluronic acid hydrogels for wound care and skin regeneration[J].Biomaterials Science, 2023, 11(7):2266-2276.
[64] PAPACCIO F, ARINO A D, CAPUTO S, et al.Focus on the contribution of oxidative stress in skin aging[J].Antioxidants, 2022, 11(6):1121.
[65] KOJIMA A, YUASA I, KIYOMOTO K, et al.Composition for promoting collagen production, for promoting elastin production and/or for promoting keratinocyte migration and usage therefor:US9629823[P].2017-04-25.