白酒是我国传统的蒸馏酒,具有独特的民族文化内涵,是我国传统文化的重要载体之一[1]。大曲是白酒酿造过程中重要的糖化发酵剂,其含有多种微生物菌系和各种酿酒酶系,其品质对白酒的出酒率和酒质有很大的影响,因而有“曲为酒之骨”,“曲香定酒香”之说[2-4]。大曲主要利用粉碎的谷物原料,经过自然界的微生物接种、繁殖、富集有益微生物并伴随复杂的生化反应制作而成[5-6]。根据大曲发酵最高温不同可分为高温大曲(酱香型大曲)、中高温大曲(浓香型大曲)和低温大曲(清香型大曲)。
小麦是制作大曲的优质谷物原料之一,因其籽粒营养丰富,富含大量的碳水化合物、粗蛋白质、氨基酸等,能为微生物的生长繁殖提供碳素和氮素[7]。小麦在高温高湿环境下更容易产生大量淀粉酶、蛋白酶等既可水解大分子糖(淀粉)为微生物提供营养,又能分解蛋白质等合成多种风味物质,为酒体提味增香。但长期以来对小麦营养物质在大曲发酵过程中的变化及其与微生物群落关系了解较少,这阻碍了大曲工艺的改进和酿造专用型小麦品种的选育。
本研究以中高温大曲为对象,研究了发酵过程中曲皮和曲心中淀粉、糖、氨基酸等营养物质的变化,并利用冗余分析对这些营养物质与微生物群落的关系进行了分析,本研究结果可为优化大曲工艺和选育酿造专用型原粮小麦品种提供依据。
1 材料和方法
1.1 材料与试剂
土壤DNA提取试剂盒(Soil Kit),美国QIAGEN公司;测序试剂盒MiSeq Reagent Kit v3 (600 cycle)、测序试剂盒HiSeq Rapid SBS kit v2 (500 cycle),美国Illumina公司;直链淀粉/支链淀粉测定试剂盒,爱尔兰Megazyme公司;NaCl、NaOH、乙醇、三氯乙酸、盐酸、NaH2PO4、苯酚、鼠李糖、阿拉伯糖、葡萄糖、木糖、果糖、蔗糖、2,4-二硝基氟苯,上海源叶生物科技有限公司;17种氨基酸标准品、二甲基亚砜、Tris、二硫苏糖醇、4-乙烯吡啶、溴酚蓝、琼脂糖、考马斯亮蓝、乙醇、异丙醇、丙酮、十二烷基硫酸钠、标准HPLC级乙腈和乙酸铵,西陇化工有限公司。
1.2 仪器与设备
LX-0型万能高速粉碎机,红光工贸有限公司;Allegra X-30R Centrifuge型高速离心机,贝克曼库尔特商贸有限公司;UV-2000型紫外可见分光光度计,上海尤尼柯有限公司;KQ-400KDE型高功率数控超声波清洗器,昆山市超声仪器有限公司;电泳仪,北京六一生物科技有限公司;1200 HPLC系统,美国Agilent科技有限公司;SU3500扫描电镜,日本日立公司;DIONEX-ICS-5000+型离子色谱(HPAEC),美国Hermo公司;MiSeq PE300高通量测序系统和HiSeq PE250高通量测序系统,美国Illumina公司。
1.3 大曲制备
大曲的制备和发酵是在泸州某酒厂制曲生态园进行,采用中高温大曲生产工艺。将小麦磨成粉,加水搅拌,后压制成砖(新鲜大曲),将新鲜的大曲砖一层一层地堆放在发酵室架子上,堆砌砖层孵育约9 d后将大曲转移到另一个发酵室贮存3个月至成熟,即为成熟大曲。
1.4 样品采集
为确定营养成分的动态变化,在相似条件下,于8个不同发酵时间点(0、3、6、9、15、30、60和90 d)采集样品,0 d即在制曲完成后立刻进行采样。样品分别采集大曲曲皮(外表皮1 cm厚度层,包括大曲侧面、底层和曲包表面混合均匀)和曲心各500 g左右,混合后转移到无菌聚乙烯袋中,然后分别保存在-80 ℃(用于微生物群落的测定)和-20 ℃(用于营养成分的测定)。每批样品一式3份。
1.5 大曲微生物群落数据
大曲微生物群落数据均来源于DING等[8],其原始测序数据保存在NCBI GenBank的SRA(sequence read archive)。
1.6 营养物质的测定
直链、支链淀粉含量的测定使用Megazyme直链淀粉/支链淀粉测定试剂盒。A、B型淀粉采用水柱沉淀离心分离法提取[9]。
总黄酮含量的测定采用比色法[10]。
谷蛋白浓度的测定采用考马斯亮蓝法(Bradford法),取5 mg/mL的牛血清蛋白(bovine serum albumin,BSA)稀释终质量浓度为0.5 mg/mL的标准品,制作标准曲线。通过比色法[11]一式3份地测量谷蛋白浓度。
纤维素的测定采用重铬酸钾氧化法[12]。
1.7 糖类化合物的高效阴离子交换色谱分析
称取1 g大曲样品,加入10 mL超纯水,活性炭0.05 g,置于超声清洗机于400 W,50 ℃超声波提取30 min,8 000×g下离心10 min。上清液用于分析糖化合物的浓度,同时进行对照品(鼠李糖、阿拉伯糖、葡萄糖、木糖、果糖、蔗糖)的配置。使用DIONEX-ICS-5000+型离子色谱检测糖化合物含量,淋洗液配置及色谱条件,参照陈懿瑶等[13]的方法进行。
1.8 高效液相色谱分析游离氨基酸化合物
称取1 g粉碎样品于25 mL容量瓶中,加入20 mL 5%三氯乙酸溶液,超声波处理20 min,定容至25 mL,静置1 h,6 000 r/min离心10 min,取上清液过0.45 μm 水相滤膜,即为供试品溶液。使用桑格试剂(2,4-二硝基氟苯)对样品进行衍生。游离氨基酸对照品的配制及柱前衍生化参照赵英莲等[14]的方法进行。使用高效液相色谱系统HPLC测定游离氨基酸含量,具体参照SAFADR等[15]的方法进行。
1.9 统计分析
所有检测结果用平均数进行数据分析,采用方差分析(ANOVA)(P<0.05)对测定结果进行显著性检验,用OriginPro 2021软件进行经典统计学分析及做图。使用Canoco5进行冗余分析(redundancy analysis,RDA)以评估微生物与营养物质之间的动态相关性。
2 结果与分析
2.1 大曲发酵中淀粉、蛋白质及其他营养物质的变化
大曲富含多种功能微生物及酶类,可将蛋白质转化为氨基酸,淀粉转化为葡萄糖,并产生风味前体和风味成分,如酯、吡嗪、芳香族和酚类化合物[16]。研究表明,淀粉消耗率越高,微生物代谢和繁殖活动越旺盛,产物越丰富,曲胚的成熟度也越好。本研究中,大曲直链淀粉、支链淀粉、A型和B型淀粉粒含量均呈下降趋势(图1),直链淀粉含量在0~3 d表现出显著差异,第0天含量为16.70%,随着发酵的进行,0~3 d时迅速下降,之后下降速度平缓,直至发酵结束,第90天曲皮直链淀粉含量为10.07%,曲心为8.41%(图1-a)。曲皮与曲心的支链淀粉含量先缓慢下降后迅速下降,并在9~90 d表现出了显著差异,9~90 d时曲皮和曲心分别从0 d的52.61%迅速下降到8.19%和9.81%(图1-b)。发酵初期的曲皮和曲心直链淀粉消耗较多,这可能与直链淀粉具有良好的成模性,能促进营养物质吸收等功能有关。发酵中分别消耗了曲皮和曲心总直链淀粉的39.08%和49.12%,总支链淀粉的84.43%和81.35%,可以看出,整个发酵过程仍以消耗支链淀粉为主。

a-直链淀粉;b-支链淀粉;c-A型淀粉;d-B型淀粉;e-谷蛋白;f-黄酮;g-纤维素
图1 大曲曲皮和曲心发酵过程中营养物质的变化
Fig.1 Changes in nutritious substance during fermentation in the surface and the core of Daqu
注:柱形图以取样部位进行分组,柱形图上有相同小写字母的表示在不同发酵时间点差异不显著,*和**分别表示在 0.05 和 0.01 水平上差异显著(下同)。
A型和B型淀粉粒的得率均呈下降趋势,其中,B型淀粉粒下降较A型淀粉粒更显著。A型淀粉粒得率从第0天的78%分别下降至第90天的73%(曲皮)和57%(曲心)(图1-c),分别消耗了6.41%和26.92%。B型淀粉粒得率从第0天的12%分别下降至第90天的4%(曲皮)和2%(曲心)(图1-d),分别消耗了66.67%和83.33%,A、B型淀粉粒在曲心消耗的更多,这可能与曲心曲温较高微生物代谢旺盛有关。小麦淀粉中直链淀粉含量与大颗粒(A型颗粒)体积百分比呈正相关[17],本研究结果与之一致。
发酵时蛋白质被蛋白酶水解成多肽和氨基酸并生成各种醇类、脂肪酸和醛类等构成米酒的主要香气[18]。随着发酵的进行,谷蛋白浓度逐渐降低,第0天时浓度为8.00 mg/g,第6天曲皮与曲心差异不显著但第9天后下降剧烈,第90天曲皮和曲心谷蛋白终浓度分别为 4.73 mg/g和3.53 mg/g,降幅分别为3.27%和4.47%(图1-e)。SDS-PAGE结果显示,曲皮和曲心中的谷蛋白在发酵第6天时条带和0天比有变化,第9天以后在曲心中逐渐检测不出明显的谷蛋白条带,这表明谷蛋白在曲心中降解的更快,这是由不同发酵微环境造成的。
黄酮类化合物属于生物活性化合物,可以降低心血管疾病和癌症的风险[19]。大曲发酵中曲皮和曲心中黄酮的含量先升高后平缓下降,再略有升高;曲皮和曲心中的黄酮从第0天的0.08 mg/g分别增加到0.12 mg/g和0.29 mg/g,曲心增幅更显著,原因可能是大曲微生物利用原粮产生了黄酮类代谢物导致含量增加,这些代谢物还需要进一步鉴定(图1-f)。曲皮中纤维素含量在发酵中先下降后上升,从第0天的14.23%下降至第90天的12.00%;而曲心纤维素含量先急剧下降后平缓上升,第9天时升至初始水平,直到发酵结束(图1-g)。由于曲皮和曲心中的纤维素被微生物代谢产生的纤维素酶水解,因此纤维素含量在发酵0~9 d下降,但在30~90 d略有增加,原因还有待进一步研究。
对成品曲(第90天)曲皮与曲心的各营养物质进行显著性分析,结果显示,除支链淀粉外,其余各营养物质曲皮与曲心含量均呈现极显著差异,支链淀粉含量呈现显著差异。
2.2 大曲发酵中糖化合物的变化
对大曲发酵中6种单糖分析表明(图2),鼠李糖含量均在0~3 d迅速下降,后曲皮持续下降至第60天的0.07 mg/g左右;曲心中鼠李糖含量在0~15 d持续减少到0.07 mg/g,15~90 d又略有增加到0.34 mg/g(图2-a)。曲皮中阿拉伯糖含量在60~90 d迅速增加到0.58 mg/g,而曲心中阿拉伯糖含量在0~6 d从0 mg/g增加到0.61 mg/g,后又持续下降,在第60天时下降至0.12 mg/g,随后又增加至第90天的1.38 mg/g(图2-b)。曲皮和曲心葡萄糖含量均呈先急后缓的下降趋势,葡萄糖含量在发酵前6 d急剧下降,曲皮和曲心分别从第0天的5.32 mg/g分别下降至0.61 mg/g和0.88 mg/g,第 6 天后平缓下降,曲皮中下降速度较曲心快(图2-c)。木糖含量均在0~3 d时迅速下降,之后曲皮平缓下降,而曲心略有增加,第6天时增加到0.78 mg/g,之后下降到与曲皮相同水平(图2-d)。果糖含量均先增加后降低,曲皮中从第0天0.13 mg/g增加至第15天0.57 mg/g,而曲心在第6天时达到最高0.27 mg/g(图2-e)。蔗糖含量均呈上升趋势,曲皮和曲心分别从0 d的0.25 mg/g增加至最终的0.61 mg/g和0.88 mg/g(图2-f)。对成品曲(第90天)曲皮与曲心的糖化合物进行显著性分析,结果显示,鼠李糖、阿拉伯糖、蔗糖含量在第90天的曲皮与曲心呈现出极显著差异,果糖呈现显著差异。
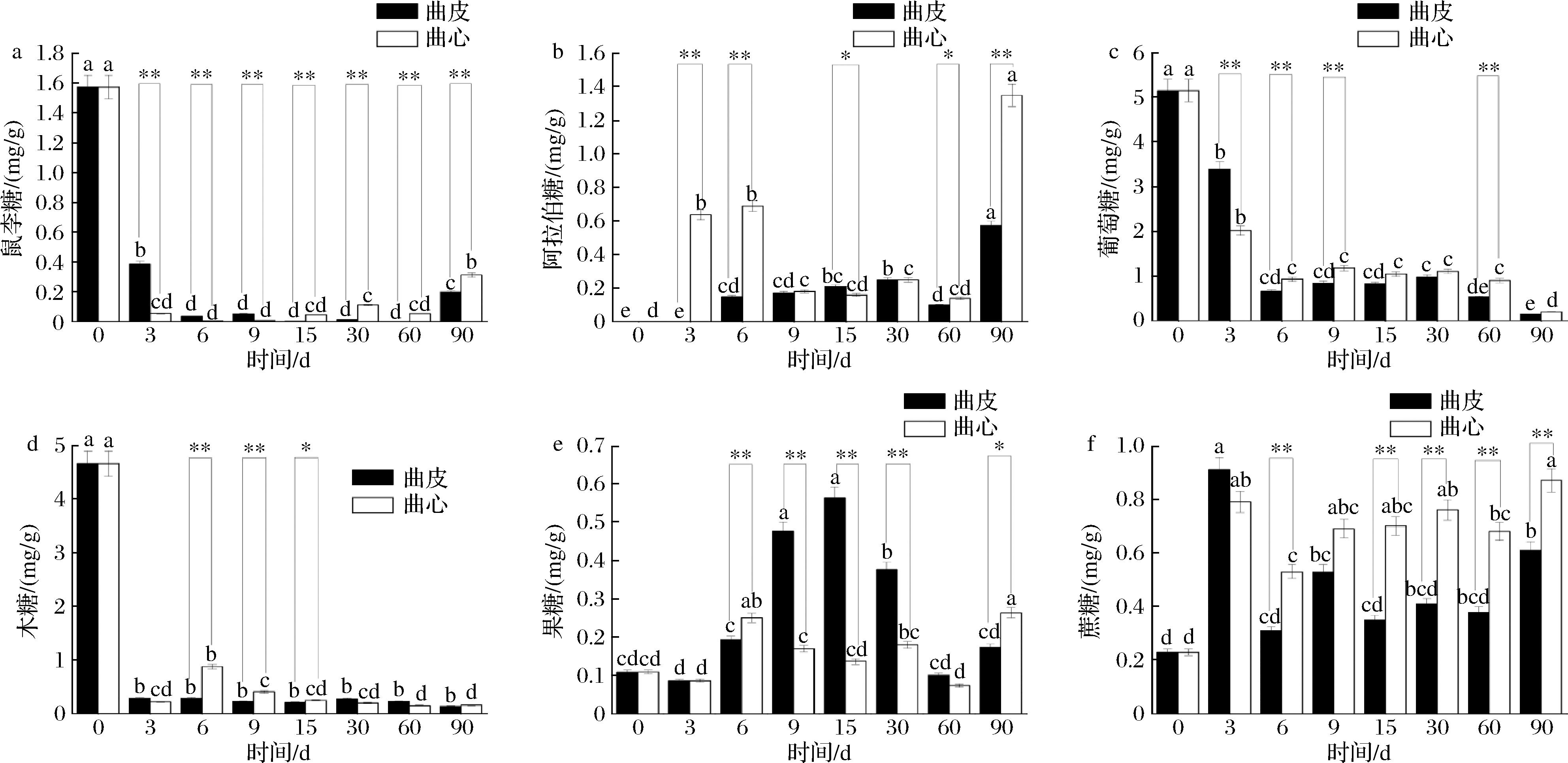
a-鼠李糖;b-阿拉伯糖;c-葡萄糖;d-木糖;e-果糖;f-蔗糖
图2 大曲曲皮和曲心发酵过程中糖化合物的变化
Fig.2 Changes in sugar compounds during fermentation in the surface and the core of Daqu
曲心中鼠李糖、阿拉伯糖、葡萄糖、木糖和蔗糖含量较高,曲皮中果糖含量较高,可以看出由于发酵微环境差异导致的在大曲不同部位含糖量差异。大曲中葡萄糖和果糖增加是谷物蛋白水解酶活性的贡献[20]。
2.3 大曲发酵中游离氨基酸(free amino acid,FAA)化合物的变化
研究表明,亲水性和碱性氨基酸如赖氨酸、组氨酸和精氨酸可以显著促进酵母生长、活力、发酵性和乙醇产量[21]。对FAA检测表明(表1),大曲中共检测到17种FAA,在发酵过程中均呈上升趋势,曲心中FAA的变化差异较曲皮更为显著,含量最高分别是谷氨酸、脯氨酸、亮氨酸、丝氨酸和苯丙氨酸,其中谷氨酸、脯氨酸含量最高,这与前人的研究一致[22]。从第0天到第90天,曲皮和曲心的谷氨酸含量分别从46.1 mg/100 g增加到48.1 mg/100 g和52.9 mg/100 g,脯氨酸含量从17.5 mg/100 g分别增加到18.2 mg/100 g和19.9 mg/100 g。曲皮和曲心的亮氨酸含量从10.5 mg/100 g增加到11.3 mg/100 g。曲心丝氨酸从第0天8.0 mg/100 g增加到90 d 10.8 mg/100 g,但曲皮的丝氨酸含量则没有显著差异。曲皮苯丙氨酸含量在第90天达到最大值9.9 mg/100 g,而曲心在第9天时达到最大值10.2 mg/100 g。
表1 大曲曲皮和曲心发酵过程中游离氨基酸的含量变化 单位:mg/100 g Table 1 Changes in the content of free amino acids during fermentation of the surface and core of Daqu
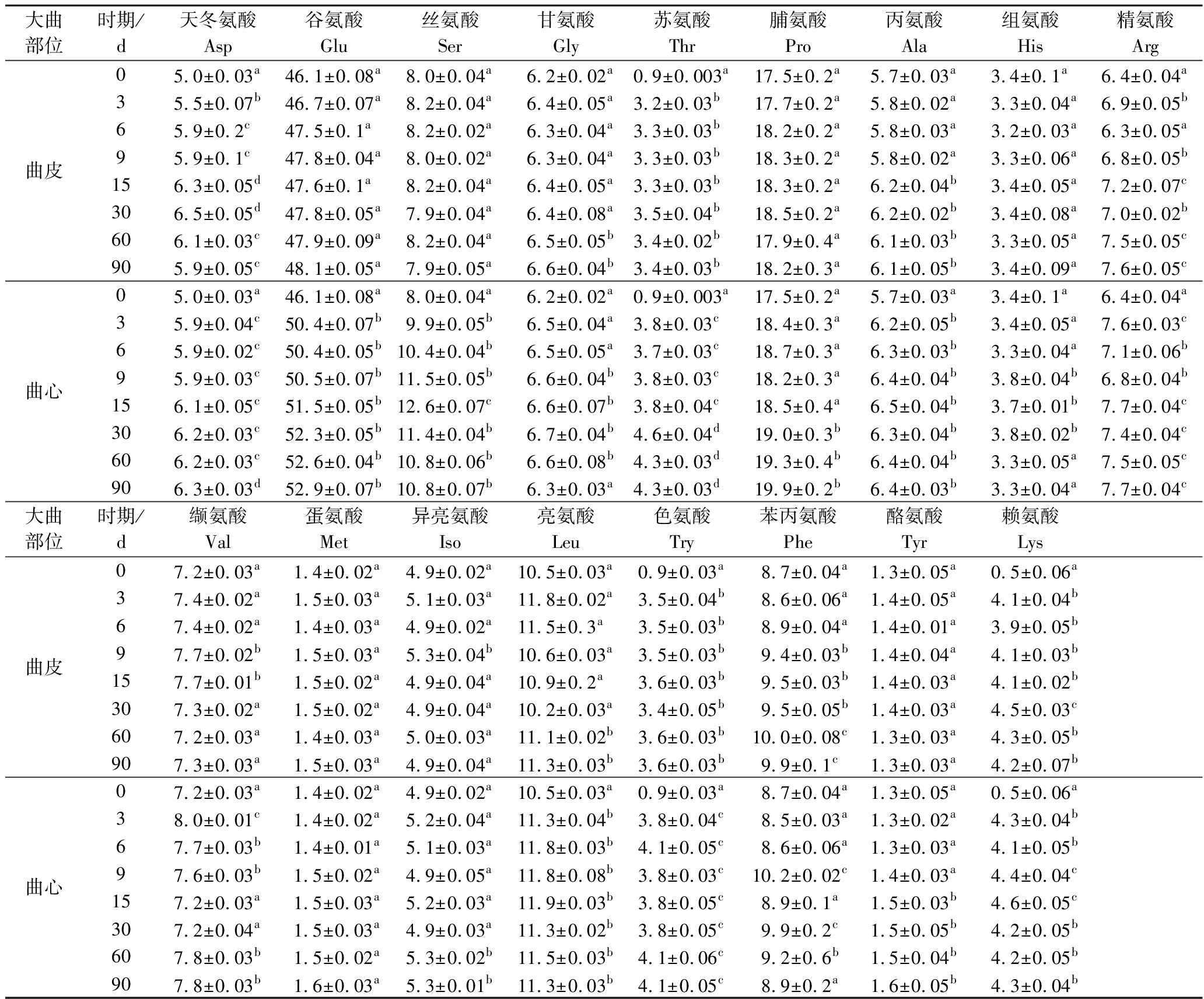
大曲部位时期/d天冬氨酸Asp谷氨酸Glu丝氨酸Ser甘氨酸Gly苏氨酸Thr脯氨酸Pro丙氨酸Ala组氨酸His精氨酸Arg曲皮05.0±0.03a46.1±0.08a8.0±0.04a6.2±0.02a0.9±0.003a17.5±0.2a5.7±0.03a3.4±0.1a6.4±0.04a35.5±0.07b46.7±0.07a8.2±0.04a6.4±0.05a3.2±0.03b17.7±0.2a5.8±0.02a3.3±0.04a6.9±0.05b65.9±0.2c47.5±0.1a8.2±0.02a6.3±0.04a3.3±0.03b18.2±0.2a5.8±0.03a3.2±0.03a6.3±0.05a95.9±0.1c47.8±0.04a8.0±0.02a6.3±0.04a3.3±0.03b18.3±0.2a5.8±0.02a3.3±0.06a6.8±0.05b156.3±0.05d47.6±0.1a8.2±0.04a6.4±0.05a3.3±0.03b18.3±0.2a6.2±0.04b3.4±0.05a7.2±0.07c306.5±0.05d47.8±0.05a7.9±0.04a6.4±0.08a3.5±0.04b18.5±0.2a6.2±0.02b3.4±0.08a7.0±0.02b606.1±0.03c47.9±0.09a8.2±0.04a6.5±0.05b3.4±0.02b17.9±0.4a6.1±0.03b3.3±0.05a7.5±0.05c905.9±0.05c48.1±0.05a7.9±0.05a6.6±0.04b3.4±0.03b18.2±0.3a6.1±0.05b3.4±0.09a7.6±0.05c曲心05.0±0.03a46.1±0.08a8.0±0.04a6.2±0.02a0.9±0.003a17.5±0.2a5.7±0.03a3.4±0.1a6.4±0.04a35.9±0.04c50.4±0.07b9.9±0.05b6.5±0.04a3.8±0.03c18.4±0.3a6.2±0.05b3.4±0.05a7.6±0.03c65.9±0.02c50.4±0.05b10.4±0.04b6.5±0.05a3.7±0.03c18.7±0.3a6.3±0.03b3.3±0.04a7.1±0.06b95.9±0.03c50.5±0.07b11.5±0.05b6.6±0.04b3.8±0.03c18.2±0.3a6.4±0.04b3.8±0.04b6.8±0.04b156.1±0.05c51.5±0.05b12.6±0.07c6.6±0.07b3.8±0.04c18.5±0.4a6.5±0.04b3.7±0.01b7.7±0.04c306.2±0.03c52.3±0.05b11.4±0.04b6.7±0.04b4.6±0.04d19.0±0.3b6.3±0.04b3.8±0.02b7.4±0.04c606.2±0.03c52.6±0.04b10.8±0.06b6.6±0.08b4.3±0.03d19.3±0.4b6.4±0.04b3.3±0.05a7.5±0.05c906.3±0.03d52.9±0.07b10.8±0.07b6.3±0.03a4.3±0.03d19.9±0.2b6.4±0.03b3.3±0.04a7.7±0.04c大曲部位时期/d缬氨酸Val蛋氨酸Met异亮氨酸Iso亮氨酸Leu色氨酸Try苯丙氨酸Phe酪氨酸Tyr赖氨酸Lys曲皮07.2±0.03a1.4±0.02a4.9±0.02a10.5±0.03a0.9±0.03a8.7±0.04a1.3±0.05a0.5±0.06a37.4±0.02a1.5±0.03a5.1±0.03a11.8±0.02a3.5±0.04b8.6±0.06a1.4±0.05a4.1±0.04b67.4±0.02a1.4±0.03a4.9±0.02a11.5±0.3a3.5±0.03b8.9±0.04a1.4±0.01a3.9±0.05b97.7±0.02b1.5±0.03a5.3±0.04b10.6±0.03a3.5±0.03b9.4±0.03b1.4±0.04a4.1±0.03b157.7±0.01b1.5±0.02a4.9±0.04a10.9±0.2a3.6±0.03b9.5±0.03b1.4±0.03a4.1±0.02b307.3±0.02a1.5±0.02a4.9±0.04a10.2±0.03a3.4±0.05b9.5±0.05b1.4±0.03a4.5±0.03c607.2±0.03a1.4±0.03a5.0±0.03a11.1±0.02b3.6±0.03b10.0±0.08c1.3±0.03a4.3±0.05b907.3±0.03a1.5±0.03a4.9±0.04a11.3±0.03b3.6±0.03b9.9±0.1c1.3±0.03a4.2±0.07b曲心07.2±0.03a1.4±0.02a4.9±0.02a10.5±0.03a0.9±0.03a8.7±0.04a1.3±0.05a0.5±0.06a38.0±0.01c1.4±0.02a5.2±0.04a11.3±0.04b3.8±0.04c8.5±0.03a1.3±0.02a4.3±0.04b67.7±0.03b1.4±0.01a5.1±0.03a11.8±0.03b4.1±0.05c8.6±0.06a1.3±0.03a4.1±0.05b97.6±0.03b1.5±0.02a4.9±0.05a11.8±0.08b3.8±0.03c10.2±0.02c1.4±0.03a4.4±0.04c157.2±0.03a1.5±0.03a5.2±0.03a11.9±0.03b3.8±0.05c8.9±0.1a1.5±0.03b4.6±0.05c307.2±0.04a1.5±0.03a4.9±0.03a11.3±0.02b3.8±0.05c9.9±0.2c1.5±0.05b4.2±0.05b607.8±0.03b1.5±0.02a5.3±0.02b11.5±0.03b4.1±0.06c9.2±0.6b1.5±0.04b4.2±0.05b907.8±0.03b1.6±0.03a5.3±0.01b11.3±0.03b4.1±0.05c8.9±0.2a1.6±0.05b4.3±0.04b
注:表中数据为平均数±标准差, 同列数据后有相同英文字母者表示在 0.05水平上差异不显著。
2.4 大曲营养物质与微生物群落组成间关系
冗余分析表明(图3),发酵中微生物群落的相对丰度与营养物质之间存在着复杂的关系。曲皮中B型淀粉和直链淀粉在第3天时与食酸菌属(Acidovorax)和叶杆菌属(Phyllobacterium)显著正相关;丝氨酸和天冬氨酸的含量与曲皮第60天时的微生物组成呈显著正相关,在属水平上与魏斯氏菌属(Weissella)、醋酸单胞菌属(Acetobacter)和乳杆菌属(Lactobacillus)显著正相关;曲皮中第60天冬氨酸与乳杆菌属(Lactobacilus)显著正相关,第90天阿拉伯糖与肠杆菌属(Enterobacter)显著正相关(图3-a)。曲心中葡萄糖、果糖、缬氨酸、支链淀粉在第3~9天与醋酸单胞菌属(Acetobacter)、双杆菌属(Undibacterium)、乳杆菌属(Lactobacillus)显著正相关;果糖、黄酮、蛋氨酸、丝氨酸、亮氨酸、组氨酸和苏氨酸与葡萄球菌属(Staphylococcus)在15~30 d内呈显著正相关;第60~90天纤维素、黄酮类、苏氨酸、蛋氨酸、缬氨酸与芽孢杆菌属(Bacillus)呈显著正相关(图3-b)。

a-曲皮细菌属;b-曲心细菌属;c-曲皮真菌属;d-曲心真菌属
图3 大曲曲皮(S)和曲心(C)微生物群落结构中属水平上与营养物质指标的RDA结果
Fig.3 RDA results of microbial community structure at the genus level and nutrient indexes in the surface(S) and the core(C) of Daqu
对于真菌,曲皮在第30天时,酿酒酵母属(Saccharomyces)和嗜热真菌属(Thermomyces)的相对丰度与果糖、阿拉伯糖、谷氨酸和精氨酸呈显著正相关,第90天木糖、阿拉伯糖和精氨酸与翘孢霉属(Emericella)显著正相关(图3-c)。毕赤酵母属(Pichia)、棍孢属(Clavispora)、假丝酵母属(Candida)和生丝毕赤酵母属(Hyphopichia)的相对丰度与曲心第3天的缬氨酸和支链淀粉含量正相关;曲心的支链淀粉、亮氨酸和丝氨酸含量在6~15 d时与热子囊菌属(Thermoacscus)显著正相关,苏氨酸含量在30~90 d与曲霉属(Aspergillus)、热子囊菌属(Thermoacscus)显著正相关(图3-d)。
本研究中曲心与曲皮品质指标的差异可能归因于发酵过程中2个不同部位因曲温差异形成的不同微生物群落结构,从而导致微生物利用资源的能力存在差异[23]。冗余分析表明9个细菌属和11个真菌属与18种检测指标存在显著相关性(P<0.05)。其中,直链淀粉与叶杆菌属(Phyllobacterium)显著正相关,纤维素与芽孢杆菌属(Bacillus),葡萄糖、缬氨酸与毕赤酵母属(Pichia)、假丝酵母属(Candida)、醋酸单胞菌属(Acetobacter)、双杆菌属(Undibacterium)、乳杆菌属(Lactobacillus)正相关,表明这些物质的消耗和生成主要与这些微生物有关。发酵乳杆菌来源于大曲[24],乳酸菌在发酵过程中将葡萄糖转化为乳酸,直接影响白酒的品质,提高白酒的甜度。毕赤酵母是大曲中最主要的酵母之一,被发现分泌淀粉酶、酸性蛋白酶和β-葡萄糖苷酶,这反过来有助于淀粉降解[25]。微生物对大曲营养物质的影响导致微生物不同的菌株和物种之间相互作用,从而实现共同演化的目标。
3 结论
本研究以中高温大曲8个不同发酵时间点的曲皮和曲心为研究对象,对多种营养物质进行了检测,探究其不同发酵时间点、不同曲块位置营养物质的消耗情况及其变化对微生物的影响。研究表明,在发酵初期大曲以消耗直链淀粉为主,后期以支链淀粉为主,发酵过程中共消耗50%左右的直链淀粉、80%左右的支链淀粉,整个发酵过程以消耗支链淀粉为主。蛋白质被蛋白酶水解后会生成各种醇类、脂肪酸和醛类等构成米酒的主要香气,在发酵第9天大曲中已基本检测不出谷蛋白条带。黄酮含量在发酵过程中呈现上升,曲心增加更明显。纤维素含量总体呈下降趋势,但曲心中后期有平缓上升。阿拉伯糖和蔗糖含量增加,葡萄糖含量下降明显。17种氨基酸均呈上升趋势,其中谷氨酸、脯氨酸含量最高,并且曲心中游离氨基酸含量高于曲皮。冗余分析表明直链淀粉和纤维素含量分别与叶杆菌属(Phyllobacterium)和芽孢杆菌属(Bacillus)丰度正相关,葡萄糖、缬氨酸含量与毕赤酵母属(Pichia)、假丝酵母属(Candida)、醋酸单胞菌属(Acetobacter)、双杆菌属(Undibacterium)、乳杆菌属(Lactobacillus)正相关。这些结果表明,大曲营养物质与微生物之间的变化存在显著的相关性,可以推测高支链淀粉、高谷蛋白、高葡萄糖含量的大曲更为优级,因此,生产上,可以选育高支链淀粉、高谷蛋白、高葡萄糖含量的小麦用于制曲。本研究可为大曲质量控制、工艺优化和选育专用型小麦原料品种提供参考,然而,要找到更适宜制曲的小麦还需要更多的尝试。
[1] 梁宗余. 白酒酿造技术[M].北京:中国轻工业出版社, 2015.LIANG Z Y.Baijiu Brewing Technology[M].Beijing:China Light Industry Press, 2015.
[2] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].Journal of Agricultural and Food Chemistry, 2018, 66(22):5425-5432.
[3] ZOU W, ZHAO C Q, LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Frontiers in Microbiology, 2018, 9:671.
[4] 徐姿静, 徐占成, 唐清兰.中国传统固态大曲酒风味质量特色的研究进展[J].酿酒科技, 2017(1):84-89.XU Z J, XU Z C, TANG Q L.Research progress in the flavor &quality characteristics of traditional Chinese Daqu Baijiu by solid-state fermentation[J].Liquor-Making Science &Technology, 2017(1):84-89.
[5] ZHENG X W, TABRIZI M R, ROBERT NOUT M J, et al.Daqu: A traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing, 2011, 117(1):82-90.
[6] 敖宗华, 陕小虎, 沈才洪, 等.我国浓香型大曲产业发展概况[J].酿酒科技, 2011(1):78-81.AO Z H, SHAN X H, SHEN C H, et al.Review of industrial development of Luzhou-flavor Daqu in China[J].Liquor-Making Science &Technology, 2011(1):78-81.
[7] 张立新. 小议制酒大曲原料[J].中国酿造, 2005, 24(3):36-38.ZHANG L X.Discussion of koji making materials of liquor[J].China Brewing, 2005, 24(3):36-38.
[8] DING L, ZHAO M M, ZHAO X F, et al.Evaluation of the spatial distribution and dynamic succession of microbial community and quality properties during fermentation in Chinese medium-temperature Daqu[J].Journal of Food Processing &Preservation, 2022, 46(12):1.
[9] 袁超, 张光杰.小麦A、B型淀粉分离提取方法研究[J].粮食与油脂, 2011, 24(2):18-20.YUAN C, ZHANG G J.Study on isolation and extraction of A-and B-type starch granules in wheat[J].Cereals &Oils, 2011, 24(2):18-20.[10] 甄红伟, 何思鲁, 牟建楼, 等.响应面法优化小麦胚芽总黄酮的提取工艺[J].中国食品添加剂, 2017(6):128-132.ZHEN H W, HE S L, MU J L, et al.Optimization of extraction process for total flavonoids from wheat germ by response surface methodology[J].China Food Additives, 2017(6):128-132.
[11] LIAN X J, GUO J J, WANG D L, et al.Effects of protein in wheat flour on retrogradation of wheat starch[J].Journal of Food Science, 2014, 79(8):C1505-C1511.
[12] JANG Y K, SHIN G R, JUNG E S, et al.Process specific differential metabolomes for industrial gochujang types (pepper paste) manufactured using white rice, brown rice, and wheat[J].Food Chemistry, 2017, 234:416-424.
[13] 陈懿瑶, 罗阳, 闫燊, 等.HPAEC-PAD法测定石斛属植物单糖组分与主成分聚类分析[J].中国实验方剂学杂志, 2018, 24(15):106-111.CHEN Y Y, LUO Y, YAN S, et al.Monosaccharide composition and principal component clustering analysis of Dendrobium by HPACE-PAD[J].Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(15):106-111.
[14] 赵英莲, 牟德华, 李艳.2, 4-二硝基氟苯柱前衍生HPLC检测树莓中游离氨基酸[J].食品科学, 2015, 36(6):178-182.ZHAO Y L, MOU D H, LI Y.High performance liquid chromatographic analysis of free amino acids in raspberry using pre-column derivatization with 2, 4-dinitrofluorobenzene[J].Food Science, 2015, 36(6):178-182.
[15] SAFDAR B, PANG Z H, LIU X Q, et al.Flaxseed gum:Extraction, bioactive composition, structural characterization, and its potential antioxidant activity[J].Journal of Food Biochemistry, 2019, 43(11):e13014.
[16] WANG P, WU Q, JIANG X J, et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology, 2017, 250:59-67.
[17] YANG Z X, YU W J, XU D, et al.Impact of frozen storage on whole wheat starch and its A-Type and B-Type granules isolated from frozen dough[J].Carbohydrate Polymers, 2019, 223:115142.
[18] KUHNE J, HENER U, JUNG J, et al.3-Methylbutanol, 2-methylbutanol and ethanol as quality parameters of apple juice[J].Deutsche Lebensmittel-Rundschau, 2007, 103(6):247-255.
[19] KRIS-ETHERTON P M, HECKER K D, BONANOME A, et al.Bioactive compounds in foods:Their role in the prevention of cardiovascular disease and cancer[J].The American Journal of Medicine, 2002, 113(9):71-88.
[20] WANG B C, XIAO L, CHAI D, et al.Metabolite analysis of wheat dough fermentation incorporated with buckwheat[J].Food Science &Nutrition, 2020, 8(8):4242-4251.
[21] ZHOU Y J, YANG H R, ZONG X Y, et al.Effects of wheat gluten hydrolysates fractionated by different methods on the growth and fermentation performances of brewer’s yeast under high gravity fermentation[J].International Journal of Food Science &Technology, 2018, 53(3):812-818.
[22] XU Y C, SUN M X, ZONG X Y, et al.Potential yeast growth and fermentation promoting activity of wheat gluten hydrolysates and soy protein hydrolysates during high-gravity fermentation[J].Industrial Crops and Products, 2019, 127:179-184.
[23] TANG J, RAO J Q, ZOU Y F, et al.The community assembly patterns determined differences between the surface and the core microbial communities of Nongxiangxing Daqu[J].LWT, 2023, 183:114936.
[24] WANG Q, ZHANG H X, LIU X.Microbial community composition associated with Maotai liquor fermentation[J].Journal of Food Science, 2016, 81(6):M1485-M1494.
[25] WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology, 2018, 84(4):e02369-e02317.