“若作酒醴,尔唯曲孽”,曲定酒型,高温制曲是赋予酒体酱香和焦香等香气特征的重要来源之一[1],其发酵温度一般为60~68 ℃[2],较为严苛的发酵条件使高温大曲富集了独特的微生物类群。然而在高温大曲发酵过程中,由于安曲方式的不同,导致不同位置大曲接触环境的温度、湿度、空气等条件存在差异[3],最终部分制曲车间呈现出白色和黑色2 种类型的高温大曲,部分呈现白色、黄色和黑色3 种类型的高温大曲。目前,已有许多研究人员从风味物质和微生物菌群等方面对不同类型的高温大曲展开了研究。张芮等[4]应用宏基因组学方法对不同类型的高温大曲研究发现,黑曲中的微生物以罗萨氏菌属(Rasamsonia)、曲霉属(Aspergillus)、丝衣霉属(Byssochlamys)、篮状菌属(Talaromyces)和青霉菌属(Penicillium)等真菌为主,且相对丰度均高于白曲。王颖等[5]对取自赤水河上游核心产区和赤水河中下游核心产区的高温大曲风味研究发现,同一产区的黑曲和白曲在挥发性成分类别上差异明显,白曲的四甲基吡嗪、乙偶姻含量比黑曲高。综上可知,不同类型的高温大曲在真菌菌群和感官指标上均存在显著差异。
随着分子生物学技术的发展,高通量测序技术已被广泛应用于酒曲微生物多样性的解析中。例如吴成等[6]运用高通量测序技术对高温大曲发酵过程中真菌多样性研究发现,从曲胚入仓开始发酵到结束发酵,真菌的多样性逐渐降低,曲坯成型入仓环节库德毕赤酵母(Pichia kudriavzevii)和矮小假丝酵母(Kazachstania humilis)等酵母菌为主要优势菌种,平均相对含量为76.91%,随着发酵的进行温度逐渐升高,坚脆嗜热子囊菌(Thermoascus crustaceus)和黄嗜热子囊菌(Thermoascus aurantiacus)等耐高温的丝状真菌成为优势菌种,平均相对含量达到92.82%。孙羊羊等[7]对不同酒厂高温大曲的微生物群落解析发现,与天津芦台春酿造有限公司的高温大曲相比,贵州怀仁市高温大曲真菌群落物种丰富度较大且多样性更高。由此可见,将高通量测序技术运用于不同类型的高温大曲样品微生物群落结构解析具有可行性。作为现代仿生学设备,电子鼻和电子舌实现了对食品品质指标的高效检测[8],王玉荣等[9]运用电子鼻与电子舌技术对酱香白酒窖池第四轮次不同深度酒醅研究发现,酒醅滋味特征中除咸味外其余7 个滋味指标相对强度较为接近,随着窖池的从上至下,W1C、W3C和W5C等检测芳香类风味物质的传感器相对强度显著增大。因此运用电子鼻和电子舌技术对不同类型高温大曲样品品质指标的解析具有可行性。
本研究以采集自河北省邯郸市某酒厂10 个白色和黑色高温大曲样品为研究对象,首先采用MiSeq高通量测序技术对两者真菌群落结构进行解析,其次进行风味和滋味指标的测定,并对2 种类型高温大曲的差异进行解析,最后对优势真菌属与风味和滋味指标之间的相关性进行探究,以期为解析不同类型高温大曲的差异和提升白酒的品质提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲,于2023年5月在河北省邯郸市某酒厂采集6 份黑色高温大曲(简称黑曲)和4 份白色高温大曲(简称白曲)样品,共计10 份。黑曲编号为B1~B6,白曲编号为W1~W4,所有高温大曲样品均为该酒厂自制。采样时首先根据大曲的外观表征将曲房堆放的大曲进行分层,其中白曲主要取于曲坯表层和上层,主要表现为灰白色略带生麦味,且表面存在少量菌丝,颗粒感较为明显,黑曲主要取于曲胚的中间部分,因为发酵时温度和湿度较高,其最终呈现黑色且伴有焦香味。采集的高温大曲为砖块型,运回实验室后进行粉碎过筛,运用四分法进行取样后于-20 ℃保存备用。
1.1.2 试剂
DNeasy mericon Food Kit DNA基因组提取试剂盒,德国QIAGEN公司;Axygen清洁试剂盒,康宁生命科学吴江有限公司;10×Buffer、DNA聚合酶、dNTP缓冲液、rTaq酶和正反向引物ITS3F/ITS4R(ITS3F:5′-GCATCGATGAAGAACGCAGC-3′和ITS4R:5′-TCCTCCGCTTATTGATATGC-3′),上海桑尼生物科技有限公司;阴离子溶液、阳离子溶液、内溶液、参比溶液,日本INSENT公司。
1.2 仪器与设备
Veriti FAST梯度PCR仪,美国ABI公司;164-5050基础电泳仪,美国Bio-Rad公司;UVPCDS8000凝胶成像分析系统,美国Protein Simple公司;Illumina MiSeq PE300高通量测序平台,美国Illumina公司;R930机架式服务器,美国DELL公司;PEN3电子鼻,德国Airsense公司;SA402B电子舌(配备5个传感器和2 个参比电极),日本INSENT公司。
1.3 实验方法
1.3.1 基因组DNA提取、PCR扩增和高通量测序
称取2.0 g高温大曲样品使用QIAGEN DNeasy mericon Food Kit DNA基因组提取试剂盒进行DNA的提取,具体提取步骤按照说明书进行。将经过琼脂糖凝胶电泳检测合格的DNA产物使用引物ITS3F/ITS4R对真菌ITS区进行PCR扩增,将经过琼脂糖凝胶电泳检测合格的扩增产物送往上海美吉生物医药有限公司进行高通量测序。
1.3.2 序列质控和生物信息学分析
首先使用QIIME v1.9.1平台参照CAI等[10]的方法对序列进行拼接,随后遵循重叠区域碱基数应小于10 bp、最大错配率为0.2、碱基核苷酸条形码标签(barcode)无错配和最大引物错配数为2等原则进行高质量序列的筛选,随后在97%序列相似性的阈值下进行分类操作单元(operational taxonomic units,OTU)矩阵的划分[11],采用UNITE数据库[12]对真菌ITS序列进行比对,同时对样品真菌群落的α和β多样性进行分析。
1.3.3 白色和黑色高温大曲风味和滋味指标的测定
风味指标测定:称取5 g高温大曲粉状样品于电子鼻顶空瓶中,静置于室温下平衡1 h,每个样品称取3 个平行。测试条件[13]:传感器自洁时间120 s,调零时间5 s;样品准备时间5 s;样品分析测定时间60 s,每间隔1 s测定1个数值;选取49、50、51 s对应的传感器响应值的平均值进行分析。
滋味指标测定:称取30 g高温大曲粉状样品与120 mL纯水混匀后室温静置30 min,10 000 r/min离心10 min,将上清液进行抽滤后,参照WANG等[14]的方法进行酸、苦、涩、咸、鲜、后味A(苦的回味)、后味B(涩的回味)和丰度(鲜的回味)指标的测定。
1.3.4 数据处理
使用Origin 2018软件绘制柱形图;使用R(v4.1.3)软件完成主坐标分析(principal coordinates analysis,PCoA)和普氏分析;使用在线网站(http://huttenhower.sph.harvard.edu/galaxy/)采用线性判别分析效应量(linear discriminant analysis effect size,LEfSe)分析方法筛选存在差异的物种;使用Cytoscape(v3.7.2)软件绘制相关性网络图;使用Past3软件中的Mann-Whitney检验法进行差异性分析。
2 结果与分析
2.1 白色和黑色高温大曲真菌菌群结构分析
高通量测序结果显示,10份高温大曲样品共得到676 371条高质量ITS基因序列。将所得高质量序列按照97%相似度进行聚类后得到1 000 个真菌OTU。通过对α多样性指数进行计算发现,白色和黑色高温大曲样品真菌群落的平均香农指数分别为2.44和2.94,平均Chao1指数分别为291和319,经Mann-Whitney检验发现,两者的差异均不显著(P>0.05),表明2 种类型高温大曲样品的真菌群落物种丰富度和多样性没有显著差异。本研究进一步对白色和黑色高温大曲在门和属水平上进行分类学分析,将平均相对含量>1.0%的门和属定义为优势真菌门和属,结果如图1所示。
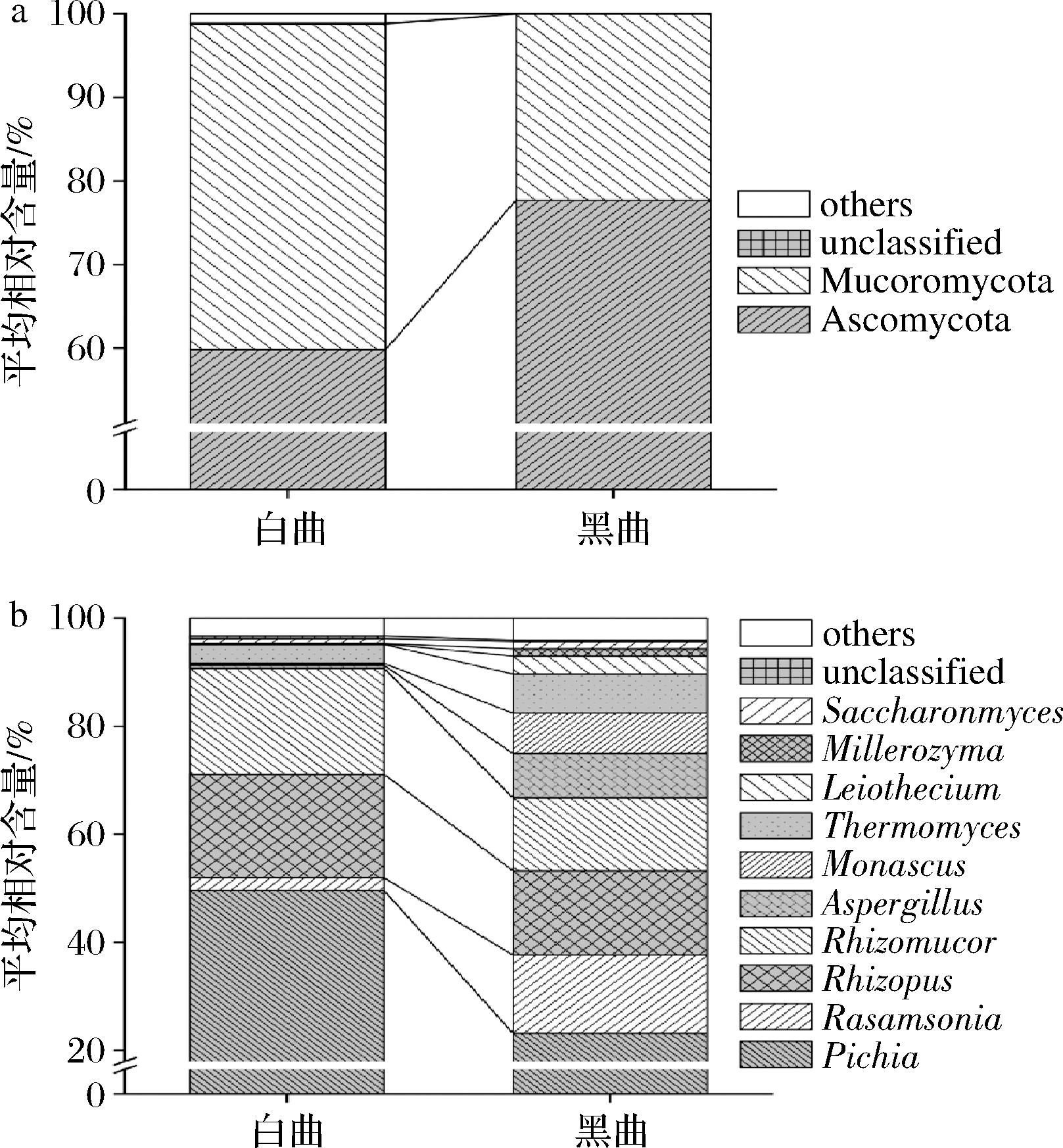
a-优势真菌门;b-优势真菌属
图1 白色和黑色高温大曲优势真菌门和属相对含量比较分析
Fig.1 Comparative analysis of dominant phyla and genera of white and black high-temperature Daqu
由图1-a可知,从10 份高温大曲样本中共检测到2 个优势真菌门,分别为子囊菌门(Ascomycota,70.55%)和毛霉菌门(Mucoromycota,28.94%),LIU等[15]对河南仰韶陶融型白酒高温大曲的真菌多样性进行研究也发现,Ascomycota和Mucoromycota是其中的优势真菌门,平均相对含量分别为75.51%和24.44%,与本研究一致。由图1-b可知,从10 份高温大曲样本中共检测到10 个优势真菌属,分别为毕赤酵母菌属(Pichia,20.53%)、罗萨氏菌属(Rasamsonia,15.68%)、根霉属(Rhizopus,15.24%)、根毛霉属(Rhizomucor,12.88%)、Aspergillus(8.97%)、红曲霉属(Monascus,8.22%)、嗜热真菌属(Thermomyces,7.56%)、Leiothecium(3.70%)、Millerozyma(1.43%)和酵母菌属(Saccharomyces,1.40%),其中白色和黑色高温大曲真核生物群落组成相似,均以Pichia、Rhizopus和Rhizomucor为主,平均相对含量分别为49.62%、19.16%和19.64%与23.17%、15.60%和13.50%。通过采用高通量测序技术,丁芳等[16]对采集自四川省某酒厂的高温大曲研究发现Aspergillus在初级和特级大曲中占主导地位,平均相对含量分别为66.67%和70.74%,孙羊羊等[7]对采集自天津芦台春酿造有限公司的高温大曲研究发现,Thermomyces平均相对含量最高为39.70%,杨旭等[17]对采集自河南漯河贾湖酒业集团有限责任公司的出房高温大曲研究发现,Rhizomucor占据优势,相对含量达到34.44%。由此可见,不同酒厂生产的高温大曲由于原料、工艺、环境等各方面因素的影响,导致其真菌菌群存在一定差异,所以积极开展对不同酒厂高温大曲微生物多样性的解析对提升大曲的品质具有积极作用。据报道Pichia具有较强的产酯能力,与苯乙醇[18]、乙酸乙酯[19]的合成有关,余硕文等[20]在对君丰大曲酱香白酒酒醅的微生物与风味研究亦发现,Pichia与异戊醇、异戊酸乙酯、甲酸乙酯等酱香型风味物质的相关性极显著(P<0.001)。Rhizopus和Rhizomucor在大曲中主要负责降解淀粉,给糖化提供动力[21]。Aspergillus是白酒发酵过程的重要丝状真菌,影响白酒风味的形成,JIN等[22]对酱香型白酒大曲研究发现,其与吡嗪类化合物、酯类和芳香族化合物呈密切正相关。Rasamsonia在黑色高温大曲中富集,平均相对含量为14.47%,而在白色高温大曲仅为2.34%,Rasamsonia是一类具有编码糖苷水解酶能力的耐高温丝状真菌属,并且能够降解纤维素[23]。此外经Mann-Whitney检验发现,白色高温大曲中Pichia的平均相对含量显著偏高(P<0.05),Monascus的平均相对含量显著偏低(P<0.05),究其原因可能与白色和黑色高温大曲在曲房中所处位置不同,导致水分含量、温度等条件的不同,从而对真菌群落结构产生影响[24]。Monascus能够在发酵过程中产生红曲霉素[25],具有药用价值,其次还能分泌酯化酶和具有酒香、果香和蜜香的物质,对产品风味产生积极影响[26]。
2.2 白色和黑色高温大曲真菌菌群结构差异分析
本研究进一步采用统计学分析方法对白色和黑色高温大曲真菌菌群结构进行解析,结果如图2所示。
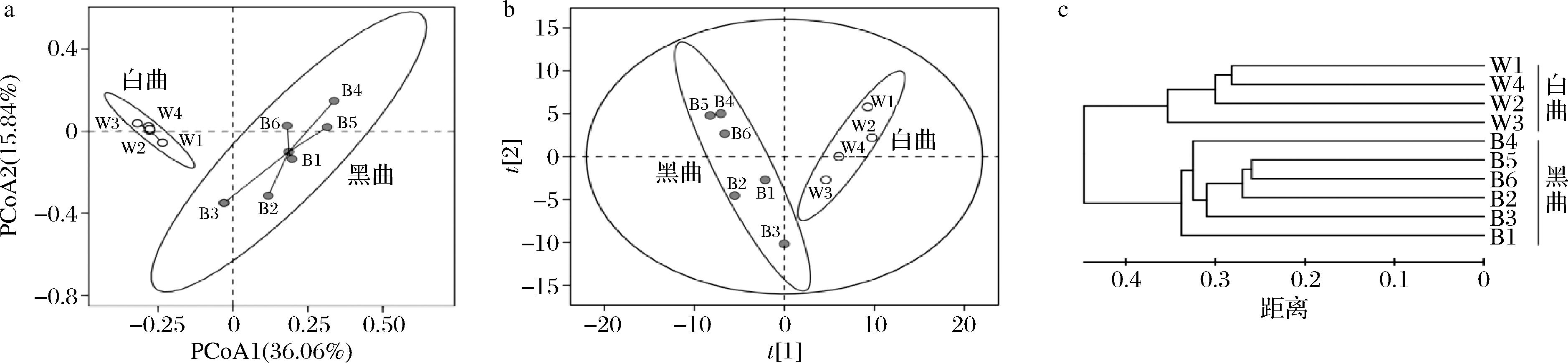
a-基于真菌非加权OTU的UniFrac距离PCoA结果;b-基于真菌菌属的平均相对含量OPLS-DA结果;c-基于真菌非加权OTU的非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类
图2 白色和黑色高温大曲菌群结构分析
Fig.2 Analysis of the community structure of white and black high-temperature Daqu
由图2-a可知,白色和黑色高温大曲样品呈现明显的分离趋势,经PERMANOVA检验发现,2 种类型高温大曲样品群落结构在整体上存在非常显著差异(P<0.01)。此外,为了对2 种类型高温大曲样品间差异的微生物属进行分析,本研究构建了正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)模型,模型中真菌的![]() 和Q2值接近1,说明可以有效地解释样品间的差异[27]。由图2-b可知,所有高温大曲样品均在95%的置信区间内,且白色和黑色高温大曲可完全分开。同时通过图2-c可知,基于细菌和真菌菌群的聚类分析均呈现白色高温大曲聚为一簇,黑色高温大曲聚为一簇。综上结果可知,2 种类型高温大曲样品的微生物菌群间存在较大差异。
和Q2值接近1,说明可以有效地解释样品间的差异[27]。由图2-b可知,所有高温大曲样品均在95%的置信区间内,且白色和黑色高温大曲可完全分开。同时通过图2-c可知,基于细菌和真菌菌群的聚类分析均呈现白色高温大曲聚为一簇,黑色高温大曲聚为一簇。综上结果可知,2 种类型高温大曲样品的微生物菌群间存在较大差异。
为进一步探究白色和黑色高温大区中的微生物群落差异,本研究基于LEfSe分析方法对2种不同类型高温大曲样品间微生物菌群显著性差异及标记物进行了分析,结果如图3所示。
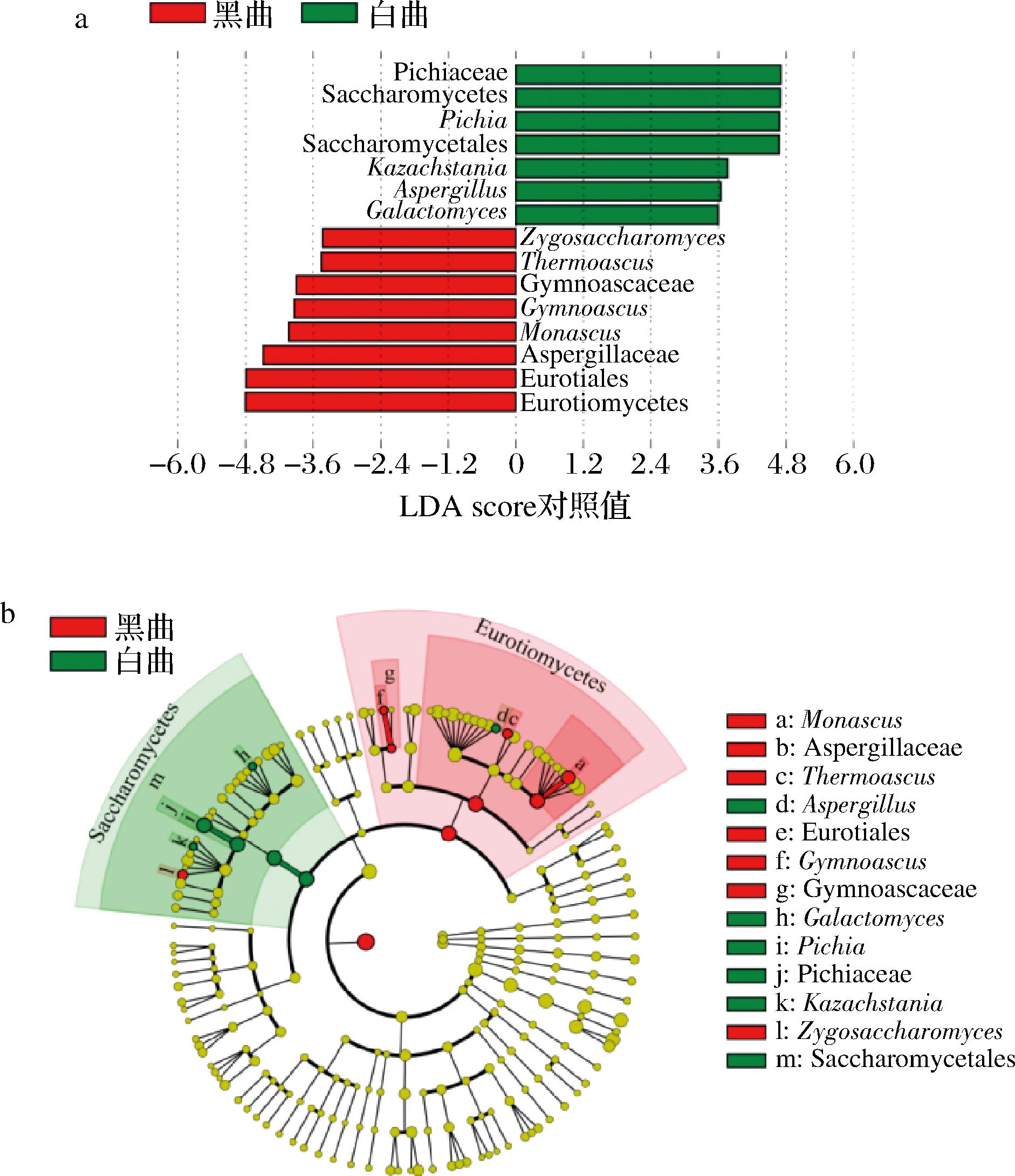
a-真菌LDA评分;b-真菌分类等级树
图3 白色和黑色高温大曲微生物LDA结果
Fig.3 LDA results of microorganisms in white and black high-temperature Daqu
由图3可知,当线性判别分析(linear discriminant analysis,LDA)评分在3.5分以上时白色和黑色高温大曲样品的共存在7 个差异真菌属,其中Pichia、哈萨克斯坦酵母属(Kazachstania)、Aspergillus和地霉属(Galactomyces)在白色高温大曲中显著富集(P<0.05),接合酵母属(Zygosaccharomyces)、嗜热子囊菌属(Thermoascus)、裸子囊菌属(Gymnoascus)和Monascus在黑色高温大曲中显著富集(P<0.05)。由此可见,Pichia为白色高温大曲的生物标志物,Monascus为黑色高温大曲的生物标志物,对优势真菌属的分析可知,Pichia在白色和黑色高温大曲中平均相对含量分别为49.62%和23.17%,Monascus分别为0.32%和7.50%。
2.3 白色和黑色高温大曲风味和滋味指标分析
由表1可知,在风味指标上,W1W和W2S这2个传感器对2种类型高温大曲样品均具有较强响应值,而其他传感器的响应值均较低,可知高温大曲样品的挥发性风味物质主要以机硫化物和乙醇类物质为主。此外经Mann-Whitney检验发现,W3S传感器对2 种类型高温大曲样品的响应值间存在非常显著的差异(P<0.01),表明2 种类型高温大曲在风味指标上的差异主要表现在烷烃类物质上。在滋味指标上,2 种类型高温大曲样品在酸味、鲜味、丰度和咸味之间的差异显著(P<0.05),而其他滋味指标间差异均不显著(P>0.05)。由此可见,2 种类型高温大曲在风味和滋味上差异亦明显。
表1 白色和黑色高温大曲风味和滋味分析结果
Table 1 Results of flavor and taste indexes in white and black high-temperature Daqu

指标白曲黑曲P值W1C(芳香型化合物)0.37(0.37,0.37-0.37)0.38(0.38,0.37-0.38)0.075W3C(芳香型化合物)0.42(0.42,0.42-0.42)0.43(0.43,0.42-0.43)0.191W5C(烷烃芳香成分)0.42(0.42,0.42-0.43)0.43(0.43,0.42-0.44)0.261W1 W(有机硫化物和萜烯类)18.24(18.40,16.67-19.49)19.19(17.79,12.54-27.14)0.915W2S(乙醇)4.52(4.52,4.51-4.53)4.44(4.41,4.29-4.71)0.105W2 W(有机硫化物)1.16(1.16,1.14-1.17)1.16(1.16,1.14-1.19)0.639W3S(烷烃类)1.14(1.14,1.10-1.17)1.04(1.04,1.01-1.08)0.006酸味1.23(0.96,-0.02-3.00)9.36(7.10,4.75-18.23)0.010苦味-0.43(-0.43,-0.87-0.00)-0.82(-0.87,-1.08-0.37)0.112涩味-0.11(0.01,-0.47-0.03)0.41(0.25,-0.23-1.19)0.259咸味-0.18(0.23,-1.76-0.60)-2.97(-3.13,-4.39-1.68)0.022鲜味0.11(0.18,-0.37-0.44)-1.29(-0.94,-2.49-0.51)0.008后味A(涩的回味)-0.05(-0.02,-0.15-0.00)0.03(-0.01,-0.10-0.23)0.563后味B(苦的回味)-0.03(-0.03,-0.15-0.07)0.42(0.45,-0.05-1.07)0.132丰度(鲜的回味)-0.33(-0.09,-1.51-0.38)-2.32(-2.45,-4.14-0.37)0.040
注:18.24(18.40,16.67-19.49)为平均值(中位数,最小值-最大值);P值为白色和黑色高温大曲理化指标的差异性分析参数。
2.4 白色和黑色高温大曲优势真菌属与风味和滋味指标的关联性分析
微生物的代谢是酒曲风味和滋味形成的重要过程,因此本研究进一步对优势真菌属与风味和滋味指标间的关联性进行了探讨,结果如图4所示。
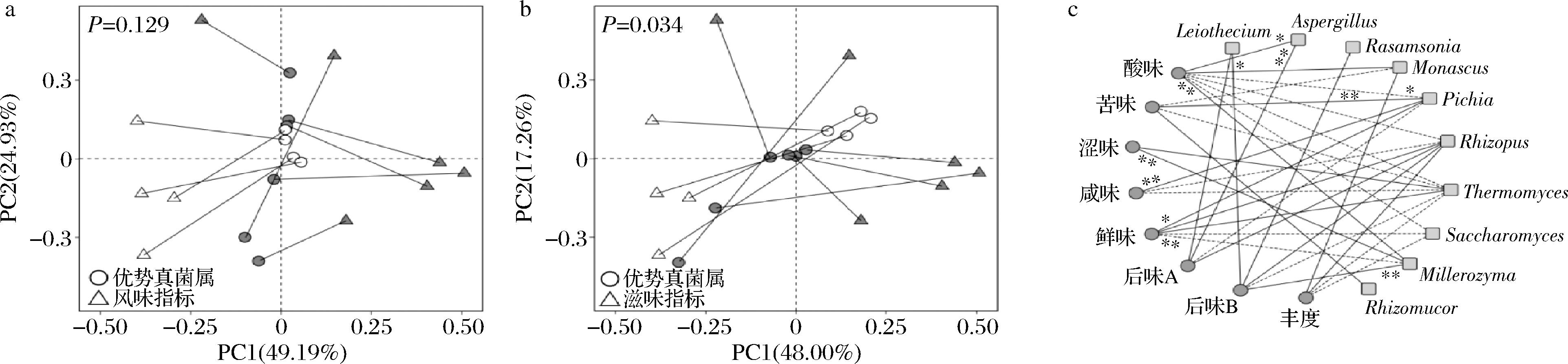
a-风味指标与优势真菌属的普氏分析;b-滋味指标与优势真菌属的普氏分析;c-滋味指标与优势真菌属的相关性网络图
图4 优势真菌属与风味和滋味指标间的相关性分析
Fig.4 Correlation analysis between dominant fungal genera and flavor and taste indicators
注:图中实线表示正相关,虚线表示负相关,“*”表示P<0.05,相关性显著;“**”表示P<0.01,相关性非常显著。
由图4-a和图4-b可知,2种类型高温大曲的优势真菌属与滋味指标之间具有显著的关联性(P<0.05),而与风味指标之间相关性不显著(P>0.05)。因此,本研究进一步揭示了2种类型高温大曲样品中优势菌属与滋味指标之间的关联性。由图4-c可知,Pichia与酸味显著负相关(P<0.05),与鲜味显著正相关(P<0.05),与苦味、咸味非常显著正相关(P<0.01)。Aspergillus与酸味显著正相关(P<0.05),与后味A非常显著正相关(P<0.01)。Leiothecium与后味B显著正相关(P<0.05)。Millerozyma与涩味、酸味、后味B非常显著正相关(P<0.01),与鲜味非常显著负相关(P<0.01)。由此可见,一种微生物可以影响多种指标,而同一个指标也可能受不同微生物的影响,他们之间存在着复杂的构效关系[28]。
3 结论
白色和黑色高温大曲微生物菌群、风味和滋味存在明显差异,其中白色高温大曲的生物标志物是Pichia,其烷烃类物质、鲜味、丰度和咸味显著偏高,黑色高温大曲的生物标志物为Monascus,其酸味显著偏高。研究发现优势真菌属对高温大曲滋味品质的形成具有显著影响,其中Pichia与酸味、鲜味、苦味和咸味的形成相关,Aspergillus与酸味和涩的回味的形成相关,Leiothecium与苦的回味的形成相关,Millerozyma与涩味、酸味、后味B和鲜味的形成相关。本研究为进一步了解不同类型高温大曲微生物和品质的差异提供了数据支撑。
[1] ZHANG Y D, DING F, SHEN Y, et al.Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J].World Journal of Microbiology &Biotechnology, 2022, 38(8):137.
[2] YANG F, LIU Y F, CHEN L Q, et al.Genome sequencing and flavor compound biosynthesis pathway analyses of Bacillus licheniformis isolated from Chinese Maotai-flavor liquor-brewing microbiome[J].Food Biotechnology, 2020, 34(3):193-211.
[3] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2020, 9(2):1003-1016.
[4] 张芮, 刘文虎, 张立强, 等.基于宏基因组学解析高温大曲微生物群落与功能的异质性[J].酿酒科技, 2023(5):70-77.ZHANG R, LIU W H, ZHANG L Q, et al.Analysis of microbial community and functional heterogeneity of high-temperature Daqu based on metagenomics[J].Liquor-Making Science &Technology, 2023(5):70-77.
[5] 王颖, 邱勇, 王隆, 等.不同产区酱香型高温大曲黑、白、黄曲的理化、挥发性成分差异性分析[J].中国调味品, 2022, 47(6):155-159.WANG Y, QIU Y, WANG L, et al.Analysis on the differences of physicochemical indexes and volatile components of black, white and yellow koji at high temperature with Maotai flavor in different production areas[J].China Condiment, 2022, 47(6):155-159.
[6] 吴成, 程平言, 谢丹, 等.酱香型白酒高温大曲发酵过程中真菌多样性研究[J].食品与生物技术学报, 2023, 42(6):95-103.WU C, CHENG P Y, XIE D, et al.Investigation on fungal diversity during high-temperature daqu fermentation of sauce-flavor Baijiu[J].Journal of Food Science and Biotechnology, 2023, 42(6):95-103.
[7] 孙羊羊, 尹亚格, 吴雨甍, 等.基于高通量测序技术分析天津高温大曲微生物菌群多样性[J].中国酿造, 2023, 42(5):28-34.SUN Y Y, YIN Y G, WU Y M, et al.Analysis of microbial community diversity of Tianjin high-temperature Daqu based on high-throughput sequencing technology[J].China Brewing, 2023, 42(5):28-34.
[8] TAN J Z, XU J.Applications of electronic nose (e-nose) and electronic tongue (e-tongue) in food quality-related properties determination:A review[J].Artificial Intelligence in Agriculture, 2020, 4:104-115.
[9] 王玉荣, 侯强川, 田龙新, 等.酱香白酒第四轮次窖池不同分层酒醅微生物群落与理化性质差异分析[J].现代食品科技, 2023, 39(2):180-187.WANG Y R, HOU Q C, TIAN L X, et al.Differences in microbial community and physicochemical properties of different layers of fermentative material in the pit of the fourth round of Jiangxiang Baijiu[J].Modern Food Science and Technology, 2023, 39(2):180-187.[10] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions, and flavor in different types of low-temperature Daqu[J].Food Research International, 2021, 150:110734.
[11] MIYAKE H, ISHITSUKA S, TANIGUCHI T, et al.Communities of arbuscular mycorrhizal fungi in forest ecosystems in Japan’s temperate region may be primarily constituted by limited fungal taxa[J].Mycorrhiza, 2020, 30(2-3):257-268.
[12] NILSSON R H, LARSSON K H, TAYLOR A F S, et al.The UNITE database for molecular identification of fungi:Handling dark taxa and parallel taxonomic classifications[J].Nucleic Acids Research, 2019, 47(D1):D259-D264.
[13] CAI W C, TANG F X, GUO Z, et al.Effects of pretreatment methods and leaching methods on jujube wine quality detected by electronic senses and HS-SPME-GC-MS[J].Food Chemistry, 2020, 330:127330.
[14] WANG Y R, XIANG F S, ZHANG Z D, et al.High-throughput sequencing-based analysis of fungal diversity and taste quality evaluation of Douchi, a traditional fermented food[J].Food Science &Nutrition, 2020, 8(12):6612-6620.
[15] LIU Y B, LI X, LI H D, et al.Taorong-type Baijiu starter:Analysis of fungal community and metabolic characteristics of middle-temperature Daqu and high-temperature Daqu[J].PLoS One, 2022, 17(10):e0274881.
[16] 丁芳, 张原頔, 蒋英丽, 等.不同等级高温大曲微生物群落和代谢物的特征分析[J].中国酿造, 2022, 41(11):24-30.DING F, ZHANG Y D, JIANG Y L, et al.Microbial communities and metabolites characteristics of high temperature Daqu with different grades[J].China Brewing, 2022, 41(11):24-30.
[17] 杨旭, 马歌丽, 王光路, 等.高通量测序解析白酒中高温大曲细菌和真菌群落结构[J].中国酿造, 2020, 39(6):119-123.YANG X, MA G L, WANG G L, et al.Analysis of bacterial and fungal community structure in medium-high temperature Daqu of Baijiu by high-throughput sequencing[J].China Brewing, 2020, 39(6):119-123.
[18] FAN G S, CHENG L J, FU Z L, et al.Screening of yeasts isolated from Baijiu environments for 2-phenylethanol production and optimization of production conditions[J].3 Biotech, 2020, 10(6):275.
[19] 韩英, 李惠源, 贾丽艳, 等.库德毕赤酵母FJZ固态发酵产乙酸乙酯工艺的优化[J].酿酒科技, 2021(9):131-135;140.HAN Y, LI H Y, JIA L Y, et al.Optimization of ethyl acetate production process of Pichia kudriavzevii FJZ by solid-state fermation[J].Liquor-Making Science &Technology, 2021(9):131-135;140.
[20] 余硕文, 佘荣书, 韩兴林, 等.君丰大曲酱香白酒出池酒醅特性与各轮次基酒风味相关性分析[J].中国酿造, 2022, 41(7):64-70.YU S W, SHE R S, HAN X L, et al.Correlation analysis between the characteristics of unloading pit fermented grains of Junfeng Daqu sauce-flavor Baijiu and the flavor of each round base liquor[J].China Brewing, 2022, 41(7):64-70.
[21] JIANG Q E, WU X Y, XU Y Q, et al.Microbial composition and dynamic succession during the Daqu production process of Northern Jiang-flavored liquor in China[J].3 Biotech, 2021, 11(5):224.
[22] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[23] 周天慈, 何宏魁, 周庆伍, 等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业, 2021, 47(16):66-71.ZHOU T C, HE H K, ZHOU Q W, et al.Exploring the source of microbiota in medium-high temperature Daqu based on high-throughput amplicon sequencing[J].Food and Fermentation Industries, 2021, 47(16):66-71.
[24] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[25] 于雪, 张威, 吴玉洁, 等.微生物产色素机制及其生物活性[J].微生物学报, 2022, 62(4):1231-1246.YU X, ZHANG W, WU Y J, et al.Production mechanism and biological activity of microbial pigments[J].Acta Microbiologica Sinica, 2022, 62(4):1231-1246.
[26] 孙利林, 李立郎, 胡萍, 等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技, 2020, 36(8):299-306;193.SUN L L, LI L L, HU P, et al.Analysis of microbial community structure and flavor composition of Maotai-flavor Daqu[J].Modern Food Science and Technology, 2020, 36(8):299-306;193.
[27] 陈丽兰, 陈祖明, 袁灿.气相色谱-离子迁移谱结合化学计量法分析不同炒制时间对郫县豆瓣酱挥发性化合物的影响[J].食品科学, 2023, 44(14):283-290.CHEN L L, CHEN Z M, YUAN C.Effect of cooking time on volatile compounds of Pixian bean paste determined by gas chromatography-ion mobility spectrometry combined with chemometrics[J].Food Science, 2023, 44(14):283-290.
[28] 吴成, 程平言, 谢丹, 等.酱香型白酒4轮次堆积发酵理化因子、风味物质与微生物群落相关性分析[J].食品科学, 2023, 44(2):240-247.WU C, CHENG P Y, XIE D, et al.Correlation analysis among physicochemical parameters, flavor compounds and microbial community during fourth round of heap fermentation of Jiang-flavor Baijiu[J].Food Science, 2023, 44(2):240-247.