我国食醋生产历史悠久,作为微生物发酵制成的一种酸性调味品,食醋具有独特的风味和香气,含有多种生物活性物质,被广泛应用于佐餐、调味、酱腌菜和食品保鲜等[1-2]。四川保宁麸醋、山西陈醋、镇江香醋、永春老醋为我国名醋代表[3],其口感、风味因其工艺、原料、气候等不同而各具特色[4]。四川麸醋主要采用传统酿造工艺,以添加药曲作为糖化发酵剂[5],能提供丰富的菌系和酶系,为液化、糖化、酒化、酸化、发酵生香提供动力,同时丰富食醋功能成分[6]。其中,酵母菌作为四川麸醋发酵过程中的功能微生物之一,是酒精发酵阶段必不可少的微生物,除了生成乙醇之外,可代谢生成醛、酸、酯、酚、酮等骨架香气成分[7-8],这些物质对食醋的风味品质起着关键作用。产酯酵母又称生香酵母,是一类能够代谢生成酯类物质的酵母菌总称,现泛指生长代谢过程中能产生香气物质的酵母。目前国内外报道高产酯酵母包括汉逊酵母属(Hansenula)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、威克汉姆酵母属(Wickerhamomyces)等[9-10],该类酵母在生长代谢过程中产生乙醇、乙酸等物质,并在分泌的酯化酶作用下利用环境中乙醇、乙酸及其衍生物合成以乙酸乙酯为主的香味物质[11-12],同时还产生醛、酮、酸等,丰富食醋的风味,直接或间接影响食醋的品质[13-14]。FAN等[15]表示乙酸乙酯可用于判断发酵产品的风格和质量,通过提高和控制乙酸乙酯水平,对发酵产品稳定性具有重要意义,并从大曲中分离得到一株高产乙酸乙酯酵母菌株Y3604,通过产酯条件优化后,其酯产量高达16.92 g/L,该菌株具有显著提高乙酸乙酯含量和增强产品香气特性的潜力。陈嘉等[16]从传统发酵工艺的酒醅中分离筛选到3株产酯酵母菌,利用毕赤酵母Y14与大曲混合发酵,酿制的山西老陈醋中的总酯含量比对照组提高40.5%,乙酸乙酯含量提高1.3倍,添加Y14的成品醋中酯类物质更为丰富,香味更浓郁。近年来,对四川麸醋微生物研究偏向于优势产酸细菌的筛选及微生物菌群结构的解析,而对醋源优势生香酵母菌的研究相对较少。因此,从醋醅和醋曲中筛选生香酵母菌及特性研究对四川麸醋品质和产量提升具有重要意义。
本研究为有效改善食醋风味品质问题,自醋醅、醋曲中分离筛选高产酯(生香)酵母菌,通过嗅闻法、皂化法测定菌株生香能力,利用顶空固相微萃取气质联用(headspace solid phase microextraction-gas chromatograph-mass spectrometry, HS-SPME-GC-MS)法分析菌株产挥发性风味物质情况,综合分析并选取目标菌株,进一步研究目标菌株的生长及产香特性,为生香酵母应用于食醋发酵提供理论依据。
1 材料与方法
1.1 材料与主要试剂
1.1.1 试验材料
醋醅、醋曲样品共20份,由四川保宁醋有限公司提供。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基,马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基,酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基为合成培养基,海博生物技术有限公司,溶解于蒸馏水,121 ℃灭菌20 min。
豆芽发酵培养基:新鲜豆芽10 g,加入蒸馏水80 mL,煮制30 min,过滤后加入葡萄糖5 g,补充蒸馏水至100 mL,115 ℃灭菌20 min。
高粱发酵培养基:高粱粉碎后加入5倍质量的蒸馏水进行浸泡,于80 ℃下蒸煮1 h,添加质量分数2%液化酶(20 000 U/g)、0.4%糖化酶(100 000 U/g)在60 ℃环境中处理3 h,过滤后分装,121 ℃灭菌20 min。
1.1.3 试剂
理化指标测定用试剂:无水葡萄糖、乙醇、NaOH、盐酸、浓硫酸、酚酞等均为国产分析纯,成都浩搏优科技有限公司;乙酸乙酯标准品、庚酸甲酯标准品,美国Sigma-Aldrich公司。
DNA提取及PCR扩增用试剂:DL-2000 DNA Marker、琼脂糖等,天根生化科技有限公司;真菌直扩试剂盒,擎科梓熙生物技术有限公司。
1.1.4 仪器与设备
DHG-9162电热恒温培养箱,上海一恒科技有限公司;1300 Series A2生物安全柜,美国Thermo Fisher Scientific公司;NLCD-307B光学显微镜,宁波永新光学股份有限公司;C1000 Thermal Cycler PCR仪、DYY-6D电泳仪、Gel Doc XR+凝胶成像系统、美国Bio-Rad公司;UV1800PC紫外可见光分光光度计,上海美谱达仪器有限公司;DVB/CAR/PDMS三极萃取纤维头,美国Supelco公司;安捷伦7890A-5975C气相-质谱联用仪,俊齐仪器设备(上海)有限公司。
1.2 实验方法
1.2.1 醋醅中生香酵母菌筛选及鉴定
1.2.1.1 酵母菌分离纯化
称取10 g醋醅或醋曲样品加入装有90 mL无菌生理盐水的三角瓶中,28 ℃恒温振荡培养30 min,以10倍梯度依次稀释制得10-2~10-7稀释液,分别吸取不同梯度样品稀释液100 μL涂布于PDA培养基上,28 ℃培养24~36 h左右。挑取典型酵母菌菌落接入PDB培养基中,重复进行3~4次划线分离、纯化,得到酵母菌纯培养物,并进行斜面保藏及甘油保藏。
1.2.1.2 高产酯酵母菌筛选
(1)生香酵母菌初筛
采用嗅闻法[7]初步判断是否产生酯香味,并淘汰不产香及产香能力弱的菌株,以基础豆芽发酵培养基为溶剂,分别配制0 μg/L(无香)、5 μg/L(微香)、50 μg/L(较香)、100 μg/L(香气浓郁)的乙酸乙酯溶液作为阳性参照。结果以“-”(无香)、“+”(微香)、“++”(较香)及“+++”(香气浓郁)表示,每株菌做3个平行。
(2)生香酵母菌复筛
在初筛结果的基础上,选取嗅闻结果为“++”(较香)和“+++”(香气浓郁)的酵母菌为复筛菌株,于PDB中活化后,使用无菌生理盐水调整菌体密度为108 CFU/mL,以3%接种量(体积分数,下同)接种于豆芽发酵培养基,28 ℃培养72 h后采用皂化法测定发酵液总酯含量,每株菌做3个平行。总酯测定方法:参照GB/T 19777—2013《地理标志产品山西老陈醋》规定的方法,并在周三九[17]的方法上进行调整。
以高粱发酵培养基对高产酯菌株进行发酵能力测定,以3%的接种量接入装有150 mL 20 °Brix高粱培养基的三角瓶中,28 ℃发酵5 d,每天称质量至发酵结束,测定发酵液CO2失重量及酒精度。酒精度测定方法:参照GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》。
1.2.1.3 HS-SPME-GC-MS分析生香酵母菌产挥发性风味物质
采用HS-SPME-GC-MS方法对豆芽汁发酵液的挥发性风味物质进行测定,方法条件参照WU等[18]的方法稍作改动。
(1)挥发性风味物质的萃取
吸取4 mL发酵液装入15 mL气相瓶,同时加入1 g NaCl,43 ℃预热30 min后,将萃取头插入顶空瓶,43 ℃萃取30 min。
(2)GC-MS测定
GC条件:HP-5MS毛细管柱(30 m×250 μm×0.25 μm);进样口以氦气作为载气,以1 mL/min的流速在不分流模式下运行;辅助加热器温度280 ℃;柱初温35 ℃,保持3 min,以6 ℃/min升温至160 ℃,以10 ℃/min升温至250 ℃;进样口温度230 ℃。
MS条件:质谱仪在50~550 u的扫描范围内以70 eV、四极杆在150 ℃下以电子电离模式运行。
综合嗅闻法及测定菌株的产酯能力和挥发性香味物质产生情况,筛选出香气浓郁,酯香柔和的菌株。
1.2.1.4 菌种鉴定
形态学及生理生化鉴定参照《酵母菌的特征与鉴定手册》[19]。
分子鉴定参照李泽洋等[20]的方法,对菌株IST区进行PCR扩增。通过琼脂糖凝胶电泳检测PCR产物浓度符合测序要求后,将得到的PCR产物送至擎科生物技术有限公司测序。将序列与NCBI中已有的ITS序列进行相似性比较分析,选取与供试菌株相似度高的序列,运用MEGA 6.0构建系统发育树[21],直观反映菌株间的亲缘关系。
1.2.2 生香酵母的生长及产酯特性研究
1.2.2.1 酵母菌生长特性
(1)酵母菌生长曲线测定
以3%的接种量将活化后的生香酵母接入若干支含5 mL YEPD培养基的试管中,28 ℃培养,间隔2 h测定菌悬液OD600值,测定生长曲线,OD600值最大为最难培养条件。
(2)温度对酵母菌生长的影响
在(1)最佳的培养条件下,按3%的接种量将活化后的生香酵母接入若干支含5 mL YEPD液体培养基的试管中,将其置于不同温度梯度培养:温度梯度设置为10、20、24、28、32、36、40、45 ℃,测定菌悬液OD600值,OD600值最大为最难培养条件。
(3)pH值对酵母菌生长的影响
在(1)(2)最佳的培养条件下,按3%的接种量将活化后的生香酵母分别接入若干支含5 mL不同pH值的YEPD液体培养基的试管中,培养基pH值梯度设置为3、3.5、4、4.5、5、5.5、6,28 ℃恒温培养24 h,测定菌悬液OD600值,OD600值最大为最难培养条件。
(4)乙醇含量对酵母菌生长的影响
在(1)(2)(3)最佳的培养条件下,按3%的接种量将活化后的生香酵母分别接入若干支含5 mL不同乙醇含量的YEPD液体培养基的试管中,培养基乙醇含量梯度设置为0%、3%、6%、9%、12%,28 ℃恒温培养24 h,测定菌悬液OD600值,OD600值最大为最难培养条件。
1.2.2.2 酵母菌产酯特性
(1)发酵时间对产酯的影响
将活化后的菌液以3.0%接种量接入豆芽发酵培养基中,28 ℃静止培养,每隔24 h取样,测定发酵液总酯含量,总酯含量最高为最佳发酵条件。
(2)培养温度对产酯的影响
在(1)最佳的发酵条件下,将活化后的菌液以3.0%接种量接入豆芽发酵培养基中,基于生长特性研究,分别在10、20、28、36、40、45 ℃条件下发酵,测定发酵液总酯含量,总酯含量最高为最佳发酵条件。
(3)接种量对产酯的影响
在(1)(2)最佳的发酵条件下,将活化后的菌液分别以接种量为1%、3%、6%、9%、12%接入豆芽发酵培养基中,发酵结束后测定发酵液总酯含量,总酯含量最高为最佳发酵条件。
(4)乙醇添加量对产酯的影响
在(1)(2)(3)最佳的发酵条件下,将活化后的菌液以3.0%接种量分别接种于含有0、1%、3%、6%、9%无水乙醇的豆芽发酵培养基中,发酵结束后测定发酵液总酯含量,总酯含量最高为最佳发酵条件。
(5)乙酸添加量对产酯的影响
在(1)(2)(3)(4)最佳的发酵条件下,将活化后的菌液以3.0%接种量分别接种于含有0、0.1%、0.3%、0.5%、0.7%(体积分数,下同)乙酸的豆芽发酵培养基中,发酵结束后测定发酵液总酯含量,总酯含量最高为最佳发酵条件。
1.3 数据分析处理方法
数据通过Excel 2019进行计算,使用Origin 2019绘图,通过SPSS对部分数据进行显著性分析,通过MEGA 6.0构建功能菌株的系统发育树。
2 结果与分析
2.1 酵母菌的分离纯化
自醋醅和醋曲共20份样品中分离得到101株酵母菌,大多数酵母菌菌落形态呈圆形,颜色为白色或乳白色,边缘整齐,表面光滑且湿润,有光泽;对分离得到酵母菌株进行斜面保藏和产香能力筛选。
2.2 生香酵母菌产酯能力及发酵能力筛选
2.2.1 生香酵母菌产香初筛
为得到高产酯酵母,通过嗅闻法初筛,共得到36株具有产香较明显的酵母菌(闻香结果为“++”“+++”)如表1所示,其香气易被捕捉感知,淘汰不产香或产香弱(闻香结果为“+”“-”)的菌株,并通过甘油和斜面保存菌种,用于下一步复筛试验。
表1 基于嗅闻法的筛选结果
Table 1 Screening results based on sniffing method

菌株号结果菌株号结果菌株号结果菌株号结果D1-Y2++D5-Y41+++D9-Y50+++D13-Y6++D1-Y6++D5-Y44++D9-Y52++D13-Y7++D1-Y11++D5-Y53++D9-Y91++D13-Y9++D1-Y13+++D5-Y54+++D9-Y92+++D13-Y10++D1-Y15++D5-Y55++D9-Y93++D13-Y11++D1-Y43+++D5-Y61++D13-Y1++D13-Y15+++D1-Y61+++D5-Y62①++D13-Y2+++D17-Y3++D1-Y62+++D5-Y62②++D13-Y3①+++D30-Y3+++D3-Y53++D5-Y63++D13-Y4++D30-Y4+++
注:“+++”代表香味浓郁、“++”代表较香,嗅闻结果为微香“+”、无香“-”的菌株未展示。
2.2.2 生香酵母菌产酯及发酵能力复筛
对通过嗅闻法初筛得到的36株产香明显的酵母菌分别接种于豆芽发酵培养基中,利用皂化法测定发酵液总酯含量,得到菌株具体产酯能力,测定结果如图1-a所示。其中,D13-Y2、D13-Y15等菌株产酯能力突出,D13-Y2总酯产量为(3.50±0.07) g/L,显著高于其他菌株(P<0.01),同时也高出唐红梅等[22]、刘建学等[23]筛选得到的高产酯酵母产酯量,而总酯是生香酵母在生长代谢中产生酯类物质的总量,是判断生香酵母产香能力的重要指标[24]。
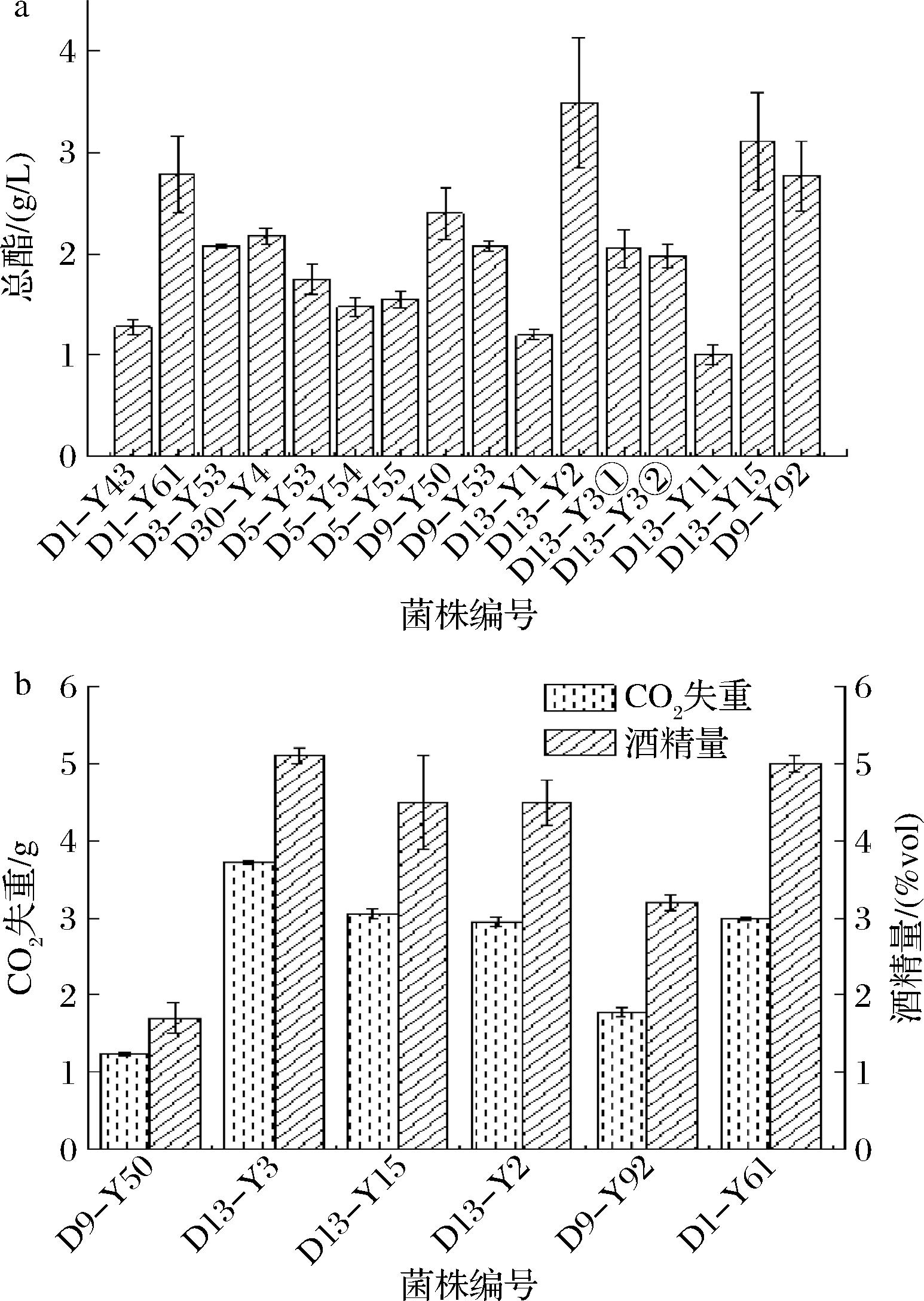
a-产总酯能力复筛结果;b-产酒能力复筛结果
图1 生香酵母菌产总酯及发酵能力
Fig.1 Total ester production and fermentation ability of aroma-producing yeast
酵母菌作为酒精发酵阶段主要作用菌株,能够利用环境中还原糖产生酒精,而酒精是醋酸发酵阶段有机酸产生的前体物质之一,因此,酵母菌产酒能力也十分重要。对菌株D1-Y61、D9-Y50、D9-Y92、D13-Y2、D13-Y3、D13-Y15的产酒能力筛选,结果如图1-b所示。菌株CO2失重量与产酒精量呈正相关,CO2失重量越大,产酒能力越强,反之越弱;其中,菌株D13-Y3、D1-Y61产酒能力相对较强,产酒量分别为(5.1±0.1)%vol、(5.0±0.0)%vol,D13-Y15、D13-Y2次之,产酒量均在(4.5±0.30)%vol左右。
2.2.3 HS-SPME-GC-MS分析生香酵母产挥发性物质结果
为得到一株产酯能力强,产香气浓郁、柔和的生香酵母菌,采用HS-SPME-GC-MS法进一步测定菌株D1-Y61、D9-Y50、D9-Y92、D13-Y2、D13-Y3、D13-Y15产挥发性香气成分。由图2可知,酵母菌株在发酵液中可产生丰富的挥发性香气物质,不同菌株产生种类各不相同,其中菌株D13-Y2产挥发性风味物质能力相对突出,在发酵液可产生最多为59种物质,包括醇类、醛类、酸类、酯类、酮类等,其中酯类物质占22种,在6株菌中产酯物质种类数量最多,同时产醇类物质9种、酸类物质4种、酮类2种、醛类1种、酚类1种,其他物质20种。由表2可知,不同酵母菌株发酵液中产挥发性风味物质含量情况不同,但酯类物质均占比重最大,其中,D1-Y61发酵液中酯类物质占比为88.02%,D13-Y15发酵液中酯类物质占比为76.80%,其次为D13-Y2,占比为57.97%,食醋中的香气物质是反映不同食醋特征的重要成分之一,对醋的品质起着重要作用[25]。
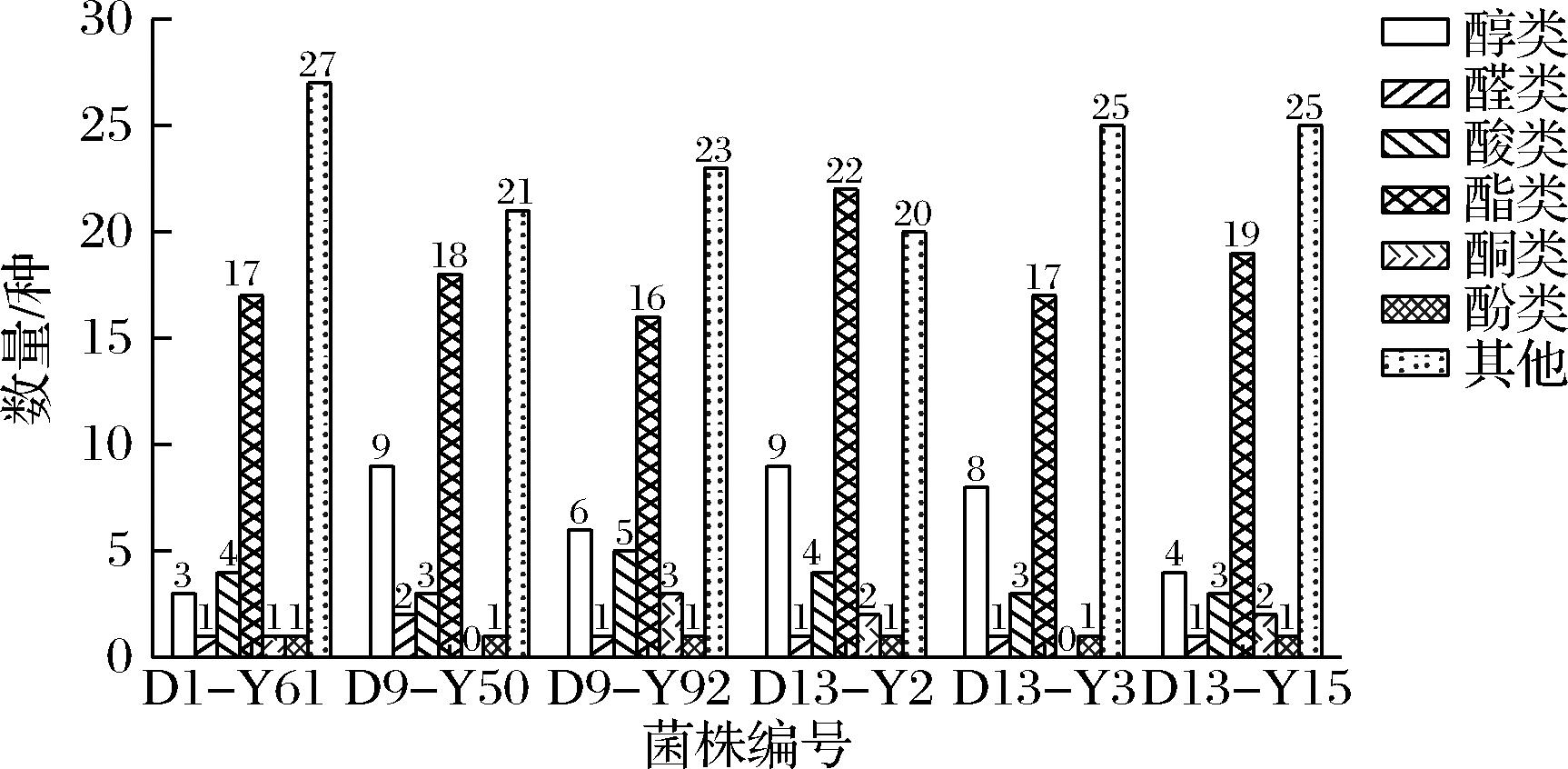
图2 酵母产挥发性香气物质种类分布情况
Fig.2 Distribution of volatile compounds produced by aroma-producing yeasts
注:图中柱形图上方数字代表物质种类数量。
表2 酵母产挥发性香气物质相对含量分布情况 单位:%
Table 2 Relative content distribution of volatile aroma compounds produced by yeast
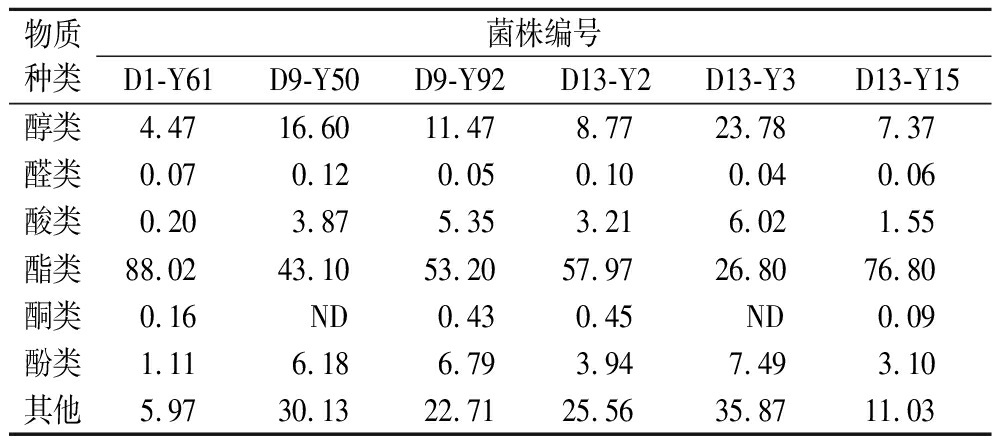
物质种类菌株编号D1-Y61D9-Y50D9-Y92D13-Y2D13-Y3D13-Y15醇类4.4716.6011.478.7723.787.37醛类0.070.120.050.100.040.06酸类0.203.875.353.216.021.55酯类88.0243.1053.2057.9726.8076.80酮类0.16 ND0.430.45 ND0.09酚类1.116.186.793.947.493.10其他5.9730.1322.7125.5635.8711.03
注:ND表示未检测出。
综合菌株产酯能力和产挥发性香气物质,筛选出一株产酯能力强、香味柔和的生香酵母菌,根据以上筛选结果,最终选择D13-Y2作为目的菌株并进行后续试验。
2.2.4 菌种鉴定
2.2.4.1 形态鉴定
酵母菌D13-Y2在PDA固体培养基上的菌落形态如图3-a所示。菌落呈圆形,边缘规整,表面光滑而湿润,质地柔软而黏稠,易挑起,不透明,有光泽,颜色为白色。D13-Y2在显微镜(10×100)下的菌体形态特征如图3-b所示,细胞呈卵圆形,多边出芽。
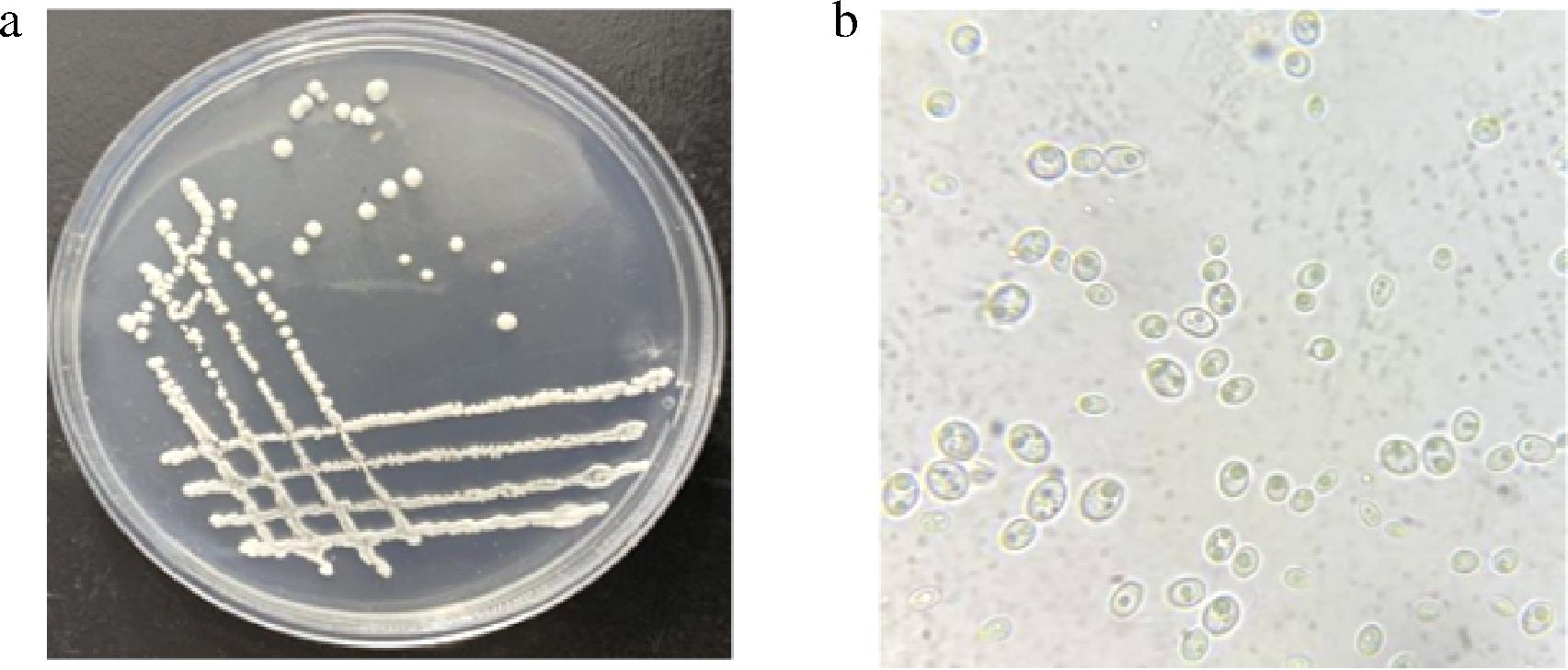
a-菌落形态图;b-细胞形态图(10×100)
图3 菌株D13-Y2菌落形态与细胞形态
Fig.3 Colony morphology and cell morphology of strain D13-Y2
2.2.4.2 生理生化鉴定
对酵母菌D13-Y2进行生理生化鉴定,结果显示,D13-Y2能利用葡萄糖、蔗糖、麦芽糖、纤维二糖进行发酵,均能同化利用纤维二糖、山梨糖、柠檬酸、乳糖等多种碳源和硝酸钠、硫酸铵两种氮源,不产类淀粉,不具有脲酶活性。
2.2.4.3 分子鉴定
对菌株D13-Y2的ITS区进行扩增,菌株的扩增条带清晰,长度在600 bp左右,符合目的基因的长度。将获得的菌株序列在NCBI上进行BLAST同源性比对,同时将菌株序列导入MEGA6.0构建系统发育树(图4)。结果显示与Wickerhamomyces anomalus(异常威克汉姆酵母)聚于一个分支,结合形态学及生理生化鉴定结果,将菌株D13-Y2鉴定为异常威克汉姆酵母。
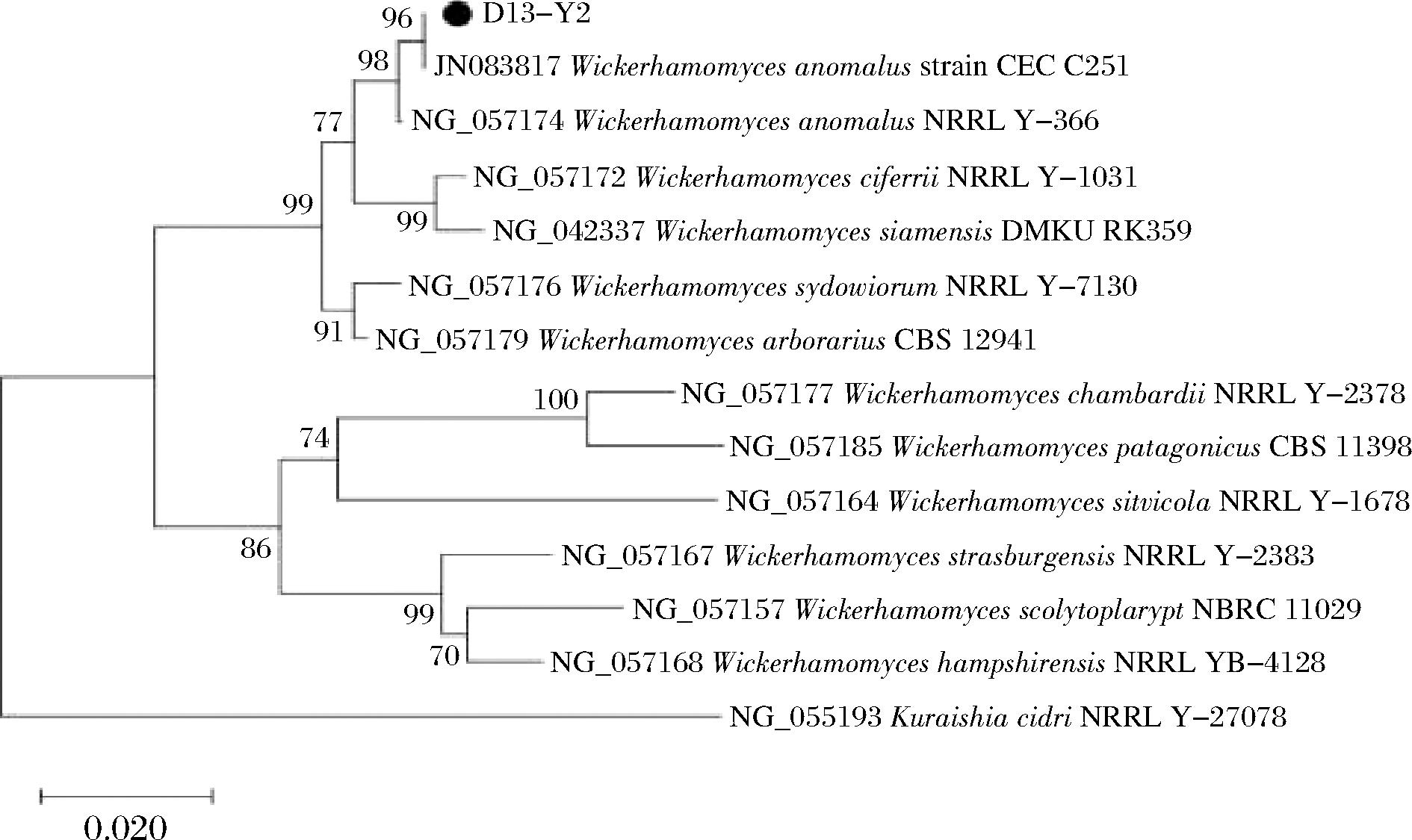
图4 菌株D13-Y2系统发育树
Fig.4 Phylogenetic tree of strain D13-Y2
2.3 生香酵母的生长特性
菌株D13-Y2生长曲线如图5-a所示。培养0~8 h期间,OD600值增长较缓慢,表明菌株生长处于延滞期;培养8~18 h期间,OD600值指数级增长,表明菌株处于对数生长期;在培养18~36 h,OD600值趋于稳定,表明菌株进入稳定期,随后,酵母菌逐渐进入衰亡期。符合一般酵母的生长趋势[22-23]。
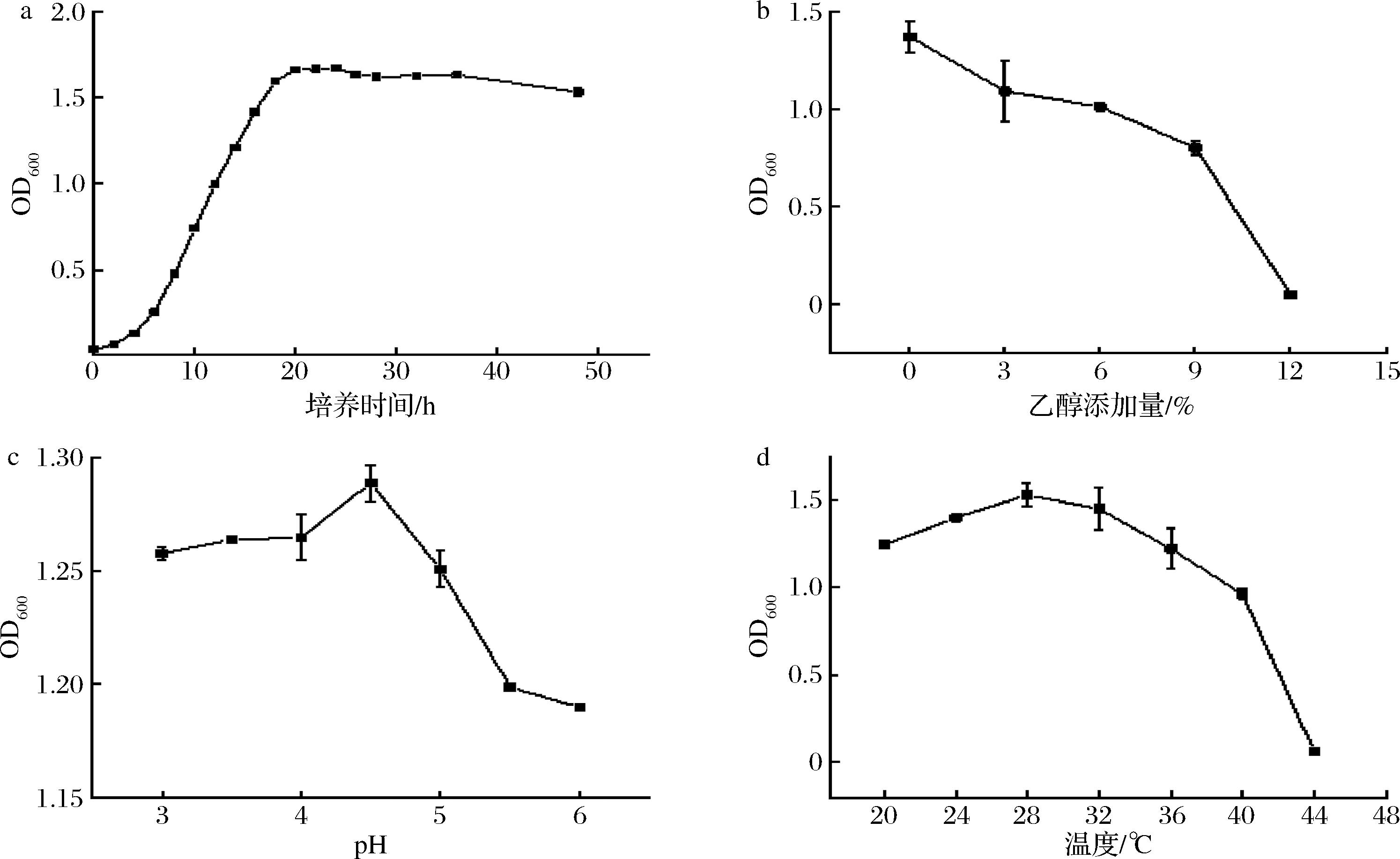
a-培养时间;b-乙醇添加量;c-pH值;d-培养温度
图5 菌株D13-Y2的生长特性
Fig.5 Growth characteristics of strain D13-Y2
食醋发酵过程中会存在一定浓度乙醇,不断累积的乙醇亦会对酵母菌的生长产生抑制作用。菌株的乙醇耐受性检测结果如图5-b所示。在培养基中添加低于9%的乙醇时,同时酵母菌株本身在生长过程中具有一定产酒能力(菌株D13-Y2产酒能力为4.5%vol),被测酵母菌株表现为较好的生长趋势,说明被测酵母菌具有较好的酒精耐受能力,乙醇添加量>12%时,酵母菌生长受到明显抑制作用。
在醋醅发酵过程中,乳酸菌和醋酸菌等代谢会产生一定的乳酸和醋酸,导致发酵体系的pH值降低。因此具有良好的酸耐受性也是优良酵母菌株应具备的生物学性质之一。菌株在pH值为3~6时仍然生长良好,其中pH=4.5是菌株最适生长pH(图5-c)。
除了以上3个条件外,温度也是影响微生物生长代谢的重要因素之一,过高的温度会影响微生物中酶的活性,从而减少代谢产物的生成。如图5-d所示,当温度逐渐升高时,菌株的活性呈现上升趋势,随着温度持续上升,菌株的生长受到了明显的抑制;温度≤40 ℃时,D13-Y2尚具有较好的生存活力,表明菌株对高温具有较好的耐受性。
2.4 生香酵母的产酯特性
2.4.1 不同发酵条件对菌株D13-Y2产酯的影响
由图6-a可知,发酵液中酵母活菌数在培养1 d后达到最大,为(7.56±0.01) lg CFU/mL,随培养时间延长生物量趋于稳定并缓慢较少。总酯产量随培养时间呈先增加后下降的趋势,在培养时间为1.5 d时总酯产量迅速累积,并在培养第4天达到峰值,含量为(3.59±0.14) g/L,与王鹏昊等[26]、徐丽萍[27]研究结果相似;培养第8天,总酯产量下降为(2.73±0.06) g/L,分析原因可能是随着时间延长酵母代谢产生的酯类物质挥发或者被分解[28]。

a-发酵时间;b-培养温度;c-接种量;d-乙醇添加量;e-乙酸添加量
图6 不同发酵条件对菌株D13-Y2产酯的影响
Fig.6 Effects of different fermentation conditions on ester production by strain D13-Y2
培养温度对酵母菌的生长具显著性影响,由图6-b可知,低温或高温条件下酵母菌生长活性均不高,在20~36 ℃均有良好的生长性能,酵母活菌数最大可达(7.55±0.01) lg CFU/mL。菌株的总酯产量随培养温度升高呈现先升后降的趋势,温度的高低直接影响酵母菌体内的酯化酶活性,进而影响酵母菌产酯能力,且温度的升高也可能会加速酯的水解及挥发;培养温度在20~36 ℃时总酯产量和生物量均处于较高水平,总酯最高产量为(3.66±0.01) g/L,在此范围内随温度的升高,总酯产量略微降低(P>0.05),分析是温度的升高会加速酯的水解及挥发,同时也发现,活菌数与总酯产量呈正相关,说明酵母菌在发酵体系中的生长情况影响酯类物质合成。
接种量过大或者过小,均会影响发酵,过大会引起溶氧不足,影响产物合成,而且会过多移入代谢废物,直接影响生长性能,过小会延长培养时间,降低发酵物的生产率。由图6-c可知,随接种量的增大,酵母活菌数和总酯产量均呈现先增大后减小的趋势,当接种量为3%时,活菌数与总酯产量均达到最大,分别为(7.62±0.01) lg CFU/mL、(3.56±0.03) g/L,当接种量为12%时,活菌数与总酯产量显著减少(P<0.01),总酯产量下降至(2.26±0.08) g/L,因此菌株最适发酵的接种量为3%。
在培养基中加入适量乙醇对酵母产酯有一定的促进作用,但高浓度的乙醇会使酵母细胞产生毒效应,具有一定乙醇耐受性的酵母菌株在发酵过程中具有较高发酵特性[29-30]。由图6-d可知,该菌对乙醇有较好的适应性,无乙醇条件下酵母活菌数为(7.57±0.04) lg CFU/mL,且在0%~9%乙醇含量下均呈现较好的生长性能。随着乙醇添加量的增加,总酯产量呈现先升后降的趋势,与不添加乙醇相比,添加量为1%时总酯产量提高了10.32%(P<0.01),达(3.74±0.01) g/L,当乙醇添加量>1%时,酯产量下降,不利于酯的合成。
游离有机酸是酯类物质合成前体物质,在酯化酶的作用下酸类、醇类合成酯,而乙酸乙酯具有果香味,对醋的风味起着重要作用[20]。如图6-e所示,乙酸添加量为0.3%时生物量为最大,为(7.59±0.01) lg CFU/mL,说明该酸度范围利于酵母菌生长;随着乙酸添加量的增加,生物量与总酯产量呈现先升后降的趋势,乙酸添加量为0.1%时总酯产量最高,其值为(4.03±0.04) g/L,与对照组相比提高13.15%,说明该酸度含量范围内有利于酯类物质合成。而过量的乙酸对产酯酵母生长繁殖和产酯能力均有一定的抑制作用,大量的酸对其酶活力会造成一定影响,当乙酸含量>0.5%,该菌生长能力和产酯能力受到显著抑制作用(P<0.01)。
2.4.6 生物量和总酯与不同发酵因素间相关性分析
如图7所示,生物量与总酯始终保持显著正相关(P<0.05),说明生物量的大小决定了总酯产量,图7-a中,发酵时间与总酯产量、生物量系正相关,说明发酵时间延长(0~4 d)对生物量和总酯的积累具有一定正向作用;由图7-b可知,发酵温度与生物量以及总酯相关性较低,反映出在食醋发酵体系中一定范围内的温度变化(20~36 ℃)对生物量以及总酯产量影响不显著,也说明该菌对温度变化具有较好的适应性,但在一定程度上较高培养温度(温度>36 ℃)不利于菌的生长以及酯类物质积累;图7-c图7-e别表示接种量、乙醇添加量、乙酸添加量均与生物量和总酯产量相关性较高(P<0.05)且呈负相关,因为结接种量过大(>3%)可能会引起溶氧不足,而且会产生过多代谢废物,直接影响生长性能,进而影响生物量和总酯积累,乙醇(>1%)、乙酸(>0.3%)含量过高对菌体具有毒害作用,导致菌株不能正常生长,以致生物量和总酯产量下降。
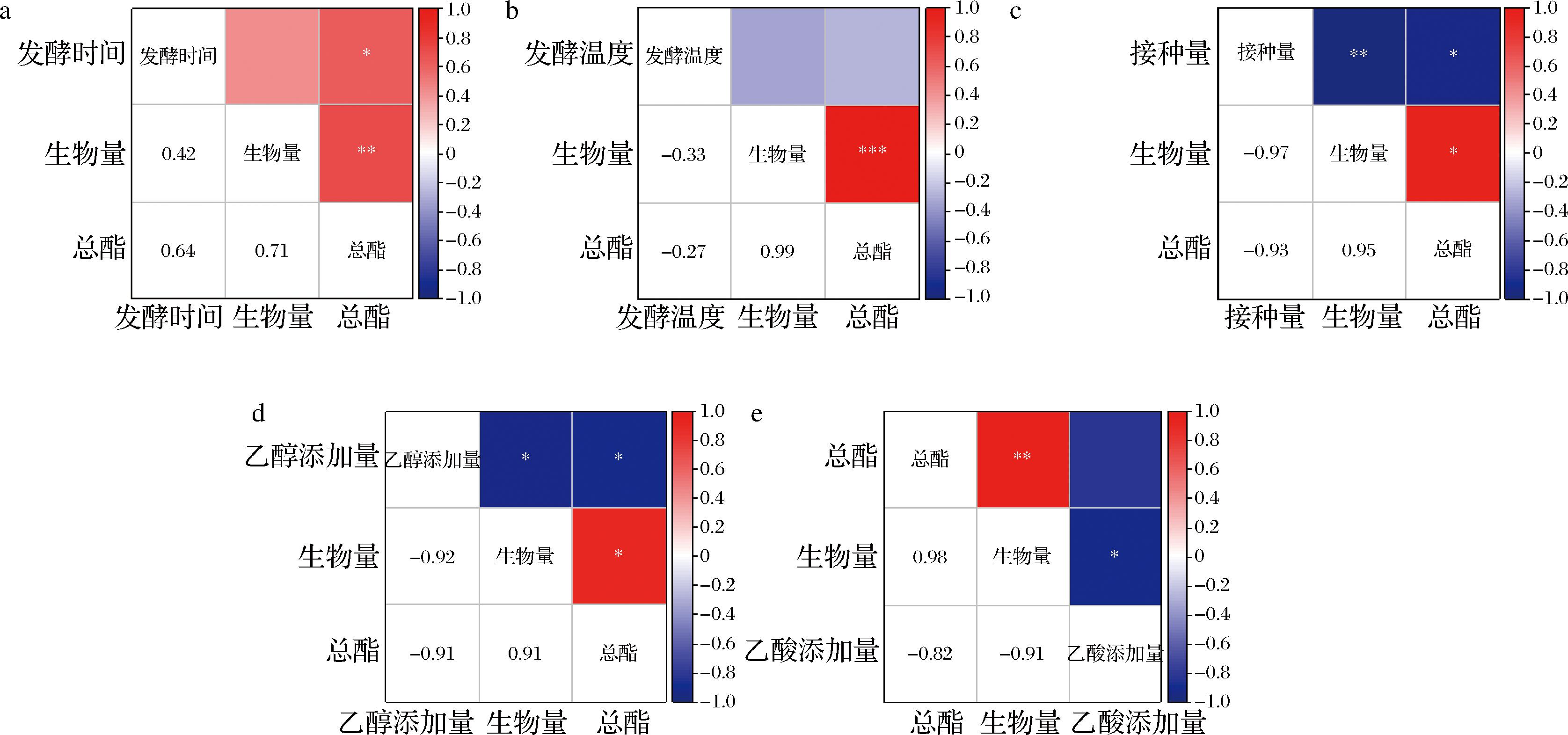
a-生物量、总酯与培养时间;b-生物量、总酯与培养温度;c-生物量、总酯与接种量;d-生物量、总酯与乙醇添加量;e-生物量、总酯与乙酸添加量
图7 生物量和总酯与不同发酵因素之间相关性热图分析
Fig.7 The correlation between biomass, total esters and different fermentation factors based on heat map analysis
注:红色(数值为正)代表呈正相关,颜色越深(数值越大),正相关越强;蓝色(数值为负)代表呈负相关,颜色越深(数值越小),负相关越强。
3 结论
本研究从醋醅和醋曲共20份样品中筛选得到一株高产酯、生香能力强的菌株D13-Y2,在28 ℃培养72 h后采用皂化法测定其总酯产量为(3.50±0.07) g/L,利用HS-SPME-GC-MS分析该菌在发酵液中产挥发性风味物质,发现其可产59种挥发性风味物质,酯类22种、醇类9种、酸类4种、酮类2种、醛类1种、酚类1种及其他物质20种。经形态学观察、生理生化及分子生物学鉴定,确定菌株D13-Y2为异常威克汉姆酵母(Wickerhamomyces anomalus)。对该菌株进行生长特性及产酯特性研究,其最适培养条件为:28 ℃、pH 4.5、18 h,对酒精有较好耐受性,可适应食醋发酵条件;最适产酯条件为20 ℃、接种量3%、发酵时间4 d,并探究添加乙醇、乙酸对产酯的影响,发现分别添加1%的乙醇、0.1%的乙酸时总酯产量可分别提高10.32%[总酯产量达(3.74±0.01) g/L]、13.15%[总酯产量达(4.03±0.04) g/L],并通过生物量和总酯与其他发酵因素之间相关性分析发现,生物量与总酯产量始终保持显著正相关,同时发酵时间也与生物量和总酯产量呈正相关,而发酵温度、接种量、乙醇添加量、乙酸添加量与生物量和总酯产量在超过限定值后呈负相关。最后,研究表明,该菌株来自醋源,能够适应食醋发酵环境条件,为改善麸醋风味品质提供了菌种资源和理论依据。
[1] HO C W, LAZIM A M, FAZRY S, et al.Varieties, production, composition and health benefits of vinegars:A review[J].Food Chemistry, 2017, 221:1621-1630.
[2] JONES M, ARNAUD E, GOUWS P, et al.Effects of the addition of vinegar, weight loss and packaging method on the physicochemical properties and microbiological profile of biltong[J].Meat Science, 2019, 156:214-221.
[3] 郑宇, 程程, 刘静, 等.中国传统固态发酵食醋主要特征风味物质组成分析[J].中国食品学报, 2020, 20(8):237-247.ZHENG Y, CHENG C, LIU J, et al.Analysis of main characteristic flavor components in Chinese traditional solid-state fermented vinegars[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):237-247.
[4] 简东振, 周志磊, 巩敏, 等.镇江香醋陈酿过程中温度和氧气对挥发性风味物质的影响[J].食品与发酵工业, 2020, 46(7):75-82.JIAN D Z, ZHOU Z L, GONG M, et al.Study on the effect of temperature and oxygen on volatile flavor compounds of Zhenjiang aromatic vinegar during aging[J].Food and Fermentation Industries, 2020, 46(7):75-82.
[5] 于华, 唐姣, 赵佳丽, 等.四川麸醋发酵过程中醋醅理化指标及有机酸变化分析[J].中国酿造, 2020, 39(7):51-55.YU H, TANG J, ZHAO J L, et al.Analysis of physicochemical indexes and organic acid changes of Cupei during Sichuan bran vinegar fermentation process[J].China Brewing, 2020, 39(7):51-55.
[6] 毛祥, 夏玙, 张芸曌, 等.四川麸醋曲药中酵母菌的分离鉴定及发酵特性[J].食品科学技术学报, 2018, 36(6):21-27.MAO X, XIA Y, ZHANG Y Z, et al.Isolation, identification and fermentation characteristics of yeast from Sichuan bran vinegar starter[J].Journal of Food Science and Technology, 2018, 36(6):21-27.
[7] 彭东, 蒋雪薇, 陈幽, 等.高盐稀态酱醪中耐盐生香酵母的筛选及生香特性研究[J].食品与发酵工业, 2020, 46(13):76-84.PENG D, JIANG X W, CHEN Y, et al.Screening and aroma-producing characteristics of salt-tolerant aroma-producing yeasts from high-salt liquid-state moromi[J].Food and Fermentation Industries, 2020, 46(13):76-84.
[8] STEENSELS J, MEERSMAN E, SNOEK T, et al.Large-scale selection and breeding to generate industrial yeasts with superior aroma production[J].Applied and Environmental Microbiology, 2014, 80(22):6965-6975.
[9] 张杰, 程伟, 彭兵, 等.小曲清香型白酒研究概述[J].酿酒科技, 2017(9):91-95.ZHANG J, CHENG W, PENG B, et al.A review of Xiaoqu Qingxiang Baijiu[J].Liquor-Making Science &Technology, 2017(9):91-95.[10] FU Z L, SUN B G, LI X T, et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotechnology &Biotechnological Equipment, 2018, 32(5):1 218-1 227.
[11] 程伟, 彭兵, 汪焰胜, 等.清香型酒醅中一株产乙酸乙酯酵母菌的筛选及其应用性能分析[J].酿酒, 2018, 45(5):43-47.CHENG W, PENG B, WANG Y S, et al.Screening of one yeast strain with high-yield of ethyl acetate from Fen-flavor liquor fermenting-grains and analysis of its application performance[J].Liquor Making, 2018, 45(5):43-47.
[12] GAO P, JIANG Q X, XU Y S, et al.Esterase activities of autochthonous starter cultures to increase volatile flavour compounds in Chinese traditional fermented fish (Suan Yu)[J].International Journal of Food Properties, 2017, 20(sup1):S663-S672.
[13] ZHANG Y Y, ZHU X Y, LI X Z, et al.The process-related dynamics of microbial community during a simulated fermentation of Chinese strong-flavored liquor[J].BMC Microbiology, 2017, 17(1):196.
[14] XU Y Q, SUN B G, FAN G S, et al.The brewing process and microbial diversity of strong flavour Chinese spirits:A review[J].Journal of the Institute of Brewing, 2017, 123(1):5-12.
[15] FAN G S, SUN B G, XU D, et al.Isolation and identification of high-yield ethyl acetate-producing yeast from Gujinggong Daqu and its fermentation characteristics[J].Journal of the American Society of Brewing Chemists, 2018, 76(2):117-124.
[16] 陈嘉, 邢晓莹, 冯志宏, 等.山西老陈醋酿造过程中产酯酵母的筛选及产香特性分析[J].食品科学, 2019, 40(16):144-151.CHEN J, XING X Y, FENG Z H, et al.Screening and aroma characteristics of ester-producing yeasts as starter cultures for Shanxi aged vinegar[J].Food Science, 2019, 40(16):144-151.
[17] 周三九. 不同皂化法测定白酒总酯结果差异分析[J].现代食品, 2021(16):214-216;225.ZHOU S J.Analysis of the difference in the results of determination of total esters in Chinese Baijiu by different saponification methods[J].Modern Food, 2021(16):214-216;225.
[18] WU R N, YU M L, LIU X Y, et al.Changes in flavour and microbial diversity during natural fermentation of Suan-Cai, a traditional food made in Northeast China[J].International Journal of Food Microbiology, 2015, 211:23-31.
[19] 巴尼特. 酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社, 1991.BARNETT.Handbook of Characteristics and Identification of Yeasts[M].Qingdao:Qingdao Ocean University Press, 1991.
[20] 李泽洋, 伍时华, 龙秀锋, 等.米酒生香酵母的分离筛选鉴定及其性能研究[J].食品与发酵工业, 2021, 47(7):43-50.LI Z Y, WU S H, LONG X F, et al.Isolation, identification and characteristics of aroma-producing yeast for rice wine[J].Food and Fermentation Industries, 2021, 47(7):43-50.
[21] KUMAR S, STECHER G, TAMURA K.MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular Biology and Evolution, 2016, 33(7):1870-1874.
[22] 唐红梅, 王浩文, 吴华昌, 等.川南腌菜耐盐生香酵母的筛选、鉴定及特性[J].食品科学, 2020, 41(12):150-157.TANG H M, WANG H W, WU H C, et al.Screening, identification and characterization of aroma-producing and salt-tolerant yeast strains from pickles from South Sichuan, China[J].Food Science, 2020, 41(12):150-157.
[23] 刘建学, 刘金科, 李璇, 等.白酒酒醅高产酯酵母筛选鉴定及其发酵性能研究[J].食品与机械, 2020, 36(6):42-49.LIU J X, LIU J K, LI X, et al.Screening, identification and fermentation performance of a high-yield yeast from fermented grains of Dukang wine[J].Food &Machinery, 2020, 36(6):42-49.
[24] 张永倩. 影响白酒总酯检测准确度的因素探析[J].现代食品, 2019(7):170-172.ZHANG Y Q.Analysis of factors affecting the accuracy of total ester detection in liquor[J].Modern Food, 2019(7):170-172.
[25] 刘若辰, 李荣, 姜子涛, 等.不同类型食醋的香气特征及挥发性成分分析[J].食品科学, 2022, 43(8):227-237.LIU R C, LI R, JIANG Z T, et al.Analysis of aroma characteristics and volatile components of different types of vinegar[J].Food Science, 2022, 43(8):227-237.
[26] 王鹏昊, 关统伟, 张习超, 等.小曲中优质产酯酵母分离鉴定及其产酯条件优化[J].食品与发酵工业, 2018, 44(2):62-67.WANG P H, GUAN T W, ZHANG X C, et al.Isolation and identification of efficient ester-producing yeast in Xiaoqu and optimization of ester production conditions[J].Food and Fermentation Industries, 2018, 44(2):62-67.
[27] 徐丽萍. 泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造, 2016, 35(2):74-78.XU L P.Screening and identification of ester-producing yeast in Luzhou Daqu and optimization of ester production conditions[J].China Brewing, 2016, 35(2):74-78.
[28] 刘君, 李玲珊, 赵文鹏, 等.中高温大曲产酯酵母代谢产酯性能研究[J].酿酒科技, 2021(12):33-38;46.LIU J, LI L S, ZHAO W P, et al.Ester-producing capacity of ester-producing yeasts from medium/high-temperature Daqu[J].Liquor-Making Science &Technology, 2021(12):33-38;46.
[29] 鲁云风, 刘智兴, 张四普, 等.猕猴桃生香酵母筛选鉴定及其发酵特性[J].河南农业科学, 2021, 50(8):166-173.LU Y F, LIU Z X, ZHANG S P, et al.Screening, identification and fermentation properties of aroma producing yeast for kiwi fruit[J].Journal of Henan Agricultural Sciences, 2021, 50(8):166-173.
[30] 李小龙, 吴群, 徐岩.乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替[J].微生物学通报, 2019, 46(1):1-10.LI X L, WU Q, XU Y.Synergism between ethanol and acidity drives microbial community succession during roasted sesame-flavor liquor solid-state fermentation[J].Microbiology China, 2019, 46(1):1-10.