高粱酒在中国白酒中有着举足轻重的地位,它以独特的风味与深厚的文化底蕴而闻名。中国许多著名的纯粮固态白酒,如酱香型白酒、清香型汾酒甚至小曲酒都是以高端品质的高粱白酒作为基酒,经过漫长的不同工艺的酿造和贮存而成。但由于高粱淀粉糖化率低,导致废弃酒糟中高粱的残余淀粉含量极高,从而造成了原粮利用率低、白酒产量低的情况[1-2]。而金花茶中的冠突散囊菌(Eurotium cristatum)发酵代谢产生淀粉酶,可与酒曲中的霉菌属协同作用促进白酒酿造过程中的糖化效率[3]。使其在酿酒淀粉原料使用量不变的前提下增加酒化底物,从而提高白酒产量。所以在现今国内纯粮酒需求量远大于供应量的背景下,利用天然微生物协同发酵提高纯粮酿造工艺中的粮食糖化效率与出酒率对当今酒业及其经济发展有着重大意义。
提高酿酒过程中糖化效率的方法有酶解法、生物发酵法以及优化糖化工艺等。基于生物发酵角度,发现金花茶中的主要优势菌种E.cristatum[4]生物学特性适宜白酒糖化发酵过程,且在白酒糖化领域的应用还是空白。所以将该E.cristatum作为生物发酵剂应用到白酒发酵的糖化过程中,以期提高糖化效率[5-6]。且白酒发酵的糖化周期长,不适用传统的优化工艺。所以采用了更简洁方便、省时节约的发酵动力学方法,优化计算出E.cristatum的最佳菌液添加量,替代了传统的工艺优化方法[7-9],填补了该方法在白酒发酵领域应用的空白。
酿酒原料的糖化过程其微观角度即为淀粉分子的逐步水解。通过酶促反应,淀粉分子中的糖苷键被淀粉酶断裂,分解成为较小的可发酵性糖[10]。所以淀粉分子会发生支/直链含量、晶体类型、分子量大小以及微观形态等系列变化[11],即可利用淀粉分子的变化验证白酒糖化效率的变化并解释E.cristatum对白酒糖化作用的影响及机制。
此前作者所在科研团队已经在糯米酒以及五粮型白酒中应用了E.cristatum,发现该菌种可以显著提高糯米酒以及五粮酒的糖化能力[12-14]。所以本文以传统高粱烧酒酿造工艺为基础,研究E.cristatum在高粱烧酒酿造过程中对高粱糖化效率的促进作用及机理。应用发酵动力学方程对糖化过程及结果进行计算,找到最佳菌液添加量,更加准确便捷的优化单底物酿酒过程的工艺。再通过对酒醅中残余淀粉的微观性状测定,观测淀粉糖化水解变化程度,并在分子水平上了解其水解机理有无影响。综上,本研究旨在提高高粱白酒的糖化效率,利用发酵动力学优化糖化过程,并检测高粱淀粉分子变化,从而全面了解E.cristatum对高粱酒酿造过程中糖化效率的影响。
1 材料与方法
1.1 材料与试剂
原料:糯性高粱、酒曲,湖南湘窖酒业有限公司提供。
菌种:E.cristatum,北京北纳创联生物技术研究院。
标准品:直链淀粉(纯度96%)、支链淀粉(纯度87.2%)、聚甲基丙烯酸甲酯(polymethyl methacrylate, PMMA)、二甲基亚砜(dimethyl sulfoxide, DMSO),北京中科质检生物技术有限公司。
试剂:Czapek Dox 培养基、葡萄糖、淀粉酶(100 000 U/g)、C6H12O6、NaOH、HCl 等(以上试剂均为分析纯)。
1.2 仪器与设备
HR-T16M台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;立式压力蒸汽灭菌器,上海博讯实业有限公司;PIXcel1DX-射线衍射仪、SSX-550扫描电子显微镜,上海永傲精密仪器有限公司;waters1525凝胶渗透色谱仪、Agilent PLgel 5 μm MIXED-C色谱柱,美国沃特世有限公司;TU-1810S紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 E.cristatum的培养
利用察氏培养基活化培养,28 ℃培养4~5 d,至菌落产生孢子。后进行扩大培养,在28 ℃、150 r/min摇床培养5 d(前3 d 100 r/min,避免转速过高导致水的剪切力过大影响菌种生长),得到实验所用菌液。以悬液中孢子浓度采用平板计数法计数,测得此时E.cristatum浓度约为1.03×106 CFU/mL。
1.3.2 粮食处理及样品发酵
优选整粒糯性高粱,按照经典高粱白酒粮曲比例4∶1发酵[15]。每坛准备3.3 kg干重高粱及0.7 kg大曲。高粱润粮后每份样品质量为5.61 kg,条件为90 ℃热水浸泡12 h。蒸粮2.5 h,至内无硬芯,但颗粒完整的状态。而后在6坛中分别加入0、0.165、0.33、0.495、0.66、0.825 mL E.cristatum,相当于每坛菌液添加0% (空白组)、5%、10%、15%、20%、25%(以上均为质量分数,下同)。6组发酵坛依次记为A组、B组、C组、D组、E组、F组。充分混匀后于35 ℃环境下静置12 h以富集好氧菌,后装入陶坛密封并于42 ℃发酵60 d。每7 d取样一次,测定其还原糖含量、残余淀粉含量[16]。
1.3.3 酒醅残余淀粉、还原糖含量测定
参照标准DB34/T 2264—2014《固态发酵酒醅分析方法》依次测定。
1.3.4 E.cristatum添加量的确定
由于糯性高粱是高粱白酒生产的唯一谷物原料,因此它是一种经典的单底物糖化发酵过程。所以,高粱白酒的糖化发酵符合经典的发酵动力学方程Michaelis-Menten Equation如公式(1)所示[17]:
(1)
式中:V,每组试样糖化过程中还原糖产生速率,g/h;S,每组试样糖化过程中淀粉消耗速率,g/h;Km,每组米氏常数的平均值;Vmax,每组试样糖化过程中还原糖最大产生速率,g/h。
分别在糖化发酵过程中的第7、14、21、28、35、42、49、56天测定每组试样的V和S。将测得的各组V、S数据带入发酵动力学方程联立,可得到每组的Km、Vmax。对比6组试样的Vmax,最大值组即为最佳菌液添加量组。该方法比繁复的传统工艺优化方法更简便、省时且节约。
1.3.5 酒醅残余淀粉的提取
由于糯性高粱经发酵后糖分多、黏性大、色素也多,所以选择糯米淀粉提取方法[18-19],并在此基础上针对该酒醅特性做适当更改。
选取上述试验中的空白组与最佳菌液接入量组作对照,平行2组,入坛发酵。记空白组为A、实验组为B。酒醅浸泡2 h过40目筛,除去可溶性糖与糠壳、高粱皮及曲粉等杂质。研磨挤压剩余高粱醅,分离出醅中的残余淀粉。加水浸泡将淀粉液洗出,浆液过100目筛除去高粱皮以及菌块蛋白等杂质。静置1 h倒出上清液,用纯水洗至清澈,得到淀粉沉淀,40 ℃烘干48 h,过200目筛,装袋并在4 ℃的条件下保存备用。
1.3.6 酒醅直链淀粉含量测定
采用分光光度法测定高粱酒醅残余淀粉中的直链淀粉含量[20-21]。将直链淀粉和支链淀粉标准品分别按0.2∶0、0.16∶0.04、0.12∶0.08、0.1∶0.1、0.08∶0.12、0.04∶0.16、0∶0.2比例混合,再分别配制成100 mL的淀粉溶液。取1 mol/L的I2液1 mL,依次加入到5组淀粉溶液中,用UV-2600紫外-可见分光光度计在720 nm处测定5组溶液的吸光度。直链淀粉含量计算如公式(2)所示:
(2)
式中:X,直链淀粉含量;Y,吸光度。
1.3.7 酒醅残余淀粉分子量分布测定
以不同分子量标准PMMA样品过色谱柱,记录其保留时间,以此做出标准方程。色谱柱温度40 ℃,DMSO为流动相,流速为1 mL/min。将高粱酒醅淀粉样品分别溶为2 g/L的淀粉待测液,过色谱柱。进样量10 μL,过柱时间15 min,记录其保留时间,代入标准方程计算分子量。标准曲线方程如公式(3)所示:
(3)
式中:X,保留时间;Y,分子质量。
1.3.8 酒醅残余淀粉晶体结构测定
采用X射线衍射仪测定高粱酒醅残余淀粉的晶体结构[23]。测试角度范围为起始10°~终止80°,步宽0.01°,入射光波长 1.540 56 Å,得到2θ与衍射强度的关系曲线,通过强度对比可知淀粉晶体结构状态及结晶度。
1.3.9 酒醅残余淀粉微形态测定
采用扫描电子显微镜直观地对比观测了两组高粱酒醅残余淀粉的微观形态[24]。放大倍数4 000×。
1.3.10 统计分析
所有检测样本均有3个平行并取平均。本研究采用Excel 2023计算发酵动力学方程,并制作标准曲线方程,数据采用平均数±标准差。Origin 2022处理XRD数据,SPSS 27.0进行显著性统计分析,P<0.05为差异显著有统计学意义。
2 结果与分析
分别对发酵中6组不同E.cristatum添加量的高粱酒醅进行了还原糖、残余淀粉含量测定,验证了E.cristatum促进高粱酒酿造过程的糖化效率。并依据6组的发酵动力学方程验证试验结论,确定了最佳菌液添加量及糖化时间。
随后选出最佳E.cristatum添加量组为实验组与不接入E.cristatum的空白组作对照进行了高粱酒的酿制,各有两组平行,糖化时间采用上述实验所得结果。取两组酒糟提取淀粉,对其淀粉进行了分析实验,以深入了解E.cristatum促进高粱酒糖化作用的机理。
2.1 E.cristatum对高粱酒发酵过程酒醅残余淀粉含量影响
如图1所示,随着发酵时间的延长,酒醅中残余淀粉逐渐减少。对比6组不同菌液添加量,每7 d残余淀粉含量的变化趋势一致,从菌液添加量0~15%逐渐降低,证明随着菌液添加量的增加酒醅中高粱淀粉糖化消耗量也在增加。但从15%~25%的菌液添加量之间酒醅的残余淀粉含量变化趋势则逐渐升高,分析由于过多的菌液与酒醅中原有的微生物抢夺养分,反而不利于菌体生长代谢以及淀粉的糖化。且随着菌液添加量的增加,水分也相应增多,造成酒醅内氧气含量相对降低,所以发酵前期产生淀粉酶的好氧真菌等代谢受阻,淀粉水解速率也会随之降低[25]。可知D组即15% E.cristatum液添加量的发酵组淀粉消耗效果最好,在完成发酵周期后达到(18.86±1.87) g/100 g。其中A组即空白组所剩余淀粉(25.43±1.51) g/100 g,即实验组比空白组多消耗掉了35%的淀粉。证明E.cristatum的添加对高粱白酒的酿造糖化过程具有促进作用。

图1 白酒发酵过程中酒醅残余淀粉含量变化
Fig.1 Changing on residual starch content in fermented grains during liquor fermentation
注:a-f表示发酵过程中不同菌液添加量的酒醅残余淀粉含量差异显著(P<0.05),下同。
从糖化周期来看,A组即空白组中0~35 d处于糖化的主要时期,残余淀粉含量急速下降。35~56 d残余淀粉含量下降速度缓慢,微生物代谢进入平衡期,即糖化微生物生长繁殖速度下降,新个体产生与死亡基本平衡,则代谢消耗淀粉的速率也变缓。D组即15% E.cristatum液添加量的发酵组则0~42 d仍处于糖化主要时期,42~56 d残余淀粉含量下降速度才开始平缓,进入平衡期。可见E.cristatum的加入可延长高粱酒发酵的糖化周期,促进残余淀粉的进一步消耗,从而提高酒醅粮食的利用率。
2.2 E.cristatum对高粱酒发酵过程酒醅还原糖含量影响
高粱酒发酵过程中随着发酵时间的延长,酒醅中还原糖含量逐渐增加,对照组含量显著低于添加E.cristatum液的各组还原糖含量(图2)。D组15% E.cristatum添加量的发酵组还原糖含量最高,在完成发酵周期后达到 (23.25±1.25) g/100 g。其中A组即空白组还原糖含量为(16.98±0.98) g/100 g,即实验组比空白组多生成了35%的还原糖,可知E.cristatum对高粱白酒发酵的糖化过程有促进作用。
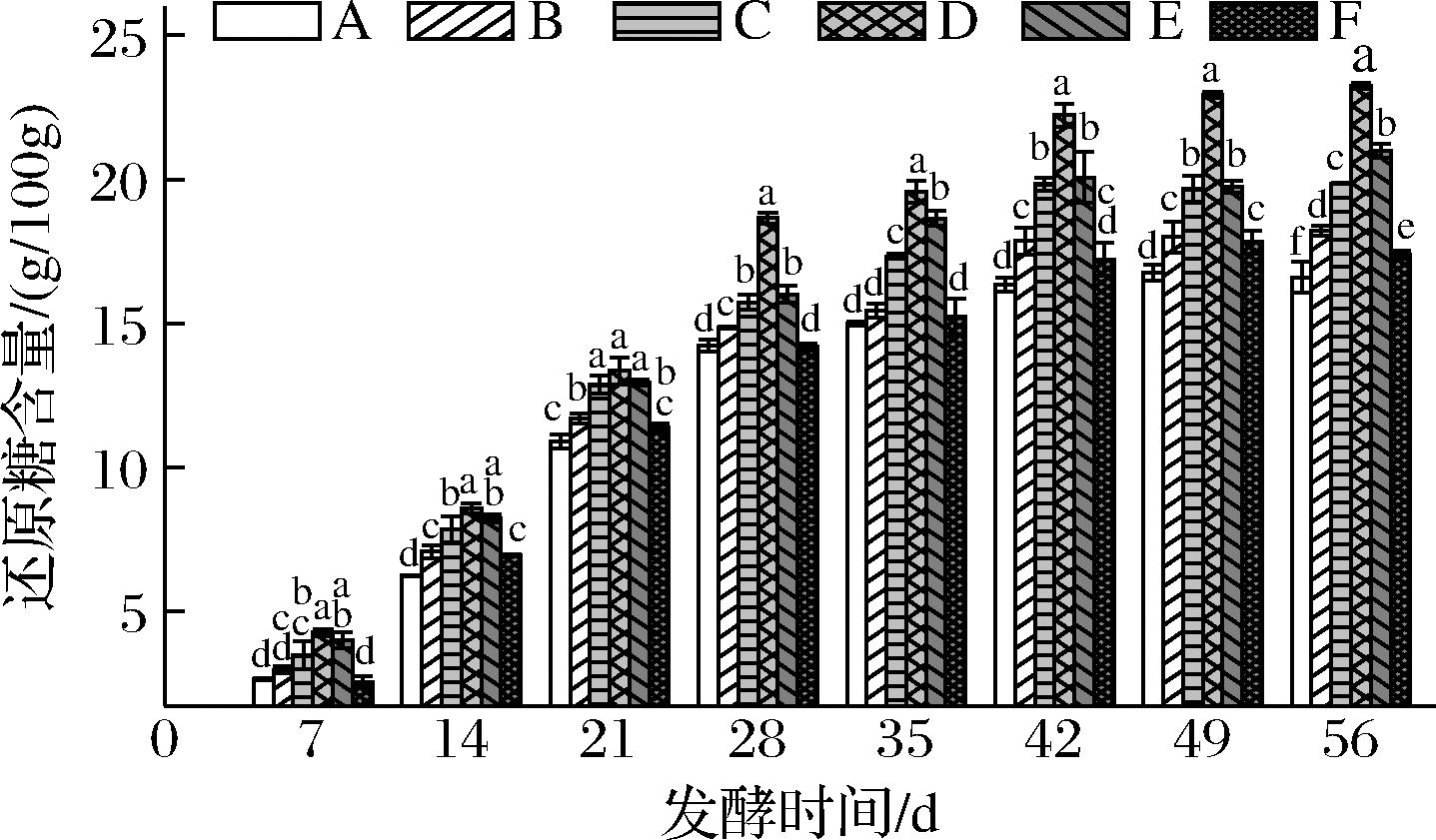
图2 白酒发酵过程中酒醅还原糖含量变化
Fig.2 Changing on reducing sugar content in fermented grains during liquor fermentation
酿酒发酵前期正是霉菌作为优势菌作用的阶段,即糖化主要时期。在其分泌的大量淀粉酶催化作用下还原糖产生速率很快,至28 d后空白组还原糖含量变化趋于平缓。但有接入E.cristatum的各组还原糖含量还在缓慢上升,尤其是15%添加量组直至(49~56 d)还原糖含量变化才完全平缓。说明E.cristatum的加入具有延长高粱白酒酿造糖化周期的作用,进一步提高酒醅中可发酵性糖的含量,为酒化及产香提供更多必要的底物。到中后期还原糖产生速率缓慢原因有以下几点原因[26-27]:有部分还原糖被酒化和酸化;酒醅中还原糖含量过高使渗透压增加,霉菌代谢受阻;随着发酵进行酒醅酸度也在升高,对菌体的生长代谢产生了抑制作用。且从2.1节可知,15%菌液添加量的酒醅样品42 d之后残余淀粉仍然有明显的消耗趋势,而还原糖42 d之后趋于平衡。由此可见,继续消耗的淀粉转化的还原糖已经和还原糖转化的醇类、酸类等物质趋于动态的平衡关系。可见添加了15% E.cristatum液的酒醅样品历经42 d后其糖化周期达到平衡状态,进入到同步的双边发酵阶段[26]。
2.3 E.cristatum添加量的确定
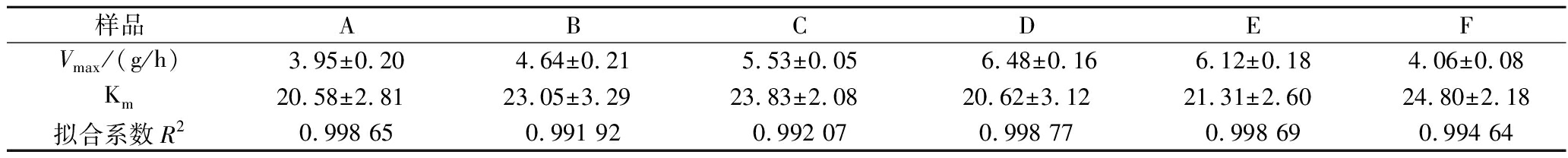
由于本文所需优化的工艺步骤只有菌液添加量一个单因素,所以采用发酵动力学方法替代了繁复耗时的传统正交及响应面等工艺优化方法,通过更省时简便的数学公式来验证实验结果的准确性,从而确定最佳的菌液添加量。根据6组不同菌液添加量的高粱酒糖化过程所产生的还原糖含量及残余淀粉含量共同生成的发酵动力学方程见表1。
表1 高粱酒糖化过程所生成的发酵动力学方程
Table 1 Dynamics equations of each samples
样品ABCDEFVmax/(g/h)3.95±0.204.64±0.215.53±0.05 6.48±0.166.12±0.184.06±0.08Km20.58±2.8123.05±3.2923.83±2.0820.62±3.1221.31±2.6024.80±2.18拟合系数R20.998 650.991 920.992 070.998 770.998 690.994 64
6组方程的拟合系数R2均接近于1,可知该高粱酒的单底物糖化发酵过程适宜应用此发酵动力学方程优化菌液添加量。且由表可得D组Vmax值最大,即15% E.cristatum添加量时产生还原糖的速率最大,促进糖化效率的效果最佳[7-9]。通过该方程验证,所得结果与残余淀粉、还原糖含量测定实验结果一致。其还原糖最大产生速率可达(6.48±0.16) g/h。
由2.1~2.3节结果可得,E.cristatum可显著提高高粱酒酿制过程的糖化能力;添加15% E.cristatum液时糖化效率达到最大值 (23.25±1.25) g/100 g,最大产生速率可达 (6.48±0.16) g/h;前42 d内为添加了15% E.cristatum的高粱酒主要糖化时期,因此其最佳糖化周期为(0~42 d)。
2.4 E.cristatum对酒醅中直链淀粉含量的影响
由上述结果可知15 mL/100 g E.cristatum添加量为糖化效果最佳组,所以以不添加E.cristatum的传统酿制组为空白组,额外接入15 mL/100 g E.cristatum的酒醅组为实验组,分别做两组平行,糖化发酵42 d。取得酒醅提取高粱淀粉,空白组所提淀粉为样品A、实验组所提淀粉为样品B。
按分光光度法测定得出样品A、B的直链淀粉含量分别为(21.24±1.24) %、(26.32±0.86) %,样品B(实验组)的高粱酒糟淀粉中直链淀粉含量比样品A(对照组)多5.08%,两组样品直链淀粉含量(P=0.028<0.05)差异显著。该现象表明加入了E.cristatum的实验组高粱淀粉中有较多的支链淀粉被淀粉酶水解成为了直链淀粉[28],即E.cristatum提高了酿酒过程中的原粮利用率,促进了高粱淀粉的糖化作用。
2.5 E.cristatum对酒醅中高粱淀粉晶体结构影响
已知淀粉结构分为结晶区和非结晶区,非结晶区容易被水解,结晶区较难被水解。由图3可知,A、B都出现明显峰值,则淀粉的非结晶区均被水解,结晶区暴露。对照组与实验组均为同种淀粉晶体。B组淀粉衍射图的主峰高及峰面积均略低于A组,但不显著。可知B组淀粉的结晶区相较A组淀粉被进一步水解。所以证明了加E.cristatum的实验组在淀粉水解过程中主要作用于糯高粱淀粉的非结晶区域,相比空白组其对结晶区的水解也有进一步的促进作用,即实验组对糯高粱淀粉糖化效果更好[29-30]。
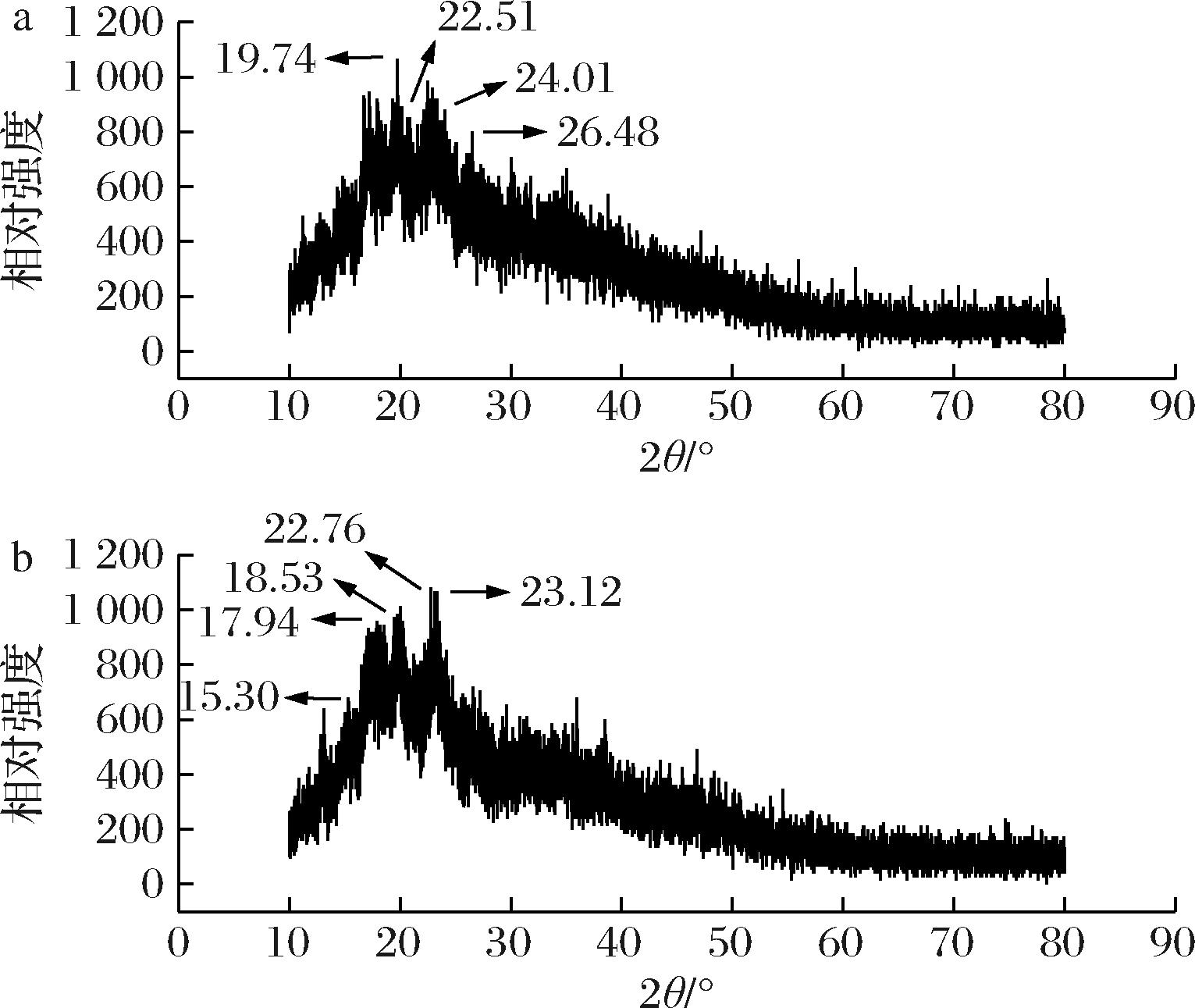
a-样品B;b-样品A
图3 淀粉样品的X-射线衍射图
Fig.3 X-ray diffraction pattern of starch samples
2.6 E.cristatum对酒醅中高粱淀粉微观形态影响
如图4所示,两组淀粉均为被水解状态,其中样品A表面较为平滑,水解程度较低。样品B表面则更为斑驳、凹凸不平,并存在大量孔洞。说明样品B中淀粉分子外层的支链淀粉被大量分解,且部分淀粉分子的内层晶体结构也遭到了破坏,验证了 X-射线衍射中所得出的晶体结构更松散,结晶度更低这一现象[31]。加入了E.cristatum的实验组B高粱淀粉被水解的程度更大,糖化效果更好。

a-样品A;b-样品B
图4 样品的扫描电子显微镜图(×4 000)
Fig.4 Scanning electron microscopy photographs of starch samples (×4 000)
2.7 E.cristatum对酒醅中高粱淀粉分子质量分布影响
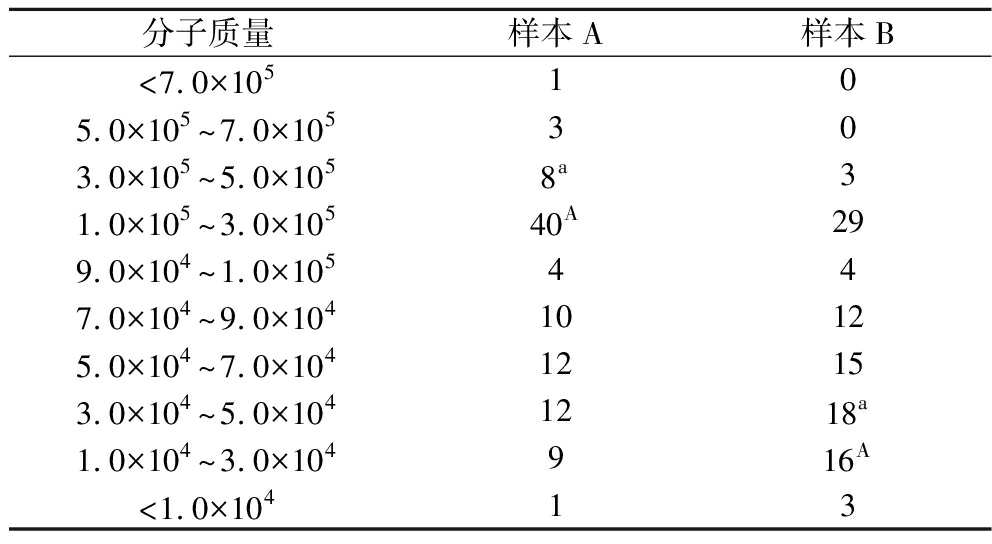
样品A、B的分子质量分布见表2。分子质量为1.0×105~7.0×105,样品A占比为52%,样品B占比32%。分子质量为1.0×104~1.0×105,样品A占比为48%,样品B则占比68%。可以看出样品B比样品A的小分子质量淀粉更多,且样品B在小分子质量区间(<7.0×104)的分布更集中,显著性也更高。从平均分子质量分布来看,样品A为150 778,B为921 98,可见B中小分子淀粉含量更多。因为E.cristatum的加入使更多淀粉分子由大分子分解成为了小分子状态[22]。
表2 空白组(样品A)与实验组(样品B)的高粱淀粉分子质量分布 单位:%
Table 2 Molecular weight distribution for the control group (sample A) and the cofermented (sample B) sorghum starch
分子质量样本A样本B<7.0×105105.0×105~7.0×105303.0×105~5.0×1058a31.0×105~3.0×10540A299.0×104~1.0×105447.0×104~9.0×10410125.0×104~7.0×10412153.0×104~5.0×1041218a1.0×104~3.0×104916A<1.0×10413
注:每行不同的小写字母表示差异显著(P<0.05),大写字母表示差异极显著(P<0.01)。
由2.4~2.7节研究可知,经E.cristatum协同糖化的高粱淀粉发生了如下变化:支链淀粉被水解,直链淀粉含量增加;淀粉结晶区被进一步水解;淀粉分子表面凹凸斑驳、布满孔洞;淀粉分子质量变小,平均分子质量下降。这些变化从分子水平解释了E.cristatum提高高粱酒糖化效率的作用原理。
由上述试验可知,E.cristatum对酒曲的协同糖化促进作用主要体现在以下两个方面。在宏观方面,当对照组样品接近糖化阶段尾声时,在E.cristatum液的协同糖化作用下,实验组样品继续消耗高粱中的残余淀粉,继而生成更多的可发酵糖,为后续的出酒增香提供必要的物质基础。可见,E.cristatum具有较强的耐渗透压,能够在相对不利于糖化的条件下继续发挥糖化作用。在微观方面,伴随着E.cristatum的协同糖化作用,高粱淀粉从支链到直链第次水解,直至结晶区域。导致淀粉分子质量趋于降低,淀粉颗粒被分解的效果十分明显。结合宏观微观两方面作用,E.cristatum能够显著促进酒曲的糖化作用,助力高粱酒产量的提升。
3 结论
综上研究可得出以下结论:(1) E.cristatum可以促进高粱白酒酿造过程中的糖化效率,延长糖化时间。当菌液添加量为15%时糖化效率达到最大值(23.25±1.25) g/100 g,相比空白组效率提高了35%。(2) 添加有E.cristatum的酒醅淀粉中大量支链被分解,直链淀粉含量增加;X-射线衍射观测淀粉结晶区被进一步水解;扫描电镜显示淀粉表面凹凸斑驳、布满孔洞,部分结晶区被破坏;淀粉分子质量整体变小,平均分子质量更低,从分子水平解释了E.cristatum促进高粱白酒酿造糖化效率的作用原理。
因此在传统的固态纯高粱白酒酿制过程中加入E.cristatum 可使其糖化效果更好,且对高粱淀粉水解效果也更明显。所以通过酿酒实验表明E.cristatum促进了高粱白酒酿造过程的糖化作用,提高了出酒率与粮食利用率,延长糖化时间,具备酿酒应用可行性。可在酿酒原料使用量不变的情况下,提高白酒产量。节约酿酒成本的同时更满足了消费者对纯粮固态高粱酒的需求量大于产量的现状,可见其有良好的商业前景。
本文研究了高粱白酒酿造过程中E.cristatum对高粱淀粉糖化发酵的促进作用及作用原理。在接下来的研究中,我们将进一步阐述E.cristatum对酿造高粱白酒风味的影响,以验证E.cristatum在高粱白酒酿造生产中的应用价值。
[1] 沈怡芳. 白酒生产技术全书[M].北京:中国轻工业出版社, 2009:284-286.SHEN Y F.Liquor Production Technology Complete book[M].Beijing:China Light Industry Press, 2009:284-286.
[2] 杨传天. 高粱淀粉精细结构对其酿造特性的影响[D].扬州:扬州大学, 2022.YANG C T.Sorghum starch fine structure affect its brewing characteristics[D].Yangzhou:Yangzhou University, 2022.
[3] 李玉婷, 吕嘉枥, 李良凤, 等.冠突散囊菌固态发酵产消化酶活力的研究[J].中国酿造, 2012, 31(10):93-95.LI Y T, LYU J L, LI L F, et al.Activity of digestive enzymes produced by Eurotium cristatum with solid-state fermentation[J].China Brewing, 2012, 31(10):93-95.
[4] 姜良珍, 王罗, 杨涛, 等.冠突散囊菌及其发酵应用研究进展[J].食品工业科技, 2022, 43(4):454-462.JIANG L Z, WANG L, YANG T, et al.Research progress on Eurotium cristatum and its fermentation application[J].Science and Technology of Food Industry, 2022, 43(4):454-462.
[5] 陈桂梅, 邓永亮, 黄亚亚, 等.冠突散囊菌生长过程中几种胞外酶活性变化[J].茶叶科学, 2013, 33(4):306-310.CHEN G M, DENG Y L, HUANG Y Y, et al.Activity changes in several extracellular enzymes of Eurotium cristatum fungi during its growth period[J].Journal of Tea Science, 2013, 33(4):306-310.
[6] 范斌强, 吴浩人, 余有贵, 等.黑茶菌添加量对包包曲培菌过程品质的影响[J].食品与机械, 2021, 37(5):27-32;77.FAN B Q, WU H R, YU Y G, et al.The effect of dark tea fungus on the quality of wrapped starter culture process[J].Food &Machinery, 2021, 37(5):27-32;77.
[7] GUO S Y, LI B, YU W, et al.Which model? Comparing fermentation kinetic expressions for cream cheese production[J].The Canadian Journal of Chemical Engineering, 2021, 99(11):2405-2427.
[8] 李桂峰, 燕妮, 原潞, 等.青枣果酒发酵动力学模型[J].食品工业, 2021, 42(5):88-91.LI G F, YAN N, YUAN L, et al.The fermentation kinetics of green jujube wine[J].The Food Industry, 2021, 42(5):88-91.
[9] 张佩, 陈默, 胡国元.胞内羧甲基茯苓多糖的发酵动力学[J].食品与发酵工业, 2020, 46(6):49-53.ZHANG P, CHEN M, HU G Y.Study on fermentation kinetics of intracellular carboxymethylpachyman[J].Food and Fermentation Industries, 2020, 46(6):49-53.[10] LEE M E, SHIN H Y, BHARDWAJ N, et al.Effective bioconversion of fungal-spoiled starchy food waste into fermentable sugars using fungi-degrading, artificial amylosomes[J].Bioresource Technology, 2023, 388:129760.
[11] BIAN X, CHEN J R, YANG Y, et al.Effects of fermentation on the structure and physical properties of glutinous proso millet starch[J].Food Hydrocolloids, 2022, 123:107144.
[12] 杨凤英, 秦洋.冠突散囊菌对酒曲糖化能力的影响及其机制研究[J].食品与发酵工业, 2023, 49(5):81-87.YANG F Y, QIN Y.Impact and mechanism of Eurotium critatum on the saccharification ability of Jiuqu[J].Food and Fermentation Industries, 2023, 49(5):81-87.
[13] 杨凤英, 秦洋, 赵千慧, 等.冠突散囊菌对大曲发酵性能、微生物区系以及白酒风味的影响[J].食品工业科技, 2023, 44(16):180-186.YANG F Y, QIN Y, ZHAO Q H, et al.Effects of Eurotium critatum on fermentation performance, microbial flora and Baijiu flavor of Daqu[J].Science and Technology of Food Industry, 2023, 44(16):180-186.
[14] QIN Y, YANG F Y.Saccharification efficiency improvement by Eurotium cristatum and its mechanism study during the glutinous rice wine fermentation[J].Starch-Stärke, 2022, 74(9-10):1-10.
[15] 刘茂柯, 田新惠, 刘成元, 等.不同品种高粱酿造浓香型白酒的香味物质组成差异及其影响因素[J].食品工业科技, 2023, 44(8):107-115.LIU M K, TIAN X H, LIU C Y, et al.Differences in the composition of flavor compounds of Nongxiangxing Baijiu brewed from different varieties of sorghum and its influencing factors[J].Science and Technology of Food Industry, 2023, 44(8):107-115.
[16] 蔡程山, 白飞荣, 许玲, 等.国井白酒窖池发酵过程中酒醅微生物多样性及理化特性[J].中国酿造, 2023, 42(11):90-98.CAI C S, BAI F R, XU L, et al.Microbial diversity and physicochemical characteristics of fermented grains during pit fermentation process of Guojing Baijiu[J].China Brewing, 2023, 42(11):90-98.
[17] YULISTIANI D, NURHAYATI.Fermentation kinetic of maize straw-Gliricidia feed mixture supplemented by fermentable carbohydrate measured by in vitro gas production[J].IOP Conference Series:Earth and Environmental Science, 2018, 119:012053.
[18] 何述栋, 王雍飞, 潘姝晓, 等.酶法辅助胶体磨同时提取糯米淀粉和蛋白质的工艺研究[J].包装与食品机械, 2022, 40(2):8-12.HE S D, WANG Y F, PAN S X, et al.Study on simultaneous extraction process of glutinous rice starch and protein by enzyme assisted colloid mill[J].Packaging and Food Machinery, 2022, 40(2):8-12.
[19] 汤振兴. 糯米淀粉纳米小体的提取及其结构特性研究[D].长沙:湖南大学, 2020.TANG Z X.Study on the extraction and structural properties of starch blocklets from waxy rice[D].Changsha:Hunan University, 2020.
[20] 焦梦悦, 高涵, 王伟娜, 等.四种测定直链淀粉和支链淀粉方法的比较[J].食品工业科技, 2019, 40(12):259-264.JIAO M Y, GAO H, WANG W N, et al.Comparison of four methods for the determination of amylose and amylopectin[J].Science and Technology of Food Industry, 2019, 40(12):259-264.
[21] PENG Y, MAO B G, ZHANG C Q, et al.Influence of physicochemical properties and starch fine structure on the eating quality of hybrid rice with similar apparent amylose content[J].Food Chemistry, 2021, 353:129461.
[22] SUN X X, SUN Z Z, SALEH A S M, et al.Understanding the granule, growth ring, blocklets, crystalline and molecular structure of normal and waxy wheat A- and B- starch granules[J].Food Hydrocolloids, 2021, 121:107034.
[23] DOME K, PODGORBUNSKIKH E, BYCHKOV A, et al.Changes in the crystallinity degree of starch having different types of crystal structure after mechanical pretreatment[J].Polymers, 2020, 12(3):641.
[24] SUN L, SUN X Y, DU Y F, et al.Effect of the starch structure fermented by Lactobacillus plantarum LB-1 and yeast on rheological and thermomechanical characteristics of dough[J].Food Chemistry, 2022, 369:130877.
[25] 高传强, 司冠儒.小窖酱香型白酒的酿造工艺[J].酿酒, 2023, 50(6):2-10.GAO C Q, SI G R.Research on the brewing technology of small pit sauce-flavor liquor[J].Liquor Making, 2023, 50(6):2-10.
[26] 蒲领平, 黄治国, 饶家权, 等.六粮浓香型白酒酒醅发酵理化指标时空差异性研究[J].中国酿造, 2023, 42(7):167-171.PU L P, HUANG Z G, RAO J Q, et al.Spatiotemporal differences of physicochemical indexes in fermented grains of six-grain strong-flavor Baijiu[J].China Brewing, 2023, 42(7):167-171.
[27] 成冬冬, 董灿灿, 徐媛媛, 等.清香型白酒酒醅理化指标变化规律研究[J].食品科技, 2022, 47(6):92-97.CHENG D D, DONG C C, XU Y Y, et al.Changes rules of the physicochemical indexes of Fen-flavor Baijiu fermented grains[J].Food Science and Technology, 2022, 47(6):92-97.
[28] 罗文业, 沈毅, 周艳, 等.采用分光光度法分析酱香型白酒生产用糯高粱中淀粉的研究[J].酿酒科技, 2022(3):133-137.LUO W Y, SHEN Y, ZHOU Y, et al.Study on starch in liquor-making sorghum by spectrophotometry[J].Liquor-Making Science &Technology, 2022(3):133-137.
[29] KONG X L, ZHU P, SUI Z Q, et al.Physicochemical properties of starches from diverse rice cultivars varying in apparent amylose content and gelatinisation temperature combinations[J].Food Chemistry, 2015, 172:433-440.
[30] RAHMAN M H, MU T H, ZHANG M, et al.Comparative study of the effects of high hydrostatic pressure on physicochemical, thermal, and structural properties of maize, potato, and sweet potato starches[J].Journal of Food Processing and Preservation, 2020, 44(11):e14852.
[31] WANG Y J, XIE Z F, WU Q, et al.Preparation and characterization of carboxymethyl starch from cadmium-contaminated rice[J].Food Chemistry, 2020, 308:125674.