Pickering乳液是一种由固体颗粒稳定的乳液,相较于传统小分子表面活性剂稳定的乳液来说具有不可逆吸附、低毒性等特点[1]。近年来,Pickering稳定剂的研究已受到多方学者的关注,并且Pickering稳定剂在食品和制药领域表现出较好的应用前景,通过固体颗粒制备稳定的Pickering乳液已成为广泛的研究热点。明胶是由动物皮、骨、肌腱等结缔组织中的胶原蛋白部分降解加工所得的一类天然高分子聚合物,具有乳化性、胶凝性、成膜性等特点。明胶侧链上具有的亲水性和疏水性基团使其具有优越的界面活性,能够自发吸附到油-水界面,降低界面张力,并在油滴周围形成稳定的黏弹性界面膜,因此明胶是一种良好的Pickering稳定剂[2]。王欣欣等[3]以玉米油为油相,利用明胶纳米颗粒制备O/W型Pickering乳液,结果发现当明胶质量浓度在20 mg/mL时,乳液的稳定性较好。FENG等[4]使用明胶颗粒制备Pickering乳液,结果表明通过调控蛋白颗粒的浓度,可以有效地抑制油滴在储藏过程中的聚集,从而显著提高乳液的稳定性。
然而由于明胶的热不稳定性、吸湿性以及机械强度较差等性质,在一定程度上限制了明胶在实际加工生产中的应用。谷氨酰胺转氨酶(transglutaminase,TG酶)是一种催化酰基发生转移的酶,具有绿色安全、底物特异性高以及反应条件温和的特点,能够催化蛋白分子之间发生交联作用,从而改善其功能特性。本课题组前期研究发现,通过TG酶催化明胶分子发生交联,使明胶的热稳定性得到显著改善,同时还发现随着酶交联时间的增加,其稳定的高内相乳液结构和稳定性均得到明显改善,并且表现出极佳的热稳定性,极大地拓宽了其在食品工业中的应用[5]。但是,TG酶交联改性明胶提升乳液稳定性的机制还尚不清楚。目前,有研究发现固体颗粒在连续相中形成的三维黏弹性粒子网络结构对维持Pickering乳液的稳定具有十分重要的影响。连续相中的颗粒间相互作用形成了粒子-粒子的黏弹性三维网络结构,这种网络结构可以提高乳液的表观黏度,降低液滴的迁移速率,从而有效阻止液滴之间的聚集,最终使乳液的稳定性提高[6]。LIU等[7]将水不溶性植物甾醇开发成一种胶体颗粒作为Pickering乳液的稳定剂,研究发现随着颗粒浓度的增加乳液形成的凝胶网络结构强度增大,从而使形成的乳液稳定性提高。XIAO等[8]研究发现高粱醇溶蛋白纳米颗粒稳定的Pickering乳液也表现出类似趋势,连续相中颗粒浓度的增加导致乳液黏弹性响应的储存模量增加。这些研究结果表明乳液连续相结构对改善乳液稳定性具有重要意义。
基于以上分析,本研究通过调控TG酶添加量进行交联,获得具有不同交联度的明胶微凝胶,重点探究其稳定的Pickering乳液的流变学行为、电位和微观结构差异,分析不同TG酶交联度对明胶微凝胶乳液连续相变化的影响规律,从连续相角度证实TG酶交联对明胶微凝胶乳液的增稳效应,以期为明胶微凝胶的研发和稳定乳液应用提供数据和理论支撑。
1 材料与方法
1.1 原料与试剂
A型明胶,美国Sigma-Aldrich公司;TG酶(酶活力为200 IU),上海枫晴化工有限公司;NaOH、盐酸、二甲基硅油,成都科隆化学品有限公司;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS),重庆跃翔化工有限公司;Na2HPO4、NaH2PO4,成都科龙化工试剂厂;尼罗红,北京索莱宝科技有限公司;尼罗蓝,上海泰坦科技股份有限公司。
1.2 仪器与设备
JA3003B电子天平,上海精天电子仪器有限公司;HH-4数显恒温搅拌水浴锅,上海新诺仪器设备有限公司;PE 20实验室酸度计,上海梅特勒-托利多仪器有限公司;Zen 3690马尔文激光粒度仪,英国Malvern公司;MCR302流变仪,澳大利亚ANTON PAAR公司;722-P紫外-可见光分光光度计,上海菁华科技仪器有限公司;T 18高速分散器,美国IKA公司;Gemini 300扫描电镜,德国ZEISS公司;LSM800激光共聚焦显微镜,德国卡尔蔡司公司。
1.3 实验方法
1.3.1 不同交联度明胶微凝胶的制备
将A型明胶加入去离子水中,于室温下溶胀1 h,随后在60 ℃下水浴搅拌孵育30 min,待冷却至室温后将明胶溶液的pH值调节至6.0,然后加入不同浓度的TG酶溶液,使TG酶添加量占明胶质量分别为1%、2%、3%、4%和5%,体系中明胶终质量分数为1%。随后在45 ℃下水浴交联1 h,之后沸水浴10 min灭酶,得到的微凝胶样品分别标记为T1、T2、T3、T4和T5,不添加TG酶的样品作为对照组(T0)。
1.3.2 交联度的测定
参考KWAK等[9]的方法并适当修改。取明胶溶液0.5 mL于试管中,加入1 mL磷酸盐缓冲液(pH 8.2),并加入2 mL质量分数0.1%的TNBS溶液于暗处进行水浴(50 ℃,60 min)。水浴后加入4 mL 0.1 mol/L盐酸终止反应,室温放置20 min后,用分光光度计在340 nm处测定吸光度的变化。以L-亮氨酸制作标准曲线。交联度的结果按公式(1)计算:
交联度![]()
(1)
式中:A,原始明胶溶液中游离氨基的含量;A1,交联明胶溶液中游离氨基的含量。
1.3.2 Pickering乳液的制备
将4 mL所制备的明胶样品加入玻璃瓶中,再加入6 mL大豆油(使大豆油体积分数为60%)。使用高速分散器在15 000 r/min下均质1 min,得到不同交联度明胶微凝胶稳定的Pickering乳液。
1.3.3 乳液流变学行为分析
通过流变仪测定乳液的流变学特性,选用夹具为PP25平行板,测试间隙1 mm,温度设置为25 ℃。上样后去除多余的乳液样品,并在样品边缘覆盖一层硅油,以防止测试时水分蒸发。
表观黏度测试:对乳液进行稳态剪切扫描,设置剪切速率范围0.1~100 s-1。
应变扫描:设置应变扫描范围为0.1%~100%,固定频率为1 Hz。
频率扫描:设置频率扫描范围为0.1~10 Hz,固定应变为0.5%。
温度扫描:设置频率为1 Hz,应变为0.5%,温度扫描测试包括2段,升温阶段和降温阶段。升温阶段以5 ℃/min的速率从25 ℃升至95 ℃进行,降温阶段以相同速率从95 ℃降至25 ℃。
1.3.4 乳液ζ电位测定
通过激光粒度分析仪测定乳液样品的ζ电位。实验参数设置为:温度25 ℃,平衡时间90 s。所有样品用去离子水稀释100倍,并调节pH值至6.0。
1.3.5 乳液微观结构观察
通过激光共聚焦显微镜(confocal laser scanning microscope, CLSM)对乳液的微观结构进行观察。首先,配制1 mg/mL尼罗红和1 mg/mL尼罗蓝的荧光染料,将2种染料按照1∶1的比例混合,并将40 μL混合染料加入到制备的1 mL乳液样品中混合均匀,避光染色15 min。观察时,尼罗红和尼罗蓝的激发波长分别设置为488 nm和633 nm。
1.3.6 数据处理
所有试验至少重复进行3次,数据以平均值±标准偏差形式表示,并通过SPSS 18.0和Origin 2022软件对所有数据进行处理分析和作图,用LSD和Duncan检验法进行显著性分析(P<0.05)。
2 结果与分析
2.1 交联度分析
如图1所示,随着TG酶添加量的升高,所制备的明胶微凝胶T1、T2、T3、T4和T5的交联度分别为1.85%、4.10%、6.85%、9.58%和12.25%,交联度随着TG酶添加量的增加而显著增大,呈现明显的量效关系。TG酶可以催化谷氨酰胺的酰基转移反应,使谷氨酰胺残基侧链的γ-甲酰胺基和赖氨酸残基侧链的ε-氨基发生共价交联,从而形成异肽键。因此,TG酶的加入使得游离氨基的可用性降低,导致明胶微凝胶交联程度的增大[10]。
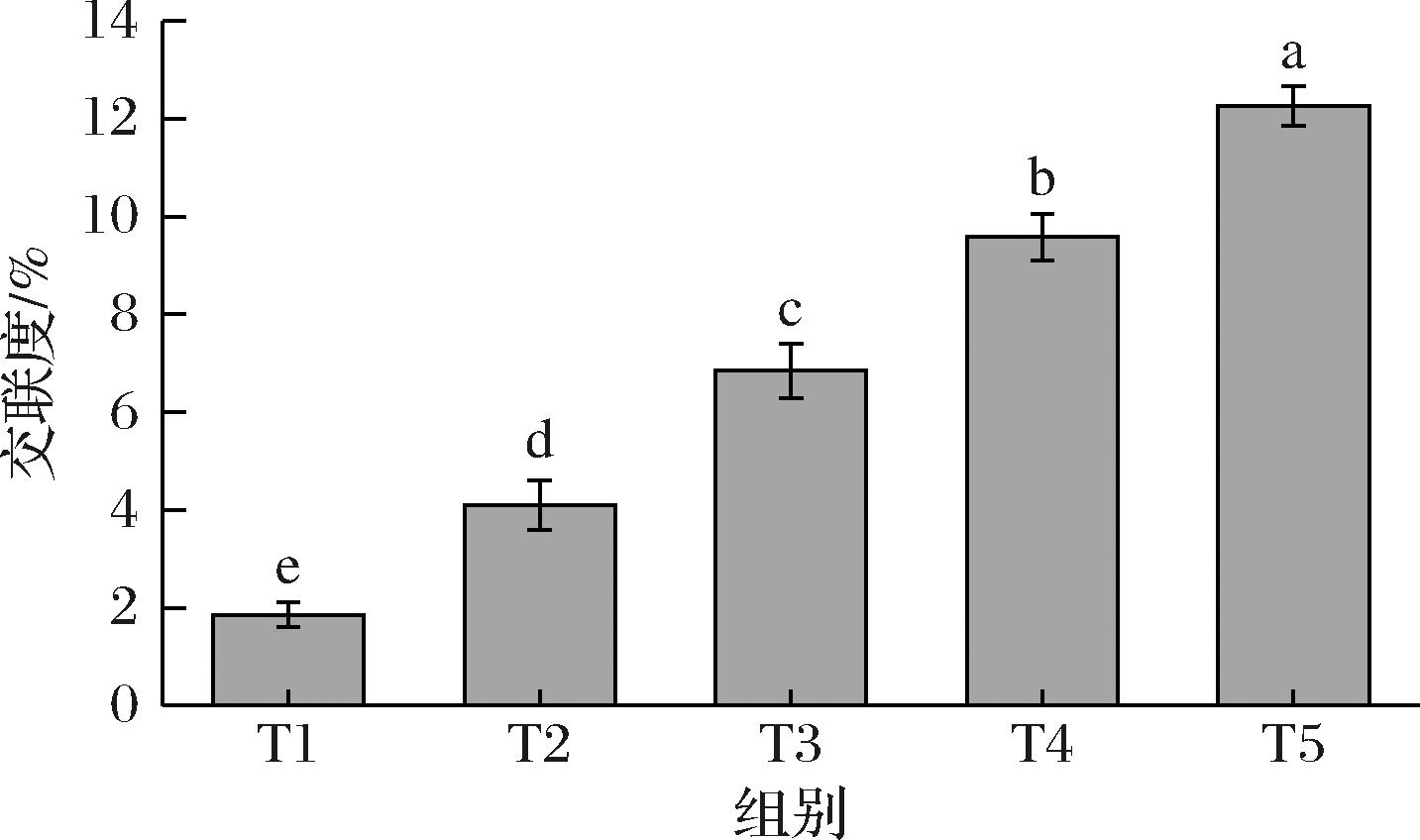
图1 不同TG酶添加量制备的明胶微凝胶的交联度(T1~T5)
Fig.1 The crosslinking degree (T1-T5) of gelatin microgel prepared with different TG enzyme concentration
注:不同小写字母代表差异显著,P<0.05(下同)。
2.2 表观黏度分析
乳液体系的表观黏度对于乳液的稳定性十分重要。稳态剪切测试结果在一定程度上可以反映乳液体系中液滴间相互作用情况。如图2-a所示,随着剪切速率增大(0.1~100 s-1),所有乳液的表观黏度不断下降,呈现剪切稀化的现象,表明所有样品均为非牛顿流体。有研究表明,乳液表现出剪切稀化行为是剪切剖面上不均匀流动导致的,这是弱絮凝网络结构被破坏的结果[11]。

a-表观黏度;b-应变扫描
图2 不同交联度(T0~T5)明胶稳定乳液的表观黏度和应变扫描
Fig.2 The apparent viscosity and the amplitude sweep of gelatin stabilized emulsions with different crosslinking degrees (T0-T5)
相同剪切速率下,与未交联明胶微凝胶乳液(T0)相比,在TG酶的催化作用下,随着交联度的增大,乳液的表观黏度呈现增大趋势,这与DING等[12]的研究结果相似。Power-law模型(η=Kγn-1)可用于描述非牛顿流体的流动行为,K为稠度系数,与体系的黏度有关,n为流动指数,描述体系的假塑性行为[13]。如表1所示,通过该方程对表观黏度曲线进行拟合,所有样品的相关性均较好(R2>0.99),得到拟合参数结果如表1所示。与未交联明胶微凝胶样品(T0)相比,随着交联度增大,K值增大,特别是当交联度达到6.85%(T3)时,乳液体系的K值明显增大,且当交联度进一步增加(T4~T5),K值不再发生明显变化,这表明乳液的稳定性随交联度的增加有效提升。这可能是由于随着交联度的增大,明胶分子链延长,使明胶颗粒之间的相互作用增强,从而使乳液的表观黏度增大,这有利于乳液稳定性的提升[14]。另外,非牛顿指数n值均小于1,且n值随着交联度的增大而呈现减小趋势,表明乳液更偏离于牛顿流体,其剪切稀化能力增强,说明乳液具有更好的可加工性。
表1 不同交联度(T0~T5)明胶微凝胶稳定乳液表观黏度的Power-law模型相关参数
Table 1 Power-law model parameters for apparent viscosity of gelatin microgel stabilized emulsion with different crosslinking degrees (T0-T5)
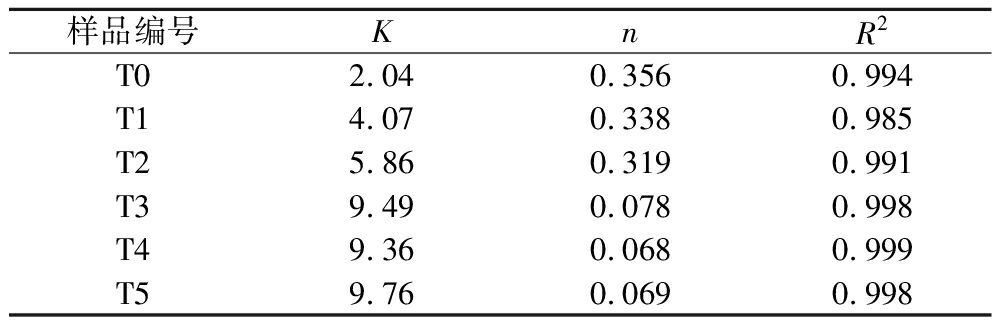
样品编号KnR2T02.040.3560.994T14.070.3380.985T25.860.3190.991T39.490.0780.998T49.360.0680.999T59.760.0690.998
2.3 应变扫描分析
应变扫描试验不仅能够评估乳液体系的稳定程度,还能够确定整个体系的线性黏弹区。如图2-b所示,在某一应变范围内,储能模量(G′)和损耗模量(G″)几乎恒定不变的区域为样品的线性黏弹区,根据图2-b可以确定T0、T1、T2、T3、T4和T5稳定的乳液样品的线性黏弹性区的终点分别接近于1.7%、1.9%、2.5%、4.0%、4.7%和4.6%,说明与未交联乳液相比,随着交联度的增大,明胶乳液的线性黏弹区变长;当交联度达到6.85%时(T3),交联度进一步增加对线性黏弹区的范围没有明显影响,这意味着乳液样品在结构破坏之前可以承受更大范围的变形,表明乳液体系中凝胶网络结构增强[15]。
如图3所示,在较低的应力条件下,G′都大于G″,表现出固体凝胶的性能,且两者都不依赖于应力变化。随着应力进一步增大,所有乳液样品的G′和G″都开始下降直到出现交点,之后表现为G″大于G′,呈现出以黏性为主的流体特征。该点的出现意味着乳液的流变特性从弹性主导变为黏性主导,这是由于乳液颗粒网络结构被破坏造成的,因此该点对应的应力值可以被定义为屈服应力[16]。随着交联度的增大,T0、T1、T2、T3、T4和T5稳定的乳液样品的屈服应力分别为2.10、2.31、2.52、3.52、4.45和4.47 Pa,即当交联度达到6.85%(T3)以上时,屈服应力不再明显增加。这表明随着交联度的增大,乳液的抗剪切和抵抗破坏的能力增强,这可能是由于在较高交联度下明胶颗粒在油-水界面处形成了更致密稳定的黏弹性界面膜,从而给乳液结构提供了更强的抵抗破坏的能力。
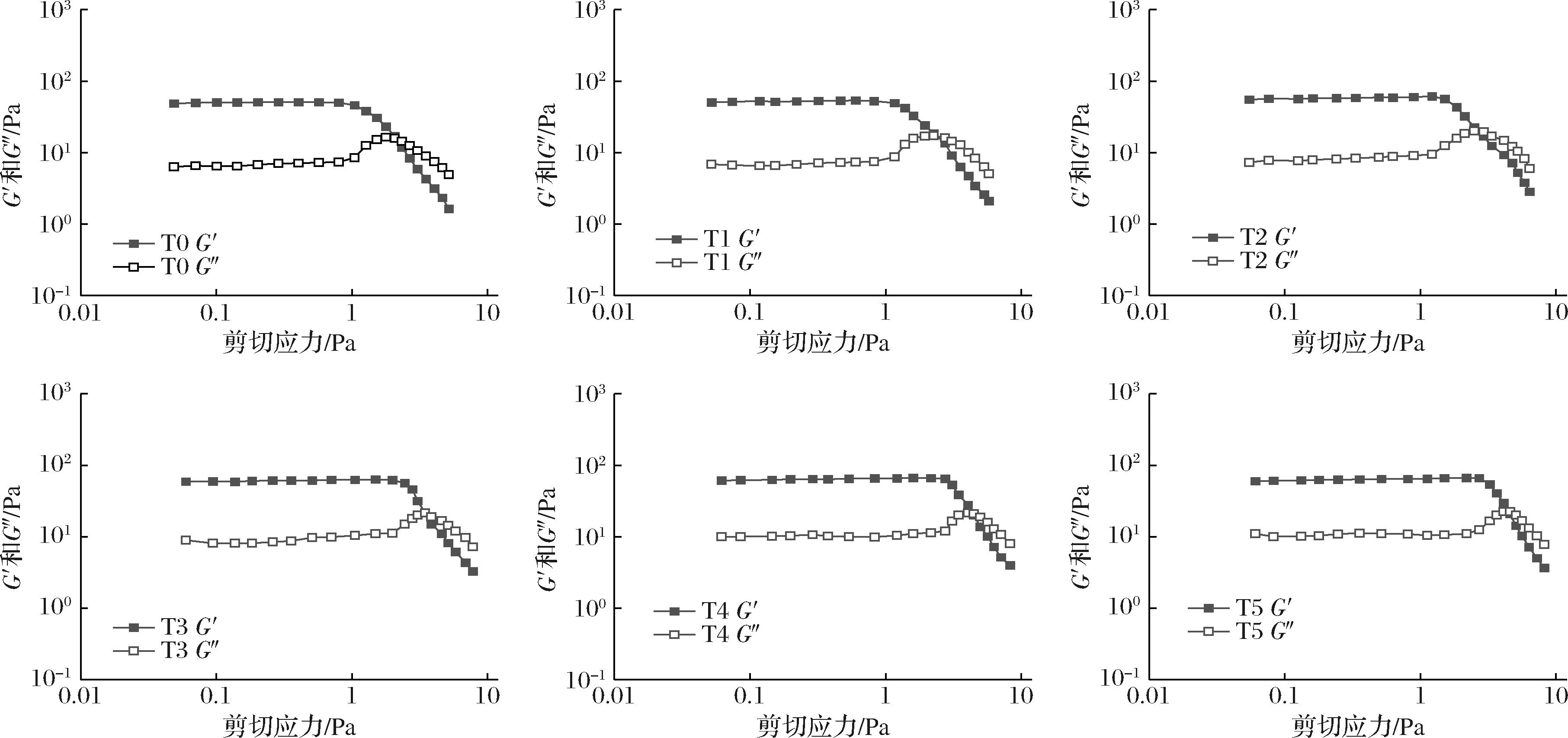
图3 不同交联度(T0~T5)明胶稳定乳液模量随剪切应力的变化曲线
Fig.3 The curve of the modulus of the emulsion stabilized by gelatin microgel with different crosslinking degrees (T0-T5) with shear stress
2.4 频率扫描分析
在线性黏弹性区内,通过频率扫描对不同交联度制备的明胶乳液进行了动态黏弹性分析,结果如图4-a所示。随着频率的升高,所有样品的G′和G″均呈现升高趋势,表现出一定的频率依赖行为,且G′值均高于G″值,表明所有乳液样品均表现出以弹性为主导的弱凝胶行为。同一频率下,随着交联度的增大,乳液样品的G′增大,这意味着明胶微凝胶乳液体系中形成了更坚实的凝胶网络结构。此外,损耗因子tan δ (G″/G′)是凝胶网络中蛋白质间相互作用的动态特性指标,较低的损耗因子表明乳液体系具有较强的弹性特征和较弱的黏性特征[17]。不同交联度明胶微凝胶乳液的损耗因子随频率变化的结果如图4-b所示,随着交联度的增大,损耗因子减小,也印证了乳液的凝胶网络结构增强。DJOULLAH等[18]研究了使用热预处理随后交联TG酶的豌豆蛋白凝胶,将其tan δ<0.1的样品归为强凝胶。本研究中T5组样品的tan δ<0.1,进一步表明TG酶交联明胶微凝胶增加了乳液凝胶网络的强度。
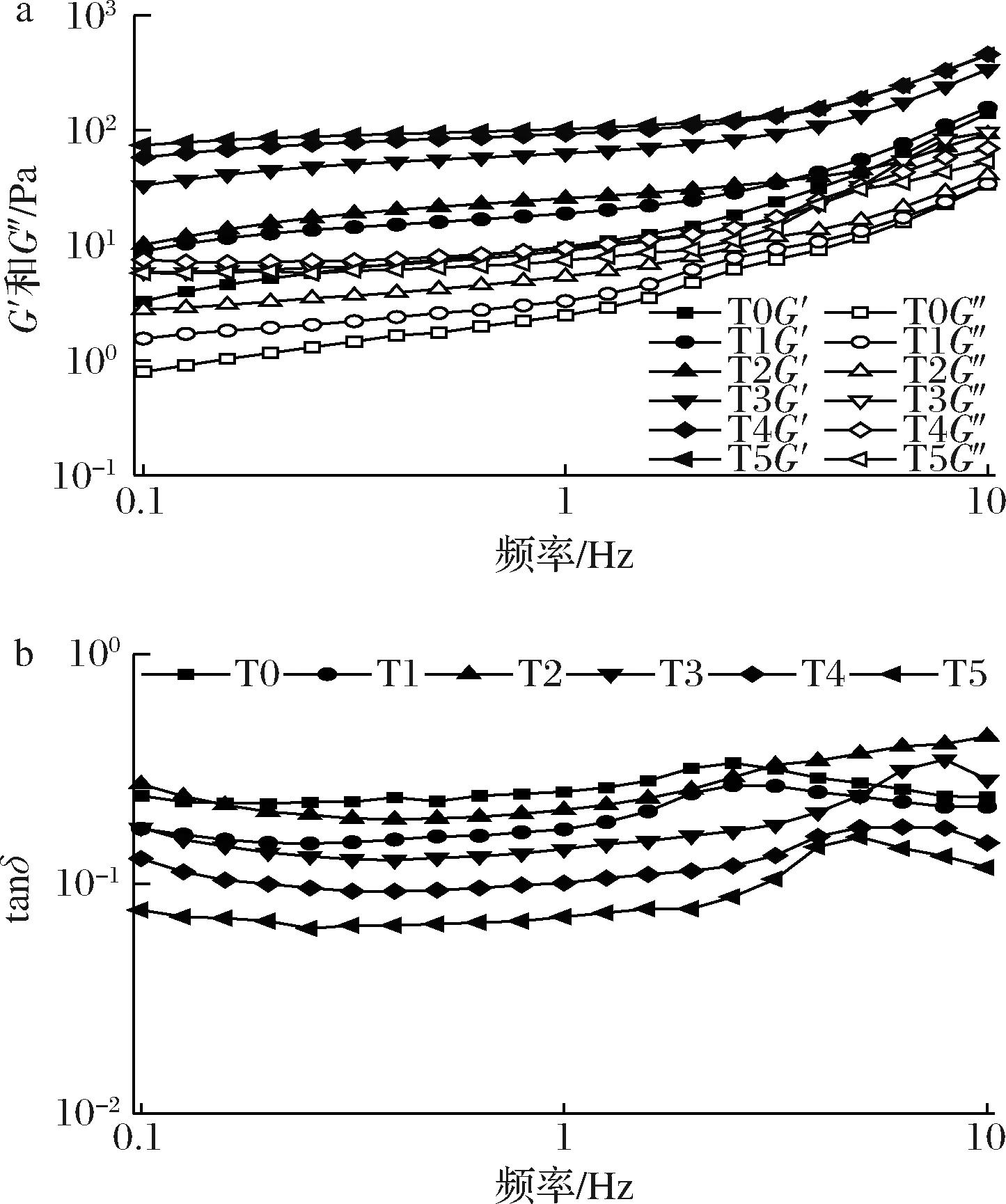
a-频率扫描;b-损耗因子
图4 不同交联度(T0~T5)明胶稳定乳液的频率扫描和损耗因子
Fig.4 The frequency sweep and loss tangent of gelatin stabilized emulsions with different crosslinking degrees (T0-T5)
G′和G″对频率的依赖性可用于评价乳液体系中存在的结构类型。为了考察G′和G″对频率的依赖程度,通过幂律模型(G′=K′ fn′,G″=K″ fn″)对乳液在频率扫描过程中的动态模量变化进行了拟合,结果如表2所示。
表2 不同交联度(T0~T5)明胶制备的乳液储能模量(G′)和损失模量(G″)的幂律方程拟合参数
Table 2 The parameters to the power-law model of the storage modulus and loss modulus for emulsions prepared by gelatin with different crosslinking degree (T0-T5)
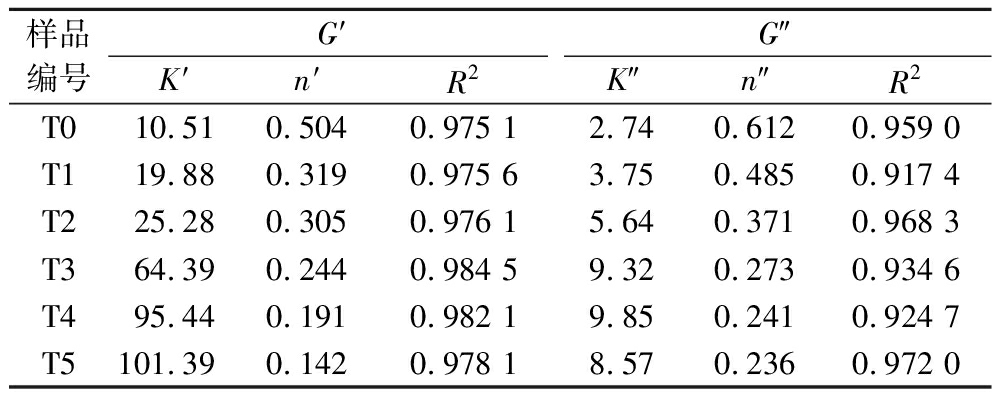
样品编号G′G″K′n′R2K″n″R2T010.510.5040.975 12.740.6120.959 0T119.880.3190.975 63.750.4850.917 4T225.280.3050.976 15.640.3710.968 3T364.390.2440.984 59.320.2730.934 6T495.440.1910.982 19.850.2410.924 7T5101.390.1420.978 18.570.2360.972 0
对G′进行拟合的相关性较G″更好,因此对弹性模量拟合所得参数更为可靠,主要对G′拟合结果进行分析。K′值反映了凝胶基质中分子相互作用的水平,随着交联度的增大,明胶乳液的K′值呈现出增大趋势,这表明明胶分子之间的相互作用增强,且当交联度达到T3时,K′值的增幅更大,这表明交联度的增加对乳液体系的弹性特征影响更大,较高交联度的明胶微凝胶乳液拥有更强的凝胶结构[19]。n′值表示凝胶网络性质,n>0表示形成的是弱物理凝胶,所有乳液样品0<n<1,这表明所有样品均为弱凝胶,与表观黏度的拟合结果一致。此外,随着交联度增大,n′逐渐减小,较低的n′代表较高的物理交联程度和更稳定的蛋白质网络,因此推测这可能是因为随着交联度的增大,明胶颗粒之间的相互作用增强,有利于明胶颗粒在油水界面形成有序稳定的界面网络结构,这些界面网络结构有助于乳液形成更强更具弹性的凝胶结构,进而导致乳液的稳定性提升。
2.5 温度扫描分析
温度对乳液样品稳定性的影响可以通过温度扫描来探索。升温(25~95 ℃)和降温(95~25 ℃)过程中明胶微凝胶乳液样品的G′和G″随温度变化的情况如图5所示。
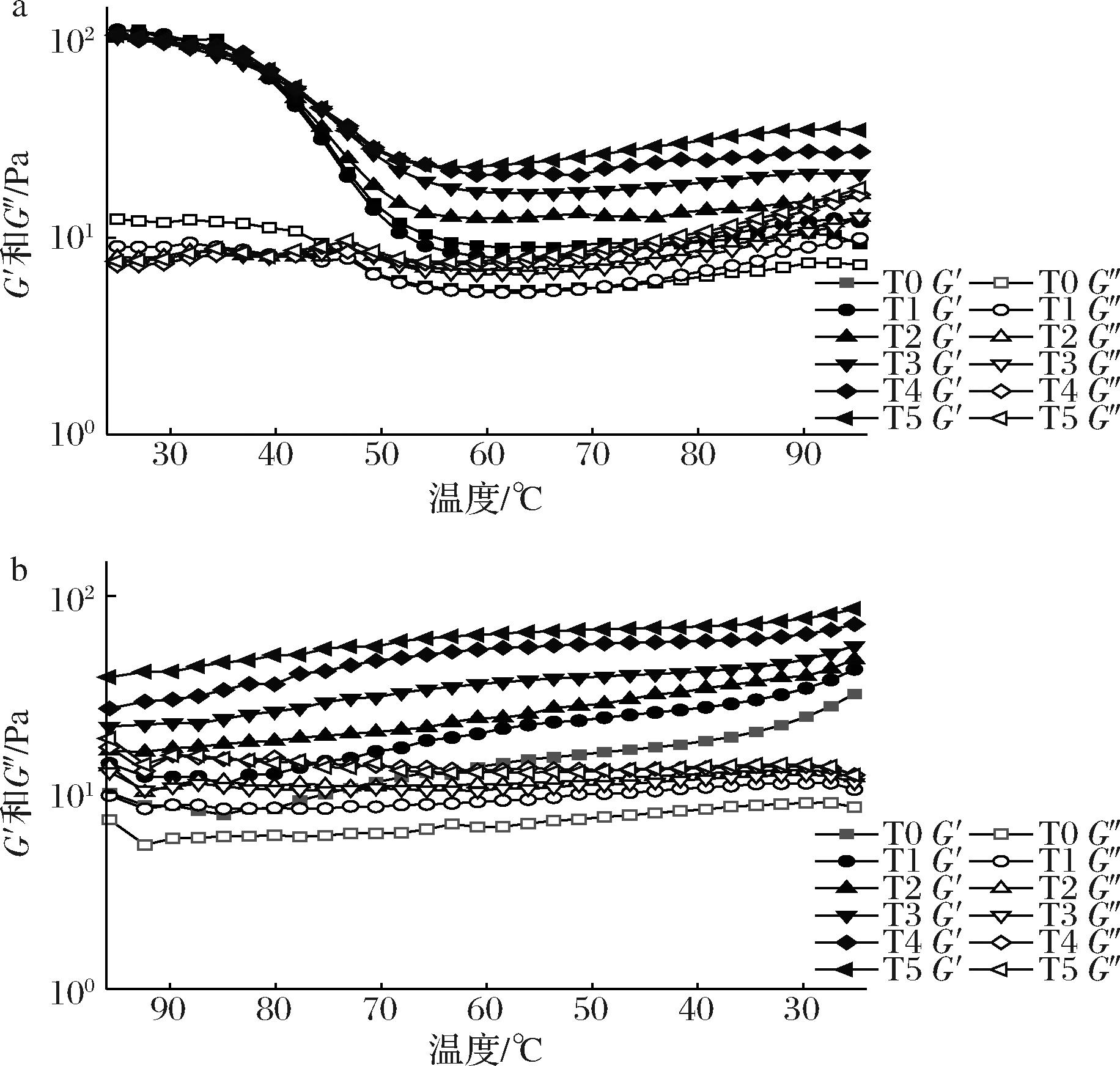
a-升温过程;b-降温过程
图5 不同交联度(T0-T5)明胶稳定乳液的温度扫描
Fig.5 The temperature sweep of gelatin stabilized emulsions with different crosslinking degrees (T0-T5)
升温过程中(图5-a),所有样品的G′随着温度升高呈现出先降低后趋于平缓的变化趋势,但是不同交联度明胶微凝胶乳液之间的变化程度有所不同,具体而言,随着交联度的升高,G′的下降程度逐渐减小,当交联度达到6.85%后(T3~T5),G′对温度变化的敏感性降低,其下降幅度明显减小,较高交联度的明胶微凝胶乳液G′值相对更大。这表明在TG酶催化作用下,交联度的增大有助于增强乳液的弹性特征和耐温性,这可能是由于TG酶的交联作用增强了乳液的网络结构,CHEN等[20]的研究也得出TG酶交联后乳液的凝胶强度和耐温性都增强。为了探索热可逆性和潜在的实际应用,在温度从95 ℃降至25 ℃的处理下,对模量进行了温度循环测试,结果如图5-b所示。所有乳液样品的G′和G″均随温度的降低而升高,且所有样品的G′值均高于G″值,说明样品仍处于类固体状态,均具有可恢复的网络结构。不同交联度乳液样品的G′值随着温度下降而呈现出不同的上升趋势,可以发现,随着交联度增大,乳液的G′值不断增大,且在较高交联度下乳液保持着更高的G′值。
此外,如表3所示,在经历加热和冷却循环过程后,不同交联度明胶微凝胶乳液的回复率不断上升。总体而言,相同温度下,较高交联度的明胶微凝胶乳液在加热和冷却过程中都保持着更大的G′值,且回复率更高。这意味着随着交联度的增大,乳液体系形成了更强的凝胶结构,有利于提高乳液抵抗温度变化而带来结构变化的能力。这可能是因为高温下液滴流动性增强,液滴间的碰撞增强,乳液结构容易受到破坏,而交联度的增大使明胶分子间的缠结增强,这有利于凝胶网络结构的增强;此外,明胶微凝胶颗粒吸附在油-水界面形成致密的黏弹性界面膜,不仅为乳液液滴提供了较强的空间屏障有效阻碍了液滴的聚集,另一方面这些界面网络结构还可以促进液滴之间的相互作用,形成液滴-液滴的三维网络结构,从而使乳液形成了更强的凝胶结构,导致乳液具有更高的耐温性[21]。
表3 不同交联度(T0~T5)明胶稳定乳液G′的回复率
Table 3 Recovery degree of storage modulus of gelatin stabilized emulsions with different crosslinking degrees (T0-T5)
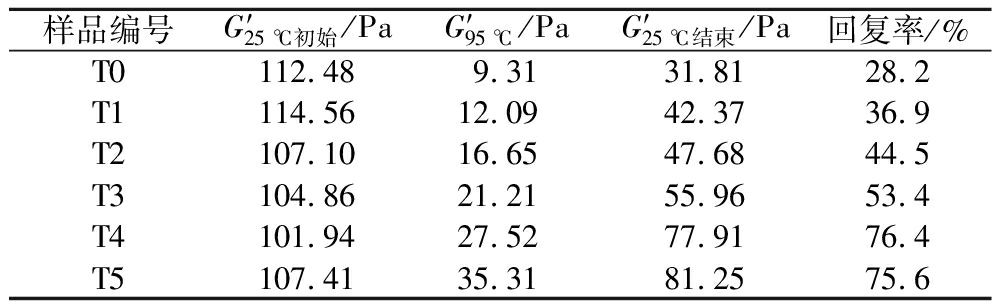
样品编号G′25 ℃初始/PaG′95 ℃/PaG′25 ℃结束/Pa回复率/%T0112.489.3131.8128.2T1114.5612.0942.3736.9T2107.1016.6547.6844.5T3104.8621.2155.9653.4T4101.9427.5277.9176.4T5107.4135.3181.2575.6
2.6 乳液的ζ电位分析
ζ电位的大小可以用来表示液滴间的静电作用,ζ电位绝对值越大,液滴之间的静电排斥力越大,较大的静电排斥作用有利于明胶颗粒更好的分散,从而有利于连续相中颗粒网络的形成[22]。不同交联度明胶微凝胶乳液的ζ电位结果如图6所示,随着交联度的增大,乳液的ζ电位绝对值不断增大,该结果与CHEN等[23]的研究结果相似;另外在较低交联度下(T1),乳液体系的ζ电位与未交联明胶乳液(T1)之间不存在显著差异,而当交联度达到6.85%时(T3),乳液的ζ电位绝对值显著升高,随着交联度的进一步增大,乳液体系的电位值之间不存在明显差异。这表明,随着交联度的增大,乳液体系中液滴之间的静电排斥增强。这可能是由于当交联度较低时,TG酶催化明胶交联消耗的氨基数量较少;而当交联度较高时,TG酶催化明胶交联消耗的氨基数量较多,氨基含量的减少使正电荷的数量减少,从而使乳液液滴表面的负电荷含量相对增加,油滴之间静电排斥力增强,从而有利于明胶颗粒在连续相中形成更为坚固的网络结构。
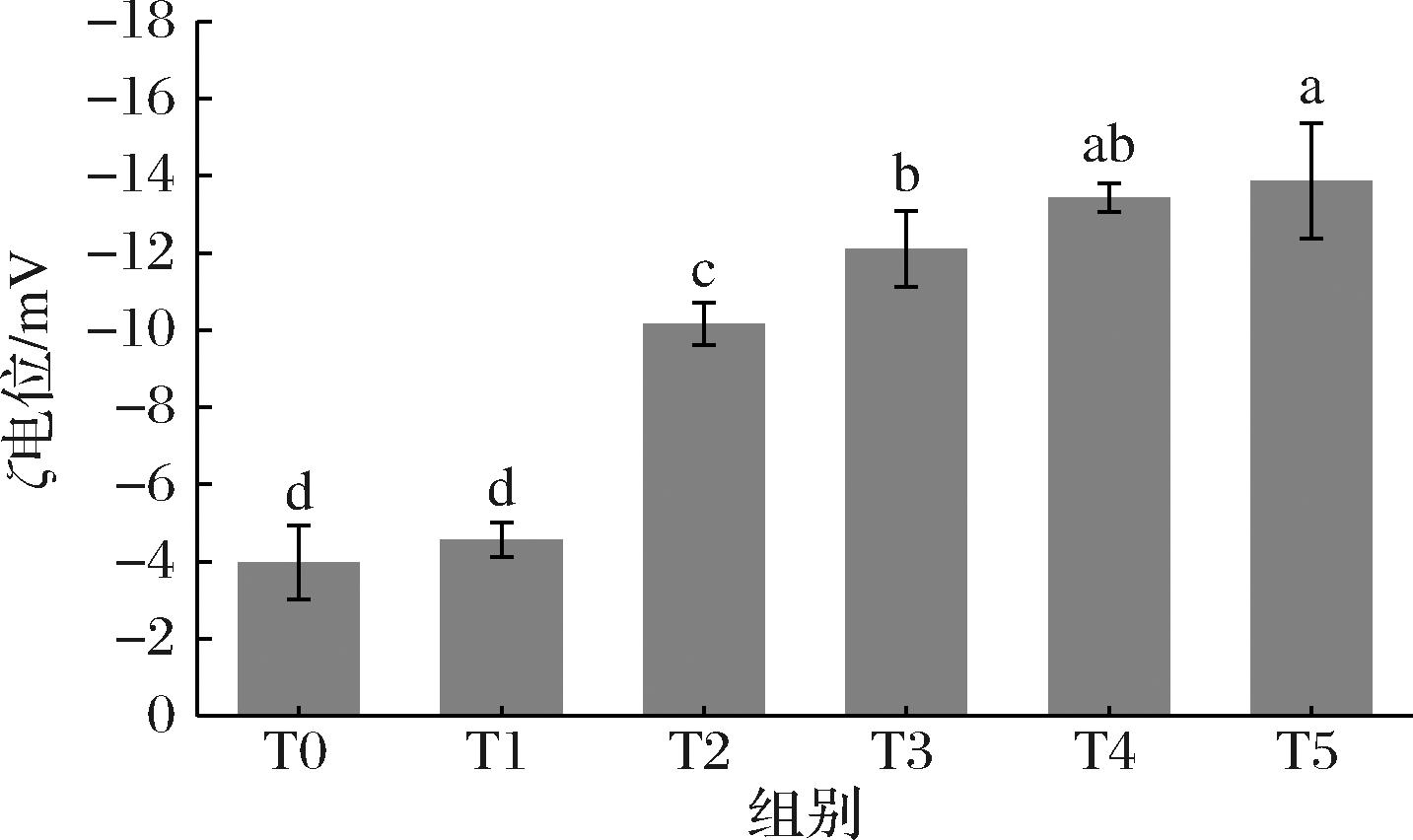
图6 不同交联度(T0~T5)明胶稳定乳液的ζ电位
Fig.6 The zeta potential of gelatin stabilized emulsions with different crosslinking degrees (T0-T5)
2.7 乳液微观结构分析
采用CLSM观察不同交联度明胶微凝胶Pickering乳液中的蛋白颗粒分布和乳液微观结构,结果如图7所示,其中蓝色代表明胶,红色代表油相。
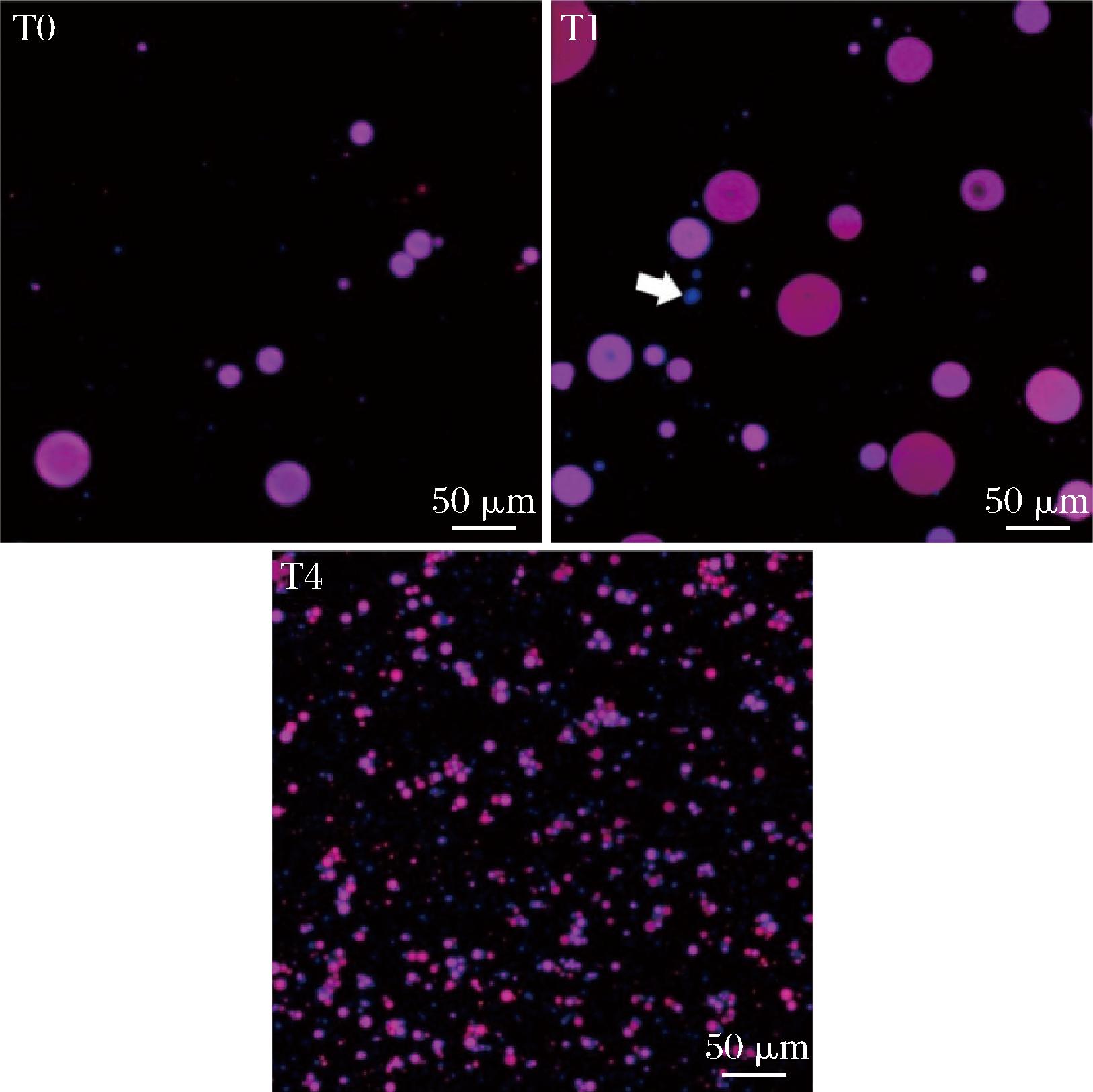
图7 不同交联度(T0、T1、T4)明胶稳定乳液的激光共聚焦图像
Fig.7 The CLSM images of gelatin stabilized emulsions with different crosslinking degrees (T0, T1, T4)
注:标尺为50 μm。
根据流变测试的结果,交联度越高越有利于形成更强的连续相网络,所以主要用未交联(T0)、低交联度(T1)和高交联度(T4)的乳液进行对比,观察其微观结构的差异,进一步验证流变分析的结果。随着交联度的升高,液滴的粒径明显减小。对于T0组的乳液,观察到仅有少量明胶微凝胶颗粒吸附在油-水界面上,T1组界面处吸附蛋白量略有增加,但与T0组差异不大;然而在T4组乳液中可以观察到大量的蛋白覆盖在油-水界面处并形成致密的界面颗粒膜,这有利于形成高稳定性的乳液结构。随着交联度的增大,尤其是在较高交联度下,覆盖在油-水界面处的蛋白颗粒含量明显增多,这可能是TG酶的共价交联促进了吸附在油滴表面的颗粒之间的相互作用,从而形成致密稳定的界面网络结构;此外,液滴界面颗粒的增多有助于促进液滴之间的相互作用,使乳液体系形成更强的整体网络结构[24]。另外,T1组乳液中还观察到明胶微凝胶颗粒聚集体的存在(如T1中箭头所示),这可能是由于颗粒-颗粒之间静电排斥作用较低,不利于连续相中颗粒网络的形成;然而较高交联度的乳液体系静电排斥作用较强,这有利于颗粒在连续相中的分散,从而有利于连续相中颗粒网络结构的形成。
3 结论
通过对乳液的流变行为、电位和微观结构的测定,研究了不同TG酶交联度对明胶微凝胶Pickering乳液连续相结构的影响。流变结果显示,当交联度达到6.85%以上(T3~T5),乳液连续相中形成更强的凝胶网络结构。主要表现为,随着交联度增加,明胶微凝胶乳液表观黏度、屈服应力值均增大;在较高交联度时(T3~T5),G′增大,损耗因子减小;温度扫描显示TG酶交联后的乳液具有更好的耐温性,温度循环测试回复率更高。此外,交联度的增加使得乳液体系的电位升高,静电排斥作用增强,较大的静电排斥作用可能有利于连续相中颗粒网络的形成。乳液微观结构的结果进一步证实,随着交联度的增大,明胶颗粒形成了更致密的界面蛋白膜,使得液滴之间相互作用增强形成更强的凝胶结构,最终导致乳液稳定性提升。因此,通过TG酶交联后的明胶微凝胶在连续相中形成了更坚固的网络结构,所制成的Pickering乳液更为稳定。这为明胶微凝胶乳液在蛋黄酱、奶油以及3D打印食品中的应用提供了理论基础,但是关于TG酶交联后的明胶微凝胶对Pickering乳液油-水界面蛋白膜形成的影响机制还有待进一步探究。
[1] BINKS B P.Particles as surfactants—Similarities and differences[J].Current Opinion in Colloid &Interface Science, 2002, 7(1-2):21-41.
[2] FENG X, DAI H J, MA L, et al.Properties of Pickering emulsion stabilized by food-grade gelatin nanoparticles:Influence of the nanoparticles concentration[J].Colloids and Surfaces.B, Biointerfaces, 2020, 196:111294.
[3] 王欣欣, 吴霞, 李德富, 等.明胶纳米颗粒稳定的Pickering乳液的制备及表征[J].食品与发酵工业, 2023, 49(1):124-131.WANG X X, WU X, LI D F, et al.Preparation and characterization of Pickering emulsion stabilized by gelatin nanoparticles[J].Food and Fermentation Industries, 2023, 49(1):124-131.
[4] FENG X, DAI H J, MA L, et al.Food-grade gelatin nanoparticles:Preparation, characterization, and preliminary application for stabilizing Pickering emulsions[J].Foods, 2019, 8(10):479.
[5] DU J, DAI H J, WANG H X, et al.Preparation of high thermal stability gelatin emulsion and its application in 3D printing[J].Food Hydrocolloids, 2021, 113:106536.
[6] DICKINSON E.Use of nanoparticles and microparticles in the formation and stabilization of food emulsions[J].Trends in Food Science &Technology, 2012, 24(1):4-12.
[7] LIU F, TANG C H.Phytosterol colloidal particles as Pickering stabilizers for emulsions[J].Journal of Agricultural and Food Chemistry, 2014, 62(22):5133-5141.
[8] XIAO J, WANG X A, PEREZ GONZALEZ A J, et al.Kafirin nanoparticles-stabilized Pickering emulsions:Microstructure and rheological behavior[J].Food Hydrocolloids, 2016, 54:30-39.
[9] KWAK H W, PARK J, YUN H, et al.Effect of crosslinkable sugar molecules on the physico-chemical and antioxidant properties of fish gelatin nanofibers[J].Food Hydrocolloids, 2021, 111:106259.[10] FANG M, XIONG S, HU Y, et al.In vitro pepsin digestion of silver carp (Hypophthalmichthys molitrix) surimi gels after cross-linking by Microbial Transglutaminase (MTGase)[J].Food Hydrocolloids, 2019,95:152-160.
[11] NIU F, NIU D, ZHANG H, et al.Ovalbumin/gum arabic-stabilized emulsion:Rheology, emulsion characteristics, and Raman spectroscopic study[J].Food Hydrocolloids, 2016,52:607-614.
[12] DING X Y, ZENG N, ZHANG G W, et al.Influence of transglutaminase-assisted ultrasound treatment on the structure and functional properties of soy protein isolate[J].Journal of Food Processing and Preservation, 2019,43(11):e14203.
[13] JO Y J, CHU Y F, CHEN L Y.Enhanced stabilization of oil-in-water (O/W) emulsions by fibrillar gel particles from lentil proteins[J].Food Research International, 2023, 172:113203.
[14] MARTIN-PI ERO M J, GARC
ERO M J, GARC A M C, MU
A M C, MU OZ J, et al.Influence of the welan gum biopolymer concentration on the rheological properties, droplet size distribution and physical stability of thyme oil/W emulsions[J].International Journal of Biological Macromolecules, 2019, 133:270-277.
OZ J, et al.Influence of the welan gum biopolymer concentration on the rheological properties, droplet size distribution and physical stability of thyme oil/W emulsions[J].International Journal of Biological Macromolecules, 2019, 133:270-277.
[15] WANG H X, HU L D, PENG L, et al.Dual encapsulation of β-carotene by β-cyclodextrin and chitosan for 3D printing application[J].Food Chemistry, 2022, 378:132088.
[16] MALDONADO-ROSAS R, TEJADA-ORTIGOZA V, CUAN-URQUIZO E, et al.Evaluation of rheology and printability of 3D printing nutritious food with complex formulations[J].Additive Manufacturing, 2022, 58:103030.
[17] ZHANG P, BAO Z Y, WANG H, et al.Ultrasonic pretreatment improved the physicochemical properties and riboflavin delivery ability of transglutaminase-catalyzed soy protein isolate gel[J].Food Hydrocolloids, 2022, 131:107782.
[18] DJOULLAH A, HUSSON F, SAUREL R.Gelation behaviors of denaturated pea albumin and globulin fractions during transglutaminase treatment[J].Food Hydrocolloids, 2018, 77:636-645.
[19] LEVY R, OKUN Z, DAVIDOVICH-PINHAS M, et al.Utilization of high-pressure homogenization of potato protein isolate for the production of dairy-free yogurt-like fermented product[J].Food Hydrocolloids, 2021, 113:106442.
[20] CHEN Y F, GAO X J, SU W M, et al.Insight into transglutaminase cross-linking induced gel strength and thermal stability improving of gelatin-based emulsion-filled gels[J].International Journal of Food Science &Technology, 2023, 58(6):2909-2920.
[21] HU L, DING F, LIU W, et al.Effect of enzymatic-ultrasonic hydrolyzed chitooligosaccharide on rheology of gelatin incorporated yogurt and 3D printing[J].Food Hydrocolloids, 2022,132:107851.
[22] CAO C A, FENG Y Y, KONG B H, et al.Transglutaminase crosslinking promotes physical and oxidative stability of filled hydrogel particles based on biopolymer phase separation[J].International Journal of Biological Macromolecules, 2021, 172:429-438.
[23] CHEN Y F, SUN Y, MENG Y L, et al.Synergistic effect of microfluidization and transglutaminase cross-linking on the structural and oil-water interface functional properties of whey protein concentrate for improving the thermal stability of nanoemulsions[J].Food Chemistry, 2023, 408:135147.
[24] ZOU Y, GUO J, YIN S W, et al.Pickering emulsion gels prepared by hydrogen-bonded zein/tannic acid complex colloidal particles[J].Journal of Agricultural and Food Chemistry, 2015, 63(33):7405-7414.