麦角硫因(ergothioneine, EGT)是于1909年首次在麦角菌(Claviceps purpurea)中被发现的含硫组氨酸衍生物[1],极易溶于水,在生理pH下通常以硫酮的形式存在[2]。麦角硫因作为一种天然的抗氧化剂,可通过降低细胞内活性氧水平,保护一些重要细胞和组织免受氧化损伤。此外,它在治疗癌症、糖尿病和心血管疾病等方面也具有积极作用,因此被广泛用作膳食补充剂和化妆品添加剂[3-5]。目前以可食用蕈菌为原料或以化学合成法制备麦角硫因的周期长、成本高,且收率低[6-8],这2种方法均不适用于工业生产,使其在各领域的应用受到限制。目前,采用微生物合成法制备麦角硫因因副产物少、可持续性好、经济效益高而成为研究热点。
自然界中存在真核和原核生物麦角硫因合成途径[9]。在原核生物耻垢分枝杆菌(Mycobacterium smegmatis)中,麦角硫因的合成途径由基因簇egtA、egtB、egtC、egtD和egtE编码的5种酶催化(图1)。而真核生物的麦角硫因合成途径仅需要2个关键基因egt1和egt2,更为简洁高效(图1)。在粗糙脉孢菌(Neurospora crassa)中鉴定到的麦角硫因合成基因NcEgt1和NcEgt2分别与egtD、egtB和egtE都有着同源性[10],其中具有多结构域的蛋白Egt1可一步催化组氨酸到组氨酸三甲基内盐基半胱氨酸亚砜(hercynylcysteine sulfoxide, Cys-HER)的转化,接着经PLP结合型C-S裂解酶Egt2的催化得到麦角硫因[11]。迄今,多种微生物内鉴定到的麦角硫因合成酶及完整生物合成途径的阐明为代谢工程构建高效产麦角硫因工程菌株提供了一定的参考;而酿酒酵母作为一种公认安全的(generally recognized as safe,GRAS)微生物,具有生物安全性高、遗传背景清晰、发酵工艺成熟和易大规模培养等特点,常作为代谢工程首选的底盘细胞之一。
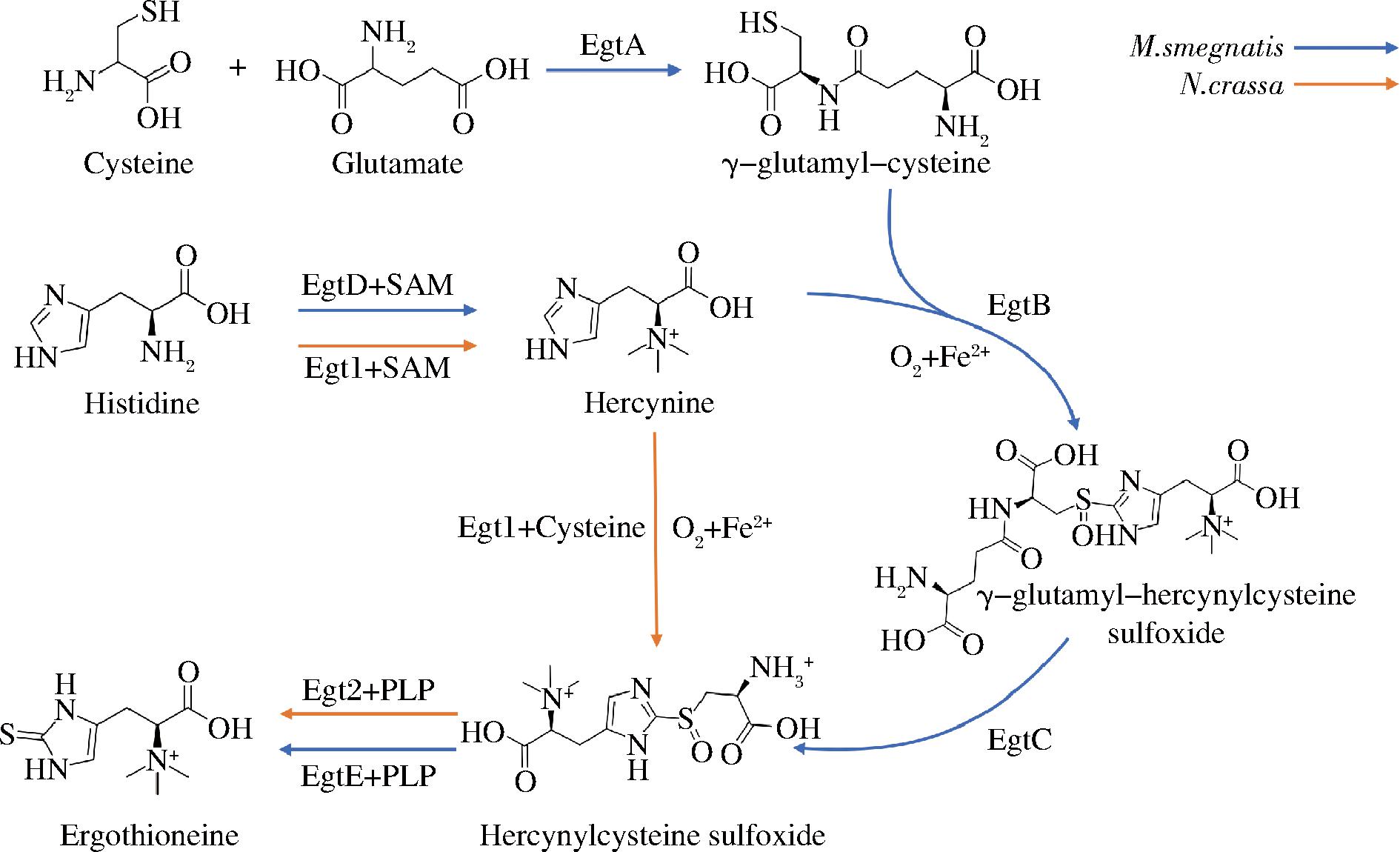
图1 麦角硫因生物合成途径[15]
Fig.1 Biosynthesis pathway of ergothioneine[15]
目前,已经研究对微生物进行了工程改造用于生产麦角硫因。其中较多研究表明,向培养基中添加一定量的组氨酸能有效提高工程菌中麦角硫因的产量,TANAKA等[12]发现补充5 mmol/L的组氨酸能显著提高大肠杆菌麦角硫因产量至240 mg/L;YU等[13]发现向酿酒酵母提供约10 mmol/L的组氨酸时,可使产量提高至少4~5 mg/L;ALAMGIR等[14]还观察到向甲基杆菌提供10 mmol/L组氨酸和半胱氨酸时,麦角硫因产量可提高一倍。综上,补充一定量的组氨酸对于产量的提高十分有利,但添加10 mmol/L及以上的组氨酸不适合作为大规模生产麦角硫因的有效手段[14]。因此,获得能在低组氨酸添加量的同时实现麦角硫因高效合成的工程菌具有重要意义。
VAN DER HOEK等[15]工作中指出NcEgt1和CpEgt2异源基因的组合能实现麦角硫因产量的最大化,因此,本研究通过CRISPR/Cas9基因编辑技术向酿酒酵母基因组中引入2个异源酶基因NcEgt1和CpEgt2,构建具有完整麦角硫因生物合成途径的工程菌株;并进一步对特异性组氨酸转运蛋白基因HIP1[16-17]进行过表达,以探究HIP1对麦角硫因产量的影响,为异源合成麦角硫因工程菌株的构建提供参考。
1 材料与方法
1.1 菌株与质粒
本实验所用的菌株及质粒如表1所示。
表1 本文所用质粒和菌株
Table 1 Plasmids and strains used in this study

名称特征来源质粒pML104包含Cas9蛋白及gRNA表达盒,URA3筛选标记实验室保藏pML104-Chr XII包含靶向XII染色体的gRNA表达盒本研究pML104-Chr XI包含靶向XI染色体的gRNA表达盒本研究pML104-Chr X包含靶向X染色体的gRNA表达盒本研究pUC57-ADH1p-CYC1tpUC57衍生质粒,包含ADH1启动子和CYC1终止子本研究pUC57-ADH1p-CYC1t-egt1pUC57衍生质粒,包含基因NcEgt1 本研究pUC57-H1-ADH1p-CYC1t-egt1-H2pUC57衍生质粒,包含XII染色体插入位点两端同源臂序列本研究pTEF2用于构建Donor DNA片段实验室保藏pTEF2-egt2pTEF2衍生质粒,包含基因CpEgt2本研究pTEF2-H1-egt2-H2pTEF2衍生质粒,包含XI染色体插入位点两端同源臂序列本研究pTEF2-HIP1pTEF2衍生质粒,包含基因HIP1本研究pTEF2-H1-HIP1-H2pTEF2衍生质粒,包含X染色体插入位点两端同源臂序列本研究菌株S.cerevisiae CEN.PK113-5D表达菌株,Mata ura3-52 His3 LEU2 TRP1 MAL2-8c SUC2实验室保藏E.coli JM110克隆菌株实验室保藏E1S.cerevisiae CEN.PK113-5D整合NcEgt1本研究E2S.cerevisiae CEN.PK113-5D整合NcEgt1和CpEgt2本研究E3S.cerevisiae CEN.PK113-5D 整合NcEgt1, CpEgt2和HIP1本研究
1.2 培养基
LB培养基(g/L):酵母粉5,胰蛋白胨10,NaCl 10,如配制固体培养基需另加入20 g/L琼脂粉。
YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母粉10。
尿嘧啶省却培养基(g/L):葡萄糖20,酵母氮源基础6.7,DO Supplement-Ura 1.29,琼脂25。
5-氟-乳清酸筛选培养基(g/L):葡萄糖20,酵母氮源基础6.7,DO Supplement-Ura 1.29,尿嘧啶0.2,5-氟乳清酸(5-fluoroorotic acid,5-FOA)1,琼脂20。
1.3 质粒与菌株构建
1.3.1 重组pML104质粒构建
选择pML104质粒上的Bcl I和Swa I位点进行双酶切;基于CRISPOR(http://crispor.tefor.net/)提供的预测引导序列,设计并合成靶向酵母基因组整合位点的gRNA寡链片段(表2),将gRNA-F和gRNA-R杂交并采用T4连接酶与线性化载体pML104进行连接,得到重组pML104-Chr Ⅻ,pML104-Chr Ⅺ和pML104-Chr X。
表2 本研究所用的引物
Table 2 Primers used in this study

引物引物序列 (5′-3′)gRNA-Chr Ⅻ-FGATCTATCTTGCACATCACATCAGGTTTTAGAGCTAGgRNA-Chr Ⅻ-RCTAGCTCTAAAACCTGATGTGATGTGCAAGATAgRNA-Chr Ⅺ-FGATCGTAGAAATCAGACGCACGCTGTTTTAGAGCTAGgRNA-Chr Ⅺ-RCTAGCTCTAAAACAGCGTGCGTCTGATTTCTACgRNA-Chr X-FGATCTGCATAATCGGCCCTCACAGGTTTTAGAGCTAGgRNA-Chr X-RCTAGCTCTAAAACCTGTGAGGGCCGATTATGCANcEgt1-FACAATCAACTAAGCTATGCCATCTGCTGAATCTATGACTCCNcEgt1-RCGCCAGTGTGATGGATATGAATTTCACAAATCTCTAACAACTCChr Ⅻ-H1-FGTAATTCGCGGATCCATCTGATTCCAAGGAGAGTGAAAGAGCChr Ⅻ-H1-RCAAAAGGATTGCACTGCAGTGCCTGGTGGCATTTGCAAAATChr Ⅻ-H2-FATTTGCACGCGTCGACAGGTTACTTGCATGCATTTCGChr Ⅻ-H2-RCCAAGCTCCGCTCGAGATCATACTCCATACCTTCTTCCpEgt2-FCACTAGTTCTAGACCCCCGAATTATGGGTTTGTTGGAAGGTGCpEgt2-RTATCCTGCAGCCCGGGGGATCTTACTCAACTGGTTGTGGChr Ⅺ-H1-FCGGCCAGTAATTCGCGGATCCTCAGTAAAGCCTAAGCATChr Ⅺ-H1-RGAAACATTTTGAAGCTATGAGCTCGGAAAACTAATCAGTTAGATGTGChr Ⅺ-H2-FGAAGGCTTTAATTTGCGGCCGGTACCAGATCATTATTAAACTGTTChr Ⅺ-H2-RTTACGCCAAGCTCCGCTCGAGACCAGCAGATAATGCATGCHIP1-FCTAGTTCTAGACCCCCGAATTATGCCTAGAAACCCATTGHIP1-RATATCCTGCAGCCCGGGGGATCTCAACACCAGAAATGTChr X-H1-FGTACTGAGAGTGCACCATATGAGAGAGAGACGAGTTAAGTATGChr X-H1-RGAAACATTTTGAAGCTATGAGCTGACGGCAAATAGATGCGChr X-H2-FGCTTTAATTTGCGGCCGGTACTCATACTATTCCTCCGCTCGChr X-H2-RATTACGCCAAGCTCCGCTCGAGGACGCCACCAAGACAATATChr Ⅻ-FGGTAGCAATGTCAGTGATCATAGCAGChr Ⅻ-RGCTAAGAGAGCAACTAAAGGAAGCChr Ⅺ-FGTGCTTGATTTGCGTCATTCChr Ⅺ-RCACATTGAGCGAATGAAACGqENO1-FTCTTCAAGGACGGTAAGTACGAqENO1-RACAGTCAAGTCATCAGCAACAAqHIP1-FACGGCGGTTACATTGGTGGTAqHIP1-RGCAGCGGAGACAGCAGTCATqNcEgt1-FCTAACGGCACCACCAATTCTGTqNcEgt1-RATAAGCAGCACAACCAGCCAATqCpEgt2-FTGCTGCTCCTTCTGCTGCTAqCpEgt2-RCGGCGGCTTCATAATCTTGTTC
1.3.2 Donor DNA片段的构建
经密码子优化的NcEgt1和CpEgt2基因片段由生工生物工程(上海)股份有限公司合成,HIP1基因片段以酵母基因组为模板扩增获得。用引物对NcEgt1-F/NcEgt1-R扩增出目的基因后,采用ClonExpress® Ultra One Step Cloning Kit一步克隆试剂盒将其连接在质粒pUC57-ADH1p-CYC1t上,用限制酶EcoR Ⅰ和Hind Ⅲ酶切得到基因表达盒ADH1p-NcEgt1-CYC1t片段,上下游同源臂H1和H2以酵母基因组为模板分别通过引物H1-F/H1-R、H2-F/H2-R扩增获得,以上3个片段及载体骨架再通过多片段克隆得到重组质粒pUC57-H1-ADH1p-NcEgt1-CYC1t-H2并转化至大肠杆菌JM110感受态细胞中,挑取转化子进行菌落PCR鉴定,将鉴定正确的转化子送往昆泰锐(武汉)生物技术有限责任公司测序。最终质粒用限制酶BamH Ⅰ和Xho Ⅰ对其进行酶切并纯化,即得到用于表达目的基因的Donor DNA片段。所有构建质粒均经测序验证正确,所用引物详见表2。
1.3.3 酿酒酵母转化及重组菌株筛选
利用LiAc转化法将重组pML104质粒和Donor DNA片段共转化至酿酒酵母菌株5D感受态细胞中,用省却尿嘧啶平板筛选阳性克隆子并测序鉴定,成功整合目的基因重组菌株涂布于5-FOA筛选平板进行反筛,所得质粒丢失的重组菌株用于下一轮基因编辑。
1.4 产麦角硫因酵母工程菌株的发酵培养
1.4.1 摇瓶发酵
将成功构建的重组菌株接种于50 mL YPD培养基中过夜预培养(30 ℃、200 r/min),按照OD600=1.0将其接种到新鲜的50 mL YPD培养基中进行摇瓶发酵(30 ℃、200 r/min),分别于12、24、48、72 h取样,测定麦角硫因含量以及OD600值,所有实验重复3次。
1.4.2 5 L发酵罐补料发酵
菌株活化后,将种子液接种到装有2 L YPD培养基(含76 mg/L组氨酸)的5 L发酵罐中(OD600=0.85)。发酵周期为72 h,温度30 ℃,通过流加KOH(2 mol/L),pH维持5.0±0.2,搅拌转速500~1 200 r/min,溶氧设定为40%并与转速关联控制。发酵22 h后流加葡萄糖,发酵24 h后一次性补加组氨酸0.5 mmol/L。
1.5 RT-qPCR检测基因的表达量
酿酒酵母工程菌的总RNA用TIANGEN的RNA simple Total RNA Kit提取,接着采用HiScript® Ⅱ Q RT Super Mix for qPCR (+gDNA wiper)去除基因组DNA并逆转录合成cDNA,再采用ChamQ Universal SYBR qPCR Master Mix(Vazyme)进行RT-qPCR实验。对菌株中目的基因和内参基因ENO1进行PCR扩增,所得数据通过2-△△Ct方法进行处理。
1.6 分析方法
1.6.1 液相色谱-质谱联用(LC-MS)鉴定麦角硫因
液相分析条件:色谱柱Welch Ultimate® HILIC Amphion Ⅱ(5 μm×250 mm×4.6 mm),柱温30 ℃。流动相A为乙腈,流动相B为0.1%甲酸水溶液,梯度洗脱程序:0~15 min,20%~40%B;15~20 min,40%~20%B;20~25 min,20%B;流速1.0 mL/min,进样量10 μL。
质谱分析条件:离子源为ESI 源,正离子扫描模式;喷雾电压4.2 kV;毛细管温度350 ℃,辅气加热温度350 ℃;S-lens RF电压50 V;辅助气(N2)流速为10 AUs,鞘气(N2)流速为40AUs。
1.6.2 LC- MS检测组氨酸含量
液相分析条件:色谱柱Agilent Eclipse Plus C18 RRHD (1.8 μm ×2.1 mm × 50 mm),柱温25 ℃,流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈,梯度洗脱程序:0~1.00 min,10%B;1.00~1.01 min,10%~25%B;1.01~13.00 min,25%~65%B;13.00~13.01 min,65%~90%B;13.01~16.00 min,90%B;16.00~16.01 min,90%~10%B;流速0.2 mL/min,进样量1 μL。
质谱分析条件:喷雾电压3.5 kV,辅助气(N2)流速为10 AUs,鞘气(N2)流速为40 AUs,源区温度350 ℃,碰撞能35 eV。
1.6.3 HPLC法检测麦角硫因含量
检测条件同1.6.1节液相分析条件。
1.6.4 麦角硫因样品处理
发酵结束后,发酵液经离心(3 000 r/min,5 min)保留菌体与上清液。将菌体重悬于体积分数50%乙醇中进行破壁处理(50 ℃水浴30 min),然后离心取上清液(12 000 r/min,5 min),滤膜过滤(0.22 μm)后用于HPLC及LC-MS检测。
1.6.5 组氨酸样品处理
100 μL胞内或胞外样品加入50 μL PITC-乙腈混合溶液和50 μL三乙胺-乙腈混合溶液,室温静置1 h后加入200 μL正己烷,充分混匀室温静置10 min后取下层液体进行组氨酸检测。
2 结果与分析
2.1 麦角硫因合成途径在酿酒酵母菌株中的构建
真菌麦角硫因合成途径仅需2个关键酶,更简洁高效的合成途径有利于后续的代谢调控及减少代谢中间体的分流,这里选择了适合酿酒酵母做底盘的异源基因组合[15],即来自粗糙脉孢霉(Neurospora crassa)的NcEgt1基因(GenBank accession:XP_956324.3)和来自麦角菌(Clavieps purpurea)的CpEgt2基因(GenBank accession:CCE33140.1)。
将构建成功的重组pML104质粒和Donor DNA片段共转化至出发菌株S.cerevisiae 5D中,分别以挑取的阳性转化子和对照菌株进行PCR鉴定(图2-a),成功在敲入位点整合NcEgt1基因表达盒后扩增产物为5 252 bp,后续测序验证及丢失质粒后,得到酿酒酵母工程菌株E1。发酵培养菌株E1,采用UPLC-Q-Exactive Orbitrap MS对菌株E1样品进行检测(图3),所测样品的保留时间为11.37 min(图3-a), 在正离子模式下其一级离子质荷比为m/z 230.095 50([M+H]+,图3-b),其与麦角硫因标品的保留时间(11.34 min,图3-c)和质荷比(m/z 230.095 72,图3-d)一致,此结果表明重组菌株E1成功合成麦角硫因。
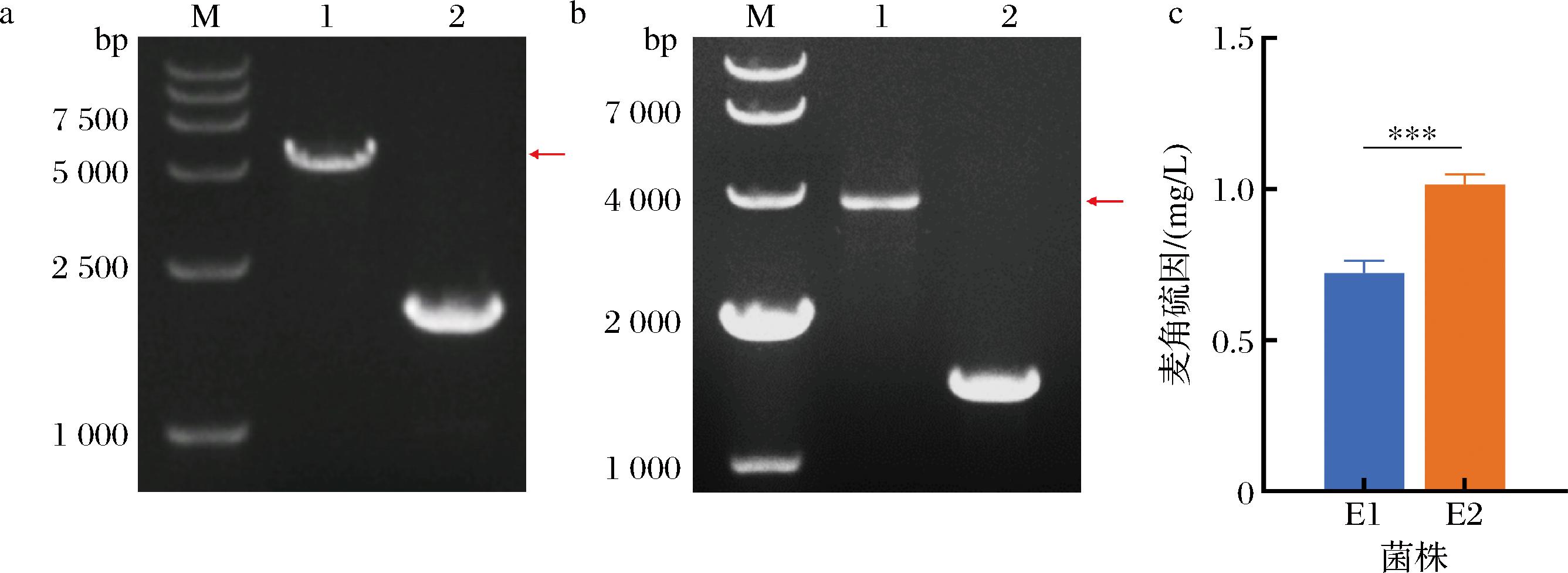
a-NcEgt1整合于Ⅻ号染色体(M-Marker;1-strain E1;2-strain 5D);b-CpEgt2整合于XI号染色体(M-Marker;1-strain E2;2-strain E1);c-菌株E1和E2产麦角硫因对比
图2 重组菌株PCR验证及麦角硫因产量对比图
Fig.2 PCR validation of recombinant strains and comparison of ergothioneine production
注:*-P<0.05, **-P<0.01, ***-P<0.001, ****-P<0.000 1(下同)。
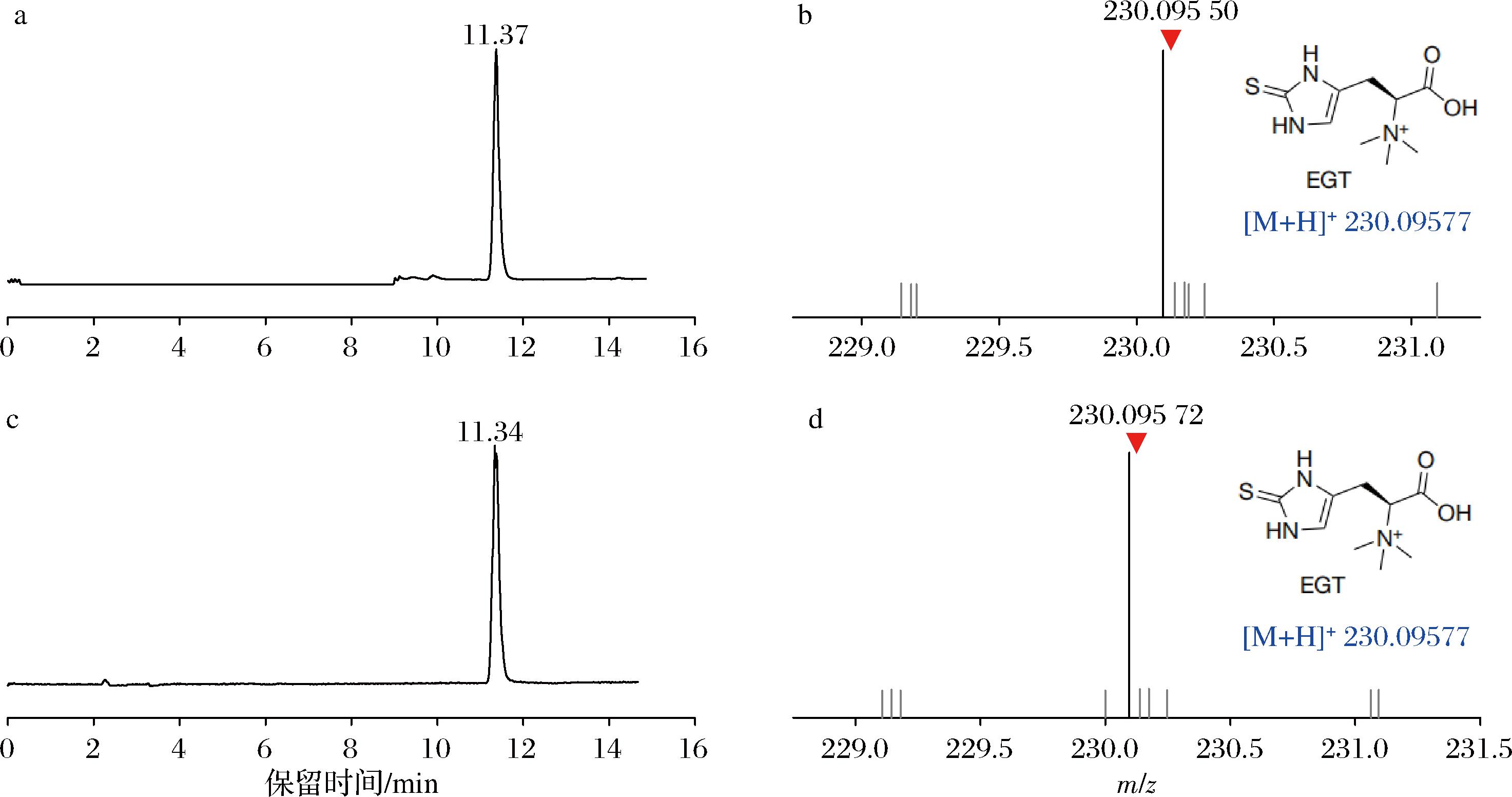
a, c-样品和麦角硫因标准品的出峰图;b, d-样品和麦角硫因标准品的质谱图(ESI正离子模式)
图3 重组菌株中麦角硫因的LC-MS分析
Fig.3 LC-MS analysis of ergothioneine from recombinant strain
将麦角硫因合成途径第2个关键酶基因,来自麦角菌(Clavieps purpurea)的CpEgt2整合进酿酒酵母第11号染色体的MTR2和ASH1之间(图2-b),成功整合CpEgt2基因表达盒后阳性转化子扩增产物为3 632 bp,即得到工程酿酒酵母菌株E2。在相同条件下培养48 h,HPLC检测到E2菌株麦角硫因产量为相较于E1产量显著提高了40.56%(图2-c)。该结果表明异源基因NcEgt1和CpEgt2均能够在酿酒酵母细胞内正确表达并催化相应反应发生,使酿酒酵母工程菌株合成异源产物麦角硫因。
2.2 过表达HIP1对麦角硫因产量的影响
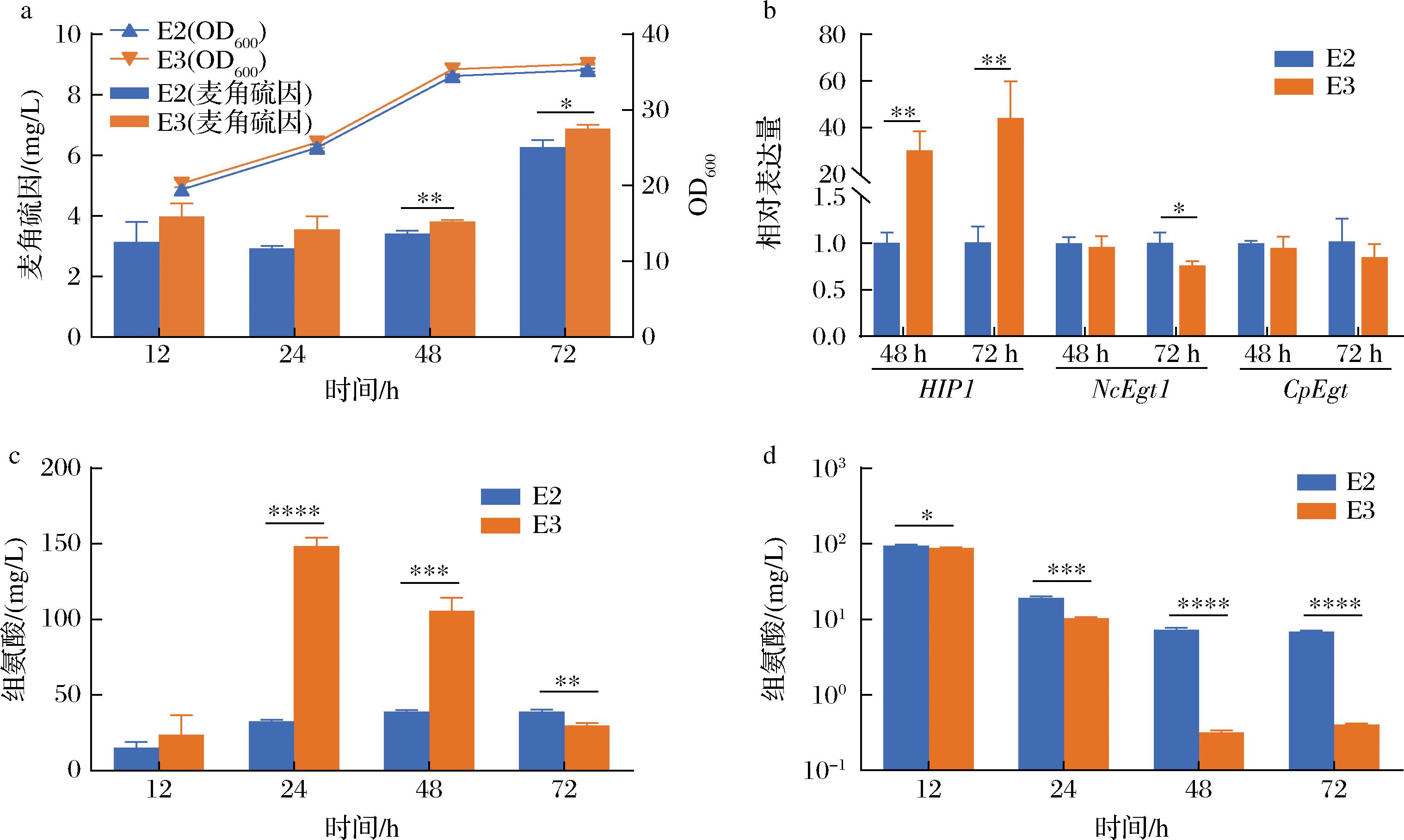
麦角硫因的合成涉及多种前体氨基酸,其中组氨酸为其结构提供基本骨架,提高胞内组氨酸水平可能是提高麦角硫因产量的关键。为了提高酿酒酵母E2胞内组氨酸水平,将1种已知内源性的编码组氨酸高亲和力渗透酶的基因HIP1利用启动子TEF1表达,在基因组十号染色体上增加1个拷贝,得到HIP1过表达菌株E3并通过实时荧光定量PCR实验对HIP1表达水平进行检验(图4-a),菌株E3中HIP1表达水平相较E2有显著提高,表明E3菌株中HIP1基因成功过表达。
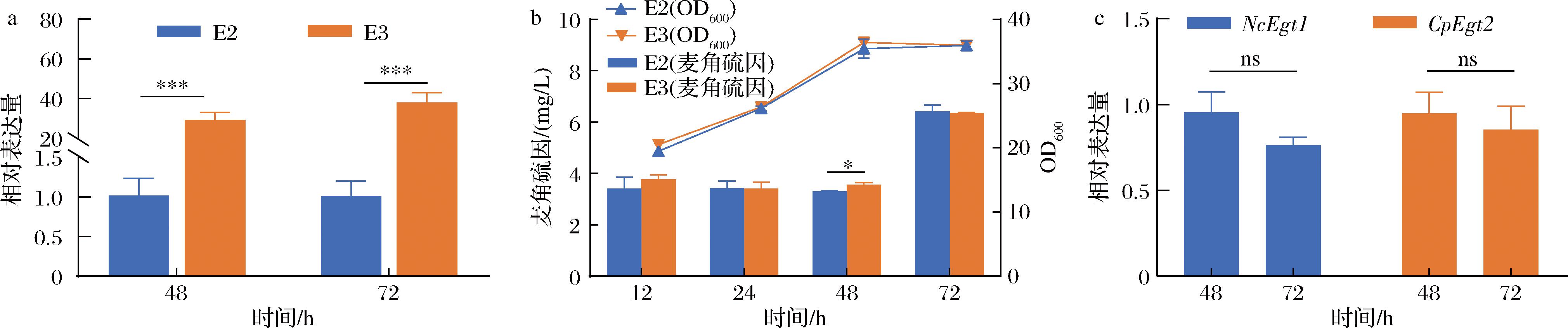
a-菌株E2和E3中基因HIP1的表达水平;b-YPD中菌株E2和E3的摇瓶发酵结果;c-菌株E3中基因NcEgt1和CpEgt2的表达水平
图4 菌株E2,E3摇瓶发酵及RT-qPCR实验结果
Fig.4 Shake flask fermentation results of strain E2, E3 and RT-qPCR results
随后进行摇瓶发酵,探究HIP1过表达对麦角硫因产量及细胞生长的影响。过表达HIP1基因对细胞生长基本没有影响,但E3菌株麦角硫因最终产量并没有提高(图4-b)。此外,菌株于48~72 h期间麦角硫因大量合成,而此阶段2个麦角硫因合成基因的表达并没有明显提高(图4-c),表明麦角硫因作为次级代谢产物更易于稳定期合成。
2.3 组氨酸供给对HIP1过表达菌株麦角硫因产量的影响
在YPD培养基中,E3菌株相较于E2麦角硫因的产量并没有显著提高,后续向培养基中额外添加了一定量的组氨酸,探究组氨酸供给对HIP1过表达菌株麦角硫因产量的影响。由于较高浓度的组氨酸会给酵母细胞带来毒害作用且成本较高,所以向YPD培养基中添加了76 mg/L的组氨酸[15],在该培养条件下,各时间点菌株E3的生物量和麦角硫因产量相较于E2均有所提高(图5-a)。菌株E3的麦角硫因产量在48 h时提高了11.6%,且在72 h时,产量达到(6.88±0.11) mg/L,相较E2提高了9.6%。此外,进一步分析了在组氨酸供给条件下HIP1基因和麦角硫因合成酶基因的表达情况,在48 h和72 h时,E3菌株中HIP1基因表达量有显著提高,而麦角硫因合成途径中2个关键基因的表达量相较于E2基本保持一致(图5-b),说明在组氨酸供给条件下,HIP1过表达有助于麦角硫因产量的提高。
a-含76 mg/L的YPD中菌株E2和E3的摇瓶发酵结果;b-培养于含76 mg/L的YPD中菌株E2和E3中基因HIP1、NcEgt1和CpEgt2的表达水平;c-胞内氨基酸水平;d-胞外氨基酸水平
图5 组氨酸供给条件下菌株发酵结果
Fig.5 Fermentation results under histidine supply
为了进一步分析Hip1p蛋白对组氨酸的转运情况,测量了发酵期间不同时间点菌株胞内外游离组氨酸含量(图5-c,图5-d)。可观察到,菌株E3在24 h和48 h胞内氨基酸水平显著高于E2,在72 h却略低于E2,这可能是由于菌株E3在稳定期大量合成麦角硫因,导致胞内游离组氨酸快速消耗造成;同时,E3胞外氨基酸也在各时间点低于E2,说明在供给一定量组氨酸的条件下,过表达HIP1工程菌能有效转运胞外组氨酸至胞内,提高胞内组氨酸水平,从而有助于提高麦角硫因产量。
2.4 5 L发酵罐补料分批发酵产麦角硫因
为了进一步评估过表达HIP1对菌株在补料分批发酵条件下麦角硫因产量的提升作用,对菌株E2和E3进行了5 L发酵罐的补料分批发酵。为获得更高产量,对组氨酸进行补加,摇瓶发酵结果显示24 h时,培养基中组氨酸基本耗尽,因此补料分批发酵过程中于24 h一次性补加组氨酸0.5 mmol/L。如图6所示,菌株E2经72 h发酵,麦角硫因产量达215.01 mg/L,菌体OD600达65.5,胞内组氨酸含量于28 h达到最高299.14 mg/L,而HIP1过表达菌株E3发酵72 h麦角硫因产量为237.34 mg/L,较E2提高10.39%,菌体OD600达69.4,胞内组氨酸含量于32 h达到最高898.86 mg/L。在整个发酵过程中,菌株E3胞内组氨酸含量在各个时间点均高于E2,其中在4~48 h内尤为明显,为菌株E2的2.1~3.7倍;此外,生物量、残糖等参数两菌株基本一致,说明在发酵罐水平下,过表达HIP1仍能有效提高胞内组氨酸含量,从而实现麦角硫因的高效生产。

a-菌株E2的补料分批发酵结果;b-菌株E3的补料分批发酵结果
图6 工程菌株补料分批发酵产麦角硫因
Fig.6 Fed-batch fermentation of engineered strain for production of ergothioneine
3 讨论
本研究中,首先向酿酒酵母基因组中引入来自粗糙脉孢菌的麦角硫因合成关键酶基因NcEgt1获得工程菌株E1,并从发酵液中检测到麦角硫因的产生。上述结果验证了酿酒酵母缺乏麦角硫因真核合成途径中的关键基因Egt1,如果在酿酒酵母中异源正常表达具有活性的Egt1基因,将会赋予菌株产生麦角硫因的能力[13, 18]。由于最初构建的E1菌株麦角硫因产量不高,针对酿酒酵母麦角硫因合成途径内源Egt2酶活力不足的问题,向E1菌株中引入了麦角菌的CpEgt2基因从而获得E2菌株。结果也证实了E2菌株的麦角硫因产量较E1提高了40.56%,进一步提示在代谢通路改造过程中对关键酶节点的修饰,比如提高酶活或增加酶的表达量等,可有效提高代谢物产量[15, 19-20]。
麦角硫因的真核合成途径与原核途径相比,合成步骤少、所需的前体物也少[9]。在合成所需的氨基酸类前体中,原核途径需要半胱氨酸、谷氨酸以及组氨酸3种氨基酸,而真核途径只需要组氨酸和半胱氨酸参与,由于组氨酸为麦角硫因结构提供基本骨架,推测组氨酸的摄入量会对麦角硫因的合成起到关键作用,所以研究中过表达了酿酒酵母内源性组氨酸转运蛋白的基因HIP1,获得E3菌株。E3菌株在额外添加组氨酸的摇瓶和5 L发酵罐中生成的麦角硫因均比E2提高了约10 %,且细胞内组氨酸的含量也显著增加。结果说明,组氨酸转运蛋白基因HIP1表达量的增加可促进前体物的吸收,提高胞内前体物供给,进而促进代谢物产量提高。
上述策略虽然在一定程度上提高了麦角硫因的产量,但是与预期效果还有很多差距。虽然组氨酸的摄入量增加了,但是组氨酸在麦角硫因合成途径中的利用率却不高,这与HU等[11]研究结果一致。下一步将针对组氨酸利用的Egt1酶做进一步理性改造,以期提高组氨酸转化为Cys-HER的效率。还将进一步提高其他关键前体半胱氨酸和S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)的含量,增强麦角硫因前体的供应量。此外,针对胞内麦角硫因的反馈抑制作用,后续还将开放麦角硫因外排通道蛋白。
4 结论
本研究通过CRISPR/Cas9基因编辑技术引入异源基因NcEgt1和CpEgt2,在酿酒酵母细胞内构建完整的麦角硫因生物合成途径,得到了能够高效生产麦角硫因的工程菌株。为进一步提高麦角硫因产量,过表达编码组氨酸的转运蛋白的HIP1基因来增强工程菌对组氨酸的吸收能力,使其在0.5 mmol/L的前体物组氨酸供给下,产量显著提高10%,其中摇瓶水平发酵72 h麦角硫因产量达(6.88±0.11) mg/L,发酵罐水平发酵72 h麦角硫因产量达237.34 mg/L。此外,通过检测胞内外组氨酸含量证明了Hip1p蛋白的高效转运能力,及RT-qPCR实验证明异源基因在酿酒酵母体内的稳定表达。综上,本研究通过构建产麦角硫因酿酒酵母工程菌株,为低成本实现麦角硫因大规模生产奠定了基础。
[1] TANRET C.Sur une base nouvelle retiree du seigle ergote, l’ergothioneine[J].Comptes Rendus Chimie, 1909, 149:222-224.
[2] CHEAH I K, HALLIWELL B.Ergothioneine;antioxidant potential, physiological function and role in disease[J].Biochimica et Biophysica Acta, 2012, 1822(5):784-793.
[3] FU T T, SHEN L.Ergothioneine as a natural antioxidant against oxidative stress-related diseases[J].Frontiers in Pharmacology, 2022, 13:850813.
[4] HAN Y W, TANG X Y, ZHANG Y T, et al.The current status of biotechnological production and the application of a novel antioxidant ergothioneine[J].Critical Reviews in Biotechnology, 2021, 41(4):580-593.
[5] CHEAH I K, TANG R M Y, WANG X Y, et al.Protection against doxorubicin-induced cardiotoxicity by ergothioneine[J].Antioxidants, 2023, 12(2):320.
[6] LAM-SIDUN D, PETERS K M, BORRADAILE N M.Mushroom-derived medicine? Preclinical studies suggest potential benefits of ergothioneine for cardiometabolic health[J].International Journal of Molecular Sciences, 2021, 22(6):3246.
[7] 冯路路, 鄂恒超, 张艳梅, 等.食用菌中麦角硫因提取分离和检测方法研究进展[J].食用菌学报, 2021, 28(1):115-123.FENG L L, E H C, ZHANG Y M, et al.Research progress on extraction, separation and detection of ergothionine in edible fungi[J].Acta Edulis Fungi, 2021, 28(1):115-123.
[8] 马晓雪, 陈旭东, 吴志文, 等.天然抗氧化剂麦角硫因的合成工艺研究[J].合成化学, 2022, 30(9):743-748.MA X X, CHEN X D, WU Z W, et al.Process research of natural antioxidant ergothioneine[J].Chinese Journal of Synthetic Chemistry, 2022, 30(9):743-748.
[9] 刘琦,毛雨丰,廖小平,等. 麦角硫因生物合成研究的新进展[J]. 生物工程学报, 2022, 38(4): 1408-1420.LIU Q, MAO Y F, LIAO X P, et al. Recent progress in ergothioneine biosynthesis: A review[J]. Chinese Journal of Biotechnology, 2022, 38(4): 1408-1420.[10] BELLO M H, BARRERA-PEREZ V, MORIN D, et al.The Neurospora crassa mutant NcΔEgt-1 identifies an ergothioneine biosynthetic gene and demonstrates that ergothioneine enhances conidial survival and protects against peroxide toxicity during conidial germination[J].Fungal Genetics and Biology:FG &B, 2012, 49(2):160-172.
[11] HU W, SONG H, HER A S, et al.Bioinformatic and biochemical characterizations of C-S bond formation and cleavage enzymes in the fungus Neurospora crassa ergothioneine biosynthetic pathway[J].Organic Letters, 2014, 16(20):5382-5385.
[12] TANAKA N, KAWANO Y, SATOH Y, et al.Gram-scale fermentative production of ergothioneine driven by overproduction of cysteine in Escherichia coli[J].Scientific Reports, 2019, 9(1):1895.
[13] YU Y H, PAN H Y, GUO L Q, et al.Successful biosynthesis of natural antioxidant ergothioneine in Saccharomyces cerevisiae required only two genes from Grifola frondosa[J].Microbial Cell Factories, 2020, 19(1):164.
[14] ALAMGIR K M, MASUDA S, FUJITANI Y, et al.Production of ergothioneine by Methylobacterium species[J].Frontiers in Microbiology, 2015, 6:1185.
[15] VAN DER HOEK S A, DARBANI B, ZUGAJ K E, et al.Engineering the yeast Saccharomyces cerevisiae for the production of L-(+)-ergothioneine[J].Frontiers in Bioengineering and Biotechnology, 2019, 7:262.
[16] TANAKA J, FINK G R.The histidine permease gene (HIP1) of Saccharomyces cerevisiae[J].Gene, 1985, 38(1-3):205-214.
[17] FARCASANU I C, MIZUNUMA M, HIRATA D, et al.Involvement of histidine permease (Hip1p) in manganese transport in Saccharomyces cerevisiae[J].Molecular and General Genetics MGG, 1998, 259(5):541-548.
[18] 潘涛, 林金德, 余颖豪, 等.酿酒酵母表达侧耳源单基因生物合成麦角硫因[J].食品科学, 2022, 43(10):214-219.PAN T, LIN J D, YU Y H, et al.Expression in Saccharomyces cerevisiae of single ergothioneine synthase genes from Pleurotus[J].Food Science, 2022, 43(10):214-219.
[19] VAN DER HOEK S A, RUSN K M, JACOBSEN I H, et al.Engineering ergothioneine production in Yarrowia lipolytica[J].FEBS Letters, 2022, 596(10):1356-1364.
K M, JACOBSEN I H, et al.Engineering ergothioneine production in Yarrowia lipolytica[J].FEBS Letters, 2022, 596(10):1356-1364.
[20] ZHANG L W, TANG J W, FENG M Q, et al.Engineering methyltransferase and sulfoxide synthase for high-yield production of ergothioneine[J].Journal of Agricultural and Food Chemistry, 2023, 71(1):671-679.