糖尿病是一种常见的慢性代谢性疾病,其中II-型糖尿病是其主要发病类型,主要特征有空腹高血糖、胰岛素抵抗等。目前,糖尿病已成为继癌症和心脑血管疾病后危害人类健康的第三大慢性疾病[1]。据国际糖尿病联盟(The International Diabetes Federation, IDF)统计,2021年全球糖尿病患者数量约为5.37亿人,预测2030年全球糖尿病患病人数将达到6.43亿,2045年将超过7.83亿[2]。二肽基肽酶-Ⅳ(dipeptidyl peptidase Ⅳ,DPP-Ⅳ)已被证实是治疗II-型糖尿病的重要靶点之一[3]。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)能够在葡萄糖刺激下促进胰岛素分泌和抑制胰高血糖素的分泌,从而发挥血糖调节作用,而DPP-Ⅳ可以通过切割GLP-1的N端二肽残基的方式使GLP-1失去促胰岛素活性,致使血糖调节失衡[4]。目前,临床上以DPP-Ⅳ为靶点治疗II-型糖尿病的药物多为化学合成药物,如沙格列汀、西格列汀和利格列汀等,但这些药物长期服用会产生一定的毒副作用,如严重过敏反应、胃肠道不良反应、低血糖等[5]。现有研究表明天然食物来源的DPP-Ⅳ抑制剂安全性高、易吸收[4,6],具有预防及治疗II-型糖尿病的潜力。
牡蛎,俗称“生蚝”,是一种高蛋白低脂肪的海洋食品,素有“海底牛奶”之美誉,牡蛎活性肽具有良好的生物活性,如抗氧化、免疫调节、降血压、抗凝血、降血糖等[7-8]。此外,特殊的海洋环境(如高盐、低氧和低温等)使得牡蛎蛋白具有独特的氨基酸组成及序列结构,是制备DPP-Ⅳ抑制肽的优势资源[9]。但是,牡蛎肽在消化过程中稳定性较差,导致其生物利用度低、活性发挥受限[10]。花色苷是一类广泛存在于植物中的水溶性酚类化合物,具有显著的DPP-Ⅳ抑制活性[6],但花色苷对温度、光、pH等环境因子敏感,稳定性较差。研究表明,活性肽与多酚组装成复合物后不仅能够提高多酚的理化稳定性,而且抗氧化活性也得到提升[11-13]。因此,将牡蛎肽与花色苷组装成复合物具有保护二者活性结构、协同增强DPP-Ⅳ抑制活性的潜力。但目前对牡蛎DPP-Ⅳ抑制肽的结构表征及其协同花色苷的活性增效研究甚少。
本研究利用碱性蛋白酶酶解法制备牡蛎肽,采用凝胶渗透色谱法测定其分子质量分布,利用氨基酸分析仪分析其氨基酸组成,采用液相色谱串联质谱(LC-MS/MS)技术鉴定其肽谱序列特征;并通过体外DPP-Ⅳ活性抑制模型与Compusyn协同计算模型探究了牡蛎DPP-Ⅳ抑制肽协同花色苷抑制DPP-Ⅳ活性的增效作用,以期为新型牡蛎DPP-Ⅳ抑制肽及其协同花色苷的活性增效研究提供科学依据。
1 材料与方法
1.1 材料与试剂
牡蛎肉,广东省湛江市东风市场;芍药色素、矢车菊素、锦葵色素、飞燕草素、天竺葵色素、矮牵牛色素-3-O-葡萄糖苷,成都草源康生物科技有限公司;合成肽,无锡迈默拓普生物科技有限公司;碱性蛋白酶(200 000 U/g),北京索莱宝生物科技有限公司;DPP-Ⅳ抑制剂筛选试剂盒,美国Cayman Chemical公司;甲酸、乙腈、NaNO3(均为色谱纯),西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
PHS-2F型pH计,上海仪电科学仪器股份有限公司;Varioskan LUX型全自动酶标仪、Easy-nLC 1200型液相色谱仪、Lynx 6000高速落地离心机、电喷雾-组合型离子阱Orbitrap质谱仪,美国Thermo公司;NS810分光测色仪,广东三恩时智能科技有限公司;LC-JSY-3恒温金属浴,上海力辰仪器科技有限公司。
1.3 方法
1.3.1 牡蛎肽的制备
参考柏昌旺等[14]的方法并稍作修改,将去除内脏的牡蛎肉经流水解冻并按照料液比1∶3(g∶mL)加水匀浆后,将pH值调至8,加入碱性蛋白酶(加酶量为1 g牡蛎肉中加入4 000 U酶)后于50 ℃水浴酶解3 h,之后沸水浴灭酶15 min,冰水浴冷却至室温后离心(4 ℃,8 000 r/min)15 min,用脱脂纱布过滤收集上清液,冷冻干燥后备用。
1.3.2 牡蛎肽相对分子质量分布测定
参考GAIDAU等[15]的方法,采用凝胶渗透色谱法测定牡蛎肽分子质量分布。使用Agilent 1260仪器,配备Waters Ultrahydrogel (300 mm×7.8 mm)色谱柱和Agilent RID G1362A检测器。色谱分析条件:流动相:0.1 mol/L NaNO3水溶液;流速1.0 mL/min;标准品聚丙二醇;柱温45 ℃;进样体积40 μL。以相对分子质量的对数(lgM)对出峰时间(X)进行线性拟合,得到标准曲线:lgM=18.94-1.21X+0.029 86X2-0.000 265 5X3,R2=0.999 6。
1.3.3 牡蛎肽的氨基酸组成分析
采用全自动氨基酸分析仪,参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》进行氨基酸含量的测定。
1.3.4 牡蛎肽的肽谱序列鉴定
参考TAN等[16]的方法,采用LC-MS/MS技术分析牡蛎肽的肽谱序列。使用C18色谱柱(100 μm×180 mm),进样量5 μL,流速600 nL/min,流动相A为含0.1%(体积分数)甲酸的水溶液,流动相B的组成为含0.1%甲酸的水溶液∶乙腈=2∶8(体积比)。采取线性梯度洗脱方式:0~2 min,B相4%~8%;2~45 min,B相8%~40%;45~55 min,B相40%~60%;55~66 min,B相60%~95%。质谱仪的扫描范围为100~1 500 m/z,扫描模式DDA;毛细管电压2 200 V;毛细管温度320 ℃。
1.3.5 牡蛎肽的DPP-Ⅳ抑制活性测定
参考JIN等[17]的方法,采用荧光底物法使用DPP-Ⅳ抑制剂筛选试剂盒测定牡蛎肽的DPP-Ⅳ抑制活性。以西格列汀为阳性对照,吸取30 μL缓冲液于96孔板微孔中,其中对照组中分别加入10 μL DPP-Ⅳ溶液和10 μL超纯水(样品配置用溶液),样品组中分别加入10 μL DPP-Ⅳ溶液和10 μL样品溶液,之后加入50 μL底物(Gly-Pro-AMC)于37 ℃条件下反应30 min,采用多功能酶标仪在激发波长355 nm、发射波长460 nm下测定其荧光值。根据式(1)计算抑制率:
DPP-Ⅳ抑制率![]()
(1)
式中:A和B分别是扣除空白后对照组和样品组的荧光值。
1.3.6 牡蛎DPP-Ⅳ抑制肽的人工合成
DPP-Ⅳ抑制肽委托无锡迈默拓普生物科技有限公司采用固相合成法合成,使用高效液相色谱串联质谱法(HPLC-MS/MS)鉴定及纯化合成肽,最终合成肽的纯度大于98%。
1.3.7 合成DPP-Ⅳ抑制肽、花色苷DPP-Ⅳ抑制活性测定
合成DPP-Ⅳ抑制肽、花色苷DPP-Ⅳ抑制活性测定方法同1.3.5节。
1.3.8 合成肽-花色苷复合物的制备
参照YAO等[18]的方法并加以调整,分别用超纯水配置质量浓度为1 mg/mL的合成肽、花色苷溶液,分别吸取样品溶液至2 mL离心管,使混合溶液中合成肽浓度为花色苷浓度的6倍,充分振荡混匀后,于25 ℃、1 000 r/min下反应2 h得合成肽-花色苷复合物。
1.3.9 合成肽、花色苷及合成肽-花色苷复合物的颜色测定
采用CIELAB颜色空间法测定样品的颜色参数,使用D65光源和10 ℃视野。测量参数包括亮度(L*)、红/绿度(a*)、黄/蓝度(b*)、色彩饱和度(C*)和色调角(h),色差(ΔE*)按公式(2)计算:
(2)
1.3.10 合成肽协同花色苷抑制DPP-Ⅳ活性增效作用分析
1.3.10.1 合成肽-花色苷复合物DPP-Ⅳ抑制活性测定
合成肽-花色苷复合物DPP-Ⅳ抑制活性测定方法同1.3.5节。
1.3.10.2 合成肽和花色苷的协同作用
参考CHENG等[19]的方法,采用Compusyn协同计算模型中的恒定比率组合设计方法,在软件中分别输入合成肽、花色苷及合成肽-花色苷复合物(合成肽浓度为花色苷浓度的6倍)的DPP-Ⅳ抑制活性测定结果,通过计算生成的剂量-效应图、联合指数图、剂量-效应减少图和等值线图来评估合成肽和花色苷协同作用。
1.4 数据处理
所有实验重复操作3次,结果用平均值±标准差表示。使用SPSS 27.0软件对实验数据进行处理与方差分析(One-way ANOVA),差异显著性采用Duncan分析并进行多重比较,P<0.05表示组间差异显著。采用Origin 2021软件绘制图像。
2 结果与分析
2.1 牡蛎肽的相对分子质量分布
将碱性蛋白酶酶解制备的牡蛎肽经色谱柱洗脱后,分离出4个色谱峰,采用峰面积归一化法计算分子质量分布,结果如图1所示。牡蛎肽的分子质量主要集中在3 kDa以下,占总比例的55.44%。大量研究表明,活性肽的分子质量与其DPP-Ⅳ抑制活性关系密切,较低分子质量的活性肽DPP-Ⅳ抑制活性更强[17],这可能是由于与高分子质量的活性肽相比,较低分子质量的活性肽更容易进入DPP-Ⅳ的活性位点并与之结合,从而发挥DPP-Ⅳ抑制作用[20-21]。孙洁等[22]从毛虾酶解液中分离出的小于3 kDa的肽组分比3~10 kDa和>10 kDa的肽组分DPP-Ⅳ抑制活性更强。
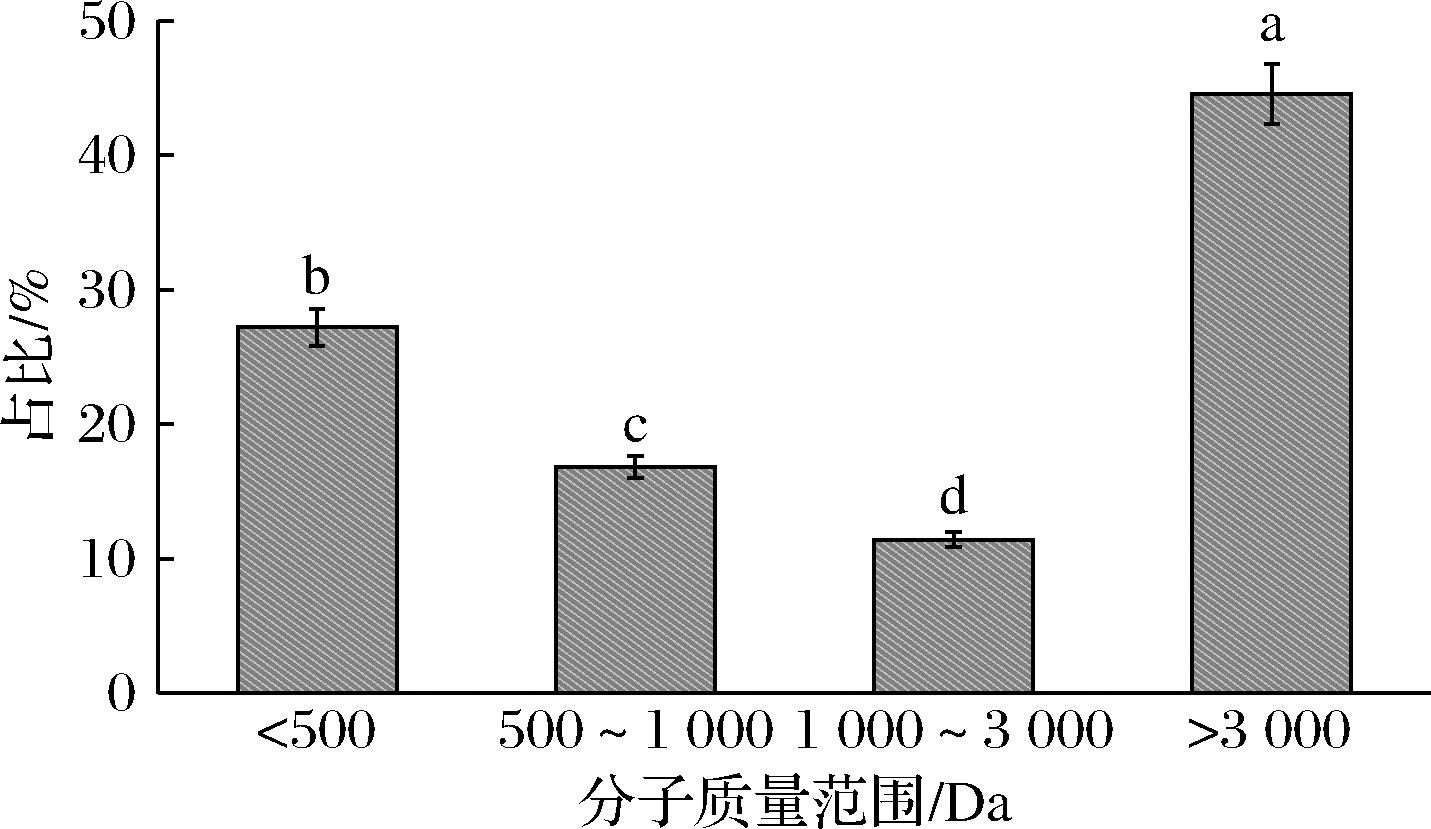
图1 牡蛎肽的相对分子质量分布
Fig.1 Relative molecular weight distribution of oyster peptides
注:不同小写字母代表差异显著,P<0.05(下同)。
2.2 牡蛎肽的氨基酸组成分析
海洋生物活性肽的DPP-Ⅳ抑制活性与其结构,如氨基酸组成、分子质量大小、肽序列等密切相关[23]。如表1所示,本研究制备的牡蛎肽主要由谷氨酸、天冬氨酸、苏氨酸、组氨酸、甘氨酸和赖氨酸组成,占氨基酸总量的55.88%,且牡蛎肽的必需氨基酸含量较为丰富(35.30%)。研究报道疏水性氨基酸尤其是支链氨基酸(BCAAs,包括缬氨酸、亮氨酸和异亮氨酸)和脯氨酸是DPP-Ⅳ抑制肽的重要组成特征[24]。本研究制备的牡蛎肽的疏水性氨基酸含量为27.39%,其中支链氨基酸和脯氨酸占比高,占疏水性氨基酸总量的60.84%,说明所制备的牡蛎肽具有DPP-Ⅳ抑制肽的氨基酸组成特征。
表1 牡蛎肽的氨基酸组成 单位:g/100 g Table 1 The amino acid components of oyster peptides
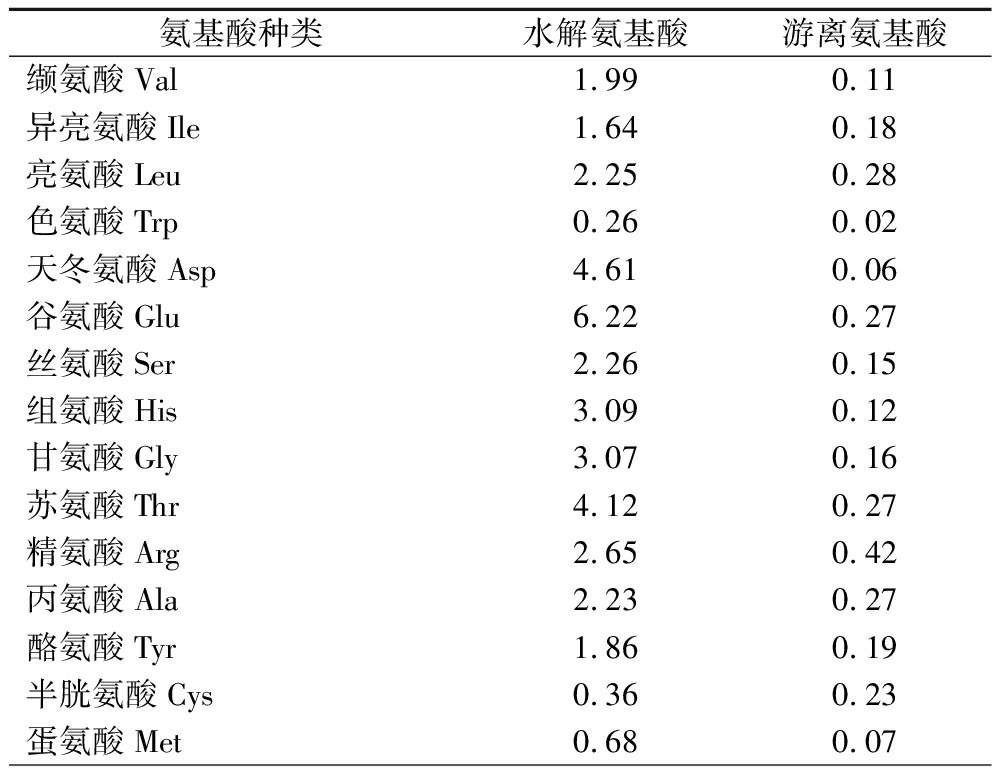
氨基酸种类水解氨基酸游离氨基酸缬氨酸Val1.990.11异亮氨酸Ile1.640.18亮氨酸Leu2.250.28色氨酸Trp0.260.02天冬氨酸Asp4.610.06谷氨酸Glu6.220.27丝氨酸Ser2.260.15组氨酸His3.090.12甘氨酸Gly3.070.16苏氨酸Thr4.120.27精氨酸Arg2.650.42丙氨酸Ala2.230.27酪氨酸Tyr1.860.19半胱氨酸Cys0.360.23蛋氨酸Met0.680.07
续表1
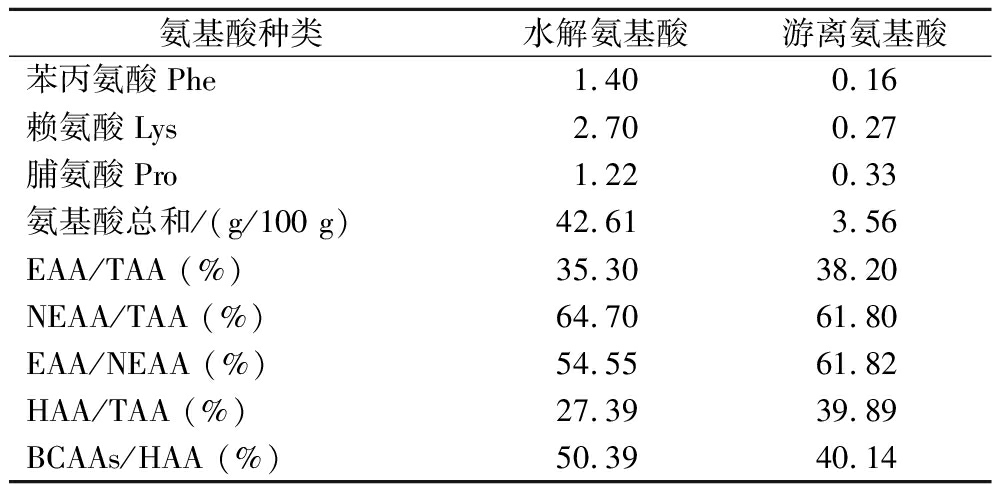
氨基酸种类水解氨基酸游离氨基酸苯丙氨酸Phe1.400.16赖氨酸Lys2.700.27脯氨酸Pro1.220.33氨基酸总和/(g/100 g)42.613.56EAA/TAA (%)35.3038.20NEAA/TAA (%)64.7061.80EAA/NEAA (%)54.5561.82HAA/TAA (%)27.3939.89BCAAs/HAA (%)50.3940.14
注:TAA(总氨基酸);EAA(必需氨基酸);NEAA(非必需氨基酸);HAA(疏水性氨基酸);BCAAs(支链氨基酸)。
2.3 牡蛎肽的肽序列分析
采用LC-MS/MS技术分析牡蛎肽的肽谱序列,共检测到100条肽链,首先通过文献对比评估牡蛎肽是否存在典型的DPP-Ⅳ抑制肽特征。据研究报道,DPP-Ⅳ抑制肽具有疏水性氨基酸含量高、肽链相对较短(一般少于15个氨基酸残基)的特征,且脯氨酸位于肽的N端前4个位置时,活性肽具有较高的DPP-Ⅳ抑制活性[18]。此外,肽序列结构中富含BCAAs或BCAAs位于肽序列特定位置的肽段具有成为DPP-Ⅳ抑制肽的潜力[25],如BCAAs位于肽段N端的前3个位置时显示出显著的DPP-Ⅳ抑制活性[26]。本研究共有42条肽符合文献报道中DPP-Ⅳ抑制肽的结构特征,其中主要的17条肽段如表2所示,这些肽段疏水性较好,富含支链氨基酸和脯氨酸且主要位于肽链N端前4个位置,具有显著的DPP-Ⅳ抑制肽结构特征,说明其具备潜在的DPP-Ⅳ抑制活性。
表2 牡蛎肽的主要DPP-Ⅳ抑制肽序列
Table 2 The predominant DPP-Ⅳ inhibitory peptide sequences of oyster peptides
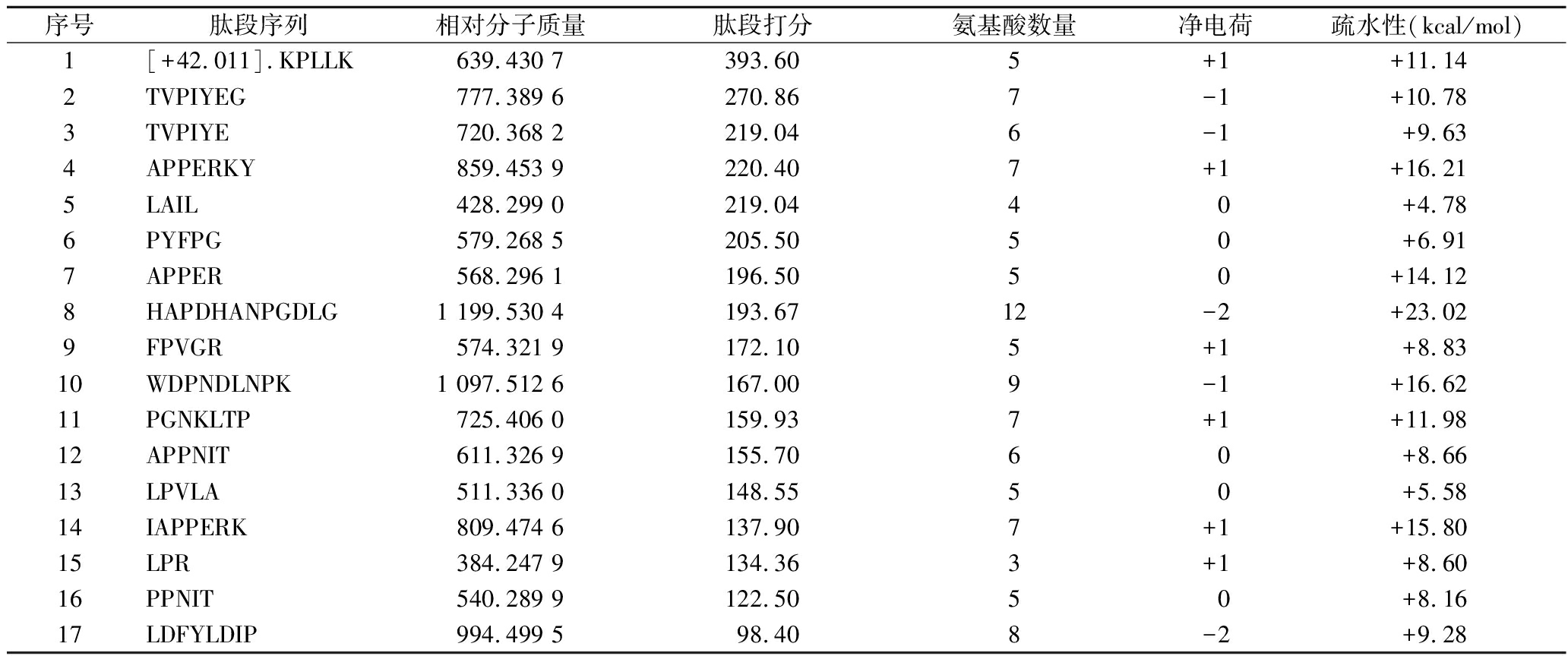
序号肽段序列相对分子质量肽段打分氨基酸数量净电荷疏水性(kcal/mol)1[+42.011].KPLLK639.430 7393.605+1+11.142TVPIYEG777.389 6270.867-1+10.783TVPIYE720.368 2219.046-1+9.634APPERKY859.453 9220.407+1+16.215LAIL428.299 0219.0440+4.786PYFPG579.268 5205.5050+6.917APPER568.296 1196.5050+14.128HAPDHANPGDLG1 199.530 4193.6712-2+23.029FPVGR574.321 9172.105+1+8.8310WDPNDLNPK1 097.512 6167.009-1+16.6211PGNKLTP725.406 0159.937+1+11.9812APPNIT611.326 9155.7060+8.6613LPVLA511.336 0148.5550+5.5814IAPPERK809.474 6137.907+1+15.8015LPR384.247 9134.363+1+8.6016PPNIT540.289 9122.5050+8.1617LDFYLDIP994.499 598.408-2+9.28
注:[+42.011]:Acetyl(Protein NTerm)乙酰化修饰,发生在蛋白氮端,相对分子质量变化为+42.011 Da。
GLP-1可系统调节机体血糖平衡,DPP-Ⅳ抑制肽能够抑制DPP-Ⅳ活性,减缓DPP-Ⅳ对GLP-1的分解作用,有利于血糖平衡的调节;其中N端第2位为Pro或Ala的肽段更易通过竞争性抑制作用抑制DPP-Ⅳ活性,发挥降血糖作用[27]。此外,考虑到花色苷具有高度亲水性,而活性肽和花色苷发生相互作用的关键作用力一般为疏水作用力和氢键,因此选择与花色苷组装的活性肽应当兼具一定的亲水性与疏水性[18]。基于DPP-Ⅳ抑制肽的特征结构以及活性肽和花色苷互作的条件,从表2中17条DPP-Ⅳ抑制肽序列中综合筛选出5条肽段(FPVGR、APPNIT、IAPPERK、LDFYLDIP、LAIL)合成,进行后续实验。
2.4 牡蛎肽的DPP-Ⅳ抑制活性分析
DPP-Ⅳ能促使GLP-1迅速降解,通过抑制DPP-Ⅳ活性可以阻止GLP-1失活,从而促进胰岛素的产生,达到降血糖的目的[28]。如图2所示,牡蛎肽具有良好的DPP-Ⅳ抑制活性,其半抑制浓度(IC50)为(0.60±0.06) mg/mL,且其对DPP-Ⅳ活性的抑制呈剂量依赖趋势。ZHANG等[29]用中性酶制备的鲢鱼肽DPP-Ⅳ抑制活性较好,IC50值为(1.12±0.04)mg/mL;蒋美龄等[30]用动物蛋白酶酶解制备的牡蛎肽具有良好的DPP-Ⅳ抑制活性,IC50值是(2.60±0.46)mg/mL。综上,本研究所制备的牡蛎肽对DPP-Ⅳ的抑制活性较强,其降糖应用潜力较大。
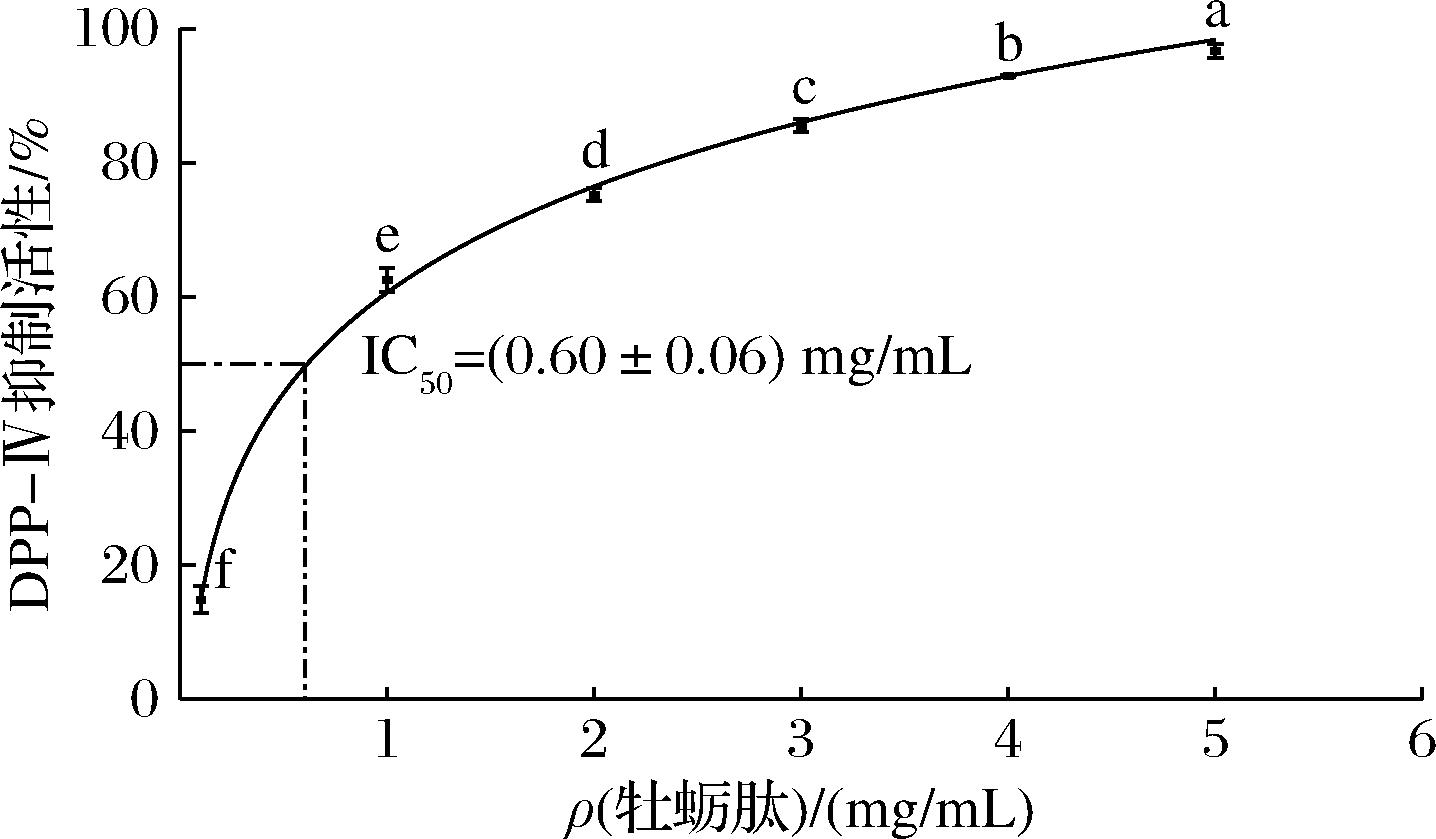
图2 牡蛎肽的DPP-Ⅳ抑制作用
Fig.2 DPP-Ⅳ inhibitory effect of oyster peptides
2.5 合成肽、花色苷DPP-Ⅳ抑制活性分析
采用GraphPad Prism 9软件非线性曲线拟合中的剂量-效应-抑制作用拟合方法分别拟合合成肽、花色苷的剂量-效应曲线,通过计算得到合成肽、花色苷对DPP-Ⅳ的IC50值如图3所示。由图3-a可知,基于肽序列分析结果筛选合成的肽FPVGR(FR-5)、APPNIT(AT-6)、IAPPERK(IK-7)、LDFYLDIP(LP-8)、LAIL(LL-4)对DPP-Ⅳ的IC50为0.06~2.15 mg/mL,均显示出良好的DPP-Ⅳ抑制活性。研究报道,芳香族氨基酸(含Trp、Tyr、Phe)和脯氨酸(Pro)对活性肽的DPP-Ⅳ抑制活性具有重要贡献[26],尤其当芳香族氨基酸和Pro位于肽链N端1~4位时,活性肽的DPP-Ⅳ抑制活性更强。5条合成肽中FR-5的DPP-Ⅳ抑制活性最强(P<0.05),其IC50值为(0.063 57±0.002 73) mg/mL,这可能是由于Phe和Pro分别位于其肽链N端的第1、2位。N端第2位为Pro或Ala的活性肽更易与DPP-Ⅳ相互作用从而抑制DPP-Ⅳ活性[9,27],但LP-8的DPP-Ⅳ抑制活性却显著高于AT-6、IK-7和LL-4,这可能是由于LP-8肽链N端第3、4位均为芳香族氨基酸,而其他3种肽链的氨基酸组成中没有芳香族氨基酸造成的。由于FR-5的DPP-Ⅳ抑制活性最强,因此选择FR-5与花色苷后续进行协同组装。
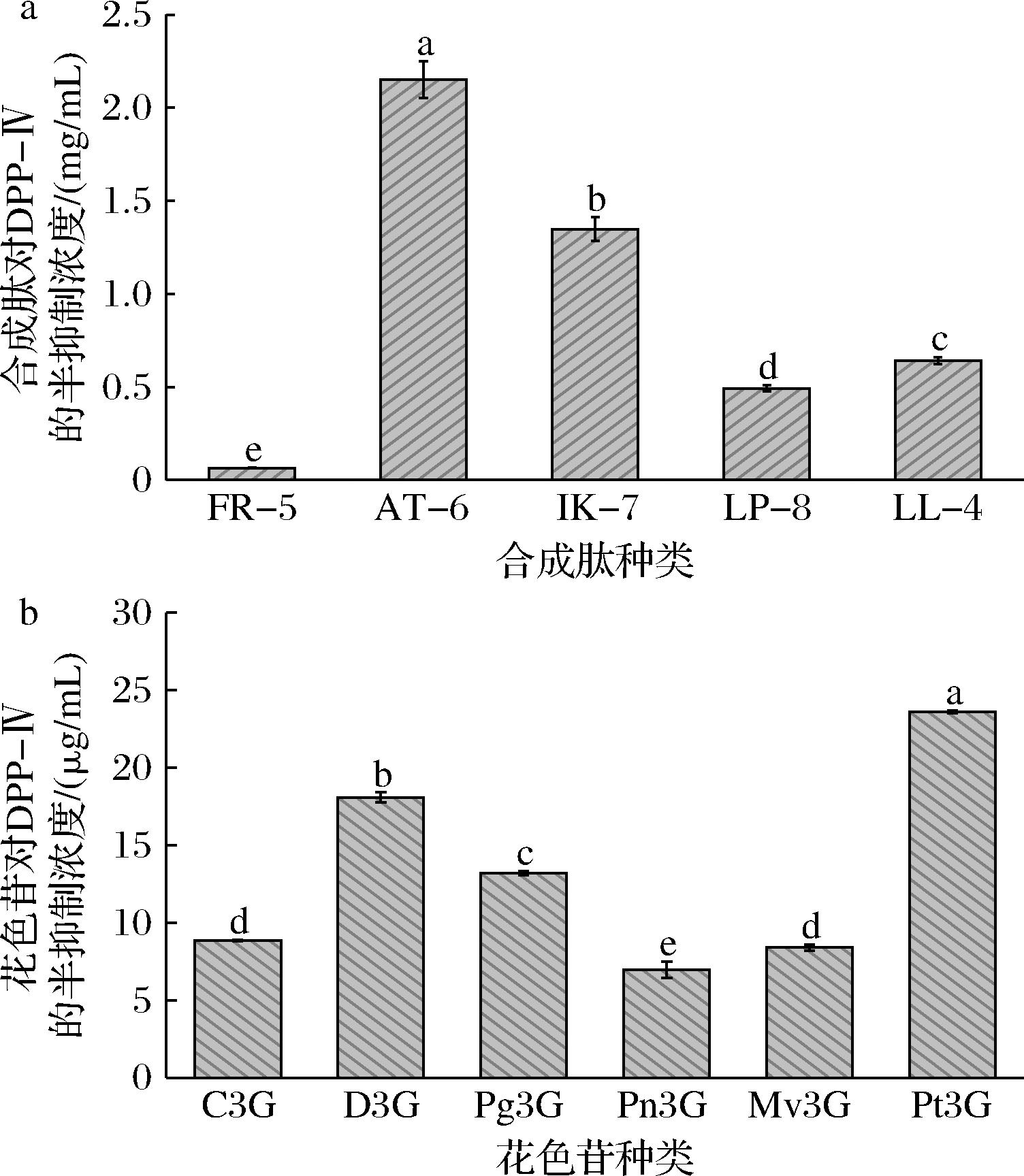
a-合成肽(FR-5/AT-6/IK-7/LP-8/LL-4)的DPP-Ⅳ抑制能力;b-花色苷(C3G/D3G/Pg3G/Pn3G/Mv3G/Pt3G)的DPP-Ⅳ抑制能力
图3 合成肽与花色苷的DPP-Ⅳ抑制能力
Fig.3 DPP-Ⅳ inhibitory abilities of synthetic peptides and anthocyanins
如图3-b所示,6种常见的花色苷:芍药色素/矢车菊素/锦葵色素/飞燕草素/天竺葵色素/矮牵牛色素-3-O-葡萄糖苷(Pn3G, C3G, Mv3G, D3G, Pg3G, Pt3G)对DPP-Ⅳ的IC50为6.99~23.62 μg/mL,均具有较强的DPP-Ⅳ抑制活性。6种花色苷的DPP-Ⅳ抑制活性强度顺序为Pn3G>C3G=Mv3G>Pg3G>D3G>Pt3G,这种差异可能是由于花色苷B环上3′和5′位置上的不同基团与DPP-Ⅳ的结合能力不同引起的[6]。李伊姣[31]的研究也证明花色苷对DPP-Ⅳ的抑制作用与其化学结构有关。综上,本研究选择DPP-Ⅳ抑制活性最佳的3种花色苷(Pn3G、C3G、Mv3G)与合成肽FR-5进行后续的协同抑制DPP-Ⅳ实验。
2.6 合成肽、花色苷及合成肽-花色苷复合物的颜色分析
合成肽FR-5与DPP-Ⅳ抑制活性最佳的3种花色苷(Pn3G、C3G、Mv3G)协同组装后的颜色参数如表3所示。FR-5与Pn3G/C3G/Mv3G组装复合物相较于Pn3G/C3G/Mv3G的L*均显著降低,a*、b*、C*和h均显著升高,表明组装复合物溶液的颜色强度与饱和度提高,这可能是FR-5与花色苷发生的相互作用导致花色苷的空间结构改变引起的[18]。通过计算ΔE*比较FR-5与Pn3G/C3G/Mv3G组装前后的颜色变化,发现ΔE*均大于3,表明组装成复合物后的样品溶液相较于组装前发生了人肉眼可察觉的颜色变化[32],此颜色变化从图4中也可观察。花色苷在光照、碱性环境及长期储存条件下稳定性较差、易降解,花色苷的降解程度越大其褪色越严重,活性损失越大(或活性保留率越低)[18],而本研究中FR-5与花色苷组装成复合物后颜色加深,这可能是合成肽FR-5可作为辅色因子通过氢键、疏水相互作用及范德华力等非共价作用力与花色苷发生相互作用结合成复合物,从而提高花色苷抵抗不良环境因子的能力,赋予增强花色苷稳定性提高其活性保留率的潜力[33]。HE等[34]的研究也表明牛奶中α-酪蛋白和β-酪蛋白能够提高花色苷颜色稳定性、热稳定性、氧化稳定性和光稳定性的原因可能是酪蛋白与花色苷间通过氢键和疏水相互作用等形成复合物从而保护花色苷不被降解。YAO等[12]研究发现两亲性肽C6通过其色氨酸残基中的吲哚基团与花色苷C3G的2-苯基苯并吡喃结构域发生相互作用组装成的纳米复合物比单独的C3G颜色深,复合物有效提高了花色苷的热稳定性、pH稳定性和储存稳定性并保证了其抗氧化活性的发挥。
表3 合成肽、花色苷和合成肽-花色苷复合物的颜色指标
Table 3 Color indexes of synthetic peptides, anthocyanins and complexes
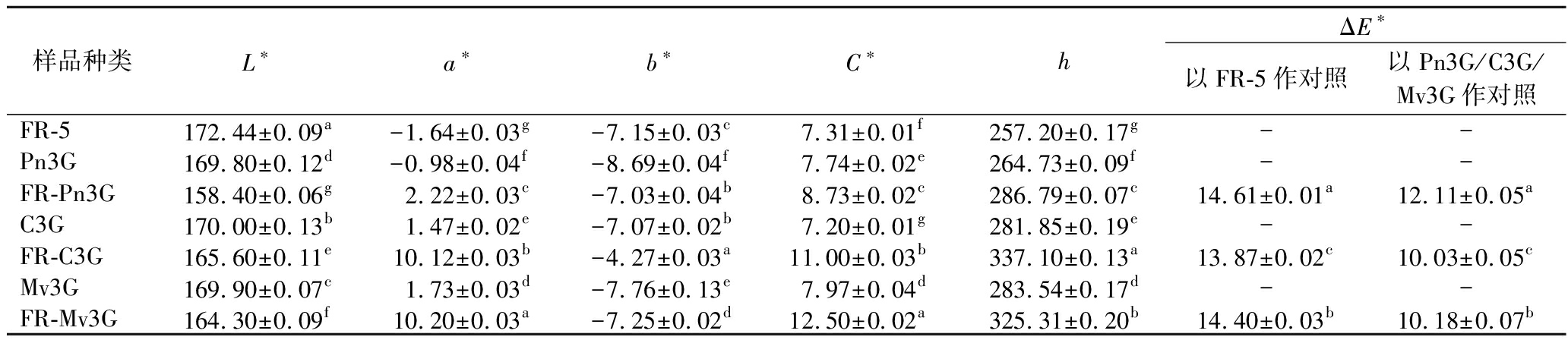
样品种类L∗a∗b∗C∗hΔE∗以FR-5作对照以Pn3G/C3G/Mv3G作对照FR-5172.44±0.09a-1.64±0.03g-7.15±0.03c7.31±0.01f257.20±0.17g--Pn3G169.80±0.12d-0.98±0.04f-8.69±0.04f7.74±0.02e264.73±0.09f--FR-Pn3G158.40±0.06g2.22±0.03c-7.03±0.04b8.73±0.02c286.79±0.07c14.61±0.01a12.11±0.05aC3G170.00±0.13b1.47±0.02e-7.07±0.02b7.20±0.01g281.85±0.19e--FR-C3G165.60±0.11e10.12±0.03b-4.27±0.03a11.00±0.03b337.10±0.13a13.87±0.02c10.03±0.05cMv3G169.90±0.07c1.73±0.03d-7.76±0.13e7.97±0.04d283.54±0.17d--FR-Mv3G164.30±0.09f10.20±0.03a-7.25±0.02d12.50±0.02a325.31±0.20b14.40±0.03b10.18±0.07b
注:-表示对应样品不计算ΔE*。

图4 合成肽、花色苷和合成肽-花色苷复合物的颜色
Fig.4 Colors of synthetic peptides, anthocyanins and complexes
2.7 合成肽FR-5-花色苷复合物DPP-Ⅳ抑制活性分析
为了探究合成肽FR-5与花色苷协同复合后是否具有DPP-Ⅳ抑制活性增效作用,分别测定FR-Pn3G、FR-C3G和FR-Mv3G复合物的DPP-Ⅳ抑制活性。由图5可知,FR-Pn3G、FR-C3G和FR-Mv3G三种协同复合物对DPP-Ⅳ均具有较强的抑制作用,其IC50值分别为(26.70±0.26)、(30.89±0.81)和(28.68±0.87) μg/mL,显著低于单独FR-5的IC50值(63.57±2.73) μg/mL,却高于单独花色苷的IC50值(6.99±0.52)、(8.86±0.06)和(8.40±0.20) μg/mL(P<0.05),但复合物颜色的加深表明FR-5与花色苷组装具有提高花色苷对不良环境因子的耐受力,从而提高其DPP-Ⅳ抑制活性保留率的潜力。由于复合物浓度为组装过程中所使用花色苷浓度的7倍,虽然复合物抑制DPP-Ⅳ的IC50值比单独的花色苷大,但复合物中的花色苷用量比单独的花色苷用量少。此外,3种合成肽-花色苷复合物中,FR-Pn3G的DPP-Ⅳ抑制活性最强(P<0.05),这可能是由于与FR-C3G和FR-Mv3G复合物相比,FR-Pn3G复合物的结构可能更容易与DPP-Ⅳ相互作用抑制其活性,具体可能原因包括:(a)Pn3G相较于C3G和Mv3G对DPP-Ⅳ的抑制活性最强,这与其结构中B环上—OCH3和—OH基团的数量和位置有关[35];(b)花色苷主要通过其结构中羟基、苯环等与活性肽中氨基酸残基上的羟基、疏水基团等发生氢键、范德华力及疏水作用力等相互作用力,从而提高花色苷的稳定性和活性[36-37];本研究中的活性肽FR-5(Phe-Pro-Val-Gly-Arg)中含有与花色苷发生互作后能够有效提高其热稳定性和抗氧化活性的精氨酸、甘氨酸和脯氨酸,且苯丙氨酸中含有的苯环结构容易与花色苷发生相互作用[38],因此,FR-5和3种花色苷(Pn3G、C3G和Mv3G)的结构对二者通过互作形成的复合物的结构及其稳定性和活性具有重要关联。类似的研究结果也曾被报道过,SU等[39]研究比较了核桃蛋白肽FQ与4种核桃皮多酚GA、CA、QU、C复合前后的AChE酶抑制活性,结果发现4种多酚中CA的AChE抑制活性最强,且CA与FQ复合后的AChE抑制活性是4种复合物中最强的,这与CA和FQ复合后的结构可能更容易与AChE酶发生相互作用有密切关联。综上,我们根据DPP-Ⅳ抑制活性数据、花色苷和活性肽的结构及现有文献报道推测与FR-C3G和FR-Mv3G复合物相比,FR-Pn3G复合物的结构可能更容易与DPP-Ⅳ相互作用抑制其活性。

图5 合成肽-花色苷复合物的DPP-Ⅳ抑制能力
Fig.5 DPP-Ⅳ inhibitory ability of synthetic peptide-anthocyanin complexes
2.8 合成肽FR-5和花色苷的协同作用结果分析
为了进一步探究合成肽和花色苷的协同作用,根据合成肽FR-5、花色苷(Pn3G/C3G/Mv3G)及合成肽FR-5-花色苷复合物抑制DPP-Ⅳ活性的剂量-效应结果,使用Compusyn协同计算模型进行研究。使用合成肽FR-5的质量浓度为25、50、100、300、500 μg/mL,其中在探究FR-5和Pn3G的协同作用时,Pn3G的浓度为5、10、15、20、25 μg/mL;在探究FR-5和C3G/Mv3G的协同作用时,C3G/Mv3G的质量浓度为1、5、10、20、30 μg/mL。FR-5和Pn3G/C3G/Mv3G复合物的质量浓度为10、20、40、60、80 μg/mL,使用恒定比率组合设计方法计算生成的合成肽FR-5和花色苷(Pn3G/C3G/Mv3G)作用结果如图6、图7和图8所示。
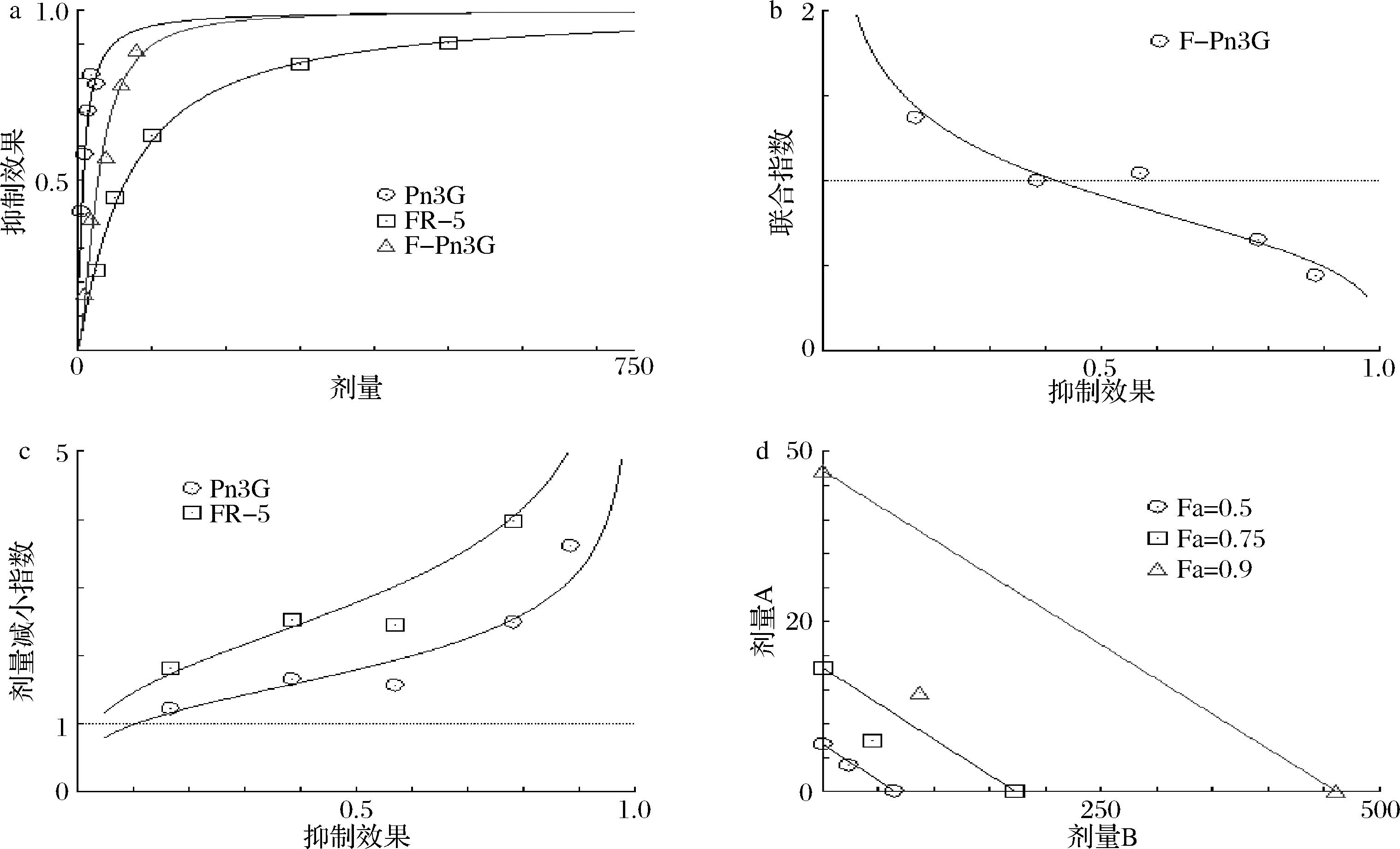
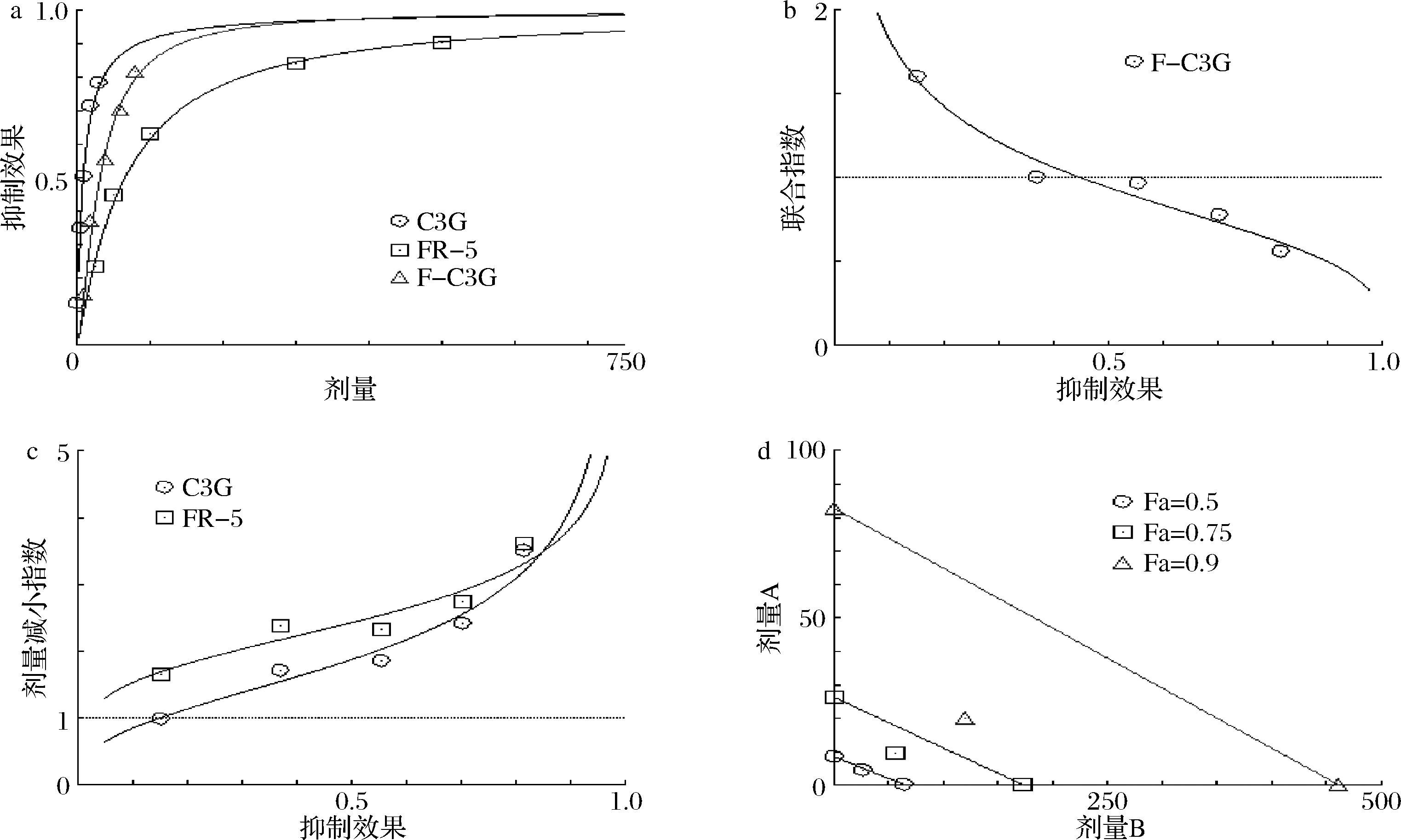
a-剂量-效应图;b-联合指数图;c-剂量-效应减少图;d-等值线图
图6 FR-5和Pn3G对DPP-Ⅳ的协同抑制作用
Fig.6 The synergistic inhibitory effect of FR-5 and Pn3G against DPP-Ⅳ
a-剂量-效应图;b-联合指数图;c-剂量-效应减少图;d-等值线图
图7 FR-5和C3G对DPP-Ⅳ的协同抑制作用
Fig.7 The synergistic inhibitory effect of FR-5 and C3G against DPP-Ⅳ
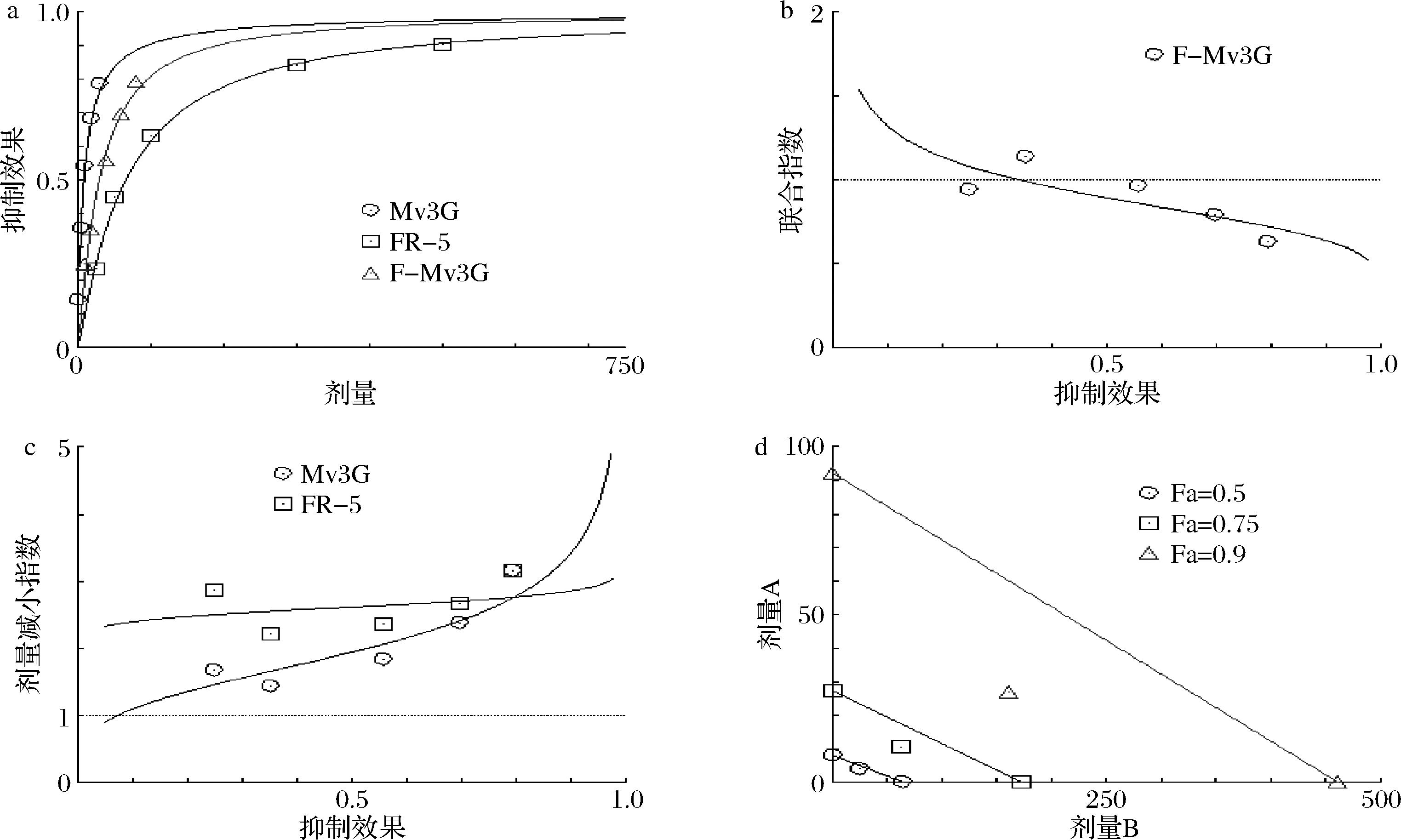
a-剂量-效应图;b-联合指数图;c-剂量-效应减少图;d-等值线图
图8 FR-5和Mv3G对DPP-Ⅳ的协同抑制作用
Fig.8 The synergistic inhibitory effect of FR-5 and Mv3G against DPP-Ⅳ
由剂量-效应图6-a、7-a、8-a可知,FR-5、Pn3G/C3G/Mv3G和FR-Pn3G/C3G/Mv3G复合物在发挥抑制DPP-Ⅳ活性时存在良好的量效关系,且Pn3G/C3G/Mv3G对DPP-Ⅳ的抑制效果强于FR-5,说明FR-5和花色苷协同后的活性主要依赖于花色苷。联合指数(combined index,CI)<1、CI=1、CI>1分别代表协同作用、加性作用和拮抗作用[19]。如图6-b、7-b和8-b所示,FR-5和Pn3G/C3G/Mv3G对DPP-Ⅳ的联合抑制作用具有浓度依赖性,且FR-5与3种花色苷的协同作用效果相似,分别在Fa≥0.45、Fa≥0.5和Fa≥0.35后,对应的CI<1,表明此时FR-5和Pn3G/C3G/Mv3G对DPP-Ⅳ均具有协同抑制作用。由图6-c、7-c、8-c可知,FR-5和Pn3G/C3G/Mv3G的剂量减少指数均大于1,且随Fa的增大而增大,说明联合使用可以明显减少FR-5和花色苷的使用剂量。等值线图是指2种药物组合的等效剂量图,组合数据点落在等值线上、左下、右上分别表示加性作用、协同作用、拮抗作用,横坐标和纵坐标分别表示FR-5和花色苷抑制率达到90% (Fa=0.9,绿线)、75% (Fa=0.75,红线)和50% (Fa=0.5,蓝线)所需的剂量[19]。由图6-d、7-d和8-d可知,当同时加入FR-5和Pn3G/C3G/Mv3G时,抑制率为90%、75%处的点在对应等值线的左下方,表明FR-5和Pn3G/C3G/Mv3G具有DPP-Ⅳ协同抑制作用。
3 结论
本研究制备的牡蛎DPP-Ⅳ抑制肽的分子质量主要集中在3 kDa以下,具有良好的DPP-Ⅳ抑制活性。肽谱分析显示牡蛎肽富含支链氨基酸和脯氨酸,且其序列位置主要位于肽链N端的前4位,具有DPP-Ⅳ抑制肽的典型结构特征。基于肽谱分析合成的5条肽段均具有显著的DPP-Ⅳ抑制效果,是良好的DPP-Ⅳ抑制肽,其中FR-5与Pn3G/C3G/Mv3G协同组装后,具有良好的DPP-Ⅳ抑制活性增效作用,且FR-Pn3G复合物的DPP-Ⅳ抑制活性最强。FR-5与Pn3G/C3G/Mv3G组装复合物相较于Pn3G/C3G/Mv3G颜色强度提高,具有增强花色苷稳定性提高其活性保留率的潜力。Compusyn协同计算模型结果显示,在Fa≥0.5后CI<1,FR-5和Pn3G/C3G/Mv3G分别具有协同抑制效果。本研究可为其他活性肽和多酚类膳食功能因子的活性增效研究及应用提供新的思路。
[1] WANG R C, ZHAO H X, PAN X X, et al.Preparation of bioactive peptides with antidiabetic, antihypertensive, and antioxidant activities and identification of α-glucosidase inhibitory peptides from soy protein[J].Food Science &Nutrition, 2019, 7(5):1848-1856.
[2] TÖNNIES T, RATHMANN W, HOYER A, et al.Quantifying the underestimation of projected global diabetes prevalence by the International Diabetes Federation (IDF) Diabetes Atlas[J].BMJ Open Diabetes Research &Care, 2021, 9(1):e002122.
[3] LACROIX I M E, LI-CHAN E C Y.Food-derived dipeptidyl-peptidase Ⅳ inhibitors as a potential approach for glycemic regulation-Current knowledge and future research considerations[J].Trends in Food Science &Technology, 2016, 54:1-16.
[4] HONG H, ZHENG Y Y, SONG S J, et al.Identification and characterization of DPP-Ⅳ inhibitory peptides from silver carp swim bladder hydrolysates[J].Food Bioscience, 2020, 38:100748.
[5] POOJA K, RANI S, KANWATE B, et al.Physico-chemical, sensory and toxicity characteristics of dipeptidyl peptidase-Ⅳ inhibitory peptides from rice bran-derived globulin using computational approaches[J].International Journal of Peptide Research and Therapeutics, 2017, 23(4):519-529.
[6] MOJICA L, BERHOW M, DE MEJIA E G.Black bean anthocyanin-rich extracts as food colorants:Physicochemical stability and antidiabetes potential[J].Food Chemistry, 2017, 229:628-639.
[7] 章超桦. 牡蛎营养特性及功能活性研究进展[J].大连海洋大学学报, 2022, 37(5):719-731.ZHANG C H.Research progress on nutritional characteristics and bioactivities of oysters:A review[J].Journal of Dalian Ocean University, 2022, 37(5):719-731.
[8] 张佩, 陈忠琴, 曹文红, 等.牡蛎抗氧化及降糖肽的结构特征及其体外模拟消化特性[J].食品与发酵工业, 2022, 48(21):196-203.ZHANG P, CHEN Z Q, CAO W H, et al.Structural characteristics of antioxidant and hypoglycemic peptides from oyster (Crassostrea hongkongensis) and their simulated digestive properties in vitro[J].Food and Fermentation Industries, 2022, 48(21):196-203.
[9] 赵嘉妮, 陈宏, 翁凌, 等.食源性DPP-Ⅳ抑制肽降血糖作用机制研究进展[J].食品工业科技, 2021, 42(23):447-454.ZHAO J N, CHEN H, WENG L, et al.Research progress on the mechanism of food-derived DPP-Ⅳ inhibitory peptides for hypoglycemic effect[J].Science and Technology of Food Industry, 2021, 42(23):447-454.[10] RENUKUNTLA J, VADLAPUDI A D, PATEL A, et al.Approaches for enhancing oral bioavailability of peptides and proteins[J].International Journal of Pharmaceutics, 2013, 447(1-2):75-93.
[11] LI Y W, YAO L, ZHANG L W, et al.Enhanced physicochemical stabilities of cyanidin-3-O-glucoside via combination with silk fibroin peptide[J].Food Chemistry, 2021, 355:129479.
[12] YAO L, XU J, ZHANG L W, et al.Physicochemical stability-increasing effects of anthocyanin via a co-assembly approach with an amphiphilic peptide[J].Food Chemistry, 2021, 362:130101.
[13] LIN D Q, SUN L C, HUO W S, et al.Improved functionality and safety of peptides by the formation of peptide-polyphenol complexes[J].Trends in Food Science &Technology, 2023, 141:104193.
[14] 柏昌旺, 章超桦, 林海生, 等.响应面法优化制备牡蛎短肽工艺[J].广东海洋大学学报, 2019, 39(6):85-92.BAI C W, ZHANG C H, LIN H S, et al.Optimization of preparation process of oyster oligopeptides by response surface methodology[J].Journal of Guangdong Ocean University, 2019, 39(6):85-92.
[15] GAIDAU C, STANCA M, NICULESCU M D, et al.Wool keratin hydrolysates for bioactive additives preparation[J].Materials, 2021, 14(16):4696.
[16] TAN X Y, ZHANG S B, MALDE A K, et al.Effects of chickpea protein fractions on α-amylase activity in digestion[J].Food Hydrocolloids, 2022, 133:108005.
[17] JIN R T, TENG X Y, SHANG J Q, et al.Identification of novel DPP-Ⅳ inhibitory peptides from Atlantic salmon (Salmo salar) skin[J].Food Research International, 2020, 133:109161.
[18] YAO L, XU J, ZHANG L W, et al.Nanoencapsulation of anthocyanin by an amphiphilic peptide for stability enhancement[J].Food Hydrocolloids, 2021, 118:106741.
[19] CHENG L, FENG Y X, HU Y, et al.The synergistic anti-inflammatory activity and interaction mechanism of ellagic acid and a bioactive tripeptide (Phe-Pro-Leu) from walnut meal[J].Plant Foods for Human Nutrition, 2022, 77(2):286-291.
[20] SU N, YI L, HE J, et al.Identification and molecular docking of a novel antidiabetic peptide from protamex-camel milk protein hydrolysates against α-amylase and DPP-Ⅳ[J].International Dairy Journal, 2024, 152:105884.
[21] BERRAQUERO-GARC A C, RIVERO-PINO F, OSPINA J L, et al.Activity, structural features and in silico digestion of antidiabetic peptides[J].Food Bioscience, 2023, 55:102954.
A C, RIVERO-PINO F, OSPINA J L, et al.Activity, structural features and in silico digestion of antidiabetic peptides[J].Food Bioscience, 2023, 55:102954.
[22] 孙洁, 李燕, 郑昌亮, 等.中国毛虾二肽基肽酶-Ⅳ抑制肽的分离纯化与结构鉴定[J].食品与发酵工业, 2023, 49(1):160-167.SUN J, LI Y, ZHENG C L, et al.Purification and identification of dipeptidyl peptidase-Ⅳ inhibitory peptide from Acetes chinensis hydrolysates[J].Food and Fermentation Industries, 2023, 49(1):160-167.
[23] 吴燕燕, 霍玉梅, 胡晓.海洋生物源DPP-Ⅳ抑制肽的制备和构效关系的研究进展[J].上海海洋大学学报, 2022, 31(4):994-1004.WU Y Y, HUO Y M, HU X.Progress in study on preparation and structure-activity relationship of DPP-Ⅳ inhibiting peptides from marine organisms[J].Journal of Shanghai Ocean University, 2022, 31(4):994-1004.
[24] DULLIUS A, FASSINA P, GIROLDI M, et al.A biotechnological approach for the production of branched chain amino acid containing bioactive peptides to improve human health:A review[J].Food Research International, 2020, 131:109002.
[25] NONGONIERMA A B, PAOLELLA S, MUDGIL P, et al.Identification of novel dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory peptides in camel milk protein hydrolysates[J].Food Chemistry, 2018, 244:340-348.
[26] GONZ LEZ-MONTOYA M, HERN
LEZ-MONTOYA M, HERN NDEZ-LEDESMA B, MORA-ESCOBEDO R, et al.Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-Ⅳ, α-amylase, and α-glucosidase enzymes[J].International Journal of Molecular Sciences, 2018, 19(10):2883.
NDEZ-LEDESMA B, MORA-ESCOBEDO R, et al.Bioactive peptides from germinated soybean with anti-diabetic potential by inhibition of dipeptidyl peptidase-Ⅳ, α-amylase, and α-glucosidase enzymes[J].International Journal of Molecular Sciences, 2018, 19(10):2883.
[27] 钱兢菁, 郑淋, 赵谋明.酪蛋白体外消化过程中DPP-Ⅳ抑制活性的变化规律及其机制分析[J].食品科学, 2020, 41(15):186-193.QIAN J J, ZHENG L, ZHAO M M.Changing pattern of dipeptidyl peptidase Ⅳ(DPP-Ⅳ) inhibitory activity during casein digestion in vitro and underlying mechanism[J].Food Science, 2020, 41(15):186-193.
[28] KUHN A, PARK J, GHAZI A, et al.Intensifying treatment beyond monotherapy in type 2 diabetes mellitus:Where do newer therapies fit?[J].Current Cardiology Reports, 2017, 19(3):25.
[29] ZHANG Y, CHEN R, CHEN X L, et al.Dipeptidyl peptidase Ⅳ-inhibitory peptides derived from silver carp (Hypophthalmichthys molitrix val.) proteins[J].Journal of Agricultural and Food Chemistry, 2016, 64(4):831-839.
[30] 蒋美龄, 陈忠琴, 秦小明, 等.牡蛎降糖肽的结构表征及其协同花色苷的活性增效作用[J].大连海洋大学学报, 2023, 38(3):455-463.JIANG M L, CHEN Z Q, QIN X M, et al.Structural characterization and the synergistic effects with anthocyanin of oyster hypoglycemic peptides[J].Journal of Dalian Ocean University, 2023, 38(3):455-463.
[31] 李伊姣. 天然黄酮类化合物及蓝莓黑莓酒中花青素对DPP-Ⅳ的抑制活性[D].北京:北京林业大学, 2014.LI Y J.Natural flavonoids and anthocyanins in blueberry-blackberry wine for dipeptidyl peptidase Ⅳ (DPP-Ⅳ) inhibitory activity[D].Beijing:Beijing Forestry University, 2014.
[32] GIUFFRIDA DE ESTEBAN M L, UBEDA C, HEREDIA F J, et al.Impact of closure type and storage temperature on chemical and sensory composition of Malbec wines (Mendoza, Argentina) during aging in bottle[J].Food Research International, 2019, 125:108553.
[33] TANG R, HE Y, FAN K.Recent advances in stability improvement of anthocyanins by efficient methods and its application in food intelligent packaging:A review[J].Food Bioscience, 2023, 56:103164.
[34] HE Z Y, XU M Z, ZENG M M, et al.Interactions of milk α- and β-casein with malvidin-3-O-glucoside and their effects on the stability of grape skin anthocyanin extracts[J].Food Chemistry, 2016, 199:314-322.
[35] WANG J D, ZHAO Y Q, SUN B, et al.The structure of anthocyanins and the copigmentation by common micromolecular copigments:A review[J].Food Research International, 2024, 176:113837.
[36] CONDURACHE N N, APRODU I, GRIGORE-GURGU L, et al.Fluorescence spectroscopy and molecular modeling of anthocyanins binding to bovine lactoferrin peptides[J].Food Chemistry, 2020, 318:126508.
[37] YIN Z C, WU Y R, CHEN Y, et al.Analysis of the interaction between cyanidin-3-O-glucoside and casein hydrolysates and its effect on the antioxidant ability of the complexes[J].Food Chemistry, 2021, 340:127915.
[38] ASEN S, STEWART R N, NORRIS K H.Co-pigmentation of anthocyanins in plant tissues and its effect on color[J].Phytochemistry, 1972, 11(3):1139-1144.
[39] SU G W, CHEN J Q, HUANG L, et al.Effects of walnut seed coat polyphenols on walnut protein hydrolysates:Structural alterations, hydrolysis efficiency, and acetylcholinesterase inhibitory capacity[J].Food Chemistry, 2024, 437(Pt 1):137905.