D-阿洛酮糖是D-果糖在C-3的差向异构体,口感和蔗糖相似,甜度是蔗糖的70%,热量仅为蔗糖的10%,被称为“低卡蔗糖”[1-2],它的功能有:蔗糖替代品;参与美拉德反应,增加食物色泽;改善食品凝胶过程;抗氧化;应用于临床医学;具备多种生理功能;可作驱虫剂等[3-4]。近年来,人们对健康低卡饮食越来越关注,而D-阿洛酮糖具备和蔗糖相似的口感和甜度,在满足人们味蕾的同时还具备低卡低热量的显著优势,因此D-阿洛酮糖的制备成为研究热点。传统制备D-阿洛酮糖的方法有化工合成法和生物合成法,其中,化工合成法具有:伴有副产物、成本高、操作危险、工艺难度大、纯化复杂、收率低、环境污染且其产品安全性待考究等缺点[5];然而,生物合成法具有:纯化步骤简单、产物浓度高、反应条件温和、低毒环保、环境相容性好等优势,因此生物合成法制备D-阿洛酮糖成为一类研究热点[6]。目前D-阿洛酮糖的生产主要集中在日本、韩国、美国及中国的部分地区等[7-8]。国外的生产企业主要有松谷化学、泰莱、宜瑞安等,国内的企业主要有保龄宝、中化国际、百龙创园等。与其他发达国家企业相比,目前我国的D-阿洛酮糖生产规模相对较小、生产成本较高、国际竞争力不强,有较大的发展进步空间,因此需要科研人员进一步研究探索,优化D-阿洛酮糖的生产[9]。根据新思界产业研究中心公布的《2021—2015年D-阿洛酮糖行业市场供需现状及行业经营指标深度调查分析报告》显示,在2020年D-阿洛酮糖的全球市场规模已达到2.2亿元,其中大约54%用于食品行业,36%用于饮料当中,预计到2030年,其产业规模可达4.3亿美元[10]。目前,D-阿洛酮糖的工业生产主要依靠生物合成法,即利用一些特定的酶或微生物细胞,将廉价的糖转化为D-阿洛酮糖[10],在这个过程中,D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,DPE)是生物合成法中的关键酶,它将D-果糖催化成D-阿洛酮糖,参与可逆反应。本研究选取溶纤瘤胃杆菌H10来源的DPE,并在地衣芽孢杆菌CICIM B1391中异源表达该酶。此前有人曾在大肠杆菌表达系统、酵母表达系统以及枯草芽孢杆菌表达系统中表达该酶,那么地衣芽孢杆菌作为又一革兰氏阳性菌,它的优势具有:生长速率适中、蛋白折叠充分;抗逆性强,不易染菌;酶系丰富、胞外蛋白分泌量高;可利用碳源选择多;嗜热菌,耐受性强等[11]。
应用高强度启动子介导目的基因在宿主内持续性高表达是工业微生物遗传改造的重要基础,选取适宜的高强度启动子对DPE的表达具有至关重要的作用[12-14]。此外,本研究还涉及到全细胞转化反应,全细胞转化是利用菌体内的酶作为催化剂,将底物转化成产物的过程[15]。本质是利用细胞内的酶进行催化,是介于发酵法和提取酶催化法之间的一种生物催化技术,具有独特的优势:首先,细胞作为催化剂制剂大大地降低了生产成本,而且全细胞也提供了生物转化所需的辅因子并简化了它们的再生过程;此外,残留的细胞壁化合物还对静止或死细胞起到保护作用,使得转化反应在不同的条件下都能顺利进行[16]。
本研究首先进行地衣芽孢杆菌重组菌的构建,建立起DPE在地衣芽孢杆菌中的表达评价方法,并对其全细胞转化方法以及摇瓶培养发酵条件进行优化,最终在最优培养条件下探索D-阿洛酮糖的最高产量。其中图1为工业制备D-阿洛酮糖生物合成法的工艺流程,本研究主要针对第2~4步开展研究。

图1 生物法合成D-阿洛酮糖的工艺流程
Fig.1 Technological process of biological synthesis of D-allulose
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究中所使用的菌株、质粒如表1所示。
表1 本研究所用的菌株及质粒
Table 1 Strains and plasmids used in this study
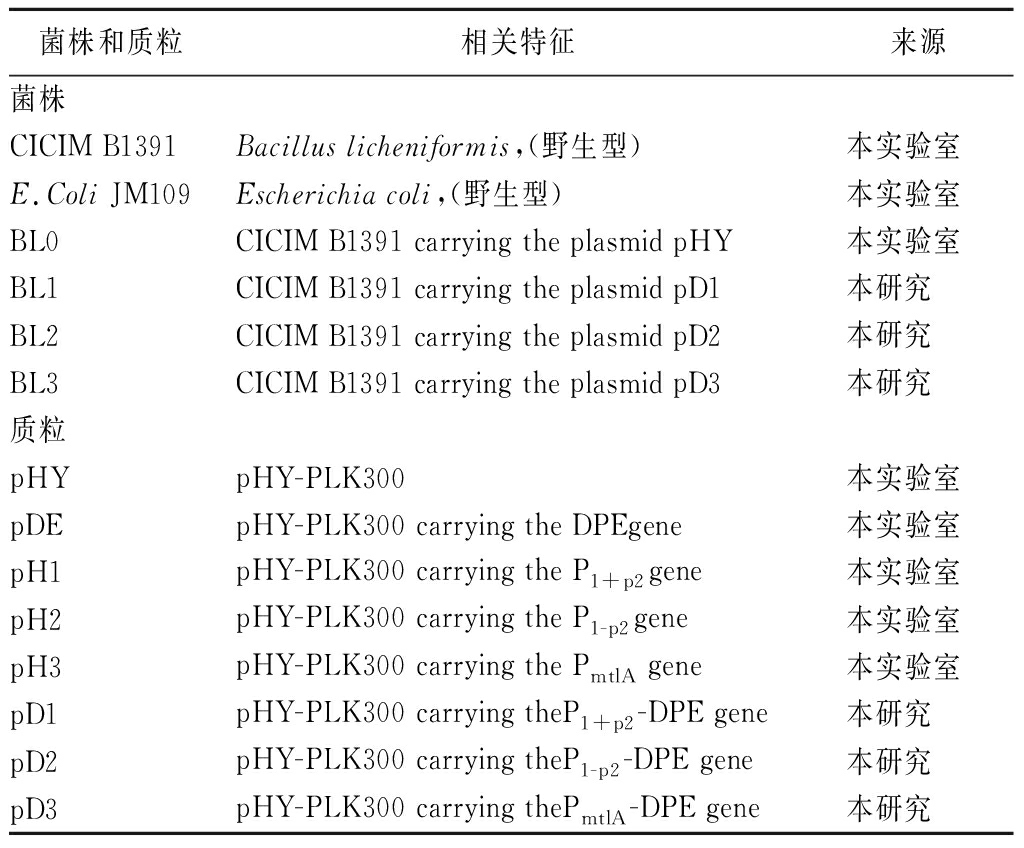
菌株和质粒相关特征来源菌株CICIM B1391Bacillus licheniformis,(野生型)本实验室E.Coli JM109Escherichia coli,(野生型)本实验室BL0CICIM B1391 carrying the plasmid pHY本实验室BL1CICIM B1391 carrying the plasmid pD1本研究BL2CICIM B1391 carrying the plasmid pD2本研究BL3CICIM B1391 carrying the plasmid pD3本研究质粒pHYpHY-PLK300本实验室pDEpHY-PLK300 carrying the DPEgene本实验室pH1pHY-PLK300 carrying the P1+p2gene本实验室pH2pHY-PLK300 carrying the P1-p2gene本实验室pH3pHY-PLK300 carrying the PmtlA gene本实验室pD1pHY-PLK300 carrying theP1+p2-DPE gene本研究pD2pHY-PLK300 carrying theP1-p2-DPE gene本研究pD3pHY-PLK300 carrying thePmtlA-DPE gene本研究
1.1.2 实验试剂
D-果糖、D-阿洛酮糖标准样品,北京百灵威科技有限公司;氨苄青霉素、四环素,美国Sigma公司;2×Phanta Max Master Mix(Dye Plus)、一步克隆连接试剂盒ClonExpress Ⅱ One Step Cloning Kit C112以及DNA提取、纯化、凝胶回收试剂盒,南京诺唯赞生物科技有限公司;2×Rapid Taq PCR Master Mix、限制性核酸内切酶,美国Thermo Fisher公司;棉籽蛋白(不溶),北京鸿润宝顺科技有限公司;硼酸等其他常用试剂,上海国药集团有限公司。
1.1.3 培养基与缓冲液
LB培养基:参照文献[15]进行配制。
发酵培养基A(g/L):磷酸氢二胺10、三水磷酸氢二钾9.12、磷酸二氢钾1.36、棉籽蛋白(不溶)30、玉米浆干粉5、胰蛋白胨10、酵母粉10、麦芽糊精75、氯化钴0.5、七水硫酸镁0.5。
发酵培养基B(g/L):棉籽蛋白(不溶)30、玉米浆干粉5、胰蛋白胨10、酵母粉10、三水磷酸氢二钾9.12、磷酸二氢钾1.36、磷酸氢二胺10、蔗糖75。
地衣芽孢杆菌电转化培养基:参照文献[17]进行配制。
上述培养基所添加的氨苄青霉素或四环素的终质量浓度分别为100、20 μg/mL。
全细胞转化用溶液:
a)10 mmol/L磷酸盐缓冲液A(pH 7.4):磷酸二氢钠10 mmol/L+磷酸氢二钠10 mmol/L,调pH。
b)金属离子母液B[18]:氯化钴0.1 mol/L+氯化锰0.1 mol/L。
c)HEPES-果糖溶液[19](pH 7.5):N-2-羟乙基哌嗪-N′-2-乙磺酸电子版1:[N-(2-hydroxyethyl)piperazine-N′-2-ethanesulfonic acid,HEPES]50 mmol/L、果糖100~500 g/L,调pH。
d)HEPES-果糖-硼酸溶液[19](pH 7.5~8):HEPES 500 mmol/L、果糖100 g/L,硼酸/D-果糖(mol/mol)0~1[16],调pH。
1.2 仪器与设备
恒温金属浴,上海一恒科技有限公司;pH计,上海梅特勒-托利多仪器有限公司;可见分光光度计,上海美谱达仪器有限公司;S100D型PCR仪,美国BIO-RAD公司。
1.3 实验方法
1.3.1 重组质粒的构建
对实验室保藏菌株中带有DPE片段的质粒pDE使用Hind Ⅲ和Kpn Ⅰ进行双酶切,胶回收纯化含有DPE片段的pHY载体,分别以pH1、pH2、pH3为模板,使用含有同源臂的引物对pH 1~3进行PCR,其中P1引物用于pH1,P2引物用于pH2,PA引物用于pH3,PCR产物回收纯化,同源重组连接形成重组质粒pD1、pD2、pD3,连接产物转化至E.coli JM109感受态细胞中,挑取阳性转化子,接入带有氨苄抗性的LB液体培养基中过夜培养,提取质粒,送上海生工测序,将测序正确的质粒电转化到地衣芽孢杆菌感受态细胞中,挑取阳性转化子,接入带有四环素抗性的LB液体培养基中过夜培养,获得重组地衣芽孢杆菌BL1-3。图2为质粒构建示意图。所用引物序列如表2所示。
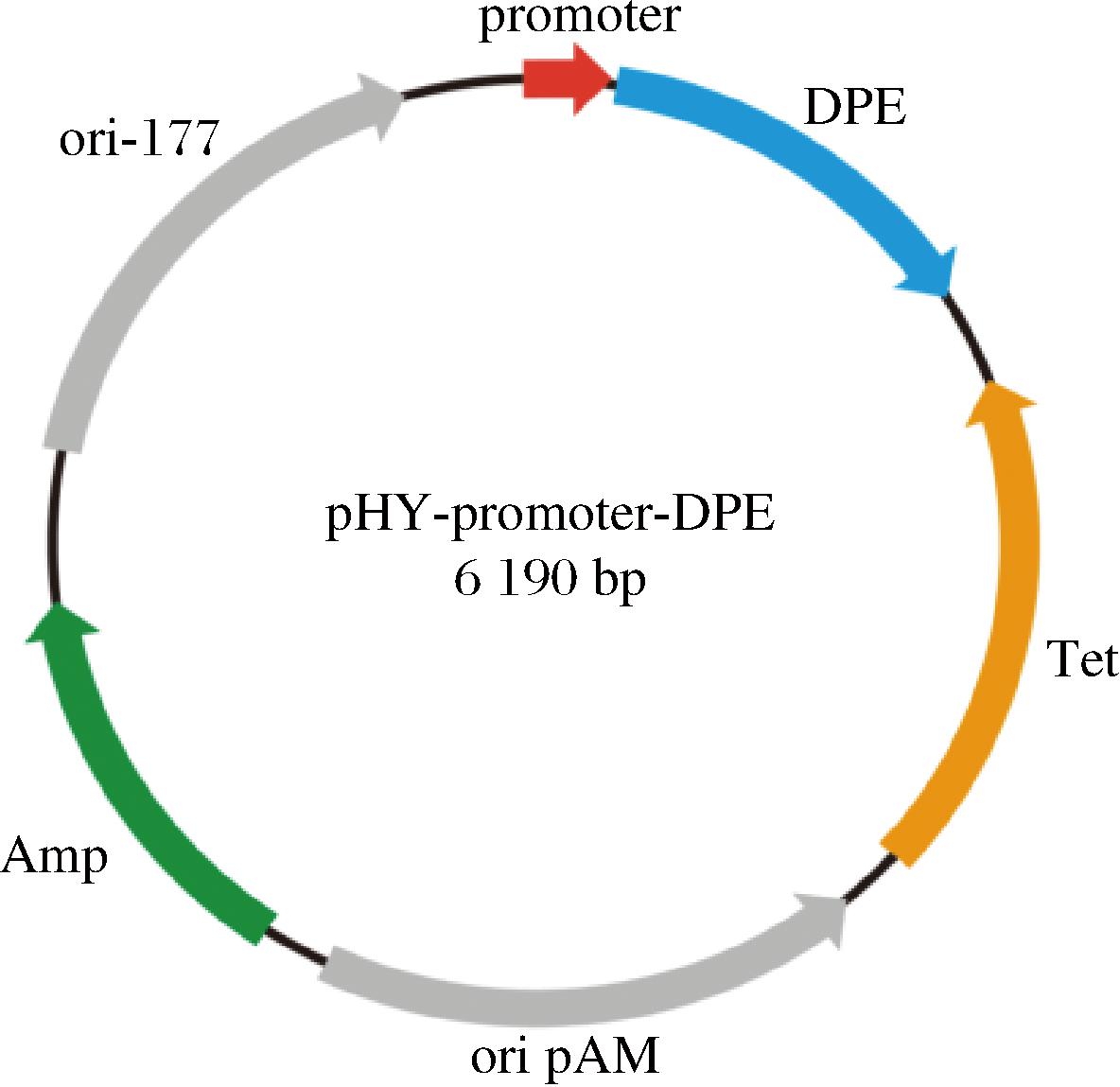
图2 重组质粒构建图谱
Fig.2 Construction map of plasmid
表2 本研究所涉及引物序列
Table 2 Primer sequences involved in this study

引物引物序列(5'-3')P1-FAAAAACGCTTTGCCCAGTTTATGTATAGATATTTTCGAATATTTAACTTATTGGACACAATP1-RATGTTTCATGGTACCTTTCCTTCACCTCTTAATTAATTTTGGGAGCTCAP2-FAAAAACGCTTTGCCCAAATAGGGCATTTTGCACAAGAAATAATCCAAAP2-RATGTTTCATGGTACCTTTCCTTCACCTCTTAATTAATTTTGGGAGCTCAPA-FAAAAACGCTTTGCCCGACCATTCCAATCAGGAATGGTCTTTTTTTATGPA-RATGTTTCATGGTACCTTTCATAACCCTCCTTTGTTGTCCTTTAAAGC
1.3.2 重组地衣芽孢杆菌的培养
1.3.2.1 种子液活化:
将在-70 ℃甘油管保藏的重组地衣芽孢杆菌BL1-3划线至带有四环素抗性的固体LB平板,37 ℃培养18~24 h。从平板上挑取单菌落,接种于装有15 mL LB培养基的锥形瓶中,于37 ℃、200 r/min的摇床中培养18~24 h,使用分光光度计测量OD600值=2~4得到种子液[15]。
1.3.2.2 摇瓶培养:
种子液以3%的接种量[17]转接于装液量为30 mL的250 mL挡板摇瓶中,37 ℃、250 r/min培养。每隔24 h取1 mL发酵液[15],测量菌株的光密度OD600值以及做全细胞转化反应。
1.3.3 全细胞转化
取出的1 mL发酵液于4 ℃、12 000 r/min离心20 min,弃去上清培养基成分,使用预冷的缓冲液A清洗,再次离心弃去上清液,根据测得的OD600值以及目标反应体系OD600值计算出加入总反应体系的体积,反应体系如下:a)反应细胞:体系细胞OD600值通过加入液体总体积来控制;b)HEPES-果糖溶液:底物D-果糖质量浓度为100~300 g/L;c)金属离子母液B:终浓度为5 mmol/L[9]。将反应体系吹吸混匀,取1 mL于1.5 mL EP管,放置于金属浴反应,反应结束后于4 ℃离心20 min,取上清加入无水乙醇(上清液与无水乙醇体积比为1∶1),并过夜沉淀,除去蛋白。
1.3.4 HPLC检测方法
加入有机相的体系12 000 r/min离心20 min,取上清经0.22 μm有机膜过滤,滤液经超纯水稀释100倍,再离心20 min,取上清进行液相检测。液相检测条件:流动相为纯水;流速为0.8 mL/min;示差检测器;色谱柱为Dikma CarboPac Ca2+(粒径:6 μm,尺寸I.D.×L:300 mm×8.0 mm);柱温80 ℃;进样量20 μL。
1.3.5 酶活性检测方法中全细胞转化条件的优化
分别对全细胞转化的温度、反应时间、反应体系细胞OD600值、底物D-果糖浓度进行优化。控制反应时间、反应体系细胞量与底物浓度相同,对转化温度进行优化,设置25、37、50、65 ℃ 4个全细胞转化温度条件[6],探索温度对全细胞转化率的影响;控制反应温度、反应时间、体系细胞量相同,对底物浓度进行优化,设置D-果糖质量浓度分别为100、300、500 g/L,探索底物浓度对全细胞转化率的影响[20];类似地,控制反应温度和底物浓度相同,探索反应体系细胞量与反应时间对全细胞转化的影响,分别设置细胞OD600值为1、2、5,时间设为1~2 h不等。使用优化后的全细胞转化条件,以反应后经液相检测的D-阿洛酮糖产量为判断标准,进行后续发酵条件优化的实验。D-阿洛酮糖转化率的计算如公式(1)所示:
(1)
式中:R1为D-阿洛酮糖生物转化率,%;C1为D-阿洛酮糖溶液质量浓度,g/L;C2为D-果糖溶液质量浓度,g/L。
酶活力定义:65 ℃,pH 7.5条件下,平均每分钟生产1 μmoL D-阿洛酮糖所需酶量为1个酶活性单位U。
1.3.6 发酵条件的优化
对发酵培养基的碳源种类、碳源浓度、初始pH以及摇床温度进行探索优化。碳源选取蔗糖、麦芽糊精、乳糖、葡萄糖分别作为单一碳源,控制初始质量浓度均为30 g/L,并保持除培养基碳源外其他条件相同;控制其他条件不变,分别设置蔗糖质量浓度为15、45、75、100 g/L,探索蔗糖质量浓度对DPE表达的影响;类似地,控制碳源等条件相同,设置初始pH值分别为4.5、6、7.5(自然)、9、10.5,探索初始pH对DPE表达的影响;控制碳源、初始pH相同,设置发酵温度分别为37、42、50 ℃,探索发酵温度对DPE表达的影响。最终使用最优发酵条件下培养的菌体细胞,进行摇瓶发酵产D-阿洛酮糖的探究。
1.3.7 反应体系中硼酸的添加
使用全细胞转化用溶液d)探索硼酸浓度的添加以及硼酸添加次数对D-阿洛酮糖转化率的影响,首先使用硼酸与果糖摩尔质量比分别为0、0.2、0.4、0.6、0.8、1的反应体系探索硼酸添加量对反应平衡转化率的影响;其次,控制反应体系中硼酸与D-果糖摩尔比为0.4,分3、4、5次加入硼酸,探索硼酸添加次数对转化率的影响。
2 结果与分析
2.1 重组地衣芽孢杆菌的构建与DPE的表达
使用1.3.1节方法构建质粒pD1~3,最终对送测序正确的质粒进行酶切验证,理论条带大小DPE基因长度为1 000 bp左右,质粒总长度为6 190 bp,结果如图3-a所示,电泳条带大小与理论值一致,表明重组质粒构建成功。按照陆一鸣等[22]的电转化方法,将构建好的重组质粒电转化到地衣芽孢杆菌感受态细胞中,于Tet抗性平板中培养20 h左右,菌落PCR,挑取正确转化子接种至LB培养基中获得重组菌。图3-b为重组地衣芽孢杆菌细胞破碎上清液蛋白电泳图,在35 kDa附近处有清晰的蛋白条带,与DPE蛋白大小理论值33~34 kDa一致,可知DPE已在重组地衣芽孢杆菌中成功表达。
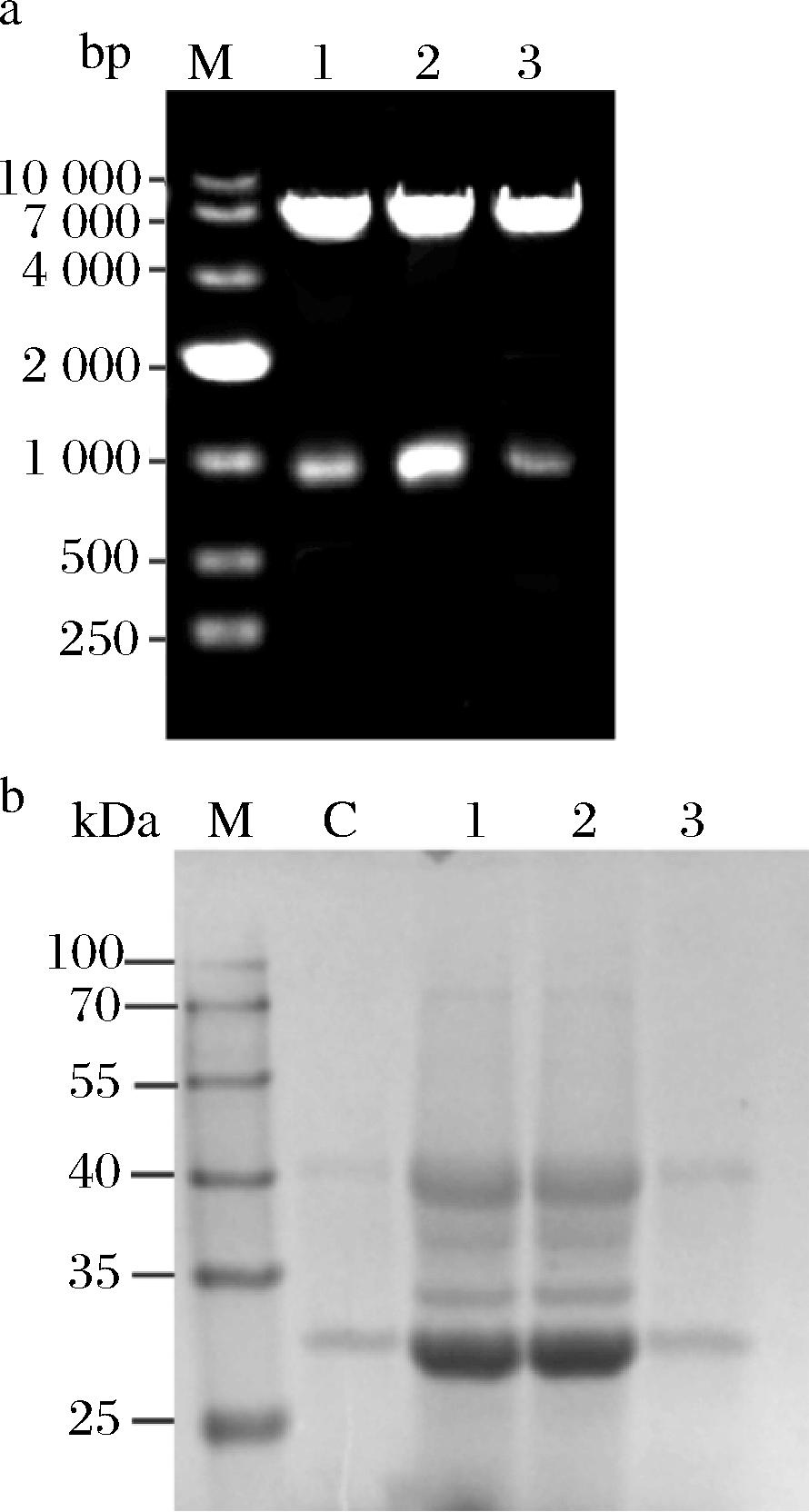
a-重组质粒经Kpn Ⅰ和Sal Ⅰ双酶切验证;b-SDS-PAGE验证重组菌BL1、BL2、BL3中DPE的表达
图3 重组质粒酶切验证及重组地衣芽孢杆菌中DPE蛋白电泳图
Fig.3 Validation of recombinant plasmid enzyme digestion and SDS-PAGE of DPE protein in recombinant Bacillus licheniformis
注:图3-a中:M-核酸marker;1~3-重组质粒pD1、pD2、pD3;图3-b中:M-蛋白marker;C-pHY空载对照;1~3-重组菌BL1、BL2、BL3。
2.2 DPE酶活检测方法的确立
使用发酵培养基A对3个重组地衣芽孢杆菌进行首批发酵,发酵第3天[22]取样检测,全细胞转化反应及检测结果如下文。
2.2.1 全细胞转化及液相检测方法的确立
对发酵液按照1.3.3节方法处理并加入反应体系,其中使用300 g/L D-果糖作底物,反应细胞OD600值控制为10,于金属浴37 ℃反应4 h,按照1.3.4节方法进行样品处理和液相检测,检测结果如图4所示,在12.29 min检测到D-果糖,在17.16 min检测到D-阿洛酮糖,且产物与标准样品的出峰时间一致,进一步验证了重组地衣芽孢杆菌具有合成D-阿洛酮糖的潜力。
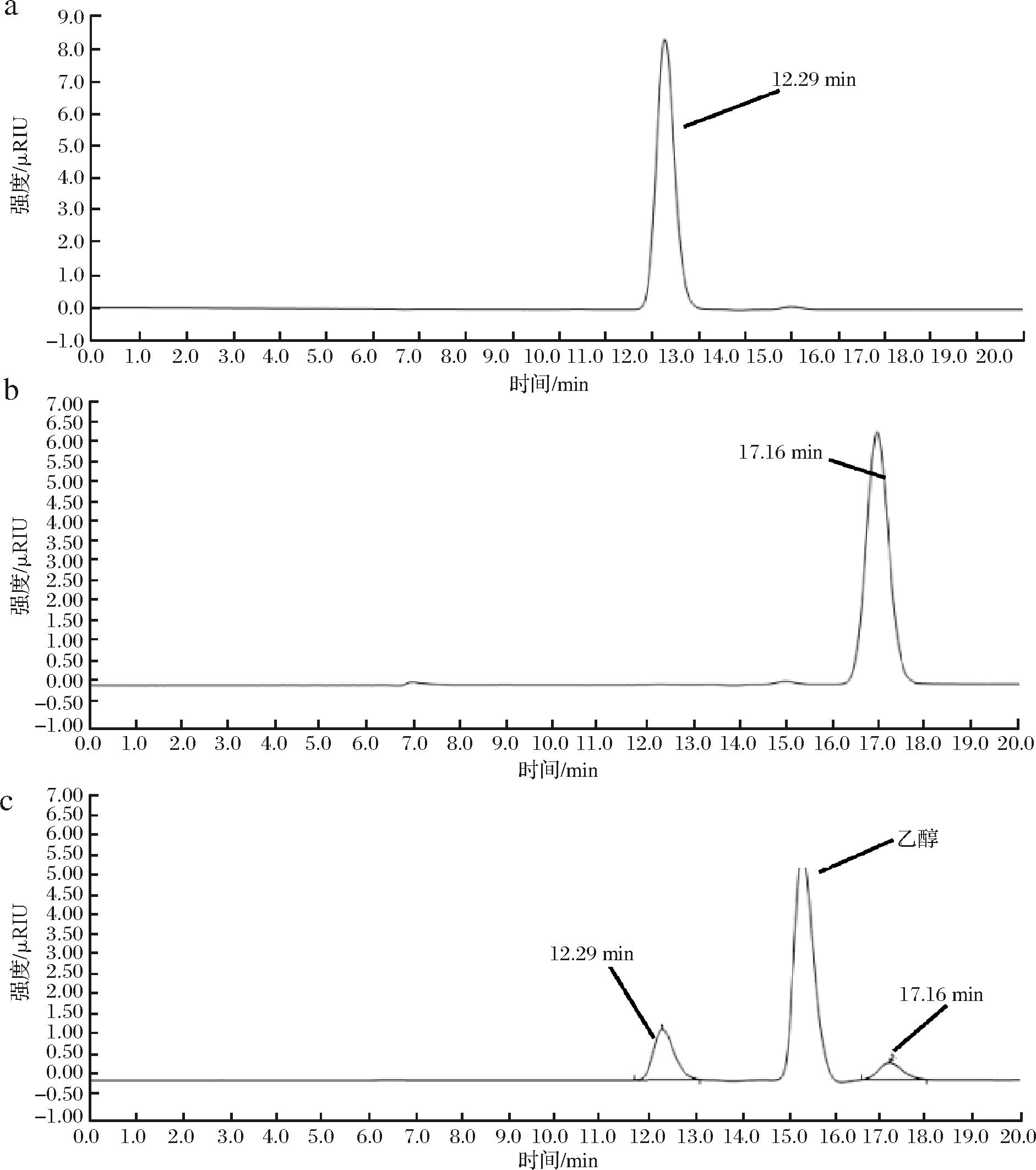
a-D-果糖标准样品;b-D-阿洛酮糖标准样品;c-发酵反应样品
图4 标样和样品的液相色谱图
Fig.4 Liquid chromatogram image of standard sample and sample
2.2.2 D-阿洛酮糖检测结果分析
对3种重组菌细胞做全细胞转化检测结果如图5所示,其中含有启动子P1+p2的重组菌株BL1发酵细胞做全细胞转化产D-阿洛酮糖的产量及转化率效果最好,D-阿洛酮糖浓度为77.9 g/L,转化率达26.32%。
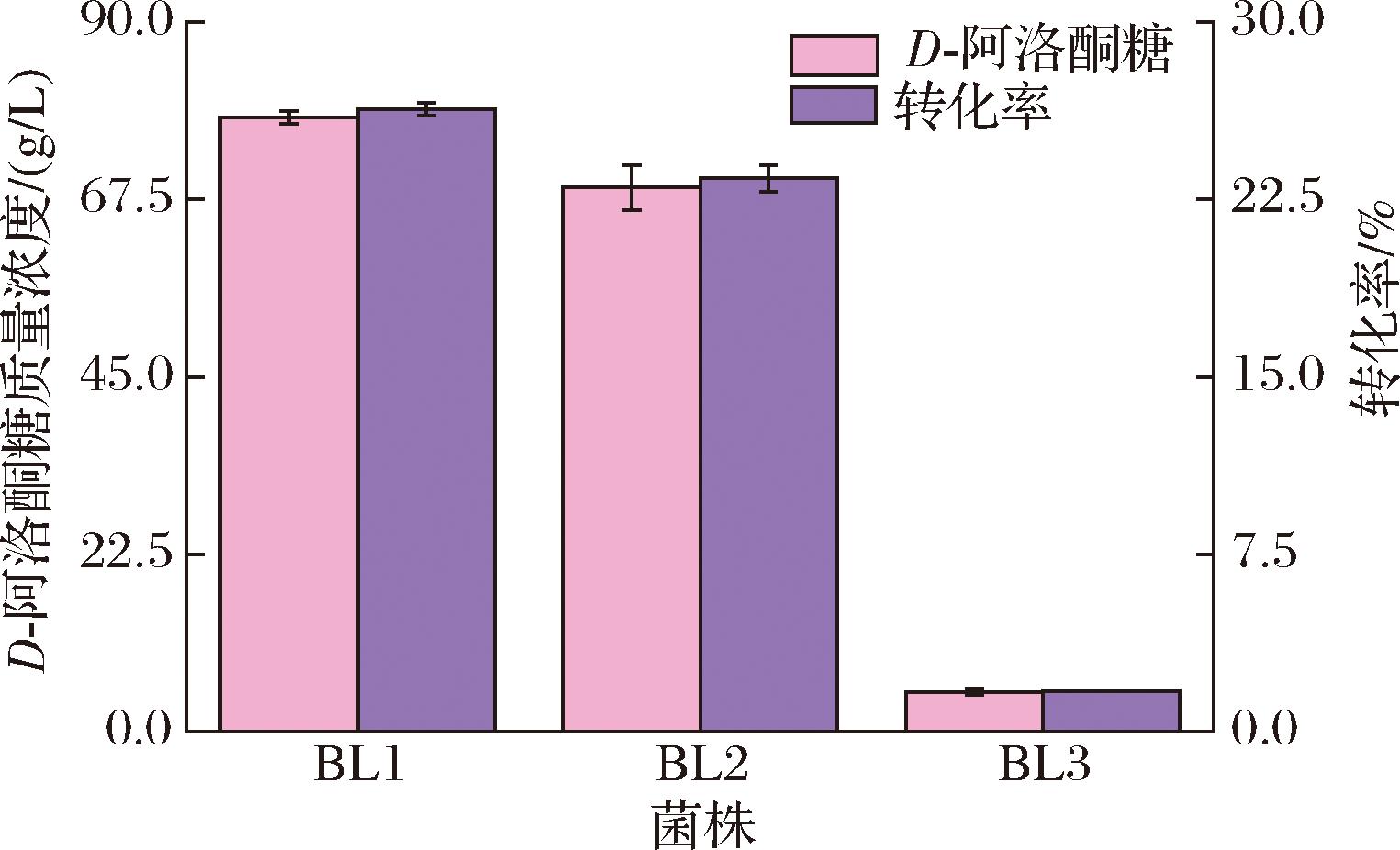
图5 不同菌株全细胞转化产D-阿洛酮糖浓度及转化率
Fig.5 Concentration and conversion rate of D-allulose produced by whole-cell transformation of different strains
2.3 酶活性检测方法中全细胞转化条件的优化
使用发酵培养基B进行接下来重组地衣芽孢杆菌的发酵,对发酵菌体细胞进行了反应温度、底物D-果糖浓度、反应细胞OD600值以及反应时间的全细胞转化条件的优化。
2.3.1 反应温度对制备D-阿洛酮糖转化率的影响
温度对酶促反应有着重要的影响,在酶作用适宜的温度区间内,随着反应温度的提高,酶促作用将会增强,对于一个可逆反应来说,其到达平衡的时间也会相应缩短。如图6-a所示,使用300 g/L D-果糖作为底物,反应体系细胞OD600值为10,相同反应温度条件下,随着反应时间的延长,可逆反应逐渐达到平衡,其中65 ℃条件下,反应1 h已到达平衡,转化率为30%。在反应到达平衡前,使用相同浓度的底物和加酶量,温度越高,到达平衡时间越短,因此考虑时间效益,选取65 ℃作为此后全细胞转化的反应温度。
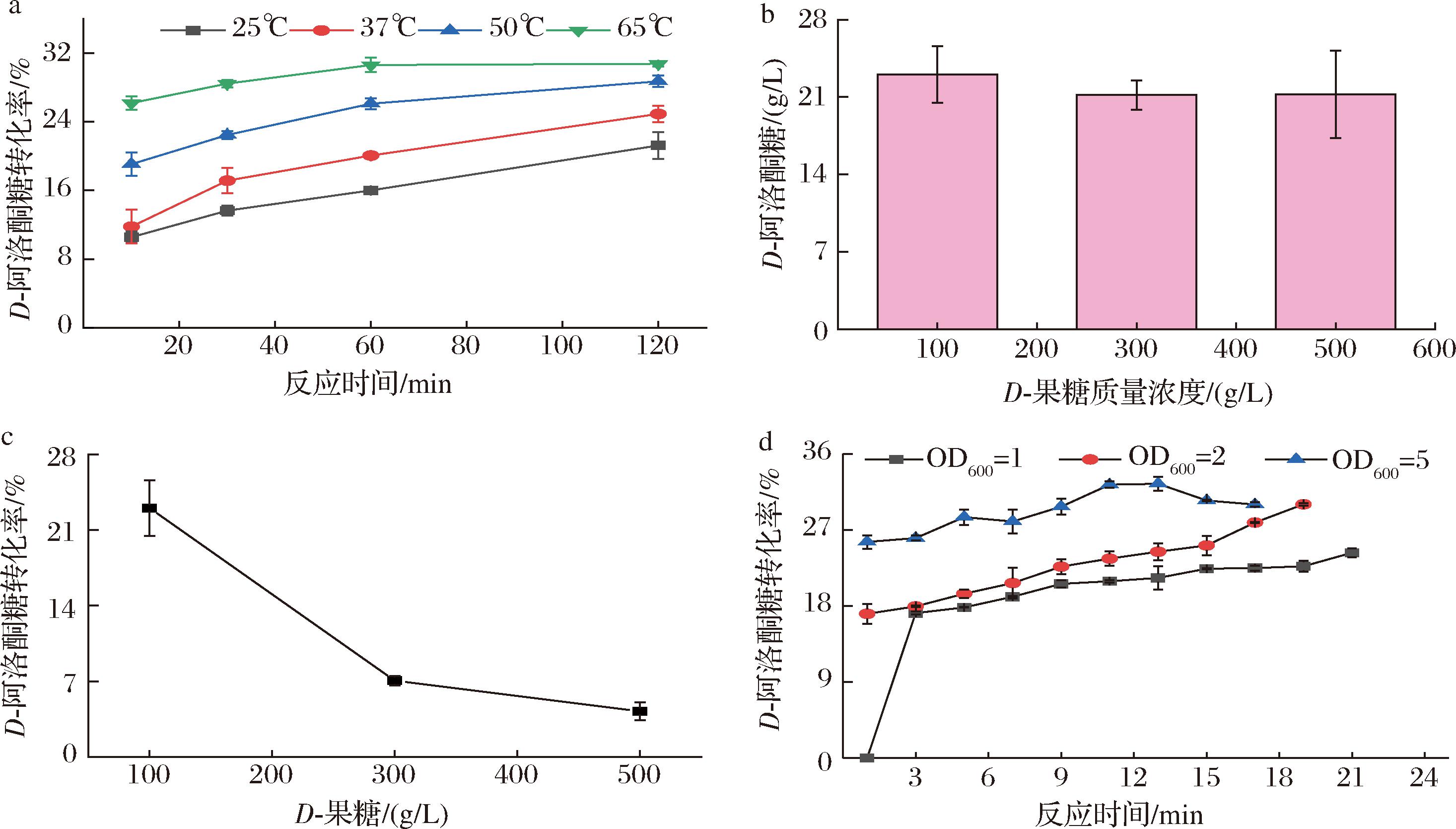
a-温度;b-D-果糖质量浓度;c-D-果糖质量浓度;d-反应体系细胞OD600、反应时间
图6 不同全细胞转化条件对D-阿洛酮糖转化率的影响
Fig.6 Effect of different whole-cell transformation conditions on the conversion rate of D-allulose
2.3.2 D-果糖浓度对制备D-阿洛酮糖转化率的影响
不同浓度D-果糖作为底物参与酶促反应,设置反应体系细胞OD600值为10,反应10 min,温度为65 ℃,如图6-b所示,当分别使用100、300、500 g/L D-果糖作为底物时,其产物浓度相差不大,考虑原因是底物过量,相应地,转化率随底物浓度增大而减小,如图6-c所示,考虑过高底物浓度对反应到达平衡具有抑制作用,会导致反应体系黏稠而不利于反应的进行[10],且会造成不必要的浪费等因素,因此选取100 g/L D-果糖作为此后全细胞转化的底物浓度。
2.3.3 反应细胞OD600值和反应时间对制备D-阿洛酮糖转化率的影响
在制备D-阿洛酮糖过程中,加酶量过低会影响产物的生成,延长反应时间,造成效率低下、底物浪费等,而加酶量过高会降低细胞利用效率,同样也会造成酶的浪费。设置反应温度为65 ℃,底物D-果糖质量浓度为100 g/L,如图6-d所示,在反应到达平衡前,反应相同的时间,随着加酶量的增加,其转化率也逐渐增大,当反应体系细胞OD600值为5的时候,反应1 min转化率已达25.56%,反应10 min到达平衡状态;当反应体系细胞OD600值为2时,反应9 min转化率为23%左右,反应19 min时转化率为30%;而当反应体系细胞OD600值为1的时候反应进行缓慢。因此考虑实际操作难易程度,选取反应体系细胞OD600值为2,反应时间10 min作为此后全细胞转化的条件。
2.4 产DPE的重组菌株摇瓶发酵优化
使用发酵培养基B对发酵培养条件中的碳源种类、碳源浓度、初始pH以及发酵培养温度进行优化。比较不同发酵条件下的酶活以及菌体生物量,从而确定最适的发酵培养条件。
2.4.1 不同碳源对DPE酶活和菌体量的影响
保持初始培养基其他成分不变,使用不同单一碳源(麦芽糊精、蔗糖、葡萄糖、乳糖,30 g/L)探索碳源种类对DPE酶活性以及菌体量的影响。如图7-a所示,除乳糖作为培养基碳源,其他碳源条件下发酵第1天菌体量为最大值,如图7-b所示,发酵第1天碳源为蔗糖时单位酶活性最高,达到13.68 U/mL,除蔗糖外,其余碳源单位酶活性呈现出先升高后降低的现象,考虑发酵培养过程中时间效益以及耗材因素,并且结合菌体量生长情况,选取总酶活性最高的碳源(蔗糖)作为此后发酵培养基的碳源。

a-不同碳源种类(OD600值);b-不同碳源种类(酶活性);c-不同碳源浓度(OD600值);d-不同碳源浓度(酶活性);e-不同初始pH(OD600值);f-不同初始pH(酶活性);g-不同发酵温度(OD600值);h-不同发酵温度(酶活性)
图7 不同发酵条件对D-阿洛酮糖酶活及菌体量的影响
Fig.7 Effects of different fermentation conditions on D-allulose activity and bacterial biomass
2.4.2 碳源浓度对DPE酶活和菌体量的影响
使用蔗糖作为碳源,设置不同浓度的蔗糖作为培养基碳源,探索蔗糖浓度对DPE酶活性和菌体量的影响。如图7-c所示,蔗糖质量浓度为75 g/L时整体菌体量较高,发酵第2天OD600值达到最大值54,蔗糖质量浓度为15 g/L时菌体量最少,说明低浓度碳源条件下菌体长势较差,而100 g/L质量浓度条件下菌体量不如75 g/L的蔗糖质量浓度,说明过高浓度的碳源对菌体生长有一定的抑制作用[20]。如图7-d所示,随着发酵时间的延长,不同浓度条件下的单位酶活均呈现出逐渐下降的趋势,且每一天的单位酶活性相差不大,结合菌体生长量,选取总酶活最高的蔗糖质量浓度(75 g/L)作为发酵培养基的碳源浓度。
2.4.3 初始pH对DPE酶活性和菌体量的影响
使用75 g/L蔗糖作为发酵培养基的碳源,分别设置初始pH值为4.5、6、7.5(自然)、9、10.5,探索初始pH对DPE酶活性和菌体量的影响。如图7-e和图7-f所示,pH值为4.5时菌体生长量最低且未能检测到酶活性,说明酸性条件下对菌体生长影响较大,且DPE酶活受到影响。pH值为6~10.5时菌体生长量相差不大,pH值为10.5时发酵第1天未能检测到DPE酶活性。结合单位酶活性与菌体量情况,选取总酶活最高的pH值[7.5(自然)]作为发酵培养基的初始pH。
2.4.4 发酵温度对DPE酶活和菌体量的影响
使用75 g/L蔗糖、初始pH为7.5的培养基基质,探索发酵温度对DPE表达和菌体量的影响,考虑地衣芽孢杆菌为耐受性嗜热菌[22],设置37、42、50 ℃ 3个发酵温度条件。如图7-g和图7-h所示,37 ℃温度条件下菌体生长量最高,而继续升高温度菌体量逐渐下降,其中50 ℃条件下菌体量和酶活均为最低,37 ℃和42 ℃温度条件下单位酶活均表现出先升高后降低的趋势,结合菌体生长情况和单位酶活,选取总酶活性最高的温度(37 ℃)作为发酵培养的温度条件。
2.5 摇瓶最优发酵条件下重组地衣芽孢杆菌产D-阿洛酮糖
使用最优发酵培养条件下的菌体细胞,发酵第1天测量菌体生长量OD600值为38.07,全细胞转化条件为65 ℃、500 g/L D-果糖,探索摇瓶发酵产D-阿洛酮糖的转化率以及产量。如图8所示,加酶量越多到达反应平衡的时间越短,当反应体系细胞OD600值为10的时候,反应10 min转化率可达到12.48%,反应1.5 h到达平衡,最大转化率为32.24%,产出D-阿洛酮糖120.65 g/L;当反应体系细胞OD600值为20的时候,反应45 min达到平衡,最大转化率为32%,可产出D-阿洛酮糖123.48 g/L;当反应体系细胞OD600值为30的时候,反应仅需20 min达到平衡,转化率为30.3%,可产出D-阿洛酮糖120 g/L,细胞单位酶活性为33.3 U/mL。
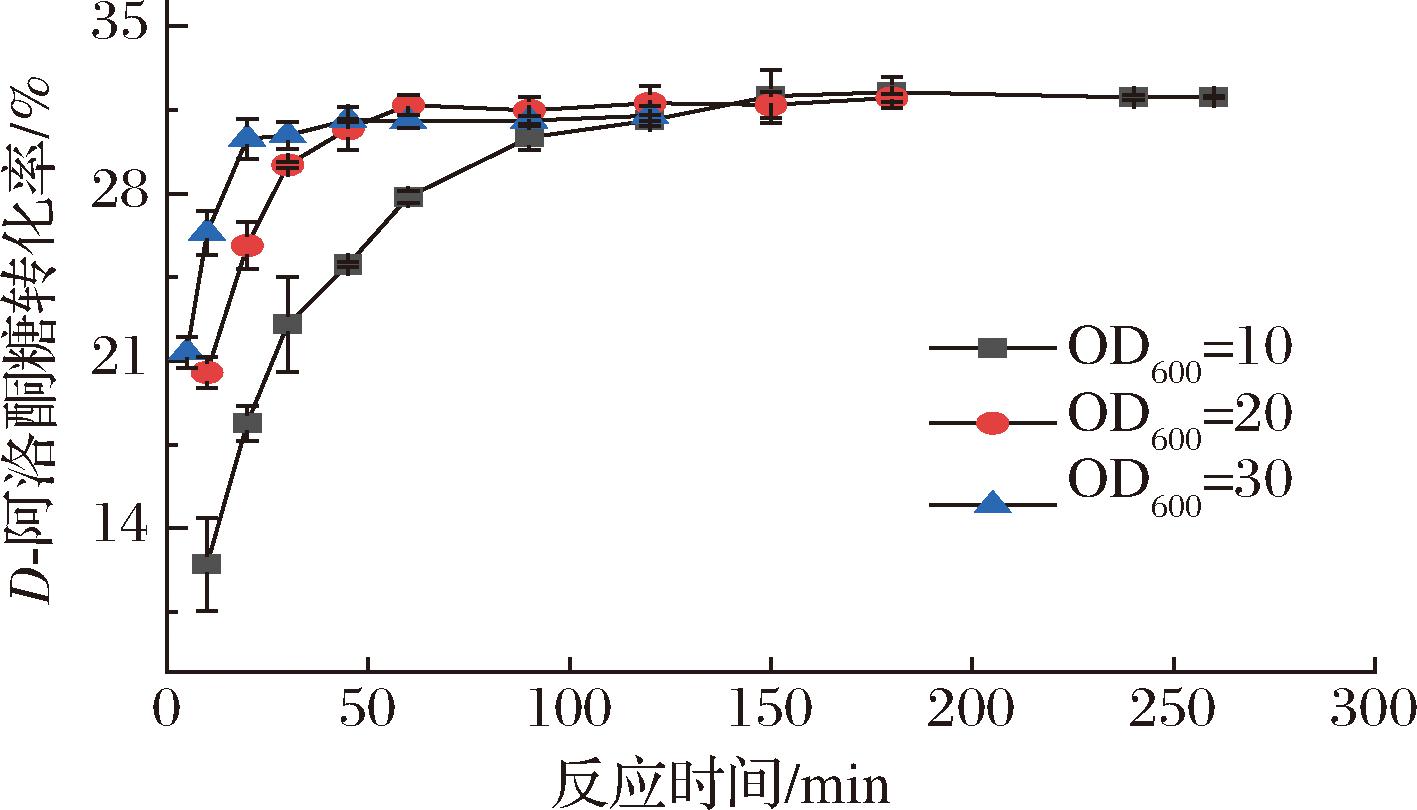
图8 摇瓶最优发酵条件下不同加酶量与反应时间对D-阿洛酮糖转化率的影响
Fig.8 Effect of different enzyme dosage and reaction time on the conversion rate of D-allulose under the optimal fermentation conditions in shake flask
2.6 硼酸的添加对D-阿洛酮糖转化率的影响
有研究曾在D-果糖与D-阿洛酮糖转化反应体系中加入一定浓度的硼酸,使转化率提高至原来的2倍左右,原理是硼酸根与D-阿洛酮糖结合产物比D-果糖更加稳定,使平衡向右移动[16]。本研究利用1.3.7节的方法,首先在反应开始前,加入与果糖不同摩尔质量比的硼酸,结果如图9-a所示,当添加硼酸与D-果糖摩尔质量比为0.4的时候,D-阿洛酮糖转化率最高,为60.8%。考虑到一开始加入硼酸会使得硼酸与果糖先结合,会在某种程度上削弱反应平衡向右进行的趋势,因此将硼酸分多次加入到反应体系中,以期反应平衡能够向生成D-阿洛酮糖的方向移动。如图9-b所示,将硼酸分别分3、4、5次加入到反应体系中,结果显示在反应过程中添加硼酸的转化率均比一次性在反应开始前加入硼酸的转化效果更好,其中当分4次加入硼酸时转化率达到69.8%,比一次性加入硼酸的转化率提高了15%左右,比不添加硼酸的转化率提高了125%左右,充分说明硼酸的添加可以大大提高D-阿洛酮糖3-差向异构酶将D-果糖催化生成D-阿洛酮糖的能力。
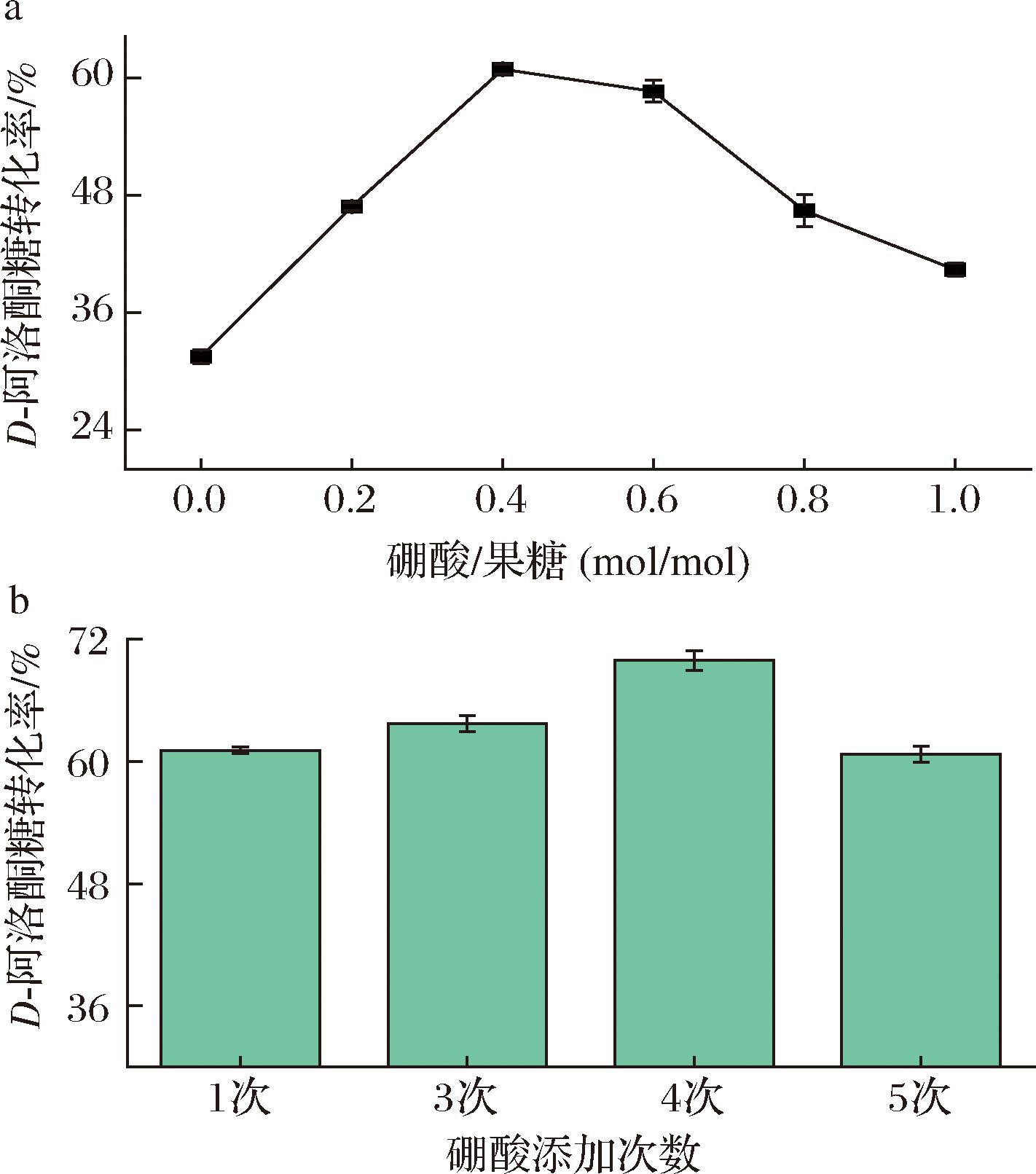
a-硼酸添加量;b-硼酸添加次数
图9 硼酸的添加对D-阿洛酮糖转化率的影响
Fig.9 The effect of boric acid addition on the conversion rate of D-allulose
3 结论与讨论
本研究成功构建了pHY-P1-p2/PmtlA/P1+p2-DPE重组质粒,使得D-阿洛酮糖3-差向异构酶在地衣芽孢杆菌中成功实现异源表达。对全细胞反应条件进行探究,利用优化后的全细胞转化条件:65 ℃、反应体系细胞OD600值为2、100 g/L D-果糖、反应10 min,作为酶活性检测方法中的全细胞转化条件,进一步优化发酵条件,探究出最优发酵条件:蔗糖75 g/L、初始pH 7.5以及发酵培养温度为37 ℃。接下来,利用最优发酵条件下的菌体细胞,使用质量浓度为500 g/L的D-果糖,控制细胞OD600值为30,65 ℃反应20 min条件下,转化率达30.3%、产出D-阿洛酮糖120 g/L,单位酶活达33.3 U/mL。有研究曾在大肠杆菌表达系统、酵母表达系统以及枯草芽孢杆菌表达系统中表达D-阿洛酮糖3-差向异构酶。其中,袁堂国等[16]利用大肠杆菌表达系统,使用700 g/L D-果糖、60 ℃、添加2.4 g/L的干重细胞、反应60 min,转化率达33%,产出D-阿洛酮糖231 g/L;胡梦莹[10]利用枯草芽孢杆菌表达系统表达DPE,利用D-果糖浓度为450 g/L,反应温度55 ℃,加酶量30 U/g,D-阿洛酮糖的转化率为28.45%,反应需要8 h才能达到平衡状态;朱星星[19]利用10 g/L马克斯克鲁维酵母工程菌在55 ℃、pH 8.0条件下,可催化750 g/L D-果糖产生190 g/L D-阿洛酮糖,转化率仅为25.33%。此外,本文将与D-果糖摩尔质量比为0.4的硼酸分4次加入到反应体系中,使D-阿洛酮糖转化率提高至69.8%,是目前报道的摇瓶培养合成D-阿洛酮糖的最高水平。
[1] HAN Y, KWON E Y, YU M K, et al.A preliminary study for evaluating the dose -dependent effect of D-allulose for fat mass reduction in adult humans:A randomized, double-blind, placebo-controlled trial[J].Nutrients, 2018, 10(2):160.
[2] LEE D, HAN Y, KWON E Y, et al.D-allulose ameliorates metabolic dysfunction in C57BL/KsJ-db/db mice[J].Molecules, 2020, 25(16):3656.
[3] HAYAKAWA M, HIRA T, NAKAMURA M, et al.Secretion of GLP-1 but not GIP is potently stimulated by luminal D-allulose (D-psicose) in rats[J].Biochemical and Biophysical Research Communications, 2018, 496:898-903.
[4] NAGATA Y, MIZUTA N, KANASAKI A, et al.Rare sugars, D-allulose, D-tagatose and D-sorbose, differently modulate lipid metabolism in rats[J].Journal of the Science of Food and Agriculture, 2018, 98(5):2020-2026.
[5] ATES E G, OZVURAL E B, OZTOP M H.Understanding the role of D-allulose and soy protein addition in pectin gels[J].Journal of Applied Polymer Science, 2021, 138(8): e49885.
[6] OGAWA M, INOUE M, HAYAKAWA S, et al.Effects of rare sugar D-allulose on heat-induced gelation of surimi prepared from marine fish[J].Journal of the Science of Food and Agriculture, 2017, 97(14): 5014-5020.
[7] XIA Y, CHENG Q Q, MU W M, et al.Research advances of D-allulose:An overview of physiological functions, enzymatic biotransformation technologies, and production processes[J].Foods, 2021, 10(9):2186.
[8] 李晓波. D-阿洛酮糖3-差向异构酶的表达及其固定化转化D-阿洛酮糖的研究[D].天津:天津科技大学, 2013.LI X B.Expression and immobilization of D-psicose 3-epimerase and its application in the production of D-psicose[D].Tianjin:Tianjin University of Science and Technology, 2013.
[9] 王琪, 彭超, 周卫强, 等.新型甜味剂阿洛酮糖绿色生物制造工艺研究进展[J].生物化工, 2022, 8(3):170-176.WANG Q, PENG C, ZHOU W Q, et al.Research progress on green bio-manufacturing technology of new sweetener D-psicose[J].Biological Chemical Engineering, 2022, 8(3):170-176.
[10] 胡梦莹. D-阿洛酮糖3-差向异构酶在枯草芽孢杆菌中的表达[D].无锡:江南大学, 2022.HU M Y.Expression of D-psicose 3-epimerase in Bacillus subtilis[D].Wuxi:Jiangnan University, 2022.
[11] 李秋凤, 陈静, 赵婧邑, 等.D-阿洛酮糖3-差向异构酶在大肠杆菌内的高效可溶性表达及发酵条件研究[J].食品工业科技, 2022, 43(22):136-143.LI Q F, CHEN J, ZHAO J Y, et al.Efficient soluble expression and fermentation conditions of D-allulose 3-epimerase in Escherichia coli[J].Science and Technology of Food Industry, 2022, 43(22):136-143.
[12] SHINTANI T, YAMADA T, HAYASHI N, et al.Rare sugar syrup containing D-allulose but not high-fructose corn syrup maintains glucose tolerance and insulin sensitivity partly via hepatic glucokinase translocation in wistar rats[J].Journal of Agricultural and Food Chemistry, 2017, 65(13):2888-2894.
[13] NAGATA Y, KANASAKI A, TAMARU S, et al.D-psicose, an epimer of D-fructose, favorably alters lipid metabolism in Sprague-Dawley rats[J].Journal of Agricultural and Food Chemistry, 2015, 63(12):3168-3176.
[14] HOSSAIN A, YAMAGUCHI F, MATSUO T, et al.Rare sugar D-allulose:Potential role and therapeutic monitoring in maintaining obesity and type 2 diabetes mellitus[J].Pharmacology &Therapeutics, 2015, 155:49-59.
[15] 沈佳颖, 李由然, 石贵阳.重组地衣芽孢杆菌全细胞转化产(R)-柠苹酸的研究[J].食品与发酵工业, 2023, 49(14):9-15.SHEN J Y, LI Y R, SHI G Y.Whole-cell biosynthesis of (R)-Citramalate by recombinant Bacillus licheniformis[J].Food and Fermentation Industries, 2023, 49(14):9-15.
[16] 袁堂国, 李益民, 杜聪, 等.利用重组大肠杆菌和马克斯克鲁维酵母高效催化合成D-阿洛酮糖[J].食品与发酵工业, 2022, 48(1):15-20.YUAN T G, LI Y M, DU C, et al.Efficient biocatalytic production of D-allulose combinate with Escherichia coli and Kluyveromyces marxianus[J].Food and Fermentation Industries, 2022, 48(1):15-20.
[17] 赵鑫馨, 李由然, 石贵阳.地衣芽孢杆菌强组成型启动子的鉴定及其表达效果验证[J].基因组学与应用生物学, 2021, 40(Z4):3566-3575.ZHAO X X, LI Y R, SHI G Y.Identification and application of strong constitutive promoter of Bacillus licheniformis[J].Genomics and Applied Biology, 2021, 40(Z4):3566-3575.
[18] 温宇威. D-阿洛酮糖3-差向异构酶的异源表达及发酵优化[D].无锡:江南大学, 2016.WEN Y W.Heterologous expression and fermentation optimization of D-psicose 3-epimerase[D].Wuxi:Jiangnan University, 2016.
[19] 朱星星. 马克斯克鲁维酵母D-阿洛酮糖-3-差向异构酶基因工程菌的构建[D].合肥:合肥工业大学, 2018.ZHU X X.Construction of D-psicose 3-epimerase gene engineered Kluyveromyces marxianus[D].Hefei:Hefei University of Technology, 2018.
[20] PATEL S N, SHARMA M, LATA K, et al.Improved operational stability of D-psicose 3-epimerase by a novel protein engineering strategy, and D-psicose production from fruit and vegetable residues[J].Bioresource Technology, 2016, 216(1):121-127.
[21] CHEN J C, HE P, BAI H M, et al.Poly(β-cyclodextrin)/carbon quantum dots modified glassy carbon electrode:Preparation, characterization and simultaneous electrochemical determination of dopamine, uric acid and tryptophan[J].Sensors &Actuators B:Chemical, 2017, 252:9-16.
[22] 陆一鸣, 李由然, 许银彪, 等.启动子工程提高海藻糖生产用酶在地衣芽孢杆菌中的表达[J].基因组学与应用生物学, 2022, 41(8):1703-1712.LU Y M, LI Y R, XU Y B, et al.Promoter engineering improves the expression of trehalose production enzyme in Bacillus licheniformis[J].Genomics and Applied Biology, 2022, 41(8):1703-1712.