近年来,各类食源性细菌污染导致的食品安全事故频发,尤其是耐药性细菌不断涌现,亟待发展杀菌谱广、不损伤食品品质的新型杀菌技术。抗菌蓝光(antimicrobial blue light)是近年报道的新型非热杀菌技术,位于405~ 450 nm处的蓝光已被大量研究证明可以有效杀灭99%的鼠伤寒沙门氏菌[1]、荧光假单孢菌[2]、大肠杆菌[3]、金黄色葡萄球菌[4]、单核细胞增生李斯特菌[5]等致病菌。LEANSE等[6]对鲍曼不动杆菌、铜绿假单胞菌的蓝光耐受性的研究发现,1×107 CFU/mL的细菌悬液在抗菌蓝光的照射下,活菌数量减少了4 lg CFU/mL。ZHANG等[7]对白色念珠菌进行的蓝光耐受性实验也证明了415 nm的蓝光使1×107 CFU/mL的细菌悬液菌落数减少了5 lg CFU/mL。ENWEMEKA等[8]报道了470 nm不同光照强度的蓝光对2种金黄色葡萄球菌MRSA:USA 300和IS-853的影响,发现当光照剂量提高到55 J/cm2时,细菌的杀灭效率高达90.4%。抗菌蓝光作为近几年发现的一种非抗生素杀菌手段,与传统抗菌方法相比,对宿主细胞的危害小,杀菌效果良好,抗菌蓝光具有安全、高效、非特异性等优点。
近年来,抗菌蓝光在食品领域也得到了应用。据报道,405、415和460 nm蓝光对奶酪[9]、肉类[10-11](鸡肉、牛肉)及多种水果[12-14](橙汁、葡萄、哈密瓜、木瓜等)等具有较好杀菌效果(大多超过1 lg CFU),其中致病菌包括大肠杆菌、沙门氏菌、单增李斯特菌、金黄色葡萄球菌等。本实验室针对鸡蛋上的肠炎沙门氏菌[15],报道了415 nm蓝光对其的杀菌率达到3.73 lg CFU/鸡蛋,对牛肉上的单核球增多性李斯特菌、大肠杆菌、沙门氏菌[16]的杀菌率达1.01 lg CFU/g~1.58 lg CFU/g。但目前尚无在鲜牛奶中的杀菌应用研究,鲜牛奶是营养价值高、消费量大的食品,富含蛋白质、脂肪、糖类、多种维生素和矿物质,且易发生细菌污染,严重威胁到消费者健康,因此本论文首先针对新鲜牛奶中的代表性致病菌大肠杆菌,研究了415 nm抗菌蓝光对其杀菌效果的影响。
目前广为认可的蓝光杀菌机制假说之一是:抗菌蓝光会激发细菌胞内光敏剂,胞内瞬间产生大量活性氧(reactive oxygen species,ROS),ROS攻击细胞内组分如脂质导致细菌破裂死亡,内源性卟啉已在多种细菌中检测到[17],另外,通过添加活性氧清除剂可降低杀菌效率,也显示极可能存在ROS[18]。因此,蓝光对鲜牛奶杀菌时需要考虑的一个安全性问题是:细菌胞内产生的过氧化物是否对胞外的牛奶造成影响?由于脂质分子尤其是不饱和脂质最容易受到过氧化物攻击,因此首先对蓝光照射后牛奶中脂质氧化标志物——丙二醛(malondialdehyde,MDA)进行了监测,并对其可能引发的牛奶味觉等感官指标进行分析比较。此外,为进一步系统研究牛奶脂质分子的变化,论文借助差异脂质组学的手段比较蓝光照射后的鲜牛奶脂质组,揭示其是否会对牛奶脂质产生影响,为415 nm蓝光在做鲜牛奶中的杀菌应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
新鲜全脂牛乳购自中国江苏省无锡市当地牧场,已经过巴氏杀菌,保质期3 d;E.coli K-12菌株购自Invitrogen。
液体LB培养基(Luria-bertani medium):酵母膏 5 g/L,胰蛋白胨 10 g/L,NaCl 10 g/L,应用于E.coli的培育。如配制固体培养基,再添加18 g/L琼脂粉;
培养条件:E.coli K-12菌株采用LB培养基培养,培养温度为37 ℃。
PBS磷酸缓冲液速溶颗粒(pH 7.4),北京沃凯生物科技有限公司;0.3 mmol/L酒石酸、30 mmol/L KCl溶液、甲醇、三氯甲烷、甲基叔丁基醚(methyl tert-butyl ether,MTBE),国药集团化学试剂公司;脂质氧化(MDA)检测试剂盒,上海碧云天生物技术有限公司。
1.2 仪器与设备
HWS12电热恒温水浴锅,THZ-300C恒温摇床,上海一恒科学仪器有限公司;紫外可见光光度计UV-1800,上海科导超声仪器有限公司;Vanquish Q Exactive Plus超高效液相质谱联用仪,美国赛默飞世尔科技公司;SA402B味觉分析系统,日本INSENT公司;BioTek Synergy 2多功能酶标仪,美国Bio-Tek公司。
1.3 实验方法
1.3.1 蓝光对鲜牛奶的杀菌作用
首先,将E.coli K-12在LB平板划线,37 ℃过夜培养。挑取生长良好的单一菌落,转移至5 mL液体LB试管中,37 ℃,200 r/min的条件下振荡培养10 h,测定OD600值;然后,将菌液接种于5 mL的LB液体培养基,控制初始OD600值为0.02,培养至对数生长期;随后取对数期菌液1 mL到1.5 mL离心管中,12 000 r/min离心1 min,弃上清液;再用等体积0.1 mol/L的pH 7.4的PBS重悬细胞沉淀,离心弃上清液,洗涤3次,最后取1 mL的PBS重悬菌体备用,测定OD600值。
1.3.1.1 蓝光杀菌
蓝光照射装置(415 nm波长的蓝光LED灯、铁架台、磁力搅拌器等)参照前期报道方法[19]组装,杀菌方法略作修改如下:a)取巴氏杀菌后的鲜牛奶样品,转移至6孔板中的3孔中,每孔6 mL;b)将E.coli K-12菌悬液加入牛奶样品中,控制每孔样品中的菌体密度达到7 lg CFU/mL;c)在超净工作台,将蓝光LED灯固定在铁架台,调整高度使蓝光LED灯与正下方样品液面距离10 cm,使样品能均匀接受蓝光照射,蓝光LED灯在样品表面的光照剂量为1.824 J/(cm2·min);d)装有样品溶液的6孔板放在磁力搅拌器上固定,样品中放入转子,通过调整转速,使样品溶液在搅拌过程中均匀混合。环境温度(20±2) ℃。同时,控制面板中装有散热装置,以防止蓝光照射产热而造成实验偏差,并使用照度计来测定蓝光LED灯的辐照剂量。
1.3.1.2 杀菌曲线绘制
在蓝光LED照射0、15、30、45 min后分别取样,其对应的照射剂量分别为0、27.36、54.72、82.08 J/cm2。梯度稀释:每个梯度取5 μL的样品点样在LB固体琼脂培养基上,涂布培养,37 ℃恒温培养箱中过夜培养后计数。根据菌落计数结果,计算蓝光照射下不同时间点的杀菌效率,通过比较处理前后菌落对数的减少量来计算。根据计算得到的杀菌效率数据,绘制蓝光对牛奶的杀菌曲线。
1.3.2 蓝光杀菌后牛奶味觉分析
味觉特征采用味觉分析系统设备SA402B(电子舌)进行测定,以0.3 mmol/L酒石酸的30 mmol/L KCl溶液作为参比溶液。具体测试步骤如下:将鲜牛奶样品于电子舌专用烧杯中供味觉传感系统分析,对上述蓝光照射处理前和处理后(照射45 min)的鲜奶样品进行感官特性的测试分析,包括苦味、涩味、酸味、咸味、鲜味、甜味、苦的回味、涩的回味和鲜的回味(丰富度)参数。该设备通过模拟人的舌头对待测样品进行识别和定量定性分析,利用多传感阵列为基础,感知样品的整体特征响应信号。检测数据通过Origin软件绘制雷达图进行对比分析。
1.3.3 蓝光杀菌后牛奶MDA分析
使用碧云天脂质氧化物MDA检测试剂盒S0131S,实验原理是MDA与硫代巴比妥酸缩合形成的红色产物在532 nm具有最大吸收峰。通过标准品来绘制标准曲线,经数据比对后牛奶中MDA的含量,详细实验操作根据试剂盒说明书进行。
1.3.4 蓝光杀菌后牛奶脂质组的提取及分析
采用MTBE提取法,对蓝光杀菌后的牛奶进行脂质提取,具体操作参照文献报道[20],稍作修改如下:
a)样品采集:取不同蓝光照射时间(0、15、30、45 min)的样品100 μL至1.5 mL离心管中,每个时间点采集5个平行样本;
b)萃取分离:分别将240 μL预冷甲醇加入上述100 μL样品中,涡旋2 min混匀,然后加入800 μL MTBE,并将混合物在振荡器中室温孵育30 min。再加入200 μL 超纯水,诱导相分离,室温下孵育10 min。随后将上述样品以1 000×g,10 ℃离心10 min,收集上层有机相。下层水相通过2 mL溶剂混合物重新萃取,该混合物的组成与上层相的组成一致,为V(MTBE)∶V(甲醇)∶V(水)=10∶3∶2.5。
c)有机相干燥和脂质复溶。将收集的有机相合并,置于旋转蒸发仪中干燥,将提取的脂质溶解在200 μL V(三氯甲烷)∶V(甲醇)∶V(水)=60∶30∶4.5混合溶液中,放置在-20 ℃冰箱暂存,最后进行超高效液相色谱-串联质谱(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)脂质组分析,UPLC-MS/MS参数见参考文献[21]。
1.4 数据处理
采用Origin 2021软件和GraphPad Prism 9.0.0软件进行作图,通过One-way ANOVA(单因素方差分析)和Two-way ANOVA(双因素方差分析)进行差异性显著性分析,当P<0.05则差异显著。
2 结果与分析
2.1 蓝光对PBS及鲜牛奶中E.coli的杀菌作用
本研究首先分析了415 nm波长处的蓝光对污染大肠杆菌的牛奶杀菌过程。以未照射蓝光的样品作为对照组,由图1可知,对照组在不同时间点的活菌数几乎无变化,蓝光照射组中的大肠杆菌随着照射剂量增加而减少。在光照剂量分别为27.36 J/cm2和54.72 J/cm2时,E.coli K-12活菌数分别减少了1.98 lg CFU/mL和2.73 lg CFU/mL,通过Two-way ANOVA双因素方差分析可知,P<0.000 1。而在光照剂量增加至82.08 J/cm2时,牛奶中的大肠杆菌被完全杀灭。
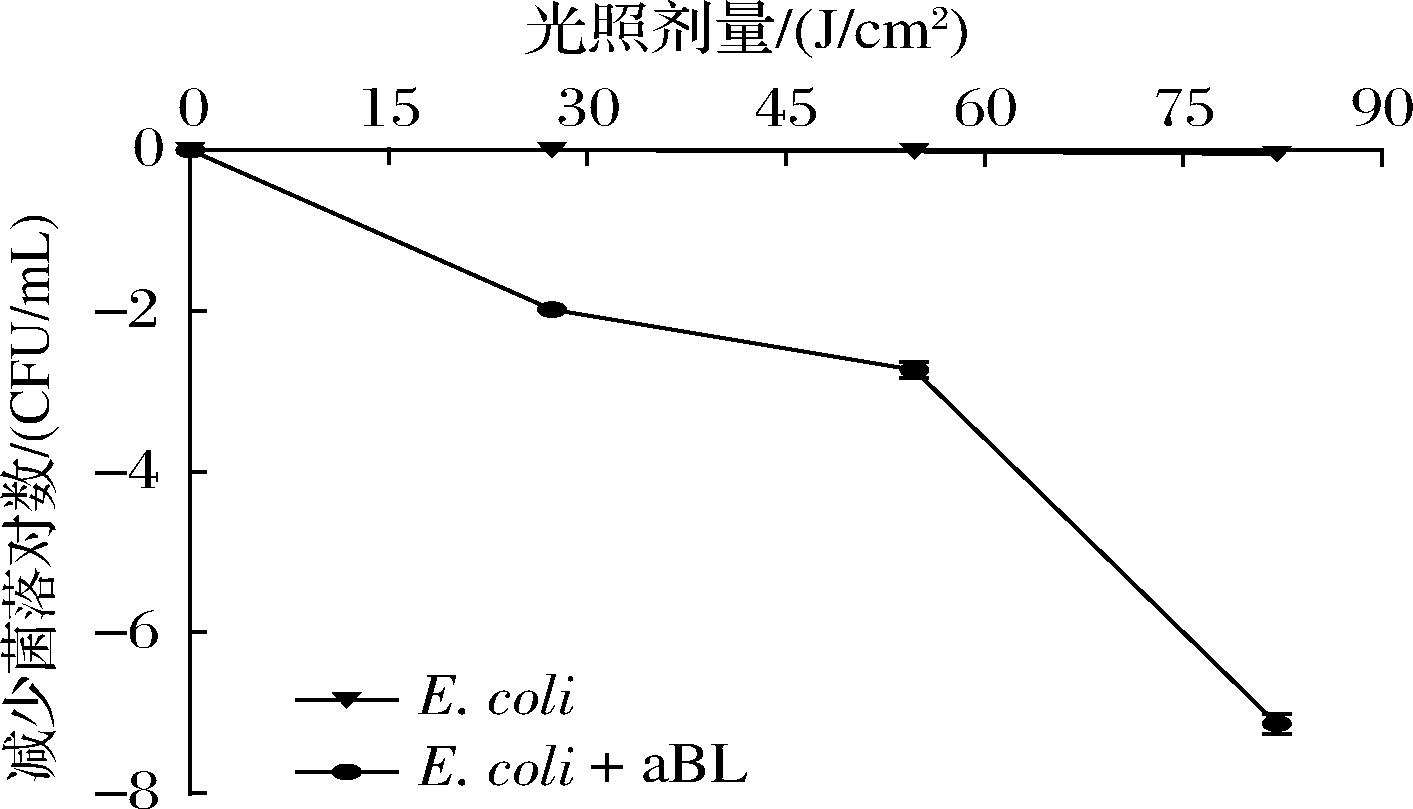
图1 415 nm蓝光对E.coli K-12的杀菌曲线
Fig.1 Inactivation kinetics of 415-nm blue light against E.coli K-12
2.2 蓝光照射对牛奶味觉的影响
蓝光在杀菌的同时是否对鲜奶品质造成影响?由于脂质成分最易被氧化,且脂质氧化后迅速改变味觉特征,因此首先通过味觉分析系统,对415 nm抗菌蓝光照射前后的牛奶样品进行分析,每个时间点设置5个平行,获得的感官指标数据通过“雷达图”进行比较分析。在雷达图(图2)中,每个感官评价指标都有一个唯一独立的坐标数轴,各个坐标轴呈辐射状围绕坐标原点向四周分散开,展示不同感官指标之间的相对关系和整体水平。
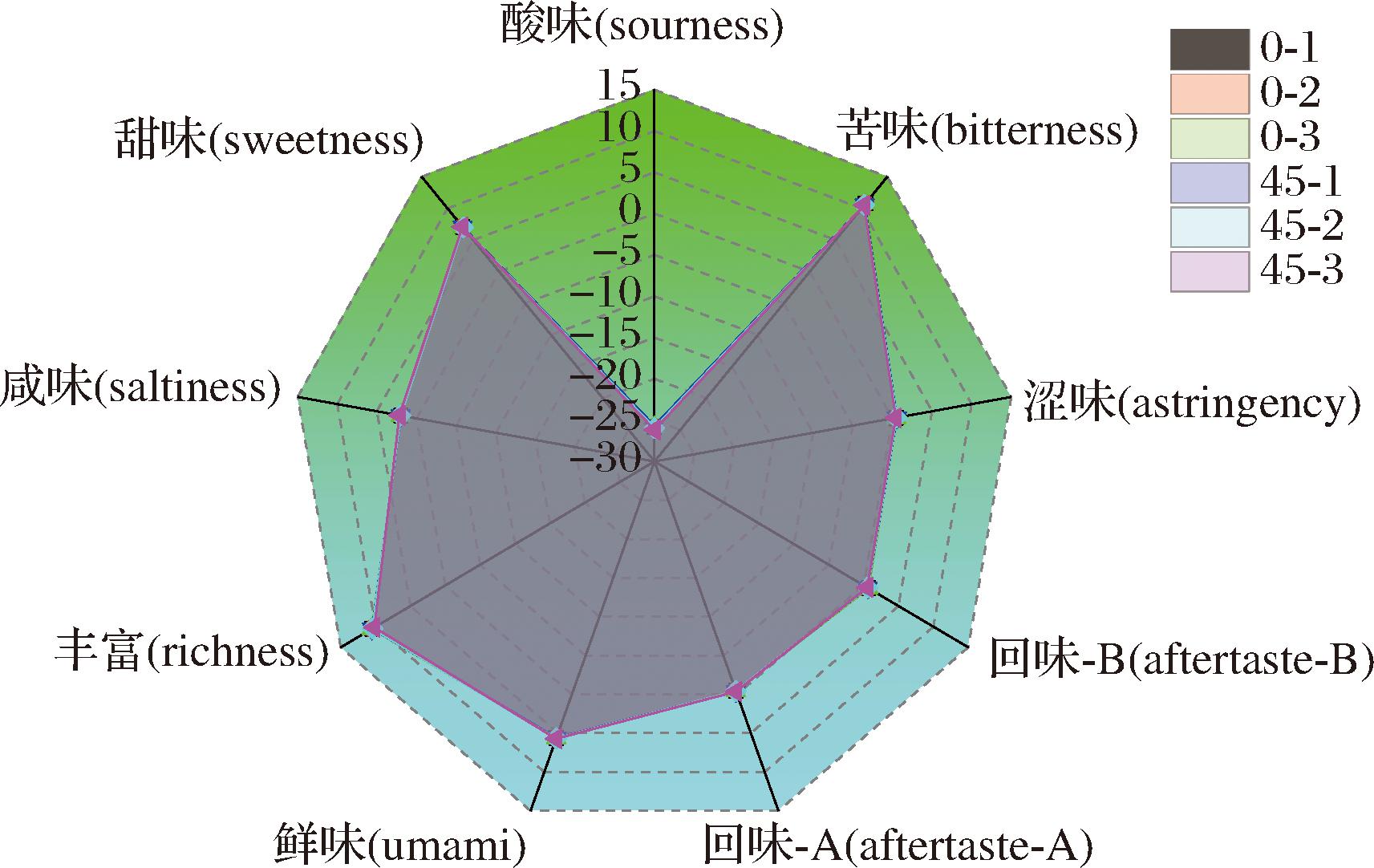
图2 蓝光照射前及照射45 min后鲜牛奶的味觉变化
Fig.2 The changes in taste character of the fresh milk before blue light irradiation and after irradiation for 45 min
注:0-1,0-2,0-3分别表示蓝光照射0 min后牛奶的味觉指标数据平行样本1,平行样本2,平行样本3;45-1,45-2,45-3分别表示蓝光照射45 min后牛奶的味觉指标数据平行样本1,平行样本2,平行样本3。
由图2可知,415 nm蓝光照射0 min和45 min处理后的牛奶样品,在雷达图上显示的酸味、甜味、苦味、涩味、咸味、涩味、鲜味等各个感官特性上的数据点非常接近,蓝光照射前后获得的雷达图形状相似,面积相近,通过Two-way ANOV双因素方差分析可知P>0.1,这表明415 nm蓝光照射45 min后,即在光照剂量为82.08 J/cm2下,鲜牛奶样品在酸、甜、苦、涩、咸、涩、鲜味等味觉上无统计学差异,因此不会影响口感。
2.3 蓝光照射对牛奶脂质组的影响
由于抗菌蓝光会激发致病菌胞内光敏剂产生ROS,ROS会攻击细胞内组分导致细菌死亡。因此,本研究对蓝光杀菌过程中,细菌胞内的过氧化物是否对牛奶中大分子如脂质造成影响这一问题展开探究。脂质过氧化物MDA易于测定,因此首先对杀菌过程中MDA进行监测。实验绘制出MDA标准曲线如图3-a所示,通过计算可知,经蓝光照射0、15、30、45 min 的牛奶样品中MDA含量的平均数分别为0.55、0.56、0.55、0.57 μmol/L。由图3-b可知,通过单因素方差分析,不同时间点的蓝光照射前后牛奶中MDA含量与对照组相比,变化不显著(P>0.99),并且不同时间点样本之间也不存在统计学差异(P>0.99),说明蓝光照射不会导致鲜牛奶中产生脂质过氧化物。
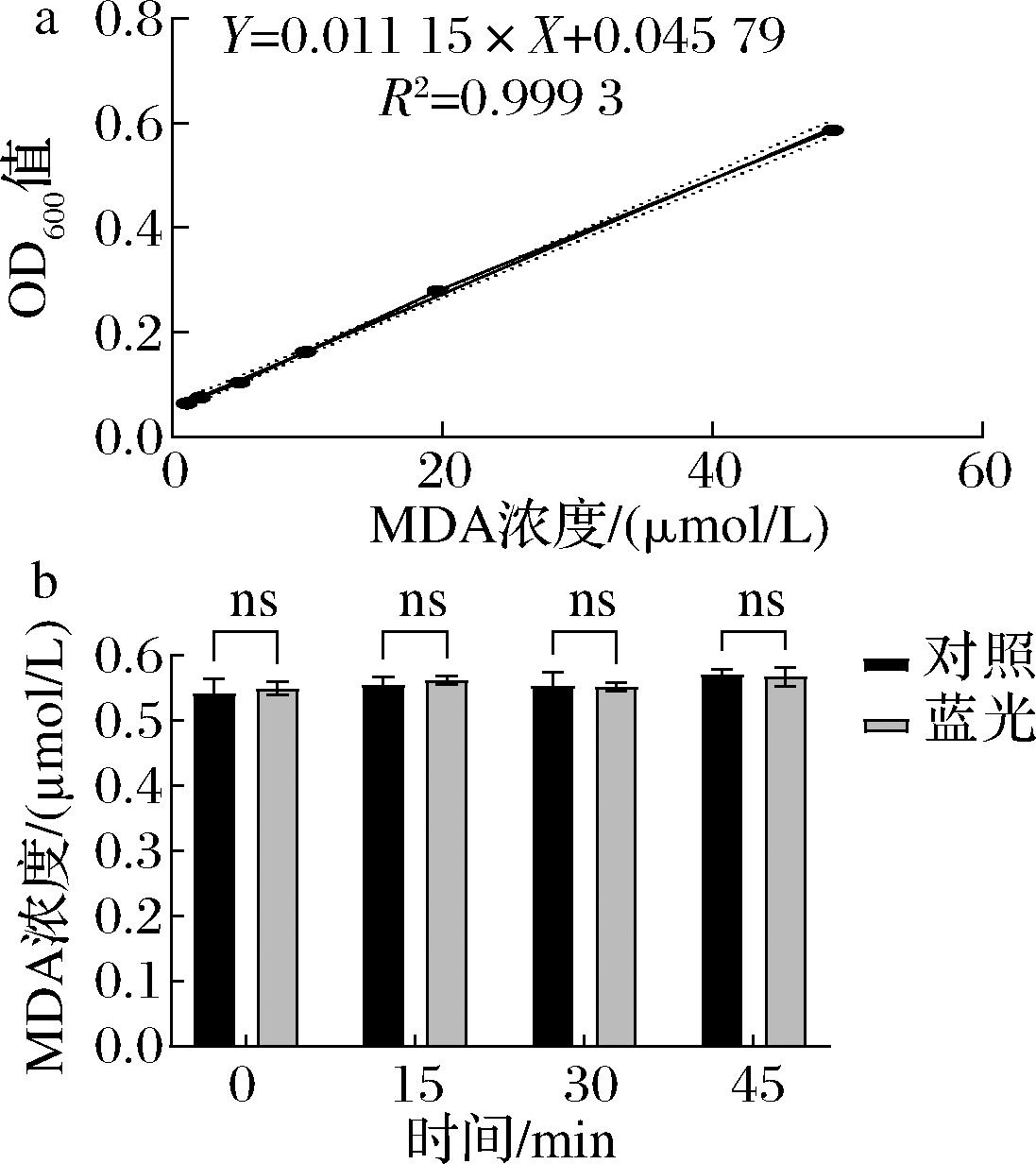
a-MDA标准曲线;b-蓝光照射后牛奶中MDA变化
图3 MDA标准曲线及蓝光照射前后牛奶中MDA变化
Fig.3 The standard curve of MDA and changes in MDA content of milk before and after blue light irradiation
脂质分子尤其是不饱和脂质最容易受到ROS攻击,本研究采用UPLC-MS/MS方法,对蓝光照射后的鲜牛奶中的整体脂质进行分析和比较,揭示其是否会对牛奶脂质组产生影响(图4)。数据分析通过LipidSearch 4.1软件比较峰丰度来评估脂质分子种类的鉴定。MS2和MS3谱图前体离子值与理论脂质离子值之间的误差范围规定<5 ppm。MS2和MS3谱图峰值与理论脂质碎片离子值之间的误差范围规定<10 ppm。
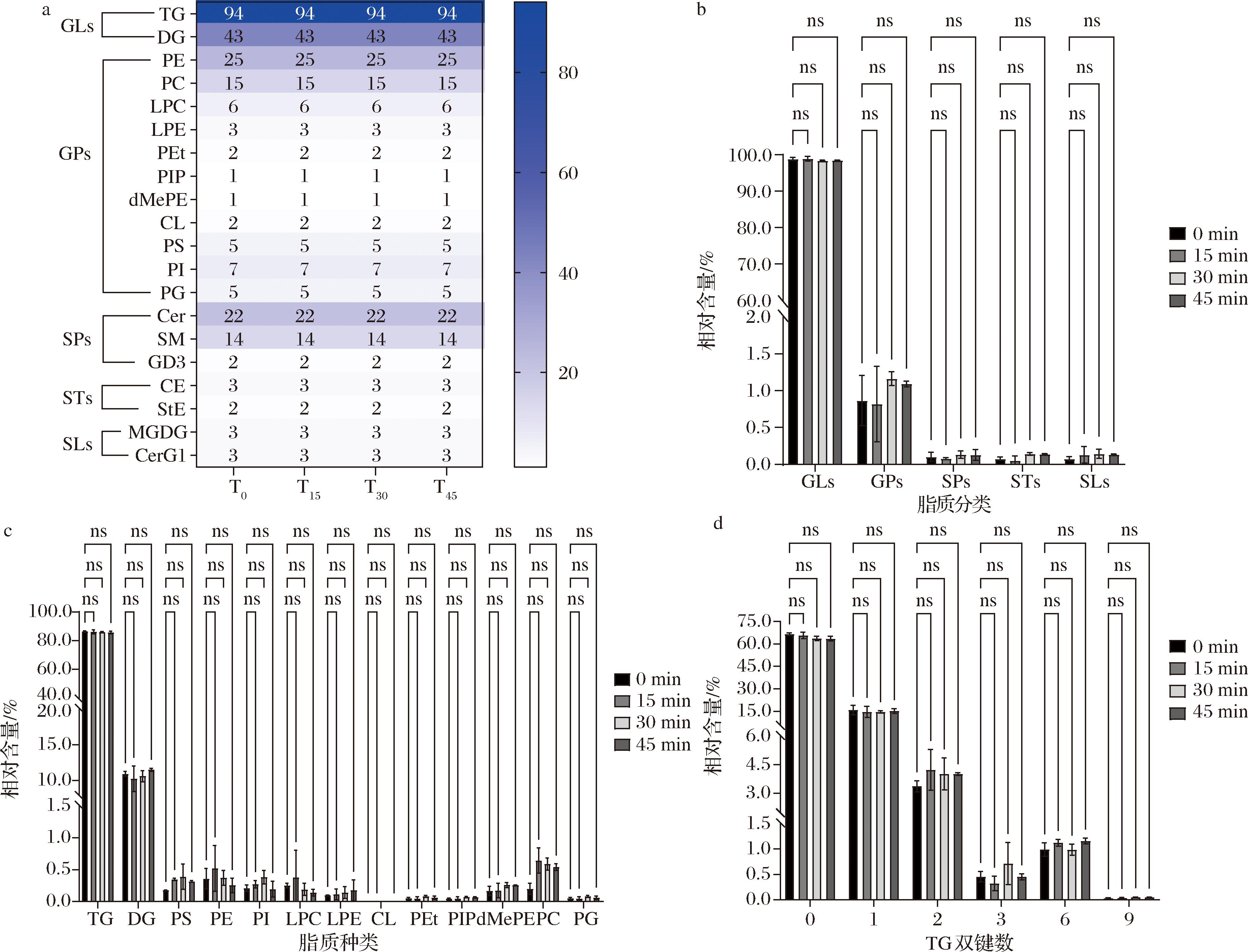
a-脂质种类和数量;b-脂质相对含量;c-GLs和GPs脂质亚类相对含量;d-不饱和TG的相对含量
图4 蓝光照射前后牛奶脂质组变化
Fig.4 Changes of the total lipids in milk before and after blue light irradiation
注:甘油三酯(triglyceride,TG);甘油二酯(diglyceride,DG);磷脂酰乙醇胺(phosphatidylethanolamine,PE);磷脂酰胆碱(phosphatidylcholine,PC);溶血磷脂酰胆碱(lyso-phosphatidylcholine,LPC);溶血磷脂酰乙醇胺(lyso-phosphatidylethanolamine,LPE);磷脂酰乙醇(phosphatidylethanol,PEt);磷脂酰肌醇(phosphatidylinositol,PI,PIP);二甲基磷脂酰乙醇胺(dimethylphosphatidylethanolamine,dMePE);心磷脂(cardiolipin,CL);磷脂酰丝氨酸(phosphatidylserine,PS);磷脂酰甘油(phosphatidylglycerol,PG);神经酰胺(ceramides,Cer);鞘磷脂(sphingomyelin,SM);神经节苷脂(gangliosides,GD3);胆固醇酯(cholesterylesters,CE);豆甾醇酯(stigmasteryl ester,StE);单半乳糖二酰甘油酯(monogalactosyldiacylglycerol,MGDG);单糖基神经酰胺(monogylcosylceramide,CerG1)
质量过滤器被指定为A级,这意味着脂肪酸链和脂质类别已被完全识别。统计分析在GraphPad Prism 9.0.0中进行。
如图4-a所示,鲜牛奶样品共鉴定出258种脂质,涵盖以下五大类20亚类脂质:a)甘油酯类(GLs):甘油二酯(DG)和甘油三酯(TG);b)甘油磷脂类(GPs):磷脂酰乙醇胺(PE)、磷脂酰胆碱(PC)、溶血磷脂酰胆碱(LPC)、溶血磷脂酰乙醇胺(LPE)、磷脂酰乙醇(PEt)、磷脂酰肌醇(PI、PIP)、二甲基磷脂酰乙醇胺(dMePE)、心磷脂(CL)、磷脂酰甘油(PG)和磷脂酰丝氨酸(PS);c)鞘脂类(SPs):鞘磷脂(SM)、神经节苷脂(GD3)和神经酰胺(Cer);d)固醇酯类(STs):胆固醇酯(CE)和豆甾醇酯(StE);e)糖脂类(SLs):单半乳糖二酰甘油酯(MGDG)和单糖基神经酰胺(CerG1)。由图4-a可知,经蓝光照射15、30、45 min的牛奶脂质与未照射(0 min)相比,种类和数量均未发生变化。然后对五大类脂质的相对强度进行分析,如图4-b所示,采用GraphPad进行双因素方差分析可知,经蓝光照射后牛奶中五大类脂质的相对含量无显著变化(P>0.99)。
在五大类脂质中,GLs脂质相对含量最高,占98%以上,而GPs的亚类最多,因此论文以GLs和GPs为代表,进行脂质亚类的相对含量分析。如图4-c所示,GLs和GPs的脂质亚类的相对含量也无显著差异(P>0.99),同时,由图可知相对含量最高的脂质亚类是甘油三酯(TG),相对含量占比超过85%。不饱和脂质是鲜奶中的关键营养成分,在改善肥胖、糖尿病和高血压等人体代谢综合征中发挥重要生理作用[22],因此,本研究对蓝光照射前后不饱和TG的变化也进行了分析,如图4-d所示,通过双因素方差分析发现,无论是饱和TG,还是不饱和双键数为1、2、3、6、9的不饱和TG,照射组与对照组之间均未出现显著差异。说明蓝光在杀菌的同时,其不会对牛奶中的脂质分子产生氧化或其他损伤,这与味觉特征及MDA结果相吻合。
3 结论
本文研究了415 nm抗菌蓝光对鲜牛奶杀菌后味觉和脂质组的影响,和未照射的鲜牛奶相比,415 nm蓝光照射几乎不会对牛奶脂质产生负面影响,照射后的鲜牛奶其味觉参数、MDA和脂质组均无统计学差异变化,这为抗菌蓝光用于鲜牛奶的杀菌保鲜奠定了基础。
[1] DOS ANJOS C, SELLERA F P, DE FREITAS L M, et al. Inactivation of milk-borne pathogens by blue light exposure[J]. Journal of Dairy Science, 2020, 103(2):1261-1268.
[2] ANGARANO V, AKKERMANS S, SMET C, et al. The potential of violet, blue, green and red light for the inactivation of P. fluorescens as planktonic cells, individual cells on a surface and biofilms[J]. Food and Bioproducts Processing, 2020, 124:184-195.
[3] HALSTEAD F D, HADIS M A, MARLEY N, et al. Violet-blue light arrays at 405 nanometers exert enhanced antimicrobial activity for photodisinfection of monomicrobial nosocomial biofilms[J]. Applied and Environmental Microbiology, 2019, 85(21): e01346-e01319.
[4] MACLEAN M, GELDERMAN M P, KULKARNI S, et al. Non-ionizing 405 nm light as a potential bactericidal technology for platelet safety: Evaluation of in vitro bacterial inactivation and in vivo platelet recovery in severe combined immunodeficient mice[J]. Frontiers in Medicine, 2020, 6:331.
[5] HYUN J E, MOON S K, LEE S Y. Antibacterial activity and mechanism of 460-470 nm light-emitting diodes against pathogenic bacteria and spoilage bacteria at different temperatures[J]. Food Control, 2021, 123:107721.
[6] LEANSE L G, HARRINGTON O D, FANG Y Y, et al. Evaluating the potential for resistance development to antimicrobial blue light (at 405 nm) in Gram-negative Bacteria: In vitro and in vivo Studies[J]. Frontiers in Microbiology, 2018, 9:2403.
[7] ZHANG Y S, ZHU Y B, GUPTA A, et al. Antimicrobial blue light therapy for multidrug-resistant Acinetobacter baumannii infection in a mouse burn model: Implications for prophylaxis and treatment of combat-related wound infections[J]. The Journal of Infectious Diseases, 2014, 209(12):1963-1971.
[8] ENWEMEKA C S, WILLIAMS D, ENWEMEKA S K, et al. Blue 470-nm light kills methicillin-resistant Staphylococcus aureus (MRSA) in vitro[J]. Photomedicine and Laser Surgery, 2009, 27(2):221-226.
[9] RICCIARDI E F, PEDROS-GARRIDO S, PAPOUTSIS K, et al. Novel technologies for preserving ricotta cheese: Effects of ultraviolet and near-ultraviolet-visible light[J]. Foods, 2020, 9(5):580.
[10] KIM M J, ADELINE NG B X, ZWE Y H, et al. Photodynamic inactivation of Salmonella enterica Enteritidis by 405±5-nm light-emitting diode and its application to control salmonellosis on cooked chicken[J]. Food Control, 2017, 82:305-315.
[11] TORTIK N, SPAETH A, PLAETZER K. Photodynamic decontamination of foodstuff from Staphylococcus aureus based on novel formulations of curcumin[J]. Photochemical &Photobiological Sciences: Official Journal of the European Photochemistry Association and the European Society for Photobiology, 2014, 13(10):1402-1409.
[12] LUKSIENE Z, PASKEVICIUTE E. Novel approach to the microbial decontamination of strawberries: Chlorophyllin-based photosensitization[J]. Journal of Applied Microbiology, 2011, 110(5):1274-1283.
[13] AURUM F S, NGUYEN L T. Efficacy of photoactivated curcumin to decontaminate food surfaces under blue light emitting diode[J]. Journal of Food Process Engineering, 2019, 42(3): e12988.
[14] KIM M J, BANG W S, YUK H G. 405±5 nm light emitting diode illumination causes photodynamic inactivation of Salmonella spp. on fresh-cut papaya without deterioration[J]. Food Microbiology, 2017, 62:124-132.
[15] HU X Q, SUN X Y, LUO S H, et al. Inactivation of Salmonella enterica serovar enteritidis on chicken eggshells using blue light[J]. Agriculture, 2021, 11(8):762.
[16] LUO S H, YANG X I, WU S Y, et al. Blue light for inactivation of meatborne pathogens and maintaining the freshness of beef[J]. Journal of Food Protection, 2022, 85(4):553-562.
[17] SOUKOS N S, SOM S, ABERNETHY A D, et al. Phototargeting oral black-pigmented bacteria[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(4):1391-1396.
[18] MACLEAN M, MACGREGOR S J, ANDERSON J G, et al. The role of oxygen in the visible-light inactivation of Staphylococcus aureus[J]. Journal of Photochemistry and Photobiology. B, Biology, 2008, 92(3):180-184.
[19] LUO S H, YANG X, WU S Y, et al. Understanding a defensive response of methicillin-resistant Staphylococcus aureus after exposure to multiple cycles of sub-lethal blue light[J]. FEMS Microbiology Letters, 2022, 369(1): fnac050.
[20] 高文浩, 尹乾隆, 王筱迪, 等. 基于脂质组学技术探究热处理和发酵对乳脂质的影响[J]. 食品科学, 2022, 43(14):48-59. GAO W H, YIN Q L, WANG X D, et al. Lipidomics analysis revealed the effects of heat treatment and fermentation on milk lipids[J]. Food Science, 2022, 43(14):48-59.
[21] LIU Z J, YU K Y, WU S Y, et al. Comparative lipidomics of methanol induced Pichia pastoris cells at different culture phases uncovers the diversity and variability of lipids[J]. Enzyme and Microbial Technology, 2022, 160:110090.
[22] KOBA K, YANAGITA T. Health benefits of conjugated linoleic acid (CLA)[J]. Obesity Research &Clinical Practice, 2014, 8(6): e525-e532.