肠道菌群是寄居在人体肠道内的微生物群,又称人体“第二基因组”[1],在调节宿主生理功能、维持代谢平衡方面发挥重要作用[2-3]。色氨酸是参与蛋白质合成、免疫和肠道平衡等生物功能的必需氨基酸[4]。肠道微生物可以通过产生丰富的酶系,尤其是乳杆菌属分泌的芳香族氨基酸氨基转移酶(ArAT),直接将色氨酸代谢转化吲哚丙酮酸。吲哚丙酮酸是吲哚丙酸(indole-3-propionic acid,IPA)、吲哚丙烯酸(indole acrylic acid, IAld)、吲哚乳酸(indole-3-lactic acid, ILA)、吲哚乙酸(indole acetic acid, IAA)和吲哚甲醛(indole-3-carboxaldehyde)等众多吲哚类代谢物的关键前体物质。这些吲哚类代谢物可作为AhR内源性配体,通过特异性结合AhR促进肠上皮细胞恢复、保持屏障完整性、调控炎性细胞因子表达等途径来维持肠道稳态[5-6]。已有人群研究表明,经由色氨酸-吲哚丙酮酸代谢途径产生的吲哚类衍生物与2型糖尿病发病风险显著负相关[7]。因此,靶向驱动色氨酸-吲哚丙酮酸代谢或可作为优化菌群导向性饮食保护肠道健康的重要手段,具有极大的预防和治疗2型糖尿病及相关代谢紊乱的潜力[8-9]。
大豆多糖(soybean polysaccharide, SP)是一种天然水溶性多糖,主要成分为葡萄糖、半乳糖和甘露糖等单糖,富含膳食纤维,营养价值丰富,具有降糖、抗氧化、保护心血管等多种生理活性[10],被广泛应用于食品、医药等领域。已有研究表明,SP能够降低肝脏脂质积累[11],促进双歧杆菌和乳酸杆菌等有益菌生长[12],抑制致病菌生长[11],驱动结肠产生短链脂肪酸[13]。基于SP对肠道微生物的调节作用,以及色氨酸代谢物与2型糖尿病病理生理学之间的密切联系,SP调控肠道菌群介导的色氨酸代谢并发挥抗糖尿病益处的潜在机制值得深入研究。
本研究构建了2型糖尿病未用药新发病患者及患病10年以上的常年病患粪便菌群体外发酵模型,检测粪便菌群发酵液的pH和产气情况直观反映SP对2型糖尿病患者粪便菌群发酵的改善效果,利用超高效液相色谱-质谱代谢组学方法全面探索SP对粪便菌群发酵过程中代谢组的影响,尤其是色氨酸代谢相关代谢物,采用16S rDNA测序综合分析不同发酵时间点的微生物组,揭示SP对粪便菌群组成的影响,为SP防治糖尿病的作用机制提供新的见解。
1 材料与方法
1.1 材料与试剂
SP生化试剂(70%),上海源叶生物科技有限公司;GAM培养基 生化试剂,青岛海博生物技术有限公司;无菌PBS溶液,武汉赛维尔生物科技有限公司。
1.2 仪器与设备
Whitley A35厌氧工作站,英国Don Whitley Scientific公司;5430R低温高速离心机,德国Eppendorf公司;Agilent 1290 Infinity LC超高效液相色谱仪,美国Agilent公司;TripleTOF 6600质谱仪,美国SCIEX公司;ACQUITY UPLC BEH Amide(1.7 μm, 2.1 mm×100 mm)色谱柱,美国Waters公司;立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 患者粪便样本采集
实验使用的粪便样本由2名2型糖尿病患者提供,患者1为未服用降糖药物的新发糖尿病患者,在入院1个月内被诊断为2型糖尿病[年龄45岁,身体质量指数(body mass index,BMI) 24.5 kg/m2,空腹血糖7.8 mmol/L];患者2已有超过10年的2型糖尿病史(年龄55岁,BMI 25.5 kg/m2,日常用药后空腹血糖6.8 mmol/L)。粪便采集前要求患者避免饮用茶酒、食用益生菌,保持清淡的中式饮食,至少3个月内未服用抗生素。2名2型糖尿病患者于西安交通大学第二附属医院注册登记,皆自愿参与研究,身体、精神状况均符合实验要求,并于实验前签署书面知情同意书,所有的实验内容均遵守相关法律法规及准则。
为确保菌群样本均存活,粪便样本在收集完毕后立即低温运输并及时处理。在超净工作台将新鲜粪便样本与无菌PBS溶液以1∶5(g∶mL)的比例混合,均质并离心,收集上清液。在厌氧工作站将收集的上清液分装到5 mL的冻存管中,与无菌甘油溶液按体积比1∶1混合,保存在-80 ℃冰箱备用。
1.3.2 体外粪便微生物发酵实验
体外粪菌发酵实验方法参考文献[14]并稍作修改。配制GAM培养基(Gifu anaerobic medium),每1 L 的GAM培养基包括月示胨(10 g)、大豆胨(3.0 g)、酵母浸粉(5.0 g)、牛肉粉(2.2 g)、消化血清粉(13.5 g)、牛肝浸粉(1.2 g)、葡萄糖(3.0 g)、磷酸二氢钾(2.5 g)、氯化钠(3.0 g)、可溶性淀粉(5.0 g)、L-半胱氨酸(0.3 g)、硫乙醇酸钠(0.3 g)、氯化血红素(5 mg)、0.1%维生素K1溶液(1 mL),将配好的培养基在121 ℃下高压灭菌15 min。于厌氧工作站中分别取两名2型糖尿病患者的2 mL粪便菌悬液与18 mL的GAM培养基于试管中混合,分为不加底物组(NC)、添加色氨酸组(Trp)以及添加色氨酸及SP组(Trp+SP)。将试管转移到37 ℃的厌氧工作站,用薄膜密封,分批发酵24 h,在发酵0、4、8、12、24 h的时间点取样并冻存在-80 ℃冰箱待后续分析。分别使用pH计和苯酚-硫酸法测定0、24 h时样本的pH和总糖含量。
1.3.3 气体成分测定
利用气体分析仪检测发酵24 h后样品中总产气量以及CO2和H2S气体的体积。
1.3.4 微生物16S rDNA测序
测序由上海中科新生命生物科技有限公司完成(http://www.aptbiotech.com/bio/#s1)。采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide, CTAB)法提取盲肠样本的DNA,用无菌水将DNA稀释到1 ng/μL,通过1%琼脂糖凝胶电泳检查提取的DNA质量。使用特异性引物341F(5′-ACTCCTACGGGRSGCAGCAG-3′)和806R(5′-GGACTACVV GGGTATCTAATC-3′)扩增细菌16S rRNA基因的V3~V4高变异区域。聚合酶链反应(polymerase chain reaction, PCR)扩增条件为98 ℃初始变性1 min,循环30次扩增(98 ℃ 变性10 s,50 ℃退火30 s,72 ℃延伸60 s),72 ℃最终延伸5 min,反应在热循环PCR系统中进行。所有PCR产物均用AxyPrep DNA凝胶提取试剂盒纯化以及使用 QuantiFluorTM-S进行定量。使用NEB Next® UltraTMDNA Library Prep Kit建库试剂盒构建文库,并通过Qubitt@ 2.0荧光仪和Bioanalyzer 2100进行评估,纯化和汇集扩增子文库在Illumina MiSeg平台上配对测序(2×300)。使用UCHIME 软件去除嵌合体序列,抽平后运用UPARSE软件RDP classifier贝叶斯算法对 97%相似水平的分类单元(operational taxonomic units, OTU)代表序列进行分类学分析,并在各个分类水平统计各样本的群落组成。
1.3.5 非靶向代谢组学检测
非靶向代谢组学检测由上海中科新生命生物科技有限公司完成(http://www.aptbiotech.com/bio/#s1)。将-80 ℃冷冻的血清样品在4 ℃下解冻,取100 μL血清与400 μL V(冷甲醇)∶V(乙腈)=1∶1溶液混合以去除蛋白质。将混合物离心15 min(14 000 r/min, 4 ℃)。在真空离心机中干燥上清液。进行LC-MS分析时,将样品重新用100 μL V(乙腈)∶V(水)=1∶1溶剂复溶。使用超高效液相色谱(ultra-high performance liquid chromatography,UHPLC)(1290 Infinity LC)串联四极杆飞行时间(AB Sciex TripleTOF 6600)对样品进行分析。进行亲水作用色谱(hydrop interaction liquid chromatography,HILIC)分离时,使用 2.1 mm×100 mm ACQUIY UPLC BEH 1.7 μm 色谱柱分析样品。
在电喷雾电离(electrospray ionization,ESI)正负离子模式下,流动相A相为25 mmol/L醋酸铵和25 mmol/L氢氧化铵水溶液,B相为乙腈。色谱柱首先用85% B液冲洗1 min,在11 min内线性下降至65%,冲洗6 s后降至40%并保持4 min,冲洗6 s后升至85%并维持5 min,进行反相液相色谱分离时使用2.1 mm×100 mm ACQUIY UPLC HSS T3 1.8 μm色谱柱。在ESI正离子模式下,流动相A相为含有0.1%甲酸的水,B相为含有0.1%甲酸的乙腈;在ESI负离子模式下,流动相A相为0.5 mmol/L氟化铵水溶液,B相为乙腈,梯度设置为1%B持续冲洗1.5 min,在11.5 min内线性增加至99%并保持3.5 min,之后在6 s内降至1%并维持3~4 min的再平衡。梯度流速为0.3 mL/min,柱温为25 ℃,每个样品进样2 μL。ESI源条件设置为:离子源气体1(Gas1)为60,离子源气体2(Gas2)为60,气帘(curtain gas,CUR)为30,源温度:600 ℃,离子喷雾电压浮动(ISVF)±5 500 V。在MS采集中,仪器设置为在60~1 000 Da的m/z范围,TOF MS扫描的累积时间为0.20 s/spectra。在自动MS/MS采集中,仪器设置为在25~1 000 Da的m/z范围,且产物离子扫描的累积时间为0.05 s/spectra。使用信息相关采集(information dependent acquisition,IDA)并选择高灵敏度模式来采集子离子扫描。参数设置如下:碰撞能量(collision energy,CE)固定在35 V±15 eV;去簇电位(declustering potential,DP)为60 V(+)和-60 V(-);排除4 Da内的同位素,每个循环监测10个候选离子。
1.4 统计方法
本实验的统计分析均使用R(V4.0.4)完成。所有实验数据测定3次平行,连续变量以平均值 ± 标准差表示。使用R包“vegan”和“ape”进行主成分分析(principal component analysis,PCA)和主坐标分析(principal coordinates analysis,PCoA)。两组之间的差异分析是通过非参数Wilcoxon检验进行的,采用方差分析(ANOVA)来评估不同发酵底物或时间点对不同供体样本的代谢物和肠道微生物群的影响,并进行Turkey事后检验。采用R软件包“Mfuzz”进行模糊C均值算法聚类分析,以探究色氨酸和SP对体外发酵过程中粪便微生物群丰度的影响[15]。此外,通过Spearman相关性分析来确定盲肠微生物群和血清代谢物之间的相关性。为降低假阳性概率,统计检验中进行错误发现率(false discovery rate,FDR)校正后P<0.05被认为具有统计学意义。
2 结果与分析
2.1 SP降低2型糖尿病患者粪便菌群发酵液pH及总糖含量
通过测定0和24 h各组发酵液的pH(表1)可以发现,新发患者粪便菌群发酵液初始pH(0 h)与常年患者无差异,经SP干预后,发酵液pH降低,且该调控作用在新发患者菌群中效果更为明显。通过测定0和24 h各组发酵液的总糖含量(表1)可以发现,发酵24 h后发酵液中总糖含量明显降低,其中Trp+SP组降低效果最显著(P<0.05),NC组和Trp组的总糖含量变化程度相当,此外,常年患者粪便菌群发酵液的总糖含量略高于新发患者。以上结果说明,2组人群肠道菌群都可以较好地利用SP,且SP对新发患者结肠环境pH减低作用更为显著。结肠pH降低可以抑制病原菌,改善肠道微生态。
表1 SP对2型糖尿病新发及常年患者粪便菌群发酵液中pH及总糖含量的影响
Table 1 Effects of soybean polysaccharides on pH and total sugar content in broth of new and year-round patients with type 2 diabetics after fecal flora fermentation for 0 and 24 h
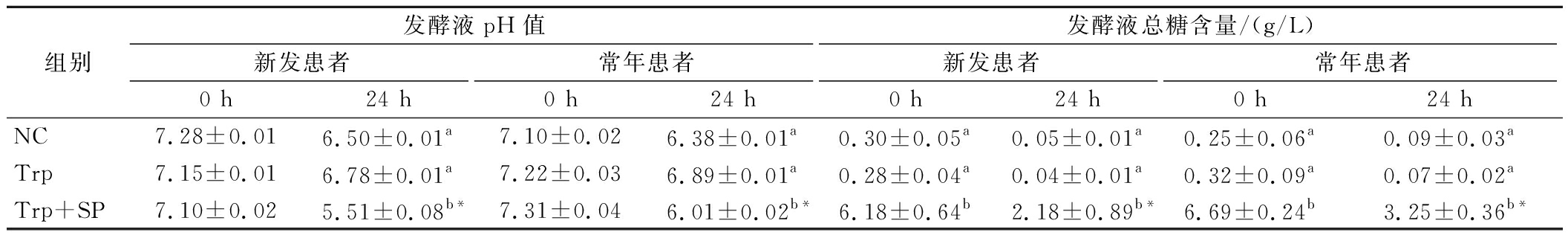
组别发酵液pH值发酵液总糖含量/(g/L)新发患者常年患者新发患者常年患者0 h24 h0 h24 h0 h24 h0 h24 hNC7.28±0.016.50±0.01a7.10±0.026.38±0.01a0.30±0.05a0.05±0.01a0.25±0.06a0.09±0.03aTrp7.15±0.016.78±0.01a7.22±0.036.89±0.01a0.28±0.04a0.04±0.01a0.32±0.09a0.07±0.02aTrp+SP7.10±0.025.51±0.08b*7.31±0.046.01±0.02b*6.18±0.64b2.18±0.89b*6.69±0.24b3.25±0.36b*
注:组别NC:不加底物组;Trp:添加色氨酸组;Trp+SP:添加色氨酸及SP组(下同)。不同字母表示不同干预对发酵液pH和总糖含量的影响差异。*表示发酵24 h对比初始(0 h)发酵液pH和总糖含量的影响差异(P<0.05)。
2.2 SP有效改善2型糖尿病患者粪便菌群发酵过程中的产气情况
2型糖尿病新发及常年患者粪便菌群发酵24 h后,测定各组总产气量、CO2产量和H2S产量。结果表明,常年患者的总产气量和CO2产量均低于新发患者,但H2S产量显著高于新发患者,组间比较发现,Trp+SP组的总产气量和CO2产量相较NC组和Trp组明显升高,而H2S产量相较其余2组明显降低,NC组和Trp组的产气量无显著差异(表2)。说明SP的添加能有效改变2型糖尿病粪便菌群发酵过程中的产气情况。
表2 SP对2型糖尿病新发及常年患者粪便菌群发酵24 h后产气量的影响
Table 2 Effects of soybean polysaccharides on gas production in broth of new and year-round patients with type 2 diabetics after fecal flora fermentation for 24 h
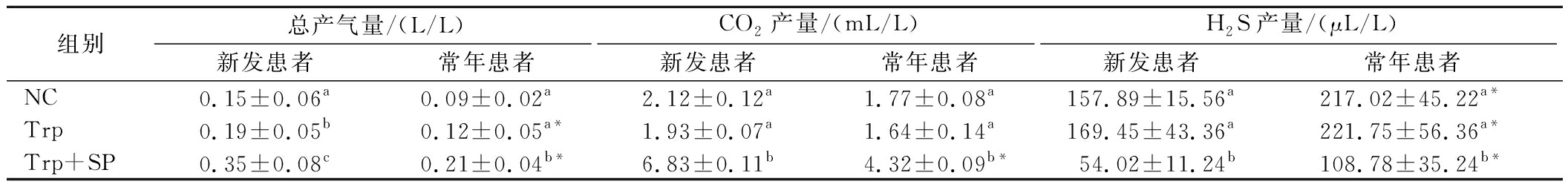
组别总产气量/(L/L)CO2产量/(mL/L)H2S产量/(μL/L)新发患者常年患者新发患者常年患者新发患者常年患者NC0.15±0.06a0.09±0.02a2.12±0.12a1.77±0.08a157.89±15.56a217.02±45.22a*Trp0.19±0.05b0.12±0.05a*1.93±0.07a1.64±0.14a169.45±43.36a221.75±56.36a*Trp+SP0.35±0.08c0.21±0.04b*6.83±0.11b4.32±0.09b*54.02±11.24b108.78±35.24b*
注:不同字母表示不同干预对发酵体系总产气量、CO2和H2S产量的影响差异。*表示发酵24 h后新发患者粪菌发酵体系对比常年患者粪菌发酵体系总产气量、CO2和H2S产量的差异(P<0.05)。
2.3 SP对2型糖尿病患者粪菌发酵液代谢物组的影响
通过代谢组学分析,在2型糖尿病患者粪便菌群体外发酵液中共检测到245种代谢物,主要包括氨基酸类(n=53)、脂肪酸类(n=44)、苯类(n=20)、碳水化合物(n=19)、胆汁酸(n=17)、吲哚类(n=13)、嘌呤核苷酸(n=12)及其他(图1-a)。主成分分析结果表明,SP干预显著改变2型糖尿病患者的微生物代谢组,且对新发患者和常年患者的代谢物改变呈现出不同的变化模式(图1-b)。在新发患者和常年患者的粪便代谢组中,SP分别显著上调82、22种代谢物,显著下调43、25种代谢物,其中,γ-氨基丁酸(γ-aminobutyric acid)、琥珀酸(succinic acid)和海藻糖(trehalose)等14种代谢物含量在新发患者和常年患者中均显著上调,去氧胆酸(chenodeoxycholic acid)和谷氨酰胺(L-glutamine)等代谢物含量在新发患者和常年患者中均下调(图1-c、图1-d),这一结果与前人研究相吻合[7,16]。此外,大多数代谢物在常年患者中的表达水平显著高于新发患者,如天门冬氨酸(L-aspartic acid)、柠檬酸(citramalic acid)、苯甲酰胺(benzamide)和蛋氨酸(L-methionine)等(图1-e)。

a-代谢物分类;b-PCA分析;c-SP上调代谢物Venn;d-SP下调代谢物Venn;e-不同组别代谢物热图
图1 2型糖尿病患者体外粪便微生物发酵代谢组学分析
Fig.1 Metabolomic analysis of fecal microbial fermentation in type 2 diabetic patients in vitro
在以上检测到的所有代谢物中共发现16种色氨酸代谢物(图2-a),由图2-c~图2-g可以看出,SP能够显著提高新发患者体外粪菌发酵过程中的大部分色氨酸代谢物(P<0.05),特别是吲哚丙酸(indole-3-propionic acid)、吲哚丙烯酸(indole acrylic acid)、吲哚乳酸(indole-3-lactic acid)、吲哚乙酸(indole acetic acid)和吲哚甲醛(indole-3-carboxaldehyde)等吲哚衍生物,而对于常年患者,只有少量色氨酸代谢物会受到影响,如褪黑素(Melatonin)、5-羟基吲哚-3-乙酸(5-hydroxyindole-3-acetic acid)和吲哚-3-乙醛(indole-3-acetaldehyde)等。此外,由图2-h可以看出,对于NC组,犬尿氨酸(L-kynurenine)在常年患者粪便菌群发酵液中的含量显著高于新发患者,在添加色氨酸之后,常年患者粪便菌群发酵液中犬尿氨酸的含量降低,而新发患者粪便菌群发酵液中犬尿氨酸的含量反而升高。以上结果表明SP显著影响2型糖尿病新发患者和常年患者的菌群代谢,尤其是以吲哚衍生物及犬尿氨酸为首的色氨酸代谢。
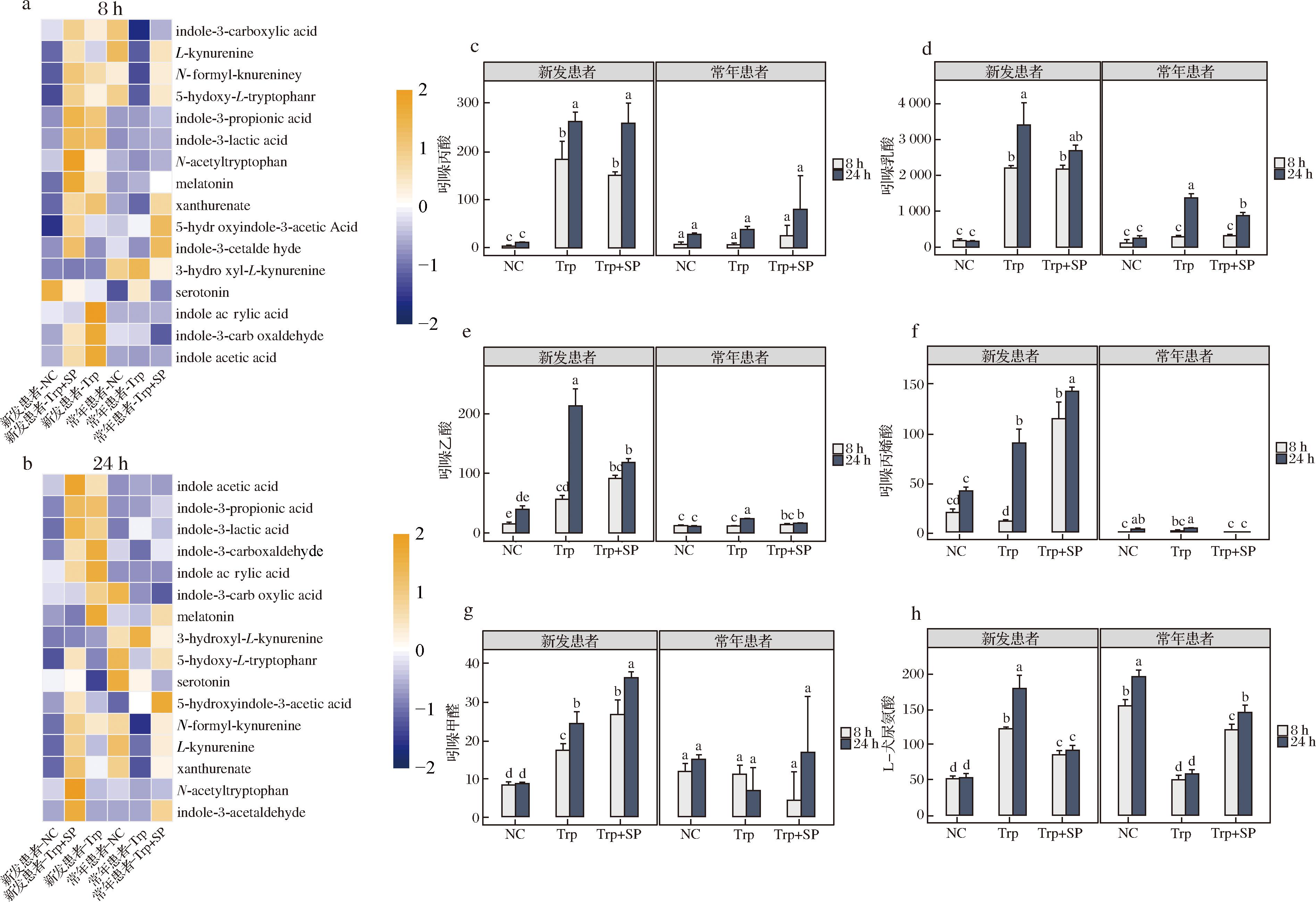
a-8 h时色氨酸代谢物在各组的丰度热图;b-24 h时色氨酸代谢物在各组的丰度热图;c-吲哚丙酸丰度;d-吲哚乳酸丰度;e-吲哚乙酸丰度;f-吲哚丙烯酸丰度;g-吲哚甲醛丰度;h-L-犬尿氨酸丰度
图2 2型糖尿病患者体外粪便微生物发酵过程中色氨酸代谢物的变化
Fig.2 Changes in tryptophan metabolites during the fecal microbial fermentation in type 2 diabetic patients in vitro
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4 SP调节2型糖尿病患者粪便菌群微生物组成
通过16S rDNA测序探究SP和色氨酸对2型糖尿病患者粪便微生物的影响,共鉴定出486个细菌分类,包括门水平(n=14)、科水平(n=74)、属水平(n=105)、种水平(n=45)和OTU水平(n=373)。多样性分析表明,与NC组相比,在0 h新发患者和常年患者粪便微生物群之间的α多样性无显著差异。随着发酵时间的推移,新发患者Trp组和Trp+SP组的α多样性相较NC组呈现降低趋势,而常年患者无显著变化(图3-a、图3-b)。新发患者和常年患者初始粪便菌群(0 h)显示,乳酸杆菌(Lactobacillus),唾液乳杆菌(Lactobacillus salivarius), 长双歧杆菌(Bifidobacterium longum)和发酵乳杆菌(Lactobacillus fermentum)的丰度在新发患者中高于常年患者(图3-c)。PCoA表明,NC组与Trp组在4 h时无明显差异,发酵8 h之后呈现显著差异,经SP干预后,2型糖尿病患者的微生物群组成得到改变(图3-d~图3-g)。说明SP和色氨酸可以有效调节2型糖尿病患者粪便菌群微生物组成。为了进一步探索色氨酸和SP在发酵过程中如何调节两名患者的粪便微生物群组成,我们分别在4个不同时间点(4、8、12、24 h)进行了趋势聚类分析,每次分析得到6个聚类。通过筛选在Trp组和Trp+SP组有上调趋势的聚类,发现双歧杆菌(Bifidobacterium)、乳酸杆菌(Lactobacillus)和梭状芽孢杆菌(Clostridium sensu stricto 1)等39个菌属以及长双歧杆菌亚种(Bifidobacterium longum subsp. Longum)、植物乳杆菌(Lactobacillus plantarum)和唾液乳杆菌(Lactobacillus salivarius)等26个菌种在新发患者和常年患者中均被色氨酸和SP上调。以上聚类分析结果表明,SP对2型糖尿病患者体外发酵过程中微生物的影响主要集中在双歧杆菌属和乳酸杆菌属,且对新发患者双歧杆菌的上调效果更为显著(图3-h、图3-i)。

a-Shannon指数;b-Simpson指数;c-初始状态新发患者和常年患者差异菌种;d-发酵4 h PCoA分析;e-发酵8 h PCoA分析;f-发酵12 h PCoA分析;g-发酵24 h PCoA分析;h-新发患者和常年患者g_Bifidobacterium在4、8、12、24 h丰度;i-新发患者和常年患者g_Lactobacillus在4、8、12、24 h丰度
图3 2型糖尿病患者体外粪便微生物发酵微生物组分析
Fig.3 Microbiome analysis of fecal microbial fermentation in type 2 diabetic patients in vitro
2.5 SP调控肠道菌群介导的色氨酸代谢
基于SP对2型糖尿病患者粪便微生物群和微生物代谢组的显著影响,我们通过分别计算不同发酵时间点受SP调控的双歧杆菌属及乳酸杆菌属与色氨酸代谢物之间的Spearman相关系数,进一步评估它们之间的相关性(图4)。分析表明,在属水平上,双歧杆菌属及乳酸杆菌属与大部分色氨酸代谢物成正相关,尤其是吲哚衍生物,其中双歧杆菌属与吲哚乙酸和吲哚丙烯酸显著正相关(r>0.8,P<0.001),乳酸杆菌属与5-羟基色氨酸、犬尿氨酸和吲哚乙醛显著正相关(r>0.5,P<0.05);在种水平上,长双歧杆菌亚种(Bifidobacterium longum subsp. Longum)与吲哚丙烯酸、吲哚乙酸、吲哚丙酸和吲哚乳酸呈显著正相关(r>0.5,P<0.05),罗伊氏乳杆菌(Lactobacillus reuteri)与5-羟基吲哚-3-乙酸呈显著正相关(r=0.614,P=0.036),唾液乳杆菌(Lactobacillus salivarius)和吲哚乙醛(indole-3-acetaldehyde)显著正相关(r=0.714,P=0.008),沙雷氏乳杆菌(Lactobacillus saerimneri)与3-羟基-L-犬尿氨酸(3-hydroxyl-L-kynurenine)显著正相关(r=0.753,P=0.004),此外,粘液乳杆菌(Lactobacillus mucosae)和发酵乳杆菌(Lactobacillus fermentum)等部分乳杆菌与犬尿氨酸显著正相关,与吲哚衍生物呈负相关。以上结果进一步证实了SP很可能通过影响双歧杆菌和乳酸杆菌来调节色氨酸代谢。

图4 SP调控的双歧杆菌、乳酸杆菌与色氨酸代谢物之间的Spearman相关性分析
Fig.4 Spearman correlation between Bifidobacteria, Lactobacillus and tryptophan metabolites regulated by Soluble soybean polysaccharide
3 结论与讨论
饮食-肠道菌群的相互作用对人类健康有重要影响[17],近年来,色氨酸代谢因其与肠道微生物群以及2型糖尿病等代谢性疾病之间的紧密联系受到学者的广泛关注[5,7]。肠道菌群失调引发的色氨酸代谢紊乱可增加肥胖、肠道疾病、2型糖尿病发病[1],肠道菌群介导的色氨酸-吲哚丙酮酸代谢产生的吲哚类代谢物可作为AhR内源性配体,通过特异性结合AhR促进肠上皮细胞恢复、保持屏障完整性、影响免疫细胞分化及抗原递呈功能、调控炎性细胞因子表达等途径来维持肠道稳态,发挥有益健康的生理功效[5-6,12]。相反,由肠上皮细胞和免疫细胞分泌的吲哚胺2,3-二氧合酶1(indoleamine-2,3-dioxygenase,IDO1)依赖性色氨酸-犬尿氨酸代谢失衡与肠道炎症、宿主免疫应答、胰岛素抵抗等代谢疾病密切相关。肠道菌群可以通过抑制犬尿氨酸代谢途径[18],激活色氨酸-吲哚代谢途径,在色氨酸酶作用下将色氨酸分解为吲哚代谢物,进而激活芳香烃受体(aromatic hydrocarbon receptor,AHR),调节宿主的免疫系统,维持宿主-肠道菌群的内稳态[19]。
SP不仅可以被机体分解提供能量,亦可作为肠道菌群的碳源促进益生菌增殖,发挥多种有益健康生理功效[20]。本研究构建2型糖尿病患者的粪便菌群体外发酵模型研究SP对发酵体系pH值和产气情况影响。结果表明,新发患者粪便菌群发酵液初始pH(0 h)与常年患者无差异,经SP干预后,发酵液PH降低,且该调控作用在新发患者菌群中效果更为明显。肠道微生物发酵利用膳食纤维并代谢生成短链脂肪酸可降低结肠 pH 值、抑制肠道有害菌生长[21],此外,结肠中气体产生主要来自微生物群,CO2大多产自肠道菌群碳水化合物发酵过程,H2S多产自蛋白质发酵过程,由硫还原菌还原硫酸盐和亚硫酸盐,继而直接通过中枢神经调节肠道蠕动。发酵体系中CO2和H2S的产量一定程度上反映着宿主肠道糖代谢情况[22]。这些结果说明,新发患者的结肠环境略优于常年患者,且SP干预对结肠环境的改善作用也在新发患者中较为突出,证实SP对二型糖尿病前期较好的逆转及防治作用。
现有大多研究将功能性膳食纤维(如SP等)和肠道微生物群之间存在的互惠关系, 即高膳食纤维有助于维持健康的肠道微生物群,归因于膳食纤维促产的短链脂肪酸[23]。通过综合分析菌群代谢物组,本研究明确SP对肠道菌群介导的色氨酸-吲哚丙酮酸代谢通路的靶向激活效能,SP促产色氨酸转化为吲哚乙酸、吲哚丙烯酸、吲哚丙酸、吲哚乳酸和吲哚乙醛等具有益生功效的菌群-宿主间的桥梁物质——吲哚类代谢物,进而增强肠道免疫,防治2型糖尿病[4]。不仅如此,通过对发酵体系菌群微生物组研究发现,双歧杆菌属和乳酸杆菌属不仅在新发患者和常年患者初始菌群中存在明显差异,在SP干预之后更是得到显著增殖,且与大部分吲哚类代谢物丰度成显著正相关。WANG等[24]通过队列人群研究发现,犬尿氨酸与二型糖尿病呈现正相关,吲哚丙酸酯与二型糖尿病呈现负相关;QI等[7]通过人群实验研究发现,经由色氨酸-吲哚丙酮酸代谢途径产生的吲哚类衍生物与2型糖尿病发病风险显著负相关;双歧杆菌产生的吲哚乳酸被报道可以通过激活AhR和Nrf2途径减少肠道上皮细胞的炎症[25];吲哚乙醇、吲哚丙酮酸、吲哚乙醛被报道可作为芳香烃受体的配体,通过抑制肌球蛋白IIA及erzin的激活,维持肠道屏障完整性,缓解小鼠结肠炎的发生[26]。长双歧杆菌能够参与色氨酸代谢调控,促产吲哚甲醛,激活AHR介导的免疫反应[27];罗伊氏乳杆菌可通过芳香族氨基酸氨基转移酶和吲哚乳酸脱氢酶将色氨酸转化为中间物吲哚-3-乳酸或吲哚丙酸,激活CD4 T细胞中AHR,下调ThPOK,调节免疫反应[28]。
综上,本研究通过开展2型糖尿病患者的体外粪便菌群发酵实验,证实SP在肠道中可被2型糖尿病患者粪便菌群酵解利用,同时揭示可溶性SP对2型糖尿病患者粪便微生物代谢组和菌群结构的直接作用。SP可促产双歧杆菌和乳酸杆菌,靶向推动肠道菌群介导的色氨酸-吲哚丙酮酸代谢,将色氨酸转化为具有改善肠道免疫功能的吲哚类化合物,如吲哚丙烯酸、吲哚乙酸、吲哚乙醛和吲哚丙酸等代谢产物。此外,我们发现SP对色氨酸平衡的正向调控作用在未用药的新发患者的粪便菌群发酵过程中体现得更加明显,证实将SP作为菌群导向型食品因子发展为预防、缓解糖尿病功能食品的极大潜力。
[1] GURUNG M, LI Z P, YOU H, et al.Role of gut microbiota in type 2 diabetes pathophysiology[J].EBioMedicine, 2020, 51:102590.
[2] BRODY H.The gut microbiome[J].Nature, 2020, 577(7792):S5.
[3] LYNCH S V, PEDERSEN O.The human intestinal microbiome in health and disease[J].The New England Journal of Medicine, 2016, 375(24):2369-2379.
[4] AGUS A, PLANCHAIS J, SOKOL H.Gut microbiota regulation of tryptophan metabolism in health and disease[J].Cell Host &Microbe, 2018, 23(6):716-724.
[5] PLATTEN M, NOLLEN E A A, RÖHRIG U F, et al.Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond[J].Nature Reviews Drug Discovery, 2019, 18(5):379-401.
[6] LAMAS B, HERNANDEZ-GALAN L, GALIPEAU H J, et al.Aryl hydrocarbon receptor ligand production by the gut microbiota is decreased in celiac disease leading to intestinal inflammation[J].Science Translational Medicine, 2020, 12(566):eaba0624.
[7] QI Q B, LI J, YU B, et al.Host and gut microbial tryptophan metabolism and type 2 diabetes:An integrative analysis of host genetics, diet, gut microbiome and circulating metabolites in cohort studies[J].Gut, 2022, 71(6):1095-1105.
[8] ROTHHAMMER V, MASCANFRONI I D, BUNSE L, et al.Type I interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor[J].Nature Medicine, 2016, 22(6):586-597.
[9] WASTYK H C, FRAGIADAKIS G K, PERELMAN D, et al.Gut-microbiota-targeted diets modulate human immune status[J].Cell, 2021, 184(16):4137-4153.
[10] 李文峰, 陶雯, 陈露红, 等.可溶性大豆多糖改善左旋肉碱诱导的小鼠小肠首过代谢[J].食品科学, 2019, 40(13):187-194.LI W F, TAO W, CHEN L H, et al.Soluble soybean polysaccharides ameliorate L-carnitine-induced first-pass metabolism in the small intestine of mice[J].Food Science, 2019, 40(13):187-194.
[11] HE H Y, CHEN C, ZHAO W.Soybean soluble polysaccharide prevents obesity in high-fat diet-induced rats via lipid metabolism regulation[J].International Journal of Biological Macromolecules, 2022, 222:3057-3065.
[12] GE P Y, QU S Y, NI S J, et al.Berberine ameliorates depression-like behavior in CUMS mice by activating TPH1 and inhibiting IDO1-associated with tryptophan metabolism[J].Phytotherapy Research:PTR, 2023, 37(1):342-357.
[13] LI L, LI M Y, WU J F, et al.Soybean polysaccharide fermentation products regulate the air-liquid interface in co-cultured Caco-2 cells by increasing short chain fatty acids transport[J].Food Research International, 2022, 162:112136.
[14] TEJADA-ORTIGOZA V, GARCIA-AMEZQUITA L E, KAZEM A E, et al.In vitro fecal fermentation of high pressure-treated fruit peels used as dietary fiber sources[J].Molecules (Basel, Switzerland), 2019, 24(4):E697.
[15] KUMAR L, E FUTSCHIK M E.Mfuzz:A software package for soft clustering of microarray data[J].Bioinformation, 2007, 2(1):5-7.
[16] WANG S Y, LI M, LIN H, et al.Amino acids, microbiota-related metabolites, and the risk of incident diabetes among normoglycemic Chinese adults:Findings from the 4C study[J].Cell Reports Medicine, 2022, 3(9):100727.
[17] WHITE E.Impact of diet-microbiota interactions on human metabolism[J/OL].Nature Research, 2019.http://www.nature.com/articles/d42859-019-00017-z.
[18] GAO K, MU C L, FARZI A, et al.Tryptophan metabolism:A link between the gut microbiota and brain[J].Advances in Nutrition (Bethesda, Md.), 2020, 11(3):709-723.
[19] NICOLAS G R, CHANG P V.Deciphering the chemical lexicon of host-gut microbiota interactions[J].Trends in Pharmacological Sciences, 2019, 40(6):430-445.
[20] XU J, CHEN H B, LI S L.Understanding the molecular mechanisms of the interplay between herbal medicines and gut microbiota[J].Medicinal Research Reviews, 2017, 37(5):1140-1185.
[21] DODD D, SPITZER M H, VAN TREUREN W, et al.A gut bacterial pathway metabolizes aromatic amino acids into nine circulating metabolites[J].Nature, 2017, 551(7682):648-652.
[22] 贾丽娜, 马倩, 王新月, 等.基于体外发酵模型分析植物多糖对T2DM患者肠道菌群及代谢的影响[J].食品科学, 2023, 44(2):248-261.JIA L N, MA Q, WANG X Y, et al.Effects of plant polysaccharides on intestinal flora and metabolism in patients investigated using in vitro fermentation model[J].Food Science, 2023, 44(2):248-261.
[23] CHEN P, CHEN X Q, HAO L L, et al.The bioavailability of soybean polysaccharides and their metabolites on gut microbiota in the simulator of the human intestinal microbial ecosystem (SHIME)[J].Food Chemistry, 2021, 362:130233.
[24] WANG Z C, WANG J, HU J X, et al.A comparative study of acarbose, vildagliptin and saxagliptin intended for better efficacy and safety on type 2 diabetes mellitus treatment[J].Life Sciences, 2021, 274:119069.
[25] EHRLICH A M, PACHECO A R, HENRICK B M, et al.Indole-3-lactic acid associated with Bifidobacterium-dominated microbiota significantly decreases inflammation in intestinal epithelial cells[J].BMC Microbiology, 2020, 20(1):357.
[26] SCOTT S A, FU J J, CHANG P V.Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor[J].Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(32):19376-19387.
[27] FANG Z F, PAN T, LI L Z, et al.Bifidobacterium longum mediated tryptophan metabolism to improve atopic dermatitis via the gut-skin axis[J].Gut Microbes, 2022, 14(1):2044723.
[28] CERVANTES-BARRAGAN L, CHAI J N, TIANERO M D, et al.Lactobacillus reuteri induces gut intraepithelial CD4+CD8αα+ T cells[J].Science, 2017, 357(6353):806-810.