细胞代谢过程中会产生大量的活性氧自由基(reactive oxygen species, ROS),包括羟自由基、超氧阴离子自由基、单线态氧和过氧化氢[1]。一般ROS会被体内的内源性抗氧化防御系统清除,但ROS的过度积累会造成氧化应激,并损伤细胞DNA、蛋白质和脂质,导致衰老、糖尿病、癌症、神经退行性疾病和动脉粥样硬化等多种疾病的发生率上升[2]。为减少以上风险,人们会选择服用抗氧化剂,以达到身体氧化还原平衡,保持机体健康,但人工合成的抗氧化剂对人体具有一定的毒副作用[3]。食源性动植物是天然抗氧化剂的优质来源,多肽是其中重要的抗氧化成分。如付镓榕等[4]从坚果中分离出可清除DPPH自由基和ABTS阳离子自由基的小分子抗氧化肽;吉正梅等[5]发现鸭胚胎源肽不仅可以清除自由基,还对过氧化氢诱导细胞氧化应激损伤有抑制作用。CAI等[6]发现草鱼皮的多肽能显著清除DPPH自由基、ABTS阳离子自由基、羟自由基和抑制脂质过氧化。因此,研究食源性动植物中的抗氧化肽对代谢类疾病的防治具有重要的意义。
中国是鱼类水产大国,2022年全国水产品总产量达6 865.91万t,渔业经济总产值为30 873.14亿元,其中渔业产值15 267.49亿元[7]。传统的大宗淡水鱼有青鱼、草鱼、鲤鱼、鲫鱼、鳙鱼、鳊鲂和鲢鱼,占淡水养殖产量的68%,其主要以粗加工为主,高附加值产品较少。鱼是抗氧化肽的优质来源,研究发现多种鱼源性生物活性肽具有抗氧化、抗癌、抗菌和抗高血压等活性[8]。如刘丹[9]研究表明,秋刀鱼蛋白肽具有很强的DPPH自由基和超氧阴离子自由基清除能力,其IC50分别为3.32 mg/mL和5.08 mg/mL,HASHEM等[10]报道表明,短盖肥脂鲤鱼肉<3 kDa的组分具有很强的DPPH自由基、ABTS阳离子自由基清除能力,低浓度下其清除率可达到81.10%和90.40%。目前虽发现淡水鱼多肽具有抗氧化活性,但缺乏不同淡水鱼多肽活性的对比研究,具体的多肽活性成分还需进一步的筛选和探究。
尽管目前已经发现淡水鱼多肽具有抗氧化活性,但对于不同淡水鱼多肽的活性比较研究及活性成分仍需要进一步的筛选探究。本研究以青鱼、草鱼、鲤鱼、鲫鱼、鳙鱼、鳊鲂和鲢鱼7种淡水鱼肉为原料,分析其基本成分,比较水分、灰分、粗蛋白和粗脂肪含量;再通过二步酶解法进行酶解制备酶解物,并采用超滤技术分离得到2个不同分子质量的肽组分,测定其分子质量分布;以ABTS阳离子自由基清除能力、铁离子还原能力和亚铁离子螯合能力为指标评价不同肽组分的抗氧化能力,并使用高效液相色谱串联质谱联用技术(liquid chromatography tandem mass spectrometry, LC-MS/MS)对抗氧化肽组分进行结构鉴定,可为淡水鱼抗氧化肽的开发利用提供参考价值,还可为我国淡水鱼高值化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
7种淡水鱼均购自江西省南昌市天虹超市;复合蛋白酶(食品级),江苏锐阳生物科技有限公司;ABTS、BSA、碱性蛋白酶(食品级)、细胞色素C、抑肽酶和羟脯氨酸,北京索莱宝科技有限公司;Na2CO3、L-氧化型谷胱甘肽和FeCl3,上海阿拉丁生化科技有限公司;三氯乙酸,天津市大茂化学试剂厂。
1.2 仪器与设备
Synergy H1型酶标仪,美国Bio Tek公司;FA1104 N型电子分析天平,上海丙林电子科技有限公司;LGJ-1D-80冷冻干燥机,北京亚泰科隆仪器技术有限公司;KQ5200DE台式数控超声波清洗器,北京仪诺科兴科技发展有限公司;U-2910型紫外-可见光光度计,日本Hitachi公司;Q-exactive质谱仪,Thermo Fisher公司。
1.3 实验方法
将青鱼、草鱼、鲤鱼、鲫鱼、鳙鱼、鳊鲂和鲢鱼洗净后去除鱼鳞、鱼头、鱼皮和内脏组织,取鱼背部肌肉,放入绞肉机绞成肉糜,于-80 ℃冰箱保存备用。
1.3.1 七种淡水鱼鱼肉的基本成分测定
取新鲜鱼肉测定其水分、灰分、蛋白质和脂肪含量。参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法测定鱼肉中的水分含量;参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》中食品中总灰分的测定方法测定鱼肉中灰分含量;参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定鱼肉中粗蛋白含量;参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法测定鱼肉中粗脂肪含量。
1.3.2 七种淡水鱼抗氧化肽的制备
参照朱敏方[11]的方法制备7种淡水鱼多肽酶解液。第一步采用复合蛋白酶酶解,酶解条件为:酶添加量(底物以鱼糜蛋白质含量计算)为10 000 U/g、温度为50 ℃、pH值为8.0、酶解时间为3 h;然后采用碱性蛋白酶进行第二步酶解,酶添加量为6 000 U/g,温度为50 ℃、pH值为9.0、酶解时间为2 h,100 ℃灭酶10 min后于7 800 r/min离心10 min获得酶解产物,0.45 μm水系滤膜过滤后保存于-20 ℃冰箱备用。
1.3.3 七种淡水鱼抗氧化肽的超滤分离
采用3 kDa的超滤离心管对酶解液进行超滤,超滤条件如下:用蒸馏水将滤液稀释10倍,4 000 r/min离心20 min。滤液为3 kDa以下的多肽组分,截留的酶解液为3 kDa以上的多肽组分,将其分别收集于试管中,真空冻干待测。
1.3.4 超滤组分多肽分子质量分布的测定
按照《食品安全国家标准 胶原蛋白肽》中的高效分子排阻色谱法测定7种淡水鱼酶解液超滤组分的分子质量分布。以羟脯氨酸(131.13 Da)、L-氧化型谷胱甘肽(612.63 Da)、抑肽酶(6 511.51 kDa)和细胞色素C(12 384.00 kDa)为标准品,以标准品相对分子质量的对数(lg Mw)和对应保留时间(t)作线性回归得到相对分子质量校正曲线(lg Mw=6.642-0.188 1t,R2=0.996 6)。根据相对分子质量校正曲线方程,可计算出样品的分子质量分布范围。
1.3.5 超滤组分肽组成鉴定
参考朱敏方[11]的方法将得到的超滤组分干粉进行溶解、脱盐等处理,采用LC-MS/MS法对多肽组分进行氨基酸序列测定,具体的液相参数、质谱参数如下:
质谱参数:配备Nanospray Flex离子源,正离子模式进行扫描。质量范围350~1 500;S-Lens RF(射频电压)值设置为50 V;离子传输管温度设置为320 ℃;喷雾电压2 000 V。色谱条件:色谱柱AcclaimR PepMap RSLC(50 μm×15 cm, C18, 2 μm, 100 Å);流动相A:0.1%(体积分数)甲酸,流动相B:0.1%甲酸,80%乙腈;流速设置为300 nL/min,柱温为50 ℃。洗脱条件如下:0 min,94% A;42 min,75% A;53 min,65% A;53.5~90 min,20% A。采用PEAKS软件对质谱数据进行分析,获得多肽氨基酸序列信息,并根据其信息在Uniprot中进行检索,鉴定的多肽序列满足错误发现率(false discovery rate, FDR)≤5%,平均局部置信度得分(average local confidence, ALC)≥95%。
1.3.6 ABTS阳离子自由基清除能力的测定
参考李军等[12]方法测定样品的ABTS阳离子自由基清除能力。称取19.2 mg ABTS和3.311 5 mg过硫酸钾混合,蒸馏水溶解后定容至10.0 mL配成母液,避光放置12~16 h,使用前用水稀释为734 nm处的吸光值为0.70±0.20的工作液。将50 μL样品或标准品与150 μL ABTS阳离子自由基工作液于96孔酶标板中混匀,室温下避光反应6 min后于734 nm处测定其吸光值。空白组以蒸馏水和PBS分别代替样品和ABTS阳离子自由基工作液,结果以IC50值(自由基清除率为50%时的样品浓度)表示。
1.3.7 铁离子还原能力的测定
采用贾韶千等[13]方法测定样品的铁离子还原能力。取2.0 mL适宜浓度的样品与2.0 mL 10 g/L铁氰化钾溶液混匀,50 ℃反应20 min后加入2.0 mL 100 g/L的三氯乙酸溶液,10 min后,再加入0.6 mL去离子水和0.12 mL 1 g/L氯化铁,混匀后取200 μL上清液于96孔酶标板中,测其在700 nm处的吸光值。空白组以去离子水代替1 g/L氯化铁。结果以反应体系吸光值为1.0时所需样品浓度(OD1.0)表示。
1.3.8 亚铁离子螯合能力的测定
按照张美玲等[14]方法测定样品的亚铁离子螯合能力。将250 μL适宜浓度的样品与150 μL 0.5 mmol/L FeCl2溶液混合,加入一定量蒸馏水,使反应体系终体积为1.5 mL,充分混匀静置2 min后,加入1.0 mL 500 μmol/L的菲洛嗪溶液,反应10 min,用紫外分光光度法于562 nm处测定其吸光值。空白组为样品溶剂代替样品,结果以IC50值表示。
1.4 数据处理
所有实验均重复3次,实验数据均以平均值 ± 标准差表示。采用Origin 2019软件进行非线性曲线拟合并作图,运用SSPS 22.0软件对数据进行单因素方差分析(ANOVA)和Tukey’s post-hoc检验,确定数据间的差异显著性。
2 结果与分析
2.1 七种淡水鱼鱼肉基本成分分析
如表1所示,7种淡水鱼鱼肉水分含量为72%~83%,鳙鱼鱼肉水分含量最高,达83.74%,略高于黄湘芬等[15]的研究,其可能与鱼的不同生长周期有关。鲤鱼具有最高的灰分含量(2.19%),而鲫鱼、鳊鱼和鲢鱼鱼肉灰分含量无显著差异(P>0.05),但显著高于草鱼、青鱼和鳙鱼鱼肉(P<0.05)。鳊鱼具有最高的粗蛋白含量(26.69%),青鱼、鲤鱼和鲢鱼鱼肉的粗蛋白含量无显著差异(P>0.05)。粗脂肪以鲢鱼鱼肉最高,为3.57%,鳊鱼粗脂肪含量次之,鲫鱼鱼肉粗脂肪含量最低,约为鲢鱼鱼肉的1/3。魏永生等[16]研究发现新鲜鲢鱼肌肉脂肪含量2.53 g/100 g,低于本研究的结果,这可能与鲢鱼生长环境及大小有关。以上结果表明,7种淡水鱼中个基本成分含量存在显著差异(P<0.05),与其他6种淡水鱼相比,鳊鱼的蛋白含量最为丰富。
表1 七种大宗淡水鱼鱼肉基本成分分析
Table 1 The basic composition analysis of seven conventional freshwater fishes

种类水分/%灰分/%粗蛋白/%粗脂肪/%青鱼77.91±0.85b1.18±0.04c22.97±1.55b2.37±0.68a草鱼80.41±0.74b0.92±0.05c18.38±1.24c1.68±0.55a鲤鱼79.44±0.18b2.19±0.14a21.00±2.47bc1.97±1.02a鲫鱼74.48±1.37c1.64±0.15b14.22±0.31d1.26±0.75a鳊鱼72.07±0.52c1.68±0.09b26.69±0.62a2.97±1.16a鳙鱼83.74±0.69a1.18±0.04c18.81±0.62c1.58±0.62a鲢鱼72.86±0.42c1.66±0.21b22.53±0.31b3.57±1.08a
注:不同字母表示差异显著(P<0.05)(下同)。
2.2 超滤组分多肽分子质量分析
7种淡水鱼多肽酶解液超滤组分的液相色谱图和分子质量分布如图1和表2所示,每张液相图谱均有4个峰,表明其主要由4个分子段的肽段组成,分子质量范围分别为2 139~2 902 Da(Ⅰ带)、1 156~2 139 Da(Ⅱ带)、408~1 156 Da(Ⅲ带)和45~97 Da(Ⅳ带)。7种淡水鱼超滤组分中,Ⅰ带的含量为42.51%~52.36%,鳙鱼多肽酶解液超滤组分中Ⅰ带含量最高,鳊鱼和草鱼次之。7种淡水鱼超滤组分中Ⅱ带的含量为0.6%~1.08%,其中鲫鱼多肽酶解液超滤组分中Ⅱ带的含量最高,鳊鱼最低;Ⅲ带的含量为38.65%~48.42%,鲫鱼多肽酶解液超滤组分中Ⅲ带的含量最高,青鱼、鲤鱼和鲢鱼次之;Ⅳ带的含量为1.12%~4.77%,鲫鱼多肽酶解液超滤组分中Ⅳ带的含量最高,鳙鱼最低。总体来说,7种淡水鱼多肽酶解液超滤组分中多肽分子质量分布主要在2 139~2 902 Da和408~1 156 Da,其含量均超过90%。
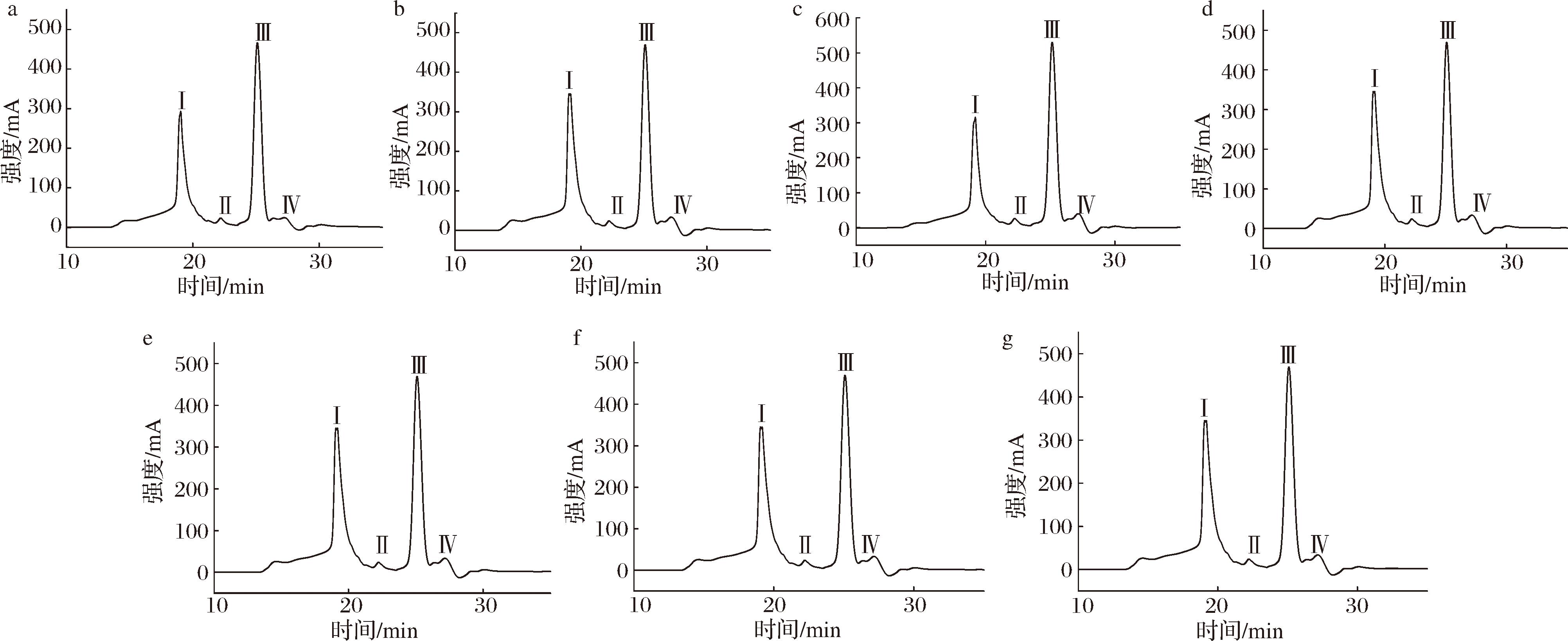
a-青鱼;b-草鱼;c-鲤鱼;d-鲫鱼;e-鳊鱼;f-鳙鱼;g-鲢鱼
图1 七种大宗淡水鱼肉酶解液超滤组分的高效液相色谱图
Fig.1 HPLC diagram of ultrafiltration fractions of enzymatic hydrolysate from seven conventional freshwater fishes
表2 七种大宗淡水鱼肉酶解液超滤组分的分子质量分布及相对含量
Table 2 The molecular weight distribution and relative content of ultrafiltration fractions of enzymatic hydrolysate from seven conventional freshwater fishes meat

组分分子质量范围/Da峰位保留时间/min峰位分子质量/Da相对含量/%青Ⅰ2 139~2 90219.052 478.7146.26青Ⅱ1 156~2 13922.211 381.070.84青Ⅲ408~1 15625.11763.6345.14青Ⅳ45~9727.2577.052.06草Ⅰ2 139~2 90219.052 478.7149.99草Ⅱ1 156~2 13922.221 380.870.80草Ⅲ408~1 15625.09764.5339.86草Ⅳ45~9727.1677.252.88鲤Ⅰ2 139~2 90219.212 478.7144.17鲤Ⅱ1 156~2 13922.251 381.070.96鲤Ⅲ408~1 15625.14763.6346.65鲤Ⅳ45~9727.1577.053.33鲫Ⅰ2 139~2 90218.952 478.7142.51鲫Ⅱ1 156~2 13922.201 381.071.08鲫Ⅲ408~1 15625.06763.6348.42鲫Ⅳ45~9727.1377.054.77鳊Ⅰ2 139~2 90219.062 480.7850.41鳊Ⅱ1 156~2 13922.211 381.070.60鳊Ⅲ408~1 15625.06763.6338.65鳊Ⅳ45~9727.1277.053.24鳙Ⅰ2 139~2 90219.052 479.6152.36鳙Ⅱ1 156~2 13922.231 381.070.96鳙Ⅲ408~1 15625.08763.6342.36鳙Ⅳ45~9727.2277.051.12鲢Ⅰ2 139~2 90219.342 478.7143.71鲢Ⅱ1 156~2 13922.331 381.071.02鲢Ⅲ408~1 15625.17763.6345.52鲢Ⅳ45~9727.2677.051.67
2.3 ABTS阳离子自由基清除能力分析
7种大宗淡水鱼酶解液及其超滤组分的ABTS阳离子自由基清除能力如表3所示,所有样品均具有较好的ABTS阳离子自由基清除能力,<3 kDa多肽组分的ABTS阳离子自由基清除能力最强,>3 kDa组分次之,粗肽最弱。在<3 kDa和>3 kDa多肽组分中,草鱼<3 kDa组分和鳙鱼>3 kDa组分具有最强的ABTS阳离子自由基清除能力,其IC50分别为196.73 μg/mL和(228.85±11.50) μg/mL,约为粗肽的0.71和0.50倍。在<3 kDa组分中草鱼、鲫鱼、鳊鱼、鳙鱼和鲢鱼之间ABTS阳离子自由基清除能力无显著差异(P>0.05),在>3 kDa组分中青鱼、草鱼、鲫鱼、鳊鱼、鳙鱼和鲢鱼之间ABTS阳离子自由基清除能力无显著性差异(P>0.05),且IC50均低于粗肽。以上结果表明,超滤能达到筛选7种大宗淡水鱼酶解液中ABTS阳离子自由基清除剂的目的,且小分子质量的多肽抗氧化活性更强。研究表明,肽的自由基清除能力与分子质量有较强的相关性,分子质量越小,清除能力越强,李亚会等[17]发现<3 kDa沙丁鱼蛋白肽比>3 kDa肽具有更好的ABTS阳离子自由基清除能力。
表3 七种大宗淡水鱼肉酶解液及其超滤组分的抗氧化能力
Table 3 The antioxidant activities of enzymatic hydrolysate and its ultrafiltration fractions from seven conventional freshwater fishes

指标种类粗肽<3 kDa>3 kDaABTS阳离子自由基/(IC50, μg/mL)青鱼258.32±1.95a244.49±4.78bc244.91±22.05a草鱼276.47±8.02a196.73±16.27a267.73±16.27ab鲤鱼482.92±27.02c262.73±11.53c305.85±55.59b鲫鱼393.77±32.47b210.80±19.44a277.02±4.25ab鳊鱼705.65±35.67d226.76±4.10ab277.93±15.24ab鳙鱼453.83±6.57c218.31±18.07ab228.85±11.50a鲢鱼470.72±22.54c228.67±2.00ab252.02±22.88a铁离子还原能力/(OD1.0,mg/mL)青鱼 8.46±1.24ab 6.47±0.41a 12.32±0.70a草鱼7.55±0.58a6.90±0.81a13.60±1.17b鲤鱼10.66±0.61ab8.60±0.62b17.06±1.14c鲫鱼8.75±1.86ab8.13±1.67b14.45±0.48b鳊鱼12.37±0.57b9.69±0.87b15.81±0.75b鳙鱼10.00±0.40ab14.07±2.71c15.29±2.63b鲢鱼11.76±3.08b13.79±2.86c14.38±2.05b亚铁离子螯合能力/(IC50,μg/mL)青鱼 191.57±25.77ab189.50±31.66b 211.97±18.27ab草鱼230.60±8.98ab261.43±21.43cd256.20±4.19bc鲤鱼245.53±11.48b286.13±18.88d272.07±11.65c鲫鱼164.43±14.94a166.73±22.43ab190.27±4.24a鳊鱼155.40±37.78a154.97±53.21ab179.30±35.16a鳙鱼173.43±51.18ab114.00±3.41a221.63±21.76ab鲢鱼222.27±20.24ab199.00±22.02bc255.25±12.37bc
2.4 铁离子还原能力分析
7种大宗淡水鱼多肽酶解液及其超滤组分的还原能力OD1.0如表3所示,其均表现出较强的铁离子还原能力。与ABTS阳离子自由基清除能力结果相似,除鳙鱼和鲢鱼外,<3 kDa多肽组分的铁离子还原能力最强,粗肽次之,>3 kDa组分最弱。青鱼<3 kDa组分和草鱼粗肽具有最强的还原能力,其OD1.0分别为(6.47±0.41) mg/mL和(7.55±0.58) mg/mL,是>3 kDa组分的0.53和0.56倍。鲤鱼、鲫鱼和鳊鱼<3 kDa组分铁离子还原能力无显著差异(P>0.05),但均强于粗肽和>3 kDa多肽组分。以上结果表明,超滤的小分子多肽还原能力显著提高,这可能与小分子多肽氨基酸的数量、种类以及肽的溶解度有关[18]。冯晓文等[19]发现三文鱼骨胶原低聚肽均具有较好的铁离子还原能力,表明鱼源性小分子肽能够通过氢原子转移阻断自由基链式反应实现抗氧化作用。
2.5 亚铁离子螯合能力测定
7种大宗淡水鱼酶解液及其超滤组分的亚铁离子螯合能力如表3所示,与铁离子还原能力结果基本一致,除草鱼、鲤鱼和鲫鱼外,<3 kDa多肽组分的亚铁离子螯合能力最强,粗肽组分次之,>3 kDa组分最弱;<3 kDa的鳙鱼多肽组分具有最强的亚铁离子螯合能力,IC50为(114.00±3.41) μg/mL,其活性为鲤鱼的1.40倍(P<0.05)。在>3 kDa的多肽组分中,青鱼、鲫鱼、鳊鱼和鳙鱼亚铁离子螯合能力弱于粗肽组分和<3 kDa的多肽组分,这可能是因为分子质量较大的多肽有更大的空间位阻,与金属离子螯合能力较弱,不易发生螯合反应[20]。JIA等[21]发现草鱼肉小分子肽比草鱼肉酶解液具有更好的亚铁离子螯合能力,以上结果表明,鱼多肽是金属离子螯合剂的最佳来源。
2.6 七种大宗淡水鱼肉酶解物超滤组分抗氧化肽的结构鉴定
由于分子质量<3 kDa的7种大宗淡水鱼多肽组分具有更强的抗氧化能力,采用LC-MS/MS技术进一步对其肽段组成和序列进行了分析。通过Xcalibur软件分析和从头测序法鉴定,并经过ProteinPilot (V4.5)数据库和Paragon检索,从7种大宗淡水鱼肉酶解液超滤组分中得到510条肽段,其中蛋白得分最高及ALC≥99%的肽段共301条,肽段质谱图见图2,其肽段信息见表4。7种鱼中鉴定的总肽段数目为33~157条,且大部分肽段由9~15个氨基酸组成,均为小分子多肽。从青鱼、草鱼、鲤鱼、鲫鱼、鳊鱼、鳙鱼和鲢鱼低分子质量组分中分别鉴定出ALC≥99%的肽段22、38、35、39、58、49、101条,其中鲢鱼中的肽段数目显著高于其他组分,约为其他鱼的1.92~4.48倍,表明鲢鱼是抗氧化肽最丰富的来源。

a-鳊鱼;b-草鱼;c-鳙鱼;d-鲫鱼;e-鲢鱼;f-鲤鱼;g-青鱼
图2 七种大宗淡水鱼肉酶解液<3 kDa的多肽组分总离子流图
Fig.2 Total ion flow diagram of peptides fraction with Mw <3 kDa from the enzymatic hydrolysate of seven conventional freshwater fishes
表4 总肽段数及99% ALC肽段数
Table 4 The number of total identified peptides and 99% ALC peptide fragments
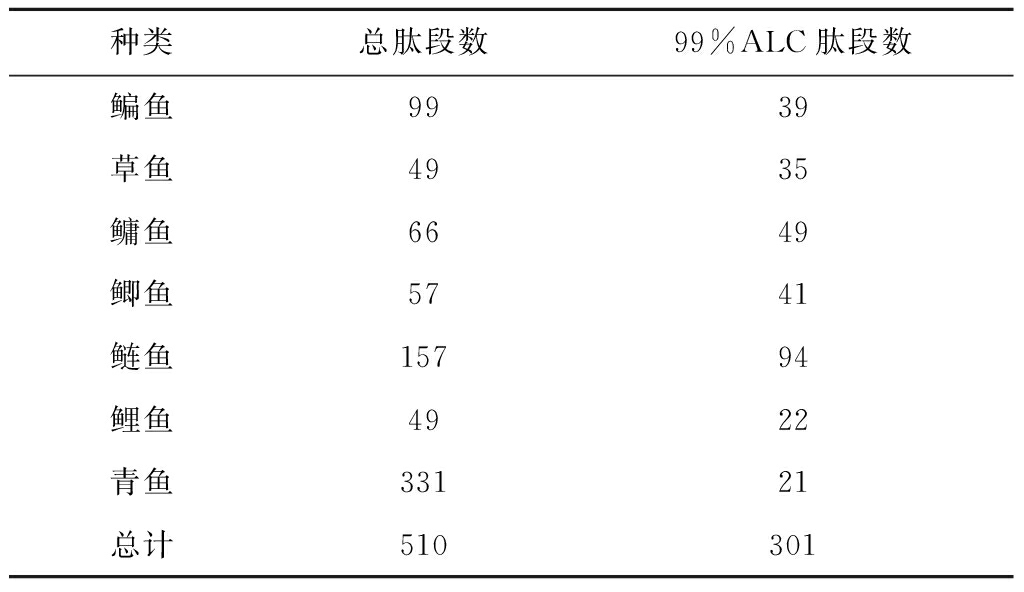
种类总肽段数99%ALC肽段数鳊鱼9939草鱼4935鳙鱼6649鲫鱼5741鲢鱼15794鲤鱼4922青鱼33121总计510301
如图3所示,通过对7种大宗淡水鱼中鉴定的肽段进行聚类分析,共发现3条共有的多肽,其名称分别为KDPIDPPWAPGKP、DPIDPPWAPGKP和VLDRPGPPEGPL,分子质量分别为141 7.61、128 9.44、124 6.41 Da,其中疏水性氨基酸含量分别为61.5%、66.7%和75.0%。除青鱼外,6种大宗淡水鱼拥有2条相同的肽段,为VVDRPQPP EGPV和DPIDPPWAPGKPT。3条共同肽段的分子质量为1 246.41~1 417.61 Da,符合大部分抗氧化肽分子质量的特征。此外,所有共有肽段的疏水性氨基酸包括丙氨酸(A)、异亮氨酸(I)、亮氨酸(L)、甘氨酸(G)、苯丙氨酸(F)、脯氨酸(P)、缬氨酸(V),且含量为61.5%~75.0%,其中VLDRPGPPEGPL中含量最高。由于小分子多肽可以更好地穿过肠道屏障,并且更易与自由基发生相互作用,因此小分子多肽具有更强的抗氧化活性,而疏水性氨基酸可以促进其脂质溶解度,从而增加抗氧化活性[22]。因此,上述共有的多肽可能是7种淡水鱼中重要的抗氧化肽,能通过清除自由基、还原能力和螯合金属离子等方式起到抗氧化的作用。
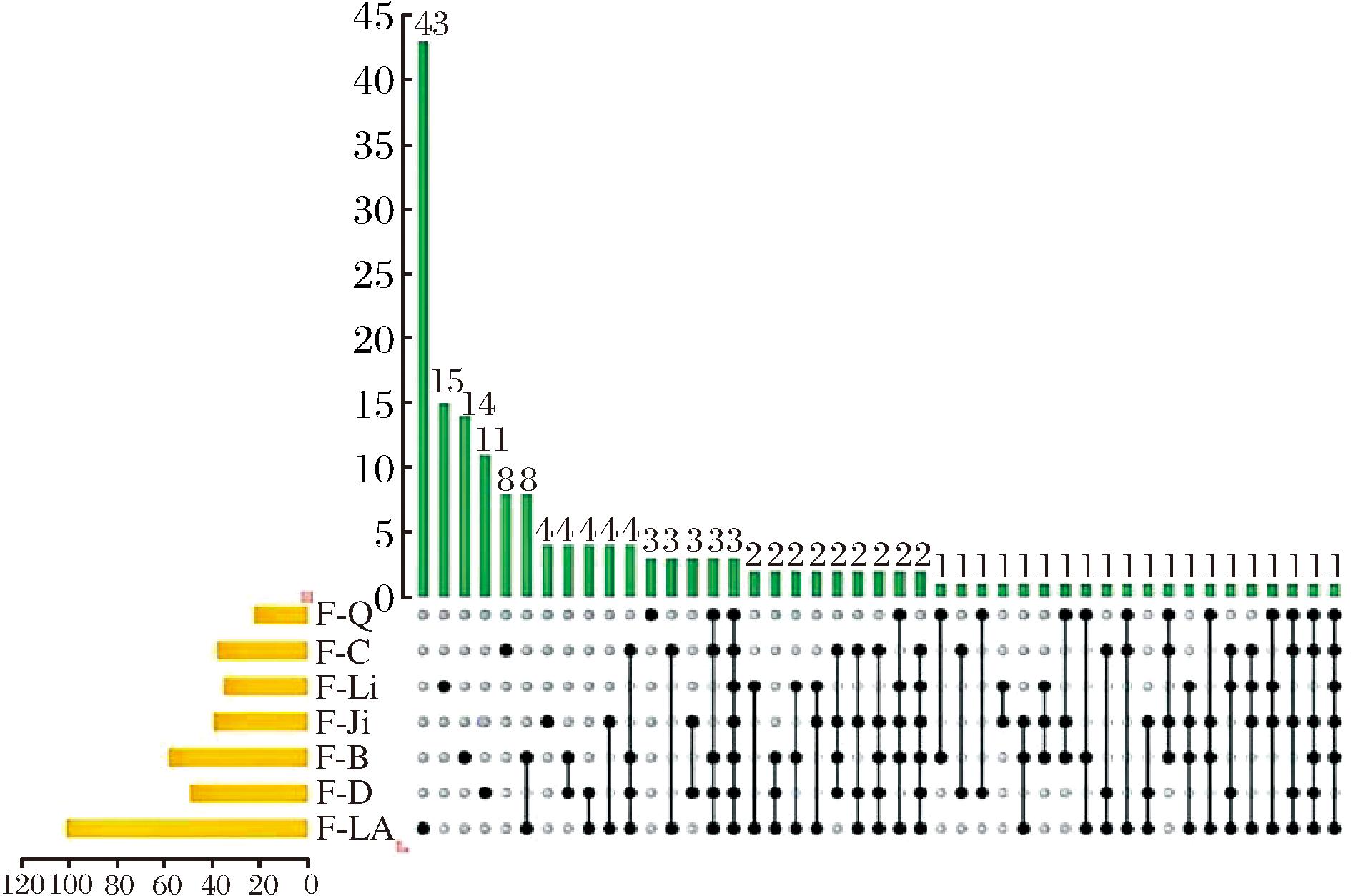
图3 七种大宗淡水鱼肉酶解物<3 kDa组分中相同肽段数
Fig.3 The number of the same peptides in enzymatic hydrolysate fraction <3 kDa from seven conventional freshwater fishes
3 结论
本研究首次比较了7种大宗淡水鱼酶解液基本成分、抗氧化活性及肽组成。结果表明,7种淡水鱼鱼肉水分、粗蛋白、灰分、粗脂肪含量等基本成分存在一定差异,其中鳙鱼、鲤鱼、鳊鱼和鲢鱼分别具有最高的水分、灰分、粗蛋白和粗脂肪含量。经二步酶解法酶解后的超滤组分多肽分子质量主要分布为2 139~2 902 Da和408~1 156 Da,占比超过90%。抗氧化分析结果表明,分子质量<3 kDa的淡水鱼多肽表现出比粗肽和大分子质量多肽更好的抗氧化活性,草鱼、青鱼和鳙鱼中<3 kDa分子质量的多肽组分分别具有最好的ABTS阳离子自由基清除能力、铁还原能力和亚铁离子螯合能力,其IC50分别为196.73 μg/mL、6.47 mg/mL和114.00 μg/mL,其是淡水鱼中抗氧化肽的最佳来源。质谱结果表明,7种大宗淡水鱼中共鉴定出<3 kDa多肽组分510条肽段,共有的肽段为KDPIDPPWAPGKP、DPIDPPWAPGKP和VLDRPGPPEGPL,疏水性氨基酸含量高,是其中潜在的抗氧化肽。本研究表明,7种大宗淡水鱼均是抗氧化肽制备与研发的潜在优质来源,可为我国大宗淡水鱼高值化利用和深度加工提供重要依据与参考。
[1] HU Y M, LU S Z, LI Y S, et al.Protective effect of antioxidant peptides from grass carp scale gelatin on the H2O2-mediated oxidative injured HepG2 cells[J].Food Chemistry, 2022, 373:131539.
[2] RUAN J P, CHEN J D, ZENG J, et al.The protective effects of Nile tilapia (Oreochromis niloticus) scale collagen hydrolysate against oxidative stress induced by tributyltin in HepG2 cells[J].Environmental Science and Pollution Research Interrational, 2019, 26(4):3612-3620.
[3] 朱臻怡, 冯民, 熊华萱, 等.食品中抗氧化剂的应用及其检测技术研究进展[J].化学分析计量, 2013, 22(5):104-108.ZHU Z Y, FENG M, XIONG H X, et al.Research progress of application and detection technology of antioxidants in food[J].Chemical Analysis and Meterage, 2013, 22(5):104-108.
[4] 付镓榕, 马尚玄, 魏元苗, 等. 澳洲坚果抗氧化肽的分离纯化及肽段鉴定[J]. 食品工业科技, 2024, 45(6):91-99.FU J R, MA S X, WEI Y M, et al. Separation, purification and identification of antioxidant peptides derived from Macadamia integrifolia[J]. Science and Technology of Food Industry, 2024, 45(6):91-99.
[5] 吉正梅, 张晓春, 彭钰迪, 等.鸭胚源抗氧化肽TD12对HepG2细胞氧化应激损伤的保护作用[J].食品与发酵工业, 2021, 47(18):141-148.JI Z M, ZHANG X C, PENG Y D, et al.Protective effect of duck embryo-derived antioxidant peptide TD12 on oxidative stress damage in HepG2 cells[J].Food and Fermentation Industries, 2021, 47(18):141-148.
[6] CAI L Y, WU X S, ZHANG Y H, et al.Purification and characterization of three antioxidant peptides from protein hydrolysate of grass carp (Ctenopharyngodon idella) skin[J].Journal of Functional Foods, 2015, 16:234-242.
[7] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会编制. 中国渔业统计年鉴-2023[M]. 北京: 中国农业出版社, 2023.Ministry of Agriculture and Rural Affairs of the People′s Republic of China, National Fisheries Technology Extension Center, Chinese Society of Fisheries. China Fishery Statistical Yearbook-2023[M]. Beijing: China Agriculture Press, 2023.
[8] YATHISHA U G, BHAT I, KARUNASAGAR I, Karunasagark I, et al.Antihypertensive activity of fish protein hydrolysates and its peptides[J].Critical Reviews in Food Science and Nutrition, 2019, 59(15):2363-2374.
[9] 刘丹. 秋刀鱼蛋白抗氧化肽的分离纯化及其抗疲劳功效研究[D].广州:华南理工大学, 2015.LIU D. Study on the purification of antioxidant peptide from Pacific saury protein and its antifatigue activities[D]. Guangzhou: South China University of Technology, 2015.
[10] HASHEM A M A, VENMARATH A, KUDRE T G.Preparation, purification, and identification of novel antioxidant peptides from red-bellied pacu (Piaractus brachypomus) fish meat protein hydrolysate[J].Food Science and Biotechnology, 2023, 32(14):2057-2068.
[11] 朱敏方. 草鱼鱼肉抗氧化肽的制备、分离鉴定及其活性研究[D].南昌:江西师范大学, 2020.ZHU M F.Preparation, isolation, identification and activity of antioxidant peptides from grass carp fish (Ctenopharyngodon Idella) muscle[D].Nanchang:Jiangxi Normal University, 2020.
[12] 李军, 罗娟, 涂宗财, 等.鲢鱼骨胶原多肽的制备及其抗氧化活性研究[J].食品与发酵工业, 2020, 46(2):222-230.LI J, LUO J, TU Z C, et al.Study on the preparation and antioxidant activity of collagen polypeptide from silver carp bone[J].Food and Fermentation Industries, 2020, 46(2):222-230.
[13] 贾韶千, 李艳霞.黄鳝鱼骨多肽制备及其抗氧化活性[J].食品科学, 2016,37(1):133-138.JIA S Q, LI Y X.Preparation and antioxidant activity of Monopterus albus bone peptides[J].Food Science, 2016, 37(1):133-138.
[14] 张美玲, 赵新淮.大豆蛋白水解物的酶法修饰及其亚铁和钙离子的螯合能力[J].食品与发酵工业, 2012, 38(12):26-30.ZHANG M L, ZHAO X H.Enzymatic modification of soybean protein hydrolysates by plastein reaction and its influence on chelating activities for ferrous and calcium ions[J].Food and Fermentation Industries, 2012, 38(12):26-30.
[15] 黄湘芬, 陈开健, 许宝红, 等.不同饲养条件下的鳙鱼肌肉营养成分研究[J].当代水产, 2011, 36(7):57-61.HUANG X F, CHEN K J, XU B H, et al.Study on nutritional components of bighead carp muscle under different feeding conditions[J].Current Fisheries, 2011, 36(7):57-61.
[16] 魏永生, 李维维, 隆晶, 等.GC/MS测定鲢鱼肌肉中的脂肪酸组成[J].广州化工, 2017, 45(5):74-76.WEI Y S, LI W W, LONG J, et al.Determination of fatty acid compositions in muscle of silver carp by GC/MS[J].Guangzhou Chemical Industry, 2017, 45(5):74-76.
[17] 李亚会, 李积华, 吉宏武, 等.远东拟沙丁鱼抗氧化肽的分离纯化及结构解析[J].中国食品学报, 2021, 21(2):229-238.LI Y H, LI J H, JI H W, et al.Isolation, purification and structural analysis of antioxidant peptides from Sardinops sagax[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(2):229-238.
[18] 左依瑾, 于子淇, 申雪晴, 等.鱼源抗氧化肽的结构与其功能关系研究进展[J].食品工业科技, 2023, 44(14):419-429.ZUO Y J, YU Z Q, SHEN X Q, et al.Recent advance on the structure-activity relationship in antioxidant peptides of fish[J].Science and Technology of Food Industry, 2023, 44(14):419-429.
[19] 冯晓文, 赵晓涵, 潘骁琦, 等.体外模拟消化对海洋鱼骨胶原低聚肽结构和抗氧化活性的影响[J].食品与发酵工业, 2022, 48(5):173-179.FENG X W, ZHAO X H, PAN X Q, et al.The effect of simulated digestion in vitro on structure and antioxidant activity of marine fish bone collagen oligopeptides[J].Food and Fermentation Industries, 2022, 48(5):173-179.
[20] 乔虹, 黎松松, 周南希, 等. 海洋来源金属离子螯合肽研究进展[J]. 食品工业科技, 2024, 45(1):368-377.QIAO H, LI S S, ZHOU N X, et al. Research progress in metal ion chelated peptides of marine sources[J]. Science and Technology of Food Industry, 2024, 45(1):368-377.
[21] JIA X Y, ZHU M F, ZHANG L, et al.Extraction optimization and screening of antioxidant peptides from grass carp meat and synergistic-antagonistic effect[J].Food Science &Nutrition, 2022, 10(5):1481-1493.
[22] 范三红, 贾槐旺, 李兰, 等.紫苏籽粕蛋白源抗氧化肽的纯化、结构鉴定及体外抗氧化活性[J].中国粮油学报, 2022, 37(3):79-87.FAN S H, JIA H W, LI L, et al.Purification and structural identification of antioxidant peptide from perilla seed meal protein and antioxidant activity in vitro[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(3):79-87.