将秸秆为代表的木质纤维素资源由纤维素酶降解为纤维二糖,再通过纤维二糖磷酸化酶(cellobiose phosphorylase, CBP)和淀粉磷酸化酶转化为人类需求的淀粉是引领“烃经济”向“糖经济”转型的新思路,对在人口多、耕地小等难题下保证我国粮食安全具有现实意义,也使粮食生产从“农业种植”转向“工业生产”成为可能[1-4]。然而,纤维素酶中含有的β-葡萄糖苷酶与CBP竞争降解纤维二糖,导致CBP磷酸解纤维二糖的产物葡萄糖-1-磷酸产量降低,而葡萄糖-1-磷酸是合成直链淀粉的底物,因此直链淀粉转化率降低[5-8]。如果在此过程中足量添加CBP,就会提高葡萄糖-1-磷酸产量,进而提高直链淀粉转化率。所以实现高产CBP从而降低其成本对于人造淀粉合成具有一定意义。
CBP主要来自于可降解纤维素的厌氧菌,比如Clostridium thermocellum[9]、Ruminococcus albus[10]和Thermotoga maritima[11]等。其中来自于C.thermocellum的CBP已被证明可以用于纤维二糖转化为淀粉的体外多酶催化体系,且具有耐高温性能[9,12],而利用C.thermocellum直接发酵生产CBP产量较低。因此,利用大肠杆菌异源表达cbp基因并优化诱导条件,且对重组酶的酶学性质进行研究,不仅可以实现高产CBP,而且为后续通过蛋白质工程技术手段理性改造该蛋白提供理论支持,最终实现纤维素到淀粉的高效率转化。
基于此,本研究将来自于C.thermocellum YM4的cbp基因构建到Escherichia coli蛋白表达载体pET-28a(+),并在E.coli Rosetta (DE3)中异源表达;进而对诱导表达的关键参数异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside, IPTG)浓度、诱导温度和诱导时间进行优化;最后纯化出重组酶并对其酶学性质进行研究。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
Clostridium thermocellum YM4的cbp基因(GenBank accession no.AY072794.1)委托北京擎科生物科技股份有限公司合成;E.coli Rosetta (DE3),E.coli DH5α菌株以及蛋白表达载体pET-28a(+)由本实验室保存。
1.1.2 主要培养基及缓冲液
LB培养基(g/L):酵母粉5,胰蛋白胨10,NaCl 10,如需配制固体培养基额外添加20 g琼脂粉。
PBS缓冲液(g/L):NaCl 8,KCl 0.2,Na2HPO4 1.42,KH2PO4 0.27,浓盐酸调整pH值为7.4。置于121 ℃,20 min高温高压蒸汽灭菌后使用。
1.1.3 主要试剂
Seaming Cloning K无缝克隆试剂盒、5×SDS-PAGE蛋白上样缓冲液、彩色预染蛋白Marker(10~180 kDa),Biosharp生物公司;氢氧化钠、咪唑、硫酸镁、氯化锰、氯化钙、硫酸铜、硝酸锌、硝酸铁、琼脂粉、磷酸氢二钠、磷酸二氢钾、酵母粉、胰蛋白胨、氯化钠、氯化钾、硫酸卡那霉素、氯霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒、限制性内切酶NdeⅠ、EcoRⅠ,生工生物工程(上海)股份有限公司;BeyoGoldTM His-tag Purification Resin(耐还原螯合型)、Bradford蛋白浓度测定试剂盒、BeyoLyticTM细菌活性蛋白抽提试剂,碧云天生物技术有限公司;基因合成、DNA引物合成及测序,北京擎科生物科技有限公司。
1.2 仪器与设备
SPX-250-Ⅱ型生化培养箱,上海跃进医疗器械有限公司;SW-CJ-1BU洁净工作台,苏州安泰空气技术有限公司;A300基因扩增仪,杭州朗基科学仪器有限公司;希尔曼S-10生物传感器分析仪,深圳市西尔曼科技有限公司;DK-8D型电热恒温水槽,上海一恒有限公司;ZWY-240恒温培养振荡器,上海智诚分析仪器制造有限公司;JY600C型三恒电泳仪,北京君意东方电泳设备有限公司;酶标仪iMark,美国Bio-Rad公司。
1.3 实验方法
1.3.1 蛋白表达载体的构建及转化子验证
以含有cbp基因的质粒pUC57-CBP为模板,利用引物CBP-F/R通过聚合酶链式反应(polymerase chain reaction, PCR)扩增目的基因。PCR反应条件为:解链时间5 min,温度95 ℃;变性时间30 s,温度95 ℃;退火时间30 s,温度66 ℃;延伸时间90 s,温度72 ℃,进行30个循环。将载体pET28a用限制性内切酶NdeⅠ和EcoRⅠ线性化后与PCR获得的含有载体同源臂的目的基因通过Seaming Cloning K无缝克隆试剂盒连接,热激法将连接产物转入E.coli DH5α感受态细胞,37 ℃过夜培养,挑取单克隆培养后分别以CBP-F/R和T7-F/R 2对引物进行菌液PCR验证,通过凝胶电泳分析扩增出的DNA条带,PCR验证正确后委托上海生工公司进行DNA测序,验证cbp基因DNA碱基无突变后再利用热激法转化到E.coli Rosetta (DE3)进行表达。本研究使用到的引物如表1所示。
表1 引物名和基因序列
Table 1 Primer names and gene sequences
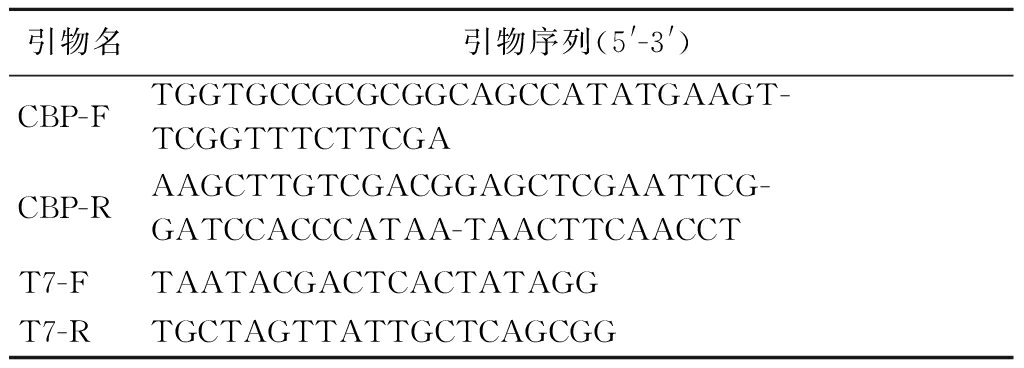
引物名引物序列(5'-3')CBP-FTGGTGCCGCGCGGCAGCCATATGAAGT-TCGGTTTCTTCGACBP-RAAGCTTGTCGACGGAGCTCGAATTCG-GATCCACCCATAA-TAACTTCAACCTT7-FTAATACGACTCACTATAGGT7-RTGCTAGTTATTGCTCAGCGG
1.3.2 重组蛋白诱导表达条件的优化及其纯化
将阳性转化子的单克隆在含有50 μg/mL卡那霉素与20 μg/mL氯霉素的固体LB平板中划线培养,挑取单菌落接种于5 mL含有相应抗生素的液体LB培养基过夜培养,然后按1%(体积分数)接种至含有抗生素的50 mL液体LB培养基,于37 ℃、180 r/min条件下培养至OD600为0.6后开始诱导蛋白表达。初始诱导条件:IPTG终浓度为0.1 mmol/L、37 ℃,180 r/min下诱导8 h。
1.3.2.1 最佳诱导剂浓度
将生长于固体LB平板的重组菌Rosetta(DE3)/pET-28a-CBP单菌落接种于5 mL含有相应抗生素的液体LB培养基活化,然后按1%(体积分数)接种至50 mL的LB液体培养基,分别加入终浓度为0.01、0.03、0.05、0.1、0.15、0.2、0.25、0.5,0.8、1.0 mmol/L的IPTG,37 ℃恒温诱导表达8 h。取4 mL且OD600=2.0的菌液,在8 000 r/min离心10 min后去上清液,重悬于800 μL蛋白抽提试剂,室温裂解30 min后离心,上清液即为粗酶液,通过CBP活力确定最佳IPTG诱导浓度。
1.3.2.2 最佳诱导温度
按上述方法活化重组菌株并培养至OD600值为0.6时,加入0.2 mmol/L的IPTG后分别置于15、20、25、30、37、42 ℃诱导表达8 h。取4 mL且OD600=2.0的菌液,于8 000 r/min离心10 min后重悬于800 μL蛋白抽提试剂,室温裂解30 min后离心,上清液即为粗酶液,通过CBP活力确定最佳诱导温度。
1.3.2.3 最佳诱导时间
重组菌株生长至OD600值为0.6时,在诱导温度15 ℃且IPTG终浓度为0.2 mmol/L的条件下进行诱导时间的优化,分别在诱导0、1、2、4、6、8、12、15、18、21、24 h时取样,取4 mL且OD600=2.0的菌液,于8 000 r/min离心10 min后重悬于800 μL蛋白抽提试剂,室温裂解30 min后离心,上清液即为粗酶液,通过纤维二糖磷酸化酶活性确定最佳诱导时间。
1.3.2.4 蛋白的纯化
离心收集诱导表达后的重组菌Rosetta(DE3)/pET-28a-CBP,用30 mL预冷的PBS缓冲液重悬,离心弃上清液,重复3次。再以30 mL PBS缓冲液重悬菌体,在冰浴条件下进行超声破碎(超声时间20 min,工作3 s,停6 s),破碎后离心取上清液。将上清液过Ni柱进行分离纯化:先将蛋白纯化柱用非变性裂解液(50 mmol/L NaH2PO4、300 mmol/L NaCl,用氢氧化钠调pH 8)进行平衡,将上清液重复上柱5次,使蛋白与柱料充分结合。然后用非变性洗涤液(50 mmol/L NaH2PO4、300 mmol/L NaCl、2 mmol/L咪唑、用氢氧化钠调pH至8)对填料进行洗涤,去除杂蛋白。最后用非变性洗脱液(50 mmol/L NaH2PO4、300 mmol/L NaCl、50 mmol/L咪唑、用氢氧化钠调pH至8)进行洗脱,收集洗脱液。用SDS-PAGE检测并分析纯化效果,Bradford法测定蛋白浓度,收集纯化的酶液进行酶学性质研究。
1.3.3 CBP酶学性质研究
1.3.3.1 酶反应最适pH值及最适温度的测定
使用pH值不同的PBS缓冲液(pH 4.5~7,以0.5为间隔)将酶液稀释适当倍数后进行纤维二糖磷酸化酶活力测定以确定最适反应pH值。使用最适pH值的PBS缓冲液稀释酶液,然后分别在45、50、55、60、65、70、75 ℃温度下进行酶活力测定确定最适反应温度。
1.2.3.2 金属离子对酶活力的影响
金属离子作为很多酶促反应的辅因子可激活或者抑制该酶[13-14]。在反应中分别加入终浓度为5 mmol/L的K+、Mg2+、Na+、Mn4+、Ca2+、Fe3+,Cu2+和Zn2+的金属离子,在最适反应条件测定纤维二糖磷酸化酶活力以确定不同的金属离子对重组酶CBP的影响。
1.2.3.3 半失活时间与动力学参数
将稀释适当倍数的酶液在60 ℃下保温,分别在0、5、10、15、20、25、30、60、360、960、1 260 min后取样在最适反应条件下测定酶活力,确定酶的半失活时间。
配制不同浓度的纤维二糖溶液:2、5、10、15、20、25、50、100 mmol/L,在最适反应条件(pH 6,温度60 ℃)下测定重组酶CBP催化不同浓度底物的速率V。采用双倒数法作图并计算Vmax、Km和Kcat。
1.4 分析方法
纤维二糖磷酸化酶测定方法[15]:取适当稀释酶液100 μL与100 μL 15 mmol/L纤维二糖溶液混合置50 ℃反应30 min,然后立即于沸水中反应2 min使酶失活,然后测定葡萄糖含量。将1 mL酶液1 min产生1 μmol葡萄糖定义为1个酶活力单位。
葡萄糖浓度测定:使用希尔曼S-10生物传感器分析仪测定葡萄糖的浓度。
Bradford法测定蛋白质量浓度[16]:将蛋白标准(5 mg/mL BSA)稀释为0、0.125、0.25、0.5、0.75、1、1.5、2 mg/mL,分别取不同质量浓度的蛋白标准液5 μL与250 μL G250染色液充分混匀,室温静置5 min后,用酶标仪测定A595,制作标曲。然后以相同的实验步骤与样品体积即可计算出样品中的蛋白浓度。
以上所有实验结果均由3个独立实验的均值和标准差表示,且3个实验进行了3次重复。使用ANOVA统计学分析方法,显著性水平设定为P<0.05,极显著水平设定为P<0.01。
2 结果与分析
2.1 载体的构建及转化子验证
将cbp基因与线性化的载体pET28a通过无缝克隆方式进行连接进而构建蛋白表达载体,质粒图谱如图1-a所示,基因两端存在His标签序列便于后续分离纯化,同时去掉了载体原始存在的T7标签肽。将构建成功的载体转化到Escherichia coli Rosetta (DE3),对转化子以CBP-F/R和T7-F/R 2对引物分别进行菌液PCR验证(图1-b),琼脂糖凝胶电泳结果显示分别得到2 716 bp与2 484 bp大小的DNA片段,与预计大小一致。进一步对2 716 bp的DNA测序验证,结果如图1-c所示。DNA序列与目的序列完全一致,无碱基突变。将构建成功的阳性转化子命名为E.coli Rosetta (DE3)/pET-28a-CBP。

a-pET-28a-CBP质粒示意图;b-菌液PCR验证图(M-DNA分子质量标准Maker;1~2-T7-F/R为引物菌液PCR结果;3~4-CBP-F/R为引物菌液PCR结果);c-转化子使用T7-F/R为引物获得的DNA测序部分峰图
图1 pET-28a-CBP质粒示意图与转化子验证
Fig.1 Plasmid schematic diagram and transformation verification diagram of pET-28a-CBP
2.2 重组蛋白诱导表达条件的优化及其纯化
为获得高产量的CBP,对诱导表达条件进行优化。首先pET28a蛋白表达载体包含了T7启动子和乳糖操纵子,因此需要使用IPTG进行诱导。已知低浓度IPTG会导致蛋白表达量低,同时过高浓度的IPTG可能使得蛋白表达过快从而形成包涵体导致CBP失去活性,并且IPTG具有毒性会影响细胞生长[17]。其次温度是影响蛋白质折叠和溶解的重要因素,不同的蛋白可能对温度有不同的敏感度。在蛋白表达过程中,过高或过低的温度可能导致CBP的不正确折叠、聚集或失去活性[18]。最后CBP的表达需要控制在一定的时间范围,过短的诱导时间可能导致CBP的表达水平较低;而长时间诱导可能导致细胞生长停滞、CBP积累形成包涵体从而失去活性。基于此,本研究通过对IPTG浓度、诱导温度以及诱导时间进行优化,可以最大程度地提高CBP的异源表达效率和活力。
图2-a为不同IPTG浓度对诱导表达CBP活力的影响,结果显示随着IPTG浓度的增加,CBP活力随之提高。当IPTG浓度为0.2 mmol/L时CBP酶活力达到最高,为0.18 IU/mL。与优化前比较酶活力提高了36.72%(P<0.05),而继续提高IPTG浓度会导致酶活力降低;在IPTG诱导浓度为0.2 mmol/L条件下对诱导温度进行优化,结果如图2-b所示,可知当诱导温度为15 ℃时,酶活力最高为0.34 IU/mL,与优化前相比较,酶活力提高了94.29%(P<0.05),而如果继续提高诱导温度,会导致酶活力显著性降低,同时考虑到过低的温度会导致发酵过程中能耗过大,因此并未继续降低诱导温度;图2-c显示了在IPTG诱导浓度为0.2 mmol/L且诱导温度15 ℃条件下,重组菌E.coli Rosetta(DE3)/pET-28a-CBP诱导生产CBP活力随着诱导时间的变化曲线,随着诱导时间的延长,酶活力逐渐提高,且在12 h酶活力达到最高,为0.47 IU/mL;继续诱导菌株会导致酶活力降低,可能会让过量的CBP之间形成包涵体。综上,通过对重组菌株诱导条件优化,使得生产纤维二糖磷酸化酶的活力由诱导之前的0.18 IU/mL提高到0.47 IU/mL,为后续大量生产CBP提供了数据支持。
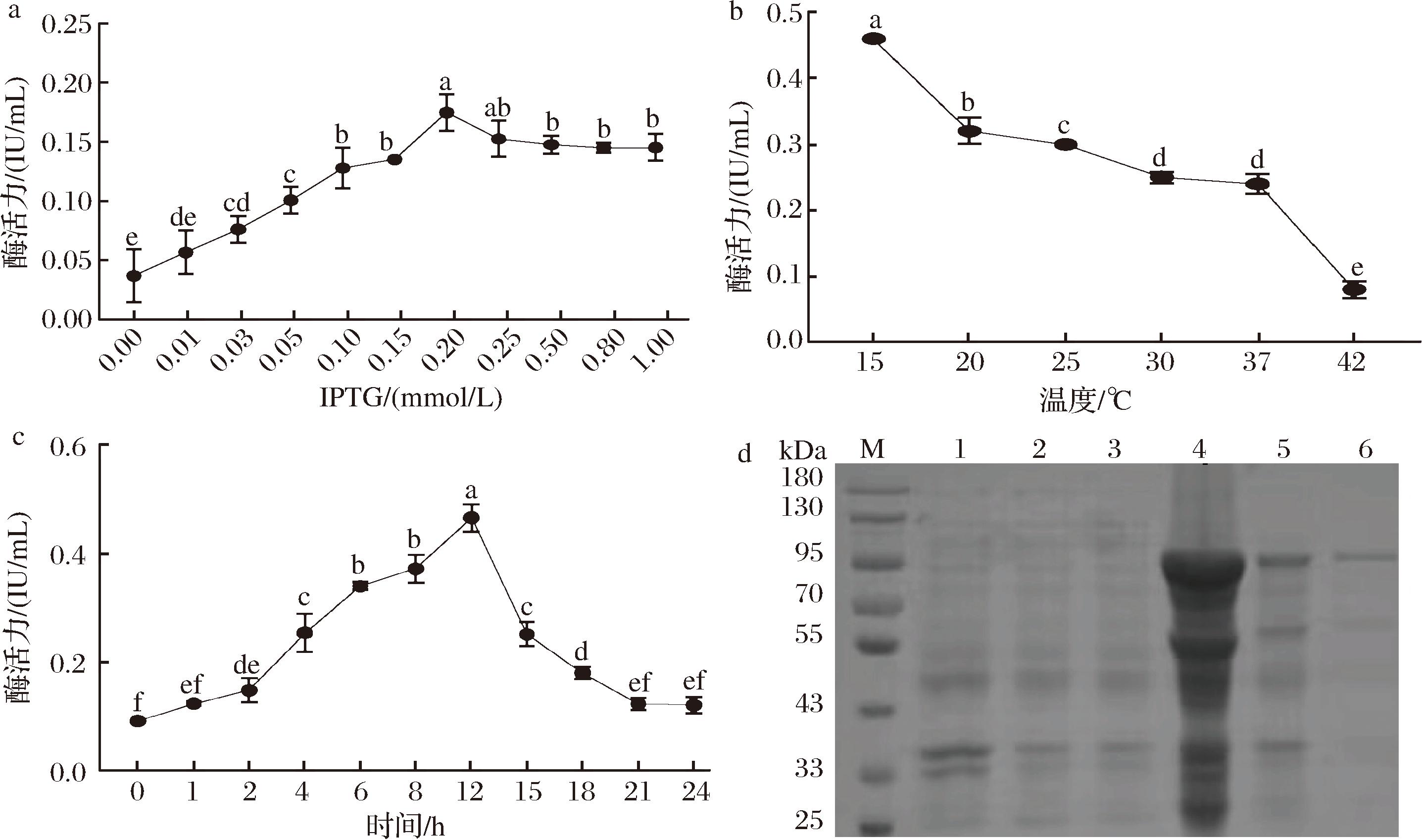
a-不同IPTG浓度诱导时的酶活力;b-不同温度诱导时的酶活力;c-不同诱导时间的酶活力;d-SDS-PAGE分析(M-蛋白Maker;1-对照沉淀;2-对照全蛋白;3-对照上清液;4-CBP沉淀;5-CBP上清液;6-纯化后的CBP)
图2 纤维二糖磷酸化酶表达条件的优化及其鉴定纯化
Fig.2 Optimization of the conditions for expressing, identifying and purifying cellobiose phosphorylase
对诱导培养后的菌体进行超声破碎,离心后将上清液经Ni柱进行亲和层析纯化。以原始菌株E.coli Rosetta (DE3)为对照,将细胞破碎液离心后的沉淀、全蛋白、上清液及纯化后的酶液进行SDS-PAGE分析。结果如图2-d所示,发现相比于野生型菌株,E.coli Rosetta (DE3)/pET-28a-CBP无论是上清液还是破碎液的沉淀均在95 kDa处有明显条带,说明CBP被成功表达;同时获得了纯化的CBP,Bradford法测定蛋白质量浓度为1.81 mg/mL,并计算比酶活力为1.03 IU/mg,该酶用于后续酶学性质研究。
2.3 CBP酶学性质研究
2.3.1 最适pH值及最适温度测定
CBP作为具有催化活性的蛋白质,环境条件直接影响酶的高级结构,尤其是pH值和温度的变化。因此研究酶的最适pH和最适温度可以帮助了解酶的工作原理和酶活力限制条件,从而在体外多酶催化体系中更好地利用CBP的催化功能。图3-a显示了pH值对CBP活力的影响,发现该酶最适pH值为6.0,同时显示该酶在pH值为4.5~7内具有较强的稳定性,已知用于木质纤维素生物炼制的酸性纤维素酶最适pH值为4.8[19-20],因此该酶在pH值为4.8时具有良好的活性,后续可以复配到纤维素酶中形成一锅反应体系直接催化木制纤维素降解为葡萄糖-1-磷酸。图3-b显示了该酶的最适反应温度为60 ℃,已知纤维素酶最适反应温度为50 ℃,重组酶CBP在50 ℃时其酶活力保留了最高活性的82.85%;但是当反应温度超过65 ℃时酶活力快速下降,反应温度达到75 ℃时,酶活力仅为最高酶活力的48.33%。与已报道不同物种的CBP比较,本研究获得的重组CBP与Clostridium Thermocellum ATCC 27405[21]的CBP最适反应温度一致;已报道嗜热菌Thermotoga neapolitana[22]和Thermotoga maritima[11]的CBP最适反应温度分别为85 ℃和80 ℃,与纤维素酶最适反应温度相差较大,因此不适合一锅反应降解纤维素。
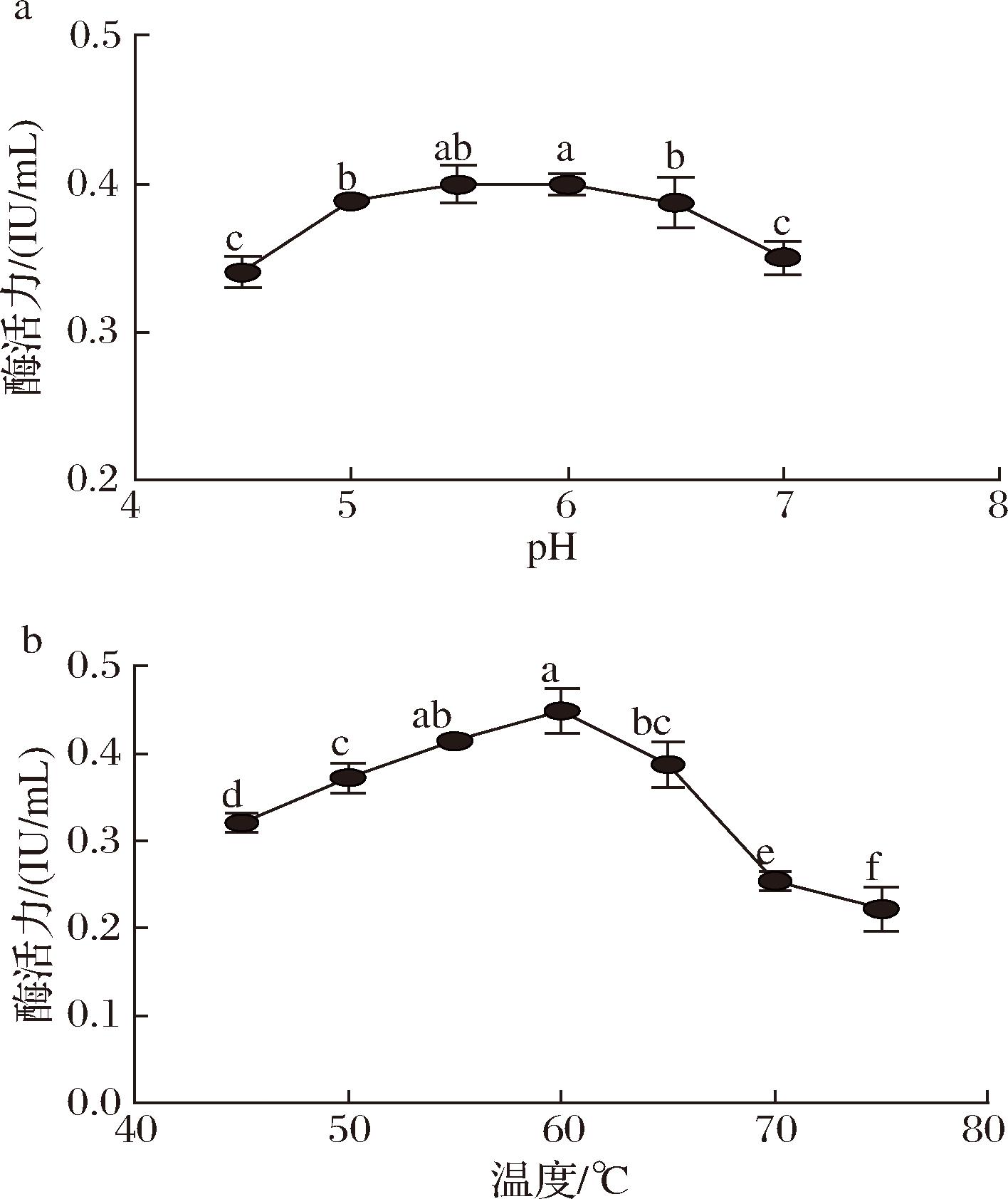
a-重组酶CBP pH稳定性;b-重组酶CBP温度稳定性
图3 纤维二糖磷酸化酶最适pH值及最适温度测定
Fig.3 Determination of the optimum pH and temperature of cellobiose phosphorylase
2.3.2 金属离子对酶活力的影响
金属离子可以与酶结合改变酶的构象或破坏催化活性中心结构,从而影响酶的活力[23],因此研究金属离子对CBP反应的影响可以增加对酶的理解,构建更好的催化反应条件。本研究选取K+、Mg2+、Na+、Mn4+、Ca2+、Fe3+,Cu2+和Zn2+金属离子,探讨在5 mmol/L终浓度下对酶反应速率的影响。结果如图4所示,发现K+、Mg2+、Na+对CBP的活力无显著性影响(P>0.05);而Cu2+显示出对该酶有强烈的抑制作用,酶的活力下降了87.60%(P<0.01),其次是金属离子Zn2+、Fe3+、Ca2+和Mn4+会分别导致酶的活力下降至36.02%、72.04%,83.33%和87.10%(P<0.05)。该结果与已报道的金属离子对嗜热菌来源的CBP活性影响结果相一致[24],并且已知K+离子是β-葡萄糖苷酶抑制剂[25],而对CBP活力无影响,正如前文分析的纤维素酶中含有的β-葡萄糖苷酶与CBP竞争降解纤维二糖从而导致葡萄糖-1-磷酸产量降低,因此后续可以考虑在纤维素转换淀粉生物催化体系中加入K+离子以提高葡萄糖-1-磷酸产量。
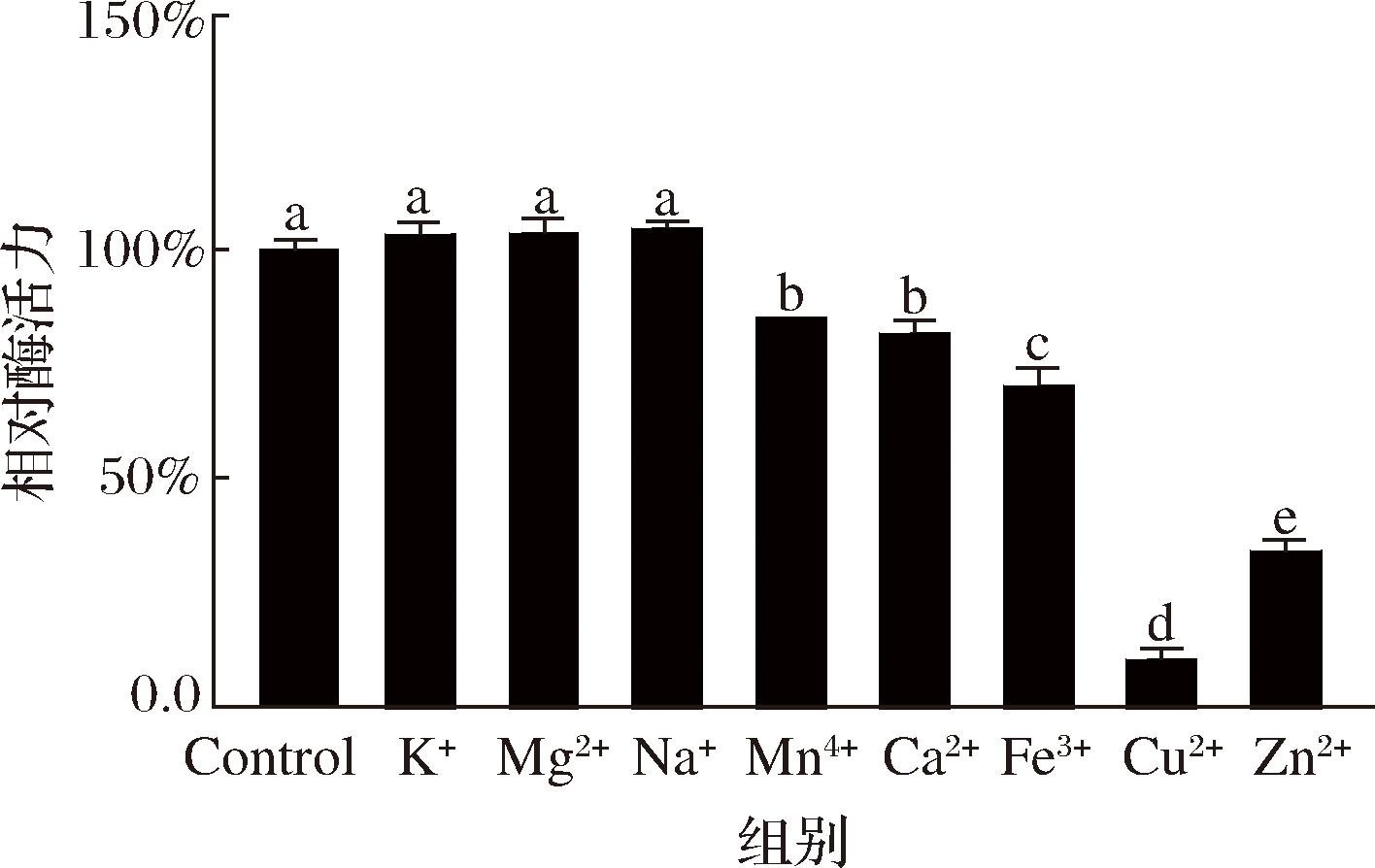
图4 金属离子对酶活力的影响
Fig.4 Effect of metal ions on enzyme activity
2.3.3 半失活时间与动力学参数
为探讨该重组酶CBP的热稳定性,将酶液在最适反应温度60 ℃下保温一定时间,通过酶活力的降低确定半失活时间。结果由图5-a所示,随着保温时间的延长,酶的活力逐步降低,且保温时间为60 min后酶活力降低50%,说明该酶半失活时间为60 min。且该酶在保温时间为1 260 min时,其相对酶活力保留28.97%,该数据可为后续秸秆制淀粉的生物催化过程持续时长提供理论依据。
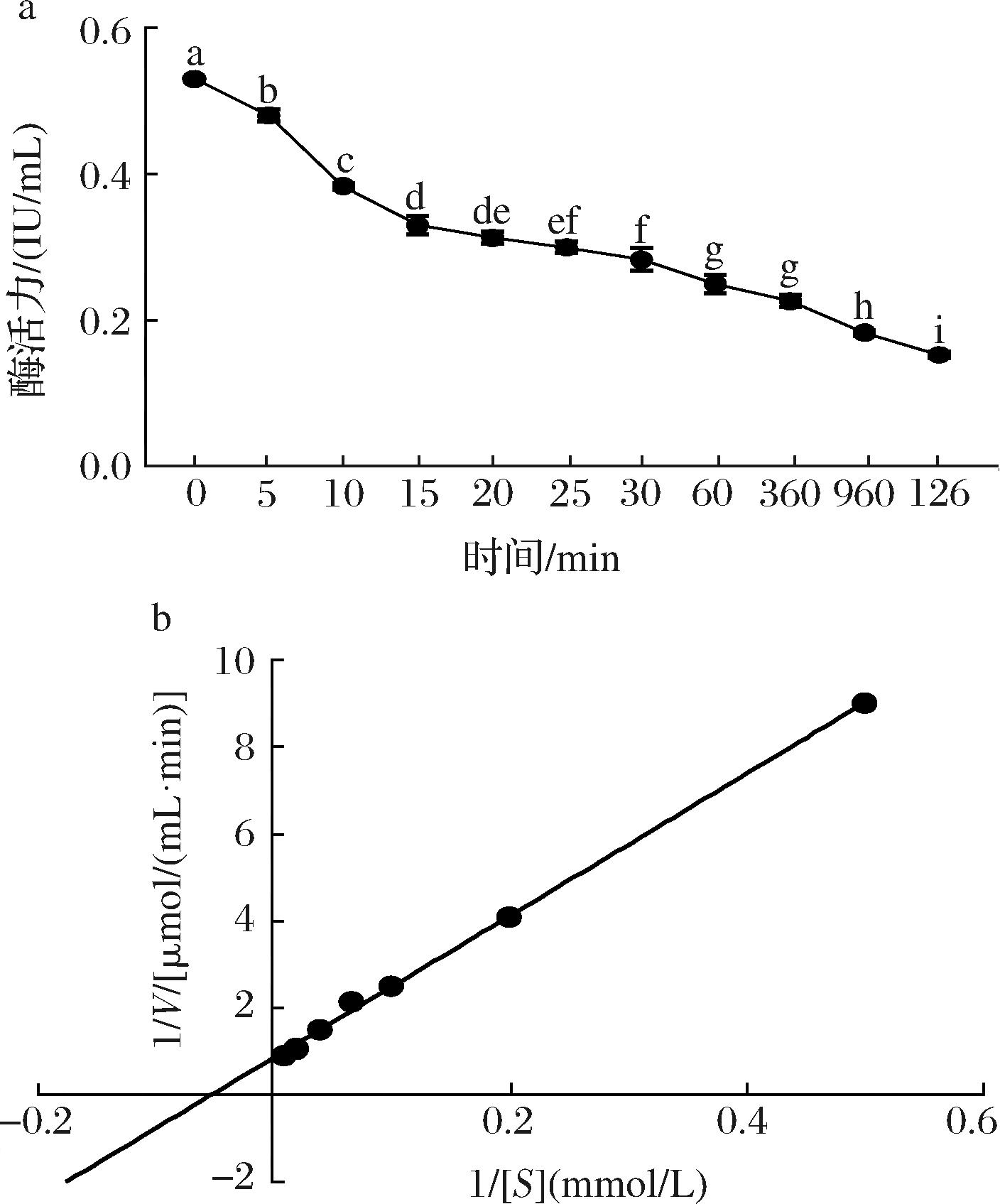
图5 半失活时间及反应动力学研究
Fig.5 Study on the half-inactivation time and reaction kinetics
以不同浓度的纤维二糖溶液为底物,在酶最适反应条件下,测定CBP催化不同底物浓度时的速率V,采用双倒数作图法确定酶的动力学参数(图5-b),结果显示该酶Km值为19.61 μmol/mL,Vmax值为1.19 μmol/(mL·min),比酶活力为1.03 IU/mg,酶的转换数Kcat为21.38 s-1。与已报道Ruminococcus albus来源的CBP相比较,具有更小的Km值[10],说明酶与底物的亲和力更好,显示了该酶具有一定的应用潜力。
3 结论
本研究成功在E.coli Rosetta (DE3)中表达了来源于Clostridium thermocellum YM4的cbp基因。结果表明在诱导温度、时间和IPTG浓度分别为15 ℃、12 h和0.2 mmol/L时,重组菌产酶活力最高且达到了0.47 IU/mL,较优化前提高了2.83倍;进一步对重组酶的酶学性质进行了研究,发现该酶最适反应pH 6,最适反应温度为60 ℃,半失活时间为60 min,动力学常数Km为19.61 μmol/mL,最大反应速率Vmax为1.19 μmol/(mL·min),催化常数Kcat为21.38 s-1;金属离子Cu2+显示出对该酶有强烈的抑制作用,然后依次是Zn2+、Fe3+、Ca2+、Mn4+(P<0.05);而K+、Mg2+和Na+对该酶活性无显著性影响。以上结果为未来对该酶的理性改造提供了理论基础,并为工业化生产提供依据。
[1] LIU C G, XIAO Y, XIA X X, et al.Cellulosic ethanol production:Progress, challenges and strategies for solutions[J].Biotechnology Advances, 2019, 37(3):491-504.
[2] 李亚鹏, 徐轶凡, 陈红歌.纤维二糖磷酸化酶和纤维寡糖磷酸化酶的研究与应用[J].微生物学通报, 2021, 48(6):2245-2258. LI Y P, XU Y F, CHEN H G.Research and application of cellobiose phosphorylase and cellodextrin phosphorylase:A review[J].Microbiology China, 2021, 48(6):2245-2258.
[3] XIAO Y, DONG S, LIU Y J, et al.Key roles of β-glucosidase BglA for the catabolism of both laminaribiose and cellobiose in the lignocellulolytic bacterium Clostridium thermocellum[J].International Journal of Biological Macromolecules, 2023, 250:126226.
[4] 李金根, 刘倩, 刘德飞, 等.秸秆真菌降解转化与可再生化工[J].生物工程学报, 2022, 38(11):4283-4310.LI J G, LIU Q, LIU D F, et al.Plant biomass degradation by filamentous fungi and production of renewable chemicals:A review[J].Chinese Journal of Biotechnology, 2022, 38(11):4283-4310.
[5] XU X X, ZHANG W, YOU C, et al.Biosynthesis of artificial starch and microbial protein from agricultural residue[J].Science Bulletin, 2023, 68(2):214-223.
[6] YOU C, CHEN H G, MYUNG S, et al.Enzymatic transformation of nonfood biomass to starch[J].Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(18):7182-7187.
[7] LIU M M, SONG Y H, ZHANG Y H P J, et al.Carrier-free immobilization of multi-enzyme complex facilitates in vitro synthetic enzymatic biosystem for biomanufacturing[J].ChemSusChem, 2023, 16(6):e202202153.
[8] BAI S W, YANG L Z, WANG H L, et al.Cellobiose phosphorylase from Caldicellulosiruptor bescii catalyzes reversible phosphorolysis via different kinetic mechanisms[J].Scientific Reports, 2022, 12(1):3978.
[9] WU Y Y, MAO G T, FAN H Y, et al.Biochemical properties of GH94 cellodextrin phosphorylase THA_1941 from a thermophilic eubacterium Thermosipho africanus TCF52B with cellobiose phosphorylase activity[J].Scientific Reports, 2017, 7(1):4849.
[10] HAMURA K, SABURI W, ABE S, et al.Enzymatic characteristics of cellobiose phosphorylase from Ruminococcus albus NE1 and kinetic mechanism of unusual substrate inhibition in reverse phosphorolysis[J].Bioscience, Biotechnology, and Biochemistry, 2012, 76(4):812-818.
[11] RAJASHEKHARA E, KITAOKA M, KIM Y K, et al.Characterization of a cellobiose phosphorylase from a hyperthermophilic eubacterium, Thermotoga maritima MSB8[J].Bioscience, Biotechnology, and Biochemistry, 2002, 66(12):2578-2586.
[12] LIU X Y, HOU H W, LI Y P, et al.Fusion of cellobiose phosphorylase and potato alpha-glucan phosphorylase facilitates substrate channeling for enzymatic conversion of cellobiose to starch[J].Preparative Biochemistry &Biotechnology, 2022, 52(6):611-617.
[13] 张悦, 黄裕颖, 李蕾, 等. Aspergillus sp.DLCS-F18胞外嗜热嗜酸β-葡萄糖苷酶的酶学性质研究[J].中国饲料, 2023, 11:50-55.ZHANG Y, HUANG Y Y, LI L, et al.Characteristics of thermoacidophilic β-glucosidase produced by Aspergillus sp.DLCS-F18[J].China Feed, 2023(11):50-55.
[14] 李金荣, 辛瑜, 石贵阳, 等.组蛋白赖氨酸特异性脱甲基酶在大肠杆菌中的重组表达及酶学性质研究[J].食品与发酵工业, 2021, 47(24):71-76.LI J R, XIN Y, SHI G Y, et al.Recombinant expression and characterization of histone lysine specific demethylase in Escherichia coli[J].Food and Fermentation Industries, 2021, 47(24):71-76.
[15] GHOSE T K.Measurement of cellulase activities[J].Pure And Applied Chemistry, 1987, 59(2):257-268.
[16] ZHANG L, LU X Z, HAN F, et al.Purification and refolding of a novel β-agarase from inclusion body of E.coli[J].Journal of Ocean University of China, 2007, 6(1):80-84.
[17] 李阳阳, 刘松, 尹小强, 等.黑曲霉木聚糖酶在大肠杆菌中的胞外表达和酶学性质研究[J].食品与发酵工业, 2022, 48(6):1-7.LI Y Y, LIU S, YIN X Q, et al.Extracellular expression of Aspergillus niger xylanase in Escherichia coli and enzymatic property characterization[J].Food and Fermentation Industries, 2022, 48(6):1-7.
[18] SUN Y J, XU J Q, ZHOU H S, et al.Recombinant protein expression chassis library of Vibrio natriegens by fine-tuning the expression of T7 RNA polymerase[J].ACS Synthetic Biology, 2023, 12(2):555-564.
[19] LI J H, CHEN Y D, GAO Y S, et al.Engineering Trichoderma reesei for the hyperproduction of cellulose induced protein 1 (Cip1) on a sophorose-containing inducer to efficiently saccharify alkali-pretreated corn stover[J].Preparative Biochemistry &Biotechnology, 2023, 53(7):880-890.
[20] 莫易, 冉小琴, 王赞丞, 等.过表达内源Trswo1基因提高里氏木霉纤维素酶对玉米秸秆水解效率的研究[J].食品与发酵工业, 2023, 49(14):60-66.MO Y, RAN X Q, WANG Z C, et al.Over-expressing of the endogenous Trswo1 gene in Trichoderma reesei to increase the cellulose degrading capability[J].Food and Fermentation Industries, 2023, 49(14):60-66.
[21] TANAKA K, KAWAGUCHI T, IMADA Y, et al.Purification and properties of cellobiose phosphorylase from Clostridium thermocellum[J].Journal of Fermentation and Bioengineering, 1995, 79(3):212-216.
[22] YERNOOL D A, MCCARTHY J K, EVELEIGH D E, et al.Cloning and characterization of the glucooligosaccharide catabolic pathway β-glucan glucohydrolase and cellobiose phosphorylase in the marine hyperthermophile Thermotoga neapolitana[J].Journal of Bacteriology, 2000, 182(18):5172-5179.
[23] DEANE D T, COPE T A, SCHULZ A M, et al.Design, heterologous expression, and application of an immobilized protein kinase[J].Bioconjugate Chemistry, 2023, 34(1):204-211.
[24] 杨良珍. 嗜热纤维二糖磷酸化酶的克隆、表达及酶学性质表征[D].长春:吉林大学, 2016.YANG L Z.Cloning, expression, and characterization of the cellobiose phosphorylase[D].Changchun:Jilin University, 2016.
[25] 李卫芬, 孙建义, 顾赛红.里氏木霉β-葡聚糖酶稳定性研究[J].西南农业大学学报, 2001,23(2):97-99.LI W F, SUN J Y, GU S H.Studies on stability of β-glucanase from Trichoderma reesei strain gxc[J].Journal of Southwest Agricultural University, 2001,23(2):97-99.